Урок 9 класса Углерод Металлы Урок 9









9m_2_10.pptx
- Размер: 685.5 Кб
- Автор:
- Количество слайдов: 16
Описание презентации Урок 9 класса Углерод Металлы Урок 9 по слайдам
 Урок 9 класса Углерод Металлы
Урок 9 класса Углерод Металлы
 Урок 9 класса Углерод Можно прийти в четверг после 16:
Урок 9 класса Углерод Можно прийти в четверг после 16:
 Подготовка к ОГЭ: По четвергам (начиная с 19. 10) в 410 в 17: 00 до 18:
Подготовка к ОГЭ: По четвергам (начиная с 19. 10) в 410 в 17: 00 до 18:
 Оксид углерода (IV) СО 2 – ангидрид угольной кислоты Н 2 СО 3. При растворении СО 2 в воде частично образуется угольная кислота: Равновесие наблюдается, поскольку угольная кислота очень слабая и в свободном виде неизвестна.
Оксид углерода (IV) СО 2 – ангидрид угольной кислоты Н 2 СО 3. При растворении СО 2 в воде частично образуется угольная кислота: Равновесие наблюдается, поскольку угольная кислота очень слабая и в свободном виде неизвестна.
 Оксид углерода (IV) Соли угольно кислоты – карбонаты и гидрокарбонаты. Качественная реакция на соли действие сильных кислот: Ca. CO 3 + 2 HCl = Ca. Cl 2 + H 2 O + CO 2 Растворимость карбонатов: Ca(OH) 2 + CO 2 = Ca. CO 3 + H 2 O Избыток СО 2 : Сa. CO 3 + H 2 O + CO 2 = Ca(HCO 3 ) 2 Нагревание: Ca. CO 3 + 2 HCl = Ca. Cl 2 + H 2 O + CO
Оксид углерода (IV) Соли угольно кислоты – карбонаты и гидрокарбонаты. Качественная реакция на соли действие сильных кислот: Ca. CO 3 + 2 HCl = Ca. Cl 2 + H 2 O + CO 2 Растворимость карбонатов: Ca(OH) 2 + CO 2 = Ca. CO 3 + H 2 O Избыток СО 2 : Сa. CO 3 + H 2 O + CO 2 = Ca(HCO 3 ) 2 Нагревание: Ca. CO 3 + 2 HCl = Ca. Cl 2 + H 2 O + CO
 Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na 2 CO 3 *10 H 2 O ; Na 2 CO 3 *7 H 2 O; Na 2 CO 3 *H 2 O. Cоду получают методом Сольвэ: Насыщение концентрированного раствора поваренной соли (точнее, насыщенного раствора Na. Cl) аммиаком при охлаждении и последующем пропускании через этот раствор СО 2 под давлением. NH 3 + CO 2 + H 2 O = NH 4 HCO 3 + Na. Cl = Na. HCO 3 + NH 4 Cl Прокаливают получившуюся питьевую соду 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + H 2 O Выделяют обратно аммиак 2 NH 4 Cl + Ca(OH) 2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O
Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na 2 CO 3 *10 H 2 O ; Na 2 CO 3 *7 H 2 O; Na 2 CO 3 *H 2 O. Cоду получают методом Сольвэ: Насыщение концентрированного раствора поваренной соли (точнее, насыщенного раствора Na. Cl) аммиаком при охлаждении и последующем пропускании через этот раствор СО 2 под давлением. NH 3 + CO 2 + H 2 O = NH 4 HCO 3 + Na. Cl = Na. HCO 3 + NH 4 Cl Прокаливают получившуюся питьевую соду 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + H 2 O Выделяют обратно аммиак 2 NH 4 Cl + Ca(OH) 2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O
 Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na 2 CO 3 *10 H 2 O ; Na 2 CO 3 *7 H 2 O; Na 2 CO 3 *H 2 O. Cоду получают методом Сольвэ: Насыщение концентрированного раствора поваренной соли (точнее, насыщенного раствора Na. Cl) аммиаком при охлаждении и последующем пропускании через этот раствор СО 2 под давлением. NH 3 + CO 2 + H 2 O = NH 4 HCO 3 + Na. Cl = Na. HCO 3 + NH 4 Cl Прокаливают получившуюся питьевую соду 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + H 2 O Выделяют обратно аммиак 2 NH 4 Cl + Ca(OH) 2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O
Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na 2 CO 3 *10 H 2 O ; Na 2 CO 3 *7 H 2 O; Na 2 CO 3 *H 2 O. Cоду получают методом Сольвэ: Насыщение концентрированного раствора поваренной соли (точнее, насыщенного раствора Na. Cl) аммиаком при охлаждении и последующем пропускании через этот раствор СО 2 под давлением. NH 3 + CO 2 + H 2 O = NH 4 HCO 3 + Na. Cl = Na. HCO 3 + NH 4 Cl Прокаливают получившуюся питьевую соду 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + H 2 O Выделяют обратно аммиак 2 NH 4 Cl + Ca(OH) 2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O
 Кремний – типичный восстановитель. Si + O 2 = Si. O 2 + Si = 2 Si. O 2 Si + O 2 = 2 Si. O При обычной температуре: Si + 2 F 2 = Si. F 4 При нагревании: Si + 2 Cl 2 = Si. Cl 4 4 Si + S 8 = 4 Si. S 2 Si + C = Si.
Кремний – типичный восстановитель. Si + O 2 = Si. O 2 + Si = 2 Si. O 2 Si + O 2 = 2 Si. O При обычной температуре: Si + 2 F 2 = Si. F 4 При нагревании: Si + 2 Cl 2 = Si. Cl 4 4 Si + S 8 = 4 Si. S 2 Si + C = Si.
 Кремний растворяется в смеси концентрированных азотной и плавиковой кислот: 3 Si + 4 HNO 3 + 12 HF = 3 Si. F 4 + 4 NO + 8 H 2 O При нагревании с оксидами активных металлов, образует силициды: 2 Mg. O + 3 Si = Mg 2 Si + Si. O При реакции с активными металлами: 2 Mg + Si = Mg 2 Si
Кремний растворяется в смеси концентрированных азотной и плавиковой кислот: 3 Si + 4 HNO 3 + 12 HF = 3 Si. F 4 + 4 NO + 8 H 2 O При нагревании с оксидами активных металлов, образует силициды: 2 Mg. O + 3 Si = Mg 2 Si + Si. O При реакции с активными металлами: 2 Mg + Si = Mg 2 Si
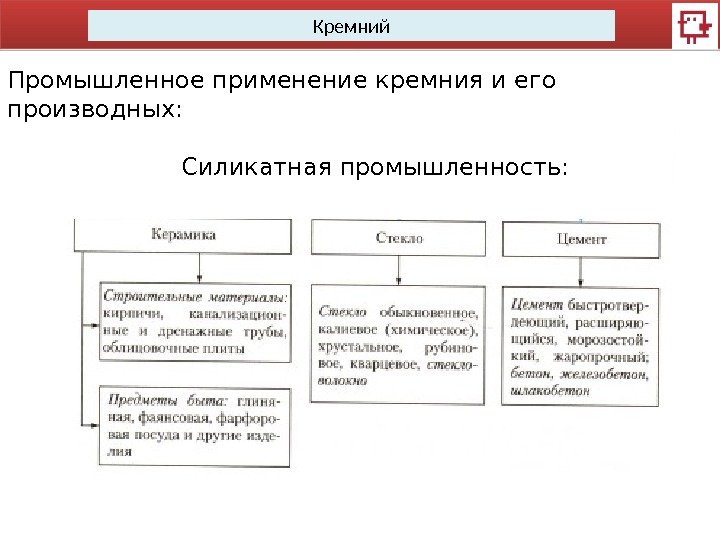
 Кремний Промышленное применение кремния и его производных: Силикатная промышленность:
Кремний Промышленное применение кремния и его производных: Силикатная промышленность:
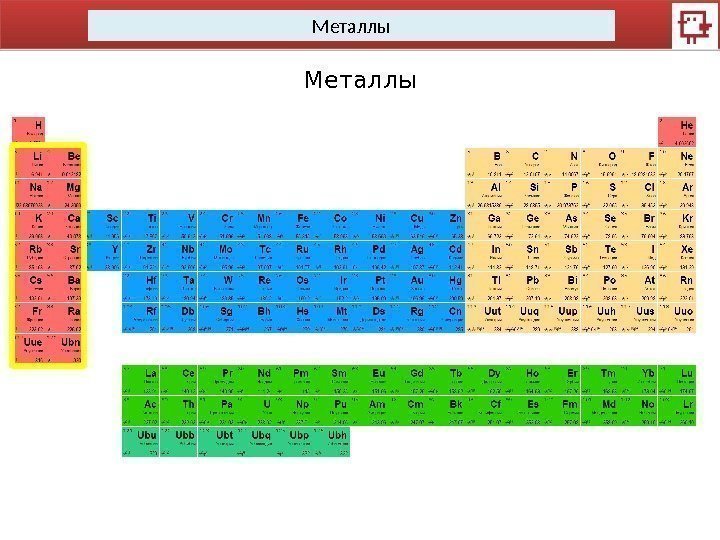
 Металлы
Металлы
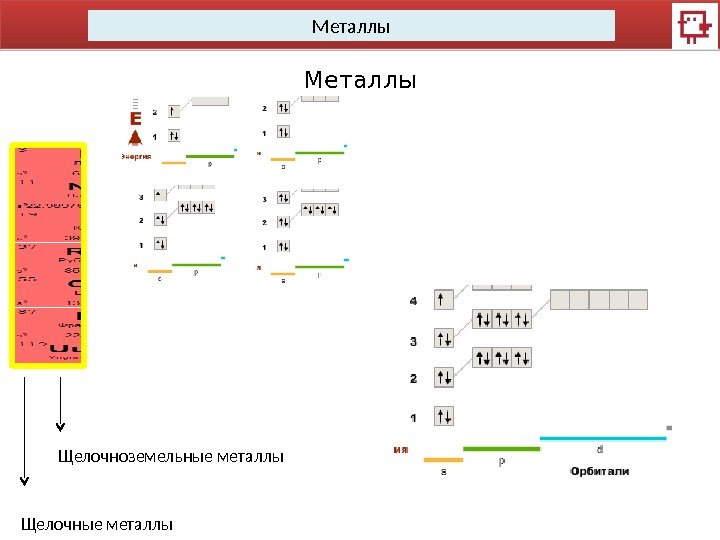
 Металлы Щелочные металлы Щелочноземельные металлы
Металлы Щелочные металлы Щелочноземельные металлы
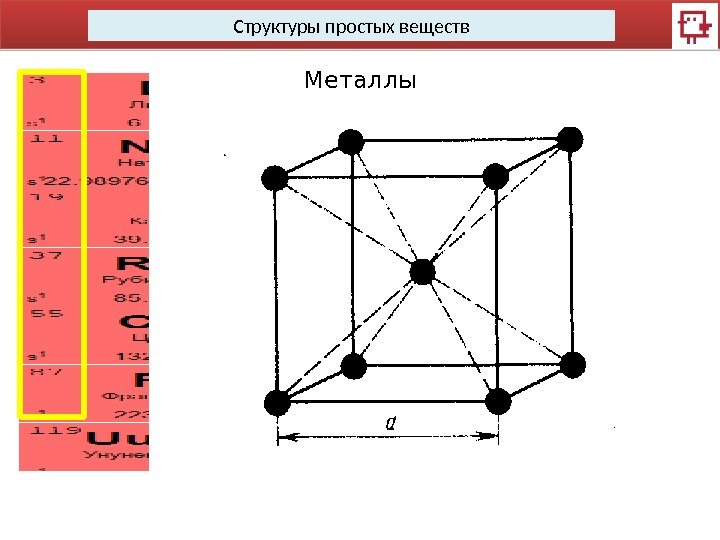
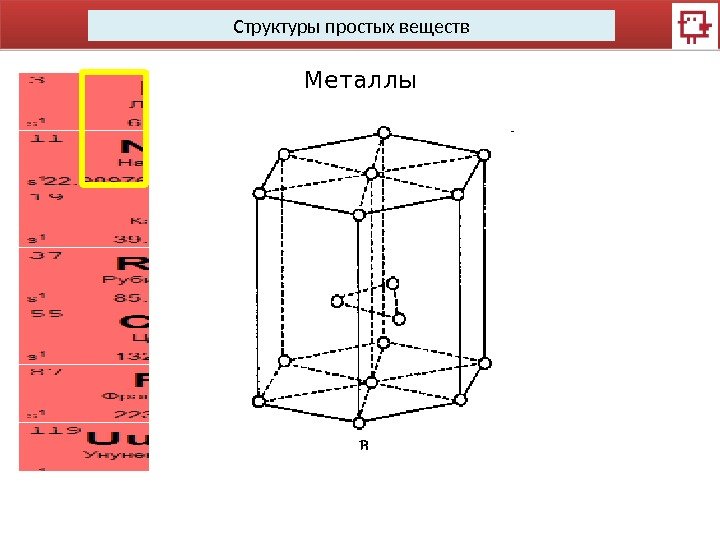
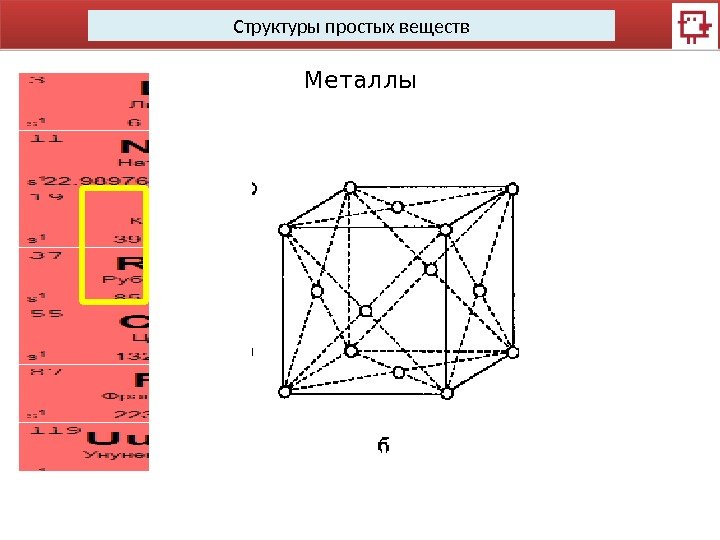
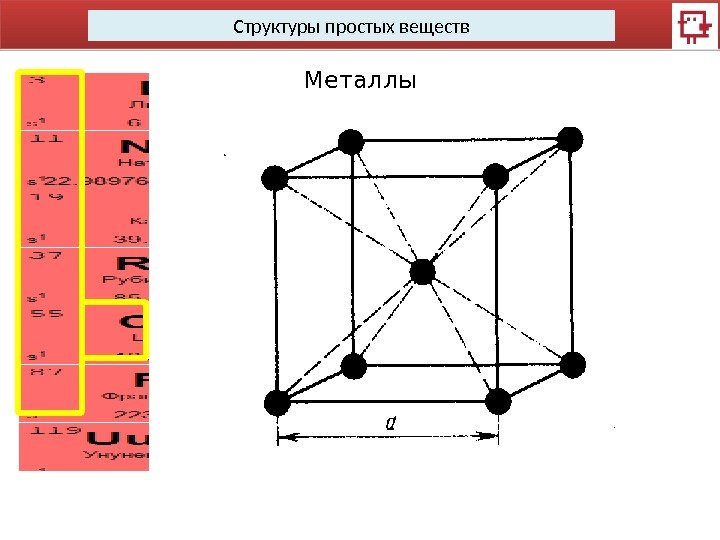
 Структуры простых веществ Металлы
Структуры простых веществ Металлы
 Структуры простых веществ Металлы
Структуры простых веществ Металлы
 Структуры простых веществ Металлы
Структуры простых веществ Металлы
 Структуры простых веществ Металлы
Структуры простых веществ Металлы

