 Урок 8 класса. Химические свойства оксидов
Урок 8 класса. Химические свойства оксидов
 Химические свойства оксидов N 2 O 5 + Mg(OH)2 Rb. O + KOH P 2 O 5 + Na. OH Кислотные оксиды 1. Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода: CO 2 + Ba(OH)2 = Ba. CO 3 + H 2 O 2. Оксиды активных металлов взаимодействуют с водой с образованием щелочи (растворимого основания): Na 2 O + H 2 O = 2 Na. OH Основные и кислотные оксиды взаимодействуют между собой с образованием соли: Ca. O + CO 2 = Ca. CO 3
Химические свойства оксидов N 2 O 5 + Mg(OH)2 Rb. O + KOH P 2 O 5 + Na. OH Кислотные оксиды 1. Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода: CO 2 + Ba(OH)2 = Ba. CO 3 + H 2 O 2. Оксиды активных металлов взаимодействуют с водой с образованием щелочи (растворимого основания): Na 2 O + H 2 O = 2 Na. OH Основные и кислотные оксиды взаимодействуют между собой с образованием соли: Ca. O + CO 2 = Ca. CO 3
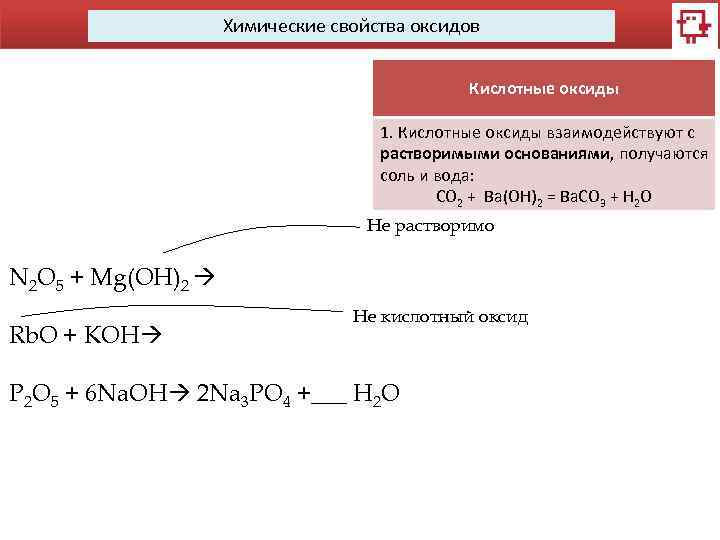 Химические свойства оксидов Кислотные оксиды 1. Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода: CO 2 + Ba(OH)2 = Ba. CO 3 + H 2 O N 2 O 5 + Mg(OH)2 Rb. O + KOH P 2 O 5 + 6 Na. OH 2 Na 3 PO 4 +___ 2. Оксиды активных металлов Не растворимо взаимодействуют с водой с образованием щелочи (растворимого основания): Na 2 O + H 2 O = 2 Na. OH Не кислотный оксид Основные и кислотные оксиды взаимодействуют между собой с H 2 образованием соли: = Ca. CO O Ca. O + CO 2 3
Химические свойства оксидов Кислотные оксиды 1. Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода: CO 2 + Ba(OH)2 = Ba. CO 3 + H 2 O N 2 O 5 + Mg(OH)2 Rb. O + KOH P 2 O 5 + 6 Na. OH 2 Na 3 PO 4 +___ 2. Оксиды активных металлов Не растворимо взаимодействуют с водой с образованием щелочи (растворимого основания): Na 2 O + H 2 O = 2 Na. OH Не кислотный оксид Основные и кислотные оксиды взаимодействуют между собой с H 2 образованием соли: = Ca. CO O Ca. O + CO 2 3
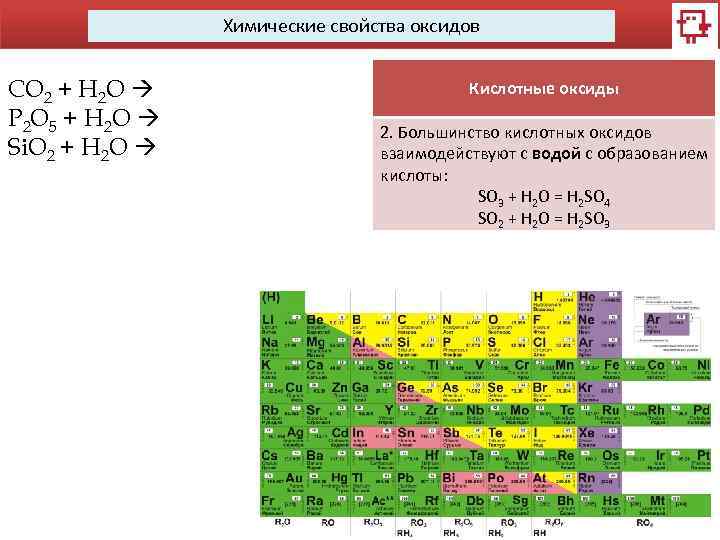 Химические свойства оксидов CO 2 + H 2 O P 2 O 5 + H 2 O Si. O 2 + H 2 O Кислотные оксиды 2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: SO 3 + H 2 O = H 2 SO 4 SO 2 + H 2 O = H 2 SO 3
Химические свойства оксидов CO 2 + H 2 O P 2 O 5 + H 2 O Si. O 2 + H 2 O Кислотные оксиды 2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: SO 3 + H 2 O = H 2 SO 4 SO 2 + H 2 O = H 2 SO 3
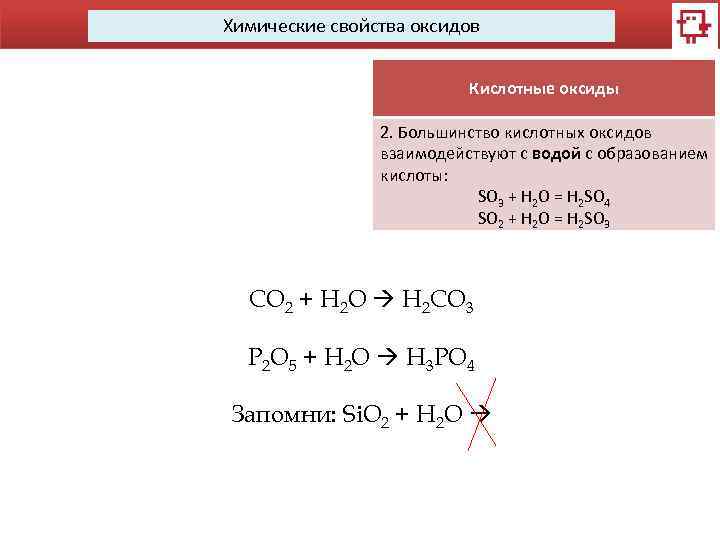 Химические свойства оксидов Кислотные оксиды 2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: SO 3 + H 2 O = H 2 SO 4 SO 2 + H 2 O = H 2 SO 3 CO 2 + H 2 O 2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: H 2 CO 3 SO + H O = H SO 3 2 2 4 SO 2 + H 2 O = H 2 SO 3 P 2 O 5 + H 2 O Большинство кислотных оксидов 2. H 3 PO 4 Запомни: взаимодействуют с водой с образованием Si. Oкислоты: O + H O = H SO 2 + H 2 SO 3 2 2 4 SO 2 + H 2 O = H 2 SO 3
Химические свойства оксидов Кислотные оксиды 2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: SO 3 + H 2 O = H 2 SO 4 SO 2 + H 2 O = H 2 SO 3 CO 2 + H 2 O 2. Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: H 2 CO 3 SO + H O = H SO 3 2 2 4 SO 2 + H 2 O = H 2 SO 3 P 2 O 5 + H 2 O Большинство кислотных оксидов 2. H 3 PO 4 Запомни: взаимодействуют с водой с образованием Si. Oкислоты: O + H O = H SO 2 + H 2 SO 3 2 2 4 SO 2 + H 2 O = H 2 SO 3
 Химические свойства оксидов Составит три уравнения реакций: Кислотные оксиды 3. Менее летучие кислотные оксиды вытесняют более летучие из их солей: Ca. CO 3 + Si. O 2 = Ca. SIO 3 + CO 2 2. Большинство кислотных оксидов Летучие Нелетучие взаимодействуют с водой с образованием кислоты: HF H 2 SO 4 SO 3 + ) 2 O = H 2 SO 4 (SO 3 H SO 2 H HCl H PO (P O+ ) 2 O = H 2 SO 3 3 4 2 5 2. Большинство кислотных оксидов HBr H 2 Si. O 3 (Si. O 2) взаимодействуют с водой с образованием HI H 3 BO кислоты: 3 (BO 2) H 2 S SO 3 + H 2 O = H 2 SO 4 SO 2 + H 2 O = H 2 SO 3 HNO 3 H 2 CO 3 H 2 SO 3
Химические свойства оксидов Составит три уравнения реакций: Кислотные оксиды 3. Менее летучие кислотные оксиды вытесняют более летучие из их солей: Ca. CO 3 + Si. O 2 = Ca. SIO 3 + CO 2 2. Большинство кислотных оксидов Летучие Нелетучие взаимодействуют с водой с образованием кислоты: HF H 2 SO 4 SO 3 + ) 2 O = H 2 SO 4 (SO 3 H SO 2 H HCl H PO (P O+ ) 2 O = H 2 SO 3 3 4 2 5 2. Большинство кислотных оксидов HBr H 2 Si. O 3 (Si. O 2) взаимодействуют с водой с образованием HI H 3 BO кислоты: 3 (BO 2) H 2 S SO 3 + H 2 O = H 2 SO 4 SO 2 + H 2 O = H 2 SO 3 HNO 3 H 2 CO 3 H 2 SO 3
 Задание Напишите уравнения реакций, подходящих для схемы: Ca Ca. O Ca(OH)2 P P 2 O 5 H 3 PO 4 N 2 O 5 + Li. OH
Задание Напишите уравнения реакций, подходящих для схемы: Ca Ca. O Ca(OH)2 P P 2 O 5 H 3 PO 4 N 2 O 5 + Li. OH






