обзорная лекция 2012.ppt
- Количество слайдов: 30
 Уравнение состояния идеального газа. (V, T, P)=0 (1) (2) где R - универсальная газовая постоянная, причём R=8, 314 m=mo. N, =mo. NA, R/NA=k. Б (3) (4)
Уравнение состояния идеального газа. (V, T, P)=0 (1) (2) где R - универсальная газовая постоянная, причём R=8, 314 m=mo. N, =mo. NA, R/NA=k. Б (3) (4)
 Изохорический процесс Процесс, происходящий в газе при постоянном объёме, называют изохорическим процессом. (1) (1. 8) При постоянном объёме и массе газа следует, что отношение P/T остаётся постоянным: Это выражение закона Шарля. График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ- и VT-диаграммах.
Изохорический процесс Процесс, происходящий в газе при постоянном объёме, называют изохорическим процессом. (1) (1. 8) При постоянном объёме и массе газа следует, что отношение P/T остаётся постоянным: Это выражение закона Шарля. График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ- и VT-диаграммах.
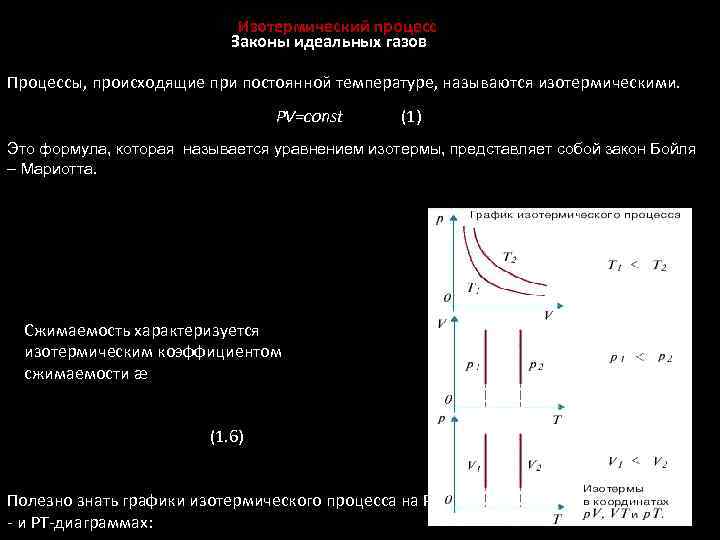 Изотермический процесс Законы идеальных газов Процессы, происходящие при постоянной температуре, называются изотермическими. PV=const (1) Это формула, которая называется уравнением изотермы, представляет собой закон Бойля – Мариотта. Сжимаемость характеризуется изотермическим коэффициентом сжимаемости æ (1. 6) Полезно знать графики изотермического процесса на РV - и РT-диаграммах:
Изотермический процесс Законы идеальных газов Процессы, происходящие при постоянной температуре, называются изотермическими. PV=const (1) Это формула, которая называется уравнением изотермы, представляет собой закон Бойля – Мариотта. Сжимаемость характеризуется изотермическим коэффициентом сжимаемости æ (1. 6) Полезно знать графики изотермического процесса на РV - и РT-диаграммах:
 Изобарический процесс Процессы, происходящие при постоянном давлении, называются изобарическими Рис. 1 (1. 7) При постоянном давлении и массе газа правая часть уравнения (1. 7) является постоянной величиной, т. е. Это уравнение называется уравнением изобары и выражает известный закон Гей-Люссака. . Для описания изобарических процессов вводится коэффициент объёмного расширения газа , который определяется следующим образом: График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV- и РTдиаграммах
Изобарический процесс Процессы, происходящие при постоянном давлении, называются изобарическими Рис. 1 (1. 7) При постоянном давлении и массе газа правая часть уравнения (1. 7) является постоянной величиной, т. е. Это уравнение называется уравнением изобары и выражает известный закон Гей-Люссака. . Для описания изобарических процессов вводится коэффициент объёмного расширения газа , который определяется следующим образом: График изобарического процесса на VT-диаграмме называется изобарой. Полезно знать графики изобарического процесса на РV- и РTдиаграммах
 2. 1. Макроскопическая работа Сила давления газа на поршень равна F=PS, где S – площадь поршня. Если поршень переместить на расстояние dx, то газ совершит работу δA=Fdx=PSdx. Учитывая, что Sdx=d. V, имеем следующее выражение для элементарной работы dx A=Pd. V. . (2. 1. 1) В том случае, когда над газом совершается работа внешними силами, то PS A=-Pd. V. Рис. 1 Формула (2. 1) верна не только для газов, но и для любых тел. Если тело переходит из состояния 1 в состояние 2, то совершённая во время этого процесса работа определяется путём интегрирования уравнения (2. 1) P (2. 2. 2) 1 M N 2 N 1 M 1 Рис. 2 V Если зависимость P(V) построена графически, то равен площади под данной кривой.
2. 1. Макроскопическая работа Сила давления газа на поршень равна F=PS, где S – площадь поршня. Если поршень переместить на расстояние dx, то газ совершит работу δA=Fdx=PSdx. Учитывая, что Sdx=d. V, имеем следующее выражение для элементарной работы dx A=Pd. V. . (2. 1. 1) В том случае, когда над газом совершается работа внешними силами, то PS A=-Pd. V. Рис. 1 Формула (2. 1) верна не только для газов, но и для любых тел. Если тело переходит из состояния 1 в состояние 2, то совершённая во время этого процесса работа определяется путём интегрирования уравнения (2. 1) P (2. 2. 2) 1 M N 2 N 1 M 1 Рис. 2 V Если зависимость P(V) построена графически, то равен площади под данной кривой.
 Вычислим работу, совершаемую идеальным газом при различных изопроцессах. При изохорическом процессе d. V=0, соответственно работа равна нулю. При изобарическом процессе P=const, тогда При изотермическом процессе Т=const, работа будет равна
Вычислим работу, совершаемую идеальным газом при различных изопроцессах. При изохорическом процессе d. V=0, соответственно работа равна нулю. При изобарическом процессе P=const, тогда При изотермическом процессе Т=const, работа будет равна
 2. 3. Внутренняя энергия. Внутренней энергией системы U называется функция состояния, приращение которой во всяком процессе, совершаемое системой в адиабатической оболочке, равно работе внешних сил над системой при переходе её из начального состояния в конечное, т. е. U 2 -U 1=A 12 Внутренней энергией системы в каком – либо равновесном состоянии называется работа, которую должны совершить внешние силы, чтобы любым возможным адиабатическим путём перенести систему из нулевого состояния в рассматриваемое. С точки зрения молекулярной физики внутренняя энергия представляет сумму кинетических энергий всех частиц системы плюс потенциальную энергию взаимодействия между ними. Отметим, что внутренняя энергия является функцией состояния. Для кругового процесса
2. 3. Внутренняя энергия. Внутренней энергией системы U называется функция состояния, приращение которой во всяком процессе, совершаемое системой в адиабатической оболочке, равно работе внешних сил над системой при переходе её из начального состояния в конечное, т. е. U 2 -U 1=A 12 Внутренней энергией системы в каком – либо равновесном состоянии называется работа, которую должны совершить внешние силы, чтобы любым возможным адиабатическим путём перенести систему из нулевого состояния в рассматриваемое. С точки зрения молекулярной физики внутренняя энергия представляет сумму кинетических энергий всех частиц системы плюс потенциальную энергию взаимодействия между ними. Отметим, что внутренняя энергия является функцией состояния. Для кругового процесса
 Количество теплоты. Математическая формулировка первого начала термодинамики Процесс обмена внутренними энергиями соприкасающихся тел, не сопровождающийся производством макроскопической работы, называется теплообменом. Энергия, переданная телу окружающей средой в результате теплообмена, называется количеством теплоты или просто теплом полученным телом в таком процессе. Это уравнение даёт математическую формулировку I закона термодинамики. Согласно этому закону тепло Q полученное системой идёт на приращение её внутренней энергии и на производство. внешней работы
Количество теплоты. Математическая формулировка первого начала термодинамики Процесс обмена внутренними энергиями соприкасающихся тел, не сопровождающийся производством макроскопической работы, называется теплообменом. Энергия, переданная телу окружающей средой в результате теплообмена, называется количеством теплоты или просто теплом полученным телом в таком процессе. Это уравнение даёт математическую формулировку I закона термодинамики. Согласно этому закону тепло Q полученное системой идёт на приращение её внутренней энергии и на производство. внешней работы
 Для бесконечно малого элементарного квазистатического процесса уравнение (2. 4. 2) принимает вид: В случае кругового состояние, процесса, при котором система возвращается в исходное и, следовательно, в круговом процессе всё тепло, полученное системой, идёт на производство внешней работы, Если U 1=U 2 и Q=0, то A=0. Это означает, что невозможен процесс, единственным результатом которого является производство работы без каких либо изменений в других телах. Механизм, в котором осуществляется такой процесс, называется вечным двигателем I рода.
Для бесконечно малого элементарного квазистатического процесса уравнение (2. 4. 2) принимает вид: В случае кругового состояние, процесса, при котором система возвращается в исходное и, следовательно, в круговом процессе всё тепло, полученное системой, идёт на производство внешней работы, Если U 1=U 2 и Q=0, то A=0. Это означает, что невозможен процесс, единственным результатом которого является производство работы без каких либо изменений в других телах. Механизм, в котором осуществляется такой процесс, называется вечным двигателем I рода.
 . 2. 5. Различные приложения I начала термодинамики. Теплоёмкостью тела C называется количество теплоты, необходимое для нагревания тела на 1 о. С. В общем случае теплоёмкость определяется соотношением (2. 5. 1) Если масса тела равна единице, то теплоёмкость называют удельной и обозначают малой буквой с. Теплоёмкость одного моля вещества называют молярной и обозначают буквой С. Из этих определений следует следующая связь между теплоёмкостями: (2. 5. 2) где v – число молей. , (2. 5. 3) При любых процессах д. Q=Cd. T, где C -теплоёмкость данного процесса. При изохорическом процессе как следует из (2. 4. 2) d. U=д. Q, соответственно Таким образом, при любом процессе производная от внутренней энергии по температуре даёт теплоёмкость при постоянном объёме.
. 2. 5. Различные приложения I начала термодинамики. Теплоёмкостью тела C называется количество теплоты, необходимое для нагревания тела на 1 о. С. В общем случае теплоёмкость определяется соотношением (2. 5. 1) Если масса тела равна единице, то теплоёмкость называют удельной и обозначают малой буквой с. Теплоёмкость одного моля вещества называют молярной и обозначают буквой С. Из этих определений следует следующая связь между теплоёмкостями: (2. 5. 2) где v – число молей. , (2. 5. 3) При любых процессах д. Q=Cd. T, где C -теплоёмкость данного процесса. При изохорическом процессе как следует из (2. 4. 2) d. U=д. Q, соответственно Таким образом, при любом процессе производная от внутренней энергии по температуре даёт теплоёмкость при постоянном объёме.
 2. 6. Внутренняя энергия идеального газа Закон Джоуля (P, V, T)=0 (2. 6. 1) U=U(V, T) (2. 6. 2) Зависимость типа (2. 6. 2) называется калорическим уравнением состояния, а типа (2. 6. 2) – термическим уравнением состояния. Как показывает опыт, для идеального газа внутренняя энергия является только функцией температуры. Этот опытный факт является законом Джоуля. Зависимость U(T) не может быть установлена методами термодинамики. Эта функция может быть выражена через теплоёмкость CV идеального газа. Поскольку , Как показывает опыт во многих случаях CV в широкой области температур остаётся постоянной. Тогда (2. 6. 3) U=Cv. T.
2. 6. Внутренняя энергия идеального газа Закон Джоуля (P, V, T)=0 (2. 6. 1) U=U(V, T) (2. 6. 2) Зависимость типа (2. 6. 2) называется калорическим уравнением состояния, а типа (2. 6. 2) – термическим уравнением состояния. Как показывает опыт, для идеального газа внутренняя энергия является только функцией температуры. Этот опытный факт является законом Джоуля. Зависимость U(T) не может быть установлена методами термодинамики. Эта функция может быть выражена через теплоёмкость CV идеального газа. Поскольку , Как показывает опыт во многих случаях CV в широкой области температур остаётся постоянной. Тогда (2. 6. 3) U=Cv. T.
 Различные формулировки основного постулата, выражающего II начало термодинамики Р а 1 Рис. 1 В цилиндре помещается газ или какое – либо другое вещество, называемое рабочим телом. 2 (1) в V (2) Отсюда в комбинации с (1) имеем называется коэффициент полезного действия. Опытные данные говорят против возможности двигателя II рода и это возведен в постулат и является постулатом II начала термодинамики. . Томсон дал такую формулировку постулаты II начала термодинамики: невозможен. круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара. Планк сформулировал постулату II начало термодинамики следующим образом: невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счёт охлаждения теплового резервуара. Формулировка Клазиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому, при условии, что во всех окружающих телах никаких изменений нет.
Различные формулировки основного постулата, выражающего II начало термодинамики Р а 1 Рис. 1 В цилиндре помещается газ или какое – либо другое вещество, называемое рабочим телом. 2 (1) в V (2) Отсюда в комбинации с (1) имеем называется коэффициент полезного действия. Опытные данные говорят против возможности двигателя II рода и это возведен в постулат и является постулатом II начала термодинамики. . Томсон дал такую формулировку постулаты II начала термодинамики: невозможен. круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара. Планк сформулировал постулату II начало термодинамики следующим образом: невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счёт охлаждения теплового резервуара. Формулировка Клазиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому, при условии, что во всех окружающих телах никаких изменений нет.
 Обратимые и необратимые процессы. Обратимыми процессами называются такие изменения состояния системы, которые, будучи, проведены в обратном направлении, возвращаются в исходное состояние, так, чтобы система прошла через те же промежуточные состояния, что и в прямом процессе, но в обратной последовательности, а состояние тел вне системы осталось неизменным. Процессы, не удовлетворяющие приведённому выше условию обратимости, называются необратимыми. Теоремы Карно: 1) Тепловая машина работающая при данных значениях температур нагревателя и холодильника не может иметь КПД, больше чем машина, работающая по обратимому циклу Карно при тех же значениях температур нагревателя и холодильника. 2) КПД цикла Карно не зависит от рабочего тела, а зависит только от температур нагревателя и холодильника
Обратимые и необратимые процессы. Обратимыми процессами называются такие изменения состояния системы, которые, будучи, проведены в обратном направлении, возвращаются в исходное состояние, так, чтобы система прошла через те же промежуточные состояния, что и в прямом процессе, но в обратной последовательности, а состояние тел вне системы осталось неизменным. Процессы, не удовлетворяющие приведённому выше условию обратимости, называются необратимыми. Теоремы Карно: 1) Тепловая машина работающая при данных значениях температур нагревателя и холодильника не может иметь КПД, больше чем машина, работающая по обратимому циклу Карно при тех же значениях температур нагревателя и холодильника. 2) КПД цикла Карно не зависит от рабочего тела, а зависит только от температур нагревателя и холодильника
 Энтропия Величину называют приведённой теплотой и это равенство говорит о равенстве приведённых теплот, полученных или отданных рабочим телом при круговом процессе. Если в результате каких-либо изменений состояния обратимым путём система переходит из состояния A в состояние B, то сумма приведённых количеств теплоты не зависит от пути от A к B, для круговых процессов Значение энтропии одного из состояний берут равной нулю. Тогда Принято считать энтропию равной нуль в состоянии, когда T=0. Таким образом, элементарное изменение энтропии определяется выражением
Энтропия Величину называют приведённой теплотой и это равенство говорит о равенстве приведённых теплот, полученных или отданных рабочим телом при круговом процессе. Если в результате каких-либо изменений состояния обратимым путём система переходит из состояния A в состояние B, то сумма приведённых количеств теплоты не зависит от пути от A к B, для круговых процессов Значение энтропии одного из состояний берут равной нулю. Тогда Принято считать энтропию равной нуль в состоянии, когда T=0. Таким образом, элементарное изменение энтропии определяется выражением
 Q не является полным дифференциалом, так как Q не является функцией состояния, Q становится полным дифференциалом после деления на T. Величина 1/T является интегрирующим множителем для Q. С учетом выражения для d. S первый закон термодинамики можно записать в виде : (1) Это уравнение носит название термодинамического тождества. Его называют вторым началом термодинамики для обратимых процессов. Если круговой процесс, претерпеваемый системой необратим, то Это выражение называется неравенством Клаузиуса.
Q не является полным дифференциалом, так как Q не является функцией состояния, Q становится полным дифференциалом после деления на T. Величина 1/T является интегрирующим множителем для Q. С учетом выражения для d. S первый закон термодинамики можно записать в виде : (1) Это уравнение носит название термодинамического тождества. Его называют вторым началом термодинамики для обратимых процессов. Если круговой процесс, претерпеваемый системой необратим, то Это выражение называется неравенством Клаузиуса.
 Закон возрастания энтропии Второе начало термодинамики При обратимом адиабатическом процессе d. Q=0 d. S=0, т. е. S=const. При изотермическом изменении объёма энтропия остаётся также неизменной. В замкнутой системе при любом обратимом процессе энтропия остаётся постоянной, т. е. d. S=0. Для необратимых процессов в замкнутых системах энтропия всегда возрастает. Рост энтропии в любом процессе продолжается не беспредельно, а лишь до определённого максимального значения, характерного для этой системы. Это максимальное значение энтропии соответствует состоянию равновесия и после того как оно достигнуто, любые изменения состояния системы без внешнего воздействия прекращаются. Закон возрастания энтропии при необратимых процессах составляет содержание II закона термодинамики: в замкнутой системе возможны только такие необратимые процессы, которые сопровождаются возрастанием энтропии.
Закон возрастания энтропии Второе начало термодинамики При обратимом адиабатическом процессе d. Q=0 d. S=0, т. е. S=const. При изотермическом изменении объёма энтропия остаётся также неизменной. В замкнутой системе при любом обратимом процессе энтропия остаётся постоянной, т. е. d. S=0. Для необратимых процессов в замкнутых системах энтропия всегда возрастает. Рост энтропии в любом процессе продолжается не беспредельно, а лишь до определённого максимального значения, характерного для этой системы. Это максимальное значение энтропии соответствует состоянию равновесия и после того как оно достигнуто, любые изменения состояния системы без внешнего воздействия прекращаются. Закон возрастания энтропии при необратимых процессах составляет содержание II закона термодинамики: в замкнутой системе возможны только такие необратимые процессы, которые сопровождаются возрастанием энтропии.
 Третье начало термодинамики При абсолютном нуле температуры любые изменения состояния происходят без изменения энтропии. Это утверждение называется теоремой Нернста или третьим началом термодинамики. При T 0 C 0, а при T=0 C=0. Должен стремиться к нулю при Т=0 коэффициент сжимаемости и коэффициент теплового расширения.
Третье начало термодинамики При абсолютном нуле температуры любые изменения состояния происходят без изменения энтропии. Это утверждение называется теоремой Нернста или третьим началом термодинамики. При T 0 C 0, а при T=0 C=0. Должен стремиться к нулю при Т=0 коэффициент сжимаемости и коэффициент теплового расширения.
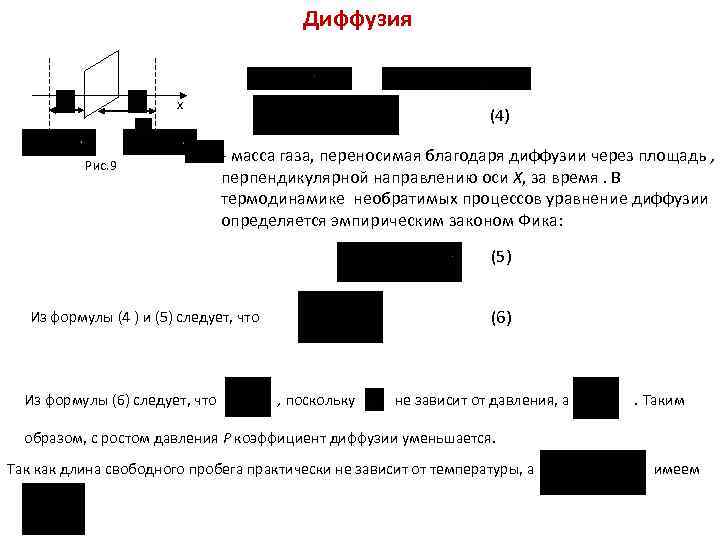 Диффузия х Рис. 9 (4) - масса газа, переносимая благодаря диффузии через площадь , перпендикулярной направлению оси Х, за время. В термодинамике необратимых процессов уравнение диффузии определяется эмпирическим законом Фика: (5) (6) Из формулы (4 ) и (5) следует, что Из формулы (6) следует, что , поскольку не зависит от давления, а . Таким образом, с ростом давления Р коэффициент диффузии уменьшается. Так как длина свободного пробега практически не зависит от температуры, а имеем
Диффузия х Рис. 9 (4) - масса газа, переносимая благодаря диффузии через площадь , перпендикулярной направлению оси Х, за время. В термодинамике необратимых процессов уравнение диффузии определяется эмпирическим законом Фика: (5) (6) Из формулы (4 ) и (5) следует, что Из формулы (6) следует, что , поскольку не зависит от давления, а . Таким образом, с ростом давления Р коэффициент диффузии уменьшается. Так как длина свободного пробега практически не зависит от температуры, а имеем
 Теплопроводность газов x. T 1 W 1 Рис. 11 Кинетическая энергия молекулы определяется как , , где T 2 W 2 - количество внутренней энергии, переносимое за время через площадку перпендикулярно направлению переноса. Подставляя эти выражения в уравнение переноса (3), получим: (1) Учитывая, что (2) Так как теплопроводности: - удельная теплоемкость, из (1) окончательно получим уравнение Эмпирически явление теплопроводности описывается уравнением Фурье: где называется коэффициентом теплопроводности. Коэффициент теплопроводности не зависит от давления, но растет с температурой несколько быстрее, чем.
Теплопроводность газов x. T 1 W 1 Рис. 11 Кинетическая энергия молекулы определяется как , , где T 2 W 2 - количество внутренней энергии, переносимое за время через площадку перпендикулярно направлению переноса. Подставляя эти выражения в уравнение переноса (3), получим: (1) Учитывая, что (2) Так как теплопроводности: - удельная теплоемкость, из (1) окончательно получим уравнение Эмпирически явление теплопроводности описывается уравнением Фурье: где называется коэффициентом теплопроводности. Коэффициент теплопроводности не зависит от давления, но растет с температурой несколько быстрее, чем.
 Вязкость газов (внутреннее трение) X 1 Согласно II закону Ньютона. X 2 Рис. 12 В термодинамике необратимых процессов это явление описывается уравнением Ньютона, записанным в виде: Коэффициент , называют динамической вязкостью. Единица измерения в системе СИ Коэффициент, определяемый выражением , называют кинематической вязкостью,
Вязкость газов (внутреннее трение) X 1 Согласно II закону Ньютона. X 2 Рис. 12 В термодинамике необратимых процессов это явление описывается уравнением Ньютона, записанным в виде: Коэффициент , называют динамической вязкостью. Единица измерения в системе СИ Коэффициент, определяемый выражением , называют кинематической вязкостью,
 Соотношения между коэффициентами переноса Для коэффициентов теплопроводности и вязкости следует, что между ними существует простое соотношение: Коэффициенты вязкости и диффузии, связаны соотношением: Коэффициенты диффузии и теплопроводности, связаны соотношением: Эту величину называют коэффициентом температуропроводности. Этот коэффициент имеет смысл коэффициента диффузии температуры.
Соотношения между коэффициентами переноса Для коэффициентов теплопроводности и вязкости следует, что между ними существует простое соотношение: Коэффициенты вязкости и диффузии, связаны соотношением: Коэффициенты диффузии и теплопроводности, связаны соотношением: Эту величину называют коэффициентом температуропроводности. Этот коэффициент имеет смысл коэффициента диффузии температуры.
 . Реальные газы § 1. Неидеальные газы. Уравнение Ван-дер-Ваальса. Учет сил отталкивания между молекулами (1) (2) r Отсюда Сторона куба равна Центр молекулы будет двигаться свободно в объеме Рис. 1 молекул, каждая из них будет иметь возможность Для одного моля, состоящего из двигаться в объеме Обычно диаметр молекулы (3) . , поэтому, пренебрегая Следовательно, по сравнению с имеем
. Реальные газы § 1. Неидеальные газы. Уравнение Ван-дер-Ваальса. Учет сил отталкивания между молекулами (1) (2) r Отсюда Сторона куба равна Центр молекулы будет двигаться свободно в объеме Рис. 1 молекул, каждая из них будет иметь возможность Для одного моля, состоящего из двигаться в объеме Обычно диаметр молекулы (3) . , поэтому, пренебрегая Следовательно, по сравнению с имеем
 Учет сил притяжения между молекулами Отсюда Давление газа с учетом сил притяжения между молекулами можно написать в виде: Отсюда (4) Это уравнение является уравнением состояния одного моля реального газа, называемым уравнением состояния реального газа. Для массы газа уравнение Ван-дер-Ваальса имеет вид: (5)
Учет сил притяжения между молекулами Отсюда Давление газа с учетом сил притяжения между молекулами можно написать в виде: Отсюда (4) Это уравнение является уравнением состояния одного моля реального газа, называемым уравнением состояния реального газа. Для массы газа уравнение Ван-дер-Ваальса имеет вид: (5)
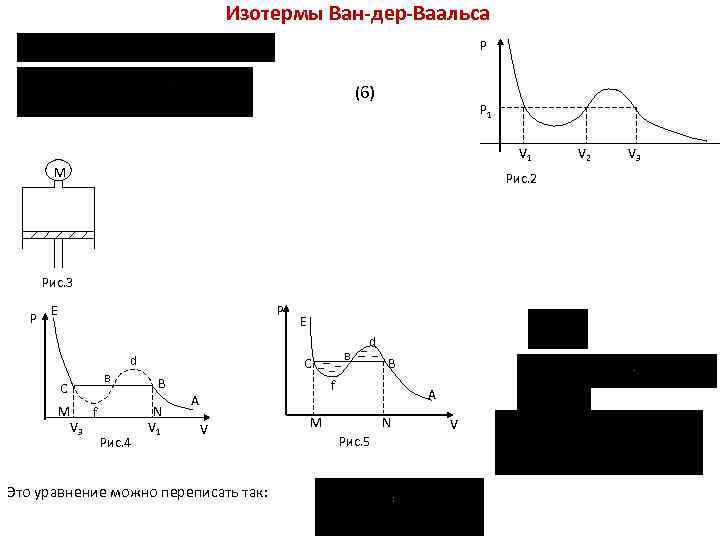 Изотермы Ван-дер-Ваальса P (6) P 1 V 1 М Рис. 2 Рис. 3 P P E C М f V 3 в d Рис. 4 E в C B N V 1 d B f A V Это уравнение можно переписать так: A M N Рис. 5 V V 2 V 3
Изотермы Ван-дер-Ваальса P (6) P 1 V 1 М Рис. 2 Рис. 3 P P E C М f V 3 в d Рис. 4 E в C B N V 1 d B f A V Это уравнение можно переписать так: A M N Рис. 5 V V 2 V 3
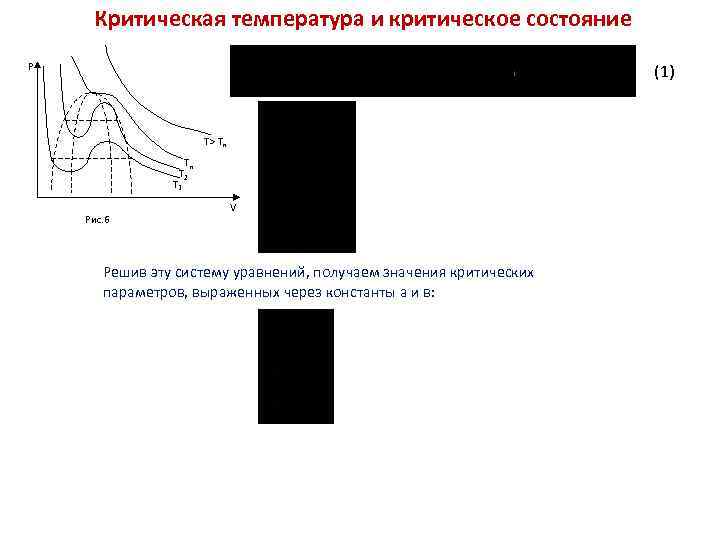 Критическая температура и критическое состояние P (1) T> Тк Tк T 2 T 1 Рис. 6 V Решив эту систему уравнений, получаем значения критических параметров, выраженных через константы а и в:
Критическая температура и критическое состояние P (1) T> Тк Tк T 2 T 1 Рис. 6 V Решив эту систему уравнений, получаем значения критических параметров, выраженных через константы а и в:
 Недостатки уравнения Ван-дер-Ваальса Теория Ван-дер-Ваальса имеет существенные недостатки: а) Параметры а и в входящие в уравнение Ван-дер-Ваальса не являются постоянными. Они зависят от температуры, хотя по смыслу уравнение Ван-дер-Ваальса должны быть постоянными, характерными для данного вещества величинами; б) Другое количественное расхождение между теоретическим уравнением и опытом связано со значениями критических параметров Рк, Vк, Тк. Между этими величинами должно существовать соотношение не зависящее от природы вещества: Опыт показывает, что величина постоянна для многих веществ В настоящее время принято описывать состояние реального газа более общим уравнением в виде ряда: Коэффициенты В, С…, которые определяются или из опыта или теоретически, называются вириальными коэффициентами, причем все они зависят от температуры.
Недостатки уравнения Ван-дер-Ваальса Теория Ван-дер-Ваальса имеет существенные недостатки: а) Параметры а и в входящие в уравнение Ван-дер-Ваальса не являются постоянными. Они зависят от температуры, хотя по смыслу уравнение Ван-дер-Ваальса должны быть постоянными, характерными для данного вещества величинами; б) Другое количественное расхождение между теоретическим уравнением и опытом связано со значениями критических параметров Рк, Vк, Тк. Между этими величинами должно существовать соотношение не зависящее от природы вещества: Опыт показывает, что величина постоянна для многих веществ В настоящее время принято описывать состояние реального газа более общим уравнением в виде ряда: Коэффициенты В, С…, которые определяются или из опыта или теоретически, называются вириальными коэффициентами, причем все они зависят от температуры.
 F 23 F 13 3 Условия равновесия на границе двух сред. Краевой угол 2 F 12 или 1 Рис. 1 или Физически это означает, что сила сил или Если не станет равной по величине больше равнодействующей , то жидкость будет стягиваться до тех пор, пока. Это и есть условие образования чечевицы.
F 23 F 13 3 Условия равновесия на границе двух сред. Краевой угол 2 F 12 или 1 Рис. 1 или Физически это означает, что сила сил или Если не станет равной по величине больше равнодействующей , то жидкость будет стягиваться до тех пор, пока. Это и есть условие образования чечевицы.
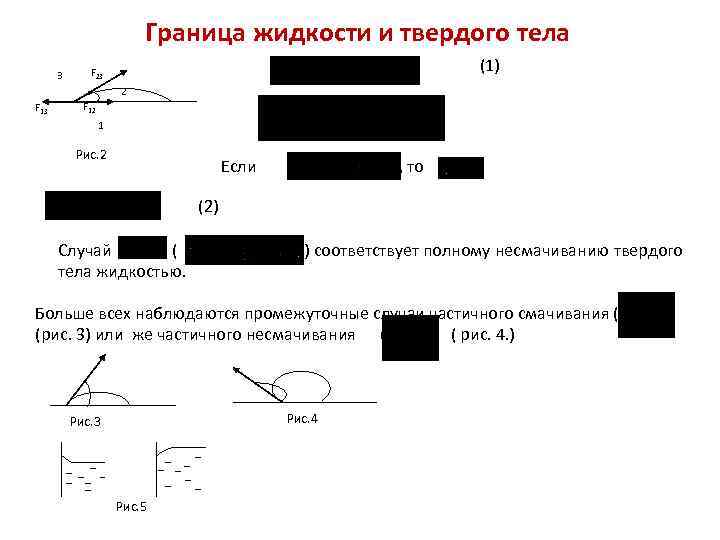 Граница жидкости и твердого тела 3 (1) F 23 2 F 13 F 12 1 Рис. 2 Если , то (2) Случай ( тела жидкостью. ) соответствует полному несмачиванию твердого Больше всех наблюдаются промежуточные случаи частичного смачивания ( (рис. 3) или же частичного несмачивания ( ( рис. 4. ) Рис. 4 Рис. 3 Рис. 5
Граница жидкости и твердого тела 3 (1) F 23 2 F 13 F 12 1 Рис. 2 Если , то (2) Случай ( тела жидкостью. ) соответствует полному несмачиванию твердого Больше всех наблюдаются промежуточные случаи частичного смачивания ( (рис. 3) или же частичного несмачивания ( ( рис. 4. ) Рис. 4 Рис. 3 Рис. 5
 . dr r Силы, возникающие на кривой поверхности жидкости (1) (2) Рис. 6 (3) (4) Давление, оказываемое на жидкость ее кривой поверхностью имеет (5) следующее выражение: Если поверхность жидкости цилиндрическая, то Следовательно, (6) В общем случае поверхности любой формы давление, обусловленное кривизной поверхности, выражаются уравнением, известным под названием уравнения Лапласа: (7)
. dr r Силы, возникающие на кривой поверхности жидкости (1) (2) Рис. 6 (3) (4) Давление, оказываемое на жидкость ее кривой поверхностью имеет (5) следующее выражение: Если поверхность жидкости цилиндрическая, то Следовательно, (6) В общем случае поверхности любой формы давление, обусловленное кривизной поверхности, выражаются уравнением, известным под названием уравнения Лапласа: (7)
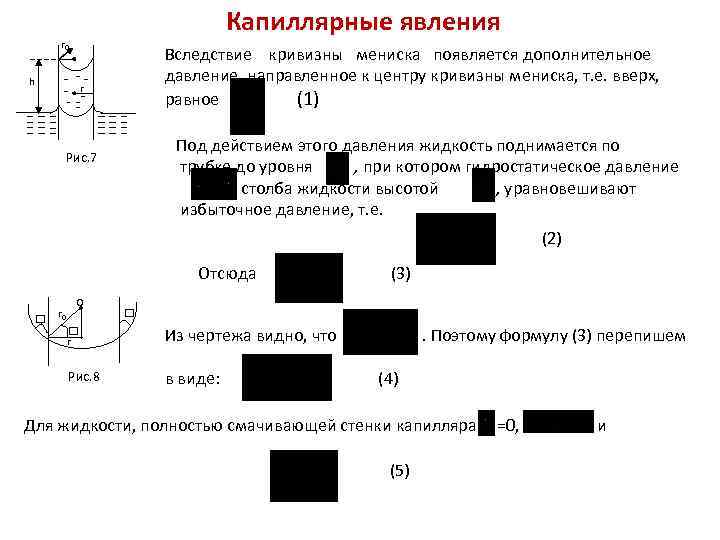 Капиллярные явления r 0 h Вследствие кривизны мениска появляется дополнительное давление, направленное к центру кривизны мениска, т. е. вверх, равное (1) r Под действием этого давления жидкость поднимается по трубке до уровня , , при котором гидростатическое давление столба жидкости высотой , уравновешивают избыточное давление, т. е. Рис. 7 (2) Отсюда r 0 О (3) r Из чертежа видно, что Рис. 8 в виде: . Поэтому формулу (3) перепишем (4) Для жидкости, полностью смачивающей стенки капилляра (5) =0, и
Капиллярные явления r 0 h Вследствие кривизны мениска появляется дополнительное давление, направленное к центру кривизны мениска, т. е. вверх, равное (1) r Под действием этого давления жидкость поднимается по трубке до уровня , , при котором гидростатическое давление столба жидкости высотой , уравновешивают избыточное давление, т. е. Рис. 7 (2) Отсюда r 0 О (3) r Из чертежа видно, что Рис. 8 в виде: . Поэтому формулу (3) перепишем (4) Для жидкости, полностью смачивающей стенки капилляра (5) =0, и
