УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ Актуализация



















gazovye_zakony.ppt
- Размер: 1.4 Мб
- Автор:
- Количество слайдов: 31
Описание презентации УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ Актуализация по слайдам
 УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ
 Актуализация опорных знаний Что является объектом изучения МКТ? Идеальный газ. Что в МКТ называется идеальным газом? Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь. Какие три термодинамических параметра используют для того, чтобы описать состояние идеального газа? Давление, объем и температура. Какое уравнение связывает между собой все три термодинамических параметра? Уравнение состояния идеального газа.
Актуализация опорных знаний Что является объектом изучения МКТ? Идеальный газ. Что в МКТ называется идеальным газом? Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь. Какие три термодинамических параметра используют для того, чтобы описать состояние идеального газа? Давление, объем и температура. Какое уравнение связывает между собой все три термодинамических параметра? Уравнение состояния идеального газа.
 НОВЫЕ ЗНАНИЯ Что называется изопроцессами? Изопроцессы – процессы, протекающие при неизменном значении одного из параметров. «Изо» — «постоянство» . Какие бывают изопроцессы? Изобарный Изохорный Изотермический Что называется газовыми законами? Количественная зависимость между двумя макропараметрами при неизменном значении третьего Какое уравнение связывает между собой все три термодинамических параметра? Уравнение состояния идеального газа.
НОВЫЕ ЗНАНИЯ Что называется изопроцессами? Изопроцессы – процессы, протекающие при неизменном значении одного из параметров. «Изо» — «постоянство» . Какие бывают изопроцессы? Изобарный Изохорный Изотермический Что называется газовыми законами? Количественная зависимость между двумя макропараметрами при неизменном значении третьего Какое уравнение связывает между собой все три термодинамических параметра? Уравнение состояния идеального газа.

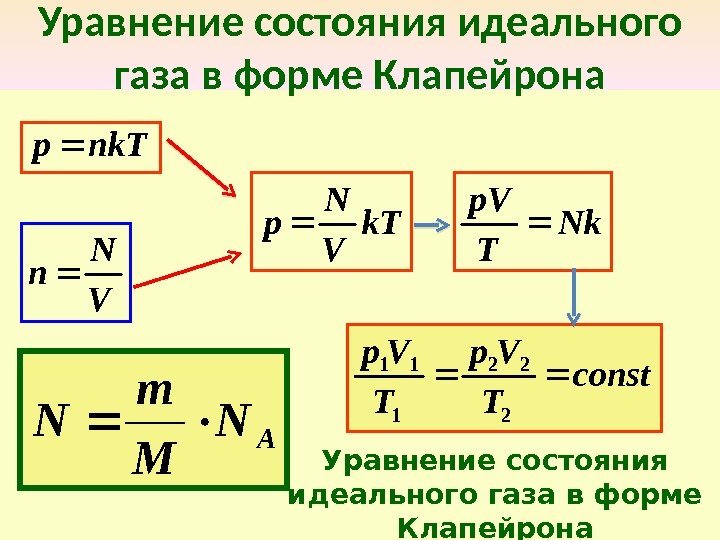
 Уравнение состояния идеального газа в форме Клапейрона nk. Tр V N n k. T V N р Nk T р. V const T Vр 2 22 1 11 Уравнение состояния идеального газа в форме Клапейрона A N M m N
Уравнение состояния идеального газа в форме Клапейрона nk. Tр V N n k. T V N р Nk T р. V const T Vр 2 22 1 11 Уравнение состояния идеального газа в форме Клапейрона A N M m N
 • Обобщив уравнение Клапейрона, в 1874 вывел общее уравнение состояния идеального газа. Менделеев Дмитрий Иванович (8. II. 1834– 2. II. 1907)
• Обобщив уравнение Клапейрона, в 1874 вывел общее уравнение состояния идеального газа. Менделеев Дмитрий Иванович (8. II. 1834– 2. II. 1907)
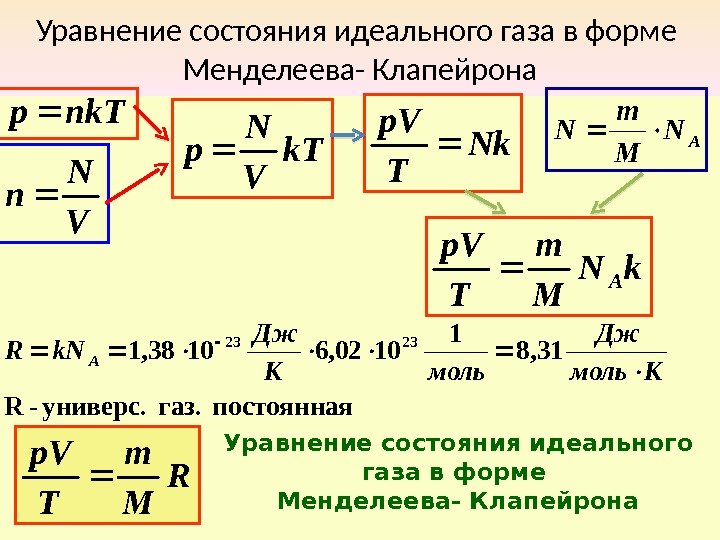
 Уравнение состояния идеального газа в форме Менделеева- Клапейрона nk. Tр V N n k. T V N р Nk Tр. V AN M m N k. N M m Tр. V A постоянная газ. универс. -R 31, 8 1 1002, 61038, 1 2323 Кмоль Дж моль. К Дж k. NR A R M m Tр. V Уравнение состояния идеального газа в форме Менделеева- Клапейрона
Уравнение состояния идеального газа в форме Менделеева- Клапейрона nk. Tр V N n k. T V N р Nk Tр. V AN M m N k. N M m Tр. V A постоянная газ. универс. -R 31, 8 1 1002, 61038, 1 2323 Кмоль Дж моль. К Дж k. NR A R M m Tр. V Уравнение состояния идеального газа в форме Менделеева- Клапейрона
 Практическое применение уравнения состояния: 1. В термометрах… • Уравнение позволяет определить одну из величин, характеризующих состояние, если известны две другие величины • Это используют в термометрах
Практическое применение уравнения состояния: 1. В термометрах… • Уравнение позволяет определить одну из величин, характеризующих состояние, если известны две другие величины • Это используют в термометрах
 2. В газовых законах… • Зная уравнение состояния, можно сказать, как протекают в системе процессы при определённых внешних условиях
2. В газовых законах… • Зная уравнение состояния, можно сказать, как протекают в системе процессы при определённых внешних условиях
 3. В молекулярной физике… • Зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел
3. В молекулярной физике… • Зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел
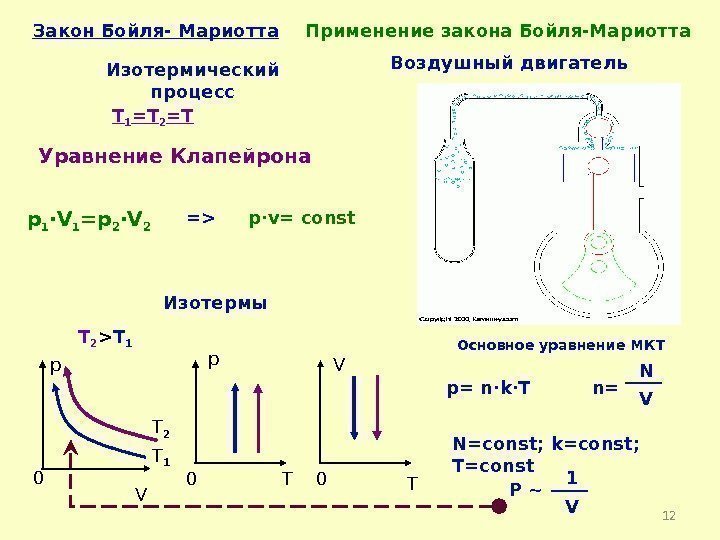
 Df. Изотермический процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре Т= const Закон Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. const T Vр 2 22 1 11 2211 Vр. Vрсоnstр. V V соnst р Э. Мариотт Р. Бойль
Df. Изотермический процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре Т= const Закон Бойля-Мариотта: Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. const T Vр 2 22 1 11 2211 Vр. Vрсоnstр. V V соnst р Э. Мариотт Р. Бойль
 12 Закон Бойля- Мариотта Изотермический процесс T 1 =T 2 =T p·v= const p 1 ·V 1 =p 2 ·V 2 p V 0 p 0 T V 0 TИзотермы T 2 T 1 T 2 > T 1 Основное уравнение МКТ p= n·k·T n= N V N=const; k=const; T=const Р ~ 1 VПрименение закона Бойля-Мариотта Воздушный двигатель = > Уравнение Клапейрона
12 Закон Бойля- Мариотта Изотермический процесс T 1 =T 2 =T p·v= const p 1 ·V 1 =p 2 ·V 2 p V 0 p 0 T V 0 TИзотермы T 2 T 1 T 2 > T 1 Основное уравнение МКТ p= n·k·T n= N V N=const; k=const; T=const Р ~ 1 VПрименение закона Бойля-Мариотта Воздушный двигатель = > Уравнение Клапейрона
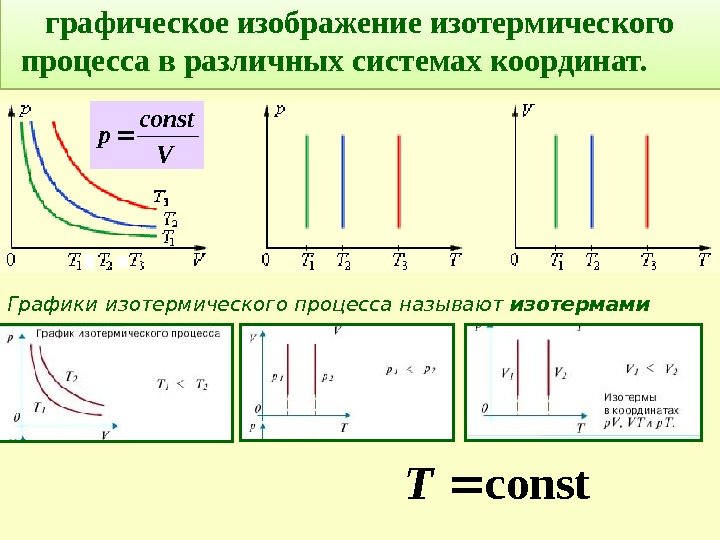
 графическое изображение изотермического процесса в различных системах координат. const Т V соnst р Графики изотермического процесса называют изотермами
графическое изображение изотермического процесса в различных системах координат. const Т V соnst р Графики изотермического процесса называют изотермами
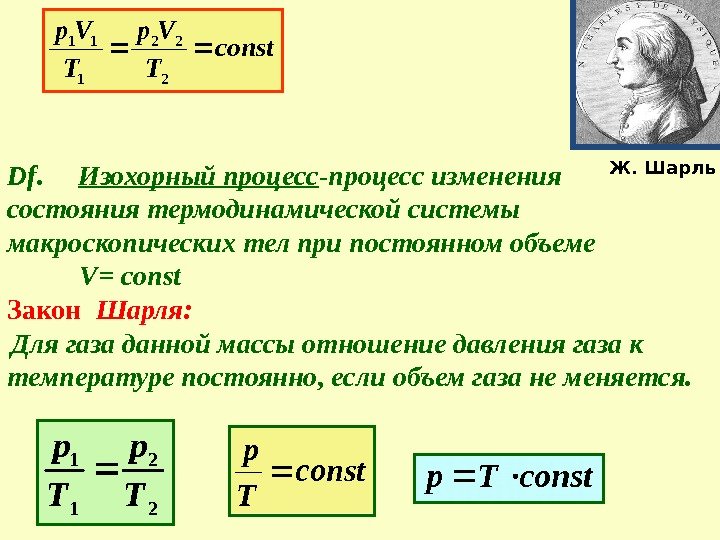
 Df. Изохорный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме V = const Закон Шарля: Для газа данной массы отношение давления газа к температуре постоянно, если объем газа не меняется. const T Vр 2 22 1 11 2 2 1 1 Т р соnst. Трconst Т р Ж. Шарль
Df. Изохорный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме V = const Закон Шарля: Для газа данной массы отношение давления газа к температуре постоянно, если объем газа не меняется. const T Vр 2 22 1 11 2 2 1 1 Т р соnst. Трconst Т р Ж. Шарль
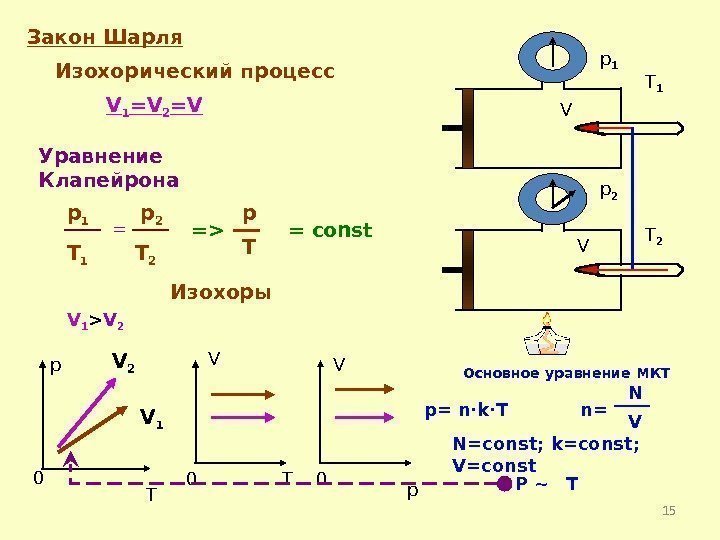
 15 Закон Шарля Изохорический процесс V 1 =V 2 =V = const p T 0 V 0 T V 0 p V V p 1 p 2 Изохоры= p Tp 1 T 1 p 2 T 1 T 2=> Основное уравнение МКТ p= n·k·T n= N V N=const; k=const; V=const P ~ TV 1 V 2 V 1 > V 2 Уравнение Клапейрона
15 Закон Шарля Изохорический процесс V 1 =V 2 =V = const p T 0 V 0 T V 0 p V V p 1 p 2 Изохоры= p Tp 1 T 1 p 2 T 1 T 2=> Основное уравнение МКТ p= n·k·T n= N V N=const; k=const; V=const P ~ TV 1 V 2 V 1 > V 2 Уравнение Клапейрона
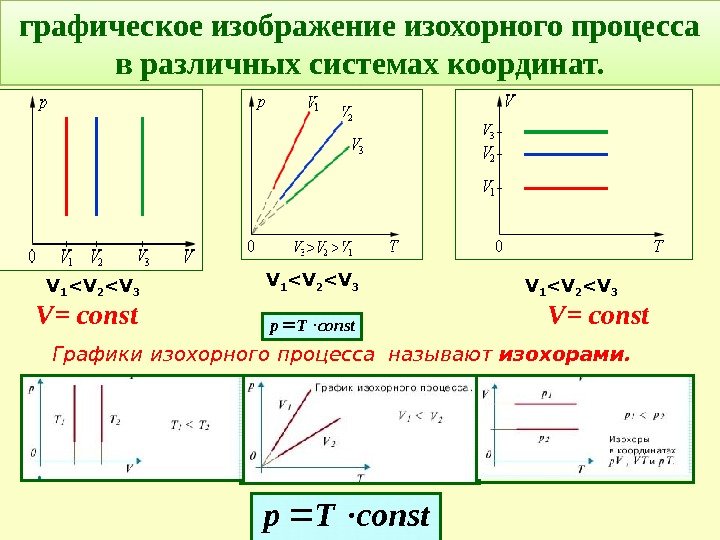
 Графики изохорного процесса называют изохорами. графическое изображение изохорного процесса в различных системах координат. V = constсоnst. Тр V 1 <V 2 <V
Графики изохорного процесса называют изохорами. графическое изображение изохорного процесса в различных системах координат. V = constсоnst. Тр V 1 <V 2 <V
 Df. Изобарный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении р= const Закон Гей-Люссака: Для газа данной массы отношение объема газа к абсолютной температуре постоянно, если давление газа не меняется. const T Vр 2 22 1 11 соnst T V 2 2 1 1 T V соnst. TV Ж. Гей-Люссак
Df. Изобарный процесс -процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении р= const Закон Гей-Люссака: Для газа данной массы отношение объема газа к абсолютной температуре постоянно, если давление газа не меняется. const T Vр 2 22 1 11 соnst T V 2 2 1 1 T V соnst. TV Ж. Гей-Люссак
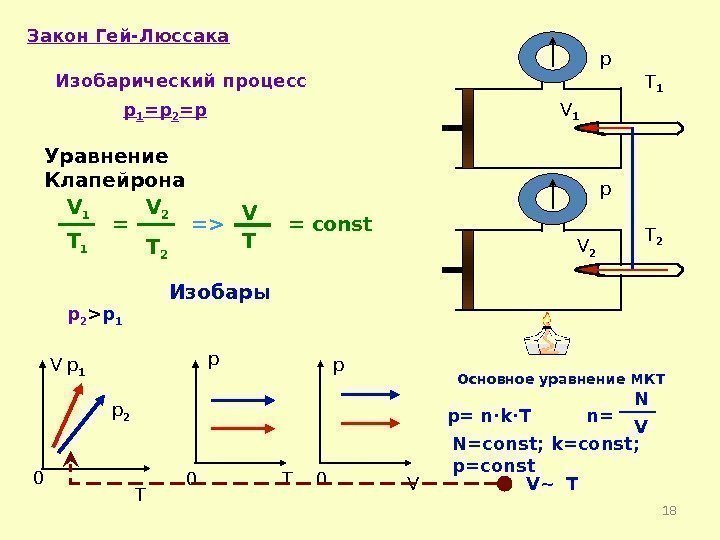
 18 Закон Гей-Люссака Изобарический процесс p 1 =p 2 =p = const V T 0 p 0 T p 0 V V 1 V 2 p p Изобары. T 1 = V TV 1 T 1 V 2 T 2= T 1 T 2=> Основное уравнение МКТ p= n·k·T n= N V N=const; k=const; p=const V~ Tp 2 > p 1 p 2 p 1 Уравнение Клапейрона
18 Закон Гей-Люссака Изобарический процесс p 1 =p 2 =p = const V T 0 p 0 T p 0 V V 1 V 2 p p Изобары. T 1 = V TV 1 T 1 V 2 T 2= T 1 T 2=> Основное уравнение МКТ p= n·k·T n= N V N=const; k=const; p=const V~ Tp 2 > p 1 p 2 p 1 Уравнение Клапейрона
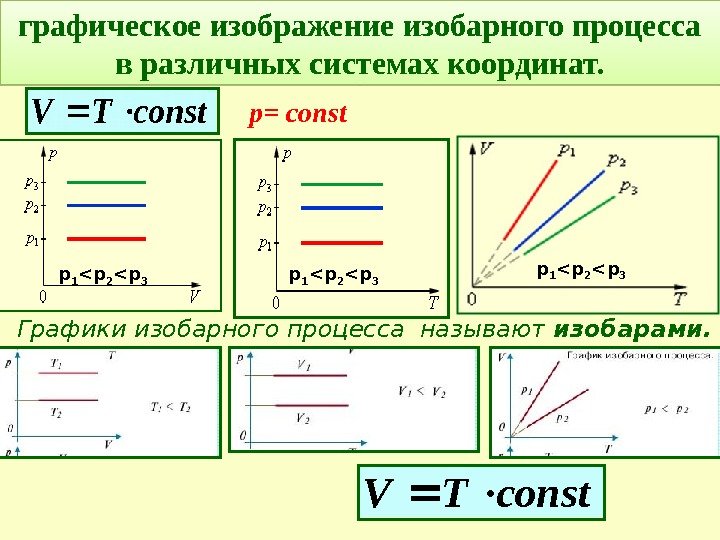
 Графики изобарного процесса называют изобарами. графическое изображение изобарного процесса в различных системах координат. соnst. ТV соnst. TV р= const р 1 < р 2 < р
Графики изобарного процесса называют изобарами. графическое изображение изобарного процесса в различных системах координат. соnst. ТV соnst. TV р= const р 1 < р 2 < р
 Изопроцессы в газах Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. ИЗОПРОЦЕССЫ: Название процесса Изотермиче ский процесс Изобарный процесс Изохорный процесс Постоянная величина T = const p = const V = const
Изопроцессы в газах Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. ИЗОПРОЦЕССЫ: Название процесса Изотермиче ский процесс Изобарный процесс Изохорный процесс Постоянная величина T = const p = const V = const
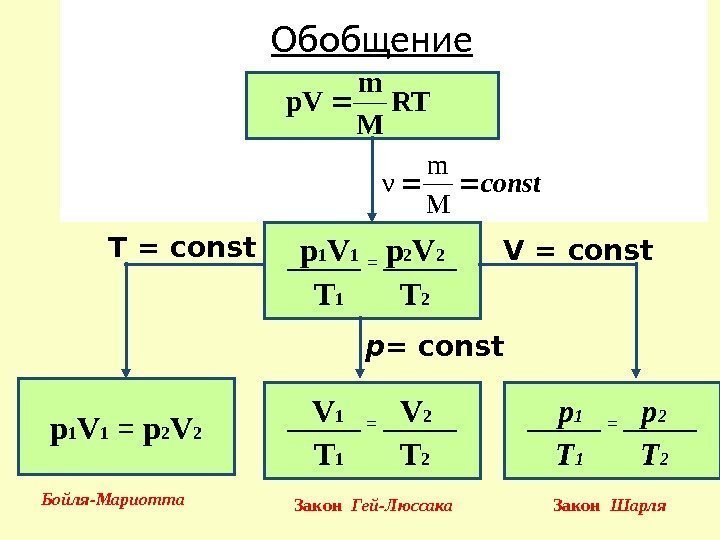
 Обобщение р 1 V 1 = р 2 V 2 T 1 T 2 V 1 = V 2 T 1 T 2 р 1 V 1 = р 2 V 2 р 1 = р 2 T 1 T 2 V = const. T = const р = const RT M m р. V const M m ν Бойля-Мариотта Закон Гей-Люссака Закон Шарля
Обобщение р 1 V 1 = р 2 V 2 T 1 T 2 V 1 = V 2 T 1 T 2 р 1 V 1 = р 2 V 2 р 1 = р 2 T 1 T 2 V = const. T = const р = const RT M m р. V const M m ν Бойля-Мариотта Закон Гей-Люссака Закон Шарля
 Выполнение лабораторной работы. Практическая часть 1. Инструктаж по ТБ. 2. Выполнение практической части работы по инструкции Аналитическая часть 1. Расчет искомых величин. 2. Расчет погрешностей. 3. Вывод о проделанном эксперименте.
Выполнение лабораторной работы. Практическая часть 1. Инструктаж по ТБ. 2. Выполнение практической части работы по инструкции Аналитическая часть 1. Расчет искомых величин. 2. Расчет погрешностей. 3. Вывод о проделанном эксперименте.
 Опытная проверка закона Гей – Люссака
Опытная проверка закона Гей – Люссака
 • 1. Последовательность действий • 2. Измерить ℓ в мм, t в º С • 3. С индексом ( 1 ) – горячее состояние, ( 2 ) – холодное состояние • 4. Измерить ℓ 1 и ℓ 2 , t 1 и t 2 – известны • 5. Перевод t → ТХОД РАБОТЫ
• 1. Последовательность действий • 2. Измерить ℓ в мм, t в º С • 3. С индексом ( 1 ) – горячее состояние, ( 2 ) – холодное состояние • 4. Измерить ℓ 1 и ℓ 2 , t 1 и t 2 – известны • 5. Перевод t → ТХОД РАБОТЫ
 • 1. Последовательность действий • 2. Измерить ℓ в мм, t в º С • 3. С индексом ( 1 ) – горячее состояние, ( 2 ) – холодное состояние • 4. Измерить ℓ 1 и ℓ 2 , t 1 и t 2 – известны • 5. Перевод t → ТХОД РАБОТЫ
• 1. Последовательность действий • 2. Измерить ℓ в мм, t в º С • 3. С индексом ( 1 ) – горячее состояние, ( 2 ) – холодное состояние • 4. Измерить ℓ 1 и ℓ 2 , t 1 и t 2 – известны • 5. Перевод t → ТХОД РАБОТЫ
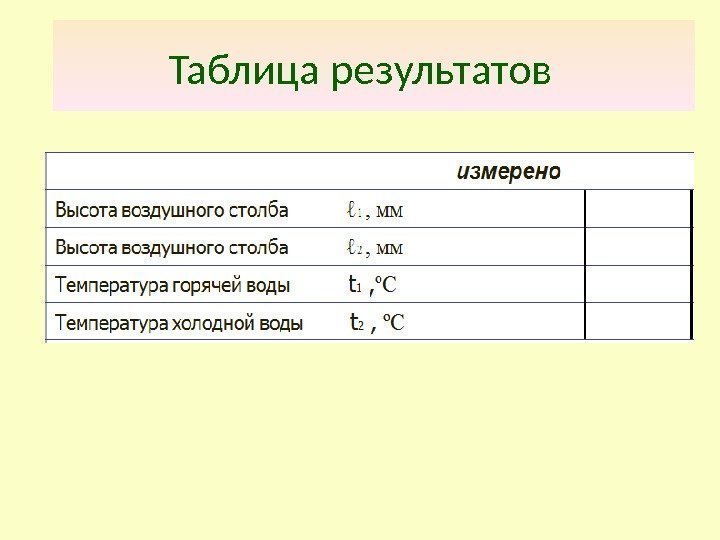
 Таблица результатов
Таблица результатов
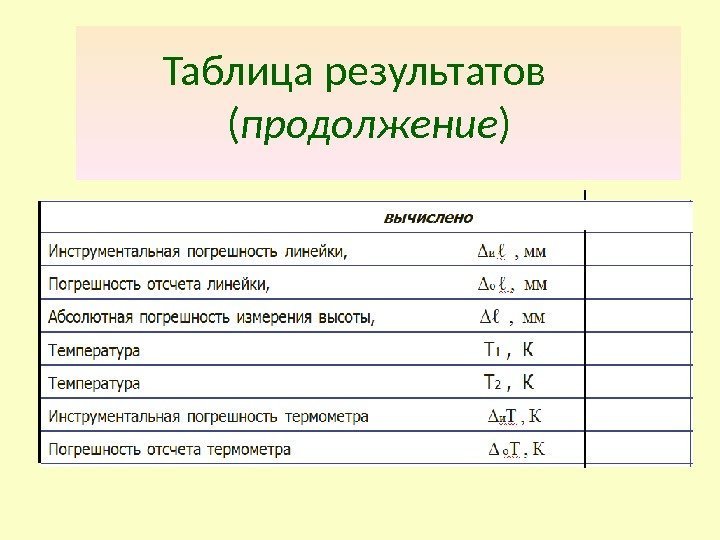
 Таблица результатов ( продолжение )
Таблица результатов ( продолжение )
 Таблица результатов ( продолжение )
Таблица результатов ( продолжение )
 Вычисления: Т = t + 273 T 1 = 64+273=327 K T 2 = 20+273 = 293 K Погрешности измерений: Δℓ = Δℓ и + Δℓ о =1+0, 5=1, 5 мм Δ Т= Δ Т и + Δ Т о = 1+0, 5 =1, 5 К Относительные погрешности: 17, 1 426 500 2 1 15, 1 293 327 2 1 Т Т %65, 00065, 0 425 5, 1 500 5, 1 21 1 мм мм %96, 00096, 0 293 5, 1 327 5, 1 21 2 К К Т Т
Вычисления: Т = t + 273 T 1 = 64+273=327 K T 2 = 20+273 = 293 K Погрешности измерений: Δℓ = Δℓ и + Δℓ о =1+0, 5=1, 5 мм Δ Т= Δ Т и + Δ Т о = 1+0, 5 =1, 5 К Относительные погрешности: 17, 1 426 500 2 1 15, 1 293 327 2 1 Т Т %65, 00065, 0 425 5, 1 500 5, 1 21 1 мм мм %96, 00096, 0 293 5, 1 327 5, 1 21 2 К К Т Т
 Абсолютные погрешности: 01, 00065, 017, 11 2 1 1 01, 00096, 015, 12 2 1 2 Т Т 01, 017, 1 21 01, 015, 1 2 1 Т Т 18, 116, 1 21 16, 114, 1 21 Т Т Вывод: закон Гей- Люссака выполняется, так как отношение объемов равно отношению температур с учетом погрешностей
Абсолютные погрешности: 01, 00065, 017, 11 2 1 1 01, 00096, 015, 12 2 1 2 Т Т 01, 017, 1 21 01, 015, 1 2 1 Т Т 18, 116, 1 21 16, 114, 1 21 Т Т Вывод: закон Гей- Люссака выполняется, так как отношение объемов равно отношению температур с учетом погрешностей
 Домашнее задание. 1. Повторить теорию по теме «Молекулярно – кинетическая теория. Идеальный газ. Уравнение состояния. Основное уравнение МКТ. Газовые законы» . 2. Отчет о выполнении лабораторной работы.
Домашнее задание. 1. Повторить теорию по теме «Молекулярно – кинетическая теория. Идеальный газ. Уравнение состояния. Основное уравнение МКТ. Газовые законы» . 2. Отчет о выполнении лабораторной работы.
