Углерод и его соединения.ppt
- Количество слайдов: 44
 Углерод и его соединения
Углерод и его соединения
 Углерод – основа органических, биоорганических соединений и многих полимеров. Большинство соединений углерода относятся к органическим веществам, но в этой работе мы уделим внимание, так называемым, неорганическим соединениям углерода.
Углерод – основа органических, биоорганических соединений и многих полимеров. Большинство соединений углерода относятся к органическим веществам, но в этой работе мы уделим внимание, так называемым, неорганическим соединениям углерода.
 Углерод встречается в природе в виде различных аллотропных видоизменений: алмаз, графит, уголь. Также он входит в состав известняка, мрамора, мела, малахита, каменного угля, нефти, природного газа. Углерод является основной частью всех органических веществ, в воздухе в виде углекислого газа.
Углерод встречается в природе в виде различных аллотропных видоизменений: алмаз, графит, уголь. Также он входит в состав известняка, мрамора, мела, малахита, каменного угля, нефти, природного газа. Углерод является основной частью всех органических веществ, в воздухе в виде углекислого газа.
 Особенности строения атомов углерода Разнообразие и многочисленность соединений углерода объясняется строением его атома. В атоме углерода на его внешних четырех атомных орбиталях имеется четыре электрона. И все четыре атомные орбитали принимают участие в образовании химических связей.
Особенности строения атомов углерода Разнообразие и многочисленность соединений углерода объясняется строением его атома. В атоме углерода на его внешних четырех атомных орбиталях имеется четыре электрона. И все четыре атомные орбитали принимают участие в образовании химических связей.
 Аллотропные видоизменения. АЛМАЗ ГРАФИТ
Аллотропные видоизменения. АЛМАЗ ГРАФИТ
 В частности графит и алмаз – аллотропные модификации с атомными кристаллическими решетками, которые различны по своей структуре. Отсюда различия физических и химических свойств. В алмазе каждый атом углерода связан с четырьмя другими атомами. В пространстве эти атомы располагаются в центре и углах тетраэдров, соединенных своими вершинами. Это очень симметричная и прочная решетка.
В частности графит и алмаз – аллотропные модификации с атомными кристаллическими решетками, которые различны по своей структуре. Отсюда различия физических и химических свойств. В алмазе каждый атом углерода связан с четырьмя другими атомами. В пространстве эти атомы располагаются в центре и углах тетраэдров, соединенных своими вершинами. Это очень симметричная и прочная решетка.
 В графите соединены между собой три атома, лежащие в одной плоскости. Следовательно, образование этих связей происходит с участием трех атомных орбиталей с тремя электронами. Каждый атом соединен с тремя другими, лежащими в той же плоскости. На образование этих связей затрачивается по три АО с тремя электронами. Четвертая орбиталь с одним электроном располагается перпендикулярно плоскости. Эти оставшиеся атомные орбитали всей сетки перекрываются между собой, образуя зону молекулярных орбиталей. Эта зона занята наполовину, что обеспечивает графиту, в отличие от алмаза, хорошую металлическую
В графите соединены между собой три атома, лежащие в одной плоскости. Следовательно, образование этих связей происходит с участием трех атомных орбиталей с тремя электронами. Каждый атом соединен с тремя другими, лежащими в той же плоскости. На образование этих связей затрачивается по три АО с тремя электронами. Четвертая орбиталь с одним электроном располагается перпендикулярно плоскости. Эти оставшиеся атомные орбитали всей сетки перекрываются между собой, образуя зону молекулярных орбиталей. Эта зона занята наполовину, что обеспечивает графиту, в отличие от алмаза, хорошую металлическую
 уголь
уголь
 Также он встречается в составе: известняк МАЛАХИТ
Также он встречается в составе: известняк МАЛАХИТ
 МРАМОР КАМЕННЫЙ УГОЛЬ
МРАМОР КАМЕННЫЙ УГОЛЬ
 нефть
нефть
 Физические свойства: Алмаз- бесцветное кристаллическое вещество, обладает исключительно твердостью, большой плотностью, используется для резки стекла, бурение горных пород, изготовление бриллиантов, для шлифования материалов. Графит- темно-серое кристаллическое вещество, со слабым металлическим блеском, жирное на ощупь, проводит тепло и электрический ток. Используется в производстве электродов, смазочного материала, в ядерных реакторах.
Физические свойства: Алмаз- бесцветное кристаллическое вещество, обладает исключительно твердостью, большой плотностью, используется для резки стекла, бурение горных пород, изготовление бриллиантов, для шлифования материалов. Графит- темно-серое кристаллическое вещество, со слабым металлическим блеском, жирное на ощупь, проводит тепло и электрический ток. Используется в производстве электродов, смазочного материала, в ядерных реакторах.
 Тугоплавкость – еще одно уникальное свойство графита, т. к. температура плавления графита пл. выше 3500° С. В природе графит – самое тугоплавкое простое вещество. Большая электрическая проводимость графита объясняется отсутствием на его поверхности какихлибо продуктов взаимодействия с окружающей средой, таких как оксиды на металлах.
Тугоплавкость – еще одно уникальное свойство графита, т. к. температура плавления графита пл. выше 3500° С. В природе графит – самое тугоплавкое простое вещество. Большая электрическая проводимость графита объясняется отсутствием на его поверхности какихлибо продуктов взаимодействия с окружающей средой, таких как оксиды на металлах.
 Кроме того графит обладает способностью оказывать смазывающее действие на трущиеся поверхности. Объясняется это тем, что в кристалле графита атомы углерода прочно связаны между собой в плоских сетках, а связь между сетками слабая и имеет межмолекулярную природу (как в веществах с молекулярными решетками). Вследствие чего уже небольшие механические усилия вызывают смещение сеток относительно друга. Это обусловливает действие графита, как смазки.
Кроме того графит обладает способностью оказывать смазывающее действие на трущиеся поверхности. Объясняется это тем, что в кристалле графита атомы углерода прочно связаны между собой в плоских сетках, а связь между сетками слабая и имеет межмолекулярную природу (как в веществах с молекулярными решетками). Вследствие чего уже небольшие механические усилия вызывают смещение сеток относительно друга. Это обусловливает действие графита, как смазки.
 Разновидности угля: А)кокс (используется в металлургии) Б)древесный уголь (используется для получения черного пороха, адсорбент) В)сажа ( используется в производстве резины, черных красок, туши, крема для обуви) Г)ископаемый уголь (каменный, бурый, антрацит)
Разновидности угля: А)кокс (используется в металлургии) Б)древесный уголь (используется для получения черного пороха, адсорбент) В)сажа ( используется в производстве резины, черных красок, туши, крема для обуви) Г)ископаемый уголь (каменный, бурый, антрацит)
 Химические свойства: 1)взаимодействие с металлами, образуя карбиды 2 4 Al + 3 C Al 4 C 3 - карбид алюминия Ca + C Ca. C 2 - карбид кальция 2) взаимодействие с неметаллами C + O 2 CO 2 2 C + H 2 CH 4 C + 2 S CS 2 - сероуглерод, яд 2 C + N 2 C 2 N 2 - дициан 2 C 2 N 2 + H 2 HNC - синильная кислота , её соли цианиды – сильнейшие яды
Химические свойства: 1)взаимодействие с металлами, образуя карбиды 2 4 Al + 3 C Al 4 C 3 - карбид алюминия Ca + C Ca. C 2 - карбид кальция 2) взаимодействие с неметаллами C + O 2 CO 2 2 C + H 2 CH 4 C + 2 S CS 2 - сероуглерод, яд 2 C + N 2 C 2 N 2 - дициан 2 C 2 N 2 + H 2 HNC - синильная кислота , её соли цианиды – сильнейшие яды
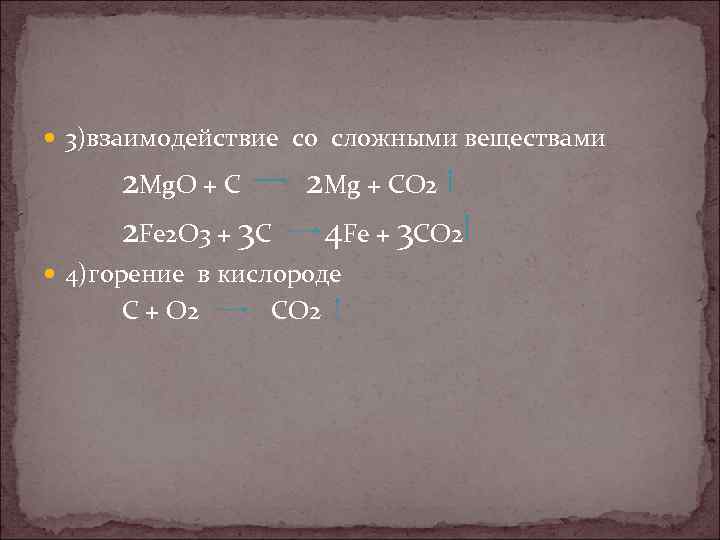 3)взаимодействие со сложными веществами 2 Mg. O + C 2 Mg + CO 2 2 Fe 2 O 3 + 3 C 4 Fe + 3 CO 2 4)горение в кислороде C + O 2 CO 2
3)взаимодействие со сложными веществами 2 Mg. O + C 2 Mg + CO 2 2 Fe 2 O 3 + 3 C 4 Fe + 3 CO 2 4)горение в кислороде C + O 2 CO 2
 Получение: Алмаз и графит добывают в природе. Алмаз можно получить из графита. Графит получают из угля и кокса.
Получение: Алмаз и графит добывают в природе. Алмаз можно получить из графита. Графит получают из угля и кокса.
 Применение: В промышленности углерод (графит) часто используется в качестве смазки. Кроме того на основе графита изготавливают так называемые композиционные материалы, в частности углепластики, в которых волокна графита находятся на матрице из эпоксидной смолы. Коррозионная стойкость графита используется в судостроении.
Применение: В промышленности углерод (графит) часто используется в качестве смазки. Кроме того на основе графита изготавливают так называемые композиционные материалы, в частности углепластики, в которых волокна графита находятся на матрице из эпоксидной смолы. Коррозионная стойкость графита используется в судостроении.
 Эти композиционные материалы широко применяются в авиационной и космической технике. Ведь помимо прочности они легкие. Достаточно сравнить плотность графита, р=2, 3 г/см 3 , с плотностью “легкого” алюминия, р=2, 7 г/см 3, и тем более железа, р=7, 9 г/см 3, чтобы убедиться в ценности этого свойства.
Эти композиционные материалы широко применяются в авиационной и космической технике. Ведь помимо прочности они легкие. Достаточно сравнить плотность графита, р=2, 3 г/см 3 , с плотностью “легкого” алюминия, р=2, 7 г/см 3, и тем более железа, р=7, 9 г/см 3, чтобы убедиться в ценности этого свойства.
 И, конечно, всем известно, что алмазы используются в ювелирной промышленности для изготовления всевозможных украшений, а так же широко применяются в различных отраслях промышленности, где используется их свойство высокой прочности.
И, конечно, всем известно, что алмазы используются в ювелирной промышленности для изготовления всевозможных украшений, а так же широко применяются в различных отраслях промышленности, где используется их свойство высокой прочности.
 Соединения углерода
Соединения углерода
 Оксид углерода является продуктом полного сгорания углерода и содержащих его веществ. В соединениях с кислородом углерод, в зависимости от условий, проявляет валентности +2 и +4. При температуре обычного пламени при горении углеродосодержащих веществ (дрова, уголь, природный газ метан, спирт и др. ) протекает реакция: С + О 2 = СО 2
Оксид углерода является продуктом полного сгорания углерода и содержащих его веществ. В соединениях с кислородом углерод, в зависимости от условий, проявляет валентности +2 и +4. При температуре обычного пламени при горении углеродосодержащих веществ (дрова, уголь, природный газ метан, спирт и др. ) протекает реакция: С + О 2 = СО 2
 Оксид углерода (II) СО – угарный газ, без цвета и запаха, не растворяется в воде, не сжижается, сильно ядовит, относится к несолеобразующим оксидам.
Оксид углерода (II) СО – угарный газ, без цвета и запаха, не растворяется в воде, не сжижается, сильно ядовит, относится к несолеобразующим оксидам.
 Угарный газ поступает в кровь человека в 200 раз быстрее кислорода. Окись углерода «перехватывает инициативу» у кислорода. Он в несколько раз легче и активнее вступает в связь с гемоглобином, переводя его в химический комплекс — карбоксигемоглобин. Гемоглобин в результате этого теряет способность переносить кислород в ткани, особенно в жизненно важные — мозг, легкие, сердце. От недостатка кислорода и наступает удушье.
Угарный газ поступает в кровь человека в 200 раз быстрее кислорода. Окись углерода «перехватывает инициативу» у кислорода. Он в несколько раз легче и активнее вступает в связь с гемоглобином, переводя его в химический комплекс — карбоксигемоглобин. Гемоглобин в результате этого теряет способность переносить кислород в ткани, особенно в жизненно важные — мозг, легкие, сердце. От недостатка кислорода и наступает удушье.
 Симптомы: При содержании 0, 08 % СО во вдыхаемом воздухе человек чувствует головную боль и удушье. При повышении концентрации СО до 0, 32 % возникает паралич и потеря сознания (смерть наступает через 30 минут). При концентрации выше 1, 2 % сознание теряется после 2 -3 вдохов, человек умирает менее чем через 3 минуты.
Симптомы: При содержании 0, 08 % СО во вдыхаемом воздухе человек чувствует головную боль и удушье. При повышении концентрации СО до 0, 32 % возникает паралич и потеря сознания (смерть наступает через 30 минут). При концентрации выше 1, 2 % сознание теряется после 2 -3 вдохов, человек умирает менее чем через 3 минуты.
 При лёгком отравлении: появляются головная боль, стук в висках, головокружение, боли в груди, сухой кашель, слезотечение, тошнота, рвота, возможны зрительные и слуховые галлюцинации, покраснение кожных покровов, карминнокрасная окраска слизистых оболочек, тахикардия, повышение артериального давления.
При лёгком отравлении: появляются головная боль, стук в висках, головокружение, боли в груди, сухой кашель, слезотечение, тошнота, рвота, возможны зрительные и слуховые галлюцинации, покраснение кожных покровов, карминнокрасная окраска слизистых оболочек, тахикардия, повышение артериального давления.
 При отравлении средней тяжести: сонливость, возможен двигательный паралич при сохраненном сознании При тяжёлом отравлении: потеря сознания, коматозное состояние судороги, непроизвольное отхождение мочи и кала, нарушение дыхания, которое становится непрерывным, иногда типа Чейна-Стокса, расширение зрачков с ослабленной реакцией на свет, резкий цианоз (посинение) слизистых оболочек и кожи лица. Смерть обычно наступает на месте происшествия в результате остановки дыхания и падения сердечной деятельности.
При отравлении средней тяжести: сонливость, возможен двигательный паралич при сохраненном сознании При тяжёлом отравлении: потеря сознания, коматозное состояние судороги, непроизвольное отхождение мочи и кала, нарушение дыхания, которое становится непрерывным, иногда типа Чейна-Стокса, расширение зрачков с ослабленной реакцией на свет, резкий цианоз (посинение) слизистых оболочек и кожи лица. Смерть обычно наступает на месте происшествия в результате остановки дыхания и падения сердечной деятельности.
 При выходе из коматозного состояния характерно появление резкого двигательного возбуждения. Возможно повторное развитие комы. Часто отмечаются тяжелые осложнения: нарушение мозгового кровообращения субарахноидальные кровоизлияния полиневриты явления отека мозга нарушение зрения нарушение слуха Возможно развитие инфаркта миокарда Часто наблюдаются кожно-трофические расстройства (пузыри, местные отеки с набуханием и последующим некрозом), миоглобинурийный нефроз. При длительной коме постоянно отмечается тяжелая пневмония.
При выходе из коматозного состояния характерно появление резкого двигательного возбуждения. Возможно повторное развитие комы. Часто отмечаются тяжелые осложнения: нарушение мозгового кровообращения субарахноидальные кровоизлияния полиневриты явления отека мозга нарушение зрения нарушение слуха Возможно развитие инфаркта миокарда Часто наблюдаются кожно-трофические расстройства (пузыри, местные отеки с набуханием и последующим некрозом), миоглобинурийный нефроз. При длительной коме постоянно отмечается тяжелая пневмония.
 Первая помощь Убрать пострадавшего из помещения с высоким содержанием угарного газа (заменить дыхательный аппарат). При слабом поверхностном дыхании или его остановке начать искусственное дыхание. Способствуют ликвидации последствий отравления: растирание тела, прикладывание грелки к ногам, кратковременное вдыхание нашатырного спирта (тампон со спиртом должен находиться не ближе, чем 1 см, тампоном нужно помахивать перед носом что очень важно т. к. прикосновении тампона к носу из-за мощного воздействия нашатырного спирта на дыхательный центр может наступить его паралич). Больные с тяжёлым отравлением подлежат госпитализации, так как возможны осложнения со стороны лёгких и нервной системы в более поздние сроки.
Первая помощь Убрать пострадавшего из помещения с высоким содержанием угарного газа (заменить дыхательный аппарат). При слабом поверхностном дыхании или его остановке начать искусственное дыхание. Способствуют ликвидации последствий отравления: растирание тела, прикладывание грелки к ногам, кратковременное вдыхание нашатырного спирта (тампон со спиртом должен находиться не ближе, чем 1 см, тампоном нужно помахивать перед носом что очень важно т. к. прикосновении тампона к носу из-за мощного воздействия нашатырного спирта на дыхательный центр может наступить его паралич). Больные с тяжёлым отравлением подлежат госпитализации, так как возможны осложнения со стороны лёгких и нервной системы в более поздние сроки.
 Химические свойства: 1)взаимодействие с кислородом 2 СО + О 2 2 СО 2 2)является хорошим восстановителем Fe 2 О 3 + 3 СО 2 Fe + 3 CO 2 3)на свету взаимодействие с хлором СО + Сl 2 COCl 2 – фосген очень сильный яд с характерным запахом, тяжелее воздуха в 4, 5 раза
Химические свойства: 1)взаимодействие с кислородом 2 СО + О 2 2 СО 2 2)является хорошим восстановителем Fe 2 О 3 + 3 СО 2 Fe + 3 CO 2 3)на свету взаимодействие с хлором СО + Сl 2 COCl 2 – фосген очень сильный яд с характерным запахом, тяжелее воздуха в 4, 5 раза
 Получение: В лаборатории: 1)разложение муравьиной кислоты t HCOOH CO + H 2 O 2)взаимодействие угарного газа с раскаленным углем t CO 2 + C 2 CO 3)взаимодействие угля с парами воды t C + H 2 O CO + H 2
Получение: В лаборатории: 1)разложение муравьиной кислоты t HCOOH CO + H 2 O 2)взаимодействие угарного газа с раскаленным углем t CO 2 + C 2 CO 3)взаимодействие угля с парами воды t C + H 2 O CO + H 2
 Долина смерти На западном склоне вулкана Кихпиныч, где начинаются истоки Гейзерной, расположены Кихпинычевские горячие источники фумарольного типа. Их небольшие термальные площадки прорезаны овражками, на склонах и на дне которых выбиваются слабые струйки кислой горячей воды, пара и газов. Самая нижняя из площадок приобрела зловещую репутацию и название «Долина Смерти» За 5 лет тут погибли 13 медведей, 9 лисиц, 3 росомахи, масса мышей и несколько десятков крупных и мелких птиц. Анализы выходящих из земли газов установили присутствие в них углекислого газа и сероводорода.
Долина смерти На западном склоне вулкана Кихпиныч, где начинаются истоки Гейзерной, расположены Кихпинычевские горячие источники фумарольного типа. Их небольшие термальные площадки прорезаны овражками, на склонах и на дне которых выбиваются слабые струйки кислой горячей воды, пара и газов. Самая нижняя из площадок приобрела зловещую репутацию и название «Долина Смерти» За 5 лет тут погибли 13 медведей, 9 лисиц, 3 росомахи, масса мышей и несколько десятков крупных и мелких птиц. Анализы выходящих из земли газов установили присутствие в них углекислого газа и сероводорода.
 Оксид углерода (IV) СО 2 - газ без цвета и запаха, растворяется в воде , легко сжижается, при t – 56 С затвердевает.
Оксид углерода (IV) СО 2 - газ без цвета и запаха, растворяется в воде , легко сжижается, при t – 56 С затвердевает.
 Химические свойства: 1)взаимодействие с водой H 2 O + CO 2 H 2 CO 3 – обратимая 2)взаимодействие с растворами щелочей CO 2 + 2 KOH K 2 CO 3 + H 2 O CO 2 + KOH KHCO 3
Химические свойства: 1)взаимодействие с водой H 2 O + CO 2 H 2 CO 3 – обратимая 2)взаимодействие с растворами щелочей CO 2 + 2 KOH K 2 CO 3 + H 2 O CO 2 + KOH KHCO 3
 3)взаимодействие с основным и амфотерным оксидами CO 2 + Ca. O Ca. CO 3 3 CO 2 + Al 2 O 3 Al 2 (CO 3)3 4)CO 2 + 2 Mg. O + C
3)взаимодействие с основным и амфотерным оксидами CO 2 + Ca. O Ca. CO 3 3 CO 2 + Al 2 O 3 Al 2 (CO 3)3 4)CO 2 + 2 Mg. O + C
 П олучение: В лабораториях: Ca. CO 3 + 2 HCl Ca. Cl 2 + H 2 O + CO 2
П олучение: В лабораториях: Ca. CO 3 + 2 HCl Ca. Cl 2 + H 2 O + CO 2
 Получение двуокиси углерода В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.
Получение двуокиси углерода В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве газ закачивается в баллоны.
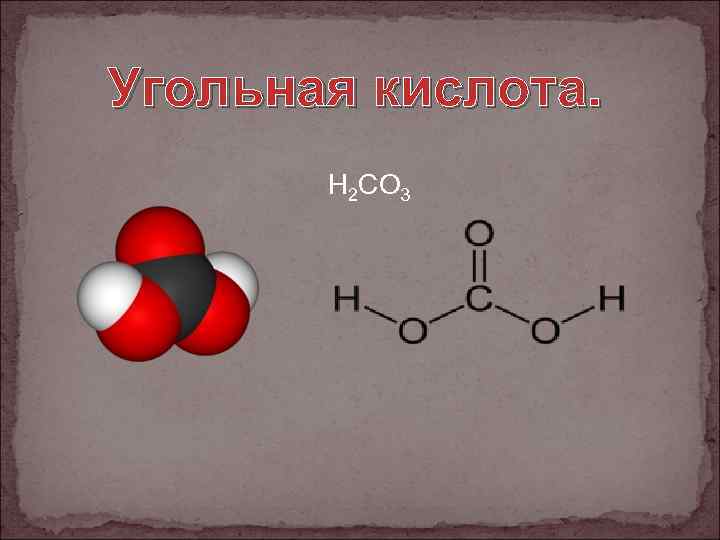 Угольная кислота. H 2 CO 3
Угольная кислота. H 2 CO 3
 Слабая двухосновная кислота, которая образуется при растворении оксида углерода СО 2 в воде. Угольная кислота дает два ряда солей: - водорастворимые гидрокарбонаты (Na. HCO 3 – питьевая сода, Na 2 CO 3 – сода, K 2 CO 3 – поташ), - нерастворимые (Mg. CO 3, Ca. CO 3). Реакции образования гидрокарбонатов и карбонатов: CO 2+Na. OH=Na. HCO 3 CO 2+2 Na. OH=Na 2 CO 3+H 2 O
Слабая двухосновная кислота, которая образуется при растворении оксида углерода СО 2 в воде. Угольная кислота дает два ряда солей: - водорастворимые гидрокарбонаты (Na. HCO 3 – питьевая сода, Na 2 CO 3 – сода, K 2 CO 3 – поташ), - нерастворимые (Mg. CO 3, Ca. CO 3). Реакции образования гидрокарбонатов и карбонатов: CO 2+Na. OH=Na. HCO 3 CO 2+2 Na. OH=Na 2 CO 3+H 2 O
 Соли угольной кислоты подвергаются гидролизу. Угольная кислота вытесняется из солей более сильными кислотами: Ca. CO 3+2 HCI=Ca. CI 2+CO 2+H 2 O
Соли угольной кислоты подвергаются гидролизу. Угольная кислота вытесняется из солей более сильными кислотами: Ca. CO 3+2 HCI=Ca. CI 2+CO 2+H 2 O
 Обменные реакции в водном растворе Сода питьевая превращается в "стиральную" - кальцинированную: 2 Na. HCO 3 Na 2 CO 3 + CO 2↑ + H 2 O Уксусная кислота вызывает разрушение карбоната натрия и выделение углекислого газа. Na 2 CO 3 + 2 CH 3 COOH 2 CH 3 COONa + CO 2↑ + H 2 O В воде карбонаты щелочных металлов подвергаются гидролизу – щелочная реакция Na 2 CO 3 + H 2 O Na. HCO 3 + Na. OH
Обменные реакции в водном растворе Сода питьевая превращается в "стиральную" - кальцинированную: 2 Na. HCO 3 Na 2 CO 3 + CO 2↑ + H 2 O Уксусная кислота вызывает разрушение карбоната натрия и выделение углекислого газа. Na 2 CO 3 + 2 CH 3 COOH 2 CH 3 COONa + CO 2↑ + H 2 O В воде карбонаты щелочных металлов подвергаются гидролизу – щелочная реакция Na 2 CO 3 + H 2 O Na. HCO 3 + Na. OH
 Получение угольной Углекислый газ CO кислоты растворяется в воде. При растворении 2 происходит его частичное взаимодействие с водой с образованием угольной кислоты. CO 2 + H 2 O ↔ H 2 CO 3 Чтобы заметить появление кислоты, добавим в стакан с водой лакмус. В нейтральной среде лакмус остается фиолетовым. Углекислый газ получаем действием соляной кислоты на мрамор карбонат кальция. Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2↑ + H 2 O Направим углекислый газ в стакан с раствором лакмуса. Фиолетовый лакмус становится красным – в стакане с водой появилась кислота.
Получение угольной Углекислый газ CO кислоты растворяется в воде. При растворении 2 происходит его частичное взаимодействие с водой с образованием угольной кислоты. CO 2 + H 2 O ↔ H 2 CO 3 Чтобы заметить появление кислоты, добавим в стакан с водой лакмус. В нейтральной среде лакмус остается фиолетовым. Углекислый газ получаем действием соляной кислоты на мрамор карбонат кальция. Ca. CO 3 + 2 HCl = Ca. Cl 2 + CO 2↑ + H 2 O Направим углекислый газ в стакан с раствором лакмуса. Фиолетовый лакмус становится красным – в стакане с водой появилась кислота.
 Применение Карбонаты кальция, магния, бария и др. применяют в строительном деле, в химической промышленности, оптике и др. В технике, промышленности и быту широко применяется сода (Na 2 CO 3 и Na. HCO 3). Кислые карбонаты выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови. Применяется при варке мыла, для производства стекла, в текстильной, нефтяной и лакокрасочной промышленности.
Применение Карбонаты кальция, магния, бария и др. применяют в строительном деле, в химической промышленности, оптике и др. В технике, промышленности и быту широко применяется сода (Na 2 CO 3 и Na. HCO 3). Кислые карбонаты выполняют важную физиологическую роль, являясь буферными веществами, регулирующими постоянство реакции крови. Применяется при варке мыла, для производства стекла, в текстильной, нефтяной и лакокрасочной промышленности.
