углерод.pptx
- Количество слайдов: 23
 Углерод и его соединения
Углерод и его соединения
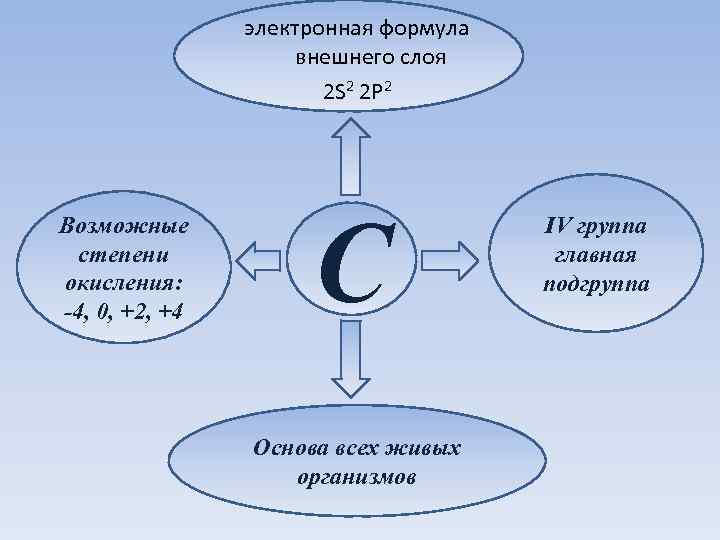 электронная формула внешнего слоя 2 S 2 2 P 2 Возможные степени окисления: -4, 0, +2, +4 C Основа всех живых организмов IV группа главная подгруппа
электронная формула внешнего слоя 2 S 2 2 P 2 Возможные степени окисления: -4, 0, +2, +4 C Основа всех живых организмов IV группа главная подгруппа
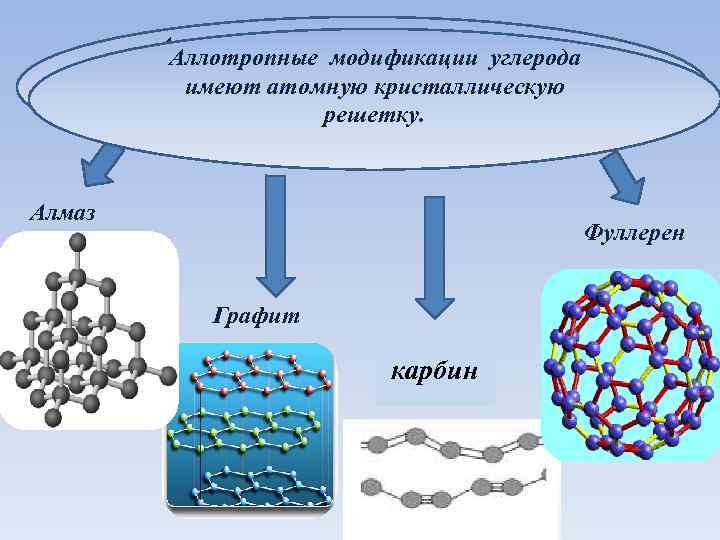 Аллотропные модификации углерода имеют атомную кристаллическую решетку. Алмаз Фуллерен Графит карбин
Аллотропные модификации углерода имеют атомную кристаллическую решетку. Алмаз Фуллерен Графит карбин
 Алмаз …это самое твердое вещество на Земле, тугоплавкое с высоким показателем преломления Применяется в: • Обрабатывающей промышленности • Электротехнике • Горной промышленности • Ювелирном производстве
Алмаз …это самое твердое вещество на Земле, тугоплавкое с высоким показателем преломления Применяется в: • Обрабатывающей промышленности • Электротехнике • Горной промышленности • Ювелирном производстве
 Графит …это мягкое серо-черное вещество, тугоплавкое , являющееся полупроводником со слоистой структурой. Применяется в: • Графитовых стержнях-электродах • Производстве теплозащитного материала для головных частей ракет (термостойкость) • Получении тиглей • Изготовлении минеральных красок • Карандашной промышленности
Графит …это мягкое серо-черное вещество, тугоплавкое , являющееся полупроводником со слоистой структурой. Применяется в: • Графитовых стержнях-электродах • Производстве теплозащитного материала для головных частей ракет (термостойкость) • Получении тиглей • Изготовлении минеральных красок • Карандашной промышленности
 Карбин • Карбин — аллотропная форма углерода, состоит из углеродных фрагментов с тройной –С≡С–, или двойной кумулированной =С=С= связью. Может быть линейным или образовывать циклические структуры. • Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1, 9÷ 2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно другу. Карбин — линейный полимер углерода
Карбин • Карбин — аллотропная форма углерода, состоит из углеродных фрагментов с тройной –С≡С–, или двойной кумулированной =С=С= связью. Может быть линейным или образовывать циклические структуры. • Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1, 9÷ 2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно другу. Карбин — линейный полимер углерода
 Фуллерен … это новая аллотропная форма углерода , молекула которого состоит из 60 -70 атомов , образующих сферу. Фуллерены планируют использовать: 1. Для создания фотоприемников 2. Для создания сверхпроводящих материалов 3. В качестве красителей для копировальных машин 4. В качестве основы для аккумуляторных батарей 5. Для создания оптоэлектронных устройств 6. В медицине и фармакологии
Фуллерен … это новая аллотропная форма углерода , молекула которого состоит из 60 -70 атомов , образующих сферу. Фуллерены планируют использовать: 1. Для создания фотоприемников 2. Для создания сверхпроводящих материалов 3. В качестве красителей для копировальных машин 4. В качестве основы для аккумуляторных батарей 5. Для создания оптоэлектронных устройств 6. В медицине и фармакологии
 Стеклоуглерод — твёрдый материал, сочетающий свойства графита (хорошая электропроводность) и стекла (высокая твёрдость). • Стеклоуглерод состоит из чистого углерода с небольшой примесью высокомолекулярных углеводородов. Его структура сложна и сходна с фуллеренами. Благодаря этому он химически нейтрален и устойчив к коррозии при воздействии кислот, щелочей и растворителей. • В нейтральном газе или в вакууме стеклоуглерод не разрушается и не плавится при нагревании до 3000 °C.
Стеклоуглерод — твёрдый материал, сочетающий свойства графита (хорошая электропроводность) и стекла (высокая твёрдость). • Стеклоуглерод состоит из чистого углерода с небольшой примесью высокомолекулярных углеводородов. Его структура сложна и сходна с фуллеренами. Благодаря этому он химически нейтрален и устойчив к коррозии при воздействии кислот, щелочей и растворителей. • В нейтральном газе или в вакууме стеклоуглерод не разрушается и не плавится при нагревании до 3000 °C.
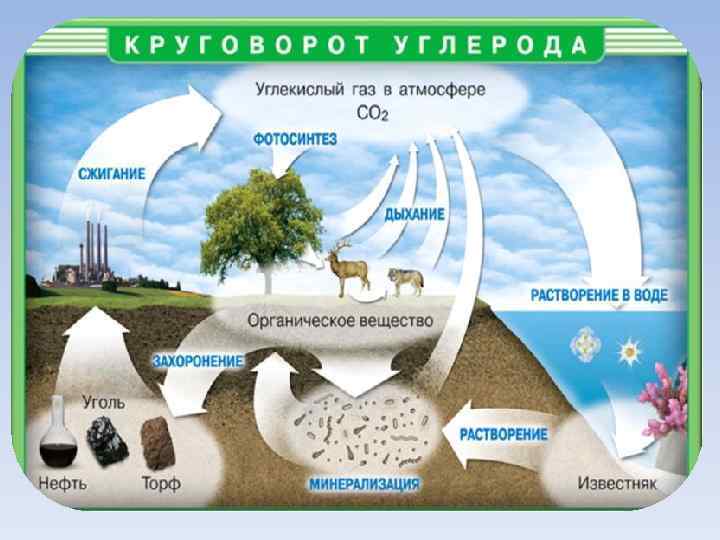
 Нахождение в природе Содержание углерода в земной коре 0, 1 % по массе В самородном виде: алмаз и графит В виде солей: Мел, известняк, мрамор Ca. CO 3 Магнезит Mg. CO 3 Сидерит Fe. CO 3
Нахождение в природе Содержание углерода в земной коре 0, 1 % по массе В самородном виде: алмаз и графит В виде солей: Мел, известняк, мрамор Ca. CO 3 Магнезит Mg. CO 3 Сидерит Fe. CO 3
 Углерод в живых организмах В составе растений и животных (~18 %). В организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Углерод в живых организмах В составе растений и животных (~18 %). В организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
 Химические свойства углерода С простыми веществами: 1. С неметаллами: Si + C 0 =Si. C-4 C 0+O 2=C+4 O 2 2. С металлами: 4 AL + 3 C 0 = AL 4 C 3 -4 Со сложными веществами: 1. Восстанавливает металлы из их оксидов Ca. O+ 3 C 0=Ca. C 2+C+2 O 2. Реагирует с концентрированными кислотами С 0+2 H 2 SO 4=2 SO 2+C+4 O 2+2 H 2 O В реакциях углерод проявляет, и окислительные, и восстановительные свойства
Химические свойства углерода С простыми веществами: 1. С неметаллами: Si + C 0 =Si. C-4 C 0+O 2=C+4 O 2 2. С металлами: 4 AL + 3 C 0 = AL 4 C 3 -4 Со сложными веществами: 1. Восстанавливает металлы из их оксидов Ca. O+ 3 C 0=Ca. C 2+C+2 O 2. Реагирует с концентрированными кислотами С 0+2 H 2 SO 4=2 SO 2+C+4 O 2+2 H 2 O В реакциях углерод проявляет, и окислительные, и восстановительные свойства
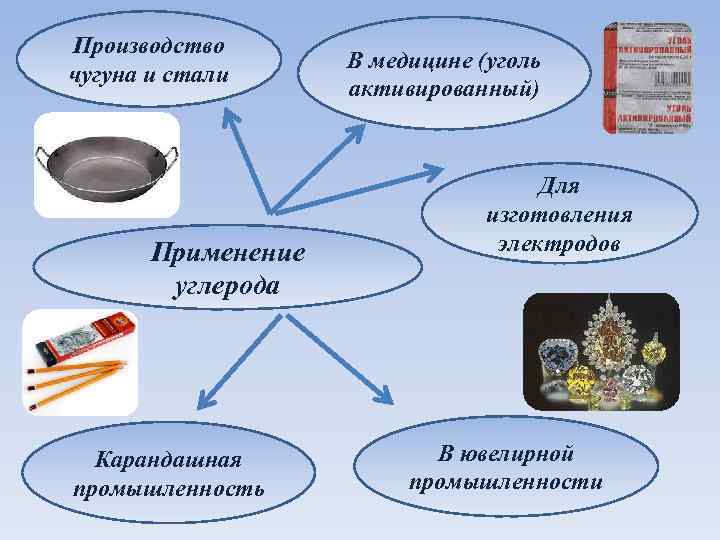 Производство чугуна и стали Применение углерода Карандашная промышленность В медицине (уголь активированный) Для изготовления электродов В ювелирной промышленности
Производство чугуна и стали Применение углерода Карандашная промышленность В медицине (уголь активированный) Для изготовления электродов В ювелирной промышленности
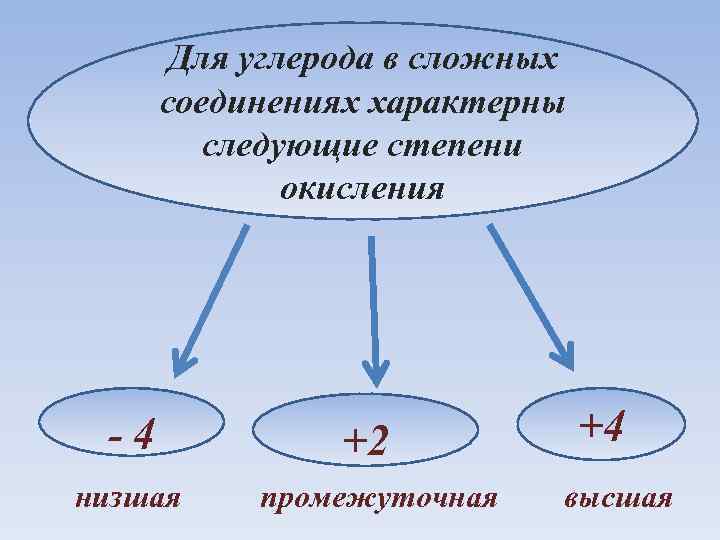 Для углерода в сложных соединениях характерны следующие степени окисления - 4 низшая +2 промежуточная +4 высшая
Для углерода в сложных соединениях характерны следующие степени окисления - 4 низшая +2 промежуточная +4 высшая
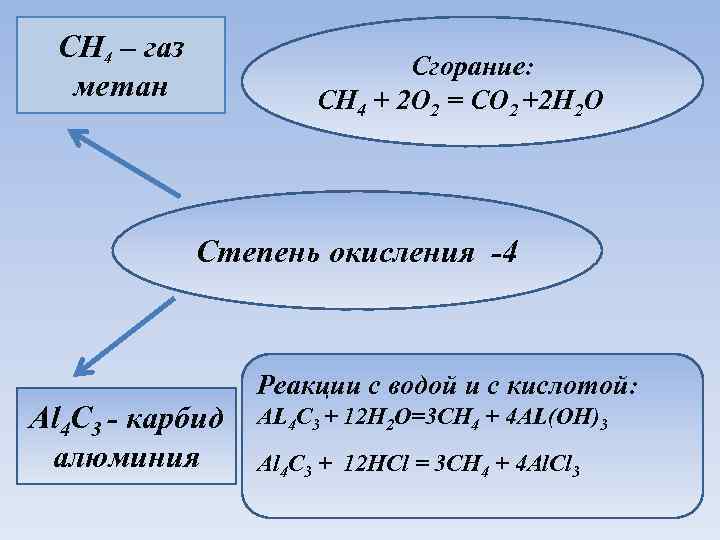 CH 4 – газ метан Сгорание: CH 4 + 2 O 2 = CO 2 +2 H 2 O Степень окисления -4 Al 4 C 3 - карбид алюминия Реакции с водой и с кислотой: AL 4 C 3 + 12 H 2 O=3 CH 4 + 4 AL(OH)3 Al 4 C 3 + 12 HCl = 3 CH 4 + 4 Al. Cl 3
CH 4 – газ метан Сгорание: CH 4 + 2 O 2 = CO 2 +2 H 2 O Степень окисления -4 Al 4 C 3 - карбид алюминия Реакции с водой и с кислотой: AL 4 C 3 + 12 H 2 O=3 CH 4 + 4 AL(OH)3 Al 4 C 3 + 12 HCl = 3 CH 4 + 4 Al. Cl 3
 Степень окисления +2 CO - угарный газ сильный яд, опасный для жизни и здоровья человека (несолеобразующий оксид)
Степень окисления +2 CO - угарный газ сильный яд, опасный для жизни и здоровья человека (несолеобразующий оксид)
 Степень окисления +4 CO 2 углекислый газ H 2 CO 3 угольная кислота Соли угольной кислоты (например, K 2 CO 3 карбонат калия)
Степень окисления +4 CO 2 углекислый газ H 2 CO 3 угольная кислота Соли угольной кислоты (например, K 2 CO 3 карбонат калия)
 Химические свойства CO 1. Реагирует с кислородом 2 CO + O 2 =CO 2 2. Является восстановителем металлов из их оксидов Zn. O + CO = Zn + CO 2
Химические свойства CO 1. Реагирует с кислородом 2 CO + O 2 =CO 2 2. Является восстановителем металлов из их оксидов Zn. O + CO = Zn + CO 2
 Химические свойства CO 2 - (кислотный оксид) 1. Реагирует с водой CO 2 + H 2 O = H 2 CO 3 2. Реагирует с основными оксидами CO 2 + Ca. O = Ca. CO 3 3. Реагирует с щелочами CO 2 + 2 KOH = K 2 CO 3 + H 2 O 4. Реагирует с углеродом CO 2 + C = 2 CO
Химические свойства CO 2 - (кислотный оксид) 1. Реагирует с водой CO 2 + H 2 O = H 2 CO 3 2. Реагирует с основными оксидами CO 2 + Ca. O = Ca. CO 3 3. Реагирует с щелочами CO 2 + 2 KOH = K 2 CO 3 + H 2 O 4. Реагирует с углеродом CO 2 + C = 2 CO
 Химические свойства карбонатов (солей угольной кислоты) 1. Качественной реакцией на карбонаты является реакция с кислотами Ca. CO 3 + 2 HCL = Ca. CL 2 + H 2 O + CO 2 2. Нерастворимые в воде карбонаты термически неустойчивы Ca. CO 3 = Ca. O + CO 2 3. Карбонаты реагируют с солями Na 2 CO 3 + Ba. CL 2 = 2 Na. CL + Ba. CO 3
Химические свойства карбонатов (солей угольной кислоты) 1. Качественной реакцией на карбонаты является реакция с кислотами Ca. CO 3 + 2 HCL = Ca. CL 2 + H 2 O + CO 2 2. Нерастворимые в воде карбонаты термически неустойчивы Ca. CO 3 = Ca. O + CO 2 3. Карбонаты реагируют с солями Na 2 CO 3 + Ba. CL 2 = 2 Na. CL + Ba. CO 3
 Углекислотный огнетушитель Соединения углерода вокруг нас Сухой лед (хладагент) Лимонады Моющие средства Сода
Углекислотный огнетушитель Соединения углерода вокруг нас Сухой лед (хладагент) Лимонады Моющие средства Сода
 . Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns 2 np 2 б) ns 2 np 3 в) ns 2 np 4 г) ns 1 np 2 1 2. Наиболее характерная валентность элементов подгруппы углерода: а) II б) III в) IV г) V 3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз: а) уменьшаются б) уменьшаются, затем возрастают в) возрастают г) не изменяются
. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns 2 np 2 б) ns 2 np 3 в) ns 2 np 4 г) ns 1 np 2 1 2. Наиболее характерная валентность элементов подгруппы углерода: а) II б) III в) IV г) V 3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз: а) уменьшаются б) уменьшаются, затем возрастают в) возрастают г) не изменяются
 4. Углерод является: а) восстановителем б) восстановителем и окислителем в) окислителем г) не проявляет окислительно-восстановительных свойств 5. Атомную слоистую кристаллическую решетку имеет: а) алмаз б) фуллерен в) графит г) карбин 6. Наибольшей прочностью отличается кристаллическая решетка: а) атомная б) ионная в) атомная слоистая г) молекулярная 7. Наиболее химически активна аллотропная модификация углерода: а) алмаз б) фуллерен в) графит г) карбин
4. Углерод является: а) восстановителем б) восстановителем и окислителем в) окислителем г) не проявляет окислительно-восстановительных свойств 5. Атомную слоистую кристаллическую решетку имеет: а) алмаз б) фуллерен в) графит г) карбин 6. Наибольшей прочностью отличается кристаллическая решетка: а) атомная б) ионная в) атомная слоистая г) молекулярная 7. Наиболее химически активна аллотропная модификация углерода: а) алмаз б) фуллерен в) графит г) карбин
