3 стр фолдинг денатурация.ppt
- Количество слайдов: 51
 ТРЕТИЧНАЯ СТРУКТУРА – УКЛАДКА ВТОРИЧНЫХ СТРУКТУР ОДНОЙ ПОЛИПЕПТИДНОЙ ЦЕПИ В ГЛОБУЛУ (ПОЛНАЯ ПРОСТРАНСТВЕННАЯ СТРУКТУРА ПОЛИПЕПТИДНОЙ ЦЕПИ) ТРЕТИЧНАЯ СТРУКТУРА СТАБИЛИЗИРУЕТСЯ НЕКОВАЛЕНТНЫМИ СВЯЗЯМИ
ТРЕТИЧНАЯ СТРУКТУРА – УКЛАДКА ВТОРИЧНЫХ СТРУКТУР ОДНОЙ ПОЛИПЕПТИДНОЙ ЦЕПИ В ГЛОБУЛУ (ПОЛНАЯ ПРОСТРАНСТВЕННАЯ СТРУКТУРА ПОЛИПЕПТИДНОЙ ЦЕПИ) ТРЕТИЧНАЯ СТРУКТУРА СТАБИЛИЗИРУЕТСЯ НЕКОВАЛЕНТНЫМИ СВЯЗЯМИ
 Max Perutz и John Kendrew – рентгеноструктурный анализ миоглобина и гемоглобина (1958 - 1959)
Max Perutz и John Kendrew – рентгеноструктурный анализ миоглобина и гемоглобина (1958 - 1959)
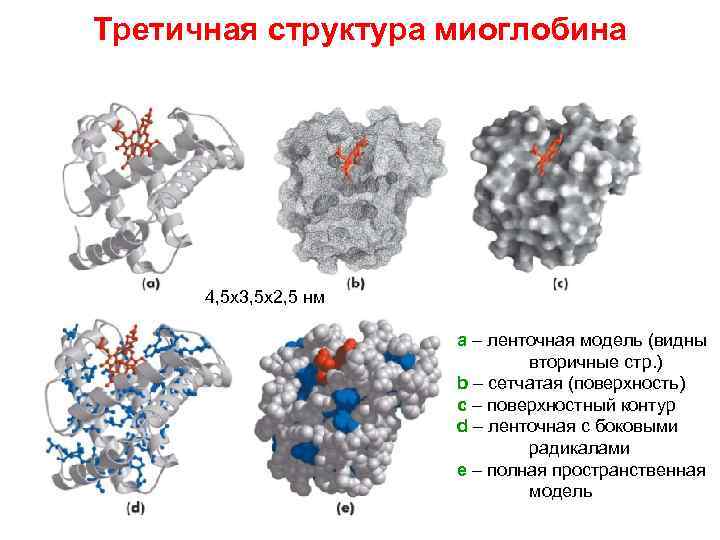 Третичная структура миоглобина 4, 5 x 3, 5 x 2, 5 нм a – ленточная модель (видны вторичные стр. ) b – сетчатая (поверхность) c – поверхностный контур d – ленточная с боковыми радикалами e – полная пространственная модель
Третичная структура миоглобина 4, 5 x 3, 5 x 2, 5 нм a – ленточная модель (видны вторичные стр. ) b – сетчатая (поверхность) c – поверхностный контур d – ленточная с боковыми радикалами e – полная пространственная модель
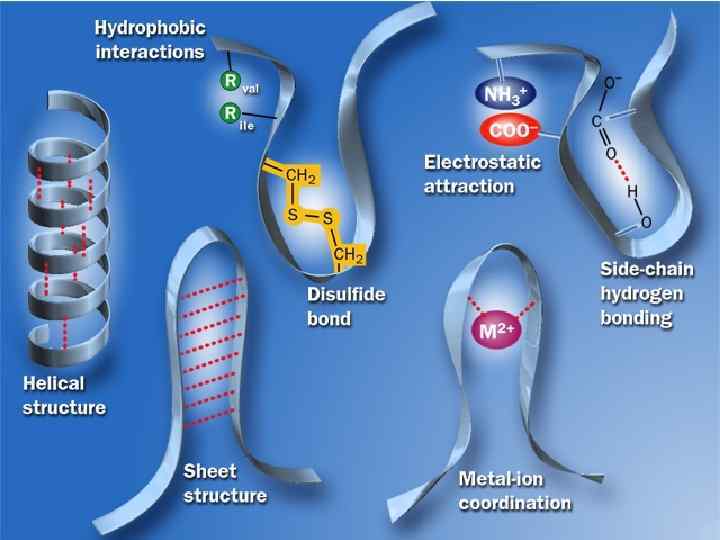
 Типы взаимодействий, стабилизирующие третичную структуру • Гидрофобные взаимодействия между неполярными радикалами • Водородные связи между полярными радикалами • Электростатические взаимодействия между противоположно заряженными радикалами
Типы взаимодействий, стабилизирующие третичную структуру • Гидрофобные взаимодействия между неполярными радикалами • Водородные связи между полярными радикалами • Электростатические взаимодействия между противоположно заряженными радикалами
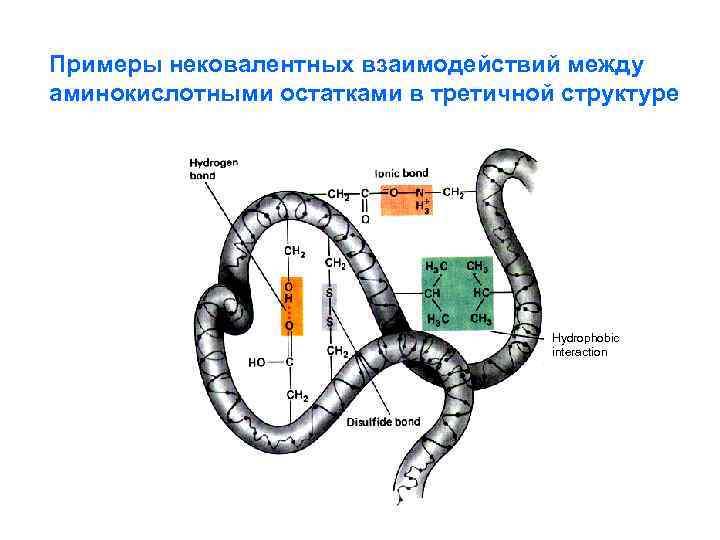 Примеры нековалентных взаимодействий между аминокислотными остатками в третичной структуре Hydrophobic interaction
Примеры нековалентных взаимодействий между аминокислотными остатками в третичной структуре Hydrophobic interaction
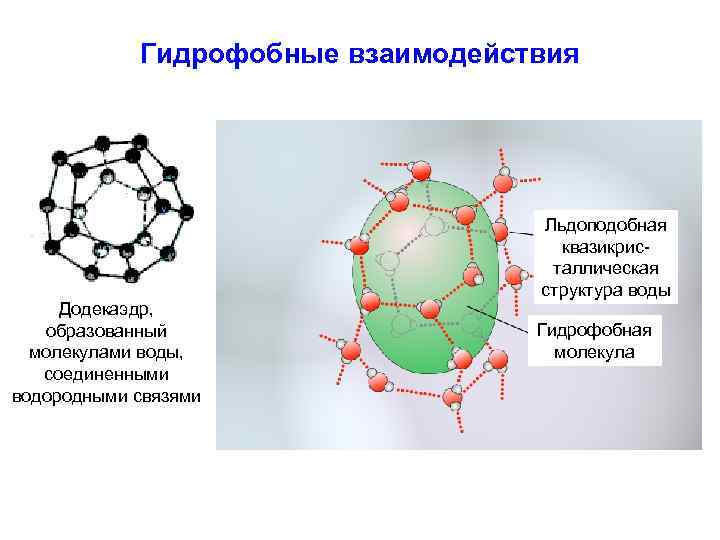 Гидрофобные взаимодействия Додекаэдр, образованный молекулами воды, соединенными водородными связями Льдоподобная квазикристаллическая структура воды Гидрофобная молекула
Гидрофобные взаимодействия Додекаэдр, образованный молекулами воды, соединенными водородными связями Льдоподобная квазикристаллическая структура воды Гидрофобная молекула
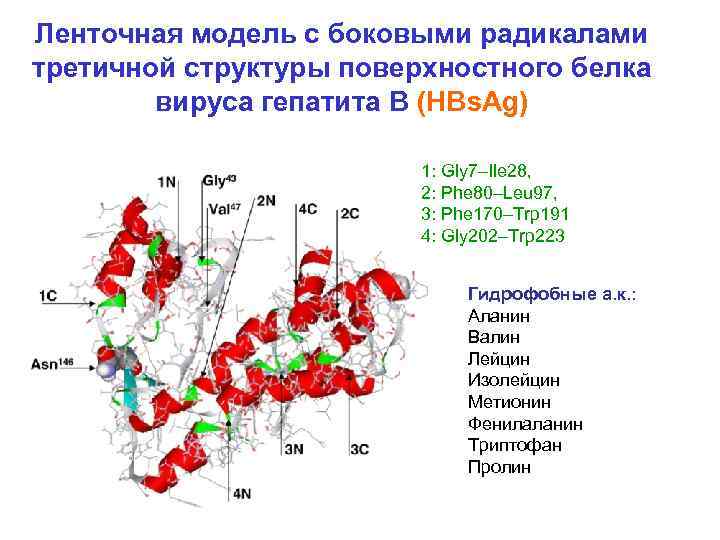 Ленточная модель с боковыми радикалами третичной структуры поверхностного белка вируса гепатита В (HBs. Ag) 1: Gly 7–Ile 28, 2: Phe 80–Leu 97, 3: Phe 170–Trp 191 4: Gly 202–Trp 223 Гидрофобные а. к. : Аланин Валин Лейцин Изолейцин Метионин Фенилаланин Триптофан Пролин
Ленточная модель с боковыми радикалами третичной структуры поверхностного белка вируса гепатита В (HBs. Ag) 1: Gly 7–Ile 28, 2: Phe 80–Leu 97, 3: Phe 170–Trp 191 4: Gly 202–Trp 223 Гидрофобные а. к. : Аланин Валин Лейцин Изолейцин Метионин Фенилаланин Триптофан Пролин
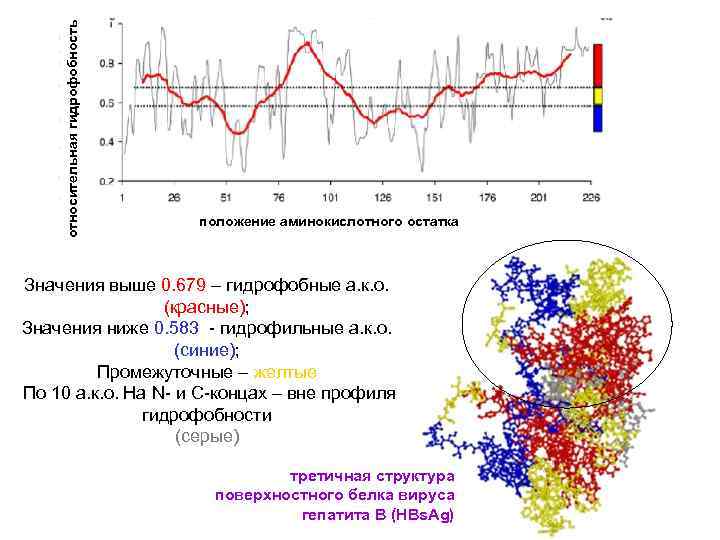 относительная гидрофобность положение аминокислотного остатка Значения выше 0. 679 – гидрофобные а. к. о. (красные); Значения ниже 0. 583 - гидрофильные а. к. о. (синие); Промежуточные – желтые По 10 а. к. о. На N- и C-концах – вне профиля гидрофобности (серые) третичная структура поверхностного белка вируса гепатита В (HBs. Ag)
относительная гидрофобность положение аминокислотного остатка Значения выше 0. 679 – гидрофобные а. к. о. (красные); Значения ниже 0. 583 - гидрофильные а. к. о. (синие); Промежуточные – желтые По 10 а. к. о. На N- и C-концах – вне профиля гидрофобности (серые) третичная структура поверхностного белка вируса гепатита В (HBs. Ag)
 Гидрофобный кор лизоцима Гидрофильные а. к. о. Гидрофобные а. к. о.
Гидрофобный кор лизоцима Гидрофильные а. к. о. Гидрофобные а. к. о.
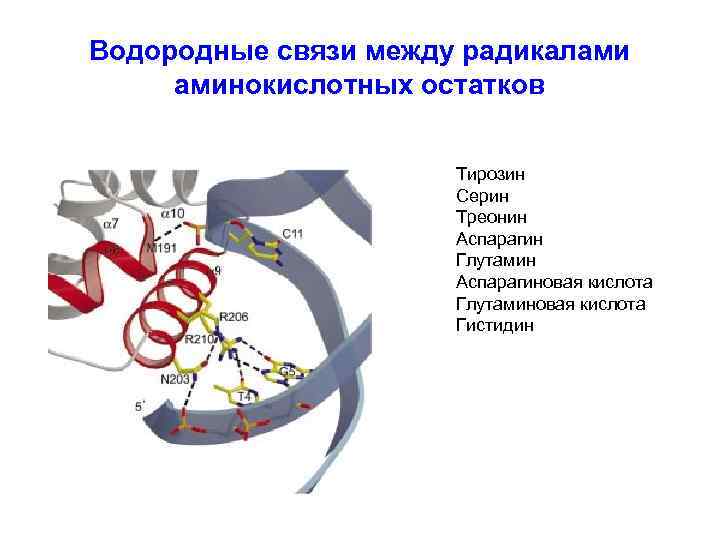 Водородные связи между радикалами аминокислотных остатков Тирозин Серин Треонин Аспарагин Глутамин Аспарагиновая кислота Глутаминовая кислота Гистидин
Водородные связи между радикалами аминокислотных остатков Тирозин Серин Треонин Аспарагин Глутамин Аспарагиновая кислота Глутаминовая кислота Гистидин
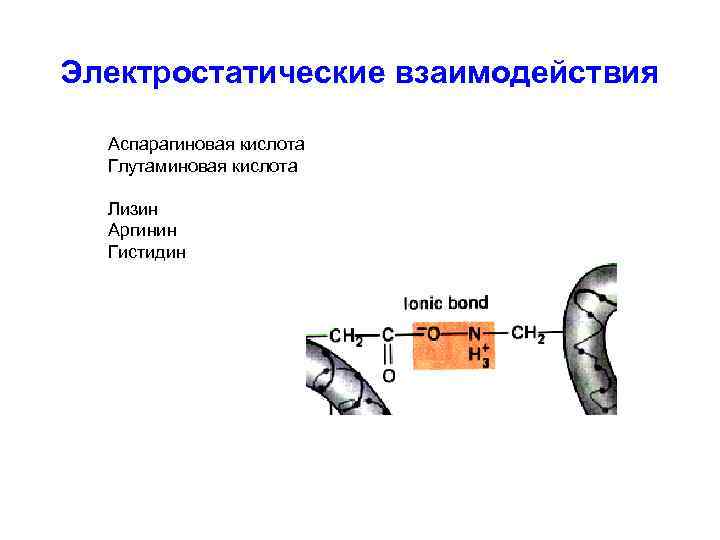 Электростатические взаимодействия Аспарагиновая кислота Глутаминовая кислота Лизин Аргинин Гистидин
Электростатические взаимодействия Аспарагиновая кислота Глутаминовая кислота Лизин Аргинин Гистидин
 ЧЕТВЕРТИЧНАЯ СТРУКТУРА – ЭТО АГРЕГАЦИЯ НЕСКОЛЬКИХ БЕЛКОВЫХ ЦЕПЕЙ С ОБРАЗОВАНИЕМ ЕДИНОЙ МОЛЕКУЛЫ ( «СУПЕРГЛОБУЛЫ» ) Гидрофобные Водородные между радикалами а. к. о. Электростатические Координационные связи с металлами
ЧЕТВЕРТИЧНАЯ СТРУКТУРА – ЭТО АГРЕГАЦИЯ НЕСКОЛЬКИХ БЕЛКОВЫХ ЦЕПЕЙ С ОБРАЗОВАНИЕМ ЕДИНОЙ МОЛЕКУЛЫ ( «СУПЕРГЛОБУЛЫ» ) Гидрофобные Водородные между радикалами а. к. о. Электростатические Координационные связи с металлами
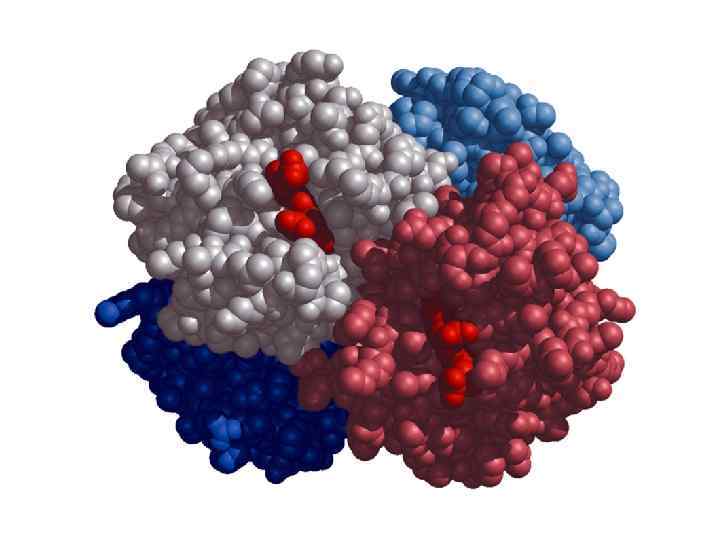
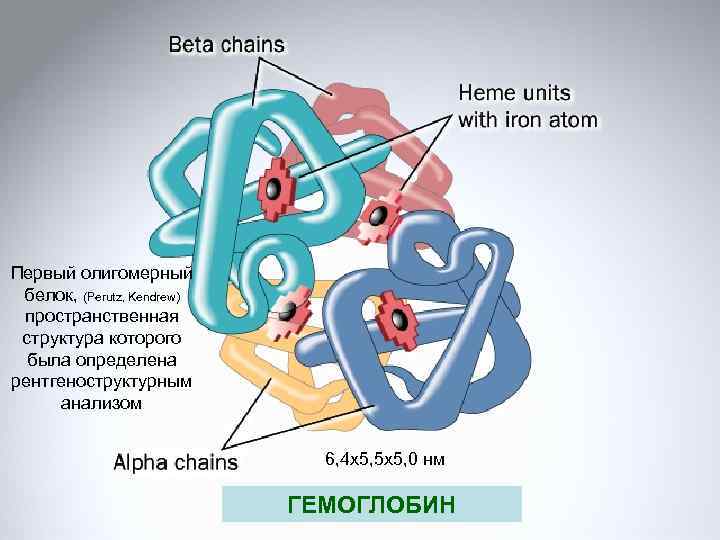 Первый олигомерный белок, (Perutz, Kendrew) пространственная структура которого была определена рентгеноструктурным анализом 6, 4 x 5, 5 x 5, 0 нм ГЕМОГЛОБИН
Первый олигомерный белок, (Perutz, Kendrew) пространственная структура которого была определена рентгеноструктурным анализом 6, 4 x 5, 5 x 5, 0 нм ГЕМОГЛОБИН
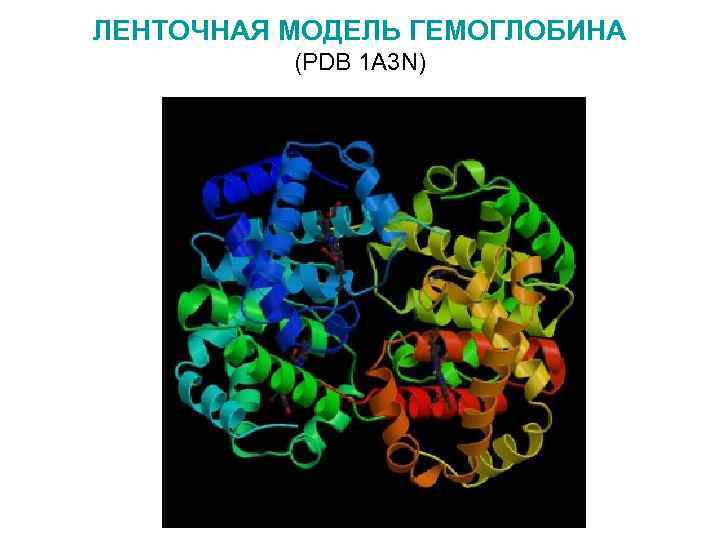 ЛЕНТОЧНАЯ МОДЕЛЬ ГЕМОГЛОБИНА (PDB 1 A 3 N)
ЛЕНТОЧНАЯ МОДЕЛЬ ГЕМОГЛОБИНА (PDB 1 A 3 N)
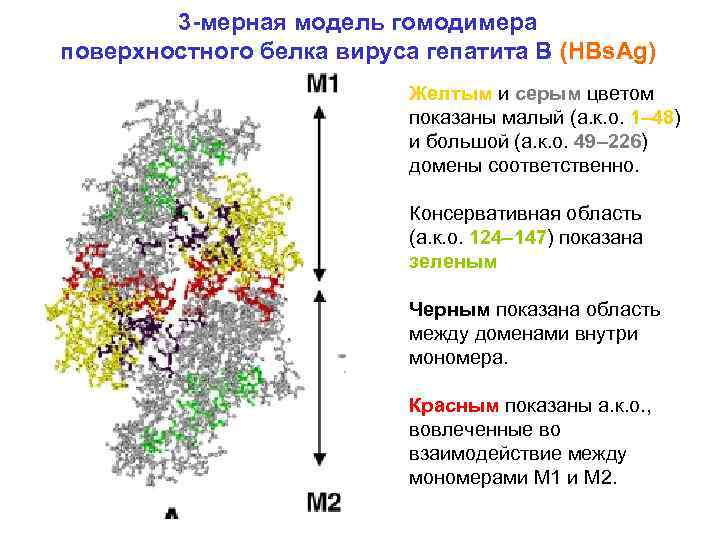 3 -мерная модель гомодимера поверхностного белка вируса гепатита В (HBs. Ag) Желтым и серым цветом показаны малый (а. к. о. 1– 48) и большой (а. к. о. 49– 226) домены соответственно. Консервативная область (а. к. о. 124– 147) показана зеленым Черным показана область между доменами внутри мономера. Красным показаны а. к. о. , вовлеченные во взаимодействие между мономерами M 1 и M 2.
3 -мерная модель гомодимера поверхностного белка вируса гепатита В (HBs. Ag) Желтым и серым цветом показаны малый (а. к. о. 1– 48) и большой (а. к. о. 49– 226) домены соответственно. Консервативная область (а. к. о. 124– 147) показана зеленым Черным показана область между доменами внутри мономера. Красным показаны а. к. о. , вовлеченные во взаимодействие между мономерами M 1 и M 2.
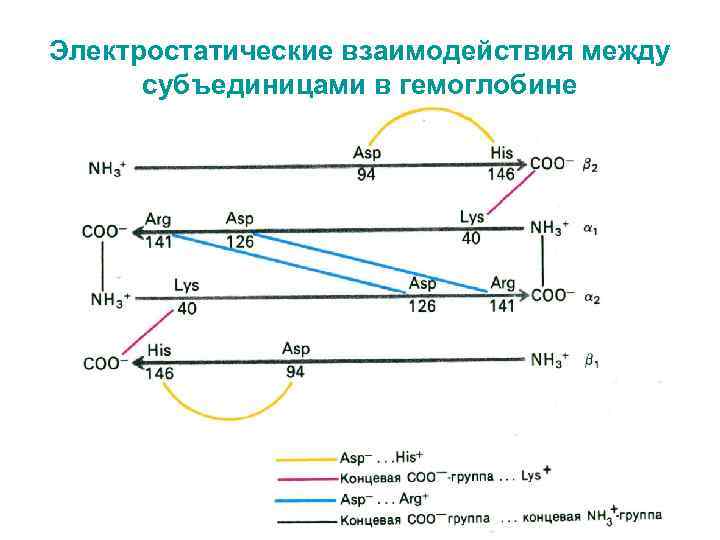 Электростатические взаимодействия между субъединицами в гемоглобине
Электростатические взаимодействия между субъединицами в гемоглобине
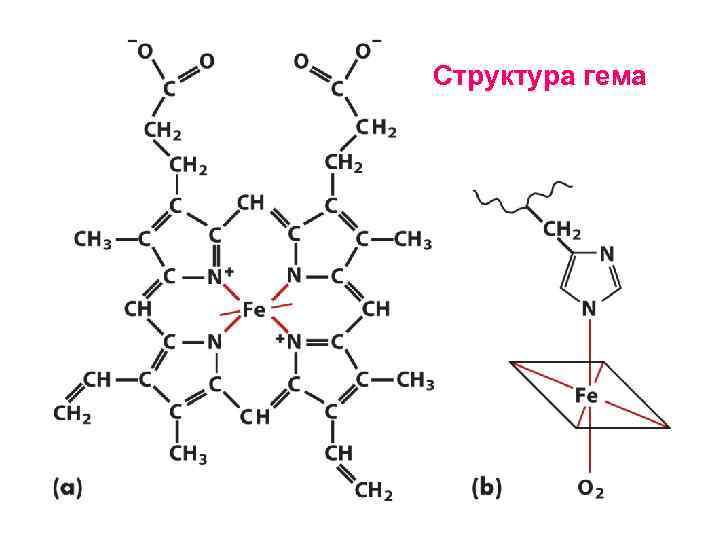 Структура гема
Структура гема
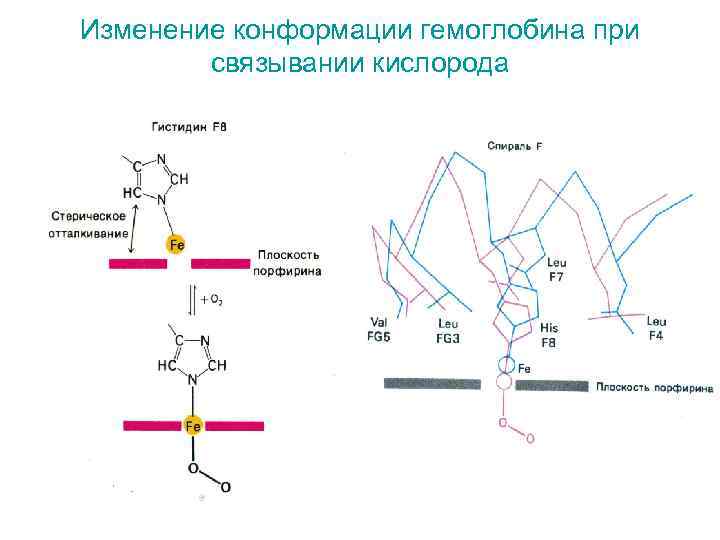 Изменение конформации гемоглобина при связывании кислорода
Изменение конформации гемоглобина при связывании кислорода
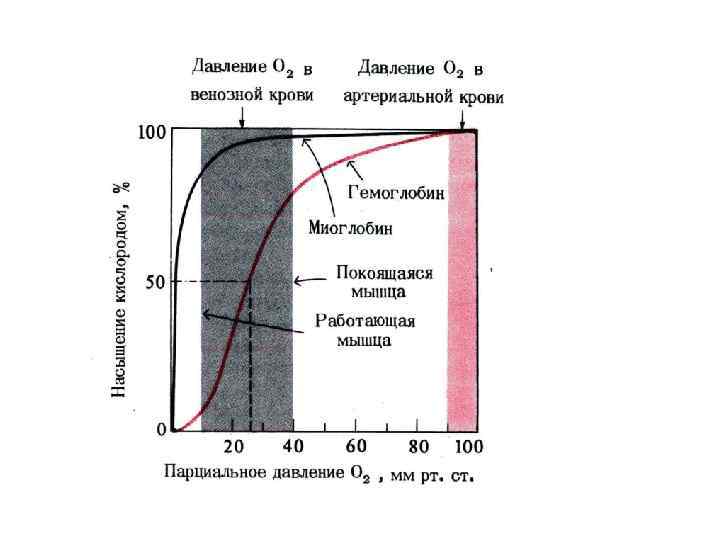
 Некоторые примеры свойств мультимерных белков Кооперативность (связывание кислорода гемоглобином) Комбинаторика (множественность иммуноглобулинов) Структурная сборка (полимерный актин – компонент цитоскелета и мышц) Регуляция (регуляторные и каталитические субъединицы протеинкиназы С)
Некоторые примеры свойств мультимерных белков Кооперативность (связывание кислорода гемоглобином) Комбинаторика (множественность иммуноглобулинов) Структурная сборка (полимерный актин – компонент цитоскелета и мышц) Регуляция (регуляторные и каталитические субъединицы протеинкиназы С)
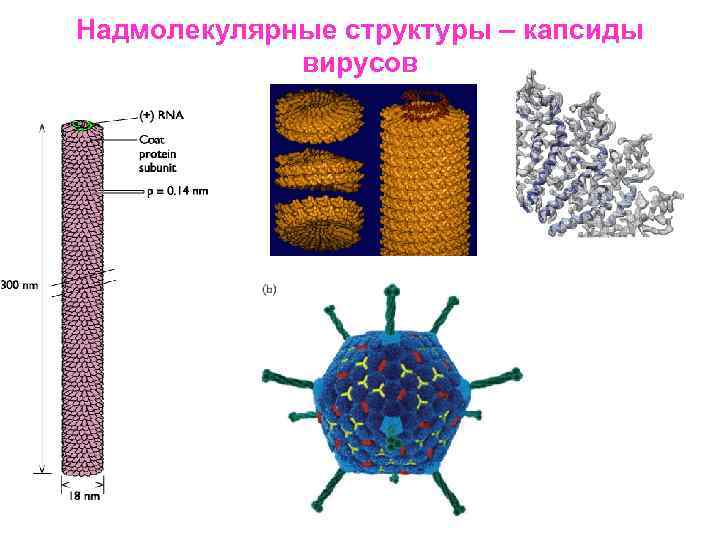 Надмолекулярные структуры – капсиды вирусов
Надмолекулярные структуры – капсиды вирусов
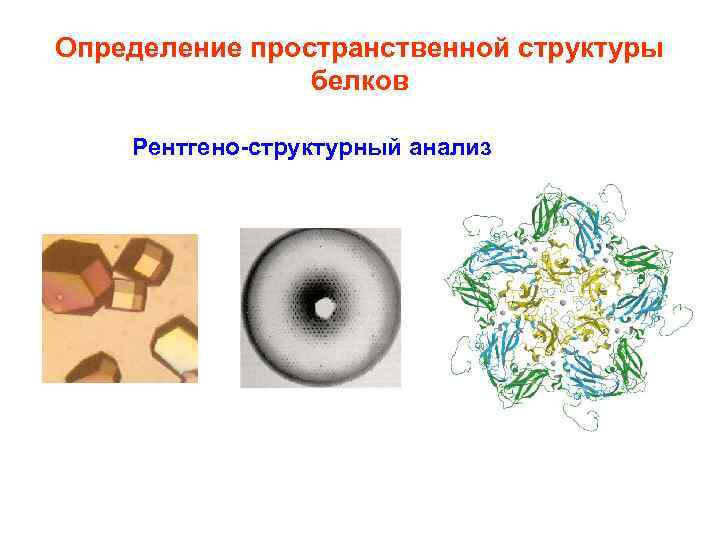 Определение пространственной структуры белков Рентгено-структурный анализ
Определение пространственной структуры белков Рентгено-структурный анализ
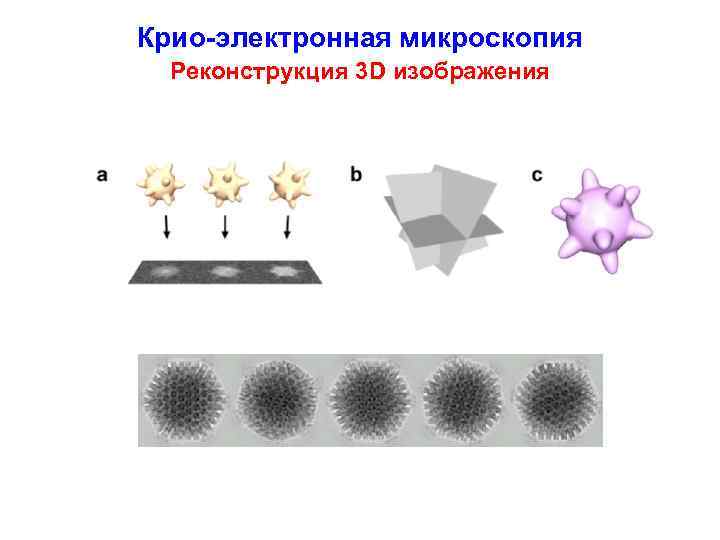 Крио-электронная микроскопия Реконструкция 3 D изображения
Крио-электронная микроскопия Реконструкция 3 D изображения
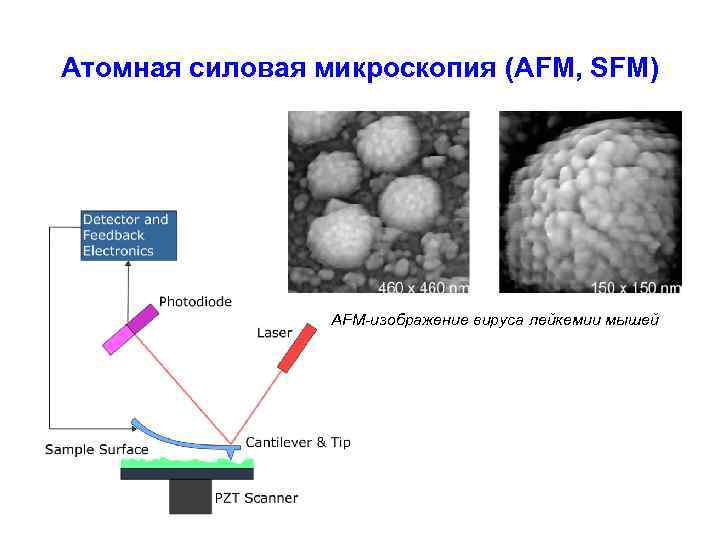 Атомная силовая микроскопия (AFM, SFM) AFM-изображение вируса лейкемии мышей
Атомная силовая микроскопия (AFM, SFM) AFM-изображение вируса лейкемии мышей
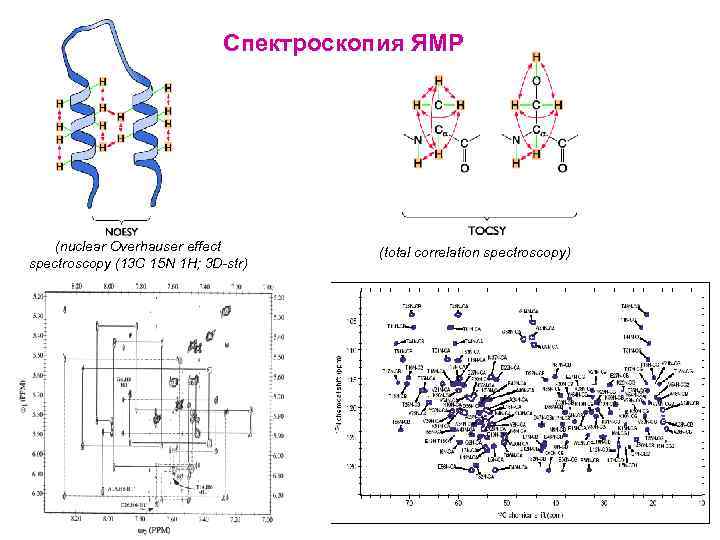 Спектроскопия ЯМР (nuclear Overhauser effect spectroscopy (13 C 15 N 1 H; 3 D-str) (total correlation spectroscopy)
Спектроскопия ЯМР (nuclear Overhauser effect spectroscopy (13 C 15 N 1 H; 3 D-str) (total correlation spectroscopy)
 ДЕНАТУРАЦИЯ И ФОЛДИНГ БЕЛКОВ
ДЕНАТУРАЦИЯ И ФОЛДИНГ БЕЛКОВ
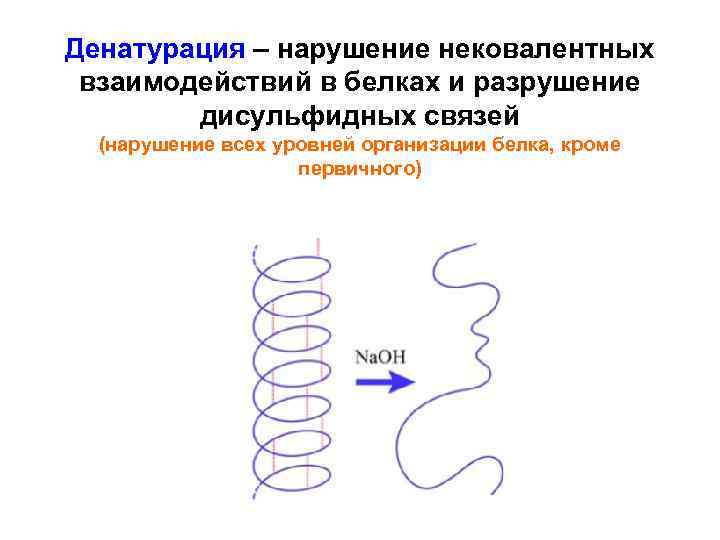 Денатурация – нарушение нековалентных взаимодействий в белках и разрушение дисульфидных связей (нарушение всех уровней организации белка, кроме первичного)
Денатурация – нарушение нековалентных взаимодействий в белках и разрушение дисульфидных связей (нарушение всех уровней организации белка, кроме первичного)
 ФАКТОРЫ ДЕНАТУРАЦИИ • • • Высокая температура Высокие концентрации солей Ионные и неионные детергенты (мочевина и др. ) Концентрированные щелочи Органические кислоты • • Денатурация • обратимая необратимая
ФАКТОРЫ ДЕНАТУРАЦИИ • • • Высокая температура Высокие концентрации солей Ионные и неионные детергенты (мочевина и др. ) Концентрированные щелочи Органические кислоты • • Денатурация • обратимая необратимая
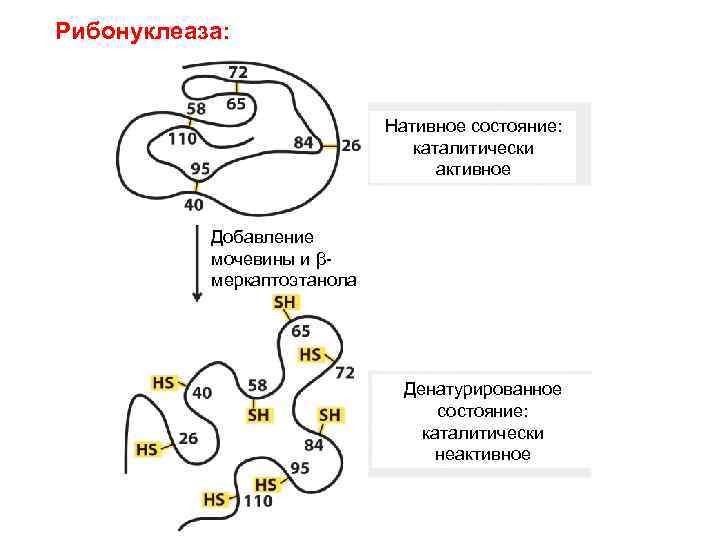 Рибонуклеаза: Нативное состояние: каталитически активное Добавление мочевины и βмеркаптоэтанола Денатурированное состояние: каталитически неактивное
Рибонуклеаза: Нативное состояние: каталитически активное Добавление мочевины и βмеркаптоэтанола Денатурированное состояние: каталитически неактивное
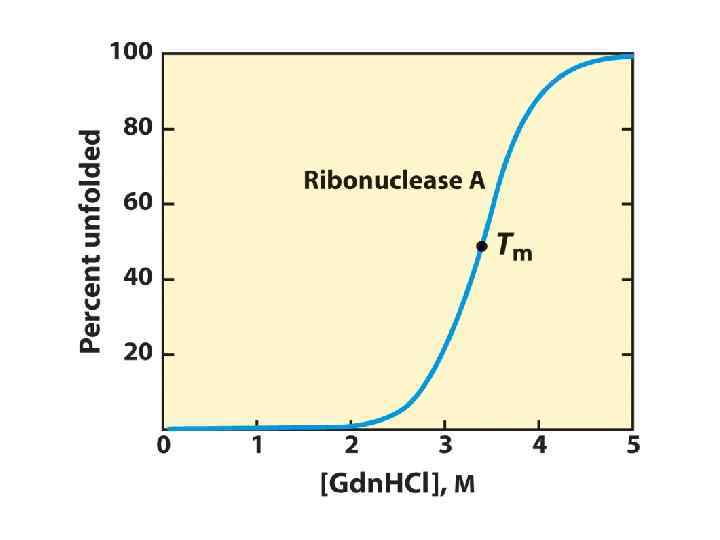
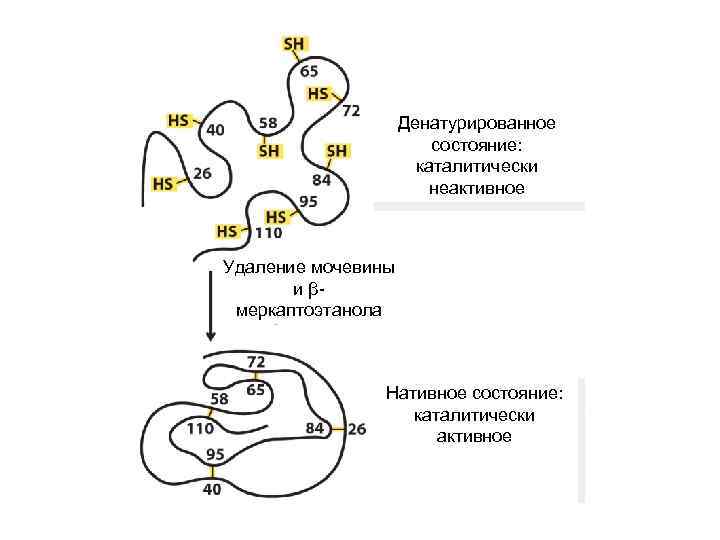 Денатурированное состояние: каталитически неактивное Удаление мочевины и βмеркаптоэтанола Нативное состояние: каталитически активное
Денатурированное состояние: каталитически неактивное Удаление мочевины и βмеркаптоэтанола Нативное состояние: каталитически активное
 Формирование третичной структуры белка Процесс сворачивания полипептидной цепи в правильную пространственную структуру (формирование третичной структуры) называется фолдингом белка; Способ сворачивания белка в глобулу зависит от его первичной структуры.
Формирование третичной структуры белка Процесс сворачивания полипептидной цепи в правильную пространственную структуру (формирование третичной структуры) называется фолдингом белка; Способ сворачивания белка в глобулу зависит от его первичной структуры.
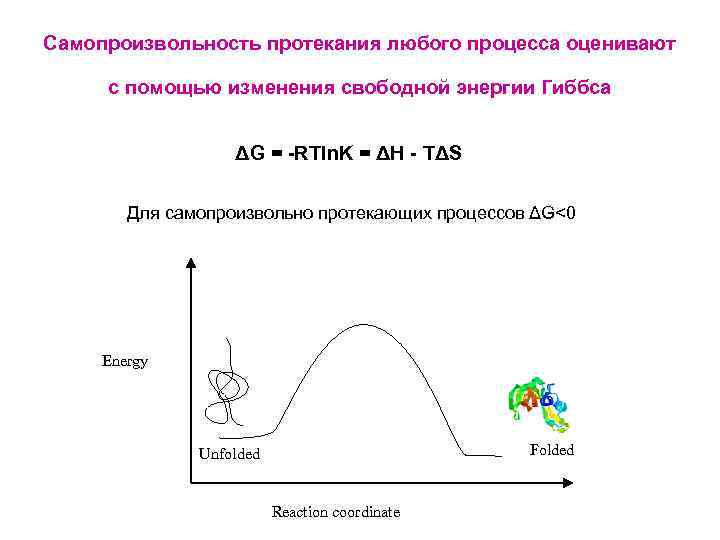 Самопроизвольность протекания любого процесса оценивают с помощью изменения свободной энергии Гиббса ΔG = -RTln. K = ΔH - TΔS Для самопроизвольно протекающих процессов ΔG<0 Energy Folded Unfolded Reaction coordinate
Самопроизвольность протекания любого процесса оценивают с помощью изменения свободной энергии Гиббса ΔG = -RTln. K = ΔH - TΔS Для самопроизвольно протекающих процессов ΔG<0 Energy Folded Unfolded Reaction coordinate
 «спонтанная» реакция Организация требует затраты энергии
«спонтанная» реакция Организация требует затраты энергии
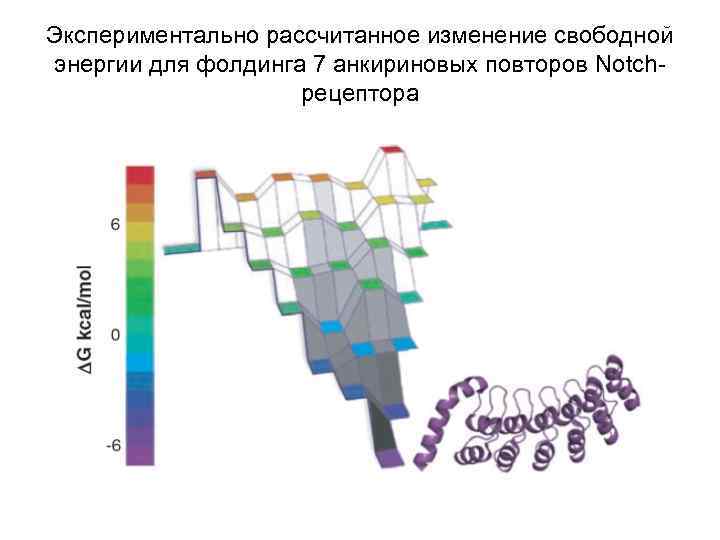 Экспериментально рассчитанное изменение свободной энергии для фолдинга 7 анкириновых повторов Notchрецептора
Экспериментально рассчитанное изменение свободной энергии для фолдинга 7 анкириновых повторов Notchрецептора
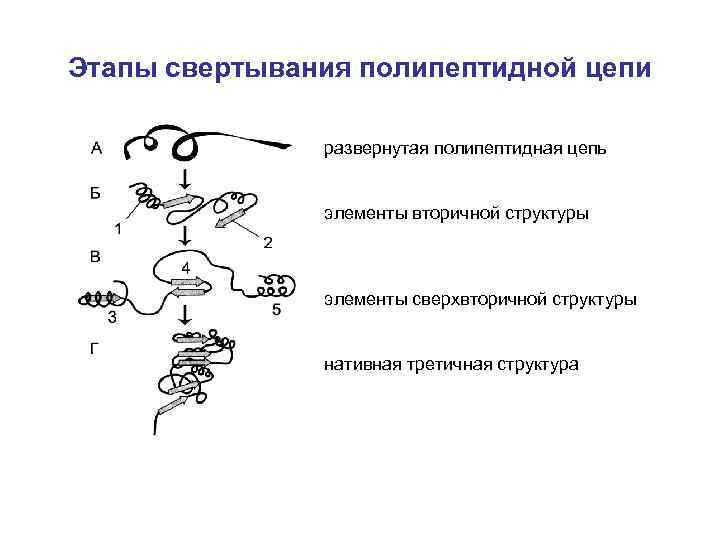 Этапы свертывания полипептидной цепи развернутая полипептидная цепь элементы вторичной структуры элементы сверхвторичной структуры нативная третичная структура
Этапы свертывания полипептидной цепи развернутая полипептидная цепь элементы вторичной структуры элементы сверхвторичной структуры нативная третичная структура
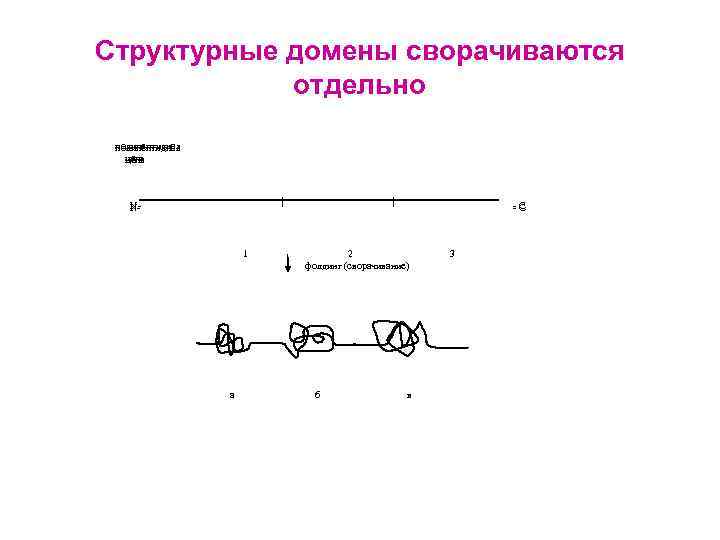 Структурные домены сворачиваются отдельно полипептидная цепь NN- -C -C 1 а 2 фолдинг (сворачивание) б в 3
Структурные домены сворачиваются отдельно полипептидная цепь NN- -C -C 1 а 2 фолдинг (сворачивание) б в 3
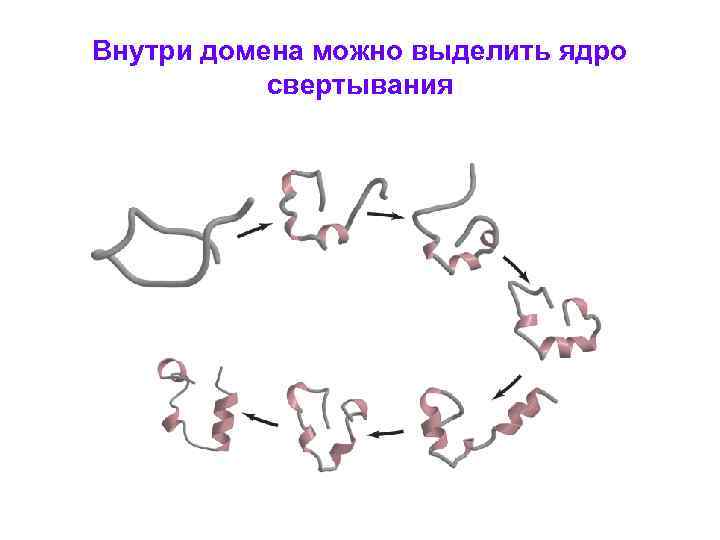 Внутри домена можно выделить ядро свертывания
Внутри домена можно выделить ядро свертывания
 Проблемы фолдинга Каков механизм фолдинга? Каков код фолдинга? Возможно ли предсказание пространственной структуры? Asn-Ala-Ile-Arg-Ser α-спираль β-складчатый слой (фосфофруктокиназа) (термолизин) Возможно, укладка белковой цепи определяется не только максимальной стабильностью образующейся структуры, но и быстротой достижения стабильного состояния
Проблемы фолдинга Каков механизм фолдинга? Каков код фолдинга? Возможно ли предсказание пространственной структуры? Asn-Ala-Ile-Arg-Ser α-спираль β-складчатый слой (фосфофруктокиназа) (термолизин) Возможно, укладка белковой цепи определяется не только максимальной стабильностью образующейся структуры, но и быстротой достижения стабильного состояния
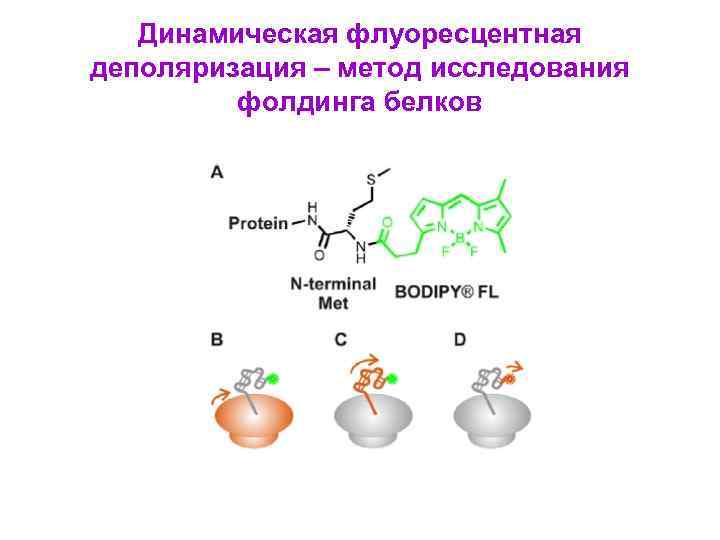 Динамическая флуоресцентная деполяризация – метод исследования фолдинга белков
Динамическая флуоресцентная деполяризация – метод исследования фолдинга белков
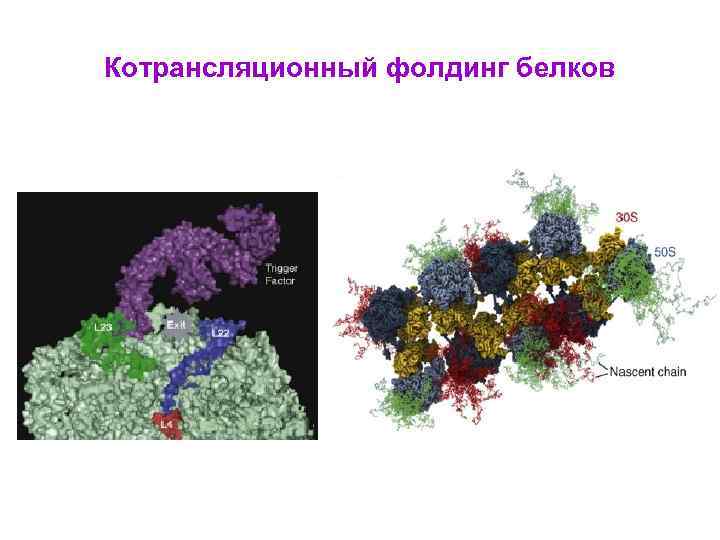 Котрансляционный фолдинг белков
Котрансляционный фолдинг белков
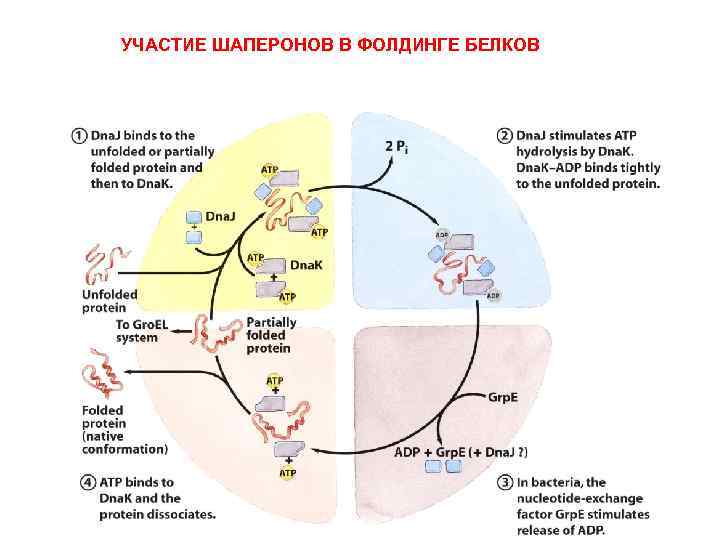 УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
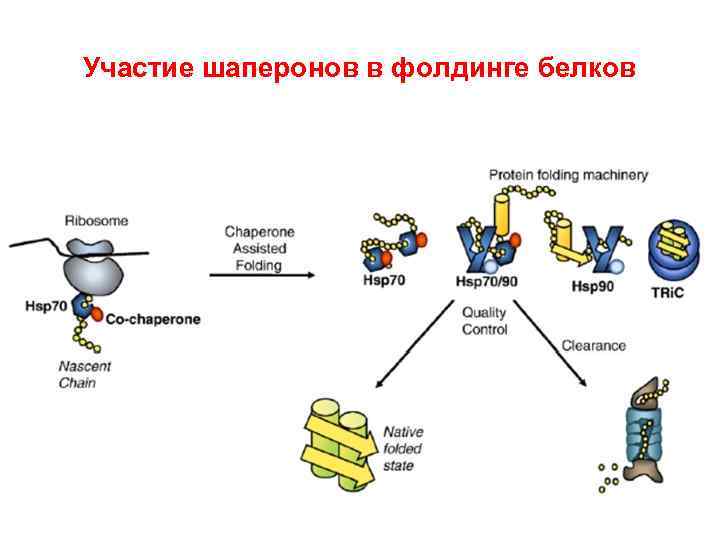 Участие шаперонов в фолдинге белков
Участие шаперонов в фолдинге белков
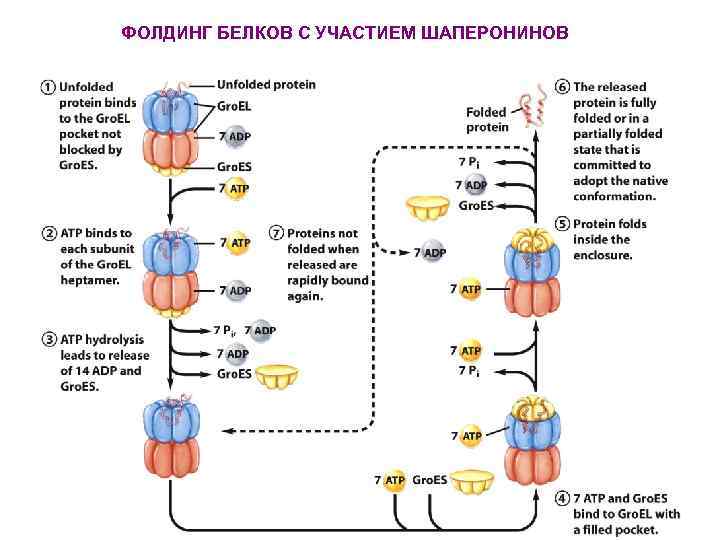 ФОЛДИНГ БЕЛКОВ С УЧАСТИЕМ ШАПЕРОНИНОВ
ФОЛДИНГ БЕЛКОВ С УЧАСТИЕМ ШАПЕРОНИНОВ
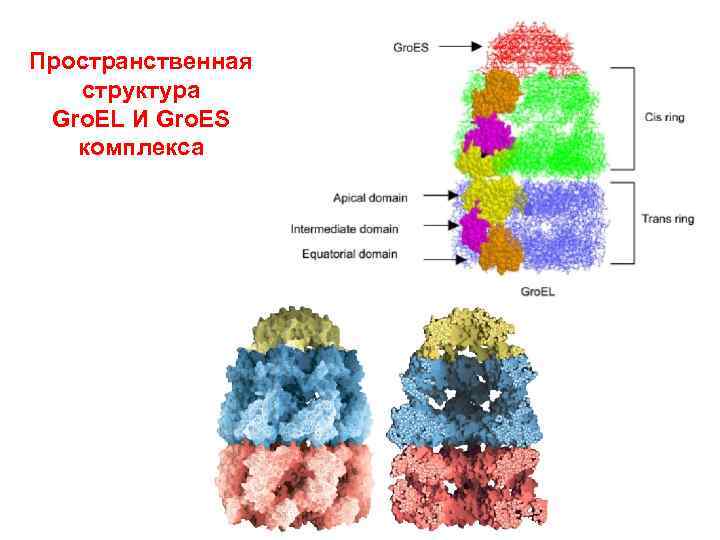 Пространственная структура Gro. EL И Gro. ES комплекса
Пространственная структура Gro. EL И Gro. ES комплекса
 Возможные причины нарушения процесса сворачивания (фолдинга) белка • а) при избыточной продукции некоторых белков, в результате чего увеличивается их концентрация в клетке и они начинают взаимодействовать друг с другом, нарушая процесс сворачивания • б) при попадании в клетки или образовании в них белков, способных влиять на сворачивание или пространственное расположение других молекул белка • в) при усилении расщепления нормальных белков, сопровождающемся образованием нерастворимых, склонных к агрегации (склеиванию) фрагментов • г) при возникновении точечных мутаций в молекуле ДНК, приводящих к заменам аминокислотных остатков в молекуле кодируемого белка.
Возможные причины нарушения процесса сворачивания (фолдинга) белка • а) при избыточной продукции некоторых белков, в результате чего увеличивается их концентрация в клетке и они начинают взаимодействовать друг с другом, нарушая процесс сворачивания • б) при попадании в клетки или образовании в них белков, способных влиять на сворачивание или пространственное расположение других молекул белка • в) при усилении расщепления нормальных белков, сопровождающемся образованием нерастворимых, склонных к агрегации (склеиванию) фрагментов • г) при возникновении точечных мутаций в молекуле ДНК, приводящих к заменам аминокислотных остатков в молекуле кодируемого белка.
 НАРУШЕНИЯ ФОЛДИНГА: ПРИОННЫЕ БОЛЕЗНИ Участок коры головного мозга пациента с болезнью Крейцфельдта – Якоба с участками с вакуолярной дегенерацией (вакуоли в межклеточном пространстве в области синапсов нарушают проведение нервного импульса) Прионные болезни вызваны накоплением аномальной изоформы прионного белка Pr. PSc (нормальный прионный белок – Pr. PC )
НАРУШЕНИЯ ФОЛДИНГА: ПРИОННЫЕ БОЛЕЗНИ Участок коры головного мозга пациента с болезнью Крейцфельдта – Якоба с участками с вакуолярной дегенерацией (вакуоли в межклеточном пространстве в области синапсов нарушают проведение нервного импульса) Прионные болезни вызваны накоплением аномальной изоформы прионного белка Pr. PSc (нормальный прионный белок – Pr. PC )
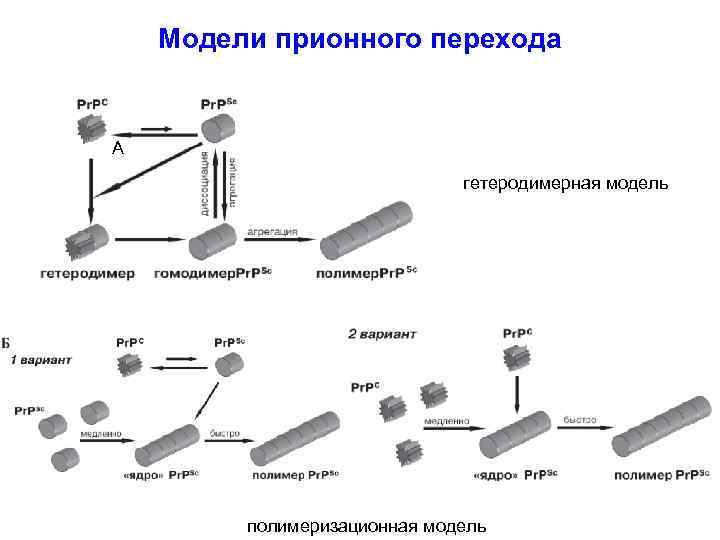 Модели прионного перехода А гетеродимерная модель полимеризационная модель
Модели прионного перехода А гетеродимерная модель полимеризационная модель
