Трансляція — перехід від нуклеїнових кислот до білків


































tema_8_translyatsiya_rnk_i_folding_bilkiv.ppt
- Размер: 3.8 Mегабайта
- Количество слайдов: 41
Описание презентации Трансляція — перехід від нуклеїнових кислот до білків по слайдам
 Трансляція — перехід від нуклеїнових кислот до білків
Трансляція — перехід від нуклеїнових кислот до білків
 Трансляція — процессинтезубілківзамінокислот, щокаталізується рибосомою на матриці матричної (інформаційної) РНК (м. РНК або іРНК). Трансляція є однією зі стадій процесу біосинтезу білків, у свою чергучастинипроцесуекспресіїгенів.
Трансляція — процессинтезубілківзамінокислот, щокаталізується рибосомою на матриці матричної (інформаційної) РНК (м. РНК або іРНК). Трансляція є однією зі стадій процесу біосинтезу білків, у свою чергучастинипроцесуекспресіїгенів.
 Загальна схема трансляції Ініціація. 1. Розпізнаваннястартовогокодону(AUG), супроводжуєтьсязв’язуваннямт. РНК аміноацильваної метіоніном (М) і збиранням рибосоми з великої і малої субодиниць. Елонгація. 2. Розпізнавання поточного кодону відповідною йому аміноацил-т. РНК (комплементарна взаємодія кодону м. РНК і антикодону т. РНК). 3. Приєднання амінокислоти, принесеної т. РНК, до кінця поліпептидного ланцюга, що росте. 4. Просування рибосоми уздовж матриці, яке супроводжується вивільненням молекули т. РНК. 5. Аміноацилювання молекули т. РНК, що вивільнилася, відповідною аміноацил-т. РНК-синтетазою. 6. Приєднання наступної молекули аміноацил-т. РНК, аналогічно стадії (2). 7. Рух рибосоми по молекулі м. РНК до стоп-кодону (в даному випадку UAG). Термінація. Розпізнавання рибосомою стоп-кодону супроводжується (8) від’єднанням новосинтезованогобілкаівдеякихвипадках(9)дисоціацієюрибосоми.
Загальна схема трансляції Ініціація. 1. Розпізнаваннястартовогокодону(AUG), супроводжуєтьсязв’язуваннямт. РНК аміноацильваної метіоніном (М) і збиранням рибосоми з великої і малої субодиниць. Елонгація. 2. Розпізнавання поточного кодону відповідною йому аміноацил-т. РНК (комплементарна взаємодія кодону м. РНК і антикодону т. РНК). 3. Приєднання амінокислоти, принесеної т. РНК, до кінця поліпептидного ланцюга, що росте. 4. Просування рибосоми уздовж матриці, яке супроводжується вивільненням молекули т. РНК. 5. Аміноацилювання молекули т. РНК, що вивільнилася, відповідною аміноацил-т. РНК-синтетазою. 6. Приєднання наступної молекули аміноацил-т. РНК, аналогічно стадії (2). 7. Рух рибосоми по молекулі м. РНК до стоп-кодону (в даному випадку UAG). Термінація. Розпізнавання рибосомою стоп-кодону супроводжується (8) від’єднанням новосинтезованогобілкаівдеякихвипадках(9)дисоціацієюрибосоми.
 Забезпечення трансляції т. РНК конкретного типу, яка відповідає певній амінокислоті, позначають індексом ( т. РНК Ala ). Аміноацильовану т. РНК позначають Ala-т. РНК Ala. Загальне позначення аміноацильованої т. РНК — аа-т. РНК. Еукаріотичні гени т. РНК (близько 500 активних генів т. РНК у геномі людини) транскрибуються РНК-полімеразою ІІІ. Загальна кількість типів т. РНК ~ 40 Одній амінокислоті може відповідати декілька (т. РНК-ізоакцепторна) Типів т. РНК більше ніж кодонів т. РН К
Забезпечення трансляції т. РНК конкретного типу, яка відповідає певній амінокислоті, позначають індексом ( т. РНК Ala ). Аміноацильовану т. РНК позначають Ala-т. РНК Ala. Загальне позначення аміноацильованої т. РНК — аа-т. РНК. Еукаріотичні гени т. РНК (близько 500 активних генів т. РНК у геномі людини) транскрибуються РНК-полімеразою ІІІ. Загальна кількість типів т. РНК ~ 40 Одній амінокислоті може відповідати декілька (т. РНК-ізоакцепторна) Типів т. РНК більше ніж кодонів т. РН К
 РИБОСОМАЗабезпечення трансляції р. РНК відповідають за структуру рибосоми та її каталітичну активність. р. РНК укладені в компактні точні тривимірні структури, які формують щільне ядро (кор). Рибосомні білки в основному знаходяться на поверхні рибосоми, а окремі їх ділянки проникають всередину через отвори в РНК-корі. Функція – стабілізація РНК-кору. Сайти зв’язування т. РНК розташовані між двома субодиницями: антикодонові частини т. РНК взаємодіють з м. РНК і малеою субодиницею, акцепторні частини — з великою субодиницею. У 2000 р. визначена повна тривимірна структура рибосоми.
РИБОСОМАЗабезпечення трансляції р. РНК відповідають за структуру рибосоми та її каталітичну активність. р. РНК укладені в компактні точні тривимірні структури, які формують щільне ядро (кор). Рибосомні білки в основному знаходяться на поверхні рибосоми, а окремі їх ділянки проникають всередину через отвори в РНК-корі. Функція – стабілізація РНК-кору. Сайти зв’язування т. РНК розташовані між двома субодиницями: антикодонові частини т. РНК взаємодіють з м. РНК і малеою субодиницею, акцепторні частини — з великою субодиницею. У 2000 р. визначена повна тривимірна структура рибосоми.
 р. РНК утворюють каталітичний сайт , де відбувається формування пептидного зв ’ язку. За це відповідіє 23 S р. РНК , оскільки найближча до нього амінокислота є на відстані > 1, 8 нм. Молекули РНК (сірі) каталізують утворення пептидних зв ’ язків між амінокислотними залишками в активному центрі рибосоми (підсвічений в центрі), тоді як білкова частина відіграє допоміжну роль. Каталітично активні молекули РНК називають рибозимами. Забезпечення трансляції Gray = RNA Gold = protein
р. РНК утворюють каталітичний сайт , де відбувається формування пептидного зв ’ язку. За це відповідіє 23 S р. РНК , оскільки найближча до нього амінокислота є на відстані > 1, 8 нм. Молекули РНК (сірі) каталізують утворення пептидних зв ’ язків між амінокислотними залишками в активному центрі рибосоми (підсвічений в центрі), тоді як білкова частина відіграє допоміжну роль. Каталітично активні молекули РНК називають рибозимами. Забезпечення трансляції Gray = RNA Gold = protein
 Рибосома містить : А-сайт , де відбувається зв’язування аа-т. РНК; Р-сайт , де з рибосомою взаємодіє пептидил-т. РНК (т. РНК, до якої приєднаний пептидний ланцюг, що синтезується); Е-сайт (від exit), де міститься деаміноацильована т. РНК перед її звільненням з рибосоми. На стадії ініціації трансляції з (Р)-пептидильним центром зв ’ язується ініціююча аа-т. РНК ( метіонінова аа-т. РНК – Мет-т. РНК i Мет ). На наступних стадіях трансляції в Р-центрі знаходиться пептидил-т. РНК.
Рибосома містить : А-сайт , де відбувається зв’язування аа-т. РНК; Р-сайт , де з рибосомою взаємодіє пептидил-т. РНК (т. РНК, до якої приєднаний пептидний ланцюг, що синтезується); Е-сайт (від exit), де міститься деаміноацильована т. РНК перед її звільненням з рибосоми. На стадії ініціації трансляції з (Р)-пептидильним центром зв ’ язується ініціююча аа-т. РНК ( метіонінова аа-т. РНК – Мет-т. РНК i Мет ). На наступних стадіях трансляції в Р-центрі знаходиться пептидил-т. РНК.
 І стадія – Оксиген — карбоксилу амінокислоти атакує фосфор первинного фосфату ATP. ІІ стадія — 2′ або 3′ гідроксил кінцевого аденозину т. РНК атакує Карбон карбонільної групи амінокислоти. Реакція каталізується аміноацил-т. РНК синтетазою, а концентрація PP i знижується внаслідок дії пірофосфатази. Аміноацил-т. РНК синтетаза каталізує зв ’ язування відповідної амінокислоти до кожної т. РНК. Аміноацилювання т. РНК поділяють на 2 стадії: amino acid + ATP → aminoacyl-AMP + PP i aminoacyl-AMP + t. RNA → aminoacyl-t. RNA + AMP
І стадія – Оксиген — карбоксилу амінокислоти атакує фосфор первинного фосфату ATP. ІІ стадія — 2′ або 3′ гідроксил кінцевого аденозину т. РНК атакує Карбон карбонільної групи амінокислоти. Реакція каталізується аміноацил-т. РНК синтетазою, а концентрація PP i знижується внаслідок дії пірофосфатази. Аміноацил-т. РНК синтетаза каталізує зв ’ язування відповідної амінокислоти до кожної т. РНК. Аміноацилювання т. РНК поділяють на 2 стадії: amino acid + ATP → aminoacyl-AMP + PP i aminoacyl-AMP + t. RNA → aminoacyl-t. RNA + AMP
 Зв ’ язування амінокислоти з т. РНК 1 -ша стадія — активування амінокислоти — її приєднання до АМР з утворенням аміноациладенілату, коли пірофосфат у складі АТР замінюється на амінокислоту 2 -га стадія — перенесення амінокислоти на т. РНК : Аміноациладенілат утворює проміжний комплекс з активним центром ферменту й ефективно атакує ОН-групу рибози 3′-кінцевого аденозину т. РНК (3′- або 2′-ОН групу залежно від класу АРСази): відбувається перенесення амінокислоти на т. РНК. Ключова роль у вірному зв ’ язуванні належить аміноацил-т. РНК-синтетазіПідготовчі стадії
Зв ’ язування амінокислоти з т. РНК 1 -ша стадія — активування амінокислоти — її приєднання до АМР з утворенням аміноациладенілату, коли пірофосфат у складі АТР замінюється на амінокислоту 2 -га стадія — перенесення амінокислоти на т. РНК : Аміноациладенілат утворює проміжний комплекс з активним центром ферменту й ефективно атакує ОН-групу рибози 3′-кінцевого аденозину т. РНК (3′- або 2′-ОН групу залежно від класу АРСази): відбувається перенесення амінокислоти на т. РНК. Ключова роль у вірному зв ’ язуванні належить аміноацил-т. РНК-синтетазіПідготовчі стадії
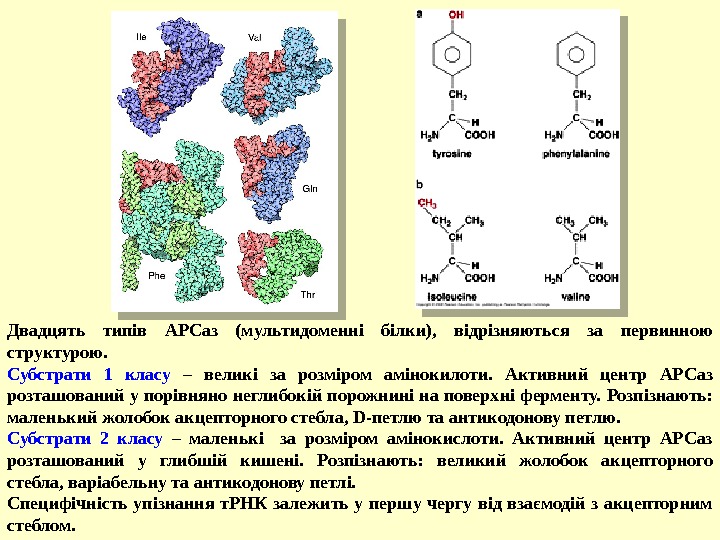
 Двадцять типів АРСаз (мультидоменні білки), відрізняються за первинною структурою. Субстрати 1 класу – великі за розміром амінокилоти. Активний центр АРСаз розташований у порівняно неглибокій порожнині на поверхні ферменту. Розпізнають: маленький жолобок акцепторного стебла, D-петлю та антикодонову петлю. Субстрати 2 класу – маленькі за розміром амінокислоти. Активний центр АРСаз розташований у глибшій кишені. Розпізнають: великий жолобок акцепторного стебла, варіабельну та антикодонову петлі. Специфічність упізнання т. РНК залежить у першу чергу від взаємодій з акцепторним стеблом.
Двадцять типів АРСаз (мультидоменні білки), відрізняються за первинною структурою. Субстрати 1 класу – великі за розміром амінокилоти. Активний центр АРСаз розташований у порівняно неглибокій порожнині на поверхні ферменту. Розпізнають: маленький жолобок акцепторного стебла, D-петлю та антикодонову петлю. Субстрати 2 класу – маленькі за розміром амінокислоти. Активний центр АРСаз розташований у глибшій кишені. Розпізнають: великий жолобок акцепторного стебла, варіабельну та антикодонову петлі. Специфічність упізнання т. РНК залежить у першу чергу від взаємодій з акцепторним стеблом.
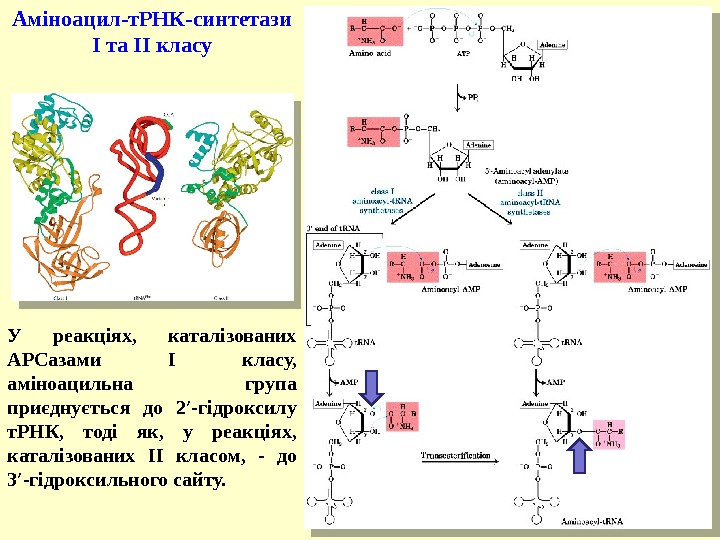
 У реакціях, каталізованих АРСазами І класу, аміноацильна група приєднується до 2′- гідроксилу т. РНК , тоді як , у реакціях, каталізованих ІІ класом, — до 3′- гідроксильного сайту. Аміноацил-т. РНК-синтетази І та ІІ класу
У реакціях, каталізованих АРСазами І класу, аміноацильна група приєднується до 2′- гідроксилу т. РНК , тоді як , у реакціях, каталізованих ІІ класом, — до 3′- гідроксильного сайту. Аміноацил-т. РНК-синтетази І та ІІ класу
 Деякі організми не мають генів для усіх 20 аміноацил-т. РНК синтетаз. Проте в амінокислотному складі їхніх білків представлені усі 20 амінокислот. Наприклад, деякі бактерії не мають фермента для завантаження глутаміну на його т. РНК. Проте один фермент приєднує глутамінову кислоту до т. РНК, які транспортують глутамат, а також глутамін. Інший фермент потім конвертує глутамінову кислоту в глутамін, утворюючи коректну пару. Донором NH 2 — групи може слугувати вільний глутамін, а також в деяких випадках аспарагін і амоніак.
Деякі організми не мають генів для усіх 20 аміноацил-т. РНК синтетаз. Проте в амінокислотному складі їхніх білків представлені усі 20 амінокислот. Наприклад, деякі бактерії не мають фермента для завантаження глутаміну на його т. РНК. Проте один фермент приєднує глутамінову кислоту до т. РНК, які транспортують глутамат, а також глутамін. Інший фермент потім конвертує глутамінову кислоту в глутамін, утворюючи коректну пару. Донором NH 2 — групи може слугувати вільний глутамін, а також в деяких випадках аспарагін і амоніак.
 Шляхи ініціації трансляції Способи пошуку стартової точки трансляції: Еукаріоти ( термінальна трансляція ): рибосомна частинка приєднується до 5 ′ -кінця м. РНК і сканує м. РНК до зустрічі з ініціюючим кодоном Прокаріоти ( внутрішня ініціація ): рибосомна частинка асоціює безпосередньо з локальною структурою м. РНК, що містить ініціюючий кодон незалежно від 5 ′ — кінця. Трансляція. Еукаріоти Прокаріоти Сканування
Шляхи ініціації трансляції Способи пошуку стартової точки трансляції: Еукаріоти ( термінальна трансляція ): рибосомна частинка приєднується до 5 ′ -кінця м. РНК і сканує м. РНК до зустрічі з ініціюючим кодоном Прокаріоти ( внутрішня ініціація ): рибосомна частинка асоціює безпосередньо з локальною структурою м. РНК, що містить ініціюючий кодон незалежно від 5 ′ — кінця. Трансляція. Еукаріоти Прокаріоти Сканування
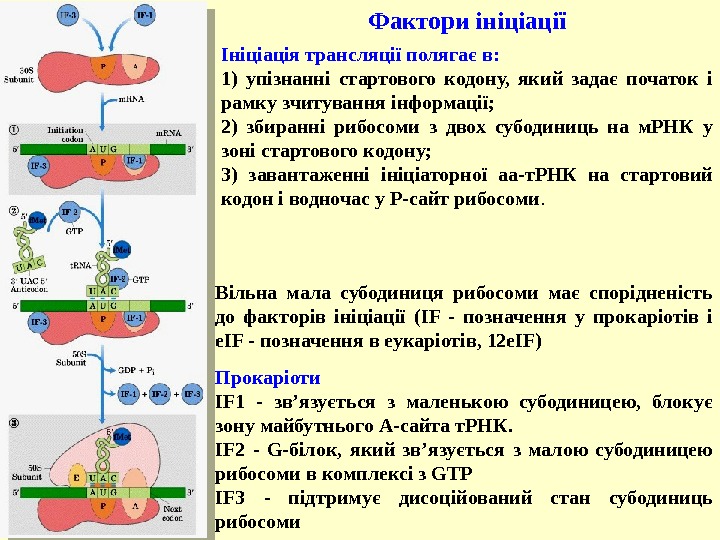
 Фактори ініціації Вільна мала субодиниця рибосоми має спорідненість до факторів ініціації (IF — позначення у прокаріотів і е. IF — позначення в еукаріотів, 12 е. IF) Прокаріоти IF 1 — зв’язується з маленькою субодиницею, блокує зону майбутнього А-сайта т. РНК. IF 2 — G-білок, який зв’язується з малою субодиницею рибосоми в комплексі з GTP IF 3 — підтримує дисоційований стан субодиниць рибосоми Ініціація трансляції полягає в: 1) упізнанні стартового кодону, який задає початок і рамку зчитування інформації; 2) збиранні рибосоми з двох субодиниць на м. РНК у зоні стартового кодону; 3) завантаженні ініціаторної аа-т. РНК на стартовий кодон і водночас у Р-сайт рибосоми.
Фактори ініціації Вільна мала субодиниця рибосоми має спорідненість до факторів ініціації (IF — позначення у прокаріотів і е. IF — позначення в еукаріотів, 12 е. IF) Прокаріоти IF 1 — зв’язується з маленькою субодиницею, блокує зону майбутнього А-сайта т. РНК. IF 2 — G-білок, який зв’язується з малою субодиницею рибосоми в комплексі з GTP IF 3 — підтримує дисоційований стан субодиниць рибосоми Ініціація трансляції полягає в: 1) упізнанні стартового кодону, який задає початок і рамку зчитування інформації; 2) збиранні рибосоми з двох субодиниць на м. РНК у зоні стартового кодону; 3) завантаженні ініціаторної аа-т. РНК на стартовий кодон і водночас у Р-сайт рибосоми.
 В бактерійних м. РНК замість “кепу” на 5′-кінці є специфічний сайт зв ’ язування з рибосомою – послідовність Шайна-Дальгарно , розміщена в м. РНК за 5 -9 нуклеотидів від стартового кодону в напрямку до 5′-кінця. Ця канонічна послідовнсть 5′-АГГАГГУ-3′ утворює комплементарні пари основ з 16 S р. РНК малої субодиниці рибосоми. Наявність послідовності Шайна-Дальгарно робить кодон AUG стартовим, відрізняючи його від звичайного метіонінового кодону. На ефективність розпізнавання АУГ також впливають нуклеотиди , які фланкують стартовий кодон (передують ділянкам, що транскрибуються або розміщуються за ними)
В бактерійних м. РНК замість “кепу” на 5′-кінці є специфічний сайт зв ’ язування з рибосомою – послідовність Шайна-Дальгарно , розміщена в м. РНК за 5 -9 нуклеотидів від стартового кодону в напрямку до 5′-кінця. Ця канонічна послідовнсть 5′-АГГАГГУ-3′ утворює комплементарні пари основ з 16 S р. РНК малої субодиниці рибосоми. Наявність послідовності Шайна-Дальгарно робить кодон AUG стартовим, відрізняючи його від звичайного метіонінового кодону. На ефективність розпізнавання АУГ також впливають нуклеотиди , які фланкують стартовий кодон (передують ділянкам, що транскрибуються або розміщуються за ними)
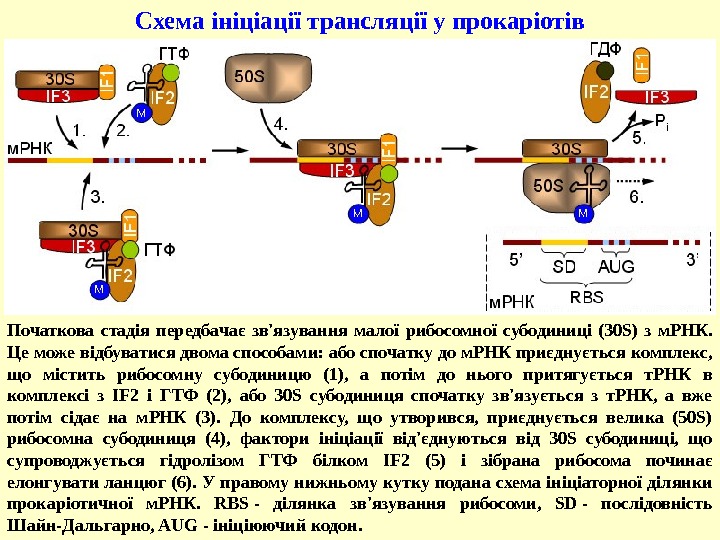
 Початкова стадія передбачає зв’язування малої рибосомної субодиниці (30 S) з м. РНК. Це може відбуватися двома способами: або спочатку до м. РНК приєднується комплекс, що містить рибосомну субодиницю (1), а потім до нього притягується т. РНК в комплексі з IF 2 і ГТФ (2), або 30 S субодиниця спочатку зв’язується з т. РНК, а вже потім сідає на м. РНК (3). До комплексу, що утворився, приєднується велика (50 S) рибосомна субодиниця (4), фактори ініціації від’єднуються від 30 S субодиниці, що супроводжується гідролізом ГТФ білком IF 2 (5) і зібрана рибосома починає елонгувати ланцюг (6). У правому нижньому кутку подана схема ініціаторної ділянки прокаріотичної м. РНК. RBS — ділянка зв’язування рибосоми, SD — послідовність Шайн-Дальгарно, AUG — ініціюючий кодон. Схема ініціації трансляції у прокаріотів
Початкова стадія передбачає зв’язування малої рибосомної субодиниці (30 S) з м. РНК. Це може відбуватися двома способами: або спочатку до м. РНК приєднується комплекс, що містить рибосомну субодиницю (1), а потім до нього притягується т. РНК в комплексі з IF 2 і ГТФ (2), або 30 S субодиниця спочатку зв’язується з т. РНК, а вже потім сідає на м. РНК (3). До комплексу, що утворився, приєднується велика (50 S) рибосомна субодиниця (4), фактори ініціації від’єднуються від 30 S субодиниці, що супроводжується гідролізом ГТФ білком IF 2 (5) і зібрана рибосома починає елонгувати ланцюг (6). У правому нижньому кутку подана схема ініціаторної ділянки прокаріотичної м. РНК. RBS — ділянка зв’язування рибосоми, SD — послідовність Шайн-Дальгарно, AUG — ініціюючий кодон. Схема ініціації трансляції у прокаріотів
 Схема ініціації трансляції в еукаріотів На першому етапі ініціації трансляції мала субодиниця рибосоми в комплексі з факторами ініціації e. IF 4 G, e. IF 4 B, e. IF 4 E та ініціаторною т. РНК приєднується до 5′-кінця м. РНК за рахунок здатності e. IF 4 E зв’язувати кеп-структуру. Потім білок e. IF 4 B залучає геліказу e. IF 4 A для розплітання м. РНК у напрямку 3′-кінця, що супроводжується витратами енергії АТФ. За рахунок роботи цього білка, 40 S субодиниця звільняється від білків e. IF 4 G і e. IF 4 E, і в комплексі з факторами ініціації, що залишилися, рухається по м. РНК до стартового кодону AUG, де відбувається дисоціація факторів ініціації, що залишилися, і залучення 60 S субодиниці рибосоми за допомогою e. IF 5, після чого починається синтез поліпептидного ланцюга.
Схема ініціації трансляції в еукаріотів На першому етапі ініціації трансляції мала субодиниця рибосоми в комплексі з факторами ініціації e. IF 4 G, e. IF 4 B, e. IF 4 E та ініціаторною т. РНК приєднується до 5′-кінця м. РНК за рахунок здатності e. IF 4 E зв’язувати кеп-структуру. Потім білок e. IF 4 B залучає геліказу e. IF 4 A для розплітання м. РНК у напрямку 3′-кінця, що супроводжується витратами енергії АТФ. За рахунок роботи цього білка, 40 S субодиниця звільняється від білків e. IF 4 G і e. IF 4 E, і в комплексі з факторами ініціації, що залишилися, рухається по м. РНК до стартового кодону AUG, де відбувається дисоціація факторів ініціації, що залишилися, і залучення 60 S субодиниці рибосоми за допомогою e. IF 5, після чого починається синтез поліпептидного ланцюга.
 Упізнання стартового кодона залежить від контексту послідовності, в якій він розташований. Найкращим контекстом, який максимально сприяє ініціації трансляції, є послідовність Козак: GCC(A/G)CCAUGG. Kozak- подібні послідовності еукаріотів Біота Послідовність нуклеотидів Хребетні gcc. Rcc ATG G Плодовамушка ( Drosophila spp. ) c. AAa ATG Пекарськідріжджі ( Saccharomyces cerevisiae ) a. Aa. A ATG TCt Наземнірослини AACA ATG GCІніціація трансляції в еукаріотів
Упізнання стартового кодона залежить від контексту послідовності, в якій він розташований. Найкращим контекстом, який максимально сприяє ініціації трансляції, є послідовність Козак: GCC(A/G)CCAUGG. Kozak- подібні послідовності еукаріотів Біота Послідовність нуклеотидів Хребетні gcc. Rcc ATG G Плодовамушка ( Drosophila spp. ) c. AAa ATG Пекарськідріжджі ( Saccharomyces cerevisiae ) a. Aa. A ATG TCt Наземнірослини AACA ATG GCІніціація трансляції в еукаріотів
 1 крок. Друга аміноацил-т. РНК входить в A сайт , за сприяння EF-Tu. 2 крок. Пептидилтрансфераза каталізує утворення пептидного зв ’ язку, який зв ’ язує дві амінокислоти. Вільна т. РНК переміщається в E сайт (exit); м. РНК транслокується на три нуклеотиди , внаслідок чого т. РНК асоційована з дипептидом потрапляє у P сайт. 3 крок. Після утворення першого пептидного зв ’ язку вивільняється перша неаміноацильованої т. РНК, за участю EF-G. Третя аа-т. РНК готова окупувати А сайт. Елонгація трансляції
1 крок. Друга аміноацил-т. РНК входить в A сайт , за сприяння EF-Tu. 2 крок. Пептидилтрансфераза каталізує утворення пептидного зв ’ язку, який зв ’ язує дві амінокислоти. Вільна т. РНК переміщається в E сайт (exit); м. РНК транслокується на три нуклеотиди , внаслідок чого т. РНК асоційована з дипептидом потрапляє у P сайт. 3 крок. Після утворення першого пептидного зв ’ язку вивільняється перша неаміноацильованої т. РНК, за участю EF-G. Третя аа-т. РНК готова окупувати А сайт. Елонгація трансляції
 4 крок. Третя аа-т. РНК займає А сайт, за сприяння EF-Tu. 5 крок. Утворюється другий пептидний зв ’ язок, формуючи трипептид, який починає рухатись через тунель у великій субодиниці. Друга неаміноацильована т. РНК входить в Е сайт і є готовою до вилучення. 6 крок. Повний поліпептид є синтезований і покидає рибосому після досягнення нею термінуючого стоп-кодону. Елонгація трансляції
4 крок. Третя аа-т. РНК займає А сайт, за сприяння EF-Tu. 5 крок. Утворюється другий пептидний зв ’ язок, формуючи трипептид, який починає рухатись через тунель у великій субодиниці. Друга неаміноацильована т. РНК входить в Е сайт і є готовою до вилучення. 6 крок. Повний поліпептид є синтезований і покидає рибосому після досягнення нею термінуючого стоп-кодону. Елонгація трансляції
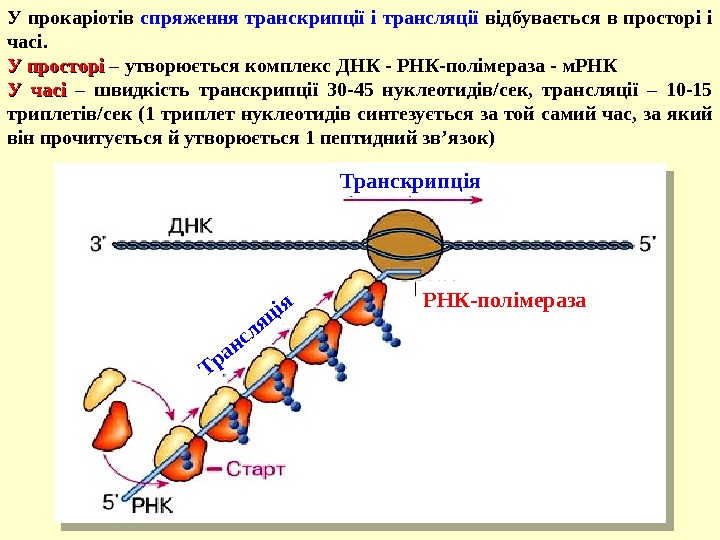
 У прокаріотів спряження транскрипції і трансляції відбувається в просторі і часі. У просторі – утворюється комплекс ДНК — РНК-полімераза — м. РНК У часі – швидкість транскрипції 30 -45 нуклеотидів/сек, трансляції – 10 -15 триплетів/сек (1 триплет нуклеотидів синтезується за той самий час, за який він прочитується й утворюється 1 пептидний зв ’ язок) Транскрипція. Трансляція РНК-полімераза
У прокаріотів спряження транскрипції і трансляції відбувається в просторі і часі. У просторі – утворюється комплекс ДНК — РНК-полімераза — м. РНК У часі – швидкість транскрипції 30 -45 нуклеотидів/сек, трансляції – 10 -15 триплетів/сек (1 триплет нуклеотидів синтезується за той самий час, за який він прочитується й утворюється 1 пептидний зв ’ язок) Транскрипція. Трансляція РНК-полімераза
 Сигнал термінації – беззмістовний кодон м. РНК ( УАА, УАГ, УГА ) Упізнається білковими факторами термінації ( e. RF ) Один упізнає УАА і УАГ Другий – УАА і УГА Фактор e. RF упізнає свій антикодон і стимулює гідролазну активність пептидилтрансферазного центру, внаслідок чого гідролізується зв ’ язок між т. РНК і пептидом. Результат: пептидний ланцюг, т. РНК, м. РНК залишають рибосому, субодиниці рибосоми дисоціюють Термінація трансляції
Сигнал термінації – беззмістовний кодон м. РНК ( УАА, УАГ, УГА ) Упізнається білковими факторами термінації ( e. RF ) Один упізнає УАА і УАГ Другий – УАА і УГА Фактор e. RF упізнає свій антикодон і стимулює гідролазну активність пептидилтрансферазного центру, внаслідок чого гідролізується зв ’ язок між т. РНК і пептидом. Результат: пептидний ланцюг, т. РНК, м. РНК залишають рибосому, субодиниці рибосоми дисоціюють Термінація трансляції
 РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ Синтез білків регулюється на 3 -х рівнях: 1) Шляхом зміни активності генів (рівень транскрипції) 2) Шляхом зміни активності м. РНК під час її трансляції рибосомами (рівень трансляції) 3) Шляхом деградації м. РНК за допомогою неселективного або вибіркового розщеплення рибонуклеазами Регуляторні механізми трансляції направлені на те, щоб дозволити (з певною швидкістю) або не дозволити ініціацію трансляції.
РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ Синтез білків регулюється на 3 -х рівнях: 1) Шляхом зміни активності генів (рівень транскрипції) 2) Шляхом зміни активності м. РНК під час її трансляції рибосомами (рівень трансляції) 3) Шляхом деградації м. РНК за допомогою неселективного або вибіркового розщеплення рибонуклеазами Регуляторні механізми трансляції направлені на те, щоб дозволити (з певною швидкістю) або не дозволити ініціацію трансляції.
 У прокаріотів швидкість або частота ініціації визначається різною спорідненістю рибосомозв ’ язуючих ділянок м. РНК до рибосом За різницею ефективності ініціації розрізняють «сильні» РНК (на них ініціація відбувається часто, за участі багатьох рибосом, з продукуванням значної кількості молекул білків) і «слабкі» РНК – з протилежною характеристикою Схожа ситуація є в еукаріотичних клітинах, в яких дискримінація м. РНК зумовлена різною спорідненістю факторів ініціації, а не самих рибосом до різних 5′-проксимальних ініціюючих структур м. РНК. «слабка» РНК «сильна» РНКРЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ
У прокаріотів швидкість або частота ініціації визначається різною спорідненістю рибосомозв ’ язуючих ділянок м. РНК до рибосом За різницею ефективності ініціації розрізняють «сильні» РНК (на них ініціація відбувається часто, за участі багатьох рибосом, з продукуванням значної кількості молекул білків) і «слабкі» РНК – з протилежною характеристикою Схожа ситуація є в еукаріотичних клітинах, в яких дискримінація м. РНК зумовлена різною спорідненістю факторів ініціації, а не самих рибосом до різних 5′-проксимальних ініціюючих структур м. РНК. «слабка» РНК «сильна» РНКРЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ
 mi. RNAs -опосередкована репресія може відбуватись шляхом інгібування ініціації або елонгації трансляції, а також може призвоидити до змін в структурі м. РНК 3′ poly(A) хвоста. Елементи, знайдені в м. РНК 5′ UTR ( жовтий прямокутник ) можуть зв ’ язувати регуляторні білки, перешкоджаючи скануванню РНК субодиницею 48 S рибосоми. Загальна регуляція трансляції м. РНК як правило здійснюється шляхом модифікацій трансляційного апарату ( фосфорилювання факторів ініціації трансляції e. IF 2α та e. IF 4 E) і самих рибосом , або змінами спорідненості взаємодіючих білків ( фосфорилювання e. IF 4 E- зв ’ язуючих білків ). Трансляція може ініціюватись “кеп”-незалежно за допомогою внутрішнього сайту входження рибосоми (IRES) в ділянці 5′ UTR , ефективність якого регулюється транс-діючими факторами (ITAFs). Упізнавання 3′ UTR послідовності або структурних елементів ( зелений і червоний прямокутники ) РНК-зв ’ язуючими білками зумовлює активацію або репресію трансляції, шляхом перебудови 3′ poly(A) хвоста або шляхом взаємодії білків з 5′ кінцевим “кепом” ( таких як e. IF 4 E або “кеп”-зв ’ язуючих білків ). РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ В ЕУКАРІОТІВ
mi. RNAs -опосередкована репресія може відбуватись шляхом інгібування ініціації або елонгації трансляції, а також може призвоидити до змін в структурі м. РНК 3′ poly(A) хвоста. Елементи, знайдені в м. РНК 5′ UTR ( жовтий прямокутник ) можуть зв ’ язувати регуляторні білки, перешкоджаючи скануванню РНК субодиницею 48 S рибосоми. Загальна регуляція трансляції м. РНК як правило здійснюється шляхом модифікацій трансляційного апарату ( фосфорилювання факторів ініціації трансляції e. IF 2α та e. IF 4 E) і самих рибосом , або змінами спорідненості взаємодіючих білків ( фосфорилювання e. IF 4 E- зв ’ язуючих білків ). Трансляція може ініціюватись “кеп”-незалежно за допомогою внутрішнього сайту входження рибосоми (IRES) в ділянці 5′ UTR , ефективність якого регулюється транс-діючими факторами (ITAFs). Упізнавання 3′ UTR послідовності або структурних елементів ( зелений і червоний прямокутники ) РНК-зв ’ язуючими білками зумовлює активацію або репресію трансляції, шляхом перебудови 3′ poly(A) хвоста або шляхом взаємодії білків з 5′ кінцевим “кепом” ( таких як e. IF 4 E або “кеп”-зв ’ язуючих білків ). РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ В ЕУКАРІОТІВ
 Загальна регуляція білкового синтезу – активація фосфокінази, яка фосфорилює e. IF 2, що призводить до пригнічення ініціації трансляції усіх м. РНК клітини. Сигнали активації фосфокінази: тепловий шок та інші стресові чинники, недостатня кількість ростових факторів, голодування за амінокислотами, недостатня кількість заліза, вірусні інфекції. В даному випадку сильне пригнічення синтезу білка є наслідком саме активації фосфокінази і фосфорилювання e. IF 2. РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ
Загальна регуляція білкового синтезу – активація фосфокінази, яка фосфорилює e. IF 2, що призводить до пригнічення ініціації трансляції усіх м. РНК клітини. Сигнали активації фосфокінази: тепловий шок та інші стресові чинники, недостатня кількість ростових факторів, голодування за амінокислотами, недостатня кількість заліза, вірусні інфекції. В даному випадку сильне пригнічення синтезу білка є наслідком саме активації фосфокінази і фосфорилювання e. IF 2. РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ
 Після завершення трансляції відбуваються: ► Часткова протеолітична деградація — відщеплення кінцевих ділянок ланцюга, частіше на N-кінці, або іноді розрізання ланцюга на окремі фрагменти. Особливо характерна для секреторних білків і ферментів, які мають гідролітичні активності (така часткова деградація трансформує білок в активну форму). ► Фолдинг – згортання пептидного ланцюга у просторову структуру. ► Д одаткова модифікація. Ковалентні посттрансляційні модифікації амінокислотних залишків (фосфорилювання, ацетилювання, глікозилювання тощо), приєднання полісахаридів, ліпідів, простетичних груп і кофакторів небілкової природи. ► Транспортування білків до місць їхнього майбутнього функціонування (процес починається з трансляції).
Після завершення трансляції відбуваються: ► Часткова протеолітична деградація — відщеплення кінцевих ділянок ланцюга, частіше на N-кінці, або іноді розрізання ланцюга на окремі фрагменти. Особливо характерна для секреторних білків і ферментів, які мають гідролітичні активності (така часткова деградація трансформує білок в активну форму). ► Фолдинг – згортання пептидного ланцюга у просторову структуру. ► Д одаткова модифікація. Ковалентні посттрансляційні модифікації амінокислотних залишків (фосфорилювання, ацетилювання, глікозилювання тощо), приєднання полісахаридів, ліпідів, простетичних груп і кофакторів небілкової природи. ► Транспортування білків до місць їхнього майбутнього функціонування (процес починається з трансляції).
 Транспорт і модифікація білків продовжуються в комплексі Гольджі. У кінцевому рахунку білок: або виділяється шляхом екзоцитозу з клітини або включається до складу тої чи іншої мембрани або залишається всередині сформованої лізосоми 2. Внутрішні білки (білки цитоплазми, мітохондрій, ядра тощо) синтезуються на вільних, тобто мембранонезв ’ язаних рибосомах Особливості транспортування: 1. “Експортні” білки (призначені для виділення з клітини), мембранні та лізосомальні білки утворюються мембранозв ’ язаними рибосомами, тобто рибосомами, прикріпленими до поверхні мембран ЕПР. В люмені ЕПР відбувається фолдинг і модифікація білків.
Транспорт і модифікація білків продовжуються в комплексі Гольджі. У кінцевому рахунку білок: або виділяється шляхом екзоцитозу з клітини або включається до складу тої чи іншої мембрани або залишається всередині сформованої лізосоми 2. Внутрішні білки (білки цитоплазми, мітохондрій, ядра тощо) синтезуються на вільних, тобто мембранонезв ’ язаних рибосомах Особливості транспортування: 1. “Експортні” білки (призначені для виділення з клітини), мембранні та лізосомальні білки утворюються мембранозв ’ язаними рибосомами, тобто рибосомами, прикріпленими до поверхні мембран ЕПР. В люмені ЕПР відбувається фолдинг і модифікація білків.
 Просторова структура нативного білка і шлях її формування повністю визначаються амінокислотною послідовністю ● на третинну структуру можуть впливати ліганди білка і хімічна модифікація ● невеликі білки формують третинну структуру самостійно Процес формування вторинної та високоспецифічної просторової структури білка в ході його рибосомного синтезу, називається згортанням, або фолдингом , який необхідний для утворення активних і життєздатних білків.
Просторова структура нативного білка і шлях її формування повністю визначаються амінокислотною послідовністю ● на третинну структуру можуть впливати ліганди білка і хімічна модифікація ● невеликі білки формують третинну структуру самостійно Процес формування вторинної та високоспецифічної просторової структури білка в ході його рибосомного синтезу, називається згортанням, або фолдингом , який необхідний для утворення активних і життєздатних білків.
 У фізіологічному розчині, що оточує рибосому, поліпептидний ланцюг зазнає згортання, компактизації і самоорганізації у просторову структуру за рахунок взаємодій між гідрофобними бічними групами поліпептидного ланцюга і гідрофільних груп з оточуючою водою й іонами. Процес відбувається — котрансляційно. Фолдинг білків
У фізіологічному розчині, що оточує рибосому, поліпептидний ланцюг зазнає згортання, компактизації і самоорганізації у просторову структуру за рахунок взаємодій між гідрофобними бічними групами поліпептидного ланцюга і гідрофільних груп з оточуючою водою й іонами. Процес відбувається — котрансляційно. Фолдинг білків
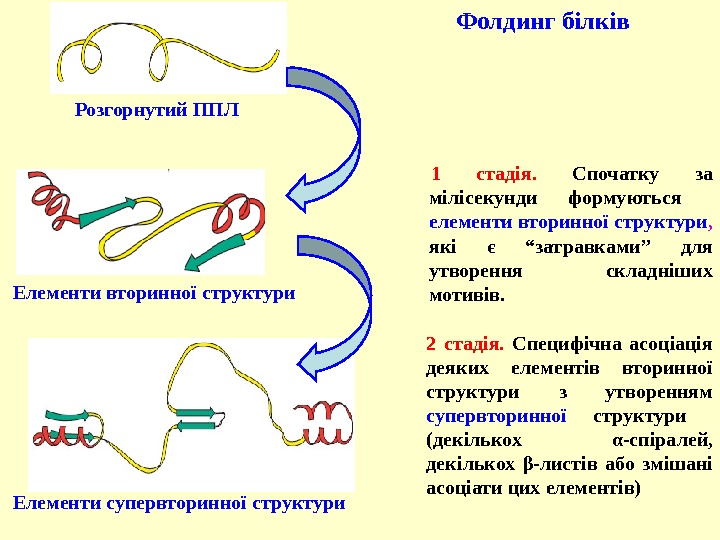
 1 стадія. Спочатку за мілісекунди формуються елементи вторинної структури , які є “затравками” для утворення складніших мотивів. 2 стадія. Специфічна асоціація деяких елементів вторинної структури з утворенням супервторинної структури (декількох α -спіралей, декількох β -листів або змішані асоціати цих елементів) Фолдинг білків Розгорнутий ППЛ Елементи вторинної структури Елементи супервторинної структури
1 стадія. Спочатку за мілісекунди формуються елементи вторинної структури , які є “затравками” для утворення складніших мотивів. 2 стадія. Специфічна асоціація деяких елементів вторинної структури з утворенням супервторинної структури (декількох α -спіралей, декількох β -листів або змішані асоціати цих елементів) Фолдинг білків Розгорнутий ППЛ Елементи вторинної структури Елементи супервторинної структури
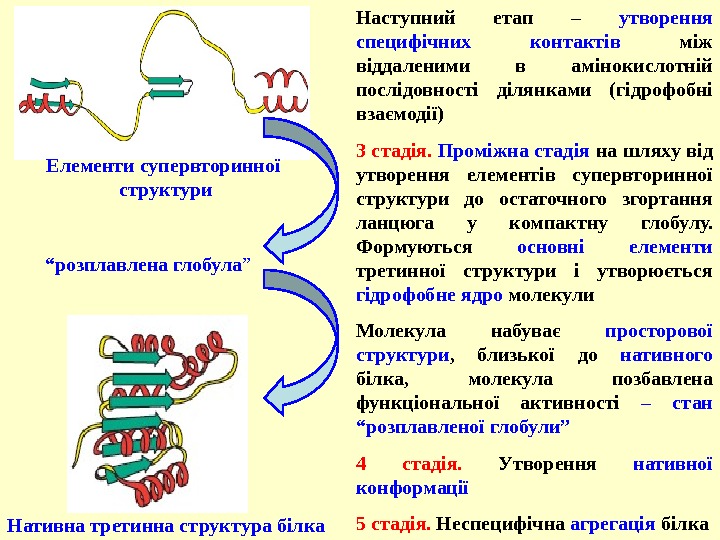
 3 стадія. Проміжна стадія на шляху від утворення елементів супервторинної структури до остаточного згортання ланцюга у компактну глобулу. Формуються основні елементи третинної структури і утворюється гідрофобне ядро молекули Молекула набуває просторової структури , близької до нативного білка, молекула позбавлена функціональної активності – стан “розплавленої глобули” 4 стадія. Утворення нативної конформації 5 стадія. Неспецифічна агрегація білка Нативна третинна структура білка Наступний етап – утворення специфічних контактів між віддаленими в амінокислотній послідовності ділянками (гідрофобні взаємодії) “ розплавлена глобула ”Елементи супервторинної структури
3 стадія. Проміжна стадія на шляху від утворення елементів супервторинної структури до остаточного згортання ланцюга у компактну глобулу. Формуються основні елементи третинної структури і утворюється гідрофобне ядро молекули Молекула набуває просторової структури , близької до нативного білка, молекула позбавлена функціональної активності – стан “розплавленої глобули” 4 стадія. Утворення нативної конформації 5 стадія. Неспецифічна агрегація білка Нативна третинна структура білка Наступний етап – утворення специфічних контактів між віддаленими в амінокислотній послідовності ділянками (гідрофобні взаємодії) “ розплавлена глобула ”Елементи супервторинної структури
 а) перша група – білки з каталітичною активністю, тобто ферменти фолдингу, або фолдази б) друга група – молекулярні шаперони – білки з різними механізмами дії, яких об ’ єднує те, що вони: — потрібні у кількостях, близьких до стехіометричних, тобто які можна порівняти за величиною з концентрацією білків, що згортаються — не входять до складу кінцевих продуктів фолдингу Фактори фолдингу
а) перша група – білки з каталітичною активністю, тобто ферменти фолдингу, або фолдази б) друга група – молекулярні шаперони – білки з різними механізмами дії, яких об ’ єднує те, що вони: — потрібні у кількостях, близьких до стехіометричних, тобто які можна порівняти за величиною з концентрацією білків, що згортаються — не входять до складу кінцевих продуктів фолдингу Фактори фолдингу
 Ферменти фолдингу: Протеїндисульфідізомераза (ПДІ) – каталізує переміщення в білках дисульфідних зв ’ язків Лабілізація (або ізомеризація) дисульфідних зв ’ язків у білку, що формується, дає йому можливість шляхом випадкового підбору знайти таку комбінацію цих зв ’ язків, якій би відповідала енергетично найбільш оптимальна просторова структура Потреба в каталітичній активності ПДІ визначається не розміром білка, а кількістю в ньому дисульфідних містків
Ферменти фолдингу: Протеїндисульфідізомераза (ПДІ) – каталізує переміщення в білках дисульфідних зв ’ язків Лабілізація (або ізомеризація) дисульфідних зв ’ язків у білку, що формується, дає йому можливість шляхом випадкового підбору знайти таку комбінацію цих зв ’ язків, якій би відповідала енергетично найбільш оптимальна просторова структура Потреба в каталітичній активності ПДІ визначається не розміром білка, а кількістю в ньому дисульфідних містків
 Ферменти фолдингу У місці знаходження проліну в поліпептидному ланцюзі утворюється вигин Пептидилпролілізомераза каталізує зворотній перехід радикалів в ділянці пептидного зв ’ язку проліна з транс- у цис-конфігурацію (коли обидва радикали опиняються із зовнішнього боку вигину) Цис-конформація в низці випадків більш вигідна. Залишок АК Залишок проліну Пептидипроліл ізомераза. Транс-конфігурація Цис-конфігурація
Ферменти фолдингу У місці знаходження проліну в поліпептидному ланцюзі утворюється вигин Пептидилпролілізомераза каталізує зворотній перехід радикалів в ділянці пептидного зв ’ язку проліна з транс- у цис-конфігурацію (коли обидва радикали опиняються із зовнішнього боку вигину) Цис-конформація в низці випадків більш вигідна. Залишок АК Залишок проліну Пептидипроліл ізомераза. Транс-конфігурація Цис-конфігурація
 Функції шаперонів : 1. Забезпечення вірного фолдингу новоутворених білків: а) запобігання агрегації нових білків б) запобігання “невірним” внутрішнім (в межах пептидного ланцюга) взаємодіям в) лабілізація “невірних” слабких зв ’ язків 2. Контроль за рефолдингом 3. Участь в деяких видах внутрішньоклітинного транспорту білків – запобігання передчасному фолдингу 4. Підтримка низки білків в певній конформації, у стані ніби незавершеного фолдингу
Функції шаперонів : 1. Забезпечення вірного фолдингу новоутворених білків: а) запобігання агрегації нових білків б) запобігання “невірним” внутрішнім (в межах пептидного ланцюга) взаємодіям в) лабілізація “невірних” слабких зв ’ язків 2. Контроль за рефолдингом 3. Участь в деяких видах внутрішньоклітинного транспорту білків – запобігання передчасному фолдингу 4. Підтримка низки білків в певній конформації, у стані ніби незавершеного фолдингу
 Вперше термін “молекулярний шаперон” був запропонований у 1978 р. для характеристики функції ядерного білка нуклеоплазміна , який забезпечував коректність взаємодії білків-гістонів з ДНК у процесі формування функціонально активних нуклеосом в ооцитах амфібій. Шаперони – білки які забезпечують механізми створення рівноважних умов поступового пошуку нативної структури та захист від агрегації (від фр. chaperon – капюшон) Шаперони не визначають ані нативну структуру білка, ані шлях її укладання. Головна функція — забезпечити умови для швидкого пошуку нативної конформації Отже, молекулярні шаперони є основними компонентами системи контроля якості клітинного протеома Функції шаперонів
Вперше термін “молекулярний шаперон” був запропонований у 1978 р. для характеристики функції ядерного білка нуклеоплазміна , який забезпечував коректність взаємодії білків-гістонів з ДНК у процесі формування функціонально активних нуклеосом в ооцитах амфібій. Шаперони – білки які забезпечують механізми створення рівноважних умов поступового пошуку нативної структури та захист від агрегації (від фр. chaperon – капюшон) Шаперони не визначають ані нативну структуру білка, ані шлях її укладання. Головна функція — забезпечити умови для швидкого пошуку нативної конформації Отже, молекулярні шаперони є основними компонентами системи контроля якості клітинного протеома Функції шаперонів
 Класифікація шаперонів ( Hsp ) Відповідно до молекулярної маси всі шаперони поділяють на 6 основних груп: • високомолекулярні, з молекулярною масою від 100 до 110 к. Да; • Hsp 90 — з молекулярною масою від 83 до 90 к. Да; • Hsp 70 — з молекулярною масою від 66 до 78 к. Да; • Hsp 60; • Hsp 40; • низькомолекулярні шаперони з молекулярною масою від 15 до 30 к. Д. Шаперони поділяють на: конститутивні (високий базальний синтез яких не залежить від стресових впливів на клітини організму) та індуцибельні , синтез яких за нормальних умов відбувається на низькому рівні, але за стресових умов стрімко зростає. Функції шаперонів
Класифікація шаперонів ( Hsp ) Відповідно до молекулярної маси всі шаперони поділяють на 6 основних груп: • високомолекулярні, з молекулярною масою від 100 до 110 к. Да; • Hsp 90 — з молекулярною масою від 83 до 90 к. Да; • Hsp 70 — з молекулярною масою від 66 до 78 к. Да; • Hsp 60; • Hsp 40; • низькомолекулярні шаперони з молекулярною масою від 15 до 30 к. Д. Шаперони поділяють на: конститутивні (високий базальний синтез яких не залежить від стресових впливів на клітини організму) та індуцибельні , синтез яких за нормальних умов відбувається на низькому рівні, але за стресових умов стрімко зростає. Функції шаперонів
 Основні родини молекулярних шаперонів: Переважно це білки теплового шоку (heat shock proteins, Hsps), які належать до висококонсервативних родин: Білки, які мають АТР-азну активність — Hsp 100, Hsp 90, Hsp 70, Hsp 60 Н е-АТР-азні малі білки теплового шоку (small Hsps, s. Hsps, мол. маси 12– 43 к. Да) Зв ’ язаний з рибосомою тригер-фактор (trigger factor, TF) – має водночас шаперонову і пептидил-цис-транс-ізомеразну активність, локалізується у ділянці виходу зростаючого поліпептидного ланцюга з рибосомного тунеля, разом з великою субодиницею рибосоми забезпечує його котрансляційне згортання. Представлені: в цитозолі, ЕПР, мітохондрійях, хлоропластах Основою функціонування шаперонів слугує різниця спорідненості їх АТФ- і АДФ-вмісних форм до білків-мішеней Свою функцію шаперони реалізують разом з кошаперонами та іншими спеціалізованими білками
Основні родини молекулярних шаперонів: Переважно це білки теплового шоку (heat shock proteins, Hsps), які належать до висококонсервативних родин: Білки, які мають АТР-азну активність — Hsp 100, Hsp 90, Hsp 70, Hsp 60 Н е-АТР-азні малі білки теплового шоку (small Hsps, s. Hsps, мол. маси 12– 43 к. Да) Зв ’ язаний з рибосомою тригер-фактор (trigger factor, TF) – має водночас шаперонову і пептидил-цис-транс-ізомеразну активність, локалізується у ділянці виходу зростаючого поліпептидного ланцюга з рибосомного тунеля, разом з великою субодиницею рибосоми забезпечує його котрансляційне згортання. Представлені: в цитозолі, ЕПР, мітохондрійях, хлоропластах Основою функціонування шаперонів слугує різниця спорідненості їх АТФ- і АДФ-вмісних форм до білків-мішеней Свою функцію шаперони реалізують разом з кошаперонами та іншими спеціалізованими білками
 Захист реакційно-здатних бічних груп новосинтезованих поліпептидних ланцюгів родиною шаперонів Hsp 70. У період синтезу білка на рибосомі захист реакційно-здатних радикалів (особливо гідрофобних) здійснює Hsp 70, високо — консервативний клас білків, наявний у всіх відділах клітини: цитоплазмі, ядрі, ЕР, мітохондріях. Функції шаперонів
Захист реакційно-здатних бічних груп новосинтезованих поліпептидних ланцюгів родиною шаперонів Hsp 70. У період синтезу білка на рибосомі захист реакційно-здатних радикалів (особливо гідрофобних) здійснює Hsp 70, високо — консервативний клас білків, наявний у всіх відділах клітини: цитоплазмі, ядрі, ЕР, мітохондріях. Функції шаперонів
 Структура шаперонового комплексу Hsp 60, який складається з 14 білкових молекул Фолдинг багатьох високо-молекулярних білків, які мають складну конформацію (наприклад, доменну будову), здійснюється в спеціальному просторі, сформованому Hsp 60. Білок зв’язується з гідрофобними радикалами апікального домену Hsp 60. У специфічному середовищі, в ізоляції від інших молекул клітини формується найбільш енергетично вигідна конформація білка. Функції шаперонів
Структура шаперонового комплексу Hsp 60, який складається з 14 білкових молекул Фолдинг багатьох високо-молекулярних білків, які мають складну конформацію (наприклад, доменну будову), здійснюється в спеціальному просторі, сформованому Hsp 60. Білок зв’язується з гідрофобними радикалами апікального домену Hsp 60. У специфічному середовищі, в ізоляції від інших молекул клітини формується найбільш енергетично вигідна конформація білка. Функції шаперонів
