03.ppt
- Количество слайдов: 38
 Токсикологічна хімія з клінічною токсикологією Лекція № 3 Тема: Група „летких” отрут. Токсикологічна характеристика, методи виділення з біологічного матеріалу та методи аналізу групи речовин, які ізолюються шляхом дистиляції. Лектор – Чорнокнижний С. І.
Токсикологічна хімія з клінічною токсикологією Лекція № 3 Тема: Група „летких” отрут. Токсикологічна характеристика, методи виділення з біологічного матеріалу та методи аналізу групи речовин, які ізолюються шляхом дистиляції. Лектор – Чорнокнижний С. І.
 2 Класифікація отрут Класифікація хімічних речовин за методами їх ізолювання: 1. Група речовин, що ізолюються дистиляцією з водяною парою «Леткі отрути» 2. Група речовин, що ізолюються мінералізацією - «Металеві отрути» ) 3. Група речовин, що ізолюються екстракцією полярними розчинниками - Лікарські речовини, Наркотичні засоби 4. Група речовин, що ізолюються екстракцією органічними розчинниками – Пестициди 5. Группа речовин, що ізолюються екстракцією (настоюванням) з водою і наступним діалізом - Кислоти, Луги, Солі 6. Група речовин, що потребують особливих методів ізолювання Сполуки фтору 7. Группа речовин, які не потребують особливих методів ізолювання Оксид вуглецю
2 Класифікація отрут Класифікація хімічних речовин за методами їх ізолювання: 1. Група речовин, що ізолюються дистиляцією з водяною парою «Леткі отрути» 2. Група речовин, що ізолюються мінералізацією - «Металеві отрути» ) 3. Група речовин, що ізолюються екстракцією полярними розчинниками - Лікарські речовини, Наркотичні засоби 4. Група речовин, що ізолюються екстракцією органічними розчинниками – Пестициди 5. Группа речовин, що ізолюються екстракцією (настоюванням) з водою і наступним діалізом - Кислоти, Луги, Солі 6. Група речовин, що потребують особливих методів ізолювання Сполуки фтору 7. Группа речовин, які не потребують особливих методів ізолювання Оксид вуглецю
 3 Перегонка з водяною парою Метод перегонки з водяною парою застосовується в для розділення і очищення деяких сполук, які розкладаються при високій температурі. При перегонці з водяною парою знижується температура кипіння сполук і усувається небезпека їх термічного розкладання. За допомогою цього методу проводиться ізолювання великої групи отруйних і сильнодіючих речовин з біологічного матеріалу. До цієї групи речовин належать представники різних класів хімічних сполук: синильна кислота, деякі спирти аліфатичного ряду, альдегіди, кетони, карболової кислоти, галогенопохідні вуглеводнів аліфатичного ряду, бензол, феноли аміно-і нітропохідних ароматичного ряду і деякі інші речовини.
3 Перегонка з водяною парою Метод перегонки з водяною парою застосовується в для розділення і очищення деяких сполук, які розкладаються при високій температурі. При перегонці з водяною парою знижується температура кипіння сполук і усувається небезпека їх термічного розкладання. За допомогою цього методу проводиться ізолювання великої групи отруйних і сильнодіючих речовин з біологічного матеріалу. До цієї групи речовин належать представники різних класів хімічних сполук: синильна кислота, деякі спирти аліфатичного ряду, альдегіди, кетони, карболової кислоти, галогенопохідні вуглеводнів аліфатичного ряду, бензол, феноли аміно-і нітропохідних ароматичного ряду і деякі інші речовини.
 Апарати для перегонки з водяною парою В хіміко-токсикологічних лабораторіях для перегонки отруйних і сильнодіючих речовин з водяною парою застосовують спеціальний апарат. Цей апарат складається з пароутворювача 1, колби для перегонки 2, холодильника 3, приймача 4 і водяної бані 5. 4
Апарати для перегонки з водяною парою В хіміко-токсикологічних лабораторіях для перегонки отруйних і сильнодіючих речовин з водяною парою застосовують спеціальний апарат. Цей апарат складається з пароутворювача 1, колби для перегонки 2, холодильника 3, приймача 4 і водяної бані 5. 4
 Вплив p. H на перегонку з водяним паром 5 Речовини, переганяється з водяною парою, належать до різних класів хімічних сполук. За хімічними властивостями їх можна підрозділити на речовини кислого, основного та нейтрального характеру. Речовини кислого характеру переганяються з водяною парою з кислого середовища. Речовини основного характеру переганяються з лужного і частково з слабокислого середовища. Речовини нейтрального характеру переганяються як з кислого, так і з лужного середовища. Причому деякі речовини нейтрального характеру переганяються з лужного середовища у більших кількостях, ніж з кислого середовища. Амфотерні сполуки переганяються з водяною парою з кислого і лужного середовища аналогічно речовинам нейтрального характеру. Амфотарні сполуки в максимальних кількостях переганяються при р. Н, відповідному ізоелектричної точці цих сполук
Вплив p. H на перегонку з водяним паром 5 Речовини, переганяється з водяною парою, належать до різних класів хімічних сполук. За хімічними властивостями їх можна підрозділити на речовини кислого, основного та нейтрального характеру. Речовини кислого характеру переганяються з водяною парою з кислого середовища. Речовини основного характеру переганяються з лужного і частково з слабокислого середовища. Речовини нейтрального характеру переганяються як з кислого, так і з лужного середовища. Причому деякі речовини нейтрального характеру переганяються з лужного середовища у більших кількостях, ніж з кислого середовища. Амфотерні сполуки переганяються з водяною парою з кислого і лужного середовища аналогічно речовинам нейтрального характеру. Амфотарні сполуки в максимальних кількостях переганяються при р. Н, відповідному ізоелектричної точці цих сполук
 Вплив p. H на перегонку з водяним паром Для підкислення біологічного матеріалу перед перегонкою з нього летких отрут з водяною парою, застосовують щавлеву чи винну кислоту. Застосування для цієї мети сильних мінеральних кислот у більшості випадків є небажаним. При підкисленні біологічного матеріалу мінеральними кислотами з водяною парою переганяється фенол, який надійшов в організм ззовні і викликав отруєння, а також фенол, що утворився в кишках (в результаті розкладання білкових речовин їжі), а потім вступив в реакцію кон'югації із сульфатами. Якщо біологічний матеріал підкислити щавлевою або винною кислотою, то розкладання кон'югата фенолу з сульфатами не відбудеться, а переганятися буде тільки фенол, що надійшов в організм ззовні і викликав отруєння. 6
Вплив p. H на перегонку з водяним паром Для підкислення біологічного матеріалу перед перегонкою з нього летких отрут з водяною парою, застосовують щавлеву чи винну кислоту. Застосування для цієї мети сильних мінеральних кислот у більшості випадків є небажаним. При підкисленні біологічного матеріалу мінеральними кислотами з водяною парою переганяється фенол, який надійшов в організм ззовні і викликав отруєння, а також фенол, що утворився в кишках (в результаті розкладання білкових речовин їжі), а потім вступив в реакцію кон'югації із сульфатами. Якщо біологічний матеріал підкислити щавлевою або винною кислотою, то розкладання кон'югата фенолу з сульфатами не відбудеться, а переганятися буде тільки фенол, що надійшов в організм ззовні і викликав отруєння. 6
 Вплив p. H на перегонку з водяним паром Синильна кислота і її солі під впливом мінеральних кислот можуть розкладатися з утворенням мурашиної кислоти. HCN + 2 Н 2 О + Н+ → НСООН + NH 4+ Мінеральні (фосфорну або сірчану) кислоти застосовують для підкислення біологічного матеріалу, досліджуваного на наявність оцтової кислоти, яка відносно добре дисоціює на іони і тільки в незначній кількості переганяється з водяною парою. При підкисленні біологічного матеріалу мінеральними кислотами пригнічується дисоціація оцтової кислоти, яка переходить в недисоційовний стан і добре переганяється з водяною парою. СН 3 СООН ←→ Н+ + СН 3 СОО- 7
Вплив p. H на перегонку з водяним паром Синильна кислота і її солі під впливом мінеральних кислот можуть розкладатися з утворенням мурашиної кислоти. HCN + 2 Н 2 О + Н+ → НСООН + NH 4+ Мінеральні (фосфорну або сірчану) кислоти застосовують для підкислення біологічного матеріалу, досліджуваного на наявність оцтової кислоти, яка відносно добре дисоціює на іони і тільки в незначній кількості переганяється з водяною парою. При підкисленні біологічного матеріалу мінеральними кислотами пригнічується дисоціація оцтової кислоти, яка переходить в недисоційовний стан і добре переганяється з водяною парою. СН 3 СООН ←→ Н+ + СН 3 СОО- 7
 Перегонка з біологічного матеріалу 100 г біологічного матеріалу ретельно подрібнюють ножицями, вносять в круглодонную колбу апарата для перегонки з водяною парою, додають воду до отримання кашкоподібної маси, яку підкислюють насиченим водним розчином щавлевої або винної кислоти до р. Н = 2 - 2, 5 (вміст колби для перегонки не повинно перевищувати 1/3 її обсягу). Першу порцію дистиляту в кількості 3 мл збирають у приймач, що містить 2 -3 мл 2%-го розчину гідроксиду натрію. При цьому кінець алонжа повинен бути занурений у зазначений розчин лугу. Потім в конічні колби місткістю 50 мл збирають 2 порції дистиляту по 25 мл. 8
Перегонка з біологічного матеріалу 100 г біологічного матеріалу ретельно подрібнюють ножицями, вносять в круглодонную колбу апарата для перегонки з водяною парою, додають воду до отримання кашкоподібної маси, яку підкислюють насиченим водним розчином щавлевої або винної кислоти до р. Н = 2 - 2, 5 (вміст колби для перегонки не повинно перевищувати 1/3 її обсягу). Першу порцію дистиляту в кількості 3 мл збирають у приймач, що містить 2 -3 мл 2%-го розчину гідроксиду натрію. При цьому кінець алонжа повинен бути занурений у зазначений розчин лугу. Потім в конічні колби місткістю 50 мл збирають 2 порції дистиляту по 25 мл. 8
 Перегонка з біологічного матеріалу Зібраний в розчин лугу дистилят (перший дистилят) використовують для виявлення в ньому ціанідів. Другий дистилят досліджують на вміст хлорвмісних вуглеводнів (хлороформ, чотирихлористий вуглець, дихлоретан та хлоралгідрат) В третьому дистиляті виявляють спирти (етиловий, метиловий, ізоаміловий, етиленгліколь), альдегіди та кетони (формальдегід, ацетон), ароматичні сполуки (бензол, фенол, анілін, толуол), кислоти (оцтова). Якщо в обох дистилятах реакції на відповідні речовини позитивні, то перегонку продовжують до тих пір, поки реакції дистилятів на ці речовини будуть негативними. 9
Перегонка з біологічного матеріалу Зібраний в розчин лугу дистилят (перший дистилят) використовують для виявлення в ньому ціанідів. Другий дистилят досліджують на вміст хлорвмісних вуглеводнів (хлороформ, чотирихлористий вуглець, дихлоретан та хлоралгідрат) В третьому дистиляті виявляють спирти (етиловий, метиловий, ізоаміловий, етиленгліколь), альдегіди та кетони (формальдегід, ацетон), ароматичні сполуки (бензол, фенол, анілін, толуол), кислоти (оцтова). Якщо в обох дистилятах реакції на відповідні речовини позитивні, то перегонку продовжують до тих пір, поки реакції дистилятів на ці речовини будуть негативними. 9
 10 Синільна кислота Синильна кислота (HCN) - газ або безбарвна рідина (т. кип. 25, 6°С, т. пл. - 13, 3°С, щільність 0, 699), має запах гіркого мигдалю, легко змішується з водою і з рядом органічних розчинників. Вона зустрічається у вигляді хімічних сполук - глікозидів (амігдалин, пруназин, дуррин та ін. ) Амігдалин міститься в насінні гіркого мигдалю, кісточках персиків, абрикосів, слив, вишень, в листі лавровишні і ін. Пруназин міститься в пенсільванською вишні, а дуррін - в просі. Синильна кислота пригнічує внутрішньоклітинні залізовмісні дихальні ферменти. При пригніченні цитохромоксидази синильною кислотою клітини організму не засвоюють кисень, що надходить із кров'ю. В результаті цього наступає клітинне кисневе голодування, незважаючи на те, що кров насичена киснем. Ціаніди також можуть блокувати гемоглобін крові, порушуючи його функції.
10 Синільна кислота Синильна кислота (HCN) - газ або безбарвна рідина (т. кип. 25, 6°С, т. пл. - 13, 3°С, щільність 0, 699), має запах гіркого мигдалю, легко змішується з водою і з рядом органічних розчинників. Вона зустрічається у вигляді хімічних сполук - глікозидів (амігдалин, пруназин, дуррин та ін. ) Амігдалин міститься в насінні гіркого мигдалю, кісточках персиків, абрикосів, слив, вишень, в листі лавровишні і ін. Пруназин міститься в пенсільванською вишні, а дуррін - в просі. Синильна кислота пригнічує внутрішньоклітинні залізовмісні дихальні ферменти. При пригніченні цитохромоксидази синильною кислотою клітини організму не засвоюють кисень, що надходить із кров'ю. В результаті цього наступає клітинне кисневе голодування, незважаючи на те, що кров насичена киснем. Ціаніди також можуть блокувати гемоглобін крові, порушуючи його функції.
 11 Синільна кислота Для виявлення синильної кислоти в дистилятах застосовують кілька реакцій, з яких найбільш доказовою є реакція утворення берлінської лазурі. Інші описані нижче реакції використовують як допоміжні. Реакція утворення берлінської лазурі. При додаванні сульфату заліза (II) до лужного розчину ціанідів, утворюється ціанід заліза (II), який при взаємодії з надлишком ціанідів, а потім з сульфатом або хлоридом заліза (III) утворює берлінську блакить (синій осад або синє забарвлення): Реакція з пікриновою кислотою. При додаванні пікринової кислоти і луги до ціаніду утворюється сіль ізопурпурової кислоти, що має червоне забарвлення.
11 Синільна кислота Для виявлення синильної кислоти в дистилятах застосовують кілька реакцій, з яких найбільш доказовою є реакція утворення берлінської лазурі. Інші описані нижче реакції використовують як допоміжні. Реакція утворення берлінської лазурі. При додаванні сульфату заліза (II) до лужного розчину ціанідів, утворюється ціанід заліза (II), який при взаємодії з надлишком ціанідів, а потім з сульфатом або хлоридом заліза (III) утворює берлінську блакить (синій осад або синє забарвлення): Реакція з пікриновою кислотою. При додаванні пікринової кислоти і луги до ціаніду утворюється сіль ізопурпурової кислоти, що має червоне забарвлення.
 12 Синільна кислота Реакція утворення роданиду заліза. При нагріванні ціанідів з розчином полісульфіду амонію утворюється роданид, від додавання до якого розчину хлориду заліза (ІІІ) з'являється криваво-червоне забарвлення: Реакція утворення бензидинової сині. Солі міді (II) з ціанідами утворюють диціан (CN)2, при взаємодії якого з водою виділяється кисень, що окисляє бензидин. Продуктом окислення бензидину є бензидинова синь:
12 Синільна кислота Реакція утворення роданиду заліза. При нагріванні ціанідів з розчином полісульфіду амонію утворюється роданид, від додавання до якого розчину хлориду заліза (ІІІ) з'являється криваво-червоне забарвлення: Реакція утворення бензидинової сині. Солі міді (II) з ціанідами утворюють диціан (CN)2, при взаємодії якого з водою виділяється кисень, що окисляє бензидин. Продуктом окислення бензидину є бензидинова синь:
 13 Формальдегід (альдегід мурашиної кислоти) - газ, добре розчинний у воді, що володіє гострим специфічним запахом. Водний розчин, що містить 36, 5 -37, 5% формальдегіду, називається формаліном. При попаданні формальдегіду в організм через рот можуть наступити некротичні ураження слизової оболонки рота, травного каналу, з'являється слинотеча, нудота, блювота, пронос. Формальдегід пригнічує центральну нервову систему, у результаті цього може відбутися втрата свідомості, з'являються судоми. Під впливом формальдегіду розвиваються дегенеративні ураження печінки, нирок, серця і головного мозку.
13 Формальдегід (альдегід мурашиної кислоти) - газ, добре розчинний у воді, що володіє гострим специфічним запахом. Водний розчин, що містить 36, 5 -37, 5% формальдегіду, називається формаліном. При попаданні формальдегіду в організм через рот можуть наступити некротичні ураження слизової оболонки рота, травного каналу, з'являється слинотеча, нудота, блювота, пронос. Формальдегід пригнічує центральну нервову систему, у результаті цього може відбутися втрата свідомості, з'являються судоми. Під впливом формальдегіду розвиваються дегенеративні ураження печінки, нирок, серця і головного мозку.
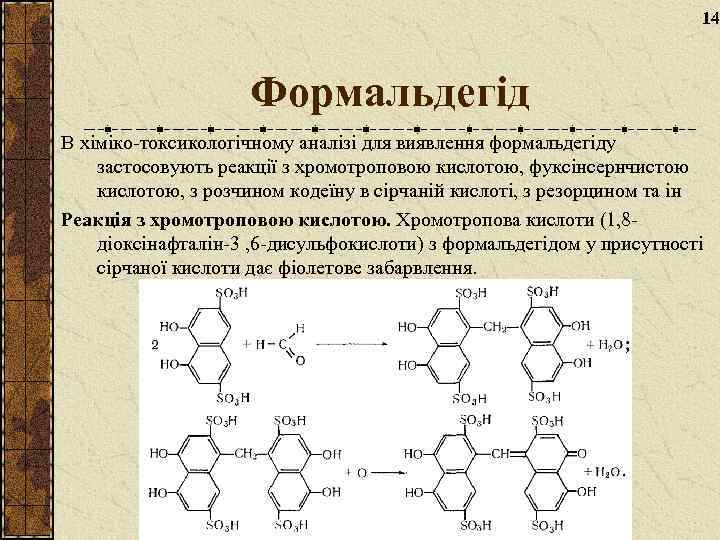 14 Формальдегід В хіміко-токсикологічному аналізі для виявлення формальдегіду застосовують реакції з хромотроповою кислотою, фуксінсернчистою кислотою, з розчином кодеїну в сірчаній кислоті, з резорцином та ін Реакція з хромотроповою кислотою. Хромотропова кислоти (1, 8 діоксінафталін-3 , 6 -дисульфокислоти) з формальдегідом у присутності сірчаної кислоти дає фіолетове забарвлення.
14 Формальдегід В хіміко-токсикологічному аналізі для виявлення формальдегіду застосовують реакції з хромотроповою кислотою, фуксінсернчистою кислотою, з розчином кодеїну в сірчаній кислоті, з резорцином та ін Реакція з хромотроповою кислотою. Хромотропова кислоти (1, 8 діоксінафталін-3 , 6 -дисульфокислоти) з формальдегідом у присутності сірчаної кислоти дає фіолетове забарвлення.
 15 Формальдегід Реакція з кодеїном і сірчаною кислотою. При нагріванні формальдегіду з кодеїном в присутності концентрованої сірчаної кислоти з'являється синє забарвлення. Реакція з метиловим фіолетовим. Метиловий фіолетовий, який аналогічно фуксину попередньо знебарвлений сульфитом натрію, з формальдегідом дає синьо-фіолетове забарвлення. Реакція з фуксінсірчистою кислотою. Фуксінсірчиста кислота (реактив Шиффа) з формальдегідом дає синє або синьо-фіолетове забарвлення. Реакція з резорцином. Альдегіди реагують з резорцином з утворенням забарвлених сполук: Реакція з реактивом Фелінга. При нагріванні реактиву Фелінга з формальдегідом випадає жовтий або червоний осад.
15 Формальдегід Реакція з кодеїном і сірчаною кислотою. При нагріванні формальдегіду з кодеїном в присутності концентрованої сірчаної кислоти з'являється синє забарвлення. Реакція з метиловим фіолетовим. Метиловий фіолетовий, який аналогічно фуксину попередньо знебарвлений сульфитом натрію, з формальдегідом дає синьо-фіолетове забарвлення. Реакція з фуксінсірчистою кислотою. Фуксінсірчиста кислота (реактив Шиффа) з формальдегідом дає синє або синьо-фіолетове забарвлення. Реакція з резорцином. Альдегіди реагують з резорцином з утворенням забарвлених сполук: Реакція з реактивом Фелінга. При нагріванні реактиву Фелінга з формальдегідом випадає жовтий або червоний осад.
 16 Метиловий спирт (метанол) - безбарвна рідина (т. кип. 64, 5°С, щільність 0, 79), змішується у всіх співвідношеннях з водою і багатьма органічними розчинниками. Метиловий спирт отруйний, по запаху і смаку майже не відрізняється від етилового. Під впливом метилового спирту відбувається ураження сітківки ока та зорового нерва, а іноді настає невиліковна сліпота. Метиловий спирт порушує окислювальні процеси і кислотнолужну рівновагу в клітинах і тканинах. Внаслідок цього настає ацидоз. Отруєння метиловим спиртом в ряді випадків закінчується смертю. Враховуючи летючість метилового спирту при ізолювання його з біологічного матеріалу шляхом перегонки з водяною парою, приймач для дистиляту необхідно охолоджувати холодною водою або льодом.
16 Метиловий спирт (метанол) - безбарвна рідина (т. кип. 64, 5°С, щільність 0, 79), змішується у всіх співвідношеннях з водою і багатьма органічними розчинниками. Метиловий спирт отруйний, по запаху і смаку майже не відрізняється від етилового. Під впливом метилового спирту відбувається ураження сітківки ока та зорового нерва, а іноді настає невиліковна сліпота. Метиловий спирт порушує окислювальні процеси і кислотнолужну рівновагу в клітинах і тканинах. Внаслідок цього настає ацидоз. Отруєння метиловим спиртом в ряді випадків закінчується смертю. Враховуючи летючість метилового спирту при ізолювання його з біологічного матеріалу шляхом перегонки з водяною парою, приймач для дистиляту необхідно охолоджувати холодною водою або льодом.
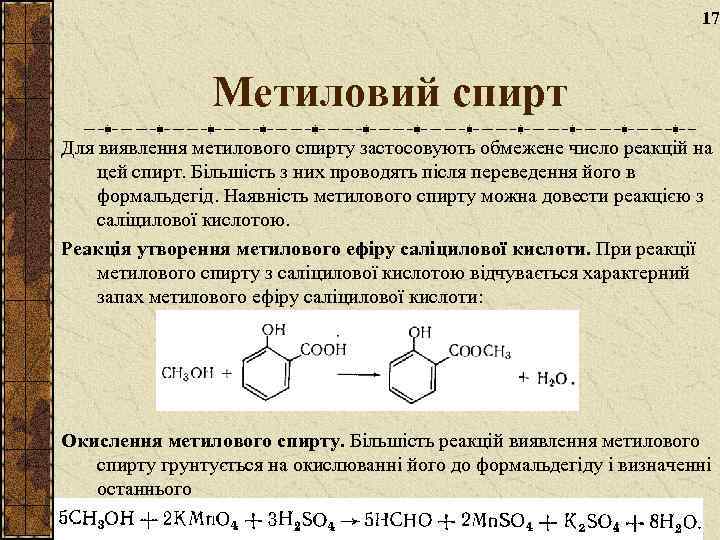 17 Метиловий спирт Для виявлення метилового спирту застосовують обмежене число реакцій на цей спирт. Більшість з них проводять після переведення його в формальдегід. Наявність метилового спирту можна довести реакцією з саліцилової кислотою. Реакція утворення метилового ефіру саліцилової кислоти. При реакції метилового спирту з саліцилової кислотою відчувається характерний запах метилового ефіру саліцилової кислоти: Окислення метилового спирту. Більшість реакцій виявлення метилового спирту грунтується на окислюванні його до формальдегіду і визначенні останнього
17 Метиловий спирт Для виявлення метилового спирту застосовують обмежене число реакцій на цей спирт. Більшість з них проводять після переведення його в формальдегід. Наявність метилового спирту можна довести реакцією з саліцилової кислотою. Реакція утворення метилового ефіру саліцилової кислоти. При реакції метилового спирту з саліцилової кислотою відчувається характерний запах метилового ефіру саліцилової кислоти: Окислення метилового спирту. Більшість реакцій виявлення метилового спирту грунтується на окислюванні його до формальдегіду і визначенні останнього
 18 Етиловий спирт С 2 Н 5 ОН (етанол, етиловий алкоголь, винний спирт) - безбарвна, летюча рідина з характерним запахом, пекуча на смак (густина 0, 813 -0, 816, т. кип. 77 -77, 5°С). Етиловий спирт діє на кору головного мозку. При цьому настає сп'яніння з характерним алкогольним «збудженням» . У великих дозах етиловий спирт викликає пригнічення функцій як спинного, так і довгастого мозку. При цьому може наступити стан тривалого глибокого наркозу з втратою рефлексів і пригніченням життєво важливих центрів. Під впливом етилового спирту може наступити смерть внаслідок паралічу дихального центру.
18 Етиловий спирт С 2 Н 5 ОН (етанол, етиловий алкоголь, винний спирт) - безбарвна, летюча рідина з характерним запахом, пекуча на смак (густина 0, 813 -0, 816, т. кип. 77 -77, 5°С). Етиловий спирт діє на кору головного мозку. При цьому настає сп'яніння з характерним алкогольним «збудженням» . У великих дозах етиловий спирт викликає пригнічення функцій як спинного, так і довгастого мозку. При цьому може наступити стан тривалого глибокого наркозу з втратою рефлексів і пригніченням життєво важливих центрів. Під впливом етилового спирту може наступити смерть внаслідок паралічу дихального центру.
 19 Етиловий спирт Реакція утворення йодоформу. При нагріванні етилового спирту з розчином йоду і лугом утворюється йодоформ (CHJ 3), що має специфічний запах: Реакція утворення оцтово-етилового ефіру. Етиловий спирт з ацетатом натрію в присутності сірчаної кислоти утворює оцтово-етиловий ефір, який має характерний запах: Реакція утворення ацетальдегіду. Етиловий спирт окислюється дихроматом калію, перманганатом калію і деякими іншими окислювачами до ацетальдегіду (специфічний запах):
19 Етиловий спирт Реакція утворення йодоформу. При нагріванні етилового спирту з розчином йоду і лугом утворюється йодоформ (CHJ 3), що має специфічний запах: Реакція утворення оцтово-етилового ефіру. Етиловий спирт з ацетатом натрію в присутності сірчаної кислоти утворює оцтово-етиловий ефір, який має характерний запах: Реакція утворення ацетальдегіду. Етиловий спирт окислюється дихроматом калію, перманганатом калію і деякими іншими окислювачами до ацетальдегіду (специфічний запах):
 20 Ацетон СН 3 -СО-СН 3 (диметилкетон, пропанон) - безбарвна рухлива рідина (т. кіп. 56, 3°С) з характерним запахом. Ацетон широко використовується в промисловості як розчинник для вилучення ряду речовин, для перекристалізації хімічних сполук, хімічного чищення, отримання хлороформу і т. д. Пари ацетону важчі за повітря. Тому в приміщеннях, в яких відбувається випаровування ацетону, створюється небезпека отруєння при вдиханні його парів. За фармакологічними властивостями ацетон відноситься до числа речовин, що проявляють наркотичну дію. Він володіє кумулятивними властивостями. Ацетон повільно виводиться з організму. При укладенні про отруєння ацетоном слід мати на увазі, що певна кількість його може бути в крові і в сечі осіб, які страждають на діабет і деякими іншими захворюваннями. Крім цього, ацетон є
20 Ацетон СН 3 -СО-СН 3 (диметилкетон, пропанон) - безбарвна рухлива рідина (т. кіп. 56, 3°С) з характерним запахом. Ацетон широко використовується в промисловості як розчинник для вилучення ряду речовин, для перекристалізації хімічних сполук, хімічного чищення, отримання хлороформу і т. д. Пари ацетону важчі за повітря. Тому в приміщеннях, в яких відбувається випаровування ацетону, створюється небезпека отруєння при вдиханні його парів. За фармакологічними властивостями ацетон відноситься до числа речовин, що проявляють наркотичну дію. Він володіє кумулятивними властивостями. Ацетон повільно виводиться з організму. При укладенні про отруєння ацетоном слід мати на увазі, що певна кількість його може бути в крові і в сечі осіб, які страждають на діабет і деякими іншими захворюваннями. Крім цього, ацетон є
 21 Ацетон Реакція утворення йодоформу. При взаємодії ацетону з розчином йоду в лужному середовищі утворюється йодоформ (характерний запах): Реакція з нітропрусидом натрію. Ацетон з нітропрусидом натрію в лужному середовищі дає інтенсивно-червоне забарвлення. Реакція з фурфуролом. Ця реакція грунтується на здатності ацетону конденсуватися з фурфуролом з утворенням забарвленої сполуки червоного кольору:
21 Ацетон Реакція утворення йодоформу. При взаємодії ацетону з розчином йоду в лужному середовищі утворюється йодоформ (характерний запах): Реакція з нітропрусидом натрію. Ацетон з нітропрусидом натрію в лужному середовищі дає інтенсивно-червоне забарвлення. Реакція з фурфуролом. Ця реакція грунтується на здатності ацетону конденсуватися з фурфуролом з утворенням забарвленої сполуки червоного кольору:
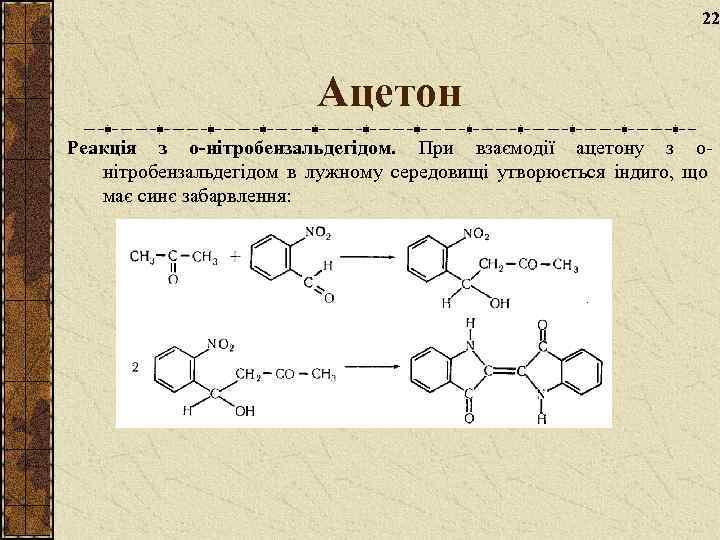 22 Ацетон Реакція з о-нітробензальдегідом. При взаємодії ацетону з онітробензальдегідом в лужному середовищі утворюється індиго, що має синє забарвлення:
22 Ацетон Реакція з о-нітробензальдегідом. При взаємодії ацетону з онітробензальдегідом в лужному середовищі утворюється індиго, що має синє забарвлення:
 23 Фенол являє собою тонкі довгі голчаті кристали або безбарвна кристалічну масу зі своєрідним запахом. На повітрі він поступово рожевіє. Фенол розчиняється у воді в співвідношенні 1: 20, легко розчиняється в етиловому спирті, діетил-ловом ефірі, хлороформі, жирних оліях, розчинах їдких лугів. Фенол застосовується в медичній практиці як дезінфікуючий засіб. Він широко використовується в хімічній промисловості для одержання багатьох хімічних сполук (барвників, пластичних мас, фармацевтичних препаратів, засобів захисту рослин). Фенол всмоктується в кров через слизові оболонки та шкіру, а потім розподіляється в органах і тканинах. Фенол, що надійшов в організм через харчовий канал, викликає болі в шлунку, блювоту, пронос, іноді з домішками крові. Сеча отруєних фенолом оливковий або оливково-чорний колір.
23 Фенол являє собою тонкі довгі голчаті кристали або безбарвна кристалічну масу зі своєрідним запахом. На повітрі він поступово рожевіє. Фенол розчиняється у воді в співвідношенні 1: 20, легко розчиняється в етиловому спирті, діетил-ловом ефірі, хлороформі, жирних оліях, розчинах їдких лугів. Фенол застосовується в медичній практиці як дезінфікуючий засіб. Він широко використовується в хімічній промисловості для одержання багатьох хімічних сполук (барвників, пластичних мас, фармацевтичних препаратів, засобів захисту рослин). Фенол всмоктується в кров через слизові оболонки та шкіру, а потім розподіляється в органах і тканинах. Фенол, що надійшов в організм через харчовий канал, викликає болі в шлунку, блювоту, пронос, іноді з домішками крові. Сеча отруєних фенолом оливковий або оливково-чорний колір.
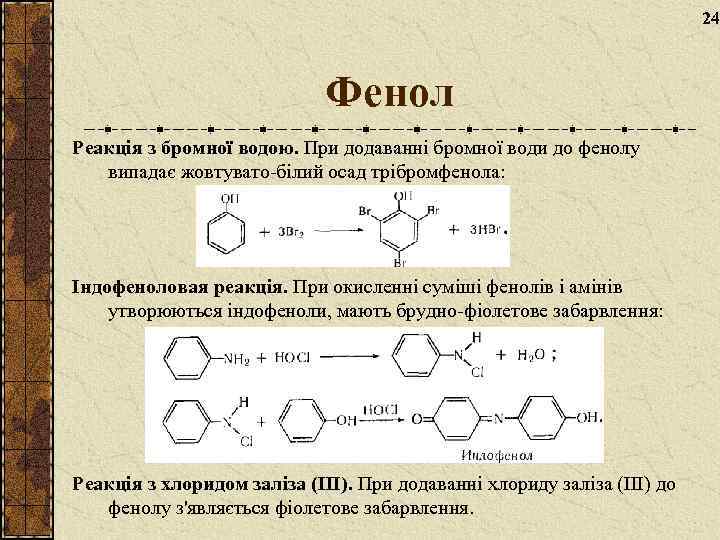 24 Фенол Реакція з бромної водою. При додаванні бромної води до фенолу випадає жовтувато-білий осад трібромфенола: Індофеноловая реакція. При окисленні суміші фенолів і амінів утворюються індофеноли, мають брудно-фіолетове забарвлення: Реакція з хлоридом заліза (III). При додаванні хлориду заліза (III) до фенолу з'являється фіолетове забарвлення.
24 Фенол Реакція з бромної водою. При додаванні бромної води до фенолу випадає жовтувато-білий осад трібромфенола: Індофеноловая реакція. При окисленні суміші фенолів і амінів утворюються індофеноли, мають брудно-фіолетове забарвлення: Реакція з хлоридом заліза (III). При додаванні хлориду заліза (III) до фенолу з'являється фіолетове забарвлення.
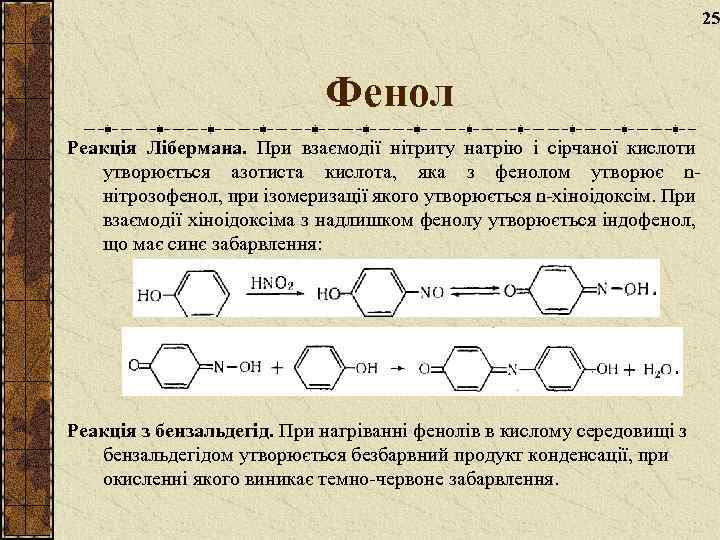 25 Фенол Реакція Лібермана. При взаємодії нітриту натрію і сірчаної кислоти утворюється азотиста кислота, яка з фенолом утворює nнітрозофенол, при ізомеризації якого утворюється n-хіноідоксім. При взаємодії хіноідоксіма з надлишком фенолу утворюється індофенол, що має синє забарвлення: Реакція з бензальдегід. При нагріванні фенолів в кислому середовищі з бензальдегідом утворюється безбарвний продукт конденсації, при окисленні якого виникає темно-червоне забарвлення.
25 Фенол Реакція Лібермана. При взаємодії нітриту натрію і сірчаної кислоти утворюється азотиста кислота, яка з фенолом утворює nнітрозофенол, при ізомеризації якого утворюється n-хіноідоксім. При взаємодії хіноідоксіма з надлишком фенолу утворюється індофенол, що має синє забарвлення: Реакція з бензальдегід. При нагріванні фенолів в кислому середовищі з бензальдегідом утворюється безбарвний продукт конденсації, при окисленні якого виникає темно-червоне забарвлення.
 26 Хлороформ (тріхлорметан) СНCl 3 - безбарвна прозора летюча рідина з характерним запахом. Змішується з діетиловим ефіром, етиловим спиртом і іншими органічними розчинниками, слабо розчиняється у воді. Під впливом світла, повітря, вологи і температури хлороформ поступово розкладається. При цьому можуть утворюватися фосген, мурашина і соляна кислоти. Хлороформ широко використовується в хімічній промисловості та в хімічних лабораторіях як розчинник. Раніше він застосовувався в медицині для наркозу. В даний час хлороформ в суміші з іншими лікарськими препаратами використовується для розтирання. Хлороформ діє на центральну нервову систему, викликаючи наркоз. При великих кількостях хлороформу, що надійшов в організм, можуть з'являтися дистрофічні зміни у внутрішніх органах, особливо в печінці. При отруєнні хлороформом смерть настає від зупинки дихання.
26 Хлороформ (тріхлорметан) СНCl 3 - безбарвна прозора летюча рідина з характерним запахом. Змішується з діетиловим ефіром, етиловим спиртом і іншими органічними розчинниками, слабо розчиняється у воді. Під впливом світла, повітря, вологи і температури хлороформ поступово розкладається. При цьому можуть утворюватися фосген, мурашина і соляна кислоти. Хлороформ широко використовується в хімічній промисловості та в хімічних лабораторіях як розчинник. Раніше він застосовувався в медицині для наркозу. В даний час хлороформ в суміші з іншими лікарськими препаратами використовується для розтирання. Хлороформ діє на центральну нервову систему, викликаючи наркоз. При великих кількостях хлороформу, що надійшов в організм, можуть з'являтися дистрофічні зміни у внутрішніх органах, особливо в печінці. При отруєнні хлороформом смерть настає від зупинки дихання.
 27 Хлоралгідрат - безбарвні кристали або дрібнокристалічний порошок з характерним гострим запахом і злегка гіркуватий, розчиняється у воді, етиловому спирті, діетиловому ефірі і хлороформі. Хлоралгідрат застосовується в медицині як заспокійливий, снодійний і аналгезуючу засіб. У великих дозах хлоралгідрат може викликати отруєння. За токсичного дії хлоралгідрат близький до хлороформу. Він застосовується при психічних збудженнях і як протисудомний засіб при правці, еклампсії і при інших захворюваннях. У певних дозах хлоралгідрат застосовується як снодійний засіб.
27 Хлоралгідрат - безбарвні кристали або дрібнокристалічний порошок з характерним гострим запахом і злегка гіркуватий, розчиняється у воді, етиловому спирті, діетиловому ефірі і хлороформі. Хлоралгідрат застосовується в медицині як заспокійливий, снодійний і аналгезуючу засіб. У великих дозах хлоралгідрат може викликати отруєння. За токсичного дії хлоралгідрат близький до хлороформу. Він застосовується при психічних збудженнях і як протисудомний засіб при правці, еклампсії і при інших захворюваннях. У певних дозах хлоралгідрат застосовується як снодійний засіб.
 28 Чотирихлористий вуглець ССl 4 - прозора рідина зі своєрідним запахом (т. кип. 75 -77 ° С). Він змішується в будь-яких співвідношеннях з ацетоном, бензолом, бензином, сірковуглецем та іншими органічними розчинниками. У воді при 20°С розчиняється близько 0, 01% чотирихлористого вуглецю. Чотирихлористий вуглець не вогненебезпечний, його пари у кілька разів важчий за повітря. Він використовується як консервант при обробці хутра, а також застосовується для видалення жирних плям з одягу. Чотирихлористий вуглець входить до складу рідин для наповнення вогнегасників. Він володіє наркотичною дією, вражає центральну нервову систему. Надходження в організм великих його доз викликає важкі дистрофічні зміни в печінці, нирках, серці та інших органах.
28 Чотирихлористий вуглець ССl 4 - прозора рідина зі своєрідним запахом (т. кип. 75 -77 ° С). Він змішується в будь-яких співвідношеннях з ацетоном, бензолом, бензином, сірковуглецем та іншими органічними розчинниками. У воді при 20°С розчиняється близько 0, 01% чотирихлористого вуглецю. Чотирихлористий вуглець не вогненебезпечний, його пари у кілька разів важчий за повітря. Він використовується як консервант при обробці хутра, а також застосовується для видалення жирних плям з одягу. Чотирихлористий вуглець входить до складу рідин для наповнення вогнегасників. Він володіє наркотичною дією, вражає центральну нервову систему. Надходження в організм великих його доз викликає важкі дистрофічні зміни в печінці, нирках, серці та інших органах.
 29 Дихлоретан Відомі два ізомеру дихлоретан (С 2 Н 4 Сl 2): 1, 1 -дихлоретан і 1, 2 -дихлоретан. 1, 1 -Дихлоретан (хлористий етіліден) СН 3 СНСl 2 - безбарвна рідина (щільність 1, 189), кипляча при 58°С. 1, 2 -Дихлоретан (хлористий етилен) Сl-СН 2 -Сl - рідина (щільність 1, 252), кипляча при 83, 7°С. У промисловості 1, 2 -дихлоретан більш широко використовується, ніж 1, 1 -дихлоретан. 1, 2 -Дихлоретан слабо розчиняється у воді, добре розчиняється у більшості органічних розчинників. Він стійкий до дії кислот і лугів. 1, 2 -Дихлоретан є більш токсичним, ніж 1, 1 -дихлоретан. У промисловості 1, 2 -дихлоретан використовується як розчинник жирів, восків, смол, парафінів та інших речовин. 1, 2 -Дихлоретан використовується для витягання жиру з вовни тварин, для хімчистки одягу. 1, 2 -Дихлоретан викликає ураження центральної нервової системи, печінки, нирок і серцевого м'яза. Після прийому токсичної дози 1, 2 -дихлоретан всередину спостерігаються блювота, пронос, болі в області печінки, здуття живота, уремія.
29 Дихлоретан Відомі два ізомеру дихлоретан (С 2 Н 4 Сl 2): 1, 1 -дихлоретан і 1, 2 -дихлоретан. 1, 1 -Дихлоретан (хлористий етіліден) СН 3 СНСl 2 - безбарвна рідина (щільність 1, 189), кипляча при 58°С. 1, 2 -Дихлоретан (хлористий етилен) Сl-СН 2 -Сl - рідина (щільність 1, 252), кипляча при 83, 7°С. У промисловості 1, 2 -дихлоретан більш широко використовується, ніж 1, 1 -дихлоретан. 1, 2 -Дихлоретан слабо розчиняється у воді, добре розчиняється у більшості органічних розчинників. Він стійкий до дії кислот і лугів. 1, 2 -Дихлоретан є більш токсичним, ніж 1, 1 -дихлоретан. У промисловості 1, 2 -дихлоретан використовується як розчинник жирів, восків, смол, парафінів та інших речовин. 1, 2 -Дихлоретан використовується для витягання жиру з вовни тварин, для хімчистки одягу. 1, 2 -Дихлоретан викликає ураження центральної нервової системи, печінки, нирок і серцевого м'яза. Після прийому токсичної дози 1, 2 -дихлоретан всередину спостерігаються блювота, пронос, болі в області печінки, здуття живота, уремія.
 30 Визначення галогенпохідних Реакція відщеплення хлору. При нагріванні галогенпохідного зі спиртовим розчином лугу відбувається відщеплення атомів хлору, які можна виявити за допомогою реакції з нітратом срібла. Реакцію дають хлороформ, хлоралгідрат, чотирихлористий вуглець і дихлоретан. Реакція утворення ізонітріла. При нагріванні хлороформу з первинними амінами і лугом утворюється ізонітріл (карбіламін), що має неприємний запах. Цю реакцію дають хлороформ, чотирихлористий вуглець і хлоралгідрат. Не дає цієї реакції дихлоретан. Реакція з реактивом Несслера. При взаємодії галогенпохідних з реактивом Несслера виділяється вільна ртуть. Утворюється цегляночервоний осад, який потім стає брудно-зеленою. Цю реакцію дає
30 Визначення галогенпохідних Реакція відщеплення хлору. При нагріванні галогенпохідного зі спиртовим розчином лугу відбувається відщеплення атомів хлору, які можна виявити за допомогою реакції з нітратом срібла. Реакцію дають хлороформ, хлоралгідрат, чотирихлористий вуглець і дихлоретан. Реакція утворення ізонітріла. При нагріванні хлороформу з первинними амінами і лугом утворюється ізонітріл (карбіламін), що має неприємний запах. Цю реакцію дають хлороформ, чотирихлористий вуглець і хлоралгідрат. Не дає цієї реакції дихлоретан. Реакція з реактивом Несслера. При взаємодії галогенпохідних з реактивом Несслера виділяється вільна ртуть. Утворюється цегляночервоний осад, який потім стає брудно-зеленою. Цю реакцію дає
 31 Визначення галогенпохідних Реакція з резорцином. При нагріванні хлороформу з резорцином в присутності лугу з'являється рожева або малиново-червоне забарвлення. Цю реакцію дають хлороформ, чотирихлористий вуглець і хлоралгідрат. Не дає цієї реакції дихлоретан. Реакція з реактивом Фелінга. При взаємодії хлорофора ма з лугом утворюється сіль мурашиної (форміатной) кислоти. Реактив Фелінга, що містить внутрішньокомплексну сполуку K 2 Na 2[Cu(С 4 Н 3 O 6)2], яке утворюється при взаємодії іонів міді (II) з сегнетової сіллю, при нагріванні окислює мурашину кислоту і її солі. У результаті реакції випадає червоного кольору осад оксиду міді (I). Реакцію дають хлороформ і хлоралгідрат. Не дають цієї реакції дихлоретан і чотирихлористий вуглець.
31 Визначення галогенпохідних Реакція з резорцином. При нагріванні хлороформу з резорцином в присутності лугу з'являється рожева або малиново-червоне забарвлення. Цю реакцію дають хлороформ, чотирихлористий вуглець і хлоралгідрат. Не дає цієї реакції дихлоретан. Реакція з реактивом Фелінга. При взаємодії хлорофора ма з лугом утворюється сіль мурашиної (форміатной) кислоти. Реактив Фелінга, що містить внутрішньокомплексну сполуку K 2 Na 2[Cu(С 4 Н 3 O 6)2], яке утворюється при взаємодії іонів міді (II) з сегнетової сіллю, при нагріванні окислює мурашину кислоту і її солі. У результаті реакції випадає червоного кольору осад оксиду міді (I). Реакцію дають хлороформ і хлоралгідрат. Не дають цієї реакції дихлоретан і чотирихлористий вуглець.
 32 Визначення галогенпохідних Реакція Фуджівара. При взаємодії галогенпохідного з піридином і лугом утворюється поліметиновий барвник. При цій реакції спочатку утворюється сіль піридинію. Під впливом лугу сіль піридинію перетворюється в похідне глутаконового альдегіду (I), при гідролізі якого утворюється глутаконовий альдегід (II), що має червоне забарвлення. Реакцію дають хлороформ, хлоралгідрат, чотирихлористий вуглець і дихлоретан.
32 Визначення галогенпохідних Реакція Фуджівара. При взаємодії галогенпохідного з піридином і лугом утворюється поліметиновий барвник. При цій реакції спочатку утворюється сіль піридинію. Під впливом лугу сіль піридинію перетворюється в похідне глутаконового альдегіду (I), при гідролізі якого утворюється глутаконовий альдегід (II), що має червоне забарвлення. Реакцію дають хлороформ, хлоралгідрат, чотирихлористий вуглець і дихлоретан.
 33 Визначення галогенпохідних Реакція з 2, 7 -діоксінафталіном. Галогенопохідні реагують з 2, 7 діоксінафталіном. Реакцію дає чотирихлористий вуглець - з'являється світло-буре забарвлення, що переходить у зелено-жовту і хлороформ темно-червоне забарвлення. Реакція утворення етиленгліколю. При нагріванні галогенпохідного з розчином карбонату натрію в запаяній ампулі утворюється етіленгліколь. При взаємодії етиленгліколю з перйодатом калію КIО 4 утворюється формальдегід. Формальдегід, визначають за допомогою реакцій з хромотроповой або фуксінсірчистою кислотою. Реакцію дає тільки дихлоретан. Реакція утворення ацетиленіда міді. При нагріванні галогенпохідного в запаяній ампулі з розчином гідроксиду натрію утворюється ацетилен, який при взаємодії з солями міді (I) дає ацетиленід міді, що має рожеве або вишнево-червоне забарвлення:
33 Визначення галогенпохідних Реакція з 2, 7 -діоксінафталіном. Галогенопохідні реагують з 2, 7 діоксінафталіном. Реакцію дає чотирихлористий вуглець - з'являється світло-буре забарвлення, що переходить у зелено-жовту і хлороформ темно-червоне забарвлення. Реакція утворення етиленгліколю. При нагріванні галогенпохідного з розчином карбонату натрію в запаяній ампулі утворюється етіленгліколь. При взаємодії етиленгліколю з перйодатом калію КIО 4 утворюється формальдегід. Формальдегід, визначають за допомогою реакцій з хромотроповой або фуксінсірчистою кислотою. Реакцію дає тільки дихлоретан. Реакція утворення ацетиленіда міді. При нагріванні галогенпохідного в запаяній ампулі з розчином гідроксиду натрію утворюється ацетилен, який при взаємодії з солями міді (I) дає ацетиленід міді, що має рожеве або вишнево-червоне забарвлення:
 34 Оцтова кислота Безводна (льодяна) оцтова кислота СН 3 СООН являє собою безбарвну гігроскопічну рідину або безбарвні кристали з різким запахом. Вона змішується з водою, етиловим спиртом і діетиловим ефіром у всіх співвідношеннях. Оцтова кислота застосовується для синтезу барвників, одержання ацетату целюлози, ацетону та багатьох інших речовин. У вигляді оцту та оцтової есенції вона застосовується в харчовій промисловості і в побуті для приготування їжі. Оцтова кислота чинить дію на кров і нирки. При контакті зі шкірою крижана оцтова кислота викликає опіки і утворення пухирців. Після прийому концентрованої оцтової кислоти або оцтової есенції всередину уражається верхня частина харчового каналу, з'являється кривава блювота, пронос, розвивається гемолітична анемія, гемогло-бінурія, анурія і уремія.
34 Оцтова кислота Безводна (льодяна) оцтова кислота СН 3 СООН являє собою безбарвну гігроскопічну рідину або безбарвні кристали з різким запахом. Вона змішується з водою, етиловим спиртом і діетиловим ефіром у всіх співвідношеннях. Оцтова кислота застосовується для синтезу барвників, одержання ацетату целюлози, ацетону та багатьох інших речовин. У вигляді оцту та оцтової есенції вона застосовується в харчовій промисловості і в побуті для приготування їжі. Оцтова кислота чинить дію на кров і нирки. При контакті зі шкірою крижана оцтова кислота викликає опіки і утворення пухирців. Після прийому концентрованої оцтової кислоти або оцтової есенції всередину уражається верхня частина харчового каналу, з'являється кривава блювота, пронос, розвивається гемолітична анемія, гемогло-бінурія, анурія і уремія.
 35 Оцтова кислота Реакція з хлоридом заліза (III). Від збільшення хлориду заліза (III) до ацетат-іонів з'являється червоне забарвлення, зумовлена утворенням основного ацетату заліза: Реакція утворення індиго. При нагріванні оцтової кислоти або ацетатів із солями кальцію утворюється ацетон, який визначають по реакції утворення індиго. Реакція з нітратом лантану та йодом. При взаємодії ацетат-іонів з нітратом лантану La(NO 3)3 у присутності йоду і аміаку розчин набуває темно-синє забарвлення або випадає такого ж кольору осад. Реакція утворення оцтово-етилового ефіру. При нагріванні ацетатів з етиловим спиртом у присутності сірчаної кислоти утворюється оцтово -етиловий ефір (етилацетат), зі специфічним запахом:
35 Оцтова кислота Реакція з хлоридом заліза (III). Від збільшення хлориду заліза (III) до ацетат-іонів з'являється червоне забарвлення, зумовлена утворенням основного ацетату заліза: Реакція утворення індиго. При нагріванні оцтової кислоти або ацетатів із солями кальцію утворюється ацетон, який визначають по реакції утворення індиго. Реакція з нітратом лантану та йодом. При взаємодії ацетат-іонів з нітратом лантану La(NO 3)3 у присутності йоду і аміаку розчин набуває темно-синє забарвлення або випадає такого ж кольору осад. Реакція утворення оцтово-етилового ефіру. При нагріванні ацетатів з етиловим спиртом у присутності сірчаної кислоти утворюється оцтово -етиловий ефір (етилацетат), зі специфічним запахом:
 36 Етиленгліколь (НО-СН 2 -ОН) є одним з представників двоатомних спиртів, мають токсикологічне значення. Це безбарвна масляниста рідина (т. кип. 197°С) солодкуватого смаку. Етиленгліколь змішується з водою у всіх співвідношеннях, погано розчиняється у діетиловому ефірі, добре - в етиловому спирті. Етиленгліколь використовується в техніці як мастила для шарикопідшипників і особливо в якості антифризу (суміші рідин, застосовуваної для запобігання замерзання води, що охолоджує мотори автомобілів). Після надходження етиленгліколю в організм він діє як судинна і протоплазматична отрута, що пригнічує окислювальні процеси і викликає дегенеративні зміни судин. Метод ізолювання заснований на використанні бензолу як селективного переносника етиленгліколю з об'єктів в дистилят. Бензол спільно з парами етиленгліколю і невеликою кількістю водяної пари переноситься в дистилят. Вода, яка переганяється при цьому, практично містить весь етиленгліколь.
36 Етиленгліколь (НО-СН 2 -ОН) є одним з представників двоатомних спиртів, мають токсикологічне значення. Це безбарвна масляниста рідина (т. кип. 197°С) солодкуватого смаку. Етиленгліколь змішується з водою у всіх співвідношеннях, погано розчиняється у діетиловому ефірі, добре - в етиловому спирті. Етиленгліколь використовується в техніці як мастила для шарикопідшипників і особливо в якості антифризу (суміші рідин, застосовуваної для запобігання замерзання води, що охолоджує мотори автомобілів). Після надходження етиленгліколю в організм він діє як судинна і протоплазматична отрута, що пригнічує окислювальні процеси і викликає дегенеративні зміни судин. Метод ізолювання заснований на використанні бензолу як селективного переносника етиленгліколю з об'єктів в дистилят. Бензол спільно з парами етиленгліколю і невеликою кількістю водяної пари переноситься в дистилят. Вода, яка переганяється при цьому, практично містить весь етиленгліколь.
 37 Етиленгліколь Реакція окислення етиленгліколю перйодатом і виявлення утвореного формальдегіду. В результаті вказаної реакції утворюється формальдегід, який можна виявити за допомогою фуксінсерністой кислоти. Реакція з сульфатом міді. При додаванні сульфату міді і лугу до етиленгліколю утворюється сполука, що має синє забарвлення:
37 Етиленгліколь Реакція окислення етиленгліколю перйодатом і виявлення утвореного формальдегіду. В результаті вказаної реакції утворюється формальдегід, який можна виявити за допомогою фуксінсерністой кислоти. Реакція з сульфатом міді. При додаванні сульфату міді і лугу до етиленгліколю утворюється сполука, що має синє забарвлення:
 Дякую за увагу
Дякую за увагу
