Theory of electrolytic dissociation — Lection 4 Konstantin

























22-lekciya_5-dissociac.ppt
- Количество слайдов: 25
 Theory of electrolytic dissociation - Lection 4 Konstantin GERMAN Chair Head of Natural and Biomedical Sciences, Medical Institute REAVIZ www.slideshare.net
Theory of electrolytic dissociation - Lection 4 Konstantin GERMAN Chair Head of Natural and Biomedical Sciences, Medical Institute REAVIZ www.slideshare.net
 ЛЕКЦИЯ № 5: www.slideshare.net Теория электролитической диссоциации Зав. кафедрой естественных наук Константин Эдуардович Герман
ЛЕКЦИЯ № 5: www.slideshare.net Теория электролитической диссоциации Зав. кафедрой естественных наук Константин Эдуардович Герман
 Теория электролитической диссоциации (план лекции) Теория электролитической диссоциации. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита. Закон разведения Оствальда. Общие положения теории Дебая-Хюккеля. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме. Осмоляльность и осмолярность биологических жидкостей. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Понятия об изоосмии (электролитном гомеостазе). Роль осмоса в биологических системах. Плазмолиз и цитолиз.
Теория электролитической диссоциации (план лекции) Теория электролитической диссоциации. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита. Закон разведения Оствальда. Общие положения теории Дебая-Хюккеля. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме. Осмоляльность и осмолярность биологических жидкостей. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Понятия об изоосмии (электролитном гомеостазе). Роль осмоса в биологических системах. Плазмолиз и цитолиз.
 Теория растворов Якоб Вант-Гофф Jacobus Henricus van 't Hoff, Jr. (30 August 1852 – 1 March 1911) Датский физикохимик и органик Первый лауреат Нобелевской премии по химии. Открыл химическую кинетику, химические равновесия, осмотическое давление, стереохимию в органике Сванте Аррениус Svante Arrhenius (19 Feb. 1859 – 2 Oct. 1927) Шведский ученый , сначала физик, затем химик – основатель физической химии. Нобелевская премия по химии в 1903
Теория растворов Якоб Вант-Гофф Jacobus Henricus van 't Hoff, Jr. (30 August 1852 – 1 March 1911) Датский физикохимик и органик Первый лауреат Нобелевской премии по химии. Открыл химическую кинетику, химические равновесия, осмотическое давление, стереохимию в органике Сванте Аррениус Svante Arrhenius (19 Feb. 1859 – 2 Oct. 1927) Шведский ученый , сначала физик, затем химик – основатель физической химии. Нобелевская премия по химии в 1903
 Причину отклонения от законов Вант-Гоффа и Рауля впервые установил в 1887 г шведский ученый Сванте Аррениус, Он предложил теорию электролитической диссоциации, которая основывается на двух постулатах:
Причину отклонения от законов Вант-Гоффа и Рауля впервые установил в 1887 г шведский ученый Сванте Аррениус, Он предложил теорию электролитической диссоциации, которая основывается на двух постулатах:
 Сванте Аррениус Два постулата теории электролитической диссоциации: Вещества, растворы которых являются электролитами (т.е. проводят электрический ток), при растворении распадаются на частицы (ионы), которые образуются в результате диссоциации растворенного вещества. Число частиц при этом увеличивается. Ионы, заряженные положительно получили название катионы, т.к. под действием электрического поля движутся к катоду. Ионы заряженные отрицательно – анионы, т.к. под действием электрического поля движутся к аноду. К электролитам относятся соли, кислоты и основания. Al(NO3)3 → Al ³+ + NO3 ֿ Электролиты диссоциируют не полностью. Способность вещества к диссоциации характеризуется значением степени электролитической диссоциации - α. Степенью электролитической диссоциации называется отношение количества вещества электролита, распавшегося на ионы, к общему количеству растворенного электролита. α = nионизированное / Nрастворенное n-количество молекул распавшихся на ионы N-общее количество молекул в растворе α- степень электролитической диссоциации Значение α может изменяться от 0 до 1, часто α выражается в процентах (от 0 до 100%).
Сванте Аррениус Два постулата теории электролитической диссоциации: Вещества, растворы которых являются электролитами (т.е. проводят электрический ток), при растворении распадаются на частицы (ионы), которые образуются в результате диссоциации растворенного вещества. Число частиц при этом увеличивается. Ионы, заряженные положительно получили название катионы, т.к. под действием электрического поля движутся к катоду. Ионы заряженные отрицательно – анионы, т.к. под действием электрического поля движутся к аноду. К электролитам относятся соли, кислоты и основания. Al(NO3)3 → Al ³+ + NO3 ֿ Электролиты диссоциируют не полностью. Способность вещества к диссоциации характеризуется значением степени электролитической диссоциации - α. Степенью электролитической диссоциации называется отношение количества вещества электролита, распавшегося на ионы, к общему количеству растворенного электролита. α = nионизированное / Nрастворенное n-количество молекул распавшихся на ионы N-общее количество молекул в растворе α- степень электролитической диссоциации Значение α может изменяться от 0 до 1, часто α выражается в процентах (от 0 до 100%).
 Причиной электролитической диссоциации являются: Со стороны растворяемого вещества характером химических связей в соединениях (к электролитам относятся вещества с ионной или ковалентной сильнополярной связью) Со стороны растворителя дипольным характером растворителя: молекула воды полярна, т.е. является диполем Таким образом, электролитической диссоциацией называют процесс распада ионных или полярных соединений на ионы под действием полярных молекул растворителя.
Причиной электролитической диссоциации являются: Со стороны растворяемого вещества характером химических связей в соединениях (к электролитам относятся вещества с ионной или ковалентной сильнополярной связью) Со стороны растворителя дипольным характером растворителя: молекула воды полярна, т.е. является диполем Таким образом, электролитической диссоциацией называют процесс распада ионных или полярных соединений на ионы под действием полярных молекул растворителя.
 Механизм электролитической диссоциации Теорию Аррениуса значительно развили русские ученые И.А.Каблуков и В.А.Кистяковский - они установили: при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, затем они диссоциируют на ионы, т.е. в растворе находятся гидратированные ионы. Легче всего диссоциация вещества с ионной связью. Последовательность процессов происходящих при диссоциации веществ с ионной связью (солей, щелочей) будет такой: Последовательность процессов происходящих при диссоциации ориентация молекул диполей воды около ионов кристалла гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла диссоциация (распад) кристалла электролита на гидратированные ионы.
Механизм электролитической диссоциации Теорию Аррениуса значительно развили русские ученые И.А.Каблуков и В.А.Кистяковский - они установили: при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, затем они диссоциируют на ионы, т.е. в растворе находятся гидратированные ионы. Легче всего диссоциация вещества с ионной связью. Последовательность процессов происходящих при диссоциации веществ с ионной связью (солей, щелочей) будет такой: Последовательность процессов происходящих при диссоциации ориентация молекул диполей воды около ионов кристалла гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла диссоциация (распад) кристалла электролита на гидратированные ионы.
 С учетом гидратации ионов уравнение диссоциации выглядит так: NaCl + X H2O → Na + n •H2O + Cl - n• H2O Так как состав гидратированных ионов не всегда постоянен, уравнение записывают сокращенно: NaCl → Na+ + Cl- Аналогично происходит и процесс диссоциации веществ с полярной связью, последовательность происходящих процессов следующая: • ориентация молекул воды вокруг полюсов молекулы электролита • гидратация (взаимодействие) молекулы воды с молекулами электролита • ионизация молекул электролита (превращение ковалентной полярной связи в ионную) • диссоциация (распад) молекул электролита на гидратированные ионы. HCl + H2O → H3O++ Cl- HCl → H+ + Cl- В процессе диссоциации ион водорода в свободном виде не встречается, только в виде иона гидроксония H3O+.
С учетом гидратации ионов уравнение диссоциации выглядит так: NaCl + X H2O → Na + n •H2O + Cl - n• H2O Так как состав гидратированных ионов не всегда постоянен, уравнение записывают сокращенно: NaCl → Na+ + Cl- Аналогично происходит и процесс диссоциации веществ с полярной связью, последовательность происходящих процессов следующая: • ориентация молекул воды вокруг полюсов молекулы электролита • гидратация (взаимодействие) молекулы воды с молекулами электролита • ионизация молекул электролита (превращение ковалентной полярной связи в ионную) • диссоциация (распад) молекул электролита на гидратированные ионы. HCl + H2O → H3O++ Cl- HCl → H+ + Cl- В процессе диссоциации ион водорода в свободном виде не встречается, только в виде иона гидроксония H3O+.
 Сильные и слабые электролиты. Константа диссоциации. Сильные электролиты в водных растворах полностью диссоциируют на ионы. Их диссоциация происходит необратимо: HNO3 → H+ + NO3- Слабые электролиты в водном растворе диссоциируют частично, т.к. их диссоциация является обратимым равновесным процессом, что и отражается знаком обратимости в уравнениях диссоциации: СН3СООН ═ СН3СОО- + Н+ Применительно к водным растворам сильными электролитами являются: 1. Сильные кислоты: HCl, HBr, HY, H2SO4, HNO3, HСlO4, HMnO4 2. Сильные основания (щелочи): гидроксиды щелочных (группа IA) и щелочноземельных металлов (г руппа IIA периодической системы, кроме гидроксидов Be(OH)2, Mg(OH)2). 3. Большинство растворимых солей (исключения: Fe (SCN)3, Mg(CN)2, HgCI2, Hg(CN)2 и др.) К слабым электролитам относятся: 1. Слабые кислоты: H2CO3, H2S, H3BO3, HCN, HNO2, H3PO4, H2SO3, H2SiO3 и большинство органических кислот. 2. Слабые основания и амфотерные гидроксиды металлов: Be(OH)2, Mg(OH)2, Fe(OH)2,Zn(OH)2, гидроксид аммония NH4OH, а также органические основания – амины (CH3NH2 ) и амфолиты (H3N+CH2COO-) . 3. Очень слабым электролитом является вода, α = 2 ·10-9.
Сильные и слабые электролиты. Константа диссоциации. Сильные электролиты в водных растворах полностью диссоциируют на ионы. Их диссоциация происходит необратимо: HNO3 → H+ + NO3- Слабые электролиты в водном растворе диссоциируют частично, т.к. их диссоциация является обратимым равновесным процессом, что и отражается знаком обратимости в уравнениях диссоциации: СН3СООН ═ СН3СОО- + Н+ Применительно к водным растворам сильными электролитами являются: 1. Сильные кислоты: HCl, HBr, HY, H2SO4, HNO3, HСlO4, HMnO4 2. Сильные основания (щелочи): гидроксиды щелочных (группа IA) и щелочноземельных металлов (г руппа IIA периодической системы, кроме гидроксидов Be(OH)2, Mg(OH)2). 3. Большинство растворимых солей (исключения: Fe (SCN)3, Mg(CN)2, HgCI2, Hg(CN)2 и др.) К слабым электролитам относятся: 1. Слабые кислоты: H2CO3, H2S, H3BO3, HCN, HNO2, H3PO4, H2SO3, H2SiO3 и большинство органических кислот. 2. Слабые основания и амфотерные гидроксиды металлов: Be(OH)2, Mg(OH)2, Fe(OH)2,Zn(OH)2, гидроксид аммония NH4OH, а также органические основания – амины (CH3NH2 ) и амфолиты (H3N+CH2COO-) . 3. Очень слабым электролитом является вода, α = 2 ·10-9.
 Константа диссоциации В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Это равновесие количественно характеризуется константой равновесия, которая применительно к процессу диссоциации называется константой диссоциации: Константа диссоциации электролита не зависит от концентрации раствора, но зависит от температуры, а также от природы растворенного вещества и растворителя и при данных условиях является постоянной величиной. Кдисс показывает отношение концентрации ионов в растворе слабого электролита к концентрации недиссоциированных молекул. У сильных электролитов константа диссоциации отсутствует. Константа диссоциации слабых электролитов является мерой их силы: чем меньше значение константы, тем слабее электролит.
Константа диссоциации В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Это равновесие количественно характеризуется константой равновесия, которая применительно к процессу диссоциации называется константой диссоциации: Константа диссоциации электролита не зависит от концентрации раствора, но зависит от температуры, а также от природы растворенного вещества и растворителя и при данных условиях является постоянной величиной. Кдисс показывает отношение концентрации ионов в растворе слабого электролита к концентрации недиссоциированных молекул. У сильных электролитов константа диссоциации отсутствует. Константа диссоциации слабых электролитов является мерой их силы: чем меньше значение константы, тем слабее электролит.
 Закон разбавления Оствальда. С изменением концентрации слабого электролита его степень диссоциации изменяется таким образом, что значение константы диссоциации остается постоянным. Математически зависимость между степенью диссоциации, константой диссоциации и концентрацией раствора выражается законом разбавления Оствальда. Из данного выражения видно, что при разбавлении раствора, т.е. при уменьшении его концентрации (См) степень диссоциации α возрастает. Vilhelms Ostwalds – р.1853 Рига, Российская империя C 1871 по 1932 – в Германии
Закон разбавления Оствальда. С изменением концентрации слабого электролита его степень диссоциации изменяется таким образом, что значение константы диссоциации остается постоянным. Математически зависимость между степенью диссоциации, константой диссоциации и концентрацией раствора выражается законом разбавления Оствальда. Из данного выражения видно, что при разбавлении раствора, т.е. при уменьшении его концентрации (См) степень диссоциации α возрастает. Vilhelms Ostwalds – р.1853 Рига, Российская империя C 1871 по 1932 – в Германии
 Закон Оствальда: С увеличением разведения (уменьшением концентрации электролита) степень диссоциации электролита возрастает. Зная характеристики α и Кдисс можно рассчитать концентрацию ионов в растворах электролитов: где n – число ионов данного типа, образовавшихся при диссоциации одной молекулы электролита
Закон Оствальда: С увеличением разведения (уменьшением концентрации электролита) степень диссоциации электролита возрастает. Зная характеристики α и Кдисс можно рассчитать концентрацию ионов в растворах электролитов: где n – число ионов данного типа, образовавшихся при диссоциации одной молекулы электролита
 Общие положения теории Дебая - Хюккеля Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля — предложенная Петером Дебаем и Эрихом Хюккелем в 1923 году - статистическая теория разбавленных растворов сильных электролитов, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемую ионную атмосферу. Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля является основой теории электропроводности разбавл. р-ров сильных электролитов, разработанной Л. Онсагером. Она позволяет объяснить увеличение электропроводности р-ра при повышении напряженности постоянного электрич. поля (эффект Вина) и в высокочастотном поле (эффект Дебая-Фалькенхагена).
Общие положения теории Дебая - Хюккеля Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля — предложенная Петером Дебаем и Эрихом Хюккелем в 1923 году - статистическая теория разбавленных растворов сильных электролитов, согласно которой каждый ион действием своего электрического заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — так называемую ионную атмосферу. Тео́рия си́льных электроли́тов Деба́я — Хю́ккеля является основой теории электропроводности разбавл. р-ров сильных электролитов, разработанной Л. Онсагером. Она позволяет объяснить увеличение электропроводности р-ра при повышении напряженности постоянного электрич. поля (эффект Вина) и в высокочастотном поле (эффект Дебая-Фалькенхагена).
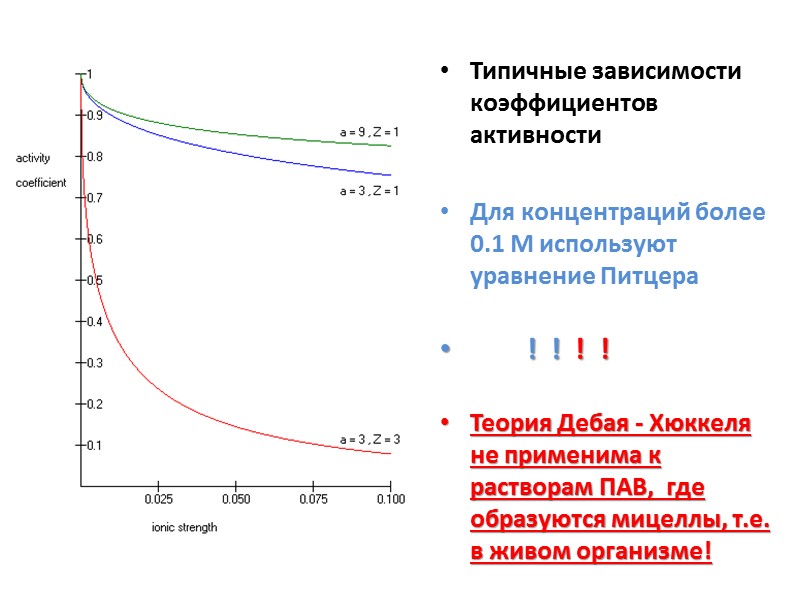
 Типичные зависимости коэффициентов активности Для концентраций более 0.1 М используют уравнение Питцера ! ! ! ! Теория Дебая - Хюккеля не применима к растворам ПАВ, где образуются мицеллы, т.е. в живом организме!
Типичные зависимости коэффициентов активности Для концентраций более 0.1 М используют уравнение Питцера ! ! ! ! Теория Дебая - Хюккеля не применима к растворам ПАВ, где образуются мицеллы, т.е. в живом организме!
 ЭЛЕКТРОЛИТЫ В ОРГАНИЗМЕ Электролиты играют колоссальную роль в жизнедеятельности организмов, в частности человеческого организма. Наличием электролитов в основном определяется осмотическое давление физиологических жидкостей. Существованием перепадов осмотического давления (осмотических градиентов) объясняется явление активного транспорта воды, происходящее в живом организме за счет осмоса. Наличие в физиологических жидкостях электролитов заметно влияет на растворимость белков, аминокислот и других органических соединений. Способность электролитов удерживать воду в виде гидратов препятствует обезвоживанию организма. При нормальном состоянии организма содержание эквивалентов катионов в плазме крови составляет в среднем 154 ммоль/л и приходится в основном на долю ионов Na+, K+, Ca+, Mg2+. Содержание анионов тоже ~154 ммоль/л, большая доля приходится на Cl-, HCO3-. Общее содержание воды в организме человека в расчете на среднюю массу 70 кг составляет 42 кг или 60% от всей массы. Причем 2/3 этого количества сосредоточено во внутриклеточных жидкостях (эритроцитах, мышечных тканях и др.), а 1/3 внеклеточных (плазме крови, тканевой жидкости, лимфе и т.д.).
ЭЛЕКТРОЛИТЫ В ОРГАНИЗМЕ Электролиты играют колоссальную роль в жизнедеятельности организмов, в частности человеческого организма. Наличием электролитов в основном определяется осмотическое давление физиологических жидкостей. Существованием перепадов осмотического давления (осмотических градиентов) объясняется явление активного транспорта воды, происходящее в живом организме за счет осмоса. Наличие в физиологических жидкостях электролитов заметно влияет на растворимость белков, аминокислот и других органических соединений. Способность электролитов удерживать воду в виде гидратов препятствует обезвоживанию организма. При нормальном состоянии организма содержание эквивалентов катионов в плазме крови составляет в среднем 154 ммоль/л и приходится в основном на долю ионов Na+, K+, Ca+, Mg2+. Содержание анионов тоже ~154 ммоль/л, большая доля приходится на Cl-, HCO3-. Общее содержание воды в организме человека в расчете на среднюю массу 70 кг составляет 42 кг или 60% от всей массы. Причем 2/3 этого количества сосредоточено во внутриклеточных жидкостях (эритроцитах, мышечных тканях и др.), а 1/3 внеклеточных (плазме крови, тканевой жидкости, лимфе и т.д.).
 Осмоти́ческая концентра́ция, коллигативные свойства растворов Электролиты – это вещества растворы, или расплавы которых проводят электрический ток. Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц. Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг растворителя). Осмо́ль — единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном кг растворителя одного моль неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр. Осмолярность электролита зависит от его концентрации, коэффициента диссоциации и числа ионов, на которые он диссоциирует: Osm = Φ*n*C где Φ — коэффициент диссоциации, принимает значения от 0 (для неэлектролита) до 1 (полная диссоциация), n — количество частиц, на которые диссоциирует молекула. Например, для NaCl n=2, для H2SO4 n=3, C — молярная концентрация раствора. От осмолярности зависят так называемые коллигативные свойства растворов: депрессия точки замерзания (чем выше осмолярность, тем ниже температура замерзания раствора), повышение точки кипения (чем выше осмолярность, тем выше температура кипения) и осмотическое давление.
Осмоти́ческая концентра́ция, коллигативные свойства растворов Электролиты – это вещества растворы, или расплавы которых проводят электрический ток. Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц. Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на кг растворителя). Осмо́ль — единица осмотической концентрации, равная осмоляльности, получаемой при растворении в одном кг растворителя одного моль неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр. Осмолярность электролита зависит от его концентрации, коэффициента диссоциации и числа ионов, на которые он диссоциирует: Osm = Φ*n*C где Φ — коэффициент диссоциации, принимает значения от 0 (для неэлектролита) до 1 (полная диссоциация), n — количество частиц, на которые диссоциирует молекула. Например, для NaCl n=2, для H2SO4 n=3, C — молярная концентрация раствора. От осмолярности зависят так называемые коллигативные свойства растворов: депрессия точки замерзания (чем выше осмолярность, тем ниже температура замерзания раствора), повышение точки кипения (чем выше осмолярность, тем выше температура кипения) и осмотическое давление.
 ОСМОТИЧЕСКАЯ АКТИВНОСТЬ (КОНЦЕНТРАЦИЯ) Осмотическая активность биологической жидкости определяется концентрацией осмотически активных веществ и создаётся недиссоциирующими соединениями и электролитами. Данная активность (соответствующая 1 л раствора) выражается в миллиосмолях (мосм), равных миллиэквивалентам (мэкв) одновалентных ионов для них также справедливо соотношение мэкв/л = ммоль/л Соли типа натрия хлорида полностью диссоциируют в воде, поэтому конечная осмотическая активность раствора вдвое больше концентрации каждого электролита. Напротив, глюкоза не диссоциирует в воде, следовательно, осмотическая активность её количества, равного 1 ммоль и содержащегося в 1 л раствора, составит 1 мосм. Для выражения степени осмотической активности раствора используют следующие понятия. Осмолярность — число осмолей растворённого вещества, содержащегося в 1 л раствора. Осмоляльность — число осмолей растворённого вещества, содержащегося в 1 кг растворителя. У биологических жидкостей разница между ними незначительна, поэтому указанные термины могут иметь одинаковое смысловое значение в медицине.
ОСМОТИЧЕСКАЯ АКТИВНОСТЬ (КОНЦЕНТРАЦИЯ) Осмотическая активность биологической жидкости определяется концентрацией осмотически активных веществ и создаётся недиссоциирующими соединениями и электролитами. Данная активность (соответствующая 1 л раствора) выражается в миллиосмолях (мосм), равных миллиэквивалентам (мэкв) одновалентных ионов для них также справедливо соотношение мэкв/л = ммоль/л Соли типа натрия хлорида полностью диссоциируют в воде, поэтому конечная осмотическая активность раствора вдвое больше концентрации каждого электролита. Напротив, глюкоза не диссоциирует в воде, следовательно, осмотическая активность её количества, равного 1 ммоль и содержащегося в 1 л раствора, составит 1 мосм. Для выражения степени осмотической активности раствора используют следующие понятия. Осмолярность — число осмолей растворённого вещества, содержащегося в 1 л раствора. Осмоляльность — число осмолей растворённого вещества, содержащегося в 1 кг растворителя. У биологических жидкостей разница между ними незначительна, поэтому указанные термины могут иметь одинаковое смысловое значение в медицине.
 ОСМОЛЯЛЬНОСТЬ И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ Под осмотическим давлением, и эффективной осмоляльностью, подразумевают разницу осмотической активности двух растворов, разделённых полупроницаемой мембраной (на два отсека), через которую свободно проходят только молекулы воды (растворитель). Данная разница создаёт осмотический градиент для движения воды из раствора с низкой концентрацией в раствор с более высокой осмотической концентрацией. Вместе с тем существуют вещества, которые, будучи растворёнными, способствуют повышению осмоляльности раствора в каждом из двух отсеков без возрастания осмотического давления. В качестве примеров таких веществ, приводящих к гиперосмоляльности растворов без повышения осмотического давления, можно привести мочевину и спирты (этанол, метанол, этиленгликоль и др.) * * Это связано с тем, что мочевина и другие вещества легко проникают через биомембраны.
ОСМОЛЯЛЬНОСТЬ И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ Под осмотическим давлением, и эффективной осмоляльностью, подразумевают разницу осмотической активности двух растворов, разделённых полупроницаемой мембраной (на два отсека), через которую свободно проходят только молекулы воды (растворитель). Данная разница создаёт осмотический градиент для движения воды из раствора с низкой концентрацией в раствор с более высокой осмотической концентрацией. Вместе с тем существуют вещества, которые, будучи растворёнными, способствуют повышению осмоляльности раствора в каждом из двух отсеков без возрастания осмотического давления. В качестве примеров таких веществ, приводящих к гиперосмоляльности растворов без повышения осмотического давления, можно привести мочевину и спирты (этанол, метанол, этиленгликоль и др.) * * Это связано с тем, что мочевина и другие вещества легко проникают через биомембраны.
 ОСМОЛЯЛЬНОСТЬ ПЛАЗМЫ КРОВИ Осмоляльность плазмы крови (внеклеточная жидкость) можно измерить в лаборатории, используя определение точки замерзания — криоскопическои константы. (Температура замерзания растворов осмотически активных веществ ниже точки замерзания воды, 00С, поэтому для каждой концентрации существует своя криоскопическая константа.) Образец плазмы крови помещают в морозильную камеру и регистрируют точку замерзания, затем по ней определяют осмоляльность этой биологической жидкости (например, одноосмоляльные растворы замерзают при температуре -1,86 °С). Осмоляльность плазмы также можно вычислить, исходя из содержания в ней натрия, хлора, глюкозы и мочевины (главные осмотические компоненты внеклеточной жидкости). В расчёте, приведённом ниже, использованы следующие данные: концентрация натрия составляет 140 мэкв/л, глюкозы — 5 ммоль/л, мочевины крови — 5 ммоль/л Осмоляльность плазмы = 2 х Na + глюкоза (ммоль/л) + мочевина (ммоль/л) = 2 х (140) + 5 + 5 = 290 мосм/кг Н2О
ОСМОЛЯЛЬНОСТЬ ПЛАЗМЫ КРОВИ Осмоляльность плазмы крови (внеклеточная жидкость) можно измерить в лаборатории, используя определение точки замерзания — криоскопическои константы. (Температура замерзания растворов осмотически активных веществ ниже точки замерзания воды, 00С, поэтому для каждой концентрации существует своя криоскопическая константа.) Образец плазмы крови помещают в морозильную камеру и регистрируют точку замерзания, затем по ней определяют осмоляльность этой биологической жидкости (например, одноосмоляльные растворы замерзают при температуре -1,86 °С). Осмоляльность плазмы также можно вычислить, исходя из содержания в ней натрия, хлора, глюкозы и мочевины (главные осмотические компоненты внеклеточной жидкости). В расчёте, приведённом ниже, использованы следующие данные: концентрация натрия составляет 140 мэкв/л, глюкозы — 5 ммоль/л, мочевины крови — 5 ммоль/л Осмоляльность плазмы = 2 х Na + глюкоза (ммоль/л) + мочевина (ммоль/л) = 2 х (140) + 5 + 5 = 290 мосм/кг Н2О
 ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ ПЛАЗМЫ Эффективная осмоляльность, или осмотическое давление плазмы, можно вычислить по аналогичной формуле, предварительно исключив из неё выражение, обозначающее концентрацию азота мочевины крови (вследствие способности мочевины свободно проникать сквозь клеточные мембраны и тем самым не создавать осмотического градиента между внеклеточной и внутриклеточной жидкостью). Осмотическое давление плазмы = 2 х Na + глюкоза (ммоль/л) = 2 х (140) + 5 = 285 мосм/кг Н2О Разница между осмоляльностью плазмы и её осмотическим давлением у здоровых людей очень незначительна из-за малой концентрации мочевины во внеклеточной жидкости. В случае азотемии (избыт. N) указанная разница существенно возрастает. Однако при чистых гиперосмолярных синдромах, не сопровождающихся повышенным осмотическим давлением, не происходит диффузии воды через клеточные мембраны и, следовательно, последствия таких расстройств незначительные.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ ПЛАЗМЫ Эффективная осмоляльность, или осмотическое давление плазмы, можно вычислить по аналогичной формуле, предварительно исключив из неё выражение, обозначающее концентрацию азота мочевины крови (вследствие способности мочевины свободно проникать сквозь клеточные мембраны и тем самым не создавать осмотического градиента между внеклеточной и внутриклеточной жидкостью). Осмотическое давление плазмы = 2 х Na + глюкоза (ммоль/л) = 2 х (140) + 5 = 285 мосм/кг Н2О Разница между осмоляльностью плазмы и её осмотическим давлением у здоровых людей очень незначительна из-за малой концентрации мочевины во внеклеточной жидкости. В случае азотемии (избыт. N) указанная разница существенно возрастает. Однако при чистых гиперосмолярных синдромах, не сопровождающихся повышенным осмотическим давлением, не происходит диффузии воды через клеточные мембраны и, следовательно, последствия таких расстройств незначительные.
 ОСМОЛЯЛЬНАЯ РАЗНИЦА Разность между измеренным и подсчитанным по формуле значением осмоляльностиляльности плазмы соответствует концентрации других осмотически активных веществ, не учтённых при вычислении (например, магний, кальций, белки и др.). Подобную разность называют осмоляльной разницей (в норме она составляет 10 мэкв/л или меньше). Повышенную осмоляльную разницу следует интерпретировать, исходя из значений вычисленной осмоляльности плазмы. Если вычисленная осмоляльность незначительна, то уменьшен объём жидкой части плазмы в результате гиперпротеинемии или гиперлипидемии. Если значение осмоляльности плазмы находится в пределах нормы, то увеличенная осмоляльная разница свидетельствует о присутствии токсинов (этанол, метанол, этиленгликоль) или других осмотически активных веществ, таких, как маннит либо трудноидентифицируемые средние молекулы, накапливающиеся при почечной недостаточности. Определение осмоляльной разницы можно использовать для дифференциации острой и хронической почечной недостаточности. При острой почечной недостаточности осмоляльная разница будет нормальной, а при хронической — повышенной.
ОСМОЛЯЛЬНАЯ РАЗНИЦА Разность между измеренным и подсчитанным по формуле значением осмоляльностиляльности плазмы соответствует концентрации других осмотически активных веществ, не учтённых при вычислении (например, магний, кальций, белки и др.). Подобную разность называют осмоляльной разницей (в норме она составляет 10 мэкв/л или меньше). Повышенную осмоляльную разницу следует интерпретировать, исходя из значений вычисленной осмоляльности плазмы. Если вычисленная осмоляльность незначительна, то уменьшен объём жидкой части плазмы в результате гиперпротеинемии или гиперлипидемии. Если значение осмоляльности плазмы находится в пределах нормы, то увеличенная осмоляльная разница свидетельствует о присутствии токсинов (этанол, метанол, этиленгликоль) или других осмотически активных веществ, таких, как маннит либо трудноидентифицируемые средние молекулы, накапливающиеся при почечной недостаточности. Определение осмоляльной разницы можно использовать для дифференциации острой и хронической почечной недостаточности. При острой почечной недостаточности осмоляльная разница будет нормальной, а при хронической — повышенной.
 Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i ) — введён Я. Вант-Гоффом. безразмерный параметр, характеризующий поведение вещества в растворе. В 1901 году первым получил Нобелевскую премию по химии — за его заслуги в изучении растворов . Численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы: где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, Tmp — температура плавления (замерзания).
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i ) — введён Я. Вант-Гоффом. безразмерный параметр, характеризующий поведение вещества в растворе. В 1901 году первым получил Нобелевскую премию по химии — за его заслуги в изучении растворов . Численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы: где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, Tmp — температура плавления (замерзания).
 Изотонический коэффициент показывает насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, Он связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α При этом образуются N·α·n ионов), Общее количество частиц в растворе равно ((N — N·α) + N·α·n).
Изотонический коэффициент показывает насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, Он связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Если формульная единица или молекула содержит n ионов (или атомов при полярных связях, в растворе превращающихся в ионы), количество исходных молекул равно N, а степень диссоциации соединения — α, то количество диссоциировавших молекул равно N·α При этом образуются N·α·n ионов), Общее количество частиц в растворе равно ((N — N·α) + N·α·n).
 Спасибо за внимание!
Спасибо за внимание!

