ТЕХНИКА ПРИГОТОВЛЕНИЯ МАЗКОВ. МЕТОДЫ ОКРАСКИ.































Занятие 2. Методы окраски.ppt
- Количество слайдов: 36
 ТЕХНИКА ПРИГОТОВЛЕНИЯ МАЗКОВ. МЕТОДЫ ОКРАСКИ.
ТЕХНИКА ПРИГОТОВЛЕНИЯ МАЗКОВ. МЕТОДЫ ОКРАСКИ.
 Техника безопасности в кабинете (лаборатории) микробиологии Правила работы со спиртовкой ØЗаправленную спиртовку хранят плотно закрытой притертым колпачком, чтобы предотвратить испарение спирта с фитиля. ØПри зажигании спиртовки нужно снять колпачок и поджечь фитиль спичкой. При этом нельзя сдвигать держатель фитиля, т. к. пламя проскочит внутрь спиртовки, что вызовет сильную вспышку и разбрызгивание горящего спирта. ØНельзя зажигать спиртовку от другой уже горящей спиртовки, т. к. при этом может сдвинуться держатель фитиля и вылиться спирт. ØНельзя дуть на пламя, чтобы погасить спиртовку. Для этого следует аккуратно закрыть спиртовку колпачком. ØНеобходимо следить за тем, чтобы спиртовка не перегревалась. Это ведет к испарению спирта и опасности взрыва. ØПри длительном нагревании лучше пользоваться двумя спиртовками. ØНе следует при работе наклонять голову над спиртовкой, т. к. при накоплении паров спирта под держателем фитиля может происходить самопроизвольное вспыхивание.
Техника безопасности в кабинете (лаборатории) микробиологии Правила работы со спиртовкой ØЗаправленную спиртовку хранят плотно закрытой притертым колпачком, чтобы предотвратить испарение спирта с фитиля. ØПри зажигании спиртовки нужно снять колпачок и поджечь фитиль спичкой. При этом нельзя сдвигать держатель фитиля, т. к. пламя проскочит внутрь спиртовки, что вызовет сильную вспышку и разбрызгивание горящего спирта. ØНельзя зажигать спиртовку от другой уже горящей спиртовки, т. к. при этом может сдвинуться держатель фитиля и вылиться спирт. ØНельзя дуть на пламя, чтобы погасить спиртовку. Для этого следует аккуратно закрыть спиртовку колпачком. ØНеобходимо следить за тем, чтобы спиртовка не перегревалась. Это ведет к испарению спирта и опасности взрыва. ØПри длительном нагревании лучше пользоваться двумя спиртовками. ØНе следует при работе наклонять голову над спиртовкой, т. к. при накоплении паров спирта под держателем фитиля может происходить самопроизвольное вспыхивание.
 Правила работы с живой культурой. 1. Главное при посеве живой культуры – это оградить посев от посторонних микробов и распространение культуры микроорганизма с питательной среды или материала во внешнюю среду. 2. Работать следует быстро, но без резких движений, усиливающих колебания воздуха. 3. Во время посевов нельзя разговаривать, перемещаться по лаборатории. 4. Вся посуда и оборудование, подвергшиеся обсеменению во время работы с культурой, обрабатываются на месте путем фломбирования в пламени спиртовки или сброса в емкость с дез. средством. 5. По окончанию посевов рабочие поверхности столов подвергаются дезинфекции, обрабатываются руки. 6. Лабораторная посуда с посевами помещается в термостат: пробирки в штативе, а чашки Петри переворачивают дном вверх. Использование материалов и средств личной гигиены, раздражающих кожу рук, запрещается.
Правила работы с живой культурой. 1. Главное при посеве живой культуры – это оградить посев от посторонних микробов и распространение культуры микроорганизма с питательной среды или материала во внешнюю среду. 2. Работать следует быстро, но без резких движений, усиливающих колебания воздуха. 3. Во время посевов нельзя разговаривать, перемещаться по лаборатории. 4. Вся посуда и оборудование, подвергшиеся обсеменению во время работы с культурой, обрабатываются на месте путем фломбирования в пламени спиртовки или сброса в емкость с дез. средством. 5. По окончанию посевов рабочие поверхности столов подвергаются дезинфекции, обрабатываются руки. 6. Лабораторная посуда с посевами помещается в термостат: пробирки в штативе, а чашки Петри переворачивают дном вверх. Использование материалов и средств личной гигиены, раздражающих кожу рук, запрещается.
 Правила приготовления и хранения стекол (предметных, покровных). Предметные и покровные стекла должны иметь абсолютно чистую поверхность и быть хорошо обезжиренными. Капля воды, нанесенная на обезжиренное стекло, растекается равномерно, а на плохо обезжиренном стекле распадается на мелкие капельки. Предметные и покровные стекла рекомендуется мыть и ополаскивать в резиновых перчатках, чтобы не загрязнять их жиром, находящимся на поверхности кожи. Стекла предметные и покровные, не бывшие в употреблении, моют в теплой мыльной воде и после споласкивания заливают смесью Никифорова.
Правила приготовления и хранения стекол (предметных, покровных). Предметные и покровные стекла должны иметь абсолютно чистую поверхность и быть хорошо обезжиренными. Капля воды, нанесенная на обезжиренное стекло, растекается равномерно, а на плохо обезжиренном стекле распадается на мелкие капельки. Предметные и покровные стекла рекомендуется мыть и ополаскивать в резиновых перчатках, чтобы не загрязнять их жиром, находящимся на поверхности кожи. Стекла предметные и покровные, не бывшие в употреблении, моют в теплой мыльной воде и после споласкивания заливают смесью Никифорова.
 Если стекла, вынутые через 2— 3 дня из смеси Никифорова, сохраняют следы жира, их складывают в фарфоровую чашечку, заливают 2— 5 % раствором гидрокарбоната натрия или едкого натра, ставят на слабый огонь и кипятят, считая от момента закипания воды, в течение 20— 30 мин. После кипячения в щелочном растворе стекла ополаскивают проточной водопроводной водой, опускают на 10— 15 мин в 5— 10% раствор хлористо-водородной кислоты и затем промывают проточной водой. Предметные и покровные стекла, бывшие в употреблении, загрязненные краской и иммерсионным маслом, обрабатывают следующим способом: • опускают на 2 ч в концентрированную серную кислоту или хромовую смесь, • затем тщательно промывают проточной водопроводной водой; • заливают 5% раствором гидрокарбоната натрия или щелочи (едкое кали или едкий натр), • ставят на слабый огонь и кипятит в течение 30— 40
Если стекла, вынутые через 2— 3 дня из смеси Никифорова, сохраняют следы жира, их складывают в фарфоровую чашечку, заливают 2— 5 % раствором гидрокарбоната натрия или едкого натра, ставят на слабый огонь и кипятят, считая от момента закипания воды, в течение 20— 30 мин. После кипячения в щелочном растворе стекла ополаскивают проточной водопроводной водой, опускают на 10— 15 мин в 5— 10% раствор хлористо-водородной кислоты и затем промывают проточной водой. Предметные и покровные стекла, бывшие в употреблении, загрязненные краской и иммерсионным маслом, обрабатывают следующим способом: • опускают на 2 ч в концентрированную серную кислоту или хромовую смесь, • затем тщательно промывают проточной водопроводной водой; • заливают 5% раствором гидрокарбоната натрия или щелочи (едкое кали или едкий натр), • ставят на слабый огонь и кипятит в течение 30— 40
 ЭТАПЫ ПРИГОТОВЛЕНИЯ ПРЕПАРАТА. 1. Приготовление мазка 2. Высушивание 3. Фиксация 4. Окрашивание
ЭТАПЫ ПРИГОТОВЛЕНИЯ ПРЕПАРАТА. 1. Приготовление мазка 2. Высушивание 3. Фиксация 4. Окрашивание
 Рецепты приготовления красителей Карболовый фуксин Циля: - насыщенного спиртового раствора основного фуксина – 10 мл - раствора карболовой кислоты 5% - 90 мл Внимание! Карболовую кислоту вливают в краситель, а не наоборот. Смесь встряхивают, фильтруют и сливают во флакон! Или - основной фуксин в порошке - 1 гр - карболовая кислота кристаллическая -5 гр - глицерин -0, 5 мл - спирт 96% - 10 мл - вода дистиллированная - 100 мл 2. Насыщенные спиртовые растворы (исходные): - красителя - 1 гр - спирта 96% - 10 мл Смесь помещают в термостат на несколько дней до полного растворения. Взбалтывают ежедневно, хранят с притертыми пробками. Фуксин Пфейффера: - фуксин Циля – 1 мл - воды дистиллированной – 9 мл Готовят непосредственно перед употреблением, т. к. раствор нестойкий. Бумага по Синеву: - 1%спиртовой раствор кристаллического фиолетового: на 100 мл 96% спирта добавляют 1 гр сухого красителя и 3 мл глицерина Полоски фильтровальной бумаги пропитывают раствором и высушивают.
Рецепты приготовления красителей Карболовый фуксин Циля: - насыщенного спиртового раствора основного фуксина – 10 мл - раствора карболовой кислоты 5% - 90 мл Внимание! Карболовую кислоту вливают в краситель, а не наоборот. Смесь встряхивают, фильтруют и сливают во флакон! Или - основной фуксин в порошке - 1 гр - карболовая кислота кристаллическая -5 гр - глицерин -0, 5 мл - спирт 96% - 10 мл - вода дистиллированная - 100 мл 2. Насыщенные спиртовые растворы (исходные): - красителя - 1 гр - спирта 96% - 10 мл Смесь помещают в термостат на несколько дней до полного растворения. Взбалтывают ежедневно, хранят с притертыми пробками. Фуксин Пфейффера: - фуксин Циля – 1 мл - воды дистиллированной – 9 мл Готовят непосредственно перед употреблением, т. к. раствор нестойкий. Бумага по Синеву: - 1%спиртовой раствор кристаллического фиолетового: на 100 мл 96% спирта добавляют 1 гр сухого красителя и 3 мл глицерина Полоски фильтровальной бумаги пропитывают раствором и высушивают.
 АЛГОРИТМ ПРИГОТОВЛЕНИЯ МАЗКА ИЗ КУЛЬТУРЫ, ВЫРАЩЕННОЙ НА СКОШЕННОМ АГАРЕ( «КОСЯЧКЕ» ) Предметное стекло аккуратно берут за ребро и с обратной стороны нанесения мазка наносят его границы и номер культуры. Зажигают спиртовку, горелку, предварительно выпустив пары спирта. Фламбируют поверхность стекла, где будет располагаться мазок. Стекло помещают вблизи спиртовки на чашку Петри В левую руку берут пробирку со стерильным физическим раствором (дистиллированной водой) и помещают между 1 и 2 пальцами таким образом, что ладонь находится под пробиркой и горлышко пробирки направлено в зону спиртовки В правую берут бактериальную петлю, как карандаш Петлю фламбируют до покраснения сначала горизонтально, затем вертикально Не выпуская петли, мизинцем правой руки прижимают пробку физ. р-ра к ладони и осторожно вынимают е из пробирки. Движения должны быть плавными Горло пробирки обжигают в пламени и вводят петлю Берут выпускной петлей физ. р-р и выносят на стекло пару капель в границы мазка Закрывают пробку, предварительно проведя через пламя спиртовки пробку и горло пробирки одновременно Ставят пробирку в штатив
АЛГОРИТМ ПРИГОТОВЛЕНИЯ МАЗКА ИЗ КУЛЬТУРЫ, ВЫРАЩЕННОЙ НА СКОШЕННОМ АГАРЕ( «КОСЯЧКЕ» ) Предметное стекло аккуратно берут за ребро и с обратной стороны нанесения мазка наносят его границы и номер культуры. Зажигают спиртовку, горелку, предварительно выпустив пары спирта. Фламбируют поверхность стекла, где будет располагаться мазок. Стекло помещают вблизи спиртовки на чашку Петри В левую руку берут пробирку со стерильным физическим раствором (дистиллированной водой) и помещают между 1 и 2 пальцами таким образом, что ладонь находится под пробиркой и горлышко пробирки направлено в зону спиртовки В правую берут бактериальную петлю, как карандаш Петлю фламбируют до покраснения сначала горизонтально, затем вертикально Не выпуская петли, мизинцем правой руки прижимают пробку физ. р-ра к ладони и осторожно вынимают е из пробирки. Движения должны быть плавными Горло пробирки обжигают в пламени и вводят петлю Берут выпускной петлей физ. р-р и выносят на стекло пару капель в границы мазка Закрывают пробку, предварительно проведя через пламя спиртовки пробку и горло пробирки одновременно Ставят пробирку в штатив
 В левую руку берут пробирку с культурой и помещают, как и пробирку с физ. р-ром петля в правой руке Петлю фламбируют Над пламенем спиртовки спокойно вынимают пробку с культуры одновременно обжигая пробку и горло пробирки Вводят в пробирку петлю, охлаждая ее о стенки пробирки Осторожно закрывают и захватывают петлей культуру, не повреждая агара , и вынимают петлю, не касаясь ею стенок пробирки Петлю с культурой вносят в каплю физ. р-ра и осторожно эмульгируют, незаходя за границы мазка Бактериальную петлю с остатками культуры прожигают до покраснения в пламени спиртовки Прожигают горло пробирки пробку в пламени, одновременно. Закрывают пробирку. Пробирку с культурой и петлю ставят в штатив Приготовленный мазок высушивают либо на воздухе либо высоко над пламенем спиртовки
В левую руку берут пробирку с культурой и помещают, как и пробирку с физ. р-ром петля в правой руке Петлю фламбируют Над пламенем спиртовки спокойно вынимают пробку с культуры одновременно обжигая пробку и горло пробирки Вводят в пробирку петлю, охлаждая ее о стенки пробирки Осторожно закрывают и захватывают петлей культуру, не повреждая агара , и вынимают петлю, не касаясь ею стенок пробирки Петлю с культурой вносят в каплю физ. р-ра и осторожно эмульгируют, незаходя за границы мазка Бактериальную петлю с остатками культуры прожигают до покраснения в пламени спиртовки Прожигают горло пробирки пробку в пламени, одновременно. Закрывают пробирку. Пробирку с культурой и петлю ставят в штатив Приготовленный мазок высушивают либо на воздухе либо высоко над пламенем спиртовки
 Примечание: 1. Приготовление мазка из культуры, выращенной на жидкой питательной среде, не требует использования физ. р-ра. 2. При приготовлении мазка из культуры, выросшей на чашке Петри необходимо: отметить изолированную колонию со стороны дна чашки чашку берут в левую руку и в сторону спиртовки приоткрывают крышку, придерживая ее 1 и 2 пальцами левой руки прокаленную петлю вводят под крышку чашки, остужая ее о крышку осторожно откалывают часть выделенной колонии и, не задевая края чашки, выносят на стекло с физ. р-ром. При подсушивании мазка следует помнить: высокая температура может нарушить структуру клетки
Примечание: 1. Приготовление мазка из культуры, выращенной на жидкой питательной среде, не требует использования физ. р-ра. 2. При приготовлении мазка из культуры, выросшей на чашке Петри необходимо: отметить изолированную колонию со стороны дна чашки чашку берут в левую руку и в сторону спиртовки приоткрывают крышку, придерживая ее 1 и 2 пальцами левой руки прокаленную петлю вводят под крышку чашки, остужая ее о крышку осторожно откалывают часть выделенной колонии и, не задевая края чашки, выносят на стекло с физ. р-ром. При подсушивании мазка следует помнить: высокая температура может нарушить структуру клетки
 Схема приготовления мазка
Схема приготовления мазка
 Виды фиксации q Физический – в пламени спиртовки. q Химический – в растворах спирта, ацетона, смеси Никифорова (1: 1 спирт и эфир) Цели фиксации Обеззараживание патогенных микробов Закрепление клеток на стекле Убитые микроорганизмы лучше воспринимают красители
Виды фиксации q Физический – в пламени спиртовки. q Химический – в растворах спирта, ацетона, смеси Никифорова (1: 1 спирт и эфир) Цели фиксации Обеззараживание патогенных микробов Закрепление клеток на стекле Убитые микроорганизмы лучше воспринимают красители
 Методы окраски: Простые Сложные (Грам, Циль-Нильсен, Ожешко, Бури - Гинс).
Методы окраски: Простые Сложные (Грам, Циль-Нильсен, Ожешко, Бури - Гинс).
 ПРОСТЫЕ МЕТОДЫ ОКРАСКИ МАЗКОВ Для окрашивания микробов используют анилиновые красители (основные, кислые и нейтральные). Микроорганизмы лучше окрашиваются основными красками. Для окраски препаратов готовят спиртовые, водно-спиртовые и водные растворы. В некоторых случаях добавляют в качестве протравы карболовую кислоту, щелочь и др. Наиболее часто употребляемыми красителями являются следующие: Синие - метиловый синий, водный синий, опаловый синий; красные - фуксин основной, конго красный, сафранин, нейтральный красный, фуксин кислый; фиолетовые - метиловый фиолетовый, кристаллический фиолетовый, генцианвиолет; зеленые - малахитовый зеленый, бриллиантовый зеленый, светло-зеленый; желто-коричневые - хризоилин, везувин.
ПРОСТЫЕ МЕТОДЫ ОКРАСКИ МАЗКОВ Для окрашивания микробов используют анилиновые красители (основные, кислые и нейтральные). Микроорганизмы лучше окрашиваются основными красками. Для окраски препаратов готовят спиртовые, водно-спиртовые и водные растворы. В некоторых случаях добавляют в качестве протравы карболовую кислоту, щелочь и др. Наиболее часто употребляемыми красителями являются следующие: Синие - метиловый синий, водный синий, опаловый синий; красные - фуксин основной, конго красный, сафранин, нейтральный красный, фуксин кислый; фиолетовые - метиловый фиолетовый, кристаллический фиолетовый, генцианвиолет; зеленые - малахитовый зеленый, бриллиантовый зеленый, светло-зеленый; желто-коричневые - хризоилин, везувин.
 При простом методе окраски на фиксированный мазок наливают несколько капель какого-либо спиртоводного или водного раствора красок на 1— 2 минуты; чаще всего для этой цели применяется фуксин 1: 10 или леффлеровская метиленовая синька. Затем краску смывают дистиллированной водой и мазок обсушивают между двумя полосками фильтровальной бумаги. Обычно Фуксином I: 10 красят 10— 30 секунд, а метиленовой синькой – 2 -10 мин. Фуксин окрашивает мазки более интенсивно. А при окраске метиленовой синькой получаются нежные, более изящные препараты. Мазок после обсушивания фильтровальной бумагой должен быть совершенно сухим, в противном случае при соприкосновении оставшейся влаги с кедровым маслом образуется эмульсия и при микроскопии получится неясное изображение. Вообще же продолжительность окраски зависит от вида и качества красящего раствора, степени восприимчивости микроба к окраске и толщины мазка.
При простом методе окраски на фиксированный мазок наливают несколько капель какого-либо спиртоводного или водного раствора красок на 1— 2 минуты; чаще всего для этой цели применяется фуксин 1: 10 или леффлеровская метиленовая синька. Затем краску смывают дистиллированной водой и мазок обсушивают между двумя полосками фильтровальной бумаги. Обычно Фуксином I: 10 красят 10— 30 секунд, а метиленовой синькой – 2 -10 мин. Фуксин окрашивает мазки более интенсивно. А при окраске метиленовой синькой получаются нежные, более изящные препараты. Мазок после обсушивания фильтровальной бумагой должен быть совершенно сухим, в противном случае при соприкосновении оставшейся влаги с кедровым маслом образуется эмульсия и при микроскопии получится неясное изображение. Вообще же продолжительность окраски зависит от вида и качества красящего раствора, степени восприимчивости микроба к окраске и толщины мазка.
 При простой окраске микробные тела воспринимают цвет применяемой краски так же интенсивно, как и ядра клеток; в то же время цитоплазма и весь фон мазка (если это не мазок из чистой культуры) окрашиваются в тот же цвет, но несколько бледнее. Фуксин и генцианвиолет относятся к более интенсивно окрашивающим краскам; метиленовая синька окрашивает значительно бледнее. Восприятие окраски зависит не только от свойств красок, но и от свойств подвергаемых окраске микробов. Большинство микробов легко и быстро окрашивается водными или спиртоводными растворами красок. Для повышения красящей способности воздействуют на краску высокой температурой (нагреванием) до появления паров (вплоть до кипения). Варьируя степень нагревания, можно получать различные степени силы окраски. Удлинение срока воздействия красящего раствора на объект также может в известной мере усилить степень окраски.
При простой окраске микробные тела воспринимают цвет применяемой краски так же интенсивно, как и ядра клеток; в то же время цитоплазма и весь фон мазка (если это не мазок из чистой культуры) окрашиваются в тот же цвет, но несколько бледнее. Фуксин и генцианвиолет относятся к более интенсивно окрашивающим краскам; метиленовая синька окрашивает значительно бледнее. Восприятие окраски зависит не только от свойств красок, но и от свойств подвергаемых окраске микробов. Большинство микробов легко и быстро окрашивается водными или спиртоводными растворами красок. Для повышения красящей способности воздействуют на краску высокой температурой (нагреванием) до появления паров (вплоть до кипения). Варьируя степень нагревания, можно получать различные степени силы окраски. Удлинение срока воздействия красящего раствора на объект также может в известной мере усилить степень окраски.
 СЛОЖНЫЕ МЕТОДЫ ОКРАШИВАНИЯ Основаны на особенностях физико-химического строения микробной клетки. Сущность этих методов заключается в воздействии на мазок двух красящих веществ, из которых одно является основной, главной краской, а другое дополнительной - контраст. После воздействия первой краской мазок обесцвечивают и только после этого подвергают дополнительной окраске. В качестве обесцвечивающих веществ может быть применен целый ряд химических реагентов (кислоты, щелочи, спирт, ацетон и др. ). Обмывание мазка простой водой также является в какой-то степени чисто механическим процессом обесцвечивания, но для этого необходимо продолжительное время; кроме того, обесцвечивание получается неполное. По отношению к обесцвечивающим веществам можно разбить микробов на группы легко и трудно обесцвечиваемых. Не все виды микробов одинаково относятся к обесцвечивающим реагентам; некоторые являются кислото - и спиртоустойчивыми, другие только кислотоустойчивы. Наконец, некоторые, как, например, споры, энергично противостоящие воздействию всех обесцвечивающих веществ, относятся к группе краскоустойчивых.
СЛОЖНЫЕ МЕТОДЫ ОКРАШИВАНИЯ Основаны на особенностях физико-химического строения микробной клетки. Сущность этих методов заключается в воздействии на мазок двух красящих веществ, из которых одно является основной, главной краской, а другое дополнительной - контраст. После воздействия первой краской мазок обесцвечивают и только после этого подвергают дополнительной окраске. В качестве обесцвечивающих веществ может быть применен целый ряд химических реагентов (кислоты, щелочи, спирт, ацетон и др. ). Обмывание мазка простой водой также является в какой-то степени чисто механическим процессом обесцвечивания, но для этого необходимо продолжительное время; кроме того, обесцвечивание получается неполное. По отношению к обесцвечивающим веществам можно разбить микробов на группы легко и трудно обесцвечиваемых. Не все виды микробов одинаково относятся к обесцвечивающим реагентам; некоторые являются кислото - и спиртоустойчивыми, другие только кислотоустойчивы. Наконец, некоторые, как, например, споры, энергично противостоящие воздействию всех обесцвечивающих веществ, относятся к группе краскоустойчивых.
 СПОСОБ ГРАМА v На фиксированный мазок нанести генцианвиолет (бумага по Синеву) на 1 -2 мин. v Краску слить и нанести раствор Люголя на 1 мин. v Раствор Люголя слить и на мазок нанести 96% спирт на 15 -20 мин в зависимости от толщины мазка. v Спирт смыть дистиллированной водой. v Мазок дополнительно окрасить разведенным фуксином Пфейффера на 2 -3 мин. v Краситель смыть водой, препарат высушить, промикроскопировать с иммерсией Микроскопия с иммерсией. Генцианвиолет связывается с пептидогликаном клеточной стенки Толстый слой пептидогликана грамположительных бактерий связывает много красителя, тонкий слой – грамотрицательных – мало. Раствор Люголя фиксирует краситель за счет образования комплекса – краситель-пептидогликан-йод. При обработке мазка спиртом грамотрицательные микроорганизмы быстро теряют краситель и обесцвечиваются, а грамположительные остаются окрашенными в синий цвет. Дополнительный краситель окрашивает грамотрицательные микроорганизмы в красный цвет Грамположительные бактерии окрашиваются в сине-фиолетовый цвет. Грамотрицательные бактерии окрашиваются в красный цвет.
СПОСОБ ГРАМА v На фиксированный мазок нанести генцианвиолет (бумага по Синеву) на 1 -2 мин. v Краску слить и нанести раствор Люголя на 1 мин. v Раствор Люголя слить и на мазок нанести 96% спирт на 15 -20 мин в зависимости от толщины мазка. v Спирт смыть дистиллированной водой. v Мазок дополнительно окрасить разведенным фуксином Пфейффера на 2 -3 мин. v Краситель смыть водой, препарат высушить, промикроскопировать с иммерсией Микроскопия с иммерсией. Генцианвиолет связывается с пептидогликаном клеточной стенки Толстый слой пептидогликана грамположительных бактерий связывает много красителя, тонкий слой – грамотрицательных – мало. Раствор Люголя фиксирует краситель за счет образования комплекса – краситель-пептидогликан-йод. При обработке мазка спиртом грамотрицательные микроорганизмы быстро теряют краситель и обесцвечиваются, а грамположительные остаются окрашенными в синий цвет. Дополнительный краситель окрашивает грамотрицательные микроорганизмы в красный цвет Грамположительные бактерии окрашиваются в сине-фиолетовый цвет. Грамотрицательные бактерии окрашиваются в красный цвет.
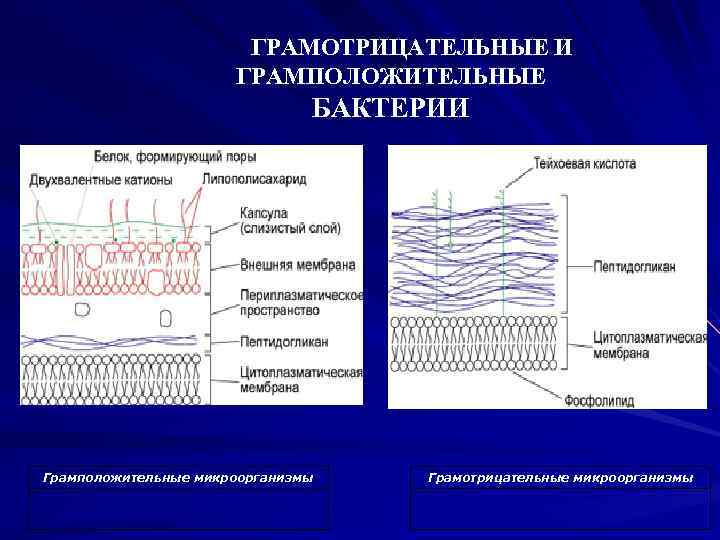
 отношение бактерий к окраске по Граму определяется их способностью удерживать образовавшийся в процессе окраски комплекс генцианового фиолетового и йода. У грамположительных бактерий основным веществом клеточной стенки (до 90%) являются мукопептиды-муреин ( пептидогликан ). У грамотрицательных бактерий однослойный муреин располагается в глубине клеточной стенки, значительно больше содержится белков и липидов, которые вместе с полисахаридами образуют поверхностные слои в виде мозаики, их цитоплазма содержит РНК и ДНК в соотношении 8: 1 и 1: 1 соответственно. Кроме того, проницаемость клеточной стенки у грамположительных бактерий меньше, чем у грамотрицательных. Это объясняется большим содержанием мукопептида в составе клеточной стенки грамположительных бактерий и меньшим диаметром пор, что способствует удержанию образовавшегося комплекса при обработке бактерий этиловым спиртом.
отношение бактерий к окраске по Граму определяется их способностью удерживать образовавшийся в процессе окраски комплекс генцианового фиолетового и йода. У грамположительных бактерий основным веществом клеточной стенки (до 90%) являются мукопептиды-муреин ( пептидогликан ). У грамотрицательных бактерий однослойный муреин располагается в глубине клеточной стенки, значительно больше содержится белков и липидов, которые вместе с полисахаридами образуют поверхностные слои в виде мозаики, их цитоплазма содержит РНК и ДНК в соотношении 8: 1 и 1: 1 соответственно. Кроме того, проницаемость клеточной стенки у грамположительных бактерий меньше, чем у грамотрицательных. Это объясняется большим содержанием мукопептида в составе клеточной стенки грамположительных бактерий и меньшим диаметром пор, что способствует удержанию образовавшегося комплекса при обработке бактерий этиловым спиртом.
 ГРАМОТРИЦАТЕЛЬНЫЕ И ГРАМПОЛОЖИТЕЛЬНЫЕ БАКТЕРИИ Грамположительные микроорганизмы Грамотрицательные микроорганизмы
ГРАМОТРИЦАТЕЛЬНЫЕ И ГРАМПОЛОЖИТЕЛЬНЫЕ БАКТЕРИИ Грамположительные микроорганизмы Грамотрицательные микроорганизмы
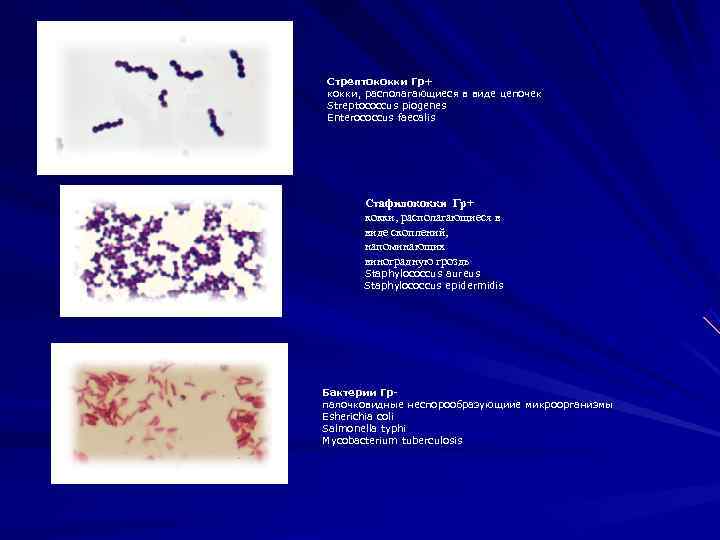
 Стрептококки Гр+ кокки, располагающиеся в виде цепочек Streptococcus piogenes Enterococcus faecalis Стафилококки Гр+ кокки, располагающиеся в виде скоплений, напоминающих виноградную гроздь Staphylococcus aureus Staphylococcus epidermidis Бактерии Гр- палочковидные неспорообразующиие микроорганизмы Esherichia coli Salmonella typhi Mycobacterium tuberculosis
Стрептококки Гр+ кокки, располагающиеся в виде цепочек Streptococcus piogenes Enterococcus faecalis Стафилококки Гр+ кокки, располагающиеся в виде скоплений, напоминающих виноградную гроздь Staphylococcus aureus Staphylococcus epidermidis Бактерии Гр- палочковидные неспорообразующиие микроорганизмы Esherichia coli Salmonella typhi Mycobacterium tuberculosis
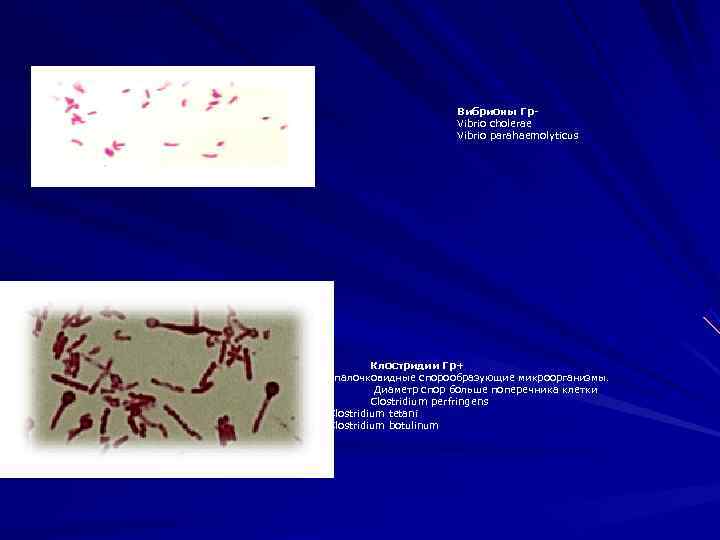
 Вибрионы Гр- Vibrio cholerae Vibrio parahaemolyticus Клостридии Гр+ ппалочковидные спорообразующие микроорганизмы. Диаметр спор больше поперечника клетки Clostridium perfringens Clostridium tetani Clostridium botulinum
Вибрионы Гр- Vibrio cholerae Vibrio parahaemolyticus Клостридии Гр+ ппалочковидные спорообразующие микроорганизмы. Диаметр спор больше поперечника клетки Clostridium perfringens Clostridium tetani Clostridium botulinum
 ДИАГНОСТИКА ТУБЕРКУЛЕЗА ЛЕГКИХ БАКТЕРИОСКОПИЧЕСКИМ МЕТОДОМ ОСНОВАНИЕ: МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ МЕЖДУНАРОДНОГО СОЮЗА БОРЬБЫ С ТУБЕРКУЛЕЗОМ. ФРАНЦИЯ, ПАРИЖ, 1999 г Приготовление мазков Бактерии обнаруживаются в плотных гнойных частицах мокроты. Захватите петлей материал и распределите тонким слоем на 2/3 части предметного стекла. Можно стекло с кусочком мокроты покрыть другим предметным стеклом, придавить друг к другу и раздавить в противоположном направлении до образования тонкого мазка. Можно для приготовления мазка пользоваться деревянными палочками. ВЫСУШИВАНИЕ Приготовленные мазки высушиваются на воздухе 15 -30 мин ФИКСАЦИЯ Медленно провести мазок в течение 3 -5 мин 3 раза через верхнюю или среднюю наиболее яркую часть пламени спиртовки.
ДИАГНОСТИКА ТУБЕРКУЛЕЗА ЛЕГКИХ БАКТЕРИОСКОПИЧЕСКИМ МЕТОДОМ ОСНОВАНИЕ: МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ МЕЖДУНАРОДНОГО СОЮЗА БОРЬБЫ С ТУБЕРКУЛЕЗОМ. ФРАНЦИЯ, ПАРИЖ, 1999 г Приготовление мазков Бактерии обнаруживаются в плотных гнойных частицах мокроты. Захватите петлей материал и распределите тонким слоем на 2/3 части предметного стекла. Можно стекло с кусочком мокроты покрыть другим предметным стеклом, придавить друг к другу и раздавить в противоположном направлении до образования тонкого мазка. Можно для приготовления мазка пользоваться деревянными палочками. ВЫСУШИВАНИЕ Приготовленные мазки высушиваются на воздухе 15 -30 мин ФИКСАЦИЯ Медленно провести мазок в течение 3 -5 мин 3 раза через верхнюю или среднюю наиболее яркую часть пламени спиртовки.
 ОКРАШИВАНИЕ а) мазок накрыть фильтровальной бумагой и на всю поверхность бумаги нанести карболовый фуксин Циля б) медленно нагревайте стекло с мазком над пламенем спиртовки до появления паров, не допуская кипения и высушивания. Оставить мазок с прогретым раствором на 5 мин ОБЕСЦВЕЧИВАНИЕ а) снять фильтровальную бумагу и удалить окрашивающий раствор под слабой струей воды б) обработать каждый мазок индивидуально 25% раствором серной кислоты в течение 3 -х минут в) смыть водой г) обработать каждое стекло в течение 5 минут 96% спиртом д) смыть водой ДОПОЛНИТЕЛЬНАЯ ОКРАСКА Обесцвеченные и промытые стекла с мазками обработать 0, 3% раствором метиленовой синьки в течение 1 минуты Промыть водой и высушить на воздухе.
ОКРАШИВАНИЕ а) мазок накрыть фильтровальной бумагой и на всю поверхность бумаги нанести карболовый фуксин Циля б) медленно нагревайте стекло с мазком над пламенем спиртовки до появления паров, не допуская кипения и высушивания. Оставить мазок с прогретым раствором на 5 мин ОБЕСЦВЕЧИВАНИЕ а) снять фильтровальную бумагу и удалить окрашивающий раствор под слабой струей воды б) обработать каждый мазок индивидуально 25% раствором серной кислоты в течение 3 -х минут в) смыть водой г) обработать каждое стекло в течение 5 минут 96% спиртом д) смыть водой ДОПОЛНИТЕЛЬНАЯ ОКРАСКА Обесцвеченные и промытые стекла с мазками обработать 0, 3% раствором метиленовой синьки в течение 1 минуты Промыть водой и высушить на воздухе.
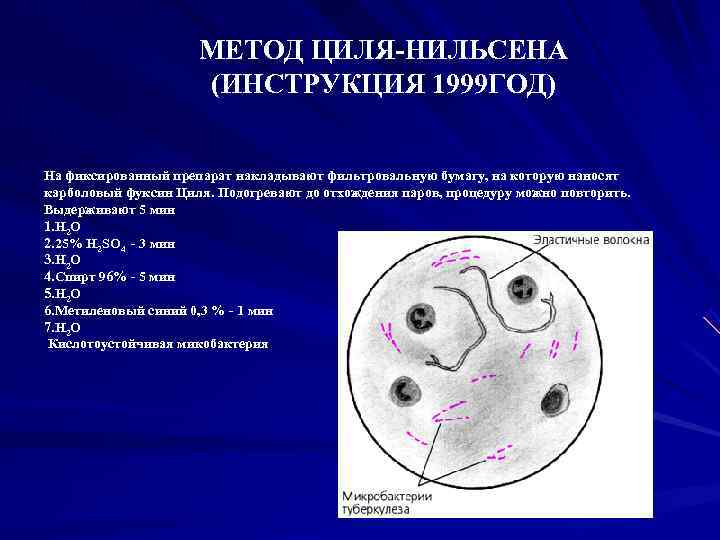
 МЕТОД ЦИЛЯ-НИЛЬСЕНА (ИНСТРУКЦИЯ 1999 ГОД) На фиксированный препарат накладывают фильтровальную бумагу, на которую наносят карболовый фуксин Циля. Подогревают до отхождения паров, процедуру можно повторить. Выдерживают 5 мин 1. Н 2 О 2. 25% Н 2 SО 4 - 3 мин 3. Н 2 О 4. Спирт 96% - 5 мин 5. Н 2 О 6. Метиленовый синий 0, 3 % - 1 мин 7. Н 2 О Кислотоустойчивая микобактерия
МЕТОД ЦИЛЯ-НИЛЬСЕНА (ИНСТРУКЦИЯ 1999 ГОД) На фиксированный препарат накладывают фильтровальную бумагу, на которую наносят карболовый фуксин Циля. Подогревают до отхождения паров, процедуру можно повторить. Выдерживают 5 мин 1. Н 2 О 2. 25% Н 2 SО 4 - 3 мин 3. Н 2 О 4. Спирт 96% - 5 мин 5. Н 2 О 6. Метиленовый синий 0, 3 % - 1 мин 7. Н 2 О Кислотоустойчивая микобактерия
 МЕТОД ЦИЛЯ-НИЛЬСЕНА 1. На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза) 2. Н 2 О 3. 5% Н 2 SО 4 (погружая 2 -3 раза) 4. Н 2 О 5. Метиленовый синий 1 % - 3 -5 мин 6. Н 2 О 7. Микроскопия с иммерсией. Кислотоустойчивые бактерии окрашиваются в красный цвет, остальные – в синий (рис. № 4, 5). Mycobacterium tuberculosis в мокроте
МЕТОД ЦИЛЯ-НИЛЬСЕНА 1. На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза) 2. Н 2 О 3. 5% Н 2 SО 4 (погружая 2 -3 раза) 4. Н 2 О 5. Метиленовый синий 1 % - 3 -5 мин 6. Н 2 О 7. Микроскопия с иммерсией. Кислотоустойчивые бактерии окрашиваются в красный цвет, остальные – в синий (рис. № 4, 5). Mycobacterium tuberculosis в мокроте
 ОБНАРУЖЕНИЕ КАПСУЛ У БАКТЕРИЙ Некоторые микробы обладают способностью откладывать на поверхности своего тела мощный слизистый слой вокруг клеточной стенки. Его называют капсулой. В состав капсул входят, главным образом, полисахариды (пневмококк), но у некоторых они содержат и полипептиды (палочка сибирской язвы). Капсулы имеют консистенцию геля, поэтому при микроскопии живых бактерий они видны очень плохо. Для обнаружения применяют негативную окраску. При этом краситель заполняет пространство вокруг бактерий, в результате чего они выглядят светлыми частицами на темном фоне. ОБНАРУЖЕНИЕ КАПСУЛ ПО МЕТОДУ БУРРИ Смешать на предметном стекле немного культуры и каплю туши, разведенной 1: 10. Ребром шлифовального стекла сделать тонкий мазок, также как мазок крови: каплю туши наносят на предметное стекло на расстояние одной трети от левого края. В эту каплю бак. петлей вносят культуру. Затем краем специально отшлифованного стекла, наклонив его под углом 45 О, прикасаются к капле туши с культурой. Прижимая отшлифованное стекло к предметному продвигают его вперед. Мазок заканчивается «метелочкой» Сбросить шлифовальное стекло в дез. Средство. Высушить на воздухе Бактериоскопировать.
ОБНАРУЖЕНИЕ КАПСУЛ У БАКТЕРИЙ Некоторые микробы обладают способностью откладывать на поверхности своего тела мощный слизистый слой вокруг клеточной стенки. Его называют капсулой. В состав капсул входят, главным образом, полисахариды (пневмококк), но у некоторых они содержат и полипептиды (палочка сибирской язвы). Капсулы имеют консистенцию геля, поэтому при микроскопии живых бактерий они видны очень плохо. Для обнаружения применяют негативную окраску. При этом краситель заполняет пространство вокруг бактерий, в результате чего они выглядят светлыми частицами на темном фоне. ОБНАРУЖЕНИЕ КАПСУЛ ПО МЕТОДУ БУРРИ Смешать на предметном стекле немного культуры и каплю туши, разведенной 1: 10. Ребром шлифовального стекла сделать тонкий мазок, также как мазок крови: каплю туши наносят на предметное стекло на расстояние одной трети от левого края. В эту каплю бак. петлей вносят культуру. Затем краем специально отшлифованного стекла, наклонив его под углом 45 О, прикасаются к капле туши с культурой. Прижимая отшлифованное стекло к предметному продвигают его вперед. Мазок заканчивается «метелочкой» Сбросить шлифовальное стекло в дез. Средство. Высушить на воздухе Бактериоскопировать.
 ОБНАРУЖЕНИЕ КАПСУЛ ПО МЕТОДУ БУРРИ-ГИНСА Приготовить мазок на предметном стекле по методу Бурри Высушить на воздухе Фиксировать химическим способом: погружение стекла в емкость со спиртом или сулемой – 10 мин, или со смесью Никифорова (спирт и эфир 1: 1) – 15 -20 мин Осторожно промыть водой На мазок нанести фуксин Пфейффера – 3 -5 мин Промыть Н 2 О Высушить на воздухе Микроскопия с иммерсией. Внимание! Фильтровальной бумагой не пользоваться, чтобы не повредить препарат. Препарат по Бурри – Гинсу под микроскопом: фон черный, клетки бактерий красные, капсулы неокрашенные (красители не воспринимают). Окраска по Бурри и Бурри-Гинсу
ОБНАРУЖЕНИЕ КАПСУЛ ПО МЕТОДУ БУРРИ-ГИНСА Приготовить мазок на предметном стекле по методу Бурри Высушить на воздухе Фиксировать химическим способом: погружение стекла в емкость со спиртом или сулемой – 10 мин, или со смесью Никифорова (спирт и эфир 1: 1) – 15 -20 мин Осторожно промыть водой На мазок нанести фуксин Пфейффера – 3 -5 мин Промыть Н 2 О Высушить на воздухе Микроскопия с иммерсией. Внимание! Фильтровальной бумагой не пользоваться, чтобы не повредить препарат. Препарат по Бурри – Гинсу под микроскопом: фон черный, клетки бактерий красные, капсулы неокрашенные (красители не воспринимают). Окраска по Бурри и Бурри-Гинсу
 ОКРАСКА ПО БУРРИ И БУРРИ-ГИНСУ Капсула у Klebsiella pneumoniae
ОКРАСКА ПО БУРРИ И БУРРИ-ГИНСУ Капсула у Klebsiella pneumoniae
 МЕТОД ОЖЕШКО сходен с методом Циля-Нильсена, но отличается использованием раствора соляной кислоты в качестве протравы, разрыхляющей оболочку споры, которая плохо воспринимает красители. Кислотоустойчивые споры окрашиваются в розово-красный, а бактериальная клетка в голубой цвет. Рис. № 9. Споры у Bacillus subtilis
МЕТОД ОЖЕШКО сходен с методом Циля-Нильсена, но отличается использованием раствора соляной кислоты в качестве протравы, разрыхляющей оболочку споры, которая плохо воспринимает красители. Кислотоустойчивые споры окрашиваются в розово-красный, а бактериальная клетка в голубой цвет. Рис. № 9. Споры у Bacillus subtilis
 ОКРАСКА ПО МЕТОДУ ОЖЕШКО На высушенный мазок (нефиксированный!) + несколько капель 0, 5% НCl, держать над пламенем спиртовки до образования паров Высушивают и фиксируют физическим способом Окрашивают по методу Циля-Нильсена: На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза) Н 2 О 5% Н 2 SО 4 (погружая 2 -3 раза) Н 2 О Метиленовый синий 1 % - 3 -5 мин Н 2 О Микроскопия с иммерсией
ОКРАСКА ПО МЕТОДУ ОЖЕШКО На высушенный мазок (нефиксированный!) + несколько капель 0, 5% НCl, держать над пламенем спиртовки до образования паров Высушивают и фиксируют физическим способом Окрашивают по методу Циля-Нильсена: На фиксированный препарат + фильтровальная бумага + фуксин Циля. Подогреваем до отхождения паров + краситель (2 раза) Н 2 О 5% Н 2 SО 4 (погружая 2 -3 раза) Н 2 О Метиленовый синий 1 % - 3 -5 мин Н 2 О Микроскопия с иммерсией
 Изучение подвижности микроорганизмов. Подвижности бактерий важный видовой признак и производиться при диагностических исследованиях: результат учитывают при идентификации микроорганизмов. У подвижных видов способность самостоятельного поступательного (и вращательного) движения обусловлена наличием жгутиков -специальных тонких нитевидных образований.
Изучение подвижности микроорганизмов. Подвижности бактерий важный видовой признак и производиться при диагностических исследованиях: результат учитывают при идентификации микроорганизмов. У подвижных видов способность самостоятельного поступательного (и вращательного) движения обусловлена наличием жгутиков -специальных тонких нитевидных образований.
 МЕТОД РАЗДАВЛЕННОЙ КАПЛИ На предметное стекло наносят пипеткой или петлей каплю культуры и покрывают ее покровным стеклом. !Чтобы не образовалось пузырьков воздуха, покровное стекло подводят ребром к краю капли и резко опускают его. Для предохранения от высыхания препарат помещают во влажную камеру Микроскопируют в темном поле при увеличении объектива 40 Х Препарат можно поместить во влажную камеру для предохранения от высыхания
МЕТОД РАЗДАВЛЕННОЙ КАПЛИ На предметное стекло наносят пипеткой или петлей каплю культуры и покрывают ее покровным стеклом. !Чтобы не образовалось пузырьков воздуха, покровное стекло подводят ребром к краю капли и резко опускают его. Для предохранения от высыхания препарат помещают во влажную камеру Микроскопируют в темном поле при увеличении объектива 40 Х Препарат можно поместить во влажную камеру для предохранения от высыхания
 Жгутики бывают различной длины. Их диаметр настолько мал, что они невидимы в световом микроскопе (менее 0, 2 мкм). У разных групп бактерий количество и расположение жгутиков неодинаково. Жгутики плохо воспринимают красители. Методы сложной окраски искажают подлинный вид жгутиков, поэтому в лабораториях окраску жгутиков не осуществляют, а исследуют бактерии в живом состоянии. В зависимости от расположения и количества жгутиков микробы подразделяют: а) монотрихи - микроорганизмы, имеющие на одном из полюсов один жгутик, движения активные, поступательные (псевдомонас); б) лофотрихи - микробы, имеющие на одном из полюсов пучок жгутиков (листерии); в) амфитрихи - микробы, имеющие жгутики на обоих полюсах микробной клетки; г) перитрихи - микробы, у которых жгутики расположены по всей поверхности клетки(E. coli). Есть виды микроорганизмов, обладающие подвижностью, но жгутиков не имеют (спирохеты, лептоспиры). Их движение обусловлено импульсивными сокращениями двигательного фибриллярного аппарата микробной клетки.
Жгутики бывают различной длины. Их диаметр настолько мал, что они невидимы в световом микроскопе (менее 0, 2 мкм). У разных групп бактерий количество и расположение жгутиков неодинаково. Жгутики плохо воспринимают красители. Методы сложной окраски искажают подлинный вид жгутиков, поэтому в лабораториях окраску жгутиков не осуществляют, а исследуют бактерии в живом состоянии. В зависимости от расположения и количества жгутиков микробы подразделяют: а) монотрихи - микроорганизмы, имеющие на одном из полюсов один жгутик, движения активные, поступательные (псевдомонас); б) лофотрихи - микробы, имеющие на одном из полюсов пучок жгутиков (листерии); в) амфитрихи - микробы, имеющие жгутики на обоих полюсах микробной клетки; г) перитрихи - микробы, у которых жгутики расположены по всей поверхности клетки(E. coli). Есть виды микроорганизмов, обладающие подвижностью, но жгутиков не имеют (спирохеты, лептоспиры). Их движение обусловлено импульсивными сокращениями двигательного фибриллярного аппарата микробной клетки.
 Определение подвижности бактерий методом «висячая капля» . Каплю молодой (18 -20 часовой) бульонной культуры бактерий бактериологической петлей наносят на покровное стекло. Специальным предметным стеклом с углублением (луночкой) накрывают каплю культуры так, чтобы покровное стекло с каплей находилось в центре луночки и прилипло к предметному стеклу (края луночки предварительно слегка смазывают вазелином). Препарат перевертывают стеклом вверх, и капля «повисает» над луночкой. Препарат микроскопируют при затемненном поле зрения, сначала при малом, затем при среднем или большом увеличении. На светлом фоне микробы темно-серые
Определение подвижности бактерий методом «висячая капля» . Каплю молодой (18 -20 часовой) бульонной культуры бактерий бактериологической петлей наносят на покровное стекло. Специальным предметным стеклом с углублением (луночкой) накрывают каплю культуры так, чтобы покровное стекло с каплей находилось в центре луночки и прилипло к предметному стеклу (края луночки предварительно слегка смазывают вазелином). Препарат перевертывают стеклом вверх, и капля «повисает» над луночкой. Препарат микроскопируют при затемненном поле зрения, сначала при малом, затем при среднем или большом увеличении. На светлом фоне микробы темно-серые
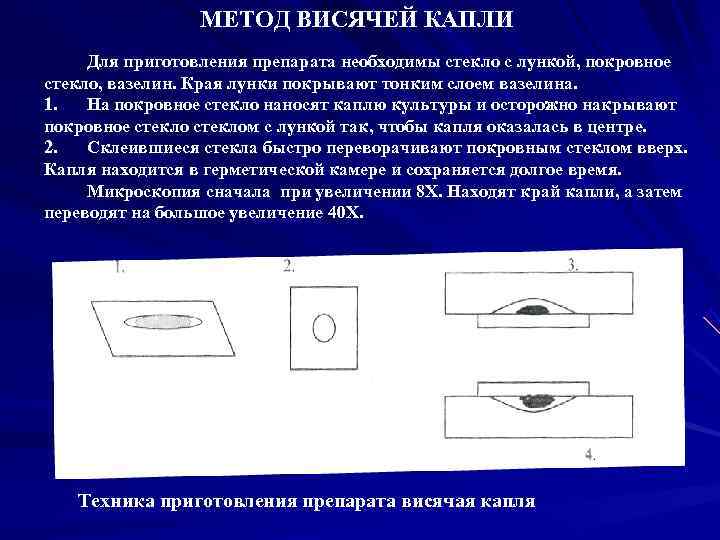
 МЕТОД ВИСЯЧЕЙ КАПЛИ Для приготовления препарата необходимы стекло с лункой, покровное стекло, вазелин. Края лунки покрывают тонким слоем вазелина. 1. На покровное стекло наносят каплю культуры и осторожно накрывают покровное стеклом с лункой так, чтобы капля оказалась в центре. 2. Склеившиеся стекла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время. Микроскопия сначала при увеличении 8 Х. Находят край капли, а затем переводят на большое увеличение 40 Х. Техника приготовления препарата висячая капля
МЕТОД ВИСЯЧЕЙ КАПЛИ Для приготовления препарата необходимы стекло с лункой, покровное стекло, вазелин. Края лунки покрывают тонким слоем вазелина. 1. На покровное стекло наносят каплю культуры и осторожно накрывают покровное стеклом с лункой так, чтобы капля оказалась в центре. 2. Склеившиеся стекла быстро переворачивают покровным стеклом вверх. Капля находится в герметической камере и сохраняется долгое время. Микроскопия сначала при увеличении 8 Х. Находят край капли, а затем переводят на большое увеличение 40 Х. Техника приготовления препарата висячая капля
