Л5,Л6 - Термодинамика,Хим.Кинетика.ppt
- Количество слайдов: 34
 Термодинамика — наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы. Система — это совокупность материальных объектов, отделённых от окружающей среды. Окружающая среда — остальная часть пространства. Изолированная система не обменивается с окружающей средой ни массой, ни энергией. Закрытая с — обменивается со средой лишь энергией, открытая c— обменивается с окружающей средой и массой, и энергией.
Термодинамика — наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы. Система — это совокупность материальных объектов, отделённых от окружающей среды. Окружающая среда — остальная часть пространства. Изолированная система не обменивается с окружающей средой ни массой, ни энергией. Закрытая с — обменивается со средой лишь энергией, открытая c— обменивается с окружающей средой и массой, и энергией.
 • Термодинамическими параметры : • экстенсивные параметры (объём, масса) и • интенсивные параметры (температура, давление, вязкость, концентрация и т. д. ). • процессы, • - ---происходящие при постоянном объёме — изохорные, • --- при постоянном давлении — изобарные • - ---при постоянной температуре — изотермические.
• Термодинамическими параметры : • экстенсивные параметры (объём, масса) и • интенсивные параметры (температура, давление, вязкость, концентрация и т. д. ). • процессы, • - ---происходящие при постоянном объёме — изохорные, • --- при постоянном давлении — изобарные • - ---при постоянной температуре — изотермические.
 • Термодинамические функции состояния – • 1. U – внутренняя энергия – сумма потенциальной энергии взаимодействия всех частиц в системе и кинетической энергии их движения. • 2. S – энтропия -мера неупорядоченности в системе, т. е. неоднородности расположения и движения частиц. S=k∙ln. W; k - постоянная Больцмана. W – термодинамическая вероятность, • Для химических реакций справедливо: • Δ S 0 р-ии = ΣΔ S 0 i (продуктов) - ΣΔ S 0 i (исходных веществ).
• Термодинамические функции состояния – • 1. U – внутренняя энергия – сумма потенциальной энергии взаимодействия всех частиц в системе и кинетической энергии их движения. • 2. S – энтропия -мера неупорядоченности в системе, т. е. неоднородности расположения и движения частиц. S=k∙ln. W; k - постоянная Больцмана. W – термодинамическая вероятность, • Для химических реакций справедливо: • Δ S 0 р-ии = ΣΔ S 0 i (продуктов) - ΣΔ S 0 i (исходных веществ).
 Н – энтальпия – теплосодержание системы. . QР = -Δ Н. Изменение энтальпии при стандартных условиях - Δ Но. • Для определения Δ Но реакции справедливо: • Δ Н 0 р-ии = Σ Δ Н 0 i (продуктов) - Σ Δ Н 0 i (исходных веществ). • •
Н – энтальпия – теплосодержание системы. . QР = -Δ Н. Изменение энтальпии при стандартных условиях - Δ Но. • Для определения Δ Но реакции справедливо: • Δ Н 0 р-ии = Σ Δ Н 0 i (продуктов) - Σ Δ Н 0 i (исходных веществ). • •
 • G - энергия Гиббса –в к. Дж/моль по формуле: • ΔG° = Δ Н 0 - ТΔS 0 : • для простых веществ ΔG° = 0, • ΔG 0 реакции = Σ ΔG 0 i (прод. ) - Σ ΔG 0 i (исх. В-в).
• G - энергия Гиббса –в к. Дж/моль по формуле: • ΔG° = Δ Н 0 - ТΔS 0 : • для простых веществ ΔG° = 0, • ΔG 0 реакции = Σ ΔG 0 i (прод. ) - Σ ΔG 0 i (исх. В-в).
 • Термохимия - это раздел химии, изучающий тепловые эффекты химических процессов. • I закон термохимии Лавуазье-Лапласа гласит: • Тепловой эффект образования данного соединения равен тепловому эффекту его разложения, но имеет противоположный знак. • II закон термохимии Гесса : • Тепловые эффекты химических реакций, зависят только от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций.
• Термохимия - это раздел химии, изучающий тепловые эффекты химических процессов. • I закон термохимии Лавуазье-Лапласа гласит: • Тепловой эффект образования данного соединения равен тепловому эффекту его разложения, но имеет противоположный знак. • II закон термохимии Гесса : • Тепловые эффекты химических реакций, зависят только от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций.
 • Из закона Гесса вытекают 2 следствия: • 1 следствие: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции ( Н˚прод. ) и суммой теплот образования исходных веществ ( Н˚исх. в-в), взятых с соответствующими стехиометрическими коэффициентами. • Математическое выражение этого следствия: • Н˚ = Н˚прод. – Н˚исх. в-в • 2 следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, взятых с учётом стехиометрических коэффициентов.
• Из закона Гесса вытекают 2 следствия: • 1 следствие: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции ( Н˚прод. ) и суммой теплот образования исходных веществ ( Н˚исх. в-в), взятых с соответствующими стехиометрическими коэффициентами. • Математическое выражение этого следствия: • Н˚ = Н˚прод. – Н˚исх. в-в • 2 следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, взятых с учётом стехиометрических коэффициентов.
 • Первый закон термодинамики • Для изолированных систем: внутренняя энергия т. с. постоянна (∆U=0). • Для закрытых систем: сообщаемая системе теплота расходуется на увеличение внутренней энергии и совершение работы против внешних сил: т. е. Q=∆U+A=∆U+P∆V. • В изохорном процессе (V= const) A=0, тогда QV =∆U • В изобарном процессе (р=const). • QР=∆H, т. е • В открытых биологических системах Q=∆U-A
• Первый закон термодинамики • Для изолированных систем: внутренняя энергия т. с. постоянна (∆U=0). • Для закрытых систем: сообщаемая системе теплота расходуется на увеличение внутренней энергии и совершение работы против внешних сил: т. е. Q=∆U+A=∆U+P∆V. • В изохорном процессе (V= const) A=0, тогда QV =∆U • В изобарном процессе (р=const). • QР=∆H, т. е • В открытых биологических системах Q=∆U-A
 • Второй закон термодинамики: • самопроизвольно могут протекать только такие процессы, в результате которых ∆G<0. • Реакции, для которых • ----∆G<0 называются экзергонические, • ----∆G>0 – эндергонические. •
• Второй закон термодинамики: • самопроизвольно могут протекать только такие процессы, в результате которых ∆G<0. • Реакции, для которых • ----∆G<0 называются экзергонические, • ----∆G>0 – эндергонические. •
 • Химическое равновесие. • необратимые - идут в одном направлении до полного израсходования одного из реагирующих веществ. • обратимые – одновременно могут протекать две взаимно противоположные реакции. • Обратимые реакции заканчиваются наступлением химического равновесия, когда Vпр = Vобр и G→min (значит ∆G→ 0); • смещение равновесия (в соответствии с принципом Ле. Шателье: • если на систему, находящуюся в состоянии химического равновесия подействовать изменением внешних факторов (P, C, T), то в системе усилится тот процесс, который препятствует этому воздействию.
• Химическое равновесие. • необратимые - идут в одном направлении до полного израсходования одного из реагирующих веществ. • обратимые – одновременно могут протекать две взаимно противоположные реакции. • Обратимые реакции заканчиваются наступлением химического равновесия, когда Vпр = Vобр и G→min (значит ∆G→ 0); • смещение равновесия (в соответствии с принципом Ле. Шателье: • если на систему, находящуюся в состоянии химического равновесия подействовать изменением внешних факторов (P, C, T), то в системе усилится тот процесс, который препятствует этому воздействию.
 • По величине Кр можно судить о направлении и глубине процесса в данных условиях. • lg. Кр=-ΔG 0 / 2, 3 RT • Если Кр>1 равновесие смещено вправо (ΔG 0 р-ции<0). • Если Кр<1 равновесие смещено влево (ΔG 0>0) • Если Кр=1 система находится в состоянии равновесия (ΔG 0=0).
• По величине Кр можно судить о направлении и глубине процесса в данных условиях. • lg. Кр=-ΔG 0 / 2, 3 RT • Если Кр>1 равновесие смещено вправо (ΔG 0 р-ции<0). • Если Кр<1 равновесие смещено влево (ΔG 0>0) • Если Кр=1 система находится в состоянии равновесия (ΔG 0=0).
 • В живом организме (открытая система) вместо термодинамического равновесия наступает стационарное состояние, которое характеризуется не равенством прямого и обратного процессов, а постоянством скорости химических изменений и отводом метаболитов.
• В живом организме (открытая система) вместо термодинамического равновесия наступает стационарное состояние, которое характеризуется не равенством прямого и обратного процессов, а постоянством скорости химических изменений и отводом метаболитов.
 • В 1946 -1960 гг. И. Пригожин: • Стационарное состояние ЖО соответсвет минимальный прирост энтропии: d. S→ min • d. S=d. Sl +d. Si • d. Sl 0 внутри организма • d. Si 0 изменение при связи с внешней средой • /d. Sl/ / d. Si /
• В 1946 -1960 гг. И. Пригожин: • Стационарное состояние ЖО соответсвет минимальный прирост энтропии: d. S→ min • d. S=d. Sl +d. Si • d. Sl 0 внутри организма • d. Si 0 изменение при связи с внешней средой • /d. Sl/ / d. Si /
 • Химическая кинетика — это учение о скорости и механизме химических реакций. • Скорость химической реакции — это количество элементарных актов взаимодействия в единицу времени в единице объёма [для гомогенной среды] или на единице поверхности раздела фаз [в гетерогенной среде].
• Химическая кинетика — это учение о скорости и механизме химических реакций. • Скорость химической реакции — это количество элементарных актов взаимодействия в единицу времени в единице объёма [для гомогенной среды] или на единице поверхности раздела фаз [в гетерогенной среде].
 • Скорость гомогенной реакции зависит • • от: - природы реагирующих веществ; - концентрации реагентов; - температуры; - катализатора. ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ -----их состава ( фтор и иод), -----вид частиц, которые участвуют в реакции: атомы, молекулы, ионы или радикалы.
• Скорость гомогенной реакции зависит • • от: - природы реагирующих веществ; - концентрации реагентов; - температуры; - катализатора. ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ -----их состава ( фтор и иод), -----вид частиц, которые участвуют в реакции: атомы, молекулы, ионы или радикалы.
 ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ • законом действующих масс (1867 г. К. М. Гульдберг и П. Вааге. ) : • Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам. • a. A + b. B = d. D • v = K • CАa • CВ b , • где К — константа скорости -численно равна скорости при концентрации в-в равной 1 моль/л.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ • законом действующих масс (1867 г. К. М. Гульдберг и П. Вааге. ) : • Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам. • a. A + b. B = d. D • v = K • CАa • CВ b , • где К — константа скорости -численно равна скорости при концентрации в-в равной 1 моль/л.
 • • • • Молекулярность — это минимальное число различных частиц, участвующих в элементарном акте химического взаимодействия. СН 4 → С + 2 Н 2 -мономолекулярная Н 2 + I 2 → 2 HI - би 2 KMn. O 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 → K 2 SO 4 + 2 Mn. SO 4 + 8 H 2 O + 10 CO 2 три Порядок реакции — это сумма показателей степеней в математическом выражении закона действия масс: a. A + b. B = d. D v = K • CА a • CВ b , n = a + b … — общий порядок реакции. Показатель степени при какой-либо одной концентрации определяет порядок реакции по данному компоненту. Например, а — показывает порядок реакции по компоненту А и т. д. Различают реакции I порядка: С + О 2 = СО 2 v = K[O 2] В реакциях II порядка скорость : H 2 + I 2 = 2 HI v = K[H 2][I 2] уравнение II порядка: 1 + 1 = 2 2 2 Н 2 О ↔ 2 Н 2 + О 2 v = K[H 2 O] прямая реакция II порядка, а обратная — III порядка: v 2[O ] 2 + 1 = 3 = K[H 2] 2 Реакция III порядка в газовой фазе — окисление оксида азота [II]: 2 NO + O 2 → 2 NO 2
• • • • Молекулярность — это минимальное число различных частиц, участвующих в элементарном акте химического взаимодействия. СН 4 → С + 2 Н 2 -мономолекулярная Н 2 + I 2 → 2 HI - би 2 KMn. O 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 → K 2 SO 4 + 2 Mn. SO 4 + 8 H 2 O + 10 CO 2 три Порядок реакции — это сумма показателей степеней в математическом выражении закона действия масс: a. A + b. B = d. D v = K • CА a • CВ b , n = a + b … — общий порядок реакции. Показатель степени при какой-либо одной концентрации определяет порядок реакции по данному компоненту. Например, а — показывает порядок реакции по компоненту А и т. д. Различают реакции I порядка: С + О 2 = СО 2 v = K[O 2] В реакциях II порядка скорость : H 2 + I 2 = 2 HI v = K[H 2][I 2] уравнение II порядка: 1 + 1 = 2 2 2 Н 2 О ↔ 2 Н 2 + О 2 v = K[H 2 O] прямая реакция II порядка, а обратная — III порядка: v 2[O ] 2 + 1 = 3 = K[H 2] 2 Реакция III порядка в газовой фазе — окисление оксида азота [II]: 2 NO + O 2 → 2 NO 2
 • • • фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых]. Эффективность фотохимической реакции определяется так называемым квантовым выходом γ: γ = число молекул продукта реакции число поглощённых квантов Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз : hν 2 HCl → H 2 + Cl 2 Фотосинтез, происходящий в растениях — сложный окислительновосстановительный процесс, сочетающий фотохимические реакции с ферментативными. | CO 2 + 2 H 2 O → [H—C—OH]n + O 2 |
• • • фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых]. Эффективность фотохимической реакции определяется так называемым квантовым выходом γ: γ = число молекул продукта реакции число поглощённых квантов Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз : hν 2 HCl → H 2 + Cl 2 Фотосинтез, происходящий в растениях — сложный окислительновосстановительный процесс, сочетающий фотохимические реакции с ферментативными. | CO 2 + 2 H 2 O → [H—C—OH]n + O 2 |
![Влияние температуры: • Правило Вант-Гоффа [1884] читается так: где • При повышении температуры на Влияние температуры: • Правило Вант-Гоффа [1884] читается так: где • При повышении температуры на](https://present5.com/presentation/3/-30500059_18305465.pdf-img/-30500059_18305465.pdf-19.jpg) Влияние температуры: • Правило Вант-Гоффа [1884] читается так: где • При повышении температуры на 10˚ скорость химической реакции увеличивается в 2 -4 раза. vt 2 — скорость реакции при конечной температуре; vt 1 — скорость реакции при начальной температуре; γ — температурный коэффициент, зависящий от природы реагирующих веществ
Влияние температуры: • Правило Вант-Гоффа [1884] читается так: где • При повышении температуры на 10˚ скорость химической реакции увеличивается в 2 -4 раза. vt 2 — скорость реакции при конечной температуре; vt 1 — скорость реакции при начальной температуре; γ — температурный коэффициент, зависящий от природы реагирующих веществ
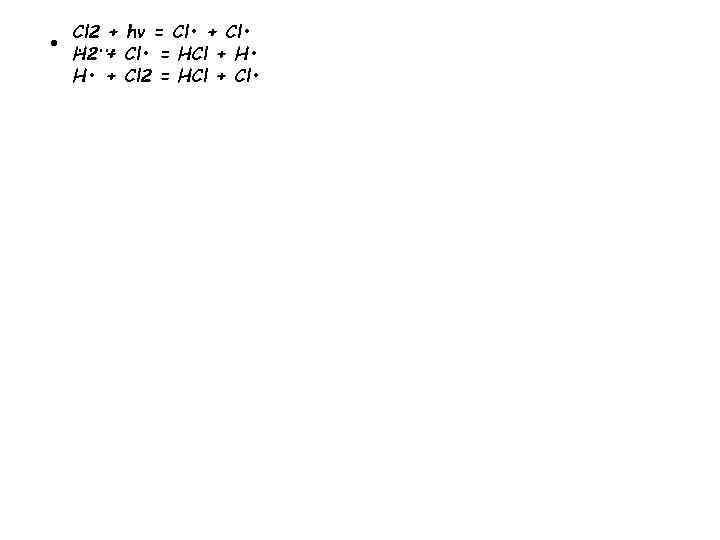 • Cl 2 + hν = Cl • + Cl • ……. H 2 + Cl • = HCl + H • + Cl 2 = HCl + Cl •
• Cl 2 + hν = Cl • + Cl • ……. H 2 + Cl • = HCl + H • + Cl 2 = HCl + Cl •
 • В 1889 г. С. Аррениус предположил, что влияние температуры сводится к увеличению числа активных молекул • • где К — константа скорости реакции; е — основание натуральных логарифмов, Т — абсолютная температура, R — газовая постоянная; Еакт — энергия активации [к. Дж/моль], А — предэкспоненциальный множитель или коэффициент, равный общему числу соударений за единицу времени в единице объёма.
• В 1889 г. С. Аррениус предположил, что влияние температуры сводится к увеличению числа активных молекул • • где К — константа скорости реакции; е — основание натуральных логарифмов, Т — абсолютная температура, R — газовая постоянная; Еакт — энергия активации [к. Дж/моль], А — предэкспоненциальный множитель или коэффициент, равный общему числу соударений за единицу времени в единице объёма.

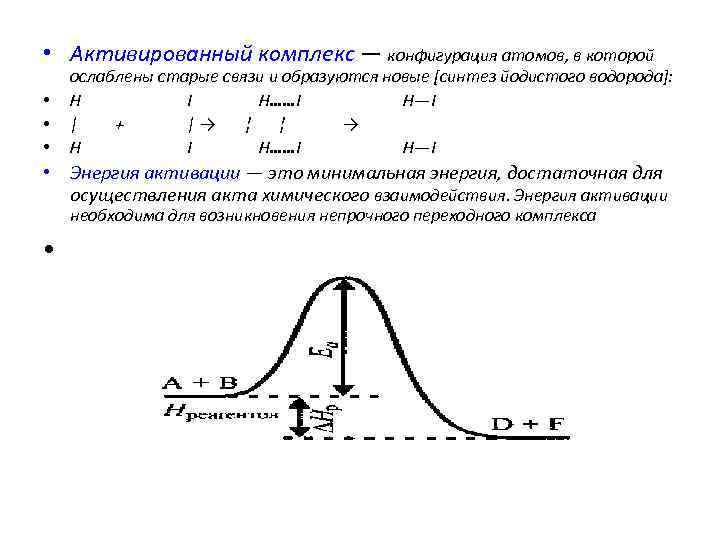 • Активированный комплекс — конфигурация атомов, в которой • • • ослаблены старые связи и образуются новые [синтез йодистого водорода]: H I H……I H—I | + |→ ¦ ¦ → H I H……I H—I • Энергия активации — это минимальная энергия, достаточная для осуществления акта химического взаимодействия. Энергия активации необходима для возникновения непрочного переходного комплекса •
• Активированный комплекс — конфигурация атомов, в которой • • • ослаблены старые связи и образуются новые [синтез йодистого водорода]: H I H……I H—I | + |→ ¦ ¦ → H I H……I H—I • Энергия активации — это минимальная энергия, достаточная для осуществления акта химического взаимодействия. Энергия активации необходима для возникновения непрочного переходного комплекса •
 Катализом называется явление изменения скорости реакции под воздействием небольших добавок специфических веществ, количество которых в ходе реакции не изменяется • По влиянию на скорость реакции • 1. Положительный катализ увеличивает скорость реакции • 2. Отрицательный катализ уменьшает скорость реакции • вещества, которые усиливают действие катализатора — промоторы, активаторы • Вещества, понижающие активность катализатора, - каталитические яды
Катализом называется явление изменения скорости реакции под воздействием небольших добавок специфических веществ, количество которых в ходе реакции не изменяется • По влиянию на скорость реакции • 1. Положительный катализ увеличивает скорость реакции • 2. Отрицательный катализ уменьшает скорость реакции • вещества, которые усиливают действие катализатора — промоторы, активаторы • Вещества, понижающие активность катализатора, - каталитические яды
 • По различным механизмам катализа различают: • 1. Гомогенный. • 2. Гетерогенный. • 3. Микрогетерогенный. • 4. Аутокатализ. • 5. Катализ в скрытой форме. • 6. Ферментативный.
• По различным механизмам катализа различают: • 1. Гомогенный. • 2. Гетерогенный. • 3. Микрогетерогенный. • 4. Аутокатализ. • 5. Катализ в скрытой форме. • 6. Ферментативный.
 • При гомогенном катализе реагирующие вещества и катализатор составляют одну фазу — газовую или жидкую. . • Механизм гетерогенного катализа различен. в присутствии Mn. O 2 : • 2 KCl. O 3 = 2 KCl + 3 O 2 • 1. 2 KCl. O 3 + 4 Mn. O 2 = 2 KCl + 2 Mn 2 O 7 • 2 2 Mn 2 O 7 = 4 Mn. O 2 + 3 O 2 • Разновидностью гетерогенного катализа является микрогетерогенный катализ, когда катализатор находится в коллоидном состоянии [ВМС] — ферменты. •
• При гомогенном катализе реагирующие вещества и катализатор составляют одну фазу — газовую или жидкую. . • Механизм гетерогенного катализа различен. в присутствии Mn. O 2 : • 2 KCl. O 3 = 2 KCl + 3 O 2 • 1. 2 KCl. O 3 + 4 Mn. O 2 = 2 KCl + 2 Mn 2 O 7 • 2 2 Mn 2 O 7 = 4 Mn. O 2 + 3 O 2 • Разновидностью гетерогенного катализа является микрогетерогенный катализ, когда катализатор находится в коллоидном состоянии [ВМС] — ферменты. •
 • Аутокатализ — катализ, при котором катализатором является один из продуктов реакции, например: • 2 KMn. O 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 = 2 Mn. SO 4 + 10 CO 2 + K 2 SO 4 + 8 H 2 O • Катализатором служат образующиеся ионы Mn 2+. • Катализ в скрытой форме. : • ---- Вода • ------Каталитическое влияние оказывают стенки сосуда •
• Аутокатализ — катализ, при котором катализатором является один из продуктов реакции, например: • 2 KMn. O 4 + 5 H 2 C 2 O 4 + 3 H 2 SO 4 = 2 Mn. SO 4 + 10 CO 2 + K 2 SO 4 + 8 H 2 O • Катализатором служат образующиеся ионы Mn 2+. • Катализ в скрытой форме. : • ---- Вода • ------Каталитическое влияние оказывают стенки сосуда •
 • Ферментативный катализ. • ферменты — биологические катализаторы
• Ферментативный катализ. • ферменты — биологические катализаторы
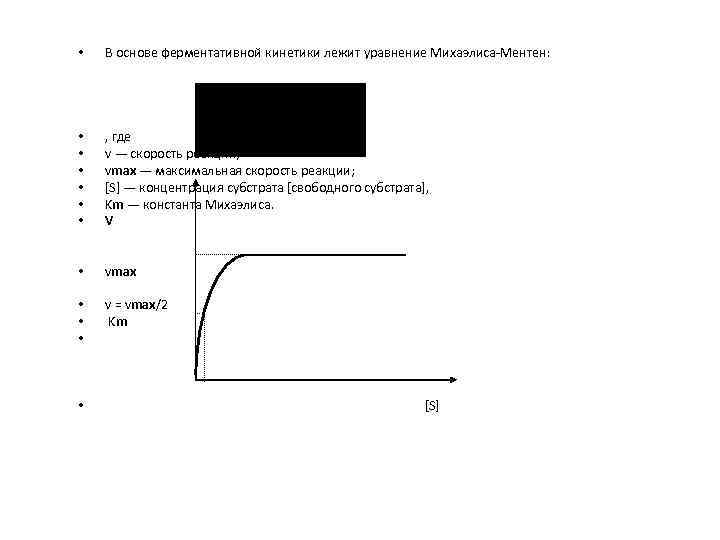 • В основе ферментативной кинетики лежит уравнение Михаэлиса-Ментен: • • • , где v — скорость реакции; vmax — максимальная скорость реакции; [S] — концентрация субстрата [свободного субстрата], Km — константа Михаэлиса. V • vmax • • • v = vmax/2 Km • [S]
• В основе ферментативной кинетики лежит уравнение Михаэлиса-Ментен: • • • , где v — скорость реакции; vmax — максимальная скорость реакции; [S] — концентрация субстрата [свободного субстрата], Km — константа Михаэлиса. V • vmax • • • v = vmax/2 Km • [S]
 • Ингибирование ферментов. • Ингибиторами ферментов являются: антибиотики, антивирусные средства, противоопухолевые средства, инсектициды, гербициды. • Ингибирование конкурентное: . Нужно повысить концентрацию субстрата, чтобы вытеснить ингибитор. • Ингибирование неконкурентное: ингибитор, субстрат и фермент образуют тройной комплекс. Повышение концентрации субстрата не помогает. • Существует и необратимое ингибирование, когда ингибиторы ковалентно связываются с ферментом [ионы ртути, свинца, мышьяка, пенициллин]. • Активаторами ферментов являются ионы калия, натрия, хлора и др
• Ингибирование ферментов. • Ингибиторами ферментов являются: антибиотики, антивирусные средства, противоопухолевые средства, инсектициды, гербициды. • Ингибирование конкурентное: . Нужно повысить концентрацию субстрата, чтобы вытеснить ингибитор. • Ингибирование неконкурентное: ингибитор, субстрат и фермент образуют тройной комплекс. Повышение концентрации субстрата не помогает. • Существует и необратимое ингибирование, когда ингибиторы ковалентно связываются с ферментом [ионы ртути, свинца, мышьяка, пенициллин]. • Активаторами ферментов являются ионы калия, натрия, хлора и др
 • По характеру промежуточного взаимодействия катализ различают: • 1. Кислотно-основной. • 2. Окислительно-восстановительный. • 3. Металлокомплексный. • Кислотно-основной катализ [Оствальд, Аррениус]. • При кислотно-основном катализе катализаторами являются ионы Н+ [Н 3 О+] и ОН–. • и нерастворимые кислоты и основания, • Окислительно-восстановительный катализ — промежуточное взаимодействие связано с переходами электронов между катализатором и реагирующим веществом.
• По характеру промежуточного взаимодействия катализ различают: • 1. Кислотно-основной. • 2. Окислительно-восстановительный. • 3. Металлокомплексный. • Кислотно-основной катализ [Оствальд, Аррениус]. • При кислотно-основном катализе катализаторами являются ионы Н+ [Н 3 О+] и ОН–. • и нерастворимые кислоты и основания, • Окислительно-восстановительный катализ — промежуточное взаимодействие связано с переходами электронов между катализатором и реагирующим веществом.
 • Сложные реакции подразделяются на параллельные, последовательные, сопряжённые и цепные. • А. Параллельные реакции — связанная система реакций, имеющих одни и те же исходные реагенты, но различные продукты реакции. Скорость системы параллельных реакций равна сумме скоростей отдельных реакций: • v 1 4 KCl + 6 O 2 • 4 KCl. O 3 vобщ = v 1 + v 2 • v 2 3 KCl. O 4 + KCl • Б. Последовательные реакции — связанная система реакций, в которой продукты предыдущих стадий расходуются в последующих реакциях. • Скорость реакции= скорости самой медленной (лимитирующей) стадии.
• Сложные реакции подразделяются на параллельные, последовательные, сопряжённые и цепные. • А. Параллельные реакции — связанная система реакций, имеющих одни и те же исходные реагенты, но различные продукты реакции. Скорость системы параллельных реакций равна сумме скоростей отдельных реакций: • v 1 4 KCl + 6 O 2 • 4 KCl. O 3 vобщ = v 1 + v 2 • v 2 3 KCl. O 4 + KCl • Б. Последовательные реакции — связанная система реакций, в которой продукты предыдущих стадий расходуются в последующих реакциях. • Скорость реакции= скорости самой медленной (лимитирующей) стадии.
 • В. Сопряжённые реакции —реакции, каждая из которых происходит только при условии протекания другой реакции, причем обе реакции имеют общий промежуточный продукт • Г. Цепные реакции — связанная система сложных реакций, протекающих последовательно, параллельно и сопряжённо с участием свободных радикалов Основные стадии реакции: • а/ зарождение цепи; • б/ разветвление цепи; • в/ продолжение цепи; • г/ обрыв цепи.
• В. Сопряжённые реакции —реакции, каждая из которых происходит только при условии протекания другой реакции, причем обе реакции имеют общий промежуточный продукт • Г. Цепные реакции — связанная система сложных реакций, протекающих последовательно, параллельно и сопряжённо с участием свободных радикалов Основные стадии реакции: • а/ зарождение цепи; • б/ разветвление цепи; • в/ продолжение цепи; • г/ обрыв цепи.
 • • • фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых]. Эффективность фотохимической реакции определяется так называемым квантовым выходом γ: γ = число молекул продукта реакции число поглощённых квантов Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз : hν 2 HCl → H 2 + Cl 2 Фотосинтез, происходящий в растениях — сложный окислительновосстановительный процесс, сочетающий фотохимические реакции с ферментативными. | CO 2 + 2 H 2 O → [H—C—OH]n + O 2 |
• • • фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых]. Эффективность фотохимической реакции определяется так называемым квантовым выходом γ: γ = число молекул продукта реакции число поглощённых квантов Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз : hν 2 HCl → H 2 + Cl 2 Фотосинтез, происходящий в растениях — сложный окислительновосстановительный процесс, сочетающий фотохимические реакции с ферментативными. | CO 2 + 2 H 2 O → [H—C—OH]n + O 2 |
