Теория электролитической диссоциации Преподаватель химии: Тухватуллина Р.З. ГАОУ СПО “Казанский медицинский колледж” Казань, 2014г.
Теория электролитической диссоциации Преподаватель химии: Тухватуллина Р.З. ГАОУ СПО “Казанский медицинский колледж” Казань, 2014г.
 План урока: Электролиты и неэлектролиты; Электролитическая диссоциация; Механизм диссоциации веществ; Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей; Кислоты и основания с точки зрения электролитической диссоциации.
План урока: Электролиты и неэлектролиты; Электролитическая диссоциация; Механизм диссоциации веществ; Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей; Кислоты и основания с точки зрения электролитической диссоциации.
 1. Электролиты и неэлектролиты. 1) Электролиты – это вещества, растворы и расплавы, которых проводят электрический ток (соли, щёлочи, кислоты). 2) Неэлектролиты – это вещества, растворы и расплавы, которых не проводят электрический ток (дистиллированная вода, оксиды, газы, сахар и другие органические вещества).
1. Электролиты и неэлектролиты. 1) Электролиты – это вещества, растворы и расплавы, которых проводят электрический ток (соли, щёлочи, кислоты). 2) Неэлектролиты – это вещества, растворы и расплавы, которых не проводят электрический ток (дистиллированная вода, оксиды, газы, сахар и другие органические вещества).
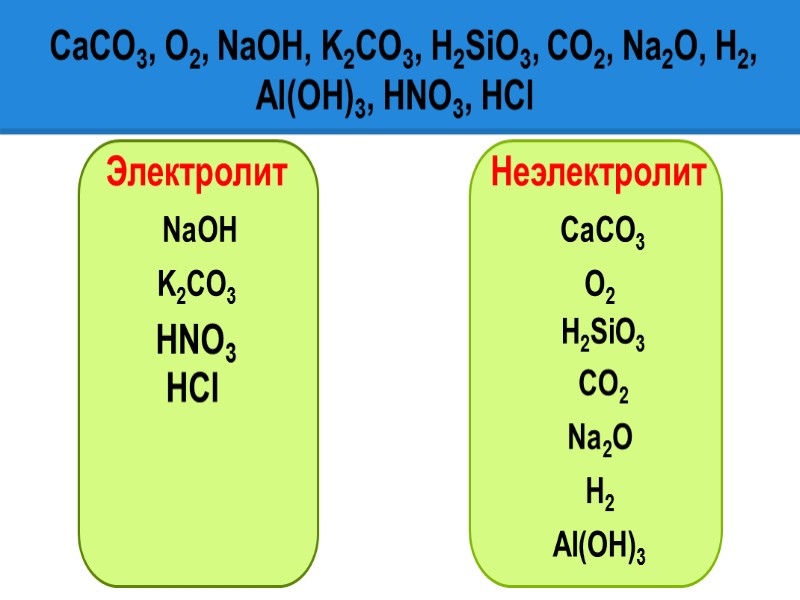
 CaCO3, O2, NaOH, K2CO3, H2SiO3, CO2, Na2O, H2, Al(OH)3, HNO3, HCl Электролит Неэлектролит CaCO3 O2 NaOH K2CO3 H2SiO3 CO2 Na2O H2 Al(OH)3 HNO3 HCl
CaCO3, O2, NaOH, K2CO3, H2SiO3, CO2, Na2O, H2, Al(OH)3, HNO3, HCl Электролит Неэлектролит CaCO3 O2 NaOH K2CO3 H2SiO3 CO2 Na2O H2 Al(OH)3 HNO3 HCl
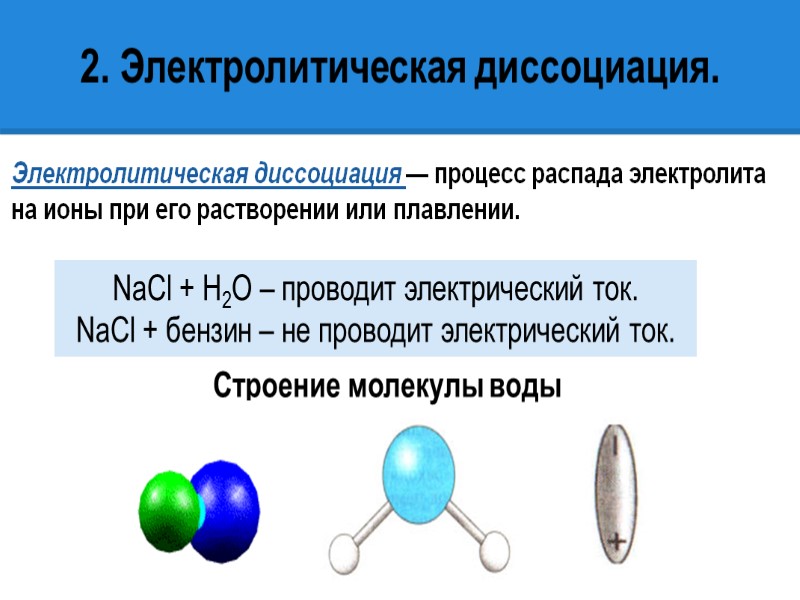
 Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. NaCl + H2O – проводит электрический ток. NaCl + бензин – не проводит электрический ток. 2. Электролитическая диссоциация. Строение молекулы воды
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. NaCl + H2O – проводит электрический ток. NaCl + бензин – не проводит электрический ток. 2. Электролитическая диссоциация. Строение молекулы воды
 3.1. Механизм диссоциации веществ при ковалентной сильно полярной связи. 1) Ориентация. 2) Гидратация. 3) Ионизация (т.е. превращение ковалентной полярной связи в ионную). 4) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: HCl = H+ + Cl-
3.1. Механизм диссоциации веществ при ковалентной сильно полярной связи. 1) Ориентация. 2) Гидратация. 3) Ионизация (т.е. превращение ковалентной полярной связи в ионную). 4) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: HCl = H+ + Cl-
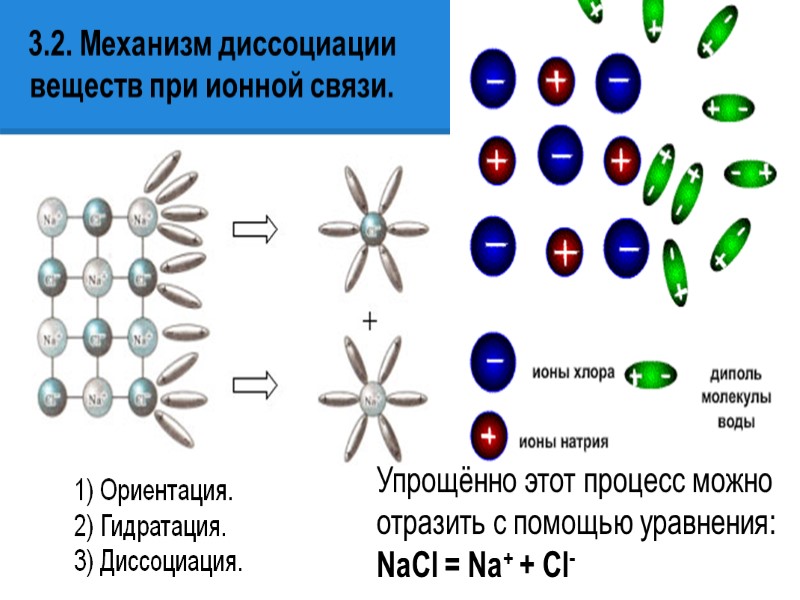
 3.2. Механизм диссоциации веществ при ионной связи. 1) Ориентация. 2) Гидратация. 3) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: NaCl = Na+ + Cl-
3.2. Механизм диссоциации веществ при ионной связи. 1) Ориентация. 2) Гидратация. 3) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: NaCl = Na+ + Cl-
 4. Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей.
4. Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей.
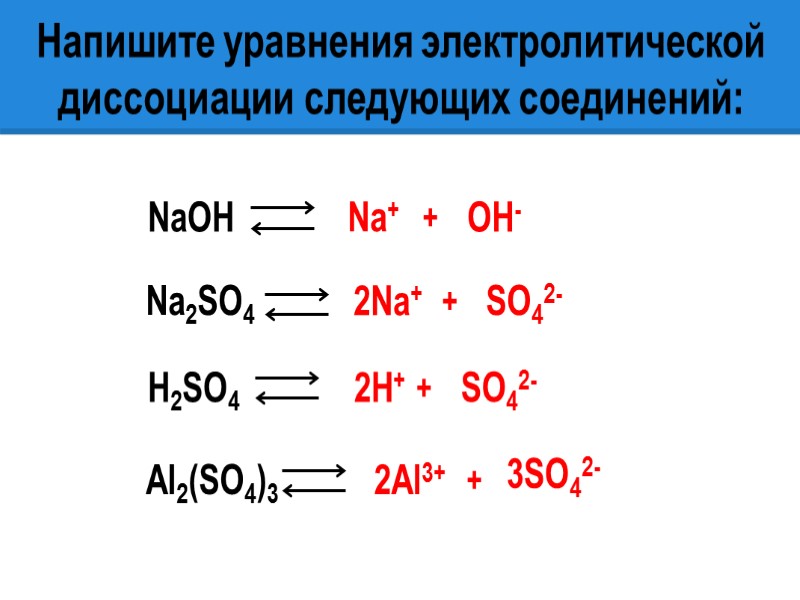
 Напишите уравнения электролитической диссоциации следующих соединений: Na2SO4 NaOH H2SO4 Al2(SO4)3 3SO42- SO42- Na+ 2Na+ 2Н+ SO42- ОН- 2Al3+ + + + +
Напишите уравнения электролитической диссоциации следующих соединений: Na2SO4 NaOH H2SO4 Al2(SO4)3 3SO42- SO42- Na+ 2Na+ 2Н+ SO42- ОН- 2Al3+ + + + +
 Ступенчатая диссоциация многоосновных кислот и многокислотных оснований. H2SO4 2H+ SO42- HSO4- В общем виде диссоциацию серной кислоты можно представить в виде: + Первая ступень: H2SO4 H+ + Вторая ступень: HSO4- H+ + SO42- катион водорода гидросульфат анион катион водорода сульфат анион
Ступенчатая диссоциация многоосновных кислот и многокислотных оснований. H2SO4 2H+ SO42- HSO4- В общем виде диссоциацию серной кислоты можно представить в виде: + Первая ступень: H2SO4 H+ + Вторая ступень: HSO4- H+ + SO42- катион водорода гидросульфат анион катион водорода сульфат анион
 Ступенчатая диссоциация ортофосфорной кислоты H+ H3PO4 HPO42- PO43- 3H+ H2PO4- В общем виде диссоциацию ортофосфорной кислоты можно представить в виде: Первая ступень: Вторая ступень: H3PO4 + + H2PO4- H+ + Третья ступень (практически не идет): HPO42- H+ + PO43- дигидрофосфат анион гидрофосфат анион фосфат анион
Ступенчатая диссоциация ортофосфорной кислоты H+ H3PO4 HPO42- PO43- 3H+ H2PO4- В общем виде диссоциацию ортофосфорной кислоты можно представить в виде: Первая ступень: Вторая ступень: H3PO4 + + H2PO4- H+ + Третья ступень (практически не идет): HPO42- H+ + PO43- дигидрофосфат анион гидрофосфат анион фосфат анион
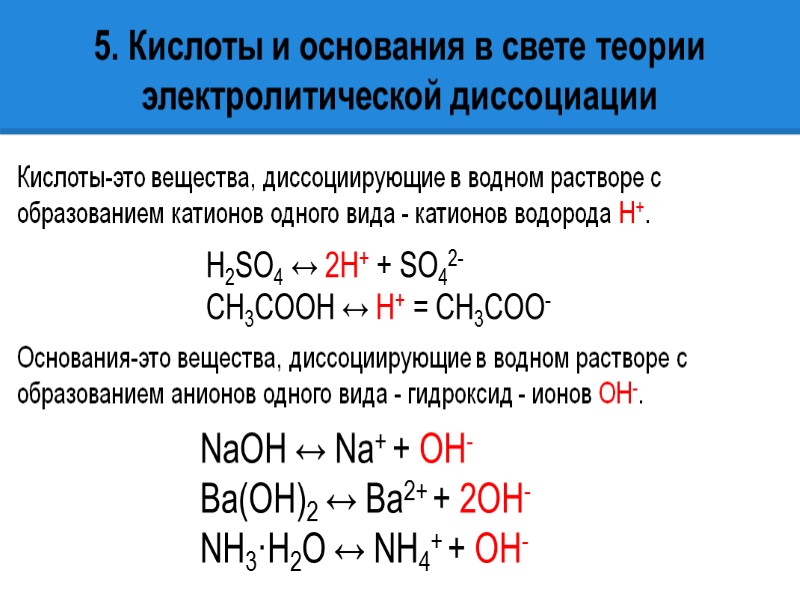
 5. Кислоты и основания в свете теории электролитической диссоциации Кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+. H2SO4 ↔ 2H+ + SO42- CH3COOH ↔ H+ = CH3COO- Основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. NaOH ↔ Na+ + OH- Ba(OH)2 ↔ Ba2+ + 2OH- NH3·H2O ↔ NH4+ + OH-
5. Кислоты и основания в свете теории электролитической диссоциации Кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+. H2SO4 ↔ 2H+ + SO42- CH3COOH ↔ H+ = CH3COO- Основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. NaOH ↔ Na+ + OH- Ba(OH)2 ↔ Ba2+ + 2OH- NH3·H2O ↔ NH4+ + OH-
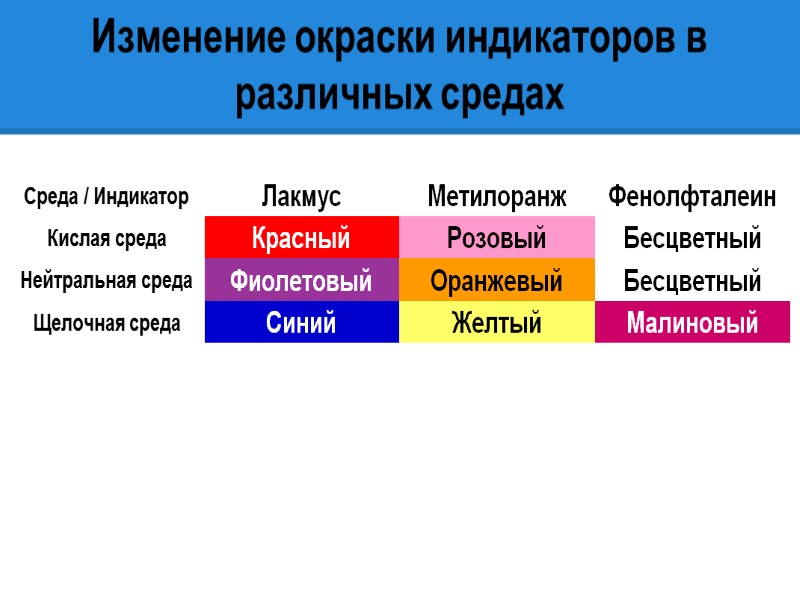
 Изменение окраски индикаторов в различных средах
Изменение окраски индикаторов в различных средах
 Домашняя работа: Учить определения, уметь составлять уравнения электролитической диссоциации Работа по карточкам
Домашняя работа: Учить определения, уметь составлять уравнения электролитической диссоциации Работа по карточкам