Теория электролитической диссоциации. Электролитическая диссоциация (ЭД) — процесс

















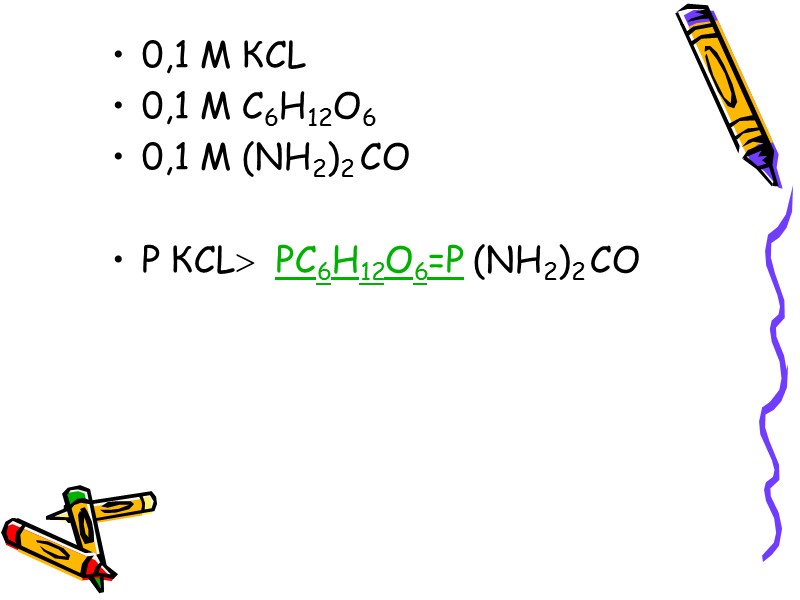

9-4-dissociaciya.ppt
- Количество слайдов: 19
 Теория электролитической диссоциации. Электролитическая диссоциация (ЭД) - процесс распада вещества на ионы, происходящий вследствие электростатического взаимодействия его с полярными молекулами растворителя. Аррениус: рассматривал раствор электролита как механическую смесь из ионов и молекул растворителя. Д. И. Менделеев и И. А. Каблуков: гидратную теорию, согласно которой молекулы вещества при растворении взаимодействуют с молекулами растворителя, образуя непрочные ассоциаты — сольваты (гидраты). Электролитами являются вещества, имеющие сильно ионную или ковалентную сильно полярную связь. Энергетика ЭД – на разрыв связей затрачивается огромная энергия, которая компенсируются выделением тепла в процессах сольватации молекул и ионов.
Теория электролитической диссоциации. Электролитическая диссоциация (ЭД) - процесс распада вещества на ионы, происходящий вследствие электростатического взаимодействия его с полярными молекулами растворителя. Аррениус: рассматривал раствор электролита как механическую смесь из ионов и молекул растворителя. Д. И. Менделеев и И. А. Каблуков: гидратную теорию, согласно которой молекулы вещества при растворении взаимодействуют с молекулами растворителя, образуя непрочные ассоциаты — сольваты (гидраты). Электролитами являются вещества, имеющие сильно ионную или ковалентную сильно полярную связь. Энергетика ЭД – на разрыв связей затрачивается огромная энергия, которая компенсируются выделением тепла в процессах сольватации молекул и ионов.
 степень ЭД - отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита: 0 = nр/no , где 0 - истинная степень ЭД, nр - количество молекул (формульных единиц) электролита, распавшихся на ионы в растворе; no - общее число молекул (формульных единиц) электролита, перешедшее в раствор. Степень ЭД прямо пропорциональна полярности и поляризуемости химической связи в электролите, диэлектрической проницаемости среды, температуре раствора и обратно пропорциональна концентрации раствора По степени ЭД все электролиты делятся на 2 типа: сильные электролиты ( 0 > 0,7) и слабые электролиты (0<0< 0,1). Сильными электролиты: сильные кислоты, щелочи и большинство солей (НС1, H2SО4, HNO3, КОН, NaOH, Ba(OH)2, NaCl, KN03). Слабые электролиты: слабые кислоты и слабые основания (СН3СООН, Н2СО3, HCN, HF, HNO2, NH3 •H2O) и H2O.
степень ЭД - отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита: 0 = nр/no , где 0 - истинная степень ЭД, nр - количество молекул (формульных единиц) электролита, распавшихся на ионы в растворе; no - общее число молекул (формульных единиц) электролита, перешедшее в раствор. Степень ЭД прямо пропорциональна полярности и поляризуемости химической связи в электролите, диэлектрической проницаемости среды, температуре раствора и обратно пропорциональна концентрации раствора По степени ЭД все электролиты делятся на 2 типа: сильные электролиты ( 0 > 0,7) и слабые электролиты (0<0< 0,1). Сильными электролиты: сильные кислоты, щелочи и большинство солей (НС1, H2SО4, HNO3, КОН, NaOH, Ba(OH)2, NaCl, KN03). Слабые электролиты: слабые кислоты и слабые основания (СН3СООН, Н2СО3, HCN, HF, HNO2, NH3 •H2O) и H2O.
 Теория растворов сильных электролитов. Процесс ЭД сильного электролита, - практически необратим - нельзя охарактеризовать константой диссоциации. - велика роль межионного взаимодействия Активность иона a(X) - эффективная концентрация иона X, соответственно которой он участвует во взаимодействиях: а (Х) = f ac(Х) , где с(Х) - концентрация иона Х в растворе, fa - коэффициент активности иона Х в растворе. Коэффициент активности иона fa показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита. Значение коэффициента активности иона зависит от: 1) концентрации этого иона (сначала уменьшается, а затем растет с ростом концентрации); 2) температуры (увеличивается с ростом температуры); 3) концентрации других ионов (влияет общая концентрация всех ионов в растворе).
Теория растворов сильных электролитов. Процесс ЭД сильного электролита, - практически необратим - нельзя охарактеризовать константой диссоциации. - велика роль межионного взаимодействия Активность иона a(X) - эффективная концентрация иона X, соответственно которой он участвует во взаимодействиях: а (Х) = f ac(Х) , где с(Х) - концентрация иона Х в растворе, fa - коэффициент активности иона Х в растворе. Коэффициент активности иона fa показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита. Значение коэффициента активности иона зависит от: 1) концентрации этого иона (сначала уменьшается, а затем растет с ростом концентрации); 2) температуры (увеличивается с ростом температуры); 3) концентрации других ионов (влияет общая концентрация всех ионов в растворе).
 Г. Льюис(1907)ввел понятие Ионная сила раствора I - величина, характеризующая интенсивность электростатического поля всех ионов в растворе: I = где q1, q2, q3, ... ,qn - заряды всех ионов, находящихся в растворе, c1, c2, c3, ... ,cn – молярные концентрации ионов. В разбавленных растворах уравнение Дебая — Хюккеля: lg fa =
Г. Льюис(1907)ввел понятие Ионная сила раствора I - величина, характеризующая интенсивность электростатического поля всех ионов в растворе: I = где q1, q2, q3, ... ,qn - заряды всех ионов, находящихся в растворе, c1, c2, c3, ... ,cn – молярные концентрации ионов. В разбавленных растворах уравнение Дебая — Хюккеля: lg fa =
 Растворы слабых электролитов. ЭД слабых электролитов — процесс обратимый: CH3COOH CH3COO- + H+. Используя закон действующих масс, электролитическое равновесие можно количественно выразить величиной константы ЭД: Кд (CH3COOH) = [H+] [CH3COO-]/ [CH3COOH] , Кд - не зависит от концентрации электролита - определяется природой вещества, природой растворителя (с увеличением диэлектрической проницаемости - возрастает); - от температуры -прямопропорционально Степень ЭД ( ) и константу ЭД связывает закон разбавления Оствальда: = Кд .
Растворы слабых электролитов. ЭД слабых электролитов — процесс обратимый: CH3COOH CH3COO- + H+. Используя закон действующих масс, электролитическое равновесие можно количественно выразить величиной константы ЭД: Кд (CH3COOH) = [H+] [CH3COO-]/ [CH3COOH] , Кд - не зависит от концентрации электролита - определяется природой вещества, природой растворителя (с увеличением диэлектрической проницаемости - возрастает); - от температуры -прямопропорционально Степень ЭД ( ) и константу ЭД связывает закон разбавления Оствальда: = Кд .
 Слабые многоосновные кислоты и слабые многокислотные основания диссоциируют в несколько этапов ( ступенчато ): I cтупень:Н2СО3 ↔ Н+ + НСО3 - КД1= ; II ступень: НСО3 - ↔ H+ + CO32- КД2 = Суммарно ЭД H2CO3 ↔ 2H+ + CO32- КД(общ) = . КД1 >> КД2 >> КД3 и т.д.
Слабые многоосновные кислоты и слабые многокислотные основания диссоциируют в несколько этапов ( ступенчато ): I cтупень:Н2СО3 ↔ Н+ + НСО3 - КД1= ; II ступень: НСО3 - ↔ H+ + CO32- КД2 = Суммарно ЭД H2CO3 ↔ 2H+ + CO32- КД(общ) = . КД1 >> КД2 >> КД3 и т.д.
 Коллигативные свойства разбавленных растворов электролитов Изотонический коэффициент показывает, во сколько раз осмотическое давление данного раствора больше теоретического: Р = 1000 i CRT Коэффициент i определяется для каждого раствора экспериментально -по повышению осмотического давления раствора, - понижению давления пара растворителя над раствором, -по повышению температуры кипения и понижению температуры замерзания: В числителе величины экспериментальные, в знаменателе — теоретические. законы Рауля: ; tкип = iКЭ m; tзам = iКК m
Коллигативные свойства разбавленных растворов электролитов Изотонический коэффициент показывает, во сколько раз осмотическое давление данного раствора больше теоретического: Р = 1000 i CRT Коэффициент i определяется для каждого раствора экспериментально -по повышению осмотического давления раствора, - понижению давления пара растворителя над раствором, -по повышению температуры кипения и понижению температуры замерзания: В числителе величины экспериментальные, в знаменателе — теоретические. законы Рауля: ; tкип = iКЭ m; tзам = iКК m
 0,1 М КCL 0,1 M C6H12O6 0,1 M (NH2)2 CO P КCL PC6H12O6=P (NH2)2 CO
0,1 М КCL 0,1 M C6H12O6 0,1 M (NH2)2 CO P КCL PC6H12O6=P (NH2)2 CO
 Электролиты в организме человека: участвуют в поддержании осмотического давления, рН среды, активируют ферменты, создают мембранный потенциал, - участвуют в проведении нервного импульса, - в сокращении мышцы сердца и т.д.
Электролиты в организме человека: участвуют в поддержании осмотического давления, рН среды, активируют ферменты, создают мембранный потенциал, - участвуют в проведении нервного импульса, - в сокращении мышцы сердца и т.д.
 ионы организма можно разделить на антагонисты и синергисты. Те ионы, которые действуют совместно и усиливают действие друг друга, называются синергистами,( ионы калия и кальция в миокарде, ионы меди, марганца, кобальта, железа в процессе образования гемоглобина) Ионы, которые ослабляют действие друг друга, называются антагонистами, ( ионы натрия и калия, натрия и кальция) Поэтому замена физиологического раствора [0,9% NaCl] раствором KCl той же концентрации приводит к остановке сердца.
ионы организма можно разделить на антагонисты и синергисты. Те ионы, которые действуют совместно и усиливают действие друг друга, называются синергистами,( ионы калия и кальция в миокарде, ионы меди, марганца, кобальта, железа в процессе образования гемоглобина) Ионы, которые ослабляют действие друг друга, называются антагонистами, ( ионы натрия и калия, натрия и кальция) Поэтому замена физиологического раствора [0,9% NaCl] раствором KCl той же концентрации приводит к остановке сердца.
 При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию (осмолярностъ) Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы. Осмотическому давлению крови человека соответствует осмолярная концентрация частиц от 275 до 300 мОсм/л. Осмолярность считается так: 0,1 М NaCl 0.1х 1 + 0.1х1= 0.2 Осм/л= 200 мОсм/л. или: 0,2М СaCl2 0,2х 1+ 0.2х2= 0.6 Осм/л
При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию (осмолярностъ) Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы. Осмотическому давлению крови человека соответствует осмолярная концентрация частиц от 275 до 300 мОсм/л. Осмолярность считается так: 0,1 М NaCl 0.1х 1 + 0.1х1= 0.2 Осм/л= 200 мОсм/л. или: 0,2М СaCl2 0,2х 1+ 0.2х2= 0.6 Осм/л
 ……. Водно-электролитный баланс В зависимости от содержания внеклеточной жидкости различают 6 состояний, приводящих к или Внеклеточной жидкости: содержание увеличено в 2 и более раза- гипергидратация уменьшено в 2 раза- дегидратация 1. Гипертоническая дегидратация : Р осм жидкость при диабете, почечной недостаточности : клетка теряет воду. 2.Изотоническая дегидратация – Р =N жидкость страдает внеклеточное пространство- при потере крови. 3.Гипотоническая дегидратация Р осм жидкость клетка пересыщается водой – при потери натрия, который удерживает воду.
……. Водно-электролитный баланс В зависимости от содержания внеклеточной жидкости различают 6 состояний, приводящих к или Внеклеточной жидкости: содержание увеличено в 2 и более раза- гипергидратация уменьшено в 2 раза- дегидратация 1. Гипертоническая дегидратация : Р осм жидкость при диабете, почечной недостаточности : клетка теряет воду. 2.Изотоническая дегидратация – Р =N жидкость страдает внеклеточное пространство- при потере крови. 3.Гипотоническая дегидратация Р осм жидкость клетка пересыщается водой – при потери натрия, который удерживает воду.
 4. Гипертоническая гипергидратация Р осм жидкость клетка обезвоживается- если нет пресной воды 5. Изотоническая гипергидратация Р =N жидкость отеки при циррозе печени, ССЗ 6. Гипотоническая гипергидратация Р осм жидкость чрезмерное потребление воды, поражаются клетки
4. Гипертоническая гипергидратация Р осм жидкость клетка обезвоживается- если нет пресной воды 5. Изотоническая гипергидратация Р =N жидкость отеки при циррозе печени, ССЗ 6. Гипотоническая гипергидратация Р осм жидкость чрезмерное потребление воды, поражаются клетки
 Методы криоскопии и эбулиоскопии используются для определения молекулярной массы веществ: , где М — молекулярная масса растворённого вещества; К — эбулиоскопическая или криоскопическая константа; m — масса растворённого вещества в г [или кг]; G — масса растворителя в г [или кг]; Осмолярность плазмы крови взрослого человека в норме 275-300 мосм/кг воды. Можно определить осмолярную концентрацию любой биологическлой жидкости, если известна точка её замерзания: .
Методы криоскопии и эбулиоскопии используются для определения молекулярной массы веществ: , где М — молекулярная масса растворённого вещества; К — эбулиоскопическая или криоскопическая константа; m — масса растворённого вещества в г [или кг]; G — масса растворителя в г [или кг]; Осмолярность плазмы крови взрослого человека в норме 275-300 мосм/кг воды. Можно определить осмолярную концентрацию любой биологическлой жидкости, если известна точка её замерзания: .
 Водно-электролитный баланс В зависимости от содержания внеклеточной жидкости различают 6 состояний, приводящих к или Внеклеточной жидкости: содержание увеличено в 2 и более раза- гипергидратация уменьшено в 2 раза- дегидратация 1. Гипертоническая дегидратация : Р осм жидкость при диабете, почечной недостаточности : клетка теряет воду. 2.Изотоническая дегидратация – Р =N жидкость страдает внеклеточное пространство- при потере крови. 3.Гипотоническая дегидратация Р осм жидкость клетка пересыщается водой – при потери натрия, который удерживает воду.
Водно-электролитный баланс В зависимости от содержания внеклеточной жидкости различают 6 состояний, приводящих к или Внеклеточной жидкости: содержание увеличено в 2 и более раза- гипергидратация уменьшено в 2 раза- дегидратация 1. Гипертоническая дегидратация : Р осм жидкость при диабете, почечной недостаточности : клетка теряет воду. 2.Изотоническая дегидратация – Р =N жидкость страдает внеклеточное пространство- при потере крови. 3.Гипотоническая дегидратация Р осм жидкость клетка пересыщается водой – при потери натрия, который удерживает воду.
 4. Гипертоническая гипергидратация Р осм жидкость клетка обезвоживается- если нет пресной воды 5. Изотоническая гипергидратация Р =N жидкость отеки при циррозе печени, ССЗ 6. Гипотоническая гипергидратация Р осм жидкость чрезмерное потребление воды, поражаются клетки
4. Гипертоническая гипергидратация Р осм жидкость клетка обезвоживается- если нет пресной воды 5. Изотоническая гипергидратация Р =N жидкость отеки при циррозе печени, ССЗ 6. Гипотоническая гипергидратация Р осм жидкость чрезмерное потребление воды, поражаются клетки

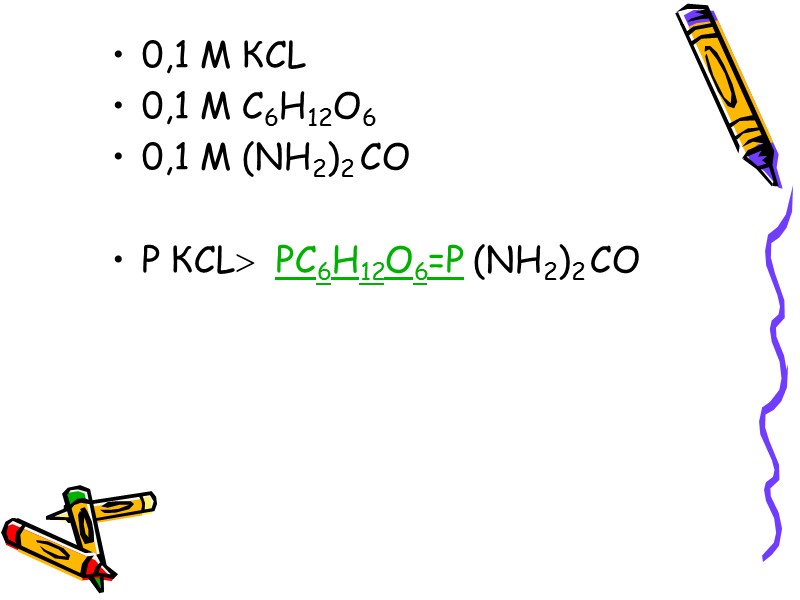
 . Равновесие между раствором и осадком малорастворимого сильного электролита. Са3(РО4)2 ↓↔ 3Са 2+ + 2PO4 3-. Применяя закон действующих масс для данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)): ПР = [Са 2+ ] 3[PO4 3- ]2 / [Са3(РО4)2 ] . [Са3(РО4)2 ] = const, и ПР(Са3(РО4)2)= [Са 2+ ] 3[PO4 3- ]2 . Чем меньше ПР, тем ниже растворимость электролита. Условия образования осадка: стехиометрическое произведение концентраций ионов сильного электролита должно быть больше ПР: [Са 2+ ] 3[PO4 3- ]2 > ПР. Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионов сильного электролита меньше ПР: [Са 2+ ] 3[PO4 3- ]2 < ПР. Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.
. Равновесие между раствором и осадком малорастворимого сильного электролита. Са3(РО4)2 ↓↔ 3Са 2+ + 2PO4 3-. Применяя закон действующих масс для данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)): ПР = [Са 2+ ] 3[PO4 3- ]2 / [Са3(РО4)2 ] . [Са3(РО4)2 ] = const, и ПР(Са3(РО4)2)= [Са 2+ ] 3[PO4 3- ]2 . Чем меньше ПР, тем ниже растворимость электролита. Условия образования осадка: стехиометрическое произведение концентраций ионов сильного электролита должно быть больше ПР: [Са 2+ ] 3[PO4 3- ]2 > ПР. Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионов сильного электролита меньше ПР: [Са 2+ ] 3[PO4 3- ]2 < ПР. Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.
