през_Ферменты_102-1.ppt
- Количество слайдов: 21
 Тема Свойства и функции энзимов
Тема Свойства и функции энзимов
 Цели урока Ученик знает: l Классификацию ферментов по типу катализируемой реакции Ученик понимает: l Механизм взаимодействия фермента с субстратом Ученик умеет: l Объяснить последовательность взаимодействия фермента с субстратом
Цели урока Ученик знает: l Классификацию ферментов по типу катализируемой реакции Ученик понимает: l Механизм взаимодействия фермента с субстратом Ученик умеет: l Объяснить последовательность взаимодействия фермента с субстратом
 Термины: l l l Фермент Катализатор активный центр Субстрат фермент-субстратный комплекс
Термины: l l l Фермент Катализатор активный центр Субстрат фермент-субстратный комплекс
 Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется около 4000 биореакций. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется около 4000 биореакций. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
 Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента.
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента.
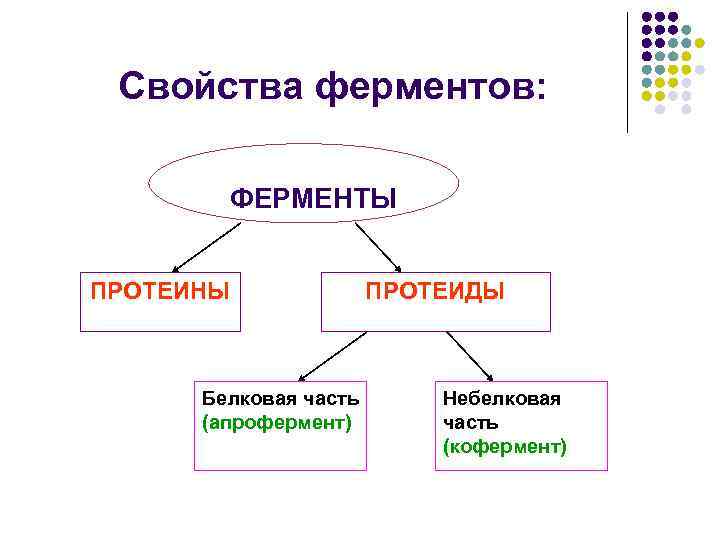 Свойства ферментов: ФЕРМЕНТЫ ПРОТЕИНЫ Белковая часть (апрофермент) ПРОТЕИДЫ Небелковая часть (кофермент)
Свойства ферментов: ФЕРМЕНТЫ ПРОТЕИНЫ Белковая часть (апрофермент) ПРОТЕИДЫ Небелковая часть (кофермент)
 Сравнение неорганических катализаторов и ферментов Признаки сравнения 1. Химическая природа 2. Селективность 3. Оптимум p. H 4. Интервалы температуры 5. Изменение структуры kat в ходе реакции 6. Увеличение скорости реакции. Неорганические катализаторы Ферменты
Сравнение неорганических катализаторов и ферментов Признаки сравнения 1. Химическая природа 2. Селективность 3. Оптимум p. H 4. Интервалы температуры 5. Изменение структуры kat в ходе реакции 6. Увеличение скорости реакции. Неорганические катализаторы Ферменты
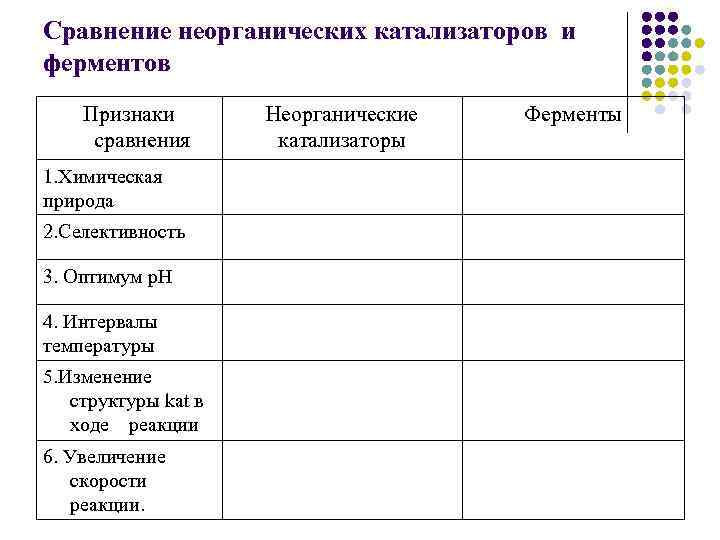
 Сравнение неорганических катализаторов и ферментов Признаки сравнения Неорганические катализаторы Ферменты 1. Химическая природа Низкомолекулярные вещества, образованные 1 или несколькими элементами. Белки – высокомолекулярные полимеры 2. Селективность Низкая, универсальный kat – Pt ускоряет множ. реакций. Высокая. На каждую р-цию нужен свой фермент. 3. Оптимум p. H Сильнокислая или щелочная Небольшой интервал, у кажд. органа – свой. 4. Интервалы температуры Очень широкие. 35 – 42 градуса, затем денатурируют. 5. Изменение структуры kat в ходе реакции Изменяется незначительно, или не изменяется вовсе. Сильно изменяются и восстанавливаются в исходную структуру по окончании реакции. 6. Увеличение скорости реакции. В 100 – 1000000 раз От 10 в 8 степени до 10 в 12 степени раз.
Сравнение неорганических катализаторов и ферментов Признаки сравнения Неорганические катализаторы Ферменты 1. Химическая природа Низкомолекулярные вещества, образованные 1 или несколькими элементами. Белки – высокомолекулярные полимеры 2. Селективность Низкая, универсальный kat – Pt ускоряет множ. реакций. Высокая. На каждую р-цию нужен свой фермент. 3. Оптимум p. H Сильнокислая или щелочная Небольшой интервал, у кажд. органа – свой. 4. Интервалы температуры Очень широкие. 35 – 42 градуса, затем денатурируют. 5. Изменение структуры kat в ходе реакции Изменяется незначительно, или не изменяется вовсе. Сильно изменяются и восстанавливаются в исходную структуру по окончании реакции. 6. Увеличение скорости реакции. В 100 – 1000000 раз От 10 в 8 степени до 10 в 12 степени раз.
 Заполнить таблицу Классы ферментов Катализируемая реакция Примеры ферментов
Заполнить таблицу Классы ферментов Катализируемая реакция Примеры ферментов
 Свойства ферментов. 1. Высокая каталитическая активность (углекислый газ из крови связывается с гемоглобином в карбогемоглобин со скоростью 10 молекул в секунду, а при ферменте карбоангидраза в 10 раз больше). 2. Специфичность (избирательность) действия (один фермент катализирует одну реакцию). 3. Регулируемость активности ферментов (внутренняя среда организма из-за действия ферментов всегда постоянна).
Свойства ферментов. 1. Высокая каталитическая активность (углекислый газ из крови связывается с гемоглобином в карбогемоглобин со скоростью 10 молекул в секунду, а при ферменте карбоангидраза в 10 раз больше). 2. Специфичность (избирательность) действия (один фермент катализирует одну реакцию). 3. Регулируемость активности ферментов (внутренняя среда организма из-за действия ферментов всегда постоянна).
 Специфические: l l Сочетание высочайшей активности с соблюдением строгого ряда условий; Специфичность действия по принципу «ключ – замок» или «рука – перчатка» ; Стабильность; Обратимость действия: Е + S ↔ ES → E + P, где Е – энзим; S – субстрат, P – продукт реакции, ES – фермент-субстратный комплекс.
Специфические: l l Сочетание высочайшей активности с соблюдением строгого ряда условий; Специфичность действия по принципу «ключ – замок» или «рука – перчатка» ; Стабильность; Обратимость действия: Е + S ↔ ES → E + P, где Е – энзим; S – субстрат, P – продукт реакции, ES – фермент-субстратный комплекс.
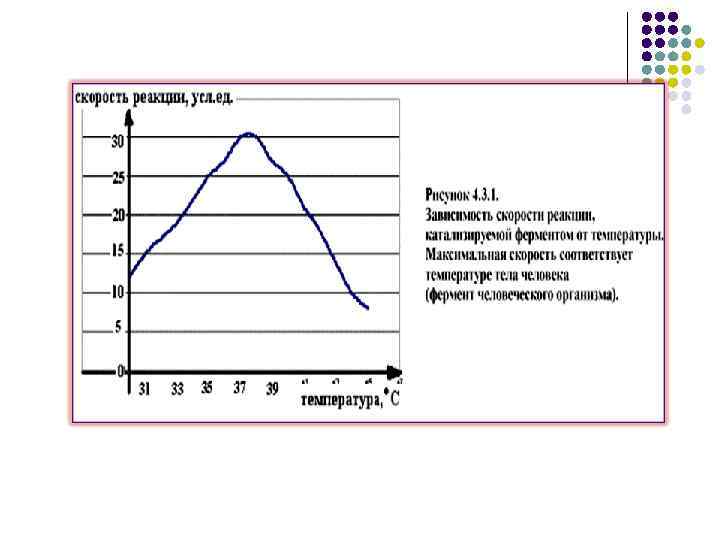
 Факторы влияющие на активность ферментов 1. Концентрация фермента и субстрата (чем выше концентрация исходных веществ, тем выше скорость реакции). 2. Активная реакция среды (р. Н) (большинство ферментов проявляют максимальную активность при значении р. Н=7 (нейтральная). Некоторые активны только в кислой среде (пепсин р. Н=2), некоторые только в щелочной (липаза р. Н=9). 3. Температура (Различные клеточные ферменты работают в своем диапазоне температур, где они проявляют наибольшую активность (средние температуры 37 -40 С) При низких температурах активность ферментов замедляется, при высоких фермент(белок) разрушается (денатурация белка). При замораживании фермент сохраняет свою структуру и затем при размораживании восстанавливает свои свойства). 4. Активаторы и ингибиторы (ионы металлов, низкомолекулярные вещества) активаторы повышают активность фермента (например кальций), ингибиторы снижают активность фермента, т. к. занимают место субстрата (конкурентные ингибиторы), или соединяются с неактивной частью и тем самым меняют химическую природу фермента (катализ нарушается) (неконкурентные ингибиторы – ионы тяжелых металлов – свинец, медь, ртуть, мышьяк и многие яды).
Факторы влияющие на активность ферментов 1. Концентрация фермента и субстрата (чем выше концентрация исходных веществ, тем выше скорость реакции). 2. Активная реакция среды (р. Н) (большинство ферментов проявляют максимальную активность при значении р. Н=7 (нейтральная). Некоторые активны только в кислой среде (пепсин р. Н=2), некоторые только в щелочной (липаза р. Н=9). 3. Температура (Различные клеточные ферменты работают в своем диапазоне температур, где они проявляют наибольшую активность (средние температуры 37 -40 С) При низких температурах активность ферментов замедляется, при высоких фермент(белок) разрушается (денатурация белка). При замораживании фермент сохраняет свою структуру и затем при размораживании восстанавливает свои свойства). 4. Активаторы и ингибиторы (ионы металлов, низкомолекулярные вещества) активаторы повышают активность фермента (например кальций), ингибиторы снижают активность фермента, т. к. занимают место субстрата (конкурентные ингибиторы), или соединяются с неактивной частью и тем самым меняют химическую природу фермента (катализ нарушается) (неконкурентные ингибиторы – ионы тяжелых металлов – свинец, медь, ртуть, мышьяк и многие яды).
 Механизм действия ферментов Взаимодействие субстрата и фермента происходит в несколько стадий: l взаимодействие субстрата (S) с активным центром фермента (Ф) и образование фермент-субстратного комплекса, l преобразование в фермент-субстратном комплексе с образованием нового продукта, l отделение продукта реакции от активного центра фермента (сам фермент в ходе реакции не изменяется и вступает в другие реакции вновь). А + В = АВ (скорость медленная) l субстрат новый продукт А + Ф = АФ + В = АВ + Ф (скорость быстрая)
Механизм действия ферментов Взаимодействие субстрата и фермента происходит в несколько стадий: l взаимодействие субстрата (S) с активным центром фермента (Ф) и образование фермент-субстратного комплекса, l преобразование в фермент-субстратном комплексе с образованием нового продукта, l отделение продукта реакции от активного центра фермента (сам фермент в ходе реакции не изменяется и вступает в другие реакции вновь). А + В = АВ (скорость медленная) l субстрат новый продукт А + Ф = АФ + В = АВ + Ф (скорость быстрая)

 1. Модель Фишера “ключ к замку”. Субстрат и фермент комплиментарны (точно подходят друг к другу, как ключ к замку). 2. Модель Кошланда “перчатка-рука”. Субстрат и активный центр фермента становятся соответствующими другу (как перчатка, одетая на руку) только после того, как соединятся.
1. Модель Фишера “ключ к замку”. Субстрат и фермент комплиментарны (точно подходят друг к другу, как ключ к замку). 2. Модель Кошланда “перчатка-рука”. Субстрат и активный центр фермента становятся соответствующими другу (как перчатка, одетая на руку) только после того, как соединятся.
 Роль ферментов в жизнедеятельности организмов: l l l l Врожденные нарушения обмена; Взаимопревращения веществ; Биохимическая революция; Превращение энергии; Биосинтез; Фармакология; Ультраструктура мембран; Генетический аппарат; Питание; Клеточный метаболизм; Катализ; Физиологическая регуляция; Бактериальное брожение.
Роль ферментов в жизнедеятельности организмов: l l l l Врожденные нарушения обмена; Взаимопревращения веществ; Биохимическая революция; Превращение энергии; Биосинтез; Фармакология; Ультраструктура мембран; Генетический аппарат; Питание; Клеточный метаболизм; Катализ; Физиологическая регуляция; Бактериальное брожение.

 Правильные ответы: l l l 1 – Б; 2 – В; 3 – А; 4 – Г; 5 – Г.
Правильные ответы: l l l 1 – Б; 2 – В; 3 – А; 4 – Г; 5 – Г.
 Итоги теста: Число правильных ответов Вывод 5 Тему усвоил 4 Тему усвоил достаточно 3 Тему усвоил плохо 2 Тему не усвоил, необходимо прийти на доп. занятия!!!
Итоги теста: Число правильных ответов Вывод 5 Тему усвоил 4 Тему усвоил достаточно 3 Тему усвоил плохо 2 Тему не усвоил, необходимо прийти на доп. занятия!!!
