 Тема: Серная кислота, свойства серной кислоты. 900 igr. net
Тема: Серная кислота, свойства серной кислоты. 900 igr. net
 Состав • Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток • H-R, где R-кислотный остаток • При электролитической диссоциации кислот в водном растворе образуются катионы водорода и анион кислотного остатка
Состав • Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток • H-R, где R-кислотный остаток • При электролитической диссоциации кислот в водном растворе образуются катионы водорода и анион кислотного остатка
 Классификация кислот • Кислородные кислоты, например, H 2 CO 3, H 3 PO 4 (отвечают кислотным оксидам и являются • Одноосновные кислоты, фактически кислотными например, HCl, HNO 3 гидроксидами) (отщепляют при диссоциации • Бескислородные один атом водорода) кислоты, например, • Многоосновные кислоты, HBr, H 2 S (относятся к например, H 2 SO 4, H 3 PO 4 числу бинарных (отщепляют при диссоциации соединений) несколько атомов водорода)
Классификация кислот • Кислородные кислоты, например, H 2 CO 3, H 3 PO 4 (отвечают кислотным оксидам и являются • Одноосновные кислоты, фактически кислотными например, HCl, HNO 3 гидроксидами) (отщепляют при диссоциации • Бескислородные один атом водорода) кислоты, например, • Многоосновные кислоты, HBr, H 2 S (относятся к например, H 2 SO 4, H 3 PO 4 числу бинарных (отщепляют при диссоциации соединений) несколько атомов водорода)
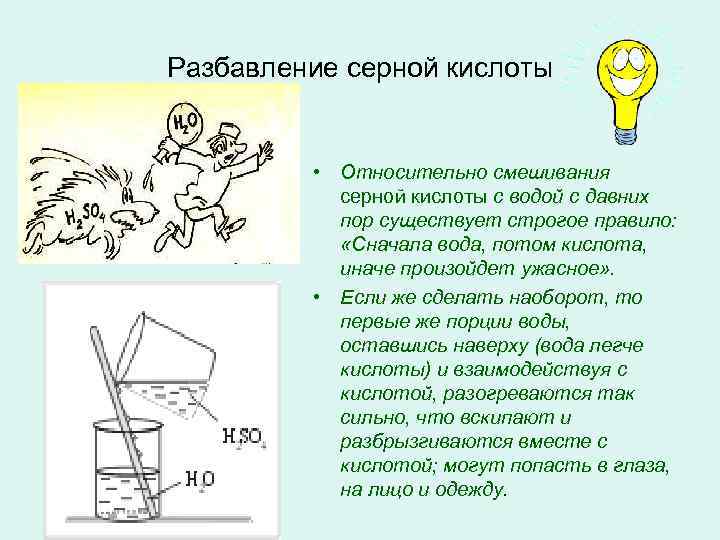 Разбавление серной кислоты • Относительно смешивания серной кислоты с водой с давних пор существует строгое правило: «Сначала вода, потом кислота, иначе произойдет ужасное» . • Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
Разбавление серной кислоты • Относительно смешивания серной кислоты с водой с давних пор существует строгое правило: «Сначала вода, потом кислота, иначе произойдет ужасное» . • Если же сделать наоборот, то первые же порции воды, оставшись наверху (вода легче кислоты) и взаимодействуя с кислотой, разогреваются так сильно, что вскипают и разбрызгиваются вместе с кислотой; могут попасть в глаза, на лицо и одежду.
 S+6 O 3 – оксид серы (VI), кислотный оксид (высшая степень окисления серы) S+6 O 3 - бесцветная жидкость Получение серной кислоты: S+6 O 3 + Н 2 О =Н 2 S+6 O 4 серная кислота
S+6 O 3 – оксид серы (VI), кислотный оксид (высшая степень окисления серы) S+6 O 3 - бесцветная жидкость Получение серной кислоты: S+6 O 3 + Н 2 О =Н 2 S+6 O 4 серная кислота
 Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства кислот: 1. С оксидами металлов. (реакция обмена) Н SO 4+Me. O→Me. SO +H O 2 4 2 2. С основаниями. (реакция обмена, реакция нейтрализации) Н SO 4+Me(OН)n→Me. SO +H O 2 4 2 3. С металлами. Н SO 4+Me(до Н)→Me. SO (р)+H ↑(реакция замещения) 2 4 2 4. С солями( реакция обмена) Н SO 4+Me. R(Р)→Me. SO 2 4 (Р)+HR (протекает в том случае, если образуется осадок или газ)
Химические свойства серной кислоты разбавленная серная кислота проявляет все характерные свойства кислот: 1. С оксидами металлов. (реакция обмена) Н SO 4+Me. O→Me. SO +H O 2 4 2 2. С основаниями. (реакция обмена, реакция нейтрализации) Н SO 4+Me(OН)n→Me. SO +H O 2 4 2 3. С металлами. Н SO 4+Me(до Н)→Me. SO (р)+H ↑(реакция замещения) 2 4 2 4. С солями( реакция обмена) Н SO 4+Me. R(Р)→Me. SO 2 4 (Р)+HR (протекает в том случае, если образуется осадок или газ)
 Качественная реакция на ион –SO 42 - • Реактивом на серную кислоту и ее соли является катион бария , т. к. с ионами бария сульфат ион образует белый нерастворимый сульфат бария, выпадающий в осадок. • Ва 2++SO 42 - = Ba. SO 4↓
Качественная реакция на ион –SO 42 - • Реактивом на серную кислоту и ее соли является катион бария , т. к. с ионами бария сульфат ион образует белый нерастворимый сульфат бария, выпадающий в осадок. • Ва 2++SO 42 - = Ba. SO 4↓
 Концентрированная серная кислота • Ме+Н 2 SO 4(кoнц)→Ме. SO 4+H 2 O+(Н 2 S, S, SO 2) Серная кислота(конц) восстанавливается до (Н 2 S, S, SO 2) в зависимости от активности металла и условий протекания реакции. Железо и алюминий пассивируются кислотой, т. е покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах. Сu+2 H 2 SO 4(конц)→Cu. SO 4+2 H 2 O+SO 2 4 Zn+5 H 2 SO 4(конц)→ 4 Zn. SO 4+4 H 2 O+H 2 S Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их. Взаимодействие кислоты с сахарозой(C 12 H 22 O 11) C 12 H 22 O 11 + 2 H 2 SO 4(конц) = 11 C + 13 H 2 O↑ +2 SO 2↑ +CO 2↑
Концентрированная серная кислота • Ме+Н 2 SO 4(кoнц)→Ме. SO 4+H 2 O+(Н 2 S, S, SO 2) Серная кислота(конц) восстанавливается до (Н 2 S, S, SO 2) в зависимости от активности металла и условий протекания реакции. Железо и алюминий пассивируются кислотой, т. е покрываются защитной пленкой, поэтому кислоту(конц) можно перевозить в стальных и алюминиевых цистернах. Сu+2 H 2 SO 4(конц)→Cu. SO 4+2 H 2 O+SO 2 4 Zn+5 H 2 SO 4(конц)→ 4 Zn. SO 4+4 H 2 O+H 2 S Концентрированная серная кислота способна отнимать воду из молекул органических веществ, обугливая их. Взаимодействие кислоты с сахарозой(C 12 H 22 O 11) C 12 H 22 O 11 + 2 H 2 SO 4(конц) = 11 C + 13 H 2 O↑ +2 SO 2↑ +CO 2↑
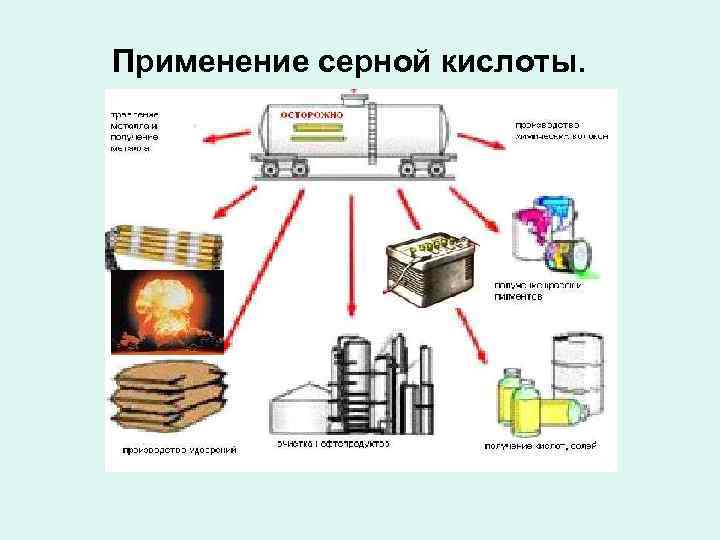 Применение серной кислоты.
Применение серной кислоты.
 Сульфат натрия.
Сульфат натрия.
 Сульфат никеля
Сульфат никеля
 дать классификацию химическим реакциям. Сульфат меди
дать классификацию химическим реакциям. Сульфат меди























