Л 7 Т 3 Подгруппа Селена.ppt
- Количество слайдов: 36
 Т 3 Л 7 Подгруппа Селена • Селен Sе, теллур Те и полоний Ро р-элементы с конфигурацией валентных электронов s 2 р4. • В образование связей у селена и его аналогов вовлекаются непарные электроны, а также одна или две электронные пары. Поэтому у рэлементов VI группы наблюдаются четные степени окисления: – 2, +4, +6. 1
Т 3 Л 7 Подгруппа Селена • Селен Sе, теллур Те и полоний Ро р-элементы с конфигурацией валентных электронов s 2 р4. • В образование связей у селена и его аналогов вовлекаются непарные электроны, а также одна или две электронные пары. Поэтому у рэлементов VI группы наблюдаются четные степени окисления: – 2, +4, +6. 1
 • В подгруппе селена, как и в других подгруппах рэлементов, с увеличением размеров атомов наблюдается общая тенденция к увеличению характерного координационного числа. Так, для серы и селена наиболее типичны координационные числа 3 и 4, а для теллура 6, иногда даже 7 и 8. • По содержанию на Земле селен и теллур рассеянные, а полоний — редкий элементы. Природный селен состоит из шести устойчивых изотопов, теллур – из семи. Получены также радиоактивные изотопы селена и теллура. Полоний стабильных изотопов не имеет, для него известно свыше двадцати радиоактивных изотопов. 2
• В подгруппе селена, как и в других подгруппах рэлементов, с увеличением размеров атомов наблюдается общая тенденция к увеличению характерного координационного числа. Так, для серы и селена наиболее типичны координационные числа 3 и 4, а для теллура 6, иногда даже 7 и 8. • По содержанию на Земле селен и теллур рассеянные, а полоний — редкий элементы. Природный селен состоит из шести устойчивых изотопов, теллур – из семи. Получены также радиоактивные изотопы селена и теллура. Полоний стабильных изотопов не имеет, для него известно свыше двадцати радиоактивных изотопов. 2
 • Собственные минералы селена и теллура встречаются редко. Чаще всего Sе и Те сопутствуют самородной сере и в виде селенидов и теллуридов присутствуют в сульфидных рудах. Полоний содержится в урановых и ториевых минералах как продукт распада радиоактивного ряда урана. 3
• Собственные минералы селена и теллура встречаются редко. Чаще всего Sе и Те сопутствуют самородной сере и в виде селенидов и теллуридов присутствуют в сульфидных рудах. Полоний содержится в урановых и ториевых минералах как продукт распада радиоактивного ряда урана. 3
 • Простые вещества. В ряду O—S—Sе—Te—Po тип устойчивых молекул изменяется: от двухатомных кислорода О 2, затем циклических S 8 и Se 8; и цепных молекул Sе∞ и Te∞ до металлического кристалла Po. • Как и сера, селен имеет полиморфные модификации. Наиболее устойчив, гексагональный или серый селен - хрупкие кристаллы с металлическим блеском. Его кристаллы образованы зигзагообразными цепями Sе∞. При быстром охлаждении жидкого селена получается красно-коричневая стекловидная (аморфная) модификация. Она образована неупорядоченно расположенными молекулами Sе∞, разной длины. • Кристаллические разновидности красного селена состоят из циклических молекул Sе 8, подобных S 8. 4
• Простые вещества. В ряду O—S—Sе—Te—Po тип устойчивых молекул изменяется: от двухатомных кислорода О 2, затем циклических S 8 и Se 8; и цепных молекул Sе∞ и Te∞ до металлического кристалла Po. • Как и сера, селен имеет полиморфные модификации. Наиболее устойчив, гексагональный или серый селен - хрупкие кристаллы с металлическим блеском. Его кристаллы образованы зигзагообразными цепями Sе∞. При быстром охлаждении жидкого селена получается красно-коричневая стекловидная (аморфная) модификация. Она образована неупорядоченно расположенными молекулами Sе∞, разной длины. • Кристаллические разновидности красного селена состоят из циклических молекул Sе 8, подобных S 8. 4
 • Серый селен — полупроводник ( Е = 1, 8 э. В). Его электрическая проводимость резко (примерно в 1000 раз) возрастает при освещении. Полупроводниковые свойства проявляет также жидкий селен. На границе селена с металлическим проводником образуется запорный слой – участок, способный пропускать электрический ток только в одном направлении. Селен применяется в полупроводниковой технике для изготовления выпрямителей фотоэлементов с запорным слоем. 5
• Серый селен — полупроводник ( Е = 1, 8 э. В). Его электрическая проводимость резко (примерно в 1000 раз) возрастает при освещении. Полупроводниковые свойства проявляет также жидкий селен. На границе селена с металлическим проводником образуется запорный слой – участок, способный пропускать электрический ток только в одном направлении. Селен применяется в полупроводниковой технике для изготовления выпрямителей фотоэлементов с запорным слоем. 5
 • Устойчивые модификации теллура образованы зигзагообразными молекулами Te∞. • Гексагональная модификация теллура — серебристо-белое металлоподобное кристаллическое вещество. Однако он хрупок, легко растирается в порошок. Его электрическая проводимость незначительна, но при освещении увеличивается, т. е. теллур — полупроводник ( Е = 0, 35 э. В). Аморфный теллур (коричневого цвета) менее устойчив, чем аморфный селен, и при 25 о. С переходит в кристаллический. 6
• Устойчивые модификации теллура образованы зигзагообразными молекулами Te∞. • Гексагональная модификация теллура — серебристо-белое металлоподобное кристаллическое вещество. Однако он хрупок, легко растирается в порошок. Его электрическая проводимость незначительна, но при освещении увеличивается, т. е. теллур — полупроводник ( Е = 0, 35 э. В). Аморфный теллур (коричневого цвета) менее устойчив, чем аморфный селен, и при 25 о. С переходит в кристаллический. 6
 • Будучи изоморфными, гексагональные селен и теллур образуют между собой непрерывный ряд твердых растворов. • При высоких температурах пары селена и теллура состоят из парамагнитных молекул Sе 2 и Те 2. При понижении температуры они полимеризуются в молекулы Э 4, Э 6 и Э 8. • Селен, теллур и их соединения очень ядовиты. 7
• Будучи изоморфными, гексагональные селен и теллур образуют между собой непрерывный ряд твердых растворов. • При высоких температурах пары селена и теллура состоят из парамагнитных молекул Sе 2 и Те 2. При понижении температуры они полимеризуются в молекулы Э 4, Э 6 и Э 8. • Селен, теллур и их соединения очень ядовиты. 7
 • П о л о н и й - мягкий металл серебристобелого цвета, по физическим свойствам напоминающий висмут и свинец (Тпл. 254 0 С). • Как видно, в ряду O—S—Sе—Te—Po структурные изменения и ослабление ковалентности связи Э—Э соответствуют изменению физических свойств; так, кислород и сера — диэлектрики, селен и теллур — полупроводники, а полоний обладает металлической проводимостью. 8
• П о л о н и й - мягкий металл серебристобелого цвета, по физическим свойствам напоминающий висмут и свинец (Тпл. 254 0 С). • Как видно, в ряду O—S—Sе—Te—Po структурные изменения и ослабление ковалентности связи Э—Э соответствуют изменению физических свойств; так, кислород и сера — диэлектрики, селен и теллур — полупроводники, а полоний обладает металлической проводимостью. 8
 • В ряду O—S—Sе—Te—Po уменьшается окислительная и возрастает восстановительная активность, о чем, в частности, свидетельствует сопоставление их электродных потенциалов. • Селен с водой и разбавленными кислотами не реагирует (только при Т 100 °С), в то время как теллур медленно при н. у. окисляется водой: Те + 2 Н 2 O = Те. O 2 + 2 Н 2 • Полоний реагирует с соляной кислотой как типичный металл, с водой при Т 100 °С: Ро + 2 НСl = Ро. Сl 2 + Н 2 9
• В ряду O—S—Sе—Te—Po уменьшается окислительная и возрастает восстановительная активность, о чем, в частности, свидетельствует сопоставление их электродных потенциалов. • Селен с водой и разбавленными кислотами не реагирует (только при Т 100 °С), в то время как теллур медленно при н. у. окисляется водой: Те + 2 Н 2 O = Те. O 2 + 2 Н 2 • Полоний реагирует с соляной кислотой как типичный металл, с водой при Т 100 °С: Ро + 2 НСl = Ро. Сl 2 + Н 2 9
 • S, Se, Te с кислотами-неокислителями не реагируют. При нагревании Se, Te и Po довольно легко окисляются кислородом и галогенами, при сплавлении взаимодействуют с металлами. • Подобно другим неметаллам Sе и Те окисляются концентрированной HNO 3 до кислот Se + 4 HNO 3 = H 2 Se. O 3 + 4 NO 2 + H 2 O. • Полоний же в этих условиях образует солеподобные соединения: Po + 8 HNO 3 = Po(NO 3)4 + 4 NO 2 + 4 H 2 O. • При кипячении в щелочных растворах селен и теллур, подобно сере, диспропорционируют: 0 +4 -2 10 3 Э + 6 КОН = К 2 ЭО 3 + 2 K 2 Э + 3 Н 2 O
• S, Se, Te с кислотами-неокислителями не реагируют. При нагревании Se, Te и Po довольно легко окисляются кислородом и галогенами, при сплавлении взаимодействуют с металлами. • Подобно другим неметаллам Sе и Те окисляются концентрированной HNO 3 до кислот Se + 4 HNO 3 = H 2 Se. O 3 + 4 NO 2 + H 2 O. • Полоний же в этих условиях образует солеподобные соединения: Po + 8 HNO 3 = Po(NO 3)4 + 4 NO 2 + 4 H 2 O. • При кипячении в щелочных растворах селен и теллур, подобно сере, диспропорционируют: 0 +4 -2 10 3 Э + 6 КОН = К 2 ЭО 3 + 2 K 2 Э + 3 Н 2 O
 • Селен и теллур извлекают из отходов производства серной кислоты, накапливающихся в пылеуловителях, и из анодного шлама, образуемого при электролитической очистке цветных металлов. Для этого отходы и шлам окисляют, например, с помощью Мn. O 2, образующиеся при этом Sе. O 2 и Те. O 2 разделяют и восстанавливают диоксидом серы: ЭO 2 + 2 SO 2 = Э • + 2 SO 3 Как полупроводники селен и теллур используются для изготовления фотоэлементов оптических и сигнальных приборов. Кроме того, селен используют в стекольной промышленности для получения стекол рубинового цвета и др. Изотоп 210 Ро (Т 1/2 = 138, 4 дня) применяют как источник -частиц. 11
• Селен и теллур извлекают из отходов производства серной кислоты, накапливающихся в пылеуловителях, и из анодного шлама, образуемого при электролитической очистке цветных металлов. Для этого отходы и шлам окисляют, например, с помощью Мn. O 2, образующиеся при этом Sе. O 2 и Те. O 2 разделяют и восстанавливают диоксидом серы: ЭO 2 + 2 SO 2 = Э • + 2 SO 3 Как полупроводники селен и теллур используются для изготовления фотоэлементов оптических и сигнальных приборов. Кроме того, селен используют в стекольной промышленности для получения стекол рубинового цвета и др. Изотоп 210 Ро (Т 1/2 = 138, 4 дня) применяют как источник -частиц. 11
 • Соединения со степенью окисления селена, теллура и полония -2. • У селена, теллура и полония степень окисления -2 проявляется соответственно в селенидах, теллуридах и полонидах — соединениях с менее электроотрицательными, чем они сами, элементами. В этих типах соединений проявляется аналогия элементов селена и теллура с кислородом и серой. Например: 12
• Соединения со степенью окисления селена, теллура и полония -2. • У селена, теллура и полония степень окисления -2 проявляется соответственно в селенидах, теллуридах и полонидах — соединениях с менее электроотрицательными, чем они сами, элементами. В этих типах соединений проявляется аналогия элементов селена и теллура с кислородом и серой. Например: 12
 • По методам получения, кристаллической структуре, растворимости и химическим свойствам селениды и теллуриды аналогичны сульфидам. Среди них имеются основные (К 2 Sе, К 2 Те) и кислотные (СSе 2, СТе 2) соединения: К 2 Sе + H 2 O КSе. Н + КОН; основный СSе 2 + 3 H 2 O = H 2 СO 3 + 2 H 2 Sе кислотный • Вследствие больших размеров и низкой электроотрицательности атомов Sе-2 и Те-2 в качестве лигандов выступают редко. Поэтому реакции между селенидами и тем более между теллуридами разной химической природы не характерны. 13
• По методам получения, кристаллической структуре, растворимости и химическим свойствам селениды и теллуриды аналогичны сульфидам. Среди них имеются основные (К 2 Sе, К 2 Те) и кислотные (СSе 2, СТе 2) соединения: К 2 Sе + H 2 O КSе. Н + КОН; основный СSе 2 + 3 H 2 O = H 2 СO 3 + 2 H 2 Sе кислотный • Вследствие больших размеров и низкой электроотрицательности атомов Sе-2 и Те-2 в качестве лигандов выступают редко. Поэтому реакции между селенидами и тем более между теллуридами разной химической природы не характерны. 13
 • В соответствии с усилением металлических признаков простых веществ в ряду O—S—Sе— Te—Po возрастает склонность к образованию соединений типа интерметаллических. • Большая группа селенидов и теллуридов (Zn. Se, Рb. Se, Cd. Te, Hg. Te, Pb. Te и др. ) — полупроводники. Наибольшее применение в качестве полупроводников имеют селениды и теллуриды элементов подгруппы цинка. 14
• В соответствии с усилением металлических признаков простых веществ в ряду O—S—Sе— Te—Po возрастает склонность к образованию соединений типа интерметаллических. • Большая группа селенидов и теллуридов (Zn. Se, Рb. Se, Cd. Te, Hg. Te, Pb. Te и др. ) — полупроводники. Наибольшее применение в качестве полупроводников имеют селениды и теллуриды элементов подгруппы цинка. 14
 • Селенид водорода H 2 Sе и теллурид водорода H 2 Те в обычных условиях — газы с очень неприятным запахом, по структуре и свойствам напоминают Н 2 S. • В ряду H 2 O—H 2 Sе—H 2 Te по мере увеличения длины и уменьшения энергии связи ЭН устойчивость молекул падает. В отличие от оксида и сульфида водорода селенид и теллурид водорода — эндотермические соединения ( Go 298 О). При нагревании H 2 Te легко распадается, а H 2 Ро разлагается уже при получении. 15
• Селенид водорода H 2 Sе и теллурид водорода H 2 Те в обычных условиях — газы с очень неприятным запахом, по структуре и свойствам напоминают Н 2 S. • В ряду H 2 O—H 2 Sе—H 2 Te по мере увеличения длины и уменьшения энергии связи ЭН устойчивость молекул падает. В отличие от оксида и сульфида водорода селенид и теллурид водорода — эндотермические соединения ( Go 298 О). При нагревании H 2 Te легко распадается, а H 2 Ро разлагается уже при получении. 15
 • В воде Н 2 Sе и Н 2 Те растворяются лучше, чем Н 2 S. Их растворы — слабые кислоты. • В ряду Н 2 O—Н 2 Sе—Н 2 Те сила кислот возрастает, что объясняется уменьшением энергии связи ЭН. В этом же ряду растет восстановительная способность Н 2 Э. • Для Н 2 Sе известны и кислые, и средние соли, для Н 2 Те – только средние. • Существуют полиселениды и полителлуриды М 2+Эn (n=2 -6), но Н 2 Эn не получены. • Селенид водорода и его производные яд о в и т ы! 16
• В воде Н 2 Sе и Н 2 Те растворяются лучше, чем Н 2 S. Их растворы — слабые кислоты. • В ряду Н 2 O—Н 2 Sе—Н 2 Те сила кислот возрастает, что объясняется уменьшением энергии связи ЭН. В этом же ряду растет восстановительная способность Н 2 Э. • Для Н 2 Sе известны и кислые, и средние соли, для Н 2 Те – только средние. • Существуют полиселениды и полителлуриды М 2+Эn (n=2 -6), но Н 2 Эn не получены. • Селенид водорода и его производные яд о в и т ы! 16
 • Соединении селена (II), теллура(II) и полония (II). Из производных Sе(II), Те(II) и Ро(II) лучше других изучены галогениды. Относительная устойчивость соединений Э(II) в ряду О—S—Sе —Те—Ро увеличивается. В то время как для S и Sе более характерны галогениды типа Э 2 Наl 2, для теллура и полония они неизвестны, но устойчивы дигалогениды Те. Наl 2 и Ро. Наl 2. • Галогениды Sе(II) — кислотные соединения, а аналогичные производные Те(II), в особенности Ро(II), по свойствам приближаются к солям. 17
• Соединении селена (II), теллура(II) и полония (II). Из производных Sе(II), Те(II) и Ро(II) лучше других изучены галогениды. Относительная устойчивость соединений Э(II) в ряду О—S—Sе —Те—Ро увеличивается. В то время как для S и Sе более характерны галогениды типа Э 2 Наl 2, для теллура и полония они неизвестны, но устойчивы дигалогениды Те. Наl 2 и Ро. Наl 2. • Галогениды Sе(II) — кислотные соединения, а аналогичные производные Те(II), в особенности Ро(II), по свойствам приближаются к солям. 17
 • Для химии Sе (II) и Те(II) очень характерны реакции диспропорцио-нирования, протекающие при нагревании и гидролизе галогенидов: +2 t +4 0 • 2 Te. Cl 2 = Te. Cl 4 + Te +2 0 +4 • 2 Sе. Cl 2 + 3 H 2 O = Sе + H 2 Sе. O 3 + 4 HCl 18
• Для химии Sе (II) и Те(II) очень характерны реакции диспропорцио-нирования, протекающие при нагревании и гидролизе галогенидов: +2 t +4 0 • 2 Te. Cl 2 = Te. Cl 4 + Te +2 0 +4 • 2 Sе. Cl 2 + 3 H 2 O = Sе + H 2 Sе. O 3 + 4 HCl 18
 • Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО 2, тетрагалогенидах ЭНаl 4, оксодигалогенидах ЭОНаl 2, а также соответствующих анионных комплексах, например, типа [ЭО 3]2 -, [ЭНаl 6]2 -. Для полония (IV), кроме того, характерны солеподобные соединения типа Ро(SO 4)2, Ро(NO 3)4. • В отличие от серы у селена и его аналогов диоксиды ЭO 2 в обычных условиях полимерные соединения. 19
• Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО 2, тетрагалогенидах ЭНаl 4, оксодигалогенидах ЭОНаl 2, а также соответствующих анионных комплексах, например, типа [ЭО 3]2 -, [ЭНаl 6]2 -. Для полония (IV), кроме того, характерны солеподобные соединения типа Ро(SO 4)2, Ро(NO 3)4. • В отличие от серы у селена и его аналогов диоксиды ЭO 2 в обычных условиях полимерные соединения. 19
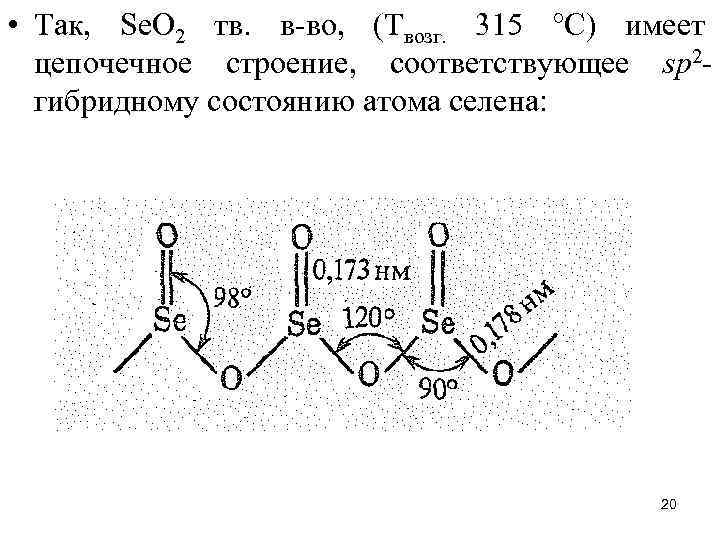 • Так, Sе. O 2 тв. в-во, (Твозг. 315 °С) имеет цепочечное строение, соответствующее sp 2 гибридному состоянию атома селена: 20
• Так, Sе. O 2 тв. в-во, (Твозг. 315 °С) имеет цепочечное строение, соответствующее sp 2 гибридному состоянию атома селена: 20
 • В ряду Sе. O 2—Те. O 2—Ро. O 2 отчетливо наблюдается ослабление кислотных свойств. Так, Sе. O 2 легко растворяется в воде, образуя селенистую кислоту Н 2 Sе. О 3 (K 1 = 2 10 -3): Sе. O 2 + Н 2 O = Н 2 Sе. О 3 (S, Se) 21
• В ряду Sе. O 2—Те. O 2—Ро. O 2 отчетливо наблюдается ослабление кислотных свойств. Так, Sе. O 2 легко растворяется в воде, образуя селенистую кислоту Н 2 Sе. О 3 (K 1 = 2 10 -3): Sе. O 2 + Н 2 O = Н 2 Sе. О 3 (S, Se) 21
 • Те. О 2 в воде не растворяется, но взаимодействует с растворами щелочей: Те. О 2 + 2 КОН + 2 Н 2 О = К 2[Те(ОH)6] • Ро. О 2 с щелочами реагирует только при сплавлении ЭО 2 + КОН = К 2 ЭО 3 + Н 2 О (Э = Se, Te, Po) • Производные ЭО 32 - — называются селенитами, теллуритами и полонитами. Po с кислотами взаимодействует как основный оксид: Ро. О 2 + 2 Н 2 SО 4 = Ро(SО 4)2 + 2 H 2 O 22
• Те. О 2 в воде не растворяется, но взаимодействует с растворами щелочей: Те. О 2 + 2 КОН + 2 Н 2 О = К 2[Те(ОH)6] • Ро. О 2 с щелочами реагирует только при сплавлении ЭО 2 + КОН = К 2 ЭО 3 + Н 2 О (Э = Se, Te, Po) • Производные ЭО 32 - — называются селенитами, теллуритами и полонитами. Po с кислотами взаимодействует как основный оксид: Ро. О 2 + 2 Н 2 SО 4 = Ро(SО 4)2 + 2 H 2 O 22
 • В отличие от Н 2 SО 3 триоксоселенат (IV) водорода Н 2 Sе. О 3 выделен в свободном состоянии. Это — твердое вещество, которое легко теряет воду (при 70 о. С). • Н 2 Те. О 3 склонен к полимеризации, и поэтому при действии кислот на теллуриты выделяется осадок переменного состава Те. О 2 n. Н 2 О (K 1 = 3 10 -6 ). • Кислотные свойства в ряду Н 2 SО 3 - Н 2 Sе. О 3 Н 2 Те. О 3 ослабевают. 23
• В отличие от Н 2 SО 3 триоксоселенат (IV) водорода Н 2 Sе. О 3 выделен в свободном состоянии. Это — твердое вещество, которое легко теряет воду (при 70 о. С). • Н 2 Те. О 3 склонен к полимеризации, и поэтому при действии кислот на теллуриты выделяется осадок переменного состава Те. О 2 n. Н 2 О (K 1 = 3 10 -6 ). • Кислотные свойства в ряду Н 2 SО 3 - Н 2 Sе. О 3 Н 2 Те. О 3 ослабевают. 23
 • Оксид Sе. O 2 (а также Sе. О 32 -) по сравнению с SO 2 (в SО 32 -) проявляют в большей степени окислительные свойства, чем восстановительные. Например, Sе. O 2 легко окисляет SО 2: 2 SО 2 + Sе. О 2 = Sе + 2 SО 3 • Для окисления же производных Э (IV) необходимы сильные окислители. H 2 Se. O 3 + H 2 O 2 = H 2 Se. O 4 + H 2 O 24
• Оксид Sе. O 2 (а также Sе. О 32 -) по сравнению с SO 2 (в SО 32 -) проявляют в большей степени окислительные свойства, чем восстановительные. Например, Sе. O 2 легко окисляет SО 2: 2 SО 2 + Sе. О 2 = Sе + 2 SО 3 • Для окисления же производных Э (IV) необходимы сильные окислители. H 2 Se. O 3 + H 2 O 2 = H 2 Se. O 4 + H 2 O 24
 • Соединения селена (VI), теллура (VI) и полония (VI). Для селена (VI) и теллура (VI) известны бинарные соединения с кислородом и фтором: • Соединения полония (VI) неустойчивы. 25
• Соединения селена (VI), теллура (VI) и полония (VI). Для селена (VI) и теллура (VI) известны бинарные соединения с кислородом и фтором: • Соединения полония (VI) неустойчивы. 25
 • Триоксид селена Sе. O 3 (Тпл. 118, 5 °С, Tразл. 185 °С) белого цвета, известен в виде стекловидной и асбестовидной модификаций. С водой Sе. O 3 взаимодействует очень энергично образуя селеновую кислоту. • Триоксид теллура Те. О 3 также имеет две модификации. В воде практически не растворяется, но взаимодействует со щелочами. 26
• Триоксид селена Sе. O 3 (Тпл. 118, 5 °С, Tразл. 185 °С) белого цвета, известен в виде стекловидной и асбестовидной модификаций. С водой Sе. O 3 взаимодействует очень энергично образуя селеновую кислоту. • Триоксид теллура Те. О 3 также имеет две модификации. В воде практически не растворяется, но взаимодействует со щелочами. 26
 • Триоксид селена Sе. О 3 получают кипячением К 2 Sе. O 4 с жидким SО 3, а Те. О 3 — обезвоживанием гексаоксотеллурата (VI) водорода: • K 2 Sе. O 4 + SO 3 = K 2 SO 4 + Sе. О 3; • H 6 Te. O 6 = Te. O 3 + 3 H 2 O • Селеновую H 2 Sе. О 4 и теллуровую H 6 Te. O 6 кислоты можно получить окислением Э+4 или Э 0 сильными окислителями: • H 2 Sе. О 3 + H 2 O 2 = H 2 Sе. O 4 + H 2 O; • Te + HCl. O 4 = H 6 Te. O 6 + HCl. • Te + HCl. O 3 + 3 H 2 O = H 6 Te. O 6 + HCl 27
• Триоксид селена Sе. О 3 получают кипячением К 2 Sе. O 4 с жидким SО 3, а Те. О 3 — обезвоживанием гексаоксотеллурата (VI) водорода: • K 2 Sе. O 4 + SO 3 = K 2 SO 4 + Sе. О 3; • H 6 Te. O 6 = Te. O 3 + 3 H 2 O • Селеновую H 2 Sе. О 4 и теллуровую H 6 Te. O 6 кислоты можно получить окислением Э+4 или Э 0 сильными окислителями: • H 2 Sе. О 3 + H 2 O 2 = H 2 Sе. O 4 + H 2 O; • Te + HCl. O 4 = H 6 Te. O 6 + HCl. • Te + HCl. O 3 + 3 H 2 O = H 6 Te. O 6 + HCl 27
 • Тетраоксоселенат (VI) водорода H 2 Sе. O 4 белое кристаллическое вещество (Тпл. 62, 4 °С). Как и Н 2 SO 4, он жадно поглощает воду, обугливает органические вещества Его водный раствор сильная кислота, Называемая селеновой (К 1 = 1 103, К 2 = 1, 2 10 -2). Из растворов выделяются кристаллогидраты (Н 2 Sе. О 4 Н 2 O, Н 2 Sе. О 4 2 Н 2 O, Н 2 Sе. О 4 4 Н 2 O), являющиеся селенатами оксония. 28
• Тетраоксоселенат (VI) водорода H 2 Sе. O 4 белое кристаллическое вещество (Тпл. 62, 4 °С). Как и Н 2 SO 4, он жадно поглощает воду, обугливает органические вещества Его водный раствор сильная кислота, Называемая селеновой (К 1 = 1 103, К 2 = 1, 2 10 -2). Из растворов выделяются кристаллогидраты (Н 2 Sе. О 4 Н 2 O, Н 2 Sе. О 4 2 Н 2 O, Н 2 Sе. О 4 4 Н 2 O), являющиеся селенатами оксония. 28
 • Гексаоксотеллурат (VI) водорода H 6 Te. O 6 белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая (К 1 = 2 10 -8, К 2 = 5 10 -11). При нейтрализации Н 6 Те. О 6 щелочью образуются гидротеллураты например: М+1[Те. О(ОН)5] - (М+1 Н 5 Те. O 6), М 2+1[Те. О 2(ОН)4] (М 2+1 H 4 Те. О 6). Получены также производные типа Аg 6 Те. О 6, Нg 3 Те. О 6. • H 6 Te. O 6 тоже сильный окислитель, но слабее, чем H 2 Sе. O 4. 29
• Гексаоксотеллурат (VI) водорода H 6 Te. O 6 белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая (К 1 = 2 10 -8, К 2 = 5 10 -11). При нейтрализации Н 6 Те. О 6 щелочью образуются гидротеллураты например: М+1[Те. О(ОН)5] - (М+1 Н 5 Те. O 6), М 2+1[Те. О 2(ОН)4] (М 2+1 H 4 Те. О 6). Получены также производные типа Аg 6 Те. О 6, Нg 3 Те. О 6. • H 6 Te. O 6 тоже сильный окислитель, но слабее, чем H 2 Sе. O 4. 29
 • Соединения селена (VI) менее устойчивы, чем соответствующие соединения серы (VI). Так, при нагревании Sе. O 3 и Н 2 Sе. O 4 разлагаются с выделением кислорода. 2 Н 2 Sе. O 4 =(T)= 2 Н 2 Sе. O 3 + O 2 • Поэтому Н 2 Sе. O 4 — более сильный окислитель, чем Н 2 SO 4: • Аu растворяется в горячей конц. H 2 Sе. O 4: 2 Au + 6 H 2 Se. O 4(к) = Au 2(Se. O 4)3 + 3 H 2 Se. O 3 + 3 H 2 O. 30
• Соединения селена (VI) менее устойчивы, чем соответствующие соединения серы (VI). Так, при нагревании Sе. O 3 и Н 2 Sе. O 4 разлагаются с выделением кислорода. 2 Н 2 Sе. O 4 =(T)= 2 Н 2 Sе. O 3 + O 2 • Поэтому Н 2 Sе. O 4 — более сильный окислитель, чем Н 2 SO 4: • Аu растворяется в горячей конц. H 2 Sе. O 4: 2 Au + 6 H 2 Se. O 4(к) = Au 2(Se. O 4)3 + 3 H 2 Se. O 3 + 3 H 2 O. 30
 • Также, Н 2 Sе. O 4 окисляет концентрированную соляную кислоту: +6 -1 +4 0 Н 2 Sе. O 4 + 2 HCl = Н 2 Sе. O 3 + Cl 2 + H 2 O • За счет выделения атомарного хлора смесь Н 2 Sе. O 4 и НСl — сильнейший окислитель, растворяет золото и платину. • Окислительные свойства H 6 Te. O 6 выражены слабее, чем у H 2 Sе. O 4. 31
• Также, Н 2 Sе. O 4 окисляет концентрированную соляную кислоту: +6 -1 +4 0 Н 2 Sе. O 4 + 2 HCl = Н 2 Sе. O 3 + Cl 2 + H 2 O • За счет выделения атомарного хлора смесь Н 2 Sе. O 4 и НСl — сильнейший окислитель, растворяет золото и платину. • Окислительные свойства H 6 Te. O 6 выражены слабее, чем у H 2 Sе. O 4. 31
 • Помимо полупроводниковой техники соединения селена и теллура используются в органическом синтезе, в частности для получения разнообразных селени теллурорганических соединений. Добавка селена к стеклу и эмали окрашивает их в красный цвет. • Многие соединения селена и теллура токсичны. Полоний еще опаснее ввиду его радиоактивности. 32
• Помимо полупроводниковой техники соединения селена и теллура используются в органическом синтезе, в частности для получения разнообразных селени теллурорганических соединений. Добавка селена к стеклу и эмали окрашивает их в красный цвет. • Многие соединения селена и теллура токсичны. Полоний еще опаснее ввиду его радиоактивности. 32
 • Ст. ок. +4 Тпл. о. С SO 2 Se. O 2 Te. O 2 Po. O 2 газ бесцв. -75 тв. в-во. белый (возг. ) 337 тв. в-во. белый 733 крист. желтый (разлаг. ) 500 уменьшение растворимости в воде ослабление кислотных свойств рост восстановительной активности Ст. ок. +6 SO 3 Se. O 3 Te. O 3 Тпл. о. С бесц. летуч. 16, 8 белое тв. в-во. 121 желтое тв. в-во. разлаг. 400 33
• Ст. ок. +4 Тпл. о. С SO 2 Se. O 2 Te. O 2 Po. O 2 газ бесцв. -75 тв. в-во. белый (возг. ) 337 тв. в-во. белый 733 крист. желтый (разлаг. ) 500 уменьшение растворимости в воде ослабление кислотных свойств рост восстановительной активности Ст. ок. +6 SO 3 Se. O 3 Te. O 3 Тпл. о. С бесц. летуч. 16, 8 белое тв. в-во. 121 желтое тв. в-во. разлаг. 400 33
 Ст. ок. +4 Тпл. Н 2 Sе. O 3 неустойч. в раств. сернистая Ст. ок. +6 Н 2 SO 3 тв. в-во белое селенистая Н 2 Те. O 3 в раств. полимеризуется теллуристая к-та ослабление кислотных свойств 2 10 -2 2 10 -3 3 10 -6 Н 2 SO 4 Н 2 Sе. O 4 Н 6 Те. O 6 бесцв. маслянистая ж. 10, 3 серная белое крист. в-во 62, 4 селеновая белое крист. в-во 136 теллуровая 1 103 2 10 -8 рост окислительной активности 34
Ст. ок. +4 Тпл. Н 2 Sе. O 3 неустойч. в раств. сернистая Ст. ок. +6 Н 2 SO 3 тв. в-во белое селенистая Н 2 Те. O 3 в раств. полимеризуется теллуристая к-та ослабление кислотных свойств 2 10 -2 2 10 -3 3 10 -6 Н 2 SO 4 Н 2 Sе. O 4 Н 6 Те. O 6 бесцв. маслянистая ж. 10, 3 серная белое крист. в-во 62, 4 селеновая белое крист. в-во 136 теллуровая 1 103 2 10 -8 рост окислительной активности 34
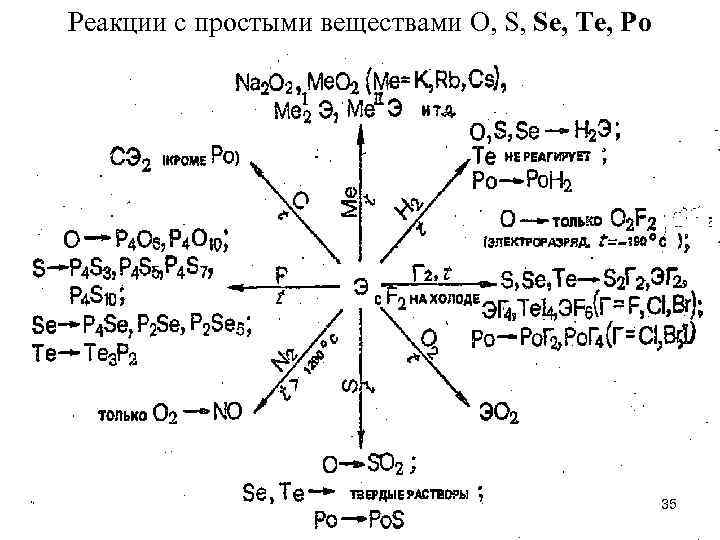 Реакции с простыми веществами O, S, Se, Te, Po 35
Реакции с простыми веществами O, S, Se, Te, Po 35
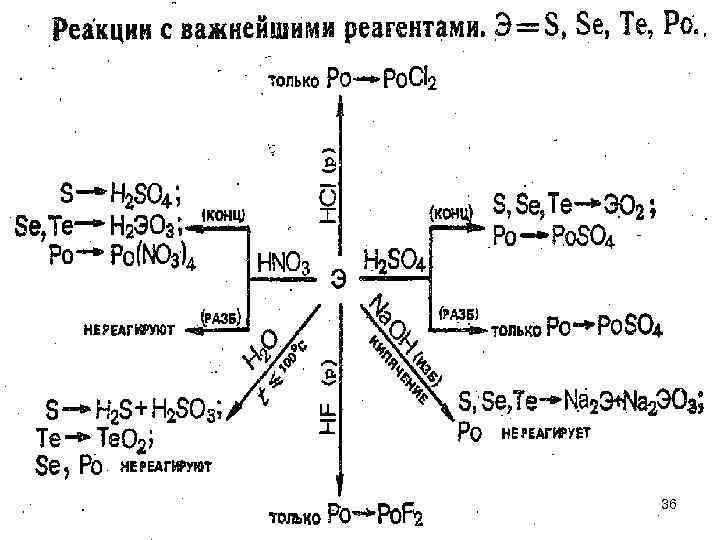 36
36


