Структура современной аналитической химии
































































Л.7.Методы разд. и конц..ppt
- Количество слайдов: 88
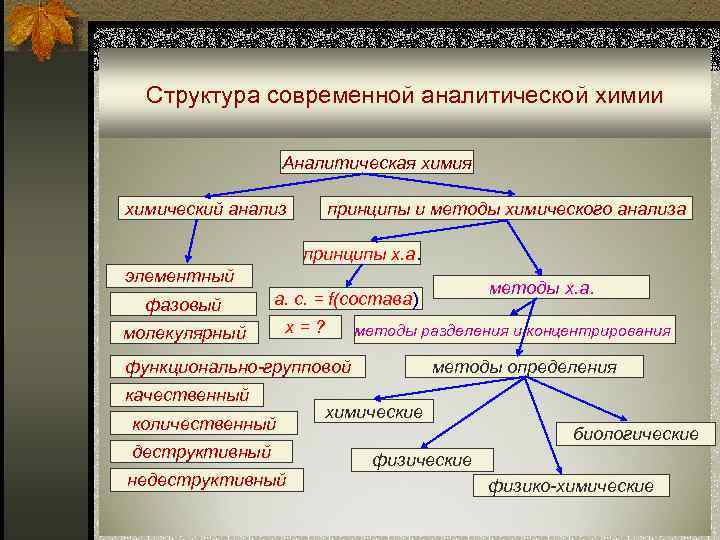
 Структура современной аналитической химии Аналитическая химический анализ принципы и методы химического анализа принципы х. а. элементный методы х. а. фазовый а. с. = f(состава) молекулярный x=? методы разделения и концентрирования функционально-групповой методы определения качественный химические количественный биологические деструктивный физические недеструктивный физико-химические
Структура современной аналитической химии Аналитическая химический анализ принципы и методы химического анализа принципы х. а. элементный методы х. а. фазовый а. с. = f(состава) молекулярный x=? методы разделения и концентрирования функционально-групповой методы определения качественный химические количественный биологические деструктивный физические недеструктивный физико-химические
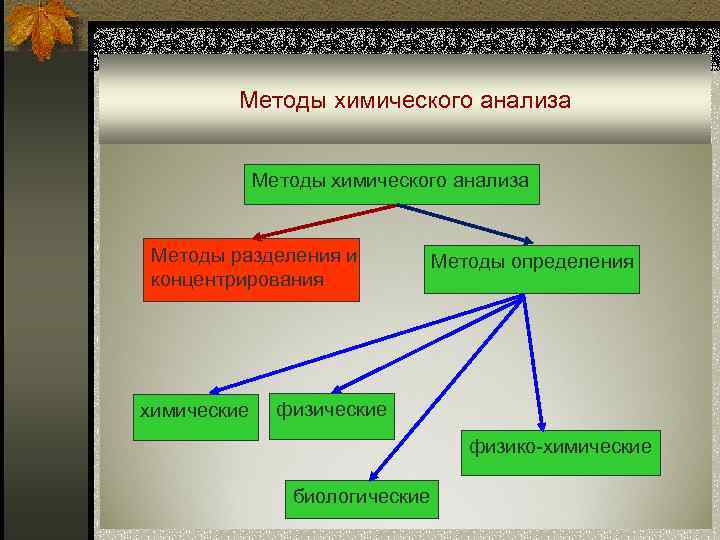
 Методы химического анализа Методы разделения и Методы определения концентрирования химические физические физико-химические биологические
Методы химического анализа Методы разделения и Методы определения концентрирования химические физические физико-химические биологические
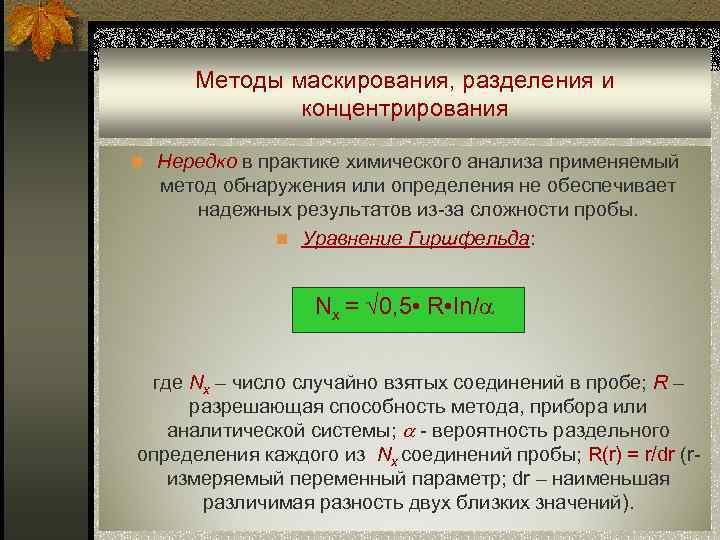
 Методы маскирования, разделения и концентрирования n Нередко в практике химического анализа применяемый метод обнаружения или определения не обеспечивает надежных результатов из-за сложности пробы. n Уравнение Гиршфельда: Nx = √ 0, 5 • R • In/ где Nx – число случайно взятых соединений в пробе; R – разрешающая способность метода, прибора или аналитической системы; - вероятность раздельного определения каждого из Nx соединений пробы; R(r) = r/dr (r- измеряемый переменный параметр; dr – наименьшая различимая разность двух близких значений).
Методы маскирования, разделения и концентрирования n Нередко в практике химического анализа применяемый метод обнаружения или определения не обеспечивает надежных результатов из-за сложности пробы. n Уравнение Гиршфельда: Nx = √ 0, 5 • R • In/ где Nx – число случайно взятых соединений в пробе; R – разрешающая способность метода, прибора или аналитической системы; - вероятность раздельного определения каждого из Nx соединений пробы; R(r) = r/dr (r- измеряемый переменный параметр; dr – наименьшая различимая разность двух близких значений).
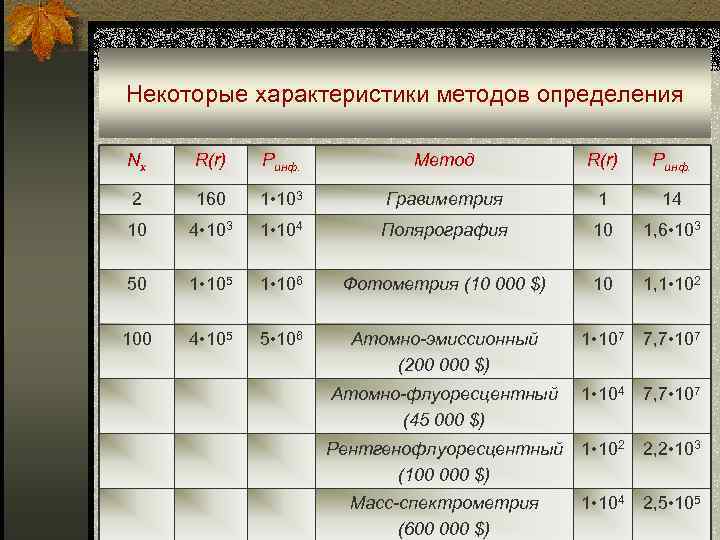
 Некоторые характеристики методов определения Nx R(r) Pинф. Метод R(r) Pинф. 2 160 1 • 103 Гравиметрия 1 14 10 4 • 103 1 • 104 Полярография 10 1, 6 • 103 50 1 • 105 1 • 106 Фотометрия (10 000 $) 10 1, 1 • 102 100 4 • 105 5 • 106 Атомно-эмиссионный 1 • 107 7, 7 • 107 (200 000 $) Атомно-флуоресцентный 1 • 104 7, 7 • 107 (45 000 $) Рентгенофлуоресцентный 1 • 102 2, 2 • 103 (100 000 $) Масс-спектрометрия 1 • 104 2, 5 • 105 (600 000 $)
Некоторые характеристики методов определения Nx R(r) Pинф. Метод R(r) Pинф. 2 160 1 • 103 Гравиметрия 1 14 10 4 • 103 1 • 104 Полярография 10 1, 6 • 103 50 1 • 105 1 • 106 Фотометрия (10 000 $) 10 1, 1 • 102 100 4 • 105 5 • 106 Атомно-эмиссионный 1 • 107 7, 7 • 107 (200 000 $) Атомно-флуоресцентный 1 • 104 7, 7 • 107 (45 000 $) Рентгенофлуоресцентный 1 • 102 2, 2 • 103 (100 000 $) Масс-спектрометрия 1 • 104 2, 5 • 105 (600 000 $)
 Методы маскирования n Маскирование – это торможение или полное подавление прямой химической реакции с участием мешающего компонента. n При термодинамическом (равновесном) маскировании концентрация мешающего компонента понижается до такой степени, что реакция с его участием незначительна (используют протолитические реакции, комплексообразования, окисления-восстановления): Fe 3+ + n. SCN- ↔ [Fe(SCN)n](3 -n); Igβ 6 = 3, 23; Co 2+ + m. SCN- ↔ [Co(SCN)m](2 -m); Igβ 4 = 2, 20; Fe 3+ + n. F- ↔ [Fe. Fn](3 -n); Igβ 3 = 11, 86.
Методы маскирования n Маскирование – это торможение или полное подавление прямой химической реакции с участием мешающего компонента. n При термодинамическом (равновесном) маскировании концентрация мешающего компонента понижается до такой степени, что реакция с его участием незначительна (используют протолитические реакции, комплексообразования, окисления-восстановления): Fe 3+ + n. SCN- ↔ [Fe(SCN)n](3 -n); Igβ 6 = 3, 23; Co 2+ + m. SCN- ↔ [Co(SCN)m](2 -m); Igβ 4 = 2, 20; Fe 3+ + n. F- ↔ [Fe. Fn](3 -n); Igβ 3 = 11, 86.
 Наиболее распространенные маскирующие агенты
Наиболее распространенные маскирующие агенты
 Наиболее распространенные маскирующие агенты
Наиболее распространенные маскирующие агенты
 Методы маскирования ■ Кинетическое маскирование основано на увеличении разности между скоростями определяемого вещества и мешающего компонента с одним и тем же реагентом
Методы маскирования ■ Кинетическое маскирование основано на увеличении разности между скоростями определяемого вещества и мешающего компонента с одним и тем же реагентом
 Методы разделения и концентрирования n Привходящие факторы для использования методов разделения и концентрирования: - проба содержит компоненты, мешающие определению; - концентрация определяемого компонента ниже предела обнаружения метода; - определяемые компоненты неравномерно распределены в пробе; - отсутствуют стандартные образцы для градуировки приборов; - проба высокотоксична, радиоактивна или дорога.
Методы разделения и концентрирования n Привходящие факторы для использования методов разделения и концентрирования: - проба содержит компоненты, мешающие определению; - концентрация определяемого компонента ниже предела обнаружения метода; - определяемые компоненты неравномерно распределены в пробе; - отсутствуют стандартные образцы для градуировки приборов; - проба высокотоксична, радиоактивна или дорога.
 Методы разделения и концентрирования n Разделение – это операция (процесс), в результате которого компоненты, составляющие исходную смесь, отделяются друг от друга. При этом концентрации разделяемых компонентов могут быть одинаковыми или различными. n Концентрирование - это операция (процесс), в результате которого повышается отношение концентрации (количества) микрокомпонента к концентрации (количеству) макрокомпонента (или основы).
Методы разделения и концентрирования n Разделение – это операция (процесс), в результате которого компоненты, составляющие исходную смесь, отделяются друг от друга. При этом концентрации разделяемых компонентов могут быть одинаковыми или различными. n Концентрирование - это операция (процесс), в результате которого повышается отношение концентрации (количества) микрокомпонента к концентрации (количеству) макрокомпонента (или основы).
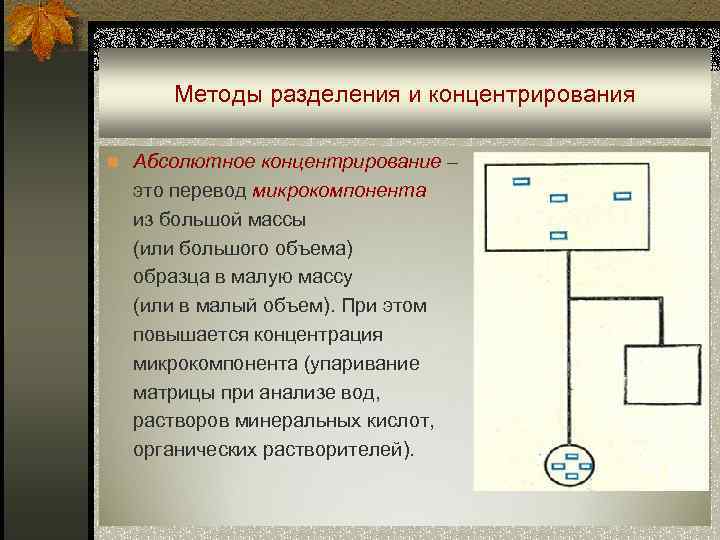
 Методы разделения и концентрирования n Абсолютное концентрирование – это перевод микрокомпонента из большой массы (или большого объема) образца в малую массу (или в малый объем). При этом повышается концентрация микрокомпонента (упаривание матрицы при анализе вод, растворов минеральных кислот, органических растворителей).
Методы разделения и концентрирования n Абсолютное концентрирование – это перевод микрокомпонента из большой массы (или большого объема) образца в малую массу (или в малый объем). При этом повышается концентрация микрокомпонента (упаривание матрицы при анализе вод, растворов минеральных кислот, органических растворителей).
 Методы разделения и концентрирования n Относительное концентрирование (обогащение) – это увеличение отношения между количествами микрокомпонента и макрокомпонента
Методы разделения и концентрирования n Относительное концентрирование (обогащение) – это увеличение отношения между количествами микрокомпонента и макрокомпонента
 Методы разделения и концентрирования n Групповое и индивидуальное разделение и концентрирование: - при групповом – за один прием отделяется несколько компонентов; - при индивидуальном – из образца выделяют один компонент или последовательно несколько компонентов. n Методы разделения и концентрирования основаны на использовании различий в свойствах компонентов анализируемой системы: растворимость, температура кипения, скорость движения частиц во внешнем электрическом поле, сорбция и др.
Методы разделения и концентрирования n Групповое и индивидуальное разделение и концентрирование: - при групповом – за один прием отделяется несколько компонентов; - при индивидуальном – из образца выделяют один компонент или последовательно несколько компонентов. n Методы разделения и концентрирования основаны на использовании различий в свойствах компонентов анализируемой системы: растворимость, температура кипения, скорость движения частиц во внешнем электрическом поле, сорбция и др.
 Классификация методов разделения и концентрирования Фаза с матрицей Метод микрокомпонентом Жидкость Экстракция микрокомпонентов и матрицы, распределительная хроматография Твердое тело Жидкость Сорбция, соосаждение, электролиз, цементация микрокомпонентов Жидкость Твердое тело Сорбция, осаждение, электролиз, кристаллизация, зонная плавка матрицы Газ Жидкость Испарение микрокомпонентов Жидкость Газ Испарение матрицы и мокрое озоление Газ Твердое тело Испарение микрокомпонентов Твердое тело Газ Сублимация, направленное
Классификация методов разделения и концентрирования Фаза с матрицей Метод микрокомпонентом Жидкость Экстракция микрокомпонентов и матрицы, распределительная хроматография Твердое тело Жидкость Сорбция, соосаждение, электролиз, цементация микрокомпонентов Жидкость Твердое тело Сорбция, осаждение, электролиз, кристаллизация, зонная плавка матрицы Газ Жидкость Испарение микрокомпонентов Жидкость Газ Испарение матрицы и мокрое озоление Газ Твердое тело Испарение микрокомпонентов Твердое тело Газ Сублимация, направленное
 Классификация методов разделения и концентрирования
Классификация методов разделения и концентрирования
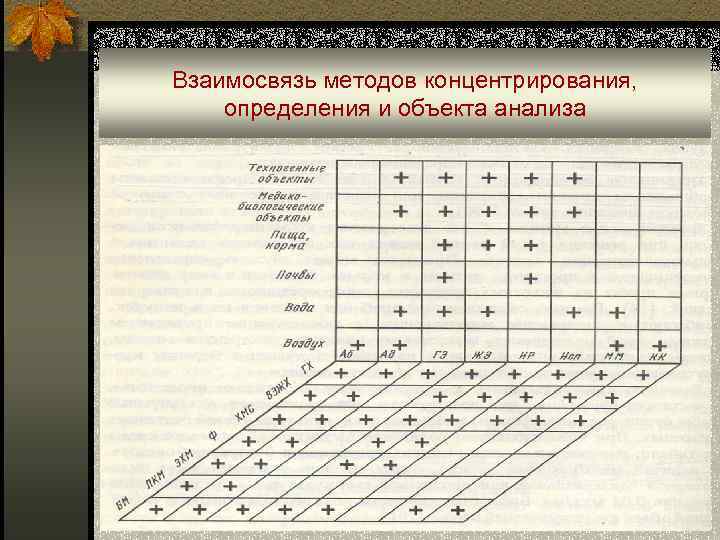
 Взаимосвязь методов концентрирования, определения и объекта анализа
Взаимосвязь методов концентрирования, определения и объекта анализа
 Количественные характеристики методов разделения и концентрирования n Большинство методов разделения и концентрирования основано на распределении вещества между двумя фазами (I и II): АII CA, I D = - коэффициент распределения. CA, II QA, II R = - степень извлечения. QA, II + QA, I
Количественные характеристики методов разделения и концентрирования n Большинство методов разделения и концентрирования основано на распределении вещества между двумя фазами (I и II): АII CA, I D = - коэффициент распределения. CA, II QA, II R = - степень извлечения. QA, II + QA, I
 Количественные характеристики методов разделения и концентрирования АII DA A/B = - коэффициент разделения. DB Коэффициент концентрирования (Sк) qк Qпроба 1 Sк = ———× ——— = Rмикр × —— qпроба Qк Rмакр
Количественные характеристики методов разделения и концентрирования АII DA A/B = - коэффициент разделения. DB Коэффициент концентрирования (Sк) qк Qпроба 1 Sк = ———× ——— = Rмикр × —— qпроба Qк Rмакр
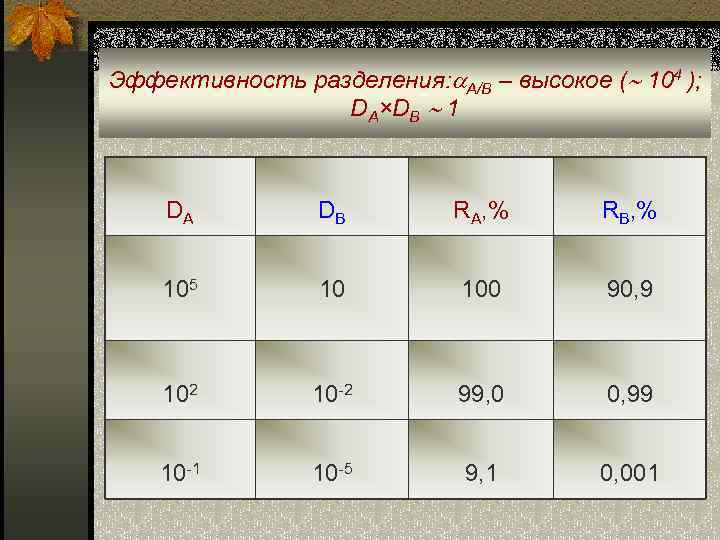
 Эффективность разделения: A/B – высокое ( 104 ); DA×DB 1 DA DB RA, % RB, % 105 100 90, 9 102 10 -2 99, 0 0, 99 10 -1 10 -5 9, 1 0, 001
Эффективность разделения: A/B – высокое ( 104 ); DA×DB 1 DA DB RA, % RB, % 105 100 90, 9 102 10 -2 99, 0 0, 99 10 -1 10 -5 9, 1 0, 001
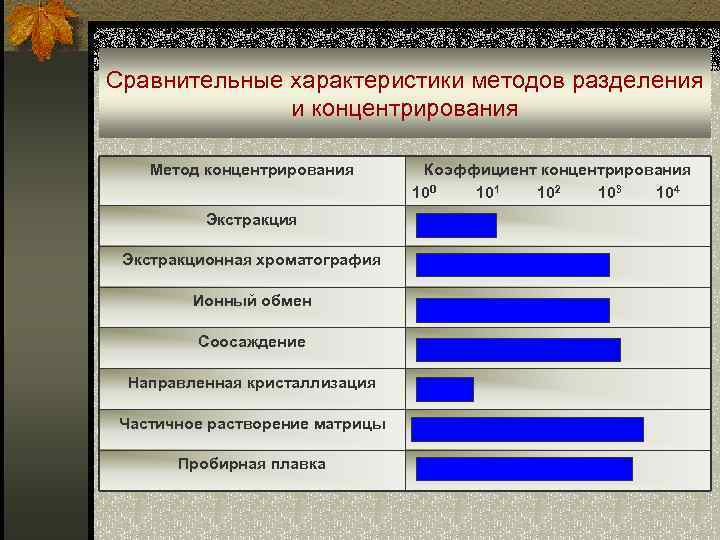
 Сравнительные характеристики методов разделения и концентрирования Метод концентрирования Коэффициент концентрирования 100 101 102 103 104 Экстракция Экстракционная хроматография Ионный обмен Соосаждение Направленная кристаллизация Частичное растворение матрицы Пробирная плавка
Сравнительные характеристики методов разделения и концентрирования Метод концентрирования Коэффициент концентрирования 100 101 102 103 104 Экстракция Экстракционная хроматография Ионный обмен Соосаждение Направленная кристаллизация Частичное растворение матрицы Пробирная плавка
 Осаждение n Метод осаждения основан на различной растворимости соединений, преимущественно в водных растворах. Метод имеет два явных недостатка: - потеря определяемого компонента вследствие частичной растворимости осадков; - cоосаждение мешающих компонентов.
Осаждение n Метод осаждения основан на различной растворимости соединений, преимущественно в водных растворах. Метод имеет два явных недостатка: - потеря определяемого компонента вследствие частичной растворимости осадков; - cоосаждение мешающих компонентов.
 Произведения растворимости ■ Соответствующие константы равновесия (произведения растворимости): K тs = a A m • a B n ; Kcs = [A]m • [B]n; K уs = С A m • С B n ; термодинамическое реальное условное; (концентрационное)
Произведения растворимости ■ Соответствующие константы равновесия (произведения растворимости): K тs = a A m • a B n ; Kcs = [A]m • [B]n; K уs = С A m • С B n ; термодинамическое реальное условное; (концентрационное)
 Осаждение n Характеристики метода: CA - [A] D = ————— [A] где CA - исходная концентрация А до осаждения; [A] – равновесная концентрация А в растворе после осаждения. при I =1, [A] = Ks /[B]; [B] – равновесная концентрация осадителя.
Осаждение n Характеристики метода: CA - [A] D = ————— [A] где CA - исходная концентрация А до осаждения; [A] – равновесная концентрация А в растворе после осаждения. при I =1, [A] = Ks /[B]; [B] – равновесная концентрация осадителя.
 Осаждение n Подставляем выражение для KS CA • [B] - KS D = ————— KS С учетом протекания конкурирующих реакций (R- осадитель) CA • Cв – Kу. S Kу. S(BR) D = ————— A/B = ———— Kу. S Kу. S(AR)
Осаждение n Подставляем выражение для KS CA • [B] - KS D = ————— KS С учетом протекания конкурирующих реакций (R- осадитель) CA • Cв – Kу. S Kу. S(BR) D = ————— A/B = ———— Kу. S Kу. S(AR)
 Осаждение n Концентрирование микрокомпонентов осаждением используют редко (трудно достичь значения Kу. S ); обычно выделяют матрицу. n Весьма эффективно разделение ионов металлов. ■ Соосаждение – распределение микрокомпонента (адсорбция, ионный обмен, окклюзия, изоморфное осаждение, образование химических соединений) между раствором (жидкая фаза) и осадком - коллектором (твердая фаза), причем микрокомпонент не образует собственной твердой фазы.
Осаждение n Концентрирование микрокомпонентов осаждением используют редко (трудно достичь значения Kу. S ); обычно выделяют матрицу. n Весьма эффективно разделение ионов металлов. ■ Соосаждение – распределение микрокомпонента (адсорбция, ионный обмен, окклюзия, изоморфное осаждение, образование химических соединений) между раствором (жидкая фаза) и осадком - коллектором (твердая фаза), причем микрокомпонент не образует собственной твердой фазы.
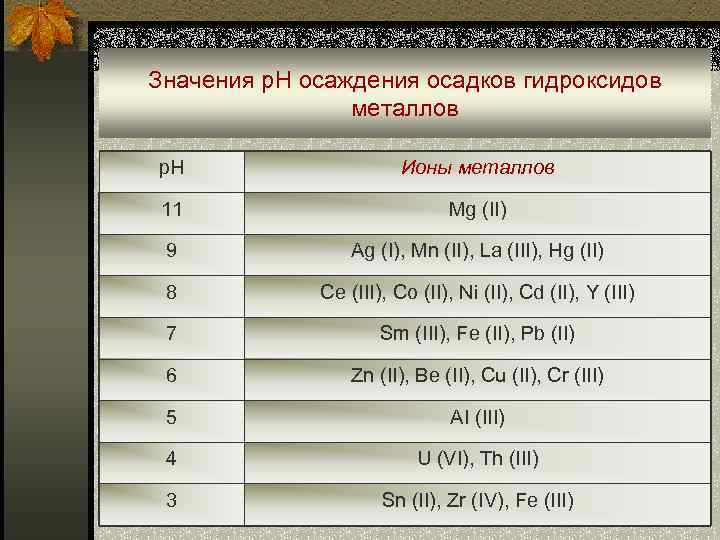
 Значения р. Н осаждения осадков гидроксидов металлов p. H Ионы металлов 11 Mg (II) 9 Ag (I), Mn (II), La (III), Hg (II) 8 Ce (III), Co (II), Ni (II), Cd (II), Y (III) 7 Sm (III), Fe (II), Pb (II) 6 Zn (II), Be (II), Cu (II), Cr (III) 5 AI (III) 4 U (VI), Th (III) 3 Sn (II), Zr (IV), Fe (III)
Значения р. Н осаждения осадков гидроксидов металлов p. H Ионы металлов 11 Mg (II) 9 Ag (I), Mn (II), La (III), Hg (II) 8 Ce (III), Co (II), Ni (II), Cd (II), Y (III) 7 Sm (III), Fe (II), Pb (II) 6 Zn (II), Be (II), Cu (II), Cr (III) 5 AI (III) 4 U (VI), Th (III) 3 Sn (II), Zr (IV), Fe (III)
 Соосаждение n Коллекторы – это малорастворимые неорганические или органические соединения с хорошо развитой поверхностью. n По степени абсолютного концентрирования, простоте и аппаратурному оформлению, соосаждение является одним из лучших методов. n Так, коэффициент концентрирования тяжелых металлов при их содержании в пробе 10 -9 -10 -6 г/л достигает 103, степень извлечения превышает 90%. n Недостаток метода соосаждения – его длительность.
Соосаждение n Коллекторы – это малорастворимые неорганические или органические соединения с хорошо развитой поверхностью. n По степени абсолютного концентрирования, простоте и аппаратурному оформлению, соосаждение является одним из лучших методов. n Так, коэффициент концентрирования тяжелых металлов при их содержании в пробе 10 -9 -10 -6 г/л достигает 103, степень извлечения превышает 90%. n Недостаток метода соосаждения – его длительность.
 Соосаждение микроэлементов с неорганическими коллекторами
Соосаждение микроэлементов с неорганическими коллекторами
 Соосаждение микроэлементов с органическими коллекторами
Соосаждение микроэлементов с органическими коллекторами
 Экстракция n Экстракция – метод выделения, разделения и концентрирования веществ, основанный на распределении растворенного вещества между двумя несмешивающимися жидкими фазами. n Экстракционный реагент – реагент, образующий экстрагируемое соединение (например, 8 -оксихинолин). n Экстрагент - вся система в целом (например, раствор 8 - оксихинолина в СНСI 3). n Разбавитель – инертный органический растворитель, применяемый для улучшения физических и экстракционных свойств экстрагента.
Экстракция n Экстракция – метод выделения, разделения и концентрирования веществ, основанный на распределении растворенного вещества между двумя несмешивающимися жидкими фазами. n Экстракционный реагент – реагент, образующий экстрагируемое соединение (например, 8 -оксихинолин). n Экстрагент - вся система в целом (например, раствор 8 - оксихинолина в СНСI 3). n Разбавитель – инертный органический растворитель, применяемый для улучшения физических и экстракционных свойств экстрагента.
 Экстракция n Экстракт – органическая фаза с экстрагированным соединением, отделенная от водной фазы. n Реэкстракция – перевод вещества из органической фазы в водную. n Реэкстрагент – раствор, используемый для реэкстракции.
Экстракция n Экстракт – органическая фаза с экстрагированным соединением, отделенная от водной фазы. n Реэкстракция – перевод вещества из органической фазы в водную. n Реэкстрагент – раствор, используемый для реэкстракции.
 Основные законы и количественные характеристики экстракции n Закон распределения Нернста: при постоянных температуре и давлении отношение активностей растворенного вещества между двумя несмешивающимися фазами есть величина постоянная. n В гетерогенной системе Aв ↔ Aо изменение энергии Гиббса (ΔG) запишется так: (a. A)o ΔG = ΔG 0 + RTIn —— (a. A)в
Основные законы и количественные характеристики экстракции n Закон распределения Нернста: при постоянных температуре и давлении отношение активностей растворенного вещества между двумя несмешивающимися фазами есть величина постоянная. n В гетерогенной системе Aв ↔ Aо изменение энергии Гиббса (ΔG) запишется так: (a. A)o ΔG = ΔG 0 + RTIn —— (a. A)в
 Основные законы и количественные характеристики экстракции ■ Поскольку в условиях равновесия ΔG = 0, получаем (a. A)o —— = e- ΔG 0/RT = Kт. D (a. A)в В реальных условиях, как правило, используют KСD = [A]o/ [A]в, поскольку fi в органической фазе редко известны.
Основные законы и количественные характеристики экстракции ■ Поскольку в условиях равновесия ΔG = 0, получаем (a. A)o —— = e- ΔG 0/RT = Kт. D (a. A)в В реальных условиях, как правило, используют KСD = [A]o/ [A]в, поскольку fi в органической фазе редко известны.
 Основные законы и количественные характеристики экстракции n Если экстрагируемое вещество существует в единственной форме, то константа равновесия может быть записана в виде: KD = Sо/Sв где Si – растворимости вещества
Основные законы и количественные характеристики экстракции n Если экстрагируемое вещество существует в единственной форме, то константа равновесия может быть записана в виде: KD = Sо/Sв где Si – растворимости вещества
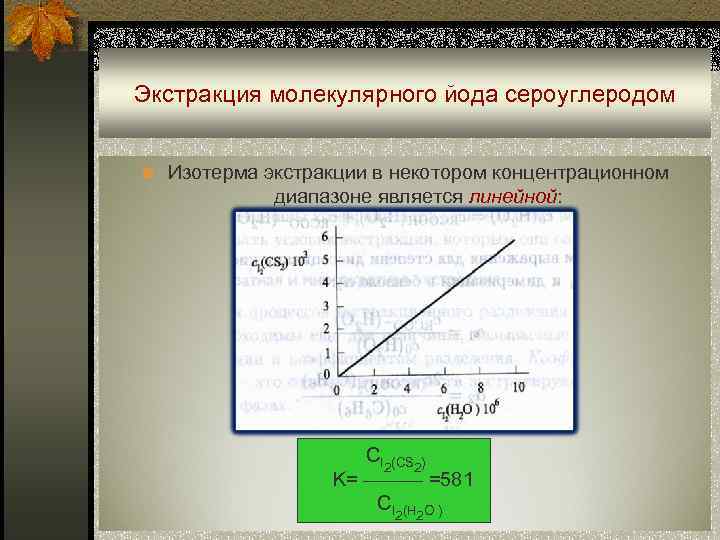
 Экстракция молекулярного йода сероуглеродом n Изотерма экстракции в некотором концентрационном диапазоне является линейной: CI 2(CS 2) K= ——— =581 CI 2(H 2 O )
Экстракция молекулярного йода сероуглеродом n Изотерма экстракции в некотором концентрационном диапазоне является линейной: CI 2(CS 2) K= ——— =581 CI 2(H 2 O )
 Основные законы и количественные характеристики экстракции n Если распределяемое между двумя фазами вещество существует в нескольких формах нахождения, наблюдается отклонение изотермы экстракции от линейной зависимости. В таких случаях используют коэффициент распределения D = Co / Cв – отношение суммарных концентраций всех форм нахождения в двух фазах.
Основные законы и количественные характеристики экстракции n Если распределяемое между двумя фазами вещество существует в нескольких формах нахождения, наблюдается отклонение изотермы экстракции от линейной зависимости. В таких случаях используют коэффициент распределения D = Co / Cв – отношение суммарных концентраций всех форм нахождения в двух фазах.
 Основные количественные характеристики экстракции n Степень извлечения (R, %): Co • Vo D R = —————— 100% Cв • Vв + Co • Vo D + V в / Vo В отличии от D, степень извлечения R зависит от соотношения объемов фаз
Основные количественные характеристики экстракции n Степень извлечения (R, %): Co • Vo D R = —————— 100% Cв • Vв + Co • Vo D + V в / Vo В отличии от D, степень извлечения R зависит от соотношения объемов фаз
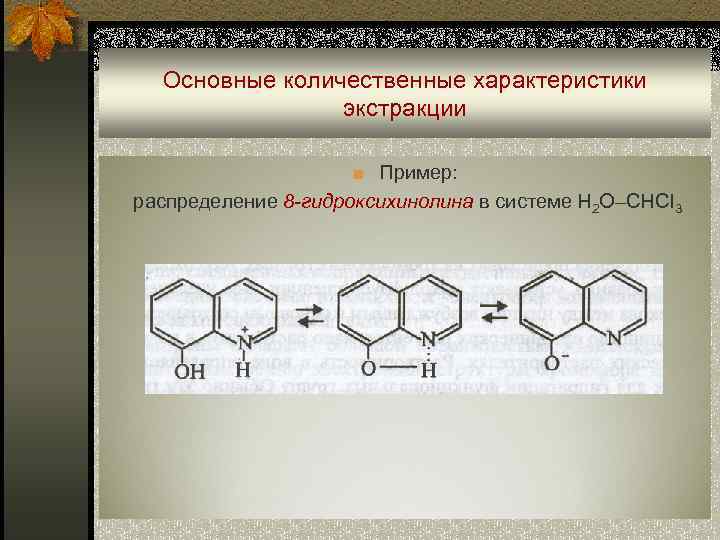
 Основные количественные характеристики экстракции ■ Пример: распределение 8 -гидроксихинолина в системе H 2 O–CHCI 3
Основные количественные характеристики экстракции ■ Пример: распределение 8 -гидроксихинолина в системе H 2 O–CHCI 3
 Основные количественные характеристики экстракции n Пример: распределение 8 -гидроксихинолина в системе H 2 O– CHCI 3 продолжение)
Основные количественные характеристики экстракции n Пример: распределение 8 -гидроксихинолина в системе H 2 O– CHCI 3 продолжение)
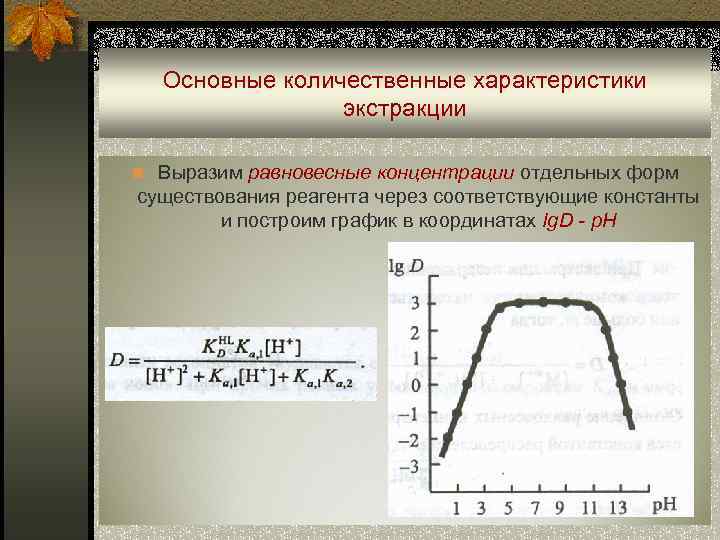
 Основные количественные характеристики экстракции n Выразим равновесные концентрации отдельных форм существования реагента через соответствующие константы и построим график в координатах Ig. D - p. H
Основные количественные характеристики экстракции n Выразим равновесные концентрации отдельных форм существования реагента через соответствующие константы и построим график в координатах Ig. D - p. H
 Основные количественные характеристики экстракции n Если имеют место процессы агрегации или ассоциации:
Основные количественные характеристики экстракции n Если имеют место процессы агрегации или ассоциации:
 Основные количественные характеристики экстракции ■ После преобразования получаем: здесь кривая 1 – D – const; кривая 2 – образование ассоциата в органической фазе; C 1, C 2 – концентрации вещества в органической и водной фазах соответственно; D зависит от [HL] в водной фазе.
Основные количественные характеристики экстракции ■ После преобразования получаем: здесь кривая 1 – D – const; кривая 2 – образование ассоциата в органической фазе; C 1, C 2 – концентрации вещества в органической и водной фазах соответственно; D зависит от [HL] в водной фазе.
 Основные количественные характеристики экстракции n При экстракции комплексов с различным числом лигандов можно использовать следующие уравнения и расчеты:
Основные количественные характеристики экстракции n При экстракции комплексов с различным числом лигандов можно использовать следующие уравнения и расчеты:
 Классификация экстракционных процессов (экстрагенты)
Классификация экстракционных процессов (экстрагенты)
 Классификация экстракционных процессов (экстрагенты) n Реакции основных типов экстрагентов: - кислотные: - основные: - нейтральные:
Классификация экстракционных процессов (экстрагенты) n Реакции основных типов экстрагентов: - кислотные: - основные: - нейтральные:
 Типы и группы экстрагирующихся соединений
Типы и группы экстрагирующихся соединений
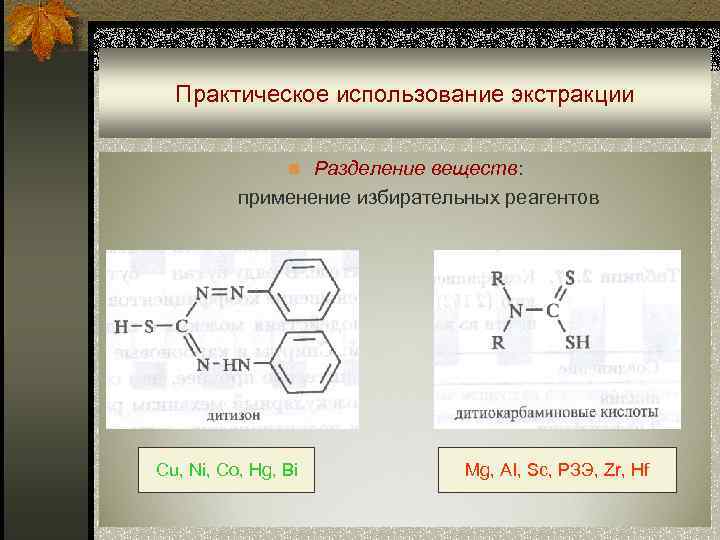
 Практическое использование экстракции n Разделение веществ: применение избирательных реагентов Cu, Ni, Co, Hg, Bi Mg, AI, Sc, РЗЭ, Zr, Hf
Практическое использование экстракции n Разделение веществ: применение избирательных реагентов Cu, Ni, Co, Hg, Bi Mg, AI, Sc, РЗЭ, Zr, Hf
 Практическое использование экстракции n Концентрирование элементов: О-изопропил-N-этилдитиокарбаминат извлекает за одну экстракцию 99, 9 % Ag+ в присутствии ионов AI, As, Ba, Be, Bi, Zn, Cd, Ni, Co, Cr, Cu, Fe, Ga, In, Mn, Pb, Sn, Te, TI, V, Zr
Практическое использование экстракции n Концентрирование элементов: О-изопропил-N-этилдитиокарбаминат извлекает за одну экстракцию 99, 9 % Ag+ в присутствии ионов AI, As, Ba, Be, Bi, Zn, Cd, Ni, Co, Cr, Cu, Fe, Ga, In, Mn, Pb, Sn, Te, TI, V, Zr
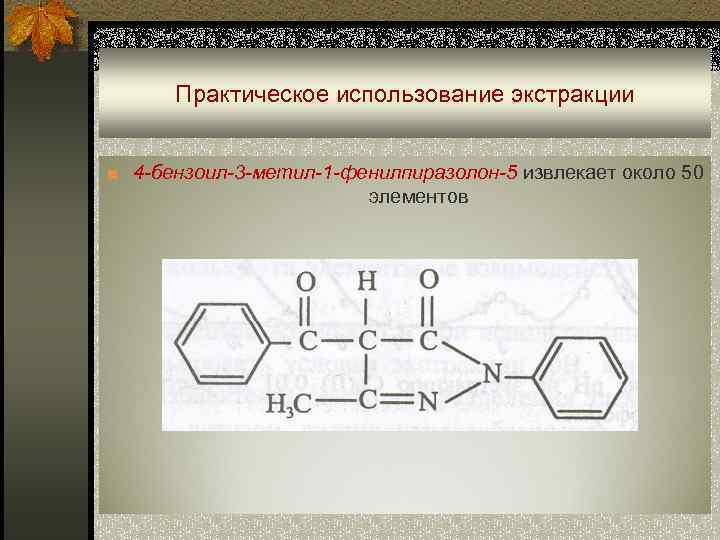
 Практическое использование экстракции ■ 4 -бензоил-3 -метил-1 -фенилпиразолон-5 извлекает около 50 элементов
Практическое использование экстракции ■ 4 -бензоил-3 -метил-1 -фенилпиразолон-5 извлекает около 50 элементов
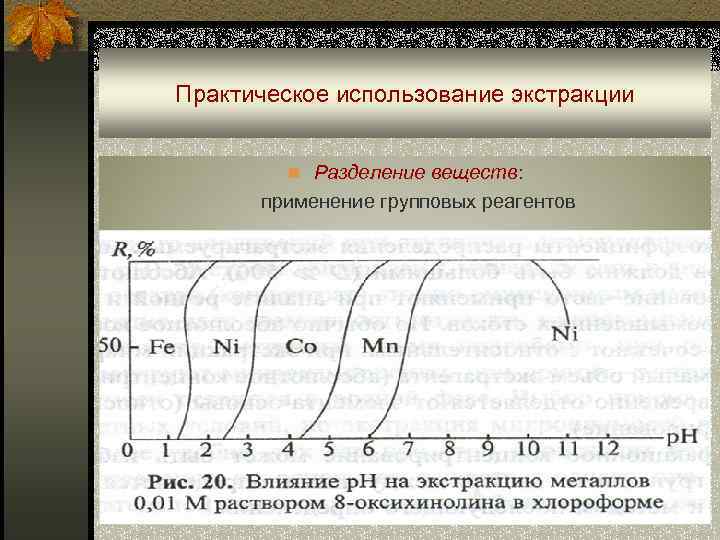
 Практическое использование экстракции n Разделение веществ: применение групповых реагентов
Практическое использование экстракции n Разделение веществ: применение групповых реагентов
 Сорбция n Сорбционные методы разделения и концентрирования основаны на различном поглощении растворенных веществ, газов и паров твердыми или жидкими поглотителями (сорбентами). n Виды сорбции: 1. адсорбция – поглощение вещества поверхностью сорбента 1. 1. физическая (молекулярная) адсорбция - взаимодействие между сорбентом и сорбируемым веществом (сорбатом) обусловлено межмолекулярными силами; 1. 2. хемосорбция – поглощение основано на протекании химических реакций сорбент-сорбат с образованием химических соединений.
Сорбция n Сорбционные методы разделения и концентрирования основаны на различном поглощении растворенных веществ, газов и паров твердыми или жидкими поглотителями (сорбентами). n Виды сорбции: 1. адсорбция – поглощение вещества поверхностью сорбента 1. 1. физическая (молекулярная) адсорбция - взаимодействие между сорбентом и сорбируемым веществом (сорбатом) обусловлено межмолекулярными силами; 1. 2. хемосорбция – поглощение основано на протекании химических реакций сорбент-сорбат с образованием химических соединений.
 Сорбция ■ Виды сорбции (продолжение): 2. абсорбция – поглощение вещества всей массой сорбента. 3. распределение вещества между двумя несмешивающимися фазами (растворитель и жидкая фаза на сорбенте). 4. капиллярная конденсация – образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров вещества. 5. смешанные механизмы (обычно реализуются на практике).
Сорбция ■ Виды сорбции (продолжение): 2. абсорбция – поглощение вещества всей массой сорбента. 3. распределение вещества между двумя несмешивающимися фазами (растворитель и жидкая фаза на сорбенте). 4. капиллярная конденсация – образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров вещества. 5. смешанные механизмы (обычно реализуются на практике).
 Сорбция n Сорбционный процесс в статических условиях описывается функциональными зависимостями типа СS = f(Ci, P), где СS – количество сорбированного вещества; Ci – его концентрация в жидкой (газообразной) или Р – давление в газообразной фазе. n Графические зависимости СS = f(Ci, P) называются изотермами сорбции.
Сорбция n Сорбционный процесс в статических условиях описывается функциональными зависимостями типа СS = f(Ci, P), где СS – количество сорбированного вещества; Ci – его концентрация в жидкой (газообразной) или Р – давление в газообразной фазе. n Графические зависимости СS = f(Ci, P) называются изотермами сорбции.
 Сорбция ■ Основные виды сорбентов: активные угли, синтетические органические ионообменники и хелатообразующее сорбенты, кремнеземы, неорганические сорбенты. n Процесс сорбции осуществляют двумя способами: статическим и динамическим. n Сорбция в динамическом режиме:
Сорбция ■ Основные виды сорбентов: активные угли, синтетические органические ионообменники и хелатообразующее сорбенты, кремнеземы, неорганические сорбенты. n Процесс сорбции осуществляют двумя способами: статическим и динамическим. n Сорбция в динамическом режиме:
 Сорбция на активных углях
Сорбция на активных углях
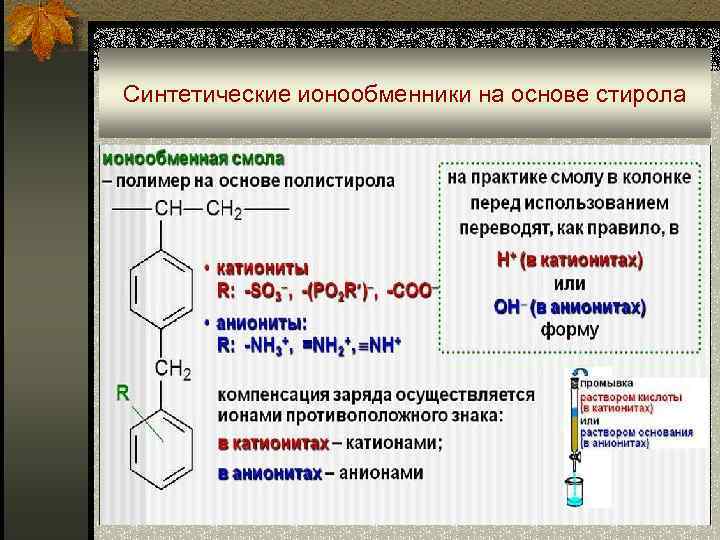
 Синтетические органические ионообменники n Продукты полимеризации и поликонденсации непредельных органических соединений, содержащих кислотные (-SO 3 H, -COOH, -PO 3 H 2 , …) или основные (- N(CH 3)3+, -NH 3+, =NH 2+, …) группы. n Ионообменный процесс можно представить уравнениями:
Синтетические органические ионообменники n Продукты полимеризации и поликонденсации непредельных органических соединений, содержащих кислотные (-SO 3 H, -COOH, -PO 3 H 2 , …) или основные (- N(CH 3)3+, -NH 3+, =NH 2+, …) группы. n Ионообменный процесс можно представить уравнениями:
 Синтетические органические ионообменники
Синтетические органические ионообменники
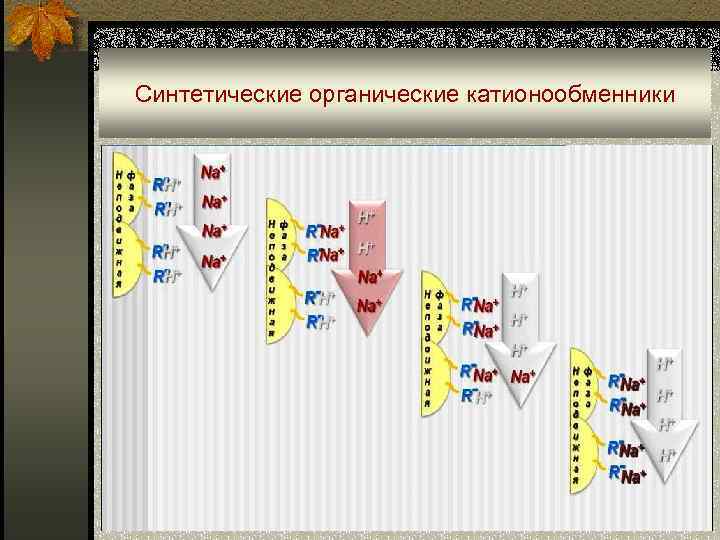
 Синтетические органические катионообменники
Синтетические органические катионообменники
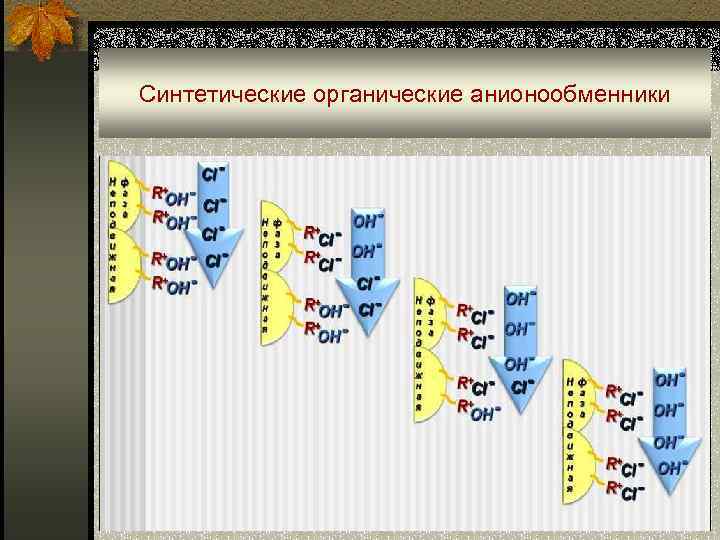
 Синтетические органические анионообменники
Синтетические органические анионообменники
 Синтетические ионообменники на основе стирола
Синтетические ионообменники на основе стирола
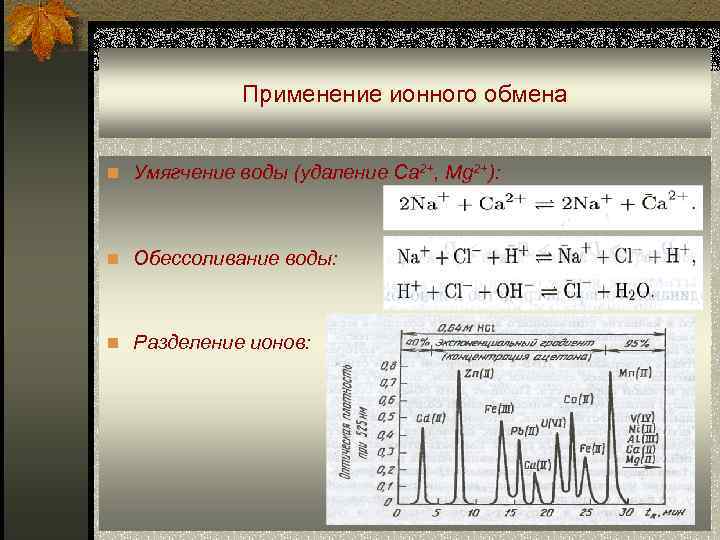
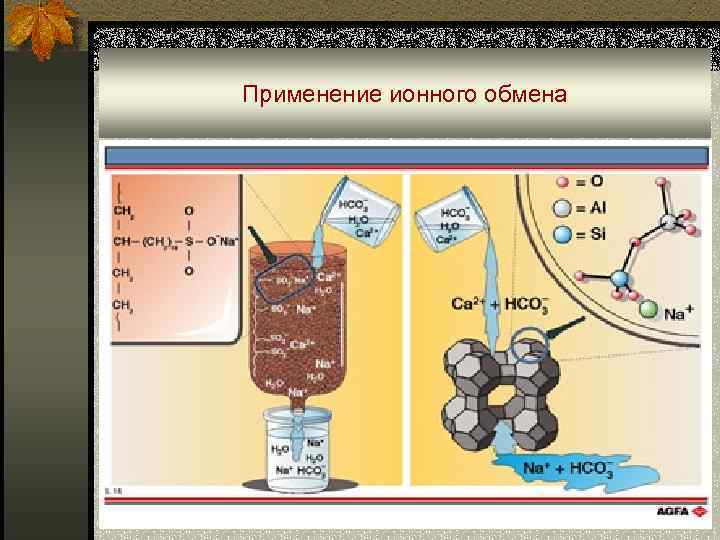
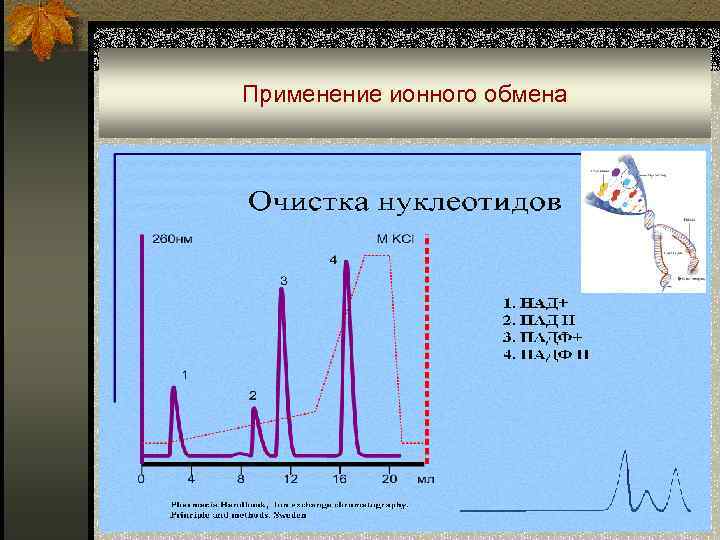
 Применение ионного обмена n Умягчение воды (удаление Ca 2+, Mg 2+): n Обессоливание воды: n Разделение ионов:
Применение ионного обмена n Умягчение воды (удаление Ca 2+, Mg 2+): n Обессоливание воды: n Разделение ионов:
 Применение ионного обмена
Применение ионного обмена
 Применение ионного обмена
Применение ионного обмена
 Применение ионного обмена
Применение ионного обмена
 Хелатообразующие сорбенты
Хелатообразующие сорбенты
 Сорбция на модифицированных сорбентах
Сорбция на модифицированных сорбентах
 Сорбция на модифицированных сорбентах
Сорбция на модифицированных сорбентах
 Кремнеземы n Кремнезем – диоксид кремния (кристаллический, аморфный или гидратированный) с поверхностными группами ≡ Si-OH. n Аморфный кремнезем: - аэросилы – безводные аморфные частицы, получаемые при высокой температуре; - аэросиликагели (силохромы) – однородная форма с удельной поверхностью 70 -150 м 2/г; - силикагели – сухие гели поликремниевой кислоты; - пористые стекла – особая форма аморфного кремнезема.
Кремнеземы n Кремнезем – диоксид кремния (кристаллический, аморфный или гидратированный) с поверхностными группами ≡ Si-OH. n Аморфный кремнезем: - аэросилы – безводные аморфные частицы, получаемые при высокой температуре; - аэросиликагели (силохромы) – однородная форма с удельной поверхностью 70 -150 м 2/г; - силикагели – сухие гели поликремниевой кислоты; - пористые стекла – особая форма аморфного кремнезема.
 Кремнеземы n Химически модифицированные кремнеземы (ХМК) – с химически привитыми молекулами органических соединений:
Кремнеземы n Химически модифицированные кремнеземы (ХМК) – с химически привитыми молекулами органических соединений:
 Определение микроэлементов в биологических объектах
Определение микроэлементов в биологических объектах
 Электрохимические методы разделения n Электролитическое выделение – осаждение вещества электрическим током при контролируемом потенциале: - катодное осаждение (Hg – катод) Fe, Cr, Zn, Ni, Pb, Co, Sn, Mo, Cu, Ag, Cd восстанавливаются до металлического состояния (образуются амальгамы, легко разлагающиеся водой с образованием гидроксидов); AI, Ti, U, Mg, Be, V, Zr, As, P остаются в растворе; - анодное осаждение, например, в форме оксидов Pb. O 2 используют редко.
Электрохимические методы разделения n Электролитическое выделение – осаждение вещества электрическим током при контролируемом потенциале: - катодное осаждение (Hg – катод) Fe, Cr, Zn, Ni, Pb, Co, Sn, Mo, Cu, Ag, Cd восстанавливаются до металлического состояния (образуются амальгамы, легко разлагающиеся водой с образованием гидроксидов); AI, Ti, U, Mg, Be, V, Zr, As, P остаются в растворе; - анодное осаждение, например, в форме оксидов Pb. O 2 используют редко.
 Электрохимические методы разделения n Цементация (внутренний электролиз) – восстановление компонентов на электроотрицательных металлах или их амальгамах; при работе анод окисляется, а высвобождающиеся электроны восстанавливают ионы металла; пример – выделение микроэлементов из воды на металлах - цементаторах AI, Mg, Zn
Электрохимические методы разделения n Цементация (внутренний электролиз) – восстановление компонентов на электроотрицательных металлах или их амальгамах; при работе анод окисляется, а высвобождающиеся электроны восстанавливают ионы металла; пример – выделение микроэлементов из воды на металлах - цементаторах AI, Mg, Zn
 Электрохимические методы разделения
Электрохимические методы разделения
 Электрофорез n Метод основан на различиях в скоростях движения частиц разного заряда, формы и размера в электрическом поле: = z. H/6 r где z – заряд частицы; - ее скорость; H – напряженность электрического поля; r – радиус частицы; - вязкость среды. ■ Обычно используют эффективный радиус частицы r + l (I – толщина гидратной оболочки) и эффективный заряд z* с учетом ионной атмосферы.
Электрофорез n Метод основан на различиях в скоростях движения частиц разного заряда, формы и размера в электрическом поле: = z. H/6 r где z – заряд частицы; - ее скорость; H – напряженность электрического поля; r – радиус частицы; - вязкость среды. ■ Обычно используют эффективный радиус частицы r + l (I – толщина гидратной оболочки) и эффективный заряд z* с учетом ионной атмосферы.
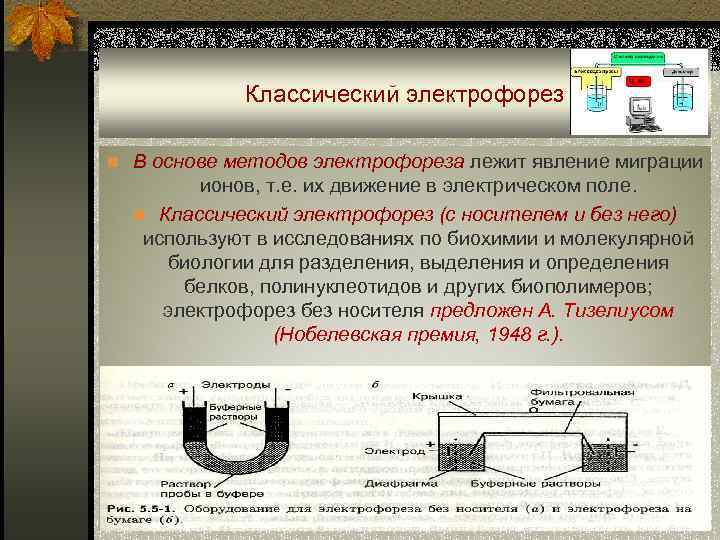
 Классический электрофорез n В основе методов электрофореза лежит явление миграции ионов, т. е. их движение в электрическом поле. n Классический электрофорез (с носителем и без него) используют в исследованиях по биохимии и молекулярной биологии для разделения, выделения и определения белков, полинуклеотидов и других биополимеров; электрофорез без носителя предложен А. Тизелиусом (Нобелевская премия, 1948 г. ).
Классический электрофорез n В основе методов электрофореза лежит явление миграции ионов, т. е. их движение в электрическом поле. n Классический электрофорез (с носителем и без него) используют в исследованиях по биохимии и молекулярной биологии для разделения, выделения и определения белков, полинуклеотидов и других биополимеров; электрофорез без носителя предложен А. Тизелиусом (Нобелевская премия, 1948 г. ).
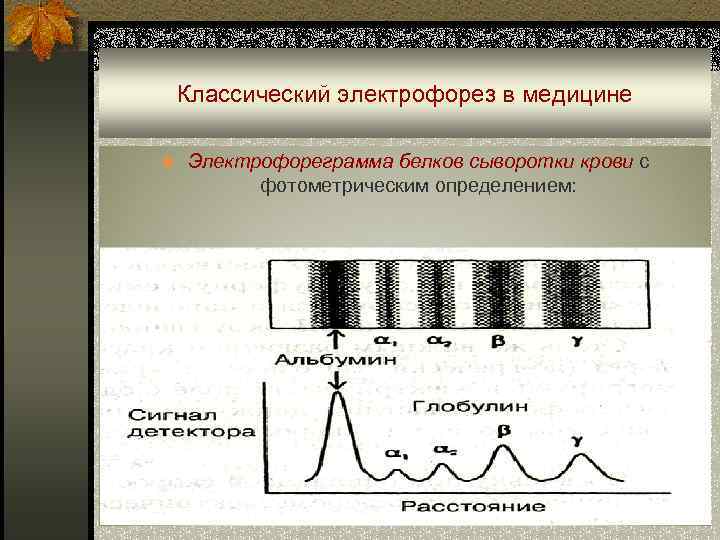
 Классический электрофорез в медицине n Электрофореграмма белков сыворотки крови с фотометрическим определением:
Классический электрофорез в медицине n Электрофореграмма белков сыворотки крови с фотометрическим определением:
 Капиллярный электрофорез n Разделение происходит в капилляре диаметром 25 - 75 мкм и длиной 25 - 100 см, заполненным электролитом. ■ Платиновые электроды присоединены к источнику тока до 250 мк. А при напряжении от 1000 до 30 000 В. ■ Малые объемы ≈1 нл обеспечивают низкие пределы обнаружения. ■ С лазерными детекторами LOD до 10 -21 моль.
Капиллярный электрофорез n Разделение происходит в капилляре диаметром 25 - 75 мкм и длиной 25 - 100 см, заполненным электролитом. ■ Платиновые электроды присоединены к источнику тока до 250 мк. А при напряжении от 1000 до 30 000 В. ■ Малые объемы ≈1 нл обеспечивают низкие пределы обнаружения. ■ С лазерными детекторами LOD до 10 -21 моль.
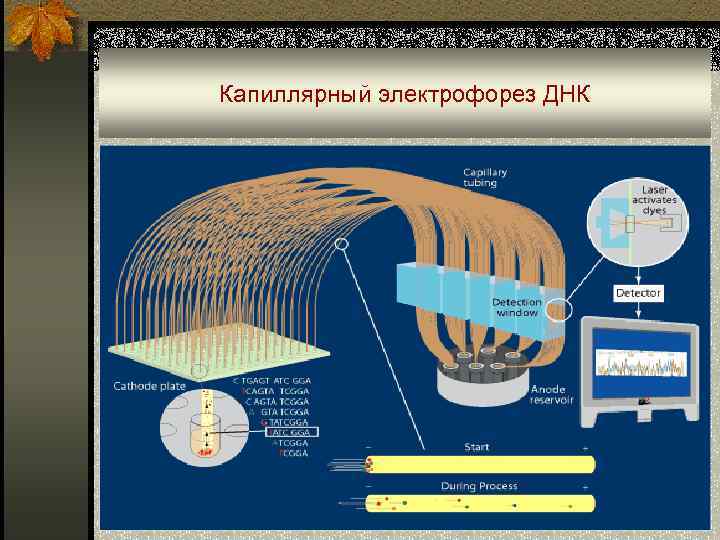
 Капиллярный электрофорез ДНК
Капиллярный электрофорез ДНК
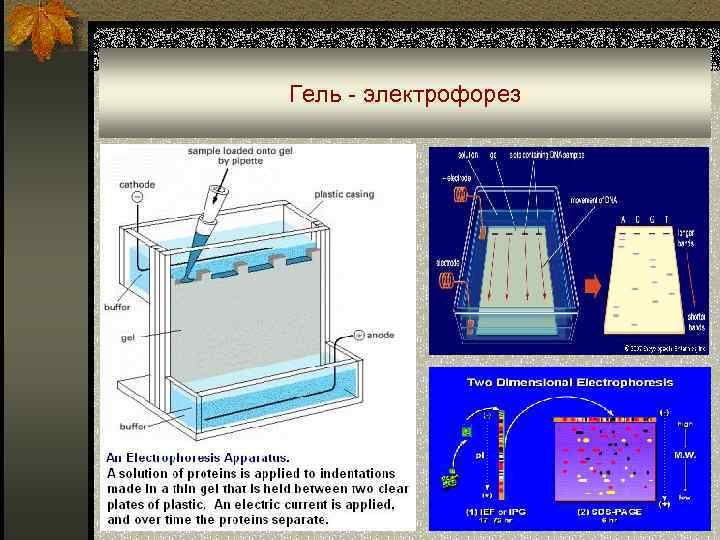
 Гель - электрофорез
Гель - электрофорез
 Диализ n Метод разделения и концентрирования растворенных веществ (значительно различающихся по молекулярным массам, например, биологически активные вещества); основан на различиях в скоростях диффузии веществ через полупроницаемую мембрану (целлюлоза, иониты) между концентрированным и разбавленным растворами; различают электродиализ:
Диализ n Метод разделения и концентрирования растворенных веществ (значительно различающихся по молекулярным массам, например, биологически активные вещества); основан на различиях в скоростях диффузии веществ через полупроницаемую мембрану (целлюлоза, иониты) между концентрированным и разбавленным растворами; различают электродиализ:
 Диализ белков
Диализ белков
 Методы испарения n Дистилляция – разная летучесть веществ; вещество переходит из жидкого состояния в газообразное, а затем при конденсации снова образует жидкую (твердую) фазу. n Простой дистилляцией успешно отделяют As. CI 3, As. Br 3, Os. O 4, Ru. O 4 от многих ионов. n Для разделения многокомпонентных систем используют принцип фракционной дистилляции в ректификационной колонке (противоточное прохождение части конденсата и поднимающихся вверх паров, между которыми происходит интенсивный обмен).
Методы испарения n Дистилляция – разная летучесть веществ; вещество переходит из жидкого состояния в газообразное, а затем при конденсации снова образует жидкую (твердую) фазу. n Простой дистилляцией успешно отделяют As. CI 3, As. Br 3, Os. O 4, Ru. O 4 от многих ионов. n Для разделения многокомпонентных систем используют принцип фракционной дистилляции в ректификационной колонке (противоточное прохождение части конденсата и поднимающихся вверх паров, между которыми происходит интенсивный обмен).
 Отгонка n Простая отгонка – выпаривание, как правило, используют при отделении матрицы: - нагревание с помощью водяной бани; - выпаривание ИК - лампой; - сушка под вакуумом в замороженном состоянии (лиофильная сушка); - сухая и мокрая минерализация (в частности, сжигание органических и биологических проб); используют автоклавы при повышенных температурах и давлении.
Отгонка n Простая отгонка – выпаривание, как правило, используют при отделении матрицы: - нагревание с помощью водяной бани; - выпаривание ИК - лампой; - сушка под вакуумом в замороженном состоянии (лиофильная сушка); - сухая и мокрая минерализация (в частности, сжигание органических и биологических проб); используют автоклавы при повышенных температурах и давлении.
 Отгонка ■ Для перевода компонентов в летучие соединения применяют различные газообразные, жидкие и твердые вещества: F 2, CI 2, Br 2, HCI, HF, CCI 4, BBr 3, AICI 3; используют специальные камеры, в частности, графитовые.
Отгонка ■ Для перевода компонентов в летучие соединения применяют различные газообразные, жидкие и твердые вещества: F 2, CI 2, Br 2, HCI, HF, CCI 4, BBr 3, AICI 3; используют специальные камеры, в частности, графитовые.
 Возгонка (сублимация), химические транспортные реакции n Возгонка (сублимация) - процесс испарения вещества путем непосредственного перехода его из твердого состояния в газообразное (возможна, когда вещество, будучи нагрето до температуры ниже точки его плавления, характеризуется достаточно высоким давлением паров): - пример: атомно-эмиссионное определение 16 микрокомпонентов (Ag, AI, Au, Ca, Cr, Cu, Fe, Mg, Ni, Pb, Sb, Sn, Ni, V, Zn) в йоде после сублимации матрицы при 60 - 65 0 С.
Возгонка (сублимация), химические транспортные реакции n Возгонка (сублимация) - процесс испарения вещества путем непосредственного перехода его из твердого состояния в газообразное (возможна, когда вещество, будучи нагрето до температуры ниже точки его плавления, характеризуется достаточно высоким давлением паров): - пример: атомно-эмиссионное определение 16 микрокомпонентов (Ag, AI, Au, Ca, Cr, Cu, Fe, Mg, Ni, Pb, Sb, Sn, Ni, V, Zn) в йоде после сублимации матрицы при 60 - 65 0 С.
 Кристаллизационные методы n Кристаллизационные методы: - направленная кристаллизация (а) - полное расплавление (в заданном направлении) слитка металла; - зонная плавка (б) - частичное расплавление (перемещение зоны расплава в твердом теле в определенном направлении).
Кристаллизационные методы n Кристаллизационные методы: - направленная кристаллизация (а) - полное расплавление (в заданном направлении) слитка металла; - зонная плавка (б) - частичное расплавление (перемещение зоны расплава в твердом теле в определенном направлении).
 Другие методы разделения и концентрирования n Фильтрация – процесс движения жидкости или газа через пористую среду, сопровождающийся отделением взвешенных частиц; например, примеси (10 -6 - 10 -7 %) As, Co, Cr, Mn, Mo, Ni, Pb, Sn, Sr, Ti, V, Zn, Zr в атмосферной пыли определяют АЭС путем пропускания пробы через фильтр, который анализируют после его озоления. n Диффузия и термодиффузия – для разделения и очистки газообразных веществ используют различия в скоростях диффузии через пористые перегородки: для двух газов 1/ 2 = √M 2 / √M 1. n Разделение и очистка в гравитационном поле – центрифугирование (кристаллизация в центробежном поле).
Другие методы разделения и концентрирования n Фильтрация – процесс движения жидкости или газа через пористую среду, сопровождающийся отделением взвешенных частиц; например, примеси (10 -6 - 10 -7 %) As, Co, Cr, Mn, Mo, Ni, Pb, Sn, Sr, Ti, V, Zn, Zr в атмосферной пыли определяют АЭС путем пропускания пробы через фильтр, который анализируют после его озоления. n Диффузия и термодиффузия – для разделения и очистки газообразных веществ используют различия в скоростях диффузии через пористые перегородки: для двух газов 1/ 2 = √M 2 / √M 1. n Разделение и очистка в гравитационном поле – центрифугирование (кристаллизация в центробежном поле).
 Благодарю за внимание!
Благодарю за внимание!

