1._Строение_атома.pptx
- Количество слайдов: 12
 Строение атома Планетарная модель атома Резерфорда: атом состоит из небольшого массивного и положительно заряженного ядра и электронов. Корпускулярно-волновой дуализм материи состоит в том, что корпускулярные и волновые свойства не исключают друга. Каждый объект может иметь и волновые, и корпускулярные свойства. Луи де Бройль предложил формулу, связывающую волновые и корпускулярные свойства объектов: l = h/(m. V), где h – постоянная Планка, а l - длина волны, которая соответствует каждому телу с массой m и скоростью V. Хотя волновые свойства существуют для всех объектов, но наблюдаться они могут лишь для микрообъектов, имеющих массы порядка массы атома и электрона
Строение атома Планетарная модель атома Резерфорда: атом состоит из небольшого массивного и положительно заряженного ядра и электронов. Корпускулярно-волновой дуализм материи состоит в том, что корпускулярные и волновые свойства не исключают друга. Каждый объект может иметь и волновые, и корпускулярные свойства. Луи де Бройль предложил формулу, связывающую волновые и корпускулярные свойства объектов: l = h/(m. V), где h – постоянная Планка, а l - длина волны, которая соответствует каждому телу с массой m и скоростью V. Хотя волновые свойства существуют для всех объектов, но наблюдаться они могут лишь для микрообъектов, имеющих массы порядка массы атома и электрона
 Строение атома Принцип неопределенности Гейзенберга означает, что нельзя одновременно сколь угодно точно указать положение и скорость частицы. Произведение неопределенностей координаты и скорости частицы всегда больше, чем h/m. Частицы с маленькими массами (атомы, ядра, электроны, молекулы) не являются частицами и не могут изучаться классической физикой. Они изучаются квантовой физикой. Согласно постулатам квантовой физики все свойства атомов (электронов) описываются волновой функцией, которую можно найти, решив волновое уравнение. Квадрат модуля волновой функции имеет смысл плотности вероятности нахождения частиц в данной точке пространства. Волновая функция зависит от параметров - квантовых чисел - n, l, ml и ms.
Строение атома Принцип неопределенности Гейзенберга означает, что нельзя одновременно сколь угодно точно указать положение и скорость частицы. Произведение неопределенностей координаты и скорости частицы всегда больше, чем h/m. Частицы с маленькими массами (атомы, ядра, электроны, молекулы) не являются частицами и не могут изучаться классической физикой. Они изучаются квантовой физикой. Согласно постулатам квантовой физики все свойства атомов (электронов) описываются волновой функцией, которую можно найти, решив волновое уравнение. Квадрат модуля волновой функции имеет смысл плотности вероятности нахождения частиц в данной точке пространства. Волновая функция зависит от параметров - квантовых чисел - n, l, ml и ms.
 Квантовые числа Главное квантовое число - n - принимает значения 1, 2, 3, 4, 5, 6 и 7, соответствующие электронным уровням (слоям) K, L, M, N, O, P и Q. Уровень - пространство, где расположены электроны с одинаковым числом n. Электроны разных уровней пространственно и энергетически отделены друг от друга, поскольку число n определяет энергию электронов Е (чем больше n, тем больше Е) и расстояние R между электронами и ядром (чем больше n, тем больше R).
Квантовые числа Главное квантовое число - n - принимает значения 1, 2, 3, 4, 5, 6 и 7, соответствующие электронным уровням (слоям) K, L, M, N, O, P и Q. Уровень - пространство, где расположены электроны с одинаковым числом n. Электроны разных уровней пространственно и энергетически отделены друг от друга, поскольку число n определяет энергию электронов Е (чем больше n, тем больше Е) и расстояние R между электронами и ядром (чем больше n, тем больше R).
 Квантовые числа Орбитальное квантовое число - l. Число l - принимает значения в зависимости от числа n: l = 0, 1, . . . (n-1). Например, если n = 2, то l = 0, 1; если n = 3, то l = 0, 1, 2. Число l характеризует подуровень (подслой). Подуровень - пространство, где расположены электроны с определенными n и l. Подуровни данного уровня обозначаются в зависимости от числа l: s - если l = 0, p если l = 1, d - если l = 2, f - если l = 3. Подуровни данного атома обозначаются в зависимости от чисел n и l, например, 2 s (n=2, l=0), 3 d (n=3, l=2), 5 f (n=5, l=3) и т. д. Подуровни данного уровня имеют разную энергию (чем больше l, тем больше E): Es
Квантовые числа Орбитальное квантовое число - l. Число l - принимает значения в зависимости от числа n: l = 0, 1, . . . (n-1). Например, если n = 2, то l = 0, 1; если n = 3, то l = 0, 1, 2. Число l характеризует подуровень (подслой). Подуровень - пространство, где расположены электроны с определенными n и l. Подуровни данного уровня обозначаются в зависимости от числа l: s - если l = 0, p если l = 1, d - если l = 2, f - если l = 3. Подуровни данного атома обозначаются в зависимости от чисел n и l, например, 2 s (n=2, l=0), 3 d (n=3, l=2), 5 f (n=5, l=3) и т. д. Подуровни данного уровня имеют разную энергию (чем больше l, тем больше E): Es
 Квантовые числа Магнитное квантовое число - ml - характеризует ориентацию орбитального магнитного момента, равного l, в пространстве относительно внешнего магнитного поля и принимает значения: -l, . . . -1, 0, 1, . . . l. Например, если l = 2, то ml = -2, -1, 0, 1, 2. Орбиталь (часть подуровня) - это пространство, где расположены электроны с определенными n, l, ml. Подуровень содержит 2 l + 1 орбиталь. Например, dподуровень содержит пять d-орбиталей. Орбитали одного подуровня, имеющие разные числа ml, имеют одинаковую энергию. Магнитное спиновое число - ms - характеризует ориентацию собственного магнитного момента электрона s, равного 1/2, относительно внешнего магнитного поля и принимает два значению: +1/2 и -1/2.
Квантовые числа Магнитное квантовое число - ml - характеризует ориентацию орбитального магнитного момента, равного l, в пространстве относительно внешнего магнитного поля и принимает значения: -l, . . . -1, 0, 1, . . . l. Например, если l = 2, то ml = -2, -1, 0, 1, 2. Орбиталь (часть подуровня) - это пространство, где расположены электроны с определенными n, l, ml. Подуровень содержит 2 l + 1 орбиталь. Например, dподуровень содержит пять d-орбиталей. Орбитали одного подуровня, имеющие разные числа ml, имеют одинаковую энергию. Магнитное спиновое число - ms - характеризует ориентацию собственного магнитного момента электрона s, равного 1/2, относительно внешнего магнитного поля и принимает два значению: +1/2 и -1/2.
 Правила заполнения Правило Паули. В одном атоме два электрона не могут иметь четыре одинаковых квантовых числа Правило наименьшей энергии. Последовательное заполнение уровней, подуровней и орбиталей должно происходить так, чтобы обеспечить минимальную энергию атома Правило Клечковского. Заполнение электронных подуровней осуществляется в порядке возрастания суммы (n + l), а в случае одинаковой суммы (n + l) - в порядке возрастания числа n Правило Гунда. Заполнение орбиталей данного подуровня осуществляется так, чтобы суммарный спин был максимален. Орбитали данного подуровня заполняются сначала по одному электрону
Правила заполнения Правило Паули. В одном атоме два электрона не могут иметь четыре одинаковых квантовых числа Правило наименьшей энергии. Последовательное заполнение уровней, подуровней и орбиталей должно происходить так, чтобы обеспечить минимальную энергию атома Правило Клечковского. Заполнение электронных подуровней осуществляется в порядке возрастания суммы (n + l), а в случае одинаковой суммы (n + l) - в порядке возрастания числа n Правило Гунда. Заполнение орбиталей данного подуровня осуществляется так, чтобы суммарный спин был максимален. Орбитали данного подуровня заполняются сначала по одному электрону
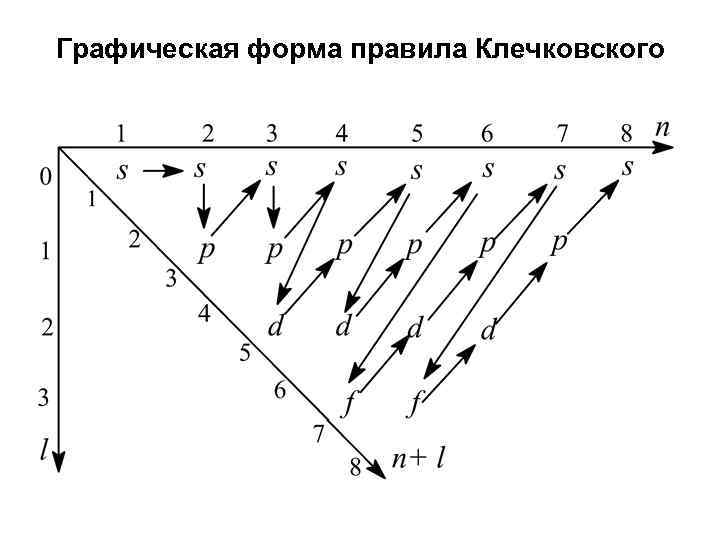 Графическая форма правила Клечковского
Графическая форма правила Клечковского
 Электронные формулы Подуровни заполняются электронами в следующем порядке: 1 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s и т. д. Подуровни записываются в электронной формуле последовательно по уровням: 1 s, 2 p, 3 s, 3 p, 3 d, 4 s, 4 p, 4 d, 4 f и т. д. Электронные конфигурации атомов можно записать по уровням, подуровням, орбиталям. Электронная формула Р(15ē) может быть записана: а) по уровням )2 )8 )5 б) по подуровням 1 s 2 2 p 6 3 s 2 3 p 3 в) по орбиталям 1 s 2 2 px 2 2 py 2 2 pz 2 3 s 2 3 px 1 3 py 1 3 pz 1
Электронные формулы Подуровни заполняются электронами в следующем порядке: 1 s, 2 p, 3 s, 3 p, 4 s, 3 d, 4 p, 5 s и т. д. Подуровни записываются в электронной формуле последовательно по уровням: 1 s, 2 p, 3 s, 3 p, 3 d, 4 s, 4 p, 4 d, 4 f и т. д. Электронные конфигурации атомов можно записать по уровням, подуровням, орбиталям. Электронная формула Р(15ē) может быть записана: а) по уровням )2 )8 )5 б) по подуровням 1 s 2 2 p 6 3 s 2 3 p 3 в) по орбиталям 1 s 2 2 px 2 2 py 2 2 pz 2 3 s 2 3 px 1 3 py 1 3 pz 1
 Электронные формулы атомов и ионов • • • V(23ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 3 4 s 2 V 3+(20ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 2 4 s 0 Fe(26ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2 Fe 3+(23ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 0 As(33ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 3 As 3 -(36ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 Исключения из правила Клечковского • Cr(24ē) • Cu(29ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1
Электронные формулы атомов и ионов • • • V(23ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 3 4 s 2 V 3+(20ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 2 4 s 0 Fe(26ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 6 4 s 2 Fe 3+(23ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 0 As(33ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 3 As 3 -(36ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 Исключения из правила Клечковского • Cr(24ē) • Cu(29ē) 1 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1
 Периодический закон (Д. И. Менделеев, 1869 г. ): свойства элементов и их соединений находятся в периодической зависимости от величины зарядов ядер их атомов Порядковый номер элемента равен числу протонов и числу электронов в атоме Номер периода равен числу электронных уровней в атомах элементов этого периода Номер группы равен числу электронов на внешних уровнях атомов элементов данной группы, равен максимальной степени окисления элементов данной группы Элементы можно разделить на четыре типа: s-, p-, d-, f-элементы, в зависимости от заполнения в них s-, p-, d-, f- подуровней соответственно
Периодический закон (Д. И. Менделеев, 1869 г. ): свойства элементов и их соединений находятся в периодической зависимости от величины зарядов ядер их атомов Порядковый номер элемента равен числу протонов и числу электронов в атоме Номер периода равен числу электронных уровней в атомах элементов этого периода Номер группы равен числу электронов на внешних уровнях атомов элементов данной группы, равен максимальной степени окисления элементов данной группы Элементы можно разделить на четыре типа: s-, p-, d-, f-элементы, в зависимости от заполнения в них s-, p-, d-, f- подуровней соответственно
 Периодическая система Эффективные атомные радиусы R уменьшаются в периодах и увеличиваются в группах. Металлические свойства (способность отдавать электроны) уменьшаются в периодах и увеличиваются в группах. Неметаллические свойства (способность принимать электроны) увеличиваются в периодах и уменьшаются в группах. Энергия ионизации - уменьшается в группах и увеличивается в периодах. Энергия сродства к электрону уменьшается в группах и увеличивается в периодах. Электроотрицательность уменьшается в группах и увеличивается в периодах.
Периодическая система Эффективные атомные радиусы R уменьшаются в периодах и увеличиваются в группах. Металлические свойства (способность отдавать электроны) уменьшаются в периодах и увеличиваются в группах. Неметаллические свойства (способность принимать электроны) увеличиваются в периодах и уменьшаются в группах. Энергия ионизации - уменьшается в группах и увеличивается в периодах. Энергия сродства к электрону уменьшается в группах и увеличивается в периодах. Электроотрицательность уменьшается в группах и увеличивается в периодах.
 Эффективные атомные радиусы R уменьшаются в периодах и увеличиваются в группах. Металлические свойства (способность отдавать электроны) уменьшаются в периодах и увеличиваются в группах. Неметаллические свойства (способность принимать электроны) увеличиваются в периодах и уменьшаются в группах. Энергия ионизации - это энергия необходимая для отрыва электрона от атома. Энергия ионизации уменьшается в группах и увеличивается в периодах: Энергия сродства к электрону - это энергия, которая выделяется присоединении электрона к атому. Электроотрицательность (способность атома в молекуле притягивать к себе электроны) - увеличивается в периодах и уменьшается в группах.
Эффективные атомные радиусы R уменьшаются в периодах и увеличиваются в группах. Металлические свойства (способность отдавать электроны) уменьшаются в периодах и увеличиваются в группах. Неметаллические свойства (способность принимать электроны) увеличиваются в периодах и уменьшаются в группах. Энергия ионизации - это энергия необходимая для отрыва электрона от атома. Энергия ионизации уменьшается в группах и увеличивается в периодах: Энергия сродства к электрону - это энергия, которая выделяется присоединении электрона к атому. Электроотрицательность (способность атома в молекуле притягивать к себе электроны) - увеличивается в периодах и уменьшается в группах.
