Строение атома Электронная оболочка — область пространства





2_urok.pptx
- Размер: 892.2 Кб
- Автор: Степан Киселёв
- Количество слайдов: 19
Описание презентации Строение атома Электронная оболочка — область пространства по слайдам
 Строение атома
Строение атома
 Электронная оболочка — область пространства вероятного местонахождения электронов. Z = кол-во p = кол-во e —
Электронная оболочка — область пространства вероятного местонахождения электронов. Z = кол-во p = кол-во e —
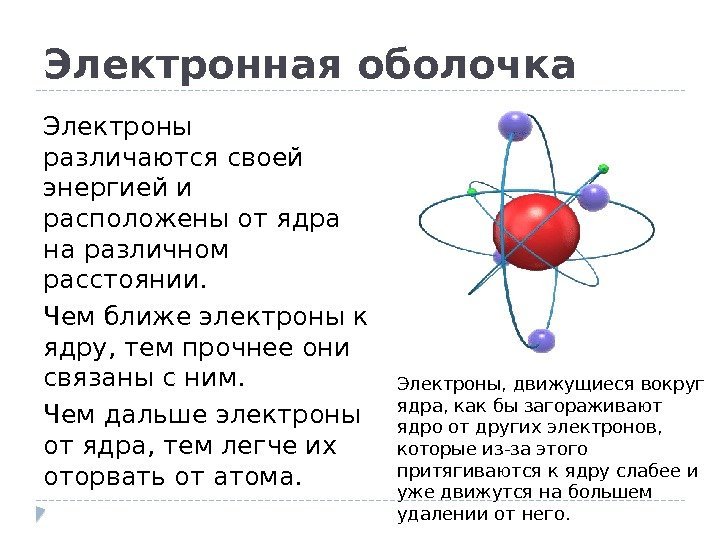
 Электронная оболочка Электроны различаются своей энергией и расположены от ядра на различном расстоянии. Чем ближе электроны к ядру, тем прочнее они связаны с ним. Чем дальше электроны от ядра, тем легче их оторвать от атома. Электроны, движущиеся вокруг ядра, как бы загораживают ядро от других электронов, которые из-за этого притягиваются к ядру слабее и уже движутся на большем удалении от него.
Электронная оболочка Электроны различаются своей энергией и расположены от ядра на различном расстоянии. Чем ближе электроны к ядру, тем прочнее они связаны с ним. Чем дальше электроны от ядра, тем легче их оторвать от атома. Электроны, движущиеся вокруг ядра, как бы загораживают ядро от других электронов, которые из-за этого притягиваются к ядру слабее и уже движутся на большем удалении от него.
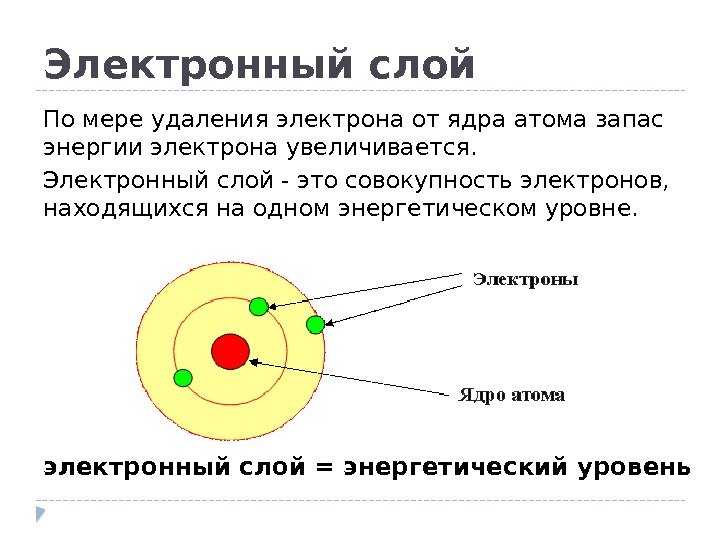
 Электронный слой По мере удаления электрона от ядра атома запас энергии электрона увеличивается. Электронный слой — это совокупность электронов, находящихся на одном энергетическом уровне. электронный слой = энергетический уровень
Электронный слой По мере удаления электрона от ядра атома запас энергии электрона увеличивается. Электронный слой — это совокупность электронов, находящихся на одном энергетическом уровне. электронный слой = энергетический уровень
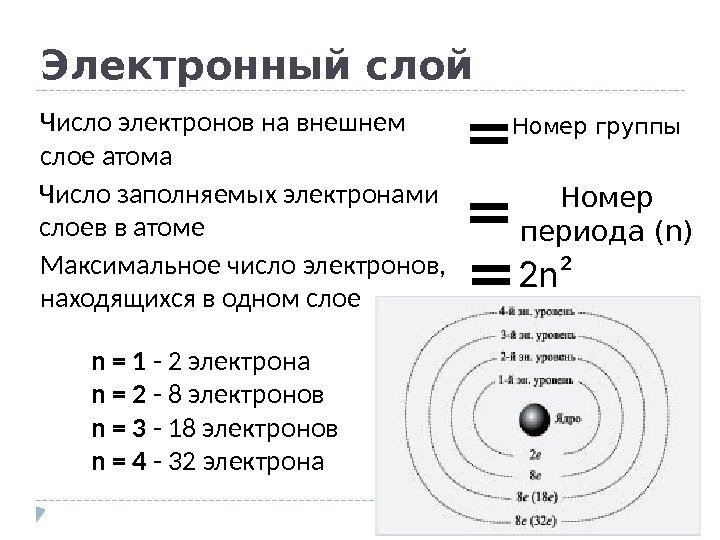
 Электронный слой Число заполняемых электронами слоев в атоме Номер периода (n)= Максимальное число электронов, находящихся в одном слое = 2 n² n = 1 — 2 электрона n = 2 — 8 электронов n = 3 — 18 электронов n = 4 — 32 электрона. Число электронов на внешнем слое атома = Номер группы
Электронный слой Число заполняемых электронами слоев в атоме Номер периода (n)= Максимальное число электронов, находящихся в одном слое = 2 n² n = 1 — 2 электрона n = 2 — 8 электронов n = 3 — 18 электронов n = 4 — 32 электрона. Число электронов на внешнем слое атома = Номер группы
 Распределение электронов по электронным уровням Н + 1 Не + 2 Li + 3 + 4 Be B + 5 C + 6 N + 7 O + 8 F + 9 N e + 10 N aa +
Распределение электронов по электронным уровням Н + 1 Не + 2 Li + 3 + 4 Be B + 5 C + 6 N + 7 O + 8 F + 9 N e + 10 N aa +
 Схема распределения электронов в атоме ₊₁ H⁰)₁ ₊₂ He⁰)₂ ₊₃ Li⁰)₂)₁ ₊₄ Be⁰)₂)₂ ₊₅ B⁰)₂)₃ ₊₆ C⁰)₂)₄ ₊₇ N⁰)₂)₅ ₊₈ O⁰)₂)₆ ₊₉ F⁰)₂)₇ ₊₁₀ Ne⁰)₂)₈ ₊₁₁ Na⁰)₂)₈)₁ ₊₁₂ Mg⁰)₂)₈)₂ … ₊₁₇ Cl⁰)₂)₈)₇ ₊₁₈ Ar⁰)₂)₈)₈
Схема распределения электронов в атоме ₊₁ H⁰)₁ ₊₂ He⁰)₂ ₊₃ Li⁰)₂)₁ ₊₄ Be⁰)₂)₂ ₊₅ B⁰)₂)₃ ₊₆ C⁰)₂)₄ ₊₇ N⁰)₂)₅ ₊₈ O⁰)₂)₆ ₊₉ F⁰)₂)₇ ₊₁₀ Ne⁰)₂)₈ ₊₁₁ Na⁰)₂)₈)₁ ₊₁₂ Mg⁰)₂)₈)₂ … ₊₁₇ Cl⁰)₂)₈)₇ ₊₁₈ Ar⁰)₂)₈)₈
 Внешние и валентные электроны Внешние электроны принимают участие в образовании связи в первую очередь, т. к. при сближении атомов их электронные облака приходят в соприкосновение прежде всего. Но участие в образовании связи могут принимать и часть электронов предвнешнего (предпоследнего) слоя, в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов. И те и другие электроны атома являются валентными. Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни. Внешние электроны – электроны внешнего электронного слоя. Валентные электроны – электроны, которые могут принимать участие в образовании атомом химических связей. Н Е П У ТА ТЬ
Внешние и валентные электроны Внешние электроны принимают участие в образовании связи в первую очередь, т. к. при сближении атомов их электронные облака приходят в соприкосновение прежде всего. Но участие в образовании связи могут принимать и часть электронов предвнешнего (предпоследнего) слоя, в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов. И те и другие электроны атома являются валентными. Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни. Внешние электроны – электроны внешнего электронного слоя. Валентные электроны – электроны, которые могут принимать участие в образовании атомом химических связей. Н Е П У ТА ТЬ
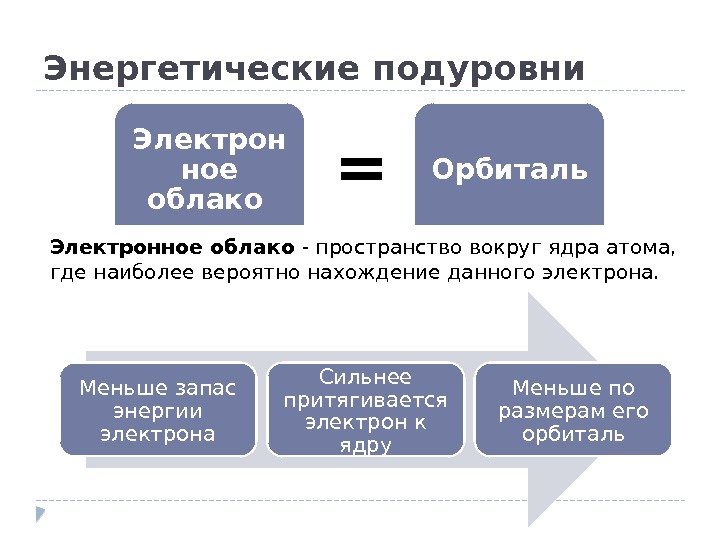
 Энергетические подуровни Электронное облако — пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона. Меньше запас энергии электрона Сильнее притягивается электрон к ядру Меньше по размерам его орбиталь. Электрон ное облако Орбиталь =
Энергетические подуровни Электронное облако — пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона. Меньше запас энергии электрона Сильнее притягивается электрон к ядру Меньше по размерам его орбиталь. Электрон ное облако Орбиталь =
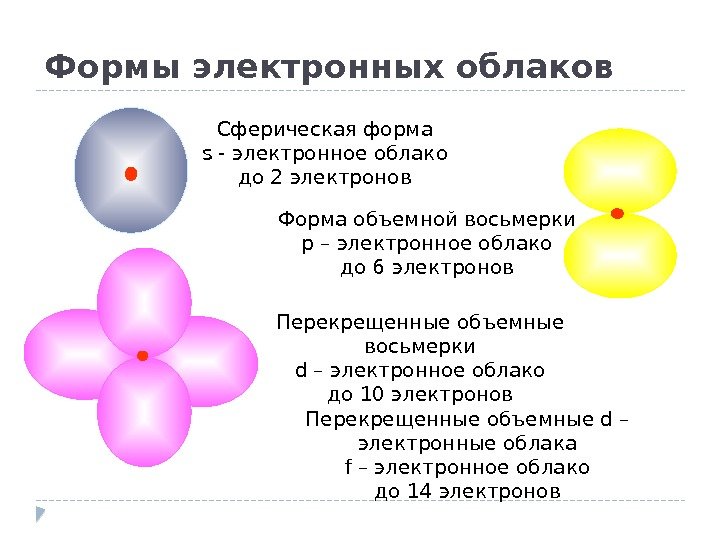
 Формы электронных облаков Сферическая форма s — электронное облако до 2 электронов Форма объемной восьмерки p – электронное облако до 6 электронов Перекрещенные объемные восьмерки d – электронное облако до 10 электронов Перекрещенные объемные d – электронные облака f – электронное облако до 14 электронов
Формы электронных облаков Сферическая форма s — электронное облако до 2 электронов Форма объемной восьмерки p – электронное облако до 6 электронов Перекрещенные объемные восьмерки d – электронное облако до 10 электронов Перекрещенные объемные d – электронные облака f – электронное облако до 14 электронов
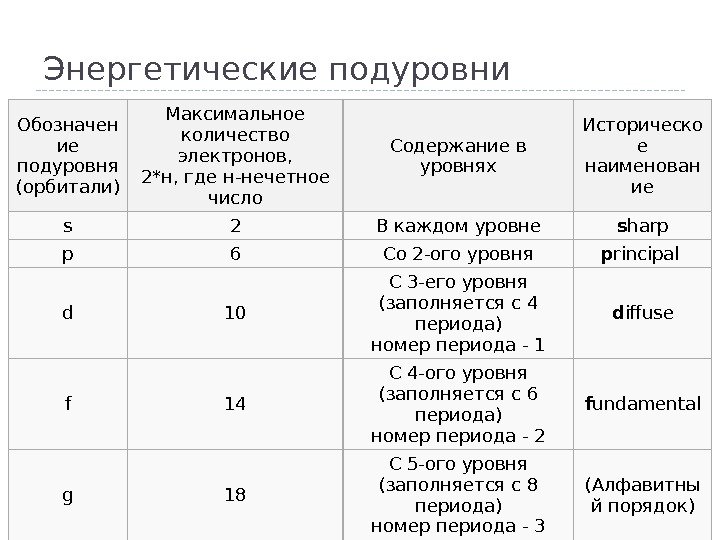
 Энергетические подуровни Обозначен ие подуровня (орбитали) Максимальное количество электронов, 2*н, где н-нечетное число Содержание в уровнях Историческо е наименован ие s 2 В каждом уровне s harp p 6 Со 2 -ого уровня p rincipal d 10 С 3 -его уровня (заполняется с 4 периода) номер периода — 1 d iffuse f 14 С 4 -ого уровня (заполняется с 6 периода) номер периода — 2 f undamental g 18 С 5 -ого уровня (заполняется с 8 периода) номер периода — 3 (Алфавитны й порядок)
Энергетические подуровни Обозначен ие подуровня (орбитали) Максимальное количество электронов, 2*н, где н-нечетное число Содержание в уровнях Историческо е наименован ие s 2 В каждом уровне s harp p 6 Со 2 -ого уровня p rincipal d 10 С 3 -его уровня (заполняется с 4 периода) номер периода — 1 d iffuse f 14 С 4 -ого уровня (заполняется с 6 периода) номер периода — 2 f undamental g 18 С 5 -ого уровня (заполняется с 8 периода) номер периода — 3 (Алфавитны й порядок)
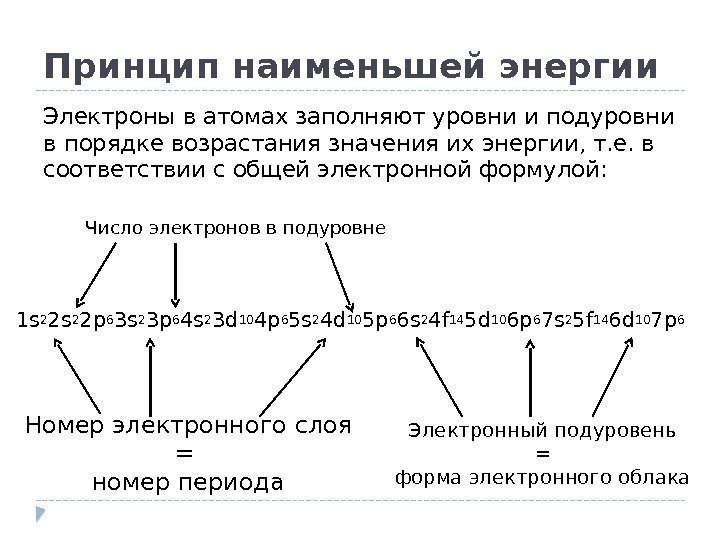
 Принцип наименьшей энергии Электроны в атомах заполняют уровни и подуровни в порядке возрастания значения их энергии, т. е. в соответствии с общей электронной формулой: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 6 Номер электронного слоя = номер периода Электронный подуровень = форма электронного облака. Число электронов в подуровне
Принцип наименьшей энергии Электроны в атомах заполняют уровни и подуровни в порядке возрастания значения их энергии, т. е. в соответствии с общей электронной формулой: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 7 p 6 Номер электронного слоя = номер периода Электронный подуровень = форма электронного облака. Число электронов в подуровне
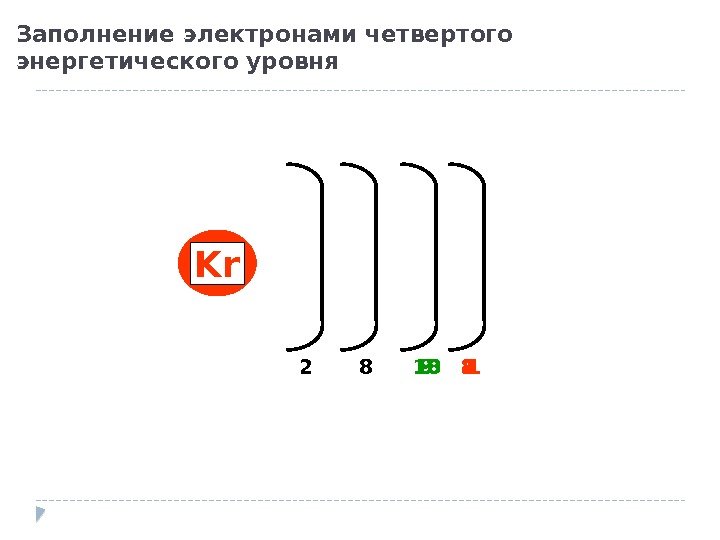
 Заполнение электронами четвертого энергетического уровня 2 8 8 1 KCa Sc Ti 2910 Zn 18 Ga 3 Ge 4 Kr
Заполнение электронами четвертого энергетического уровня 2 8 8 1 KCa Sc Ti 2910 Zn 18 Ga 3 Ge 4 Kr
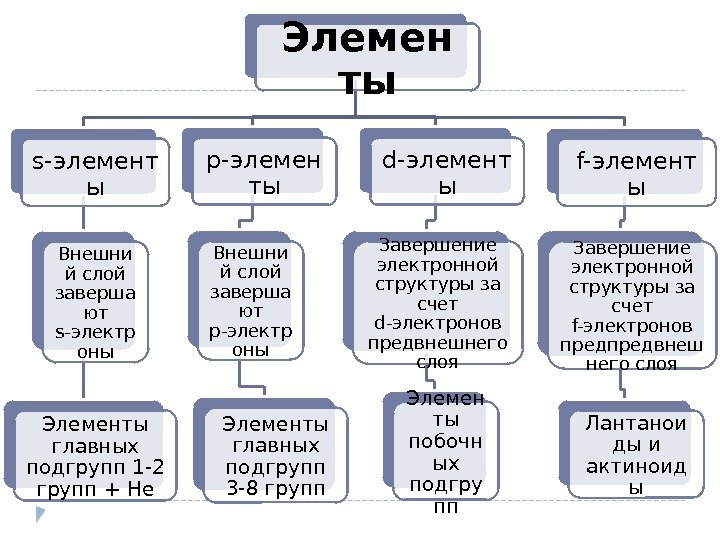
 Элемен ты s-элемент ы Внешни й слой заверша ют s-электр оны Элементы главных подгрупп 1 -2 групп + He p-элемен ты Внешни й слой заверша ют p-электр оны Элементы главных подгрупп 3 -8 групп d-элемент ы Завершение электронной структуры за счет d-электронов предвнешнего слоя Элемен ты побочн ых подгру пп f-элемент ы Завершение электронной структуры за счет f-электронов предвнеш него слоя Лантанои ды и актиноид ы
Элемен ты s-элемент ы Внешни й слой заверша ют s-электр оны Элементы главных подгрупп 1 -2 групп + He p-элемен ты Внешни й слой заверша ют p-электр оны Элементы главных подгрупп 3 -8 групп d-элемент ы Завершение электронной структуры за счет d-электронов предвнешнего слоя Элемен ты побочн ых подгру пп f-элемент ы Завершение электронной структуры за счет f-электронов предвнеш него слоя Лантанои ды и актиноид ы
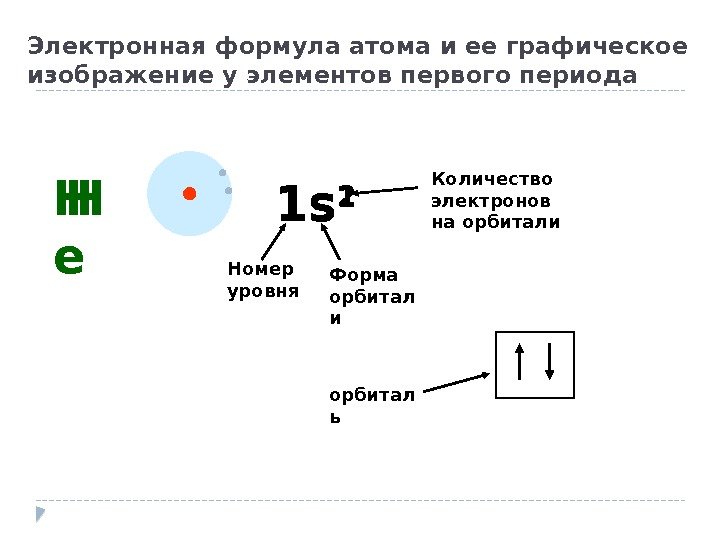
 Электронная формула атома и ее графическое изображение у элементов первого периода Н 1 s 1 Номер уровня Форма орбитал и Количество электронов на орбитали. Н е 1 s 2 орбитал ь
Электронная формула атома и ее графическое изображение у элементов первого периода Н 1 s 1 Номер уровня Форма орбитал и Количество электронов на орбитали. Н е 1 s 2 орбитал ь
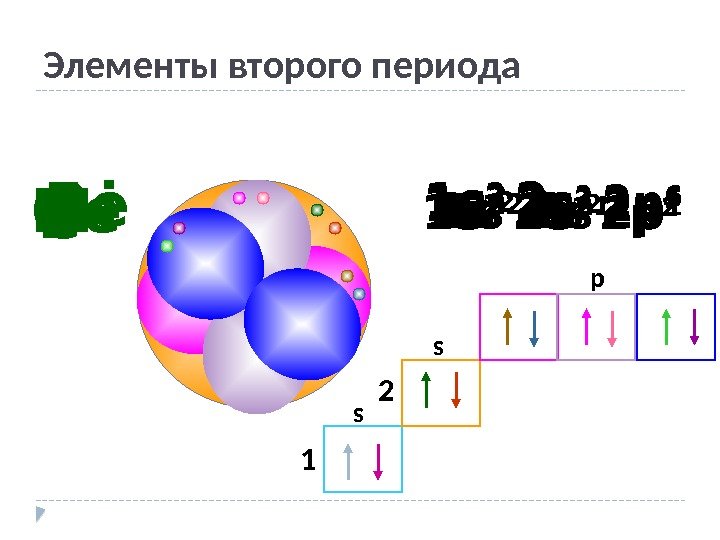
 Элементы второго периода Li 1 s 2 2 s 1 Be 1 s 2 2 s 2 B 1 s 2 2 p 1 C 1 s 2 2 p 2 N 1 s 2 2 p 3 O 1 s 2 2 p 4 F 1 s 2 2 p 5 Ne 1 s 2 2 p 6 1 s p s
Элементы второго периода Li 1 s 2 2 s 1 Be 1 s 2 2 s 2 B 1 s 2 2 p 1 C 1 s 2 2 p 2 N 1 s 2 2 p 3 O 1 s 2 2 p 4 F 1 s 2 2 p 5 Ne 1 s 2 2 p 6 1 s p s
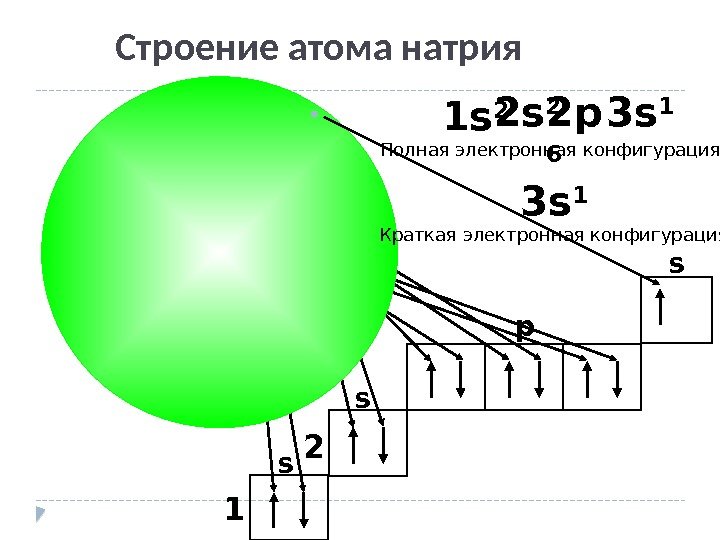
 Na. Строение атома натрия 1 2 s s p s 2 s 2 2 p 6 3 s 1 1 s 2 Полная электронная конфигурация 3 s 1 Краткая электронная конфигурация
Na. Строение атома натрия 1 2 s s p s 2 s 2 2 p 6 3 s 1 1 s 2 Полная электронная конфигурация 3 s 1 Краткая электронная конфигурация
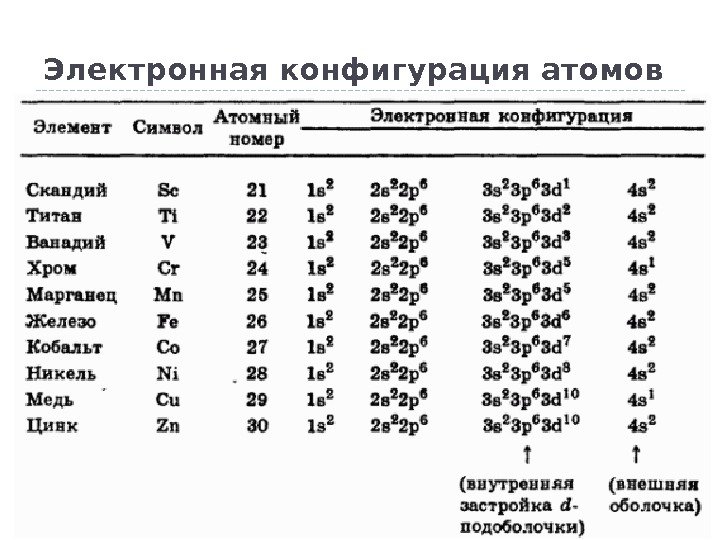
 Электронная конфигурация атомов
Электронная конфигурация атомов
 Электронная конфигурация атомов
Электронная конфигурация атомов
