строение атома.pptx
- Количество слайдов: 9
 Строение атома 1. Основы квантовой теории 2. Квантовые числа 3. Принцип минимальной энергии 4. Правило Клечковского 5. Принцип Паули 6. Правило Гунда
Строение атома 1. Основы квантовой теории 2. Квантовые числа 3. Принцип минимальной энергии 4. Правило Клечковского 5. Принцип Паули 6. Правило Гунда
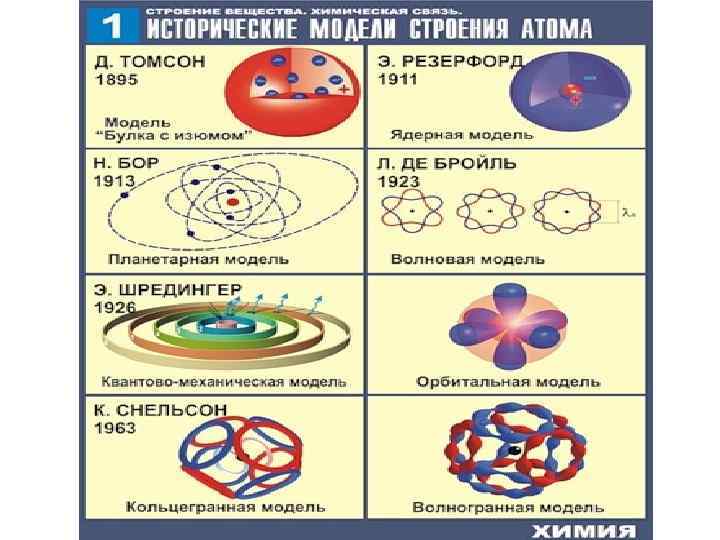
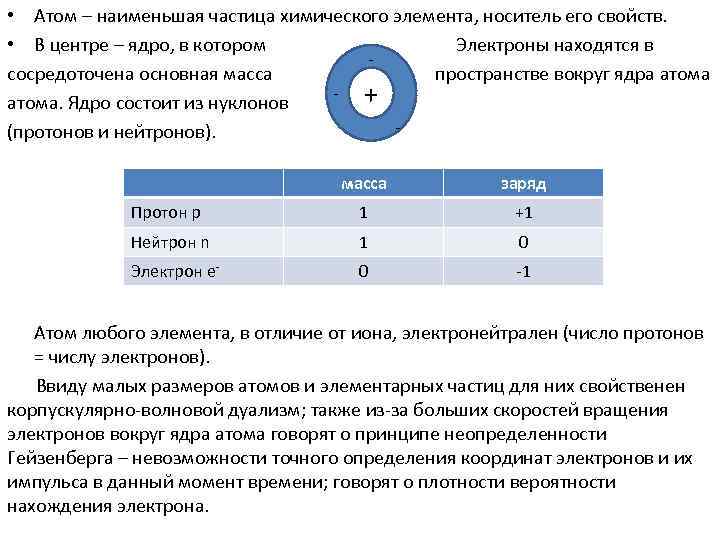 • Атом – наименьшая частица химического элемента, носитель его свойств. • В центре – ядро, в котором Электроны находятся в сосредоточена основная масса пространстве вокруг ядра атома - + атома. Ядро состоит из нуклонов (протонов и нейтронов). масса заряд Протон р 1 +1 Нейтрон n 1 0 Электрон е- 0 -1 Атом любого элемента, в отличие от иона, электронейтрален (число протонов = числу электронов). Ввиду малых размеров атомов и элементарных частиц для них свойственен корпускулярно-волновой дуализм; также из-за больших скоростей вращения электронов вокруг ядра атома говорят о принципе неопределенности Гейзенберга – невозможности точного определения координат электронов и их импульса в данный момент времени; говорят о плотности вероятности нахождения электрона.
• Атом – наименьшая частица химического элемента, носитель его свойств. • В центре – ядро, в котором Электроны находятся в сосредоточена основная масса пространстве вокруг ядра атома - + атома. Ядро состоит из нуклонов (протонов и нейтронов). масса заряд Протон р 1 +1 Нейтрон n 1 0 Электрон е- 0 -1 Атом любого элемента, в отличие от иона, электронейтрален (число протонов = числу электронов). Ввиду малых размеров атомов и элементарных частиц для них свойственен корпускулярно-волновой дуализм; также из-за больших скоростей вращения электронов вокруг ядра атома говорят о принципе неопределенности Гейзенберга – невозможности точного определения координат электронов и их импульса в данный момент времени; говорят о плотности вероятности нахождения электрона.
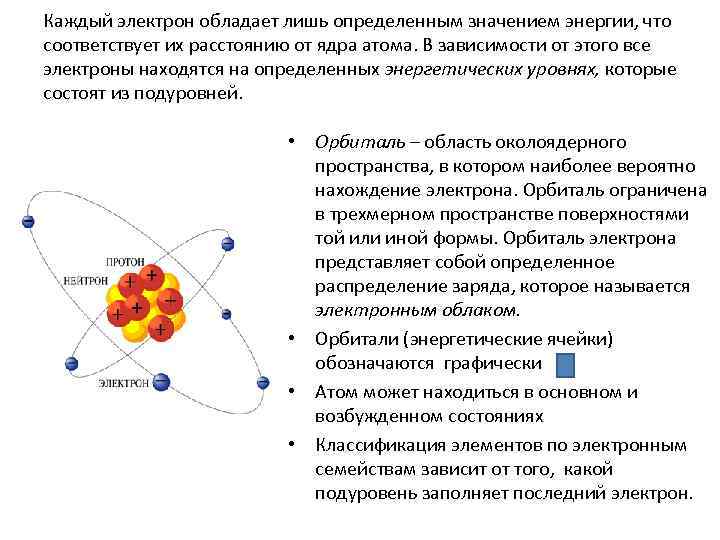 Каждый электрон обладает лишь определенным значением энергии, что соответствует их расстоянию от ядра атома. В зависимости от этого все электроны находятся на определенных энергетических уровнях, которые состоят из подуровней. • Орбиталь – область околоядерного пространства, в котором наиболее вероятно нахождение электрона. Орбиталь ограничена в трехмерном пространстве поверхностями той или иной формы. Орбиталь электрона представляет собой определенное распределение заряда, которое называется электронным облаком. • Орбитали (энергетические ячейки) обозначаются графически • Атом может находиться в основном и возбужденном состояниях • Классификация элементов по электронным семействам зависит от того, какой подуровень заполняет последний электрон.
Каждый электрон обладает лишь определенным значением энергии, что соответствует их расстоянию от ядра атома. В зависимости от этого все электроны находятся на определенных энергетических уровнях, которые состоят из подуровней. • Орбиталь – область околоядерного пространства, в котором наиболее вероятно нахождение электрона. Орбиталь ограничена в трехмерном пространстве поверхностями той или иной формы. Орбиталь электрона представляет собой определенное распределение заряда, которое называется электронным облаком. • Орбитали (энергетические ячейки) обозначаются графически • Атом может находиться в основном и возбужденном состояниях • Классификация элементов по электронным семействам зависит от того, какой подуровень заполняет последний электрон.
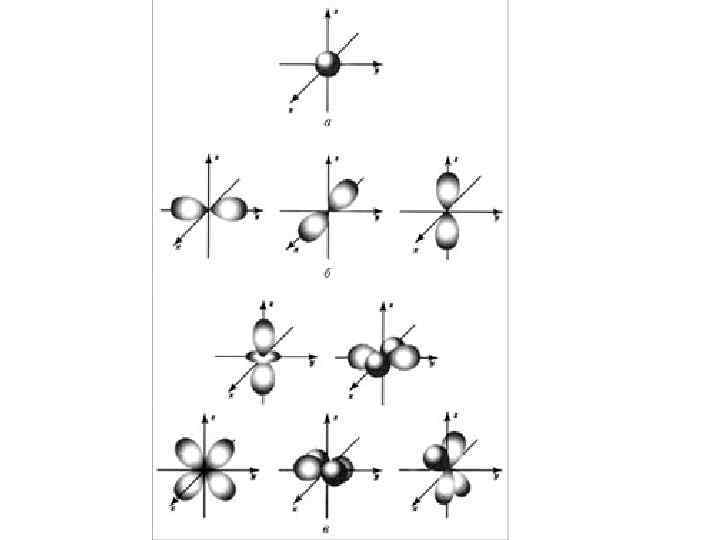
 Квантовые числа характеризуют поведение электрона в атоме • Главное квантовое число n – определяет энергию и размеры электронных орбиталей. Номер n – номер энергетического уровня. n = 1, 2, 3, 4… • Орбитальное (побочное) квантовое число l – определяет форму атомной орбитали, номер энергетического подуровня. 0 ≤ l ≤ n-1. • Магнитное квантовое число ml характеризует ориентацию атомной орбитали в пространстве. –l ≤ ml ≤ l, включая 0. Определяет число возможных орбиталей. • Спиновое квантовое число ms характеризует собственный момент движения электрона вокруг своей оси; ms = ± ½. На каждой орбитали может быть максимум два электрона с противоположными (антипараллельными) спинами – спаренные электроны.
Квантовые числа характеризуют поведение электрона в атоме • Главное квантовое число n – определяет энергию и размеры электронных орбиталей. Номер n – номер энергетического уровня. n = 1, 2, 3, 4… • Орбитальное (побочное) квантовое число l – определяет форму атомной орбитали, номер энергетического подуровня. 0 ≤ l ≤ n-1. • Магнитное квантовое число ml характеризует ориентацию атомной орбитали в пространстве. –l ≤ ml ≤ l, включая 0. Определяет число возможных орбиталей. • Спиновое квантовое число ms характеризует собственный момент движения электрона вокруг своей оси; ms = ± ½. На каждой орбитали может быть максимум два электрона с противоположными (антипараллельными) спинами – спаренные электроны.
 • Принцип минимальной энергии: электроны в основном состоянии заполняют орбитали в порядке повышения их уровня энергии. При заполнении высокоэнергетичных орбиталей последовательность усложняется из-за взаимного отталкивания электронов. • Правило Клечковского: заполнение орбиталей электронами происходит в порядке возрастания суммы квантовых чисел n+l, а при равной сумме n+l в порядке возрастания числа n. 1 s<2 s<2 p<3 s<3 p<4 s<3 d<4 p<5 s<4 d<5 p<6 s<5 d≈4 f<6 p<7 s… Элементы-исключения: Cu, Ag, Au, Cr, Mo, Nb, Ru, Rh, Pd*, Pt. • Принцип запрета Паули: в атоме не может быть двух электронов, обладающим одинаковым набором всех квантовых чисел. • Правило Гунда: в основном состоянии заполнение орбиталей одного подуровня начинается одиночными (неспаренными) электронами с одинаковыми спинами. • Количественной мерой валентности является число неспаренных электронов.
• Принцип минимальной энергии: электроны в основном состоянии заполняют орбитали в порядке повышения их уровня энергии. При заполнении высокоэнергетичных орбиталей последовательность усложняется из-за взаимного отталкивания электронов. • Правило Клечковского: заполнение орбиталей электронами происходит в порядке возрастания суммы квантовых чисел n+l, а при равной сумме n+l в порядке возрастания числа n. 1 s<2 s<2 p<3 s<3 p<4 s<3 d<4 p<5 s<4 d<5 p<6 s<5 d≈4 f<6 p<7 s… Элементы-исключения: Cu, Ag, Au, Cr, Mo, Nb, Ru, Rh, Pd*, Pt. • Принцип запрета Паули: в атоме не может быть двух электронов, обладающим одинаковым набором всех квантовых чисел. • Правило Гунда: в основном состоянии заполнение орбиталей одного подуровня начинается одиночными (неспаренными) электронами с одинаковыми спинами. • Количественной мерой валентности является число неспаренных электронов.
 Тестовые вопросы • На р-подуровне находятся два электрона. Как они располагаются на р-орбиталях в нормальном состоянии? • Написать электронную формулу атома никеля. Подсчитать число электронов на d-подуровне предвнешнего энергетического уровня. • К какому электронному семейству (s, p, d, f) относится атом элемента с порядковым номером 58? • Какие из приведенных ниже электронных состояний являются нереальными и почему: 3 p 6, 2 d 3, 3 s 3, 2 s 1, 3 f 2, 4 p 2, 4 f 1? • Хлорид – иону соответствует следующая электронная конфигурация: а) 1 s 22 p 63 s 23 р4; б) 1 s 22 p 63 s 23 р6; в) 1 s 22 p 63 s 23 d 6; г) 1 s 22 p 63 s 23 р5.
Тестовые вопросы • На р-подуровне находятся два электрона. Как они располагаются на р-орбиталях в нормальном состоянии? • Написать электронную формулу атома никеля. Подсчитать число электронов на d-подуровне предвнешнего энергетического уровня. • К какому электронному семейству (s, p, d, f) относится атом элемента с порядковым номером 58? • Какие из приведенных ниже электронных состояний являются нереальными и почему: 3 p 6, 2 d 3, 3 s 3, 2 s 1, 3 f 2, 4 p 2, 4 f 1? • Хлорид – иону соответствует следующая электронная конфигурация: а) 1 s 22 p 63 s 23 р4; б) 1 s 22 p 63 s 23 р6; в) 1 s 22 p 63 s 23 d 6; г) 1 s 22 p 63 s 23 р5.