Спирти. Характеристика спиртів Домашнє

















![Спирти. Характеристика спиртів Міжмолекулярна дегідратація С 2 Н 5 −О−[Н + Н−О]−С Спирти. Характеристика спиртів Міжмолекулярна дегідратація С 2 Н 5 −О−[Н + Н−О]−С](https://present5.com/presentation/1/174617167_277111618.pdf-img/174617167_277111618.pdf-20.jpg)



 Спирти. Характеристика спиртів
Спирти. Характеристика спиртів
 Домашнє завдання § 27 -28, характеристика спиртів
Домашнє завдання § 27 -28, характеристика спиртів
 Спирти. Характеристика спиртів Мета уроку v сформувати поняття про оксигеновмісні сполуки; v дати характеристику спиртам
Спирти. Характеристика спиртів Мета уроку v сформувати поняття про оксигеновмісні сполуки; v дати характеристику спиртам
 Спирти. Характеристика спиртів План уроку 1. Поняття «Оксигеновмісні сполуки» 2. Класифікація спиртів 3. Характеристика метанолу та етанолу
Спирти. Характеристика спиртів План уроку 1. Поняття «Оксигеновмісні сполуки» 2. Класифікація спиртів 3. Характеристика метанолу та етанолу
 Спирти. Характеристика спиртів 1. Поняття «Оксигеновмісні сполуки» Оксигеновмісні сполуки або Оксисполуки - органічні сполуки, що містять групу –С–О– Гідроксильними похідними називають похідні вуг леводнів, яких один або декілька в атомів водню заміщені на гідроксильну групу: v Спирти v Феноли
Спирти. Характеристика спиртів 1. Поняття «Оксигеновмісні сполуки» Оксигеновмісні сполуки або Оксисполуки - органічні сполуки, що містять групу –С–О– Гідроксильними похідними називають похідні вуг леводнів, яких один або декілька в атомів водню заміщені на гідроксильну групу: v Спирти v Феноли
 Спирти. Характеристика спиртів 2. Класифікація спиртів Залежно від числа гідроксильних груп у молекулі розрізняють одно-, дво-, три- та поліатомні спирти. СН 3–СН 2–ОН одноатомний спирт НО–СН 2–СН 2–ОН двоатомний спирт
Спирти. Характеристика спиртів 2. Класифікація спиртів Залежно від числа гідроксильних груп у молекулі розрізняють одно-, дво-, три- та поліатомні спирти. СН 3–СН 2–ОН одноатомний спирт НО–СН 2–СН 2–ОН двоатомний спирт
 Спирти. Характеристика спиртів 2. Класифікація спиртів За розміщенням гідроксильної групи у карбоновому ланцюзі спирти класифікують на первинні (група −ОН розміщена при пер винному атомі Карбону), вторинні (гідроксильна група розміщена при вторинному атомі Карбону) і третинні (група −ОН знахо диться при третинному атомі Карбону):
Спирти. Характеристика спиртів 2. Класифікація спиртів За розміщенням гідроксильної групи у карбоновому ланцюзі спирти класифікують на первинні (група −ОН розміщена при пер винному атомі Карбону), вторинні (гідроксильна група розміщена при вторинному атомі Карбону) і третинні (група −ОН знахо диться при третинному атомі Карбону):
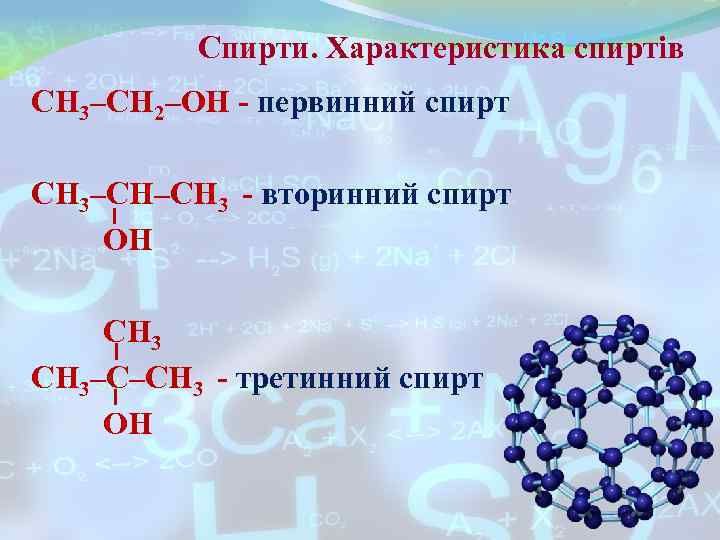
 Спирти. Характеристика спиртів СН 3–СН 2–ОН - первинний спирт СН 3–СН–СН 3 - вторинний спирт ОН СН 3–С–СН 3 - третинний спирт ОН
Спирти. Характеристика спиртів СН 3–СН 2–ОН - первинний спирт СН 3–СН–СН 3 - вторинний спирт ОН СН 3–С–СН 3 - третинний спирт ОН
 Спирти. Характеристика спиртів Одноатомні спирти містять одну гідроксильну групу. 1. Насичені − похідні алканів і циклоалканів. 2. Ненасичені − похідні ненасичених вуглеводнів, у яких гідро ксильна група не знаходиться при кратному зв’язку. 3. Ароматичні − похідні аро матичних вуглеводнів з групою −ОН у боковому ланцюзі.
Спирти. Характеристика спиртів Одноатомні спирти містять одну гідроксильну групу. 1. Насичені − похідні алканів і циклоалканів. 2. Ненасичені − похідні ненасичених вуглеводнів, у яких гідро ксильна група не знаходиться при кратному зв’язку. 3. Ароматичні − похідні аро матичних вуглеводнів з групою −ОН у боковому ланцюзі.
 Спирти. Характеристика спиртів Номенклатура та ізомерія СН 3–СН 2–ОН – етанол, етиловий спирт СН 3–СН–СН 3 - пропан-2 -ол, ОН ізопропіловий спирт СН 3 СН 2=СН−СН−СН 2−ОН 2 -метилбут-3 -ен-1 -ол
Спирти. Характеристика спиртів Номенклатура та ізомерія СН 3–СН 2–ОН – етанол, етиловий спирт СН 3–СН–СН 3 - пропан-2 -ол, ОН ізопропіловий спирт СН 3 СН 2=СН−СН−СН 2−ОН 2 -метилбут-3 -ен-1 -ол
 Спирти. Характеристика спиртів Номенклатура та ізомерія Для спиртів характерна структурна, геометрична та оптична ізомерія. Структурна ізомерія спиртів зумовлена різною будовою карбонового скелета, а також різним положенням гідроксильної групи у вуглецевому ланцюзі: СН 3–СН 2–СН 2–ОН – бутан-1 -ол СН 3–СН 2–СН–СН 3 - бутан-2 -ол, ОН
Спирти. Характеристика спиртів Номенклатура та ізомерія Для спиртів характерна структурна, геометрична та оптична ізомерія. Структурна ізомерія спиртів зумовлена різною будовою карбонового скелета, а також різним положенням гідроксильної групи у вуглецевому ланцюзі: СН 3–СН 2–СН 2–ОН – бутан-1 -ол СН 3–СН 2–СН–СН 3 - бутан-2 -ол, ОН
 Спирти. Характеристика спиртів Номенклатура та ізомерія Для ненасичених спиртів структурна ізомерія може зумовлю ватися положенням й кратного зв’язку: СН 2═СН–СН 2–ОН – бут-3 -ен-1 -ол СН 3–СН═СН–СН 2–ОН - бут-2 -ен-1 -ол
Спирти. Характеристика спиртів Номенклатура та ізомерія Для ненасичених спиртів структурна ізомерія може зумовлю ватися положенням й кратного зв’язку: СН 2═СН–СН 2–ОН – бут-3 -ен-1 -ол СН 3–СН═СН–СН 2–ОН - бут-2 -ен-1 -ол
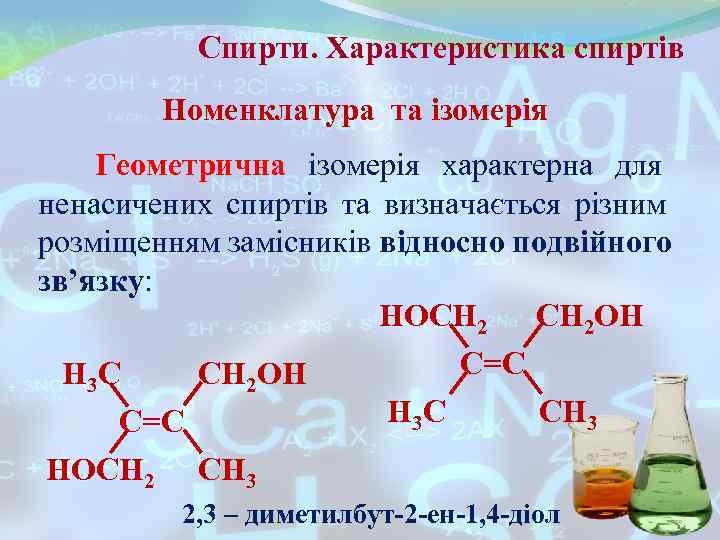
 Спирти. Характеристика спиртів Номенклатура та ізомерія Геометрична ізомерія характерна для ненасичених спиртів та визначається різним розміщенням замісників відносно подвійного зв’язку: НОСН 2 ОН Н 3 С СН 2 ОН С=С Н 3 С СН 3 НОСН 2 СН 3 2, 3 – диметилбут-2 -ен-1, 4 -діол
Спирти. Характеристика спиртів Номенклатура та ізомерія Геометрична ізомерія характерна для ненасичених спиртів та визначається різним розміщенням замісників відносно подвійного зв’язку: НОСН 2 ОН Н 3 С СН 2 ОН С=С Н 3 С СН 3 НОСН 2 СН 3 2, 3 – диметилбут-2 -ен-1, 4 -діол
 Спирти. Характеристика спиртів 3. Порівняльна характеристика метанолу та етанолу 1. Назва речовини Метанол, Етанол, метиловий спирт Етиловий спирт 2. Будова Сn. Н 2 n+1 ОН, СН 3 ОН Сn. Н 2 n+1 ОН, С 2 Н 5 ОН СН 3–ОН СН 3–СН 2–ОН 3. Класифікація речовини Спирт, одноатомний, первинний, насичений
Спирти. Характеристика спиртів 3. Порівняльна характеристика метанолу та етанолу 1. Назва речовини Метанол, Етанол, метиловий спирт Етиловий спирт 2. Будова Сn. Н 2 n+1 ОН, СН 3 ОН Сn. Н 2 n+1 ОН, С 2 Н 5 ОН СН 3–ОН СН 3–СН 2–ОН 3. Класифікація речовини Спирт, одноатомний, первинний, насичений
 Спирти. Характеристика спиртів 4. Фізичні властивості ММ: 32 г/моль ММ: 46 г/моль АС: рідина АС: рідина Колір: - Колір: - Запах: є 5. Хімічні властивості 1. Реакція горіння (окиснення) 2 СН 3 ОН + 3 О 2 → 2 СО 2 + 4 Н 2 О С 2 Н 5 ОН + 3 О 2 → 2 СО 2 + 3 Н 2 О
Спирти. Характеристика спиртів 4. Фізичні властивості ММ: 32 г/моль ММ: 46 г/моль АС: рідина АС: рідина Колір: - Колір: - Запах: є 5. Хімічні властивості 1. Реакція горіння (окиснення) 2 СН 3 ОН + 3 О 2 → 2 СО 2 + 4 Н 2 О С 2 Н 5 ОН + 3 О 2 → 2 СО 2 + 3 Н 2 О
 Спирти. Характеристика спиртів 2. Кислотно-основні властивості Спирти виявляють слабкі кислотні та слабкі основні властивості, тобто вони є амфотерними речовинами. 2. 1. Кислотні властивості Н О Н > CH 3 О Н > (CH 3)2 CH О Н 2 C 2 H 5−OH + 2 Na 2 C 2 H 5−O−Na + Н 2 етилат натрію Солі спиртів - алкоголяти
Спирти. Характеристика спиртів 2. Кислотно-основні властивості Спирти виявляють слабкі кислотні та слабкі основні властивості, тобто вони є амфотерними речовинами. 2. 1. Кислотні властивості Н О Н > CH 3 О Н > (CH 3)2 CH О Н 2 C 2 H 5−OH + 2 Na 2 C 2 H 5−O−Na + Н 2 етилат натрію Солі спиртів - алкоголяти
 Спирти. Характеристика спиртів 2. 2 Основні властивості Зумовлені наявністю на атомі кисню −ОН групи неподіленої пари електронів, здатної до приєднання протону. Так, з сильними кислотами первинні спирти утворюють на холоді нестійкі солі алкілоксонію: Н • • + С 2 Н 5 ОН + НBr ↔ С 2 Н 5−О Br Н етилоксонію бромід
Спирти. Характеристика спиртів 2. 2 Основні властивості Зумовлені наявністю на атомі кисню −ОН групи неподіленої пари електронів, здатної до приєднання протону. Так, з сильними кислотами первинні спирти утворюють на холоді нестійкі солі алкілоксонію: Н • • + С 2 Н 5 ОН + НBr ↔ С 2 Н 5−О Br Н етилоксонію бромід
 Спирти. Характеристика спиртів 2. 2 Основні властивості Реакція з нітратною кислотою: C 2 H 5–O–[H + HO]–NO 2 ↔ C 2 H 5–O–NO 2 + H 2 O етилнітрат Реакція з органічними кислотами (етерифікація) CH 3–O–[H + НО]–С–СН 3 Н 2 SO 4 О CH 3–О–С–СН 3 + Н 2 О О метилацетат
Спирти. Характеристика спиртів 2. 2 Основні властивості Реакція з нітратною кислотою: C 2 H 5–O–[H + HO]–NO 2 ↔ C 2 H 5–O–NO 2 + H 2 O етилнітрат Реакція з органічними кислотами (етерифікація) CH 3–O–[H + НО]–С–СН 3 Н 2 SO 4 О CH 3–О–С–СН 3 + Н 2 О О метилацетат
 Спирти. Характеристика спиртів 3. Дегідратація спиртів При нагріванні спиртів у присутності концентрованих H 2 SO 4 , Н 3 РО 4 а пропусканні пари спирту над каталізатором А 1 2 О 3 спирти піддаються дегідратації. У залежності від природи спирту та умов проведення реакція може проходити міжмолекулярно та внутрішньомолекулярно.
Спирти. Характеристика спиртів 3. Дегідратація спиртів При нагріванні спиртів у присутності концентрованих H 2 SO 4 , Н 3 РО 4 а пропусканні пари спирту над каталізатором А 1 2 О 3 спирти піддаються дегідратації. У залежності від природи спирту та умов проведення реакція може проходити міжмолекулярно та внутрішньомолекулярно.
![> Спирти. Характеристика спиртів Міжмолекулярна дегідратація С 2 Н 5 −О−[Н + Н−О]−С > Спирти. Характеристика спиртів Міжмолекулярна дегідратація С 2 Н 5 −О−[Н + Н−О]−С](https://present5.com/presentation/1/174617167_277111618.pdf-img/174617167_277111618.pdf-20.jpg) Спирти. Характеристика спиртів Міжмолекулярна дегідратація С 2 Н 5 −О−[Н + Н−О]−С 2 Н 5 С 2 Н 5−О−С 2 Н 5 + Н 2 О діетиловий етер Внутрішньомолекулярна дегідратація СН 3−CH−OH CH 2=CH 2 + H 2 О Н етилен
Спирти. Характеристика спиртів Міжмолекулярна дегідратація С 2 Н 5 −О−[Н + Н−О]−С 2 Н 5 С 2 Н 5−О−С 2 Н 5 + Н 2 О діетиловий етер Внутрішньомолекулярна дегідратація СН 3−CH−OH CH 2=CH 2 + H 2 О Н етилен
 Спирти. Характеристика спиртів 4. Взаємодія з галогеноводневими кислотами С 2 Н 5−ОН + НІ С 2 Н 5−І + Н 2 О іодетан 5. Каталітичне окиснення Первинні спирти при окисненні спочатку утворюють альдегіди, далі – карбонові кислоти: С 2 Н 5 ОН + [О] → СН 3−СОН + Н 2 О → CH 3 COOH
Спирти. Характеристика спиртів 4. Взаємодія з галогеноводневими кислотами С 2 Н 5−ОН + НІ С 2 Н 5−І + Н 2 О іодетан 5. Каталітичне окиснення Первинні спирти при окисненні спочатку утворюють альдегіди, далі – карбонові кислоти: С 2 Н 5 ОН + [О] → СН 3−СОН + Н 2 О → CH 3 COOH
 Спирти. Характеристика спиртів Вторинні спирти при окисненні утворюють кетони: СН 3−СН−СН 3 + [О] СН 3−С−СН 3 + Н 2 О ОН О
Спирти. Характеристика спиртів Вторинні спирти при окисненні утворюють кетони: СН 3−СН−СН 3 + [О] СН 3−С−СН 3 + Н 2 О ОН О
 Спирти. Характеристика спиртів 6. Якісна реакція 7. Добування 8. Застосування 9. Поширення в природі 10 Фізіологічна дія САМОСТІЙНО
Спирти. Характеристика спиртів 6. Якісна реакція 7. Добування 8. Застосування 9. Поширення в природі 10 Фізіологічна дія САМОСТІЙНО
