Соединения, содержащие кольца из углеродных атомов, называются алициклическими.





















rings.ppt
- Размер: 3.1 Mегабайта
- Количество слайдов: 26
Описание презентации Соединения, содержащие кольца из углеродных атомов, называются алициклическими. по слайдам
 Соединения, содержащие кольца из углеродных атомов, называются алициклическими. К ним не относят ароматические углеводороды ряда бензола
Соединения, содержащие кольца из углеродных атомов, называются алициклическими. К ним не относят ароматические углеводороды ряда бензола
 Циклогексан Норборнан Циклогекса-1, 3 -диен Циклопентен Норборнен
Циклогексан Норборнан Циклогекса-1, 3 -диен Циклопентен Норборнен

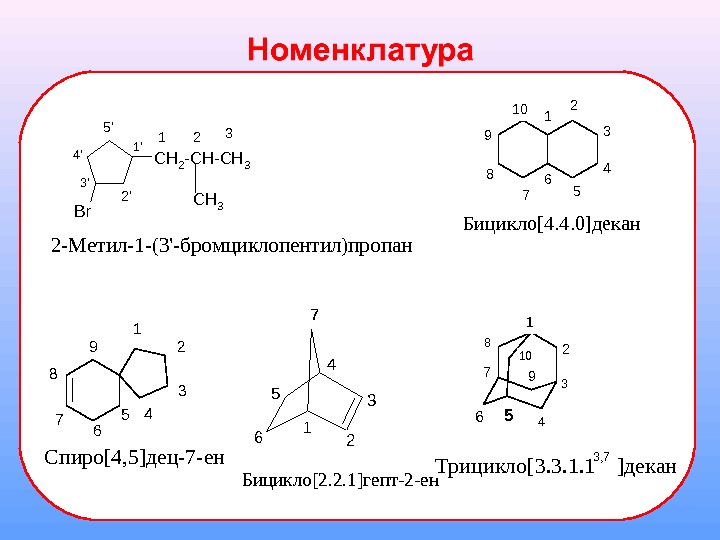
![1 2 34 5 6 7 Бицикло[2. 2. 1]гепт-2 -ен. C H 2 - C H 1 2 34 5 6 7 Бицикло[2. 2. 1]гепт-2 -ен. C H 2 - C H](/docs//rings_images/rings_3.jpg) 1 2 34 5 6 7 Бицикло[2. 2. 1]гепт-2 -ен. C H 2 — C H 3 Br C H 31 2 3 4′ 5′ 1′ 2’3′ 2 -Метил-1 -(3′-бромциклопентил)пропан Спиро[4, 5]дец-7 -ен 1 2 3 45 6 7 8 9 Трицикло[3. 3. 1. 1 ]декан 2 3 45 6 7 8 9 10 3, 7 1 Бицикло[4. 4. 0]декан
1 2 34 5 6 7 Бицикло[2. 2. 1]гепт-2 -ен. C H 2 — C H 3 Br C H 31 2 3 4′ 5′ 1′ 2’3′ 2 -Метил-1 -(3′-бромциклопентил)пропан Спиро[4, 5]дец-7 -ен 1 2 3 45 6 7 8 9 Трицикло[3. 3. 1. 1 ]декан 2 3 45 6 7 8 9 10 3, 7 1 Бицикло[4. 4. 0]декан

 НАПРЯЖЕНИЕ В ЦИКЛОАЛКАНАХ Энергия напряжения, к. Дж/моль Циклопропан 37, 7 Циклобутан 28, 4 Циклопентан 5, 0 Циклогексан 0 Циклогептан 3, 7 Циклооктан 5, 1 Циклононан 5, 9 Циклодекан 5, 0 Циклоундекан 4, 2 Циклододекан 1, 25 Циклотридекан 1, 7 Циклотетрадекан 0 Циклопентадекан 0,
НАПРЯЖЕНИЕ В ЦИКЛОАЛКАНАХ Энергия напряжения, к. Дж/моль Циклопропан 37, 7 Циклобутан 28, 4 Циклопентан 5, 0 Циклогексан 0 Циклогептан 3, 7 Циклооктан 5, 1 Циклононан 5, 9 Циклодекан 5, 0 Циклоундекан 4, 2 Циклододекан 1, 25 Циклотридекан 1, 7 Циклотетрадекан 0 Циклопентадекан 0,

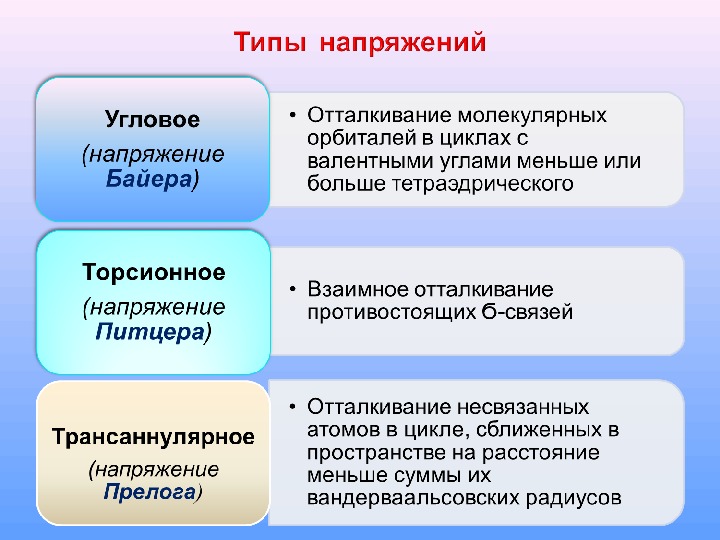
 • в циклопропане снимается за счет образования изогнутых банановых связей (орбитали перекрываются под углом )
• в циклопропане снимается за счет образования изогнутых банановых связей (орбитали перекрываются под углом )
 обусловлено взаимным отталкиванием противостоящих -связей в циклах; Ϭ максимальное в заслоненной конформации при диэдральном угле НССН ϕ =0 0 , минимальное — при ϕ =600. Циклобутан Циклопентан Стремление связей выйти из заслоненного положения способствует выходу всех или нескольких С-атомов из плоскости цикла H HHH CH 2 C H
обусловлено взаимным отталкиванием противостоящих -связей в циклах; Ϭ максимальное в заслоненной конформации при диэдральном угле НССН ϕ =0 0 , минимальное — при ϕ =600. Циклобутан Циклопентан Стремление связей выйти из заслоненного положения способствует выходу всех или нескольких С-атомов из плоскости цикла H HHH CH 2 C H
 — характерно угловое, торсионное и трансаннулярное напряжения; — выделяют складчатую и плоскую формы, находящиеся в колебательном движении; — барьер конформационных переходов – 6 к. Дж/моль; — цис-изомер устойчивее транс-формы. транс- цис- R=R’=Br ∆ Ԍ = -0, 4 ккал/моль R=CH 3 ; R’=COOCH 3 ∆ Ԍ= -0, 3 ккал/моль R R’ RR’ HHHH
— характерно угловое, торсионное и трансаннулярное напряжения; — выделяют складчатую и плоскую формы, находящиеся в колебательном движении; — барьер конформационных переходов – 6 к. Дж/моль; — цис-изомер устойчивее транс-формы. транс- цис- R=R’=Br ∆ Ԍ = -0, 4 ккал/моль R=CH 3 ; R’=COOCH 3 ∆ Ԍ= -0, 3 ккал/моль R R’ RR’ HHHH
 — характерно торсионное и несущественное угловое напряжение; — различают форму конверта или полукресла ; — волнообразное движение кольца в результате последовательного выведения из плоскости цикла каждого из пяти углеродных атомов называют псевдообращением.
— характерно торсионное и несущественное угловое напряжение; — различают форму конверта или полукресла ; — волнообразное движение кольца в результате последовательного выведения из плоскости цикла каждого из пяти углеродных атомов называют псевдообращением.
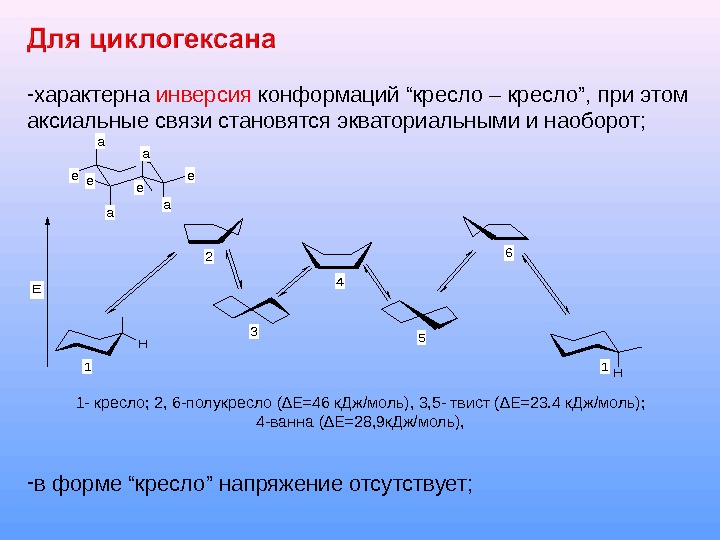
 — характерна инверсия конформаций “кресло – кресло”, при этом аксиальные связи становятся экваториальными и наоборот; 1 — кресло; 2, 6 -полукресло (∆Е=46 к. Дж/моль), 3, 5 — твист (∆Е=23. 4 к. Дж/моль); 4 -ванна (∆Е=28, 9 к. Дж/моль), — в форме “кресло” напряжение отсутствует; H H E 1 2 3 4 5 6 1 a e a e
— характерна инверсия конформаций “кресло – кресло”, при этом аксиальные связи становятся экваториальными и наоборот; 1 — кресло; 2, 6 -полукресло (∆Е=46 к. Дж/моль), 3, 5 — твист (∆Е=23. 4 к. Дж/моль); 4 -ванна (∆Е=28, 9 к. Дж/моль), — в форме “кресло” напряжение отсутствует; H H E 1 2 3 4 5 6 1 a e a e
 CH 3 H H H CH 3 H 5 %95%- пребывание заместителя в аксиальном положении невыгодно из-за вандерваальсовского напряжения з другими аксиальными заместителями, расположенными через один атом углерода (1, 3 -диаксиальное напряжение) C(CH 3) 3 H H H C(CH 3) 3 H 0 %100%
CH 3 H H H CH 3 H 5 %95%- пребывание заместителя в аксиальном положении невыгодно из-за вандерваальсовского напряжения з другими аксиальными заместителями, расположенными через один атом углерода (1, 3 -диаксиальное напряжение) C(CH 3) 3 H H H C(CH 3) 3 H 0 %100%
 — выделяют четыре конформации; «Кресло» «Твист-кресло» «Твист-ванна» «Ванна» — наиболее стабильна форма – твист-кресло; — барьер конформационного перехода – 11 к. Дж/моль
— выделяют четыре конформации; «Кресло» «Твист-кресло» «Твист-ванна» «Ванна» — наиболее стабильна форма – твист-кресло; — барьер конформационного перехода – 11 к. Дж/моль
 1. Внутримолекулярная реакция Вюрца. С хорошими выходами получают циклопропан, циклобутан, циклопентан. 1, 3 -дибромпропан циклопропан 1, 4 -Дибромбутан Циклобутан. CH 2 -Br Zn. CH 2 CH 2 -Br. Li / Hg
1. Внутримолекулярная реакция Вюрца. С хорошими выходами получают циклопропан, циклобутан, циклопентан. 1, 3 -дибромпропан циклопропан 1, 4 -Дибромбутан Циклобутан. CH 2 -Br Zn. CH 2 CH 2 -Br. Li / Hg
 2. Реакция Перкина. Взаимодействие натрий малонового эфира с α , ω -дигалогеналканами. 2 С 2 Н 5 О Na — 2 С 2 Н 5 ОН Динатрий диетилмалонат Циклобутанкарбоновая кислота. N a 2 C C O 2 C 2 H 5 CH 2 C — B r C O 2 C 2 H 5 C O O H T — C O 2 C O O H- N a B r O H 2 — C 2 H 5 O H+CH 2 C O 2 C 2 H 5 N a 2 C C O 2 C 2 H
2. Реакция Перкина. Взаимодействие натрий малонового эфира с α , ω -дигалогеналканами. 2 С 2 Н 5 О Na — 2 С 2 Н 5 ОН Динатрий диетилмалонат Циклобутанкарбоновая кислота. N a 2 C C O 2 C 2 H 5 CH 2 C — B r C O 2 C 2 H 5 C O O H T — C O 2 C O O H- N a B r O H 2 — C 2 H 5 O H+CH 2 C O 2 C 2 H 5 N a 2 C C O 2 C 2 H
 3. Метод Ружичка. Декарбоксилирование бариевых, ториевых или кальциевых солей дикарбоновых кислот. Метод используют для синтеза пяти-семичленных циклов( выход 20 -50 %). Выходы циклических кетонов С 9 –С 13 очень низкие ( ≈1%). Большие цикл ы образуются легче (выход ≈5 -8%). (CH 2)n C C O O O Ba O (CH 2)n CH 2 C O -Ba. O, CO 2 [H] (CH 2)n CH
3. Метод Ружичка. Декарбоксилирование бариевых, ториевых или кальциевых солей дикарбоновых кислот. Метод используют для синтеза пяти-семичленных циклов( выход 20 -50 %). Выходы циклических кетонов С 9 –С 13 очень низкие ( ≈1%). Большие цикл ы образуются легче (выход ≈5 -8%). (CH 2)n C C O O O Ba O (CH 2)n CH 2 C O -Ba. O, CO 2 [H] (CH 2)n CH
 4. Циклизация динитрилов по Торпу-Циглеру. Метод удобен для синтеза циклических кетонов С 3 – С 8 и С 14 -С 32 , выход соединений С 9 -С 11 очень мал (1 -2%). α , ω -Динитрилы Иминонитрилы Циклические карбоновые кислоты кетоны (CH 2)n CH 2 CN Na (Li) ROR(CH 2)n C H 2 CH — CN C=NNa H+, H 2 O (CH 2)n C H 2 CH — COOH C=O T -CO 2 (CH 2)n C H 2 C=O
4. Циклизация динитрилов по Торпу-Циглеру. Метод удобен для синтеза циклических кетонов С 3 – С 8 и С 14 -С 32 , выход соединений С 9 -С 11 очень мал (1 -2%). α , ω -Динитрилы Иминонитрилы Циклические карбоновые кислоты кетоны (CH 2)n CH 2 CN Na (Li) ROR(CH 2)n C H 2 CH — CN C=NNa H+, H 2 O (CH 2)n C H 2 CH — COOH C=O T -CO 2 (CH 2)n C H 2 C=O
 5. Сложноэфирная внутримолекулярная конденсация Дикмана. Эфиры α , ω -дикарбоновых кислот в присутствии Натрия или Натрий алкоголятов циклизуются в кетоэфиры, которые далее гидролизуют и декарбоксилируют до циклических кетонов: Метод используют для синтеза пяти-семичленных циклов, умеренные выходы (24 -48 %) получены для циклических кетонов С 14 -С 16 (CH 2)n C(O) -OC 2 H 5 CH 2 Na. H+, H 2 O (CH 2)n T -CO 2 C 2 H 5 (CH 2)n C(O) -OC 2 H 5 CH-Na CO 2 C 2 H 5 (CH 2)n CO 2 C 2 H 5 OH C-OC 2 H 5 CH — C 2 H 5 OH CO 2 C 2 H 5 C=O CH (CH 2)n COOH C=O CH (CH 2)n C=O CH 2 — C 2 H 5 OH
5. Сложноэфирная внутримолекулярная конденсация Дикмана. Эфиры α , ω -дикарбоновых кислот в присутствии Натрия или Натрий алкоголятов циклизуются в кетоэфиры, которые далее гидролизуют и декарбоксилируют до циклических кетонов: Метод используют для синтеза пяти-семичленных циклов, умеренные выходы (24 -48 %) получены для циклических кетонов С 14 -С 16 (CH 2)n C(O) -OC 2 H 5 CH 2 Na. H+, H 2 O (CH 2)n T -CO 2 C 2 H 5 (CH 2)n C(O) -OC 2 H 5 CH-Na CO 2 C 2 H 5 (CH 2)n CO 2 C 2 H 5 OH C-OC 2 H 5 CH — C 2 H 5 OH CO 2 C 2 H 5 C=O CH (CH 2)n COOH C=O CH (CH 2)n C=O CH 2 — C 2 H 5 OH
 6. Ацилоиновая конденсация. Эфиры α , ω -дикарбоновых кислот в присутствии избытка Натрия (4 экв. ) циклизуются в α -гидрокси-кетоны (ацилоины), которые далее восстанавливают в циклоалканы: 4 Ацилоины Метод используют для синтеза всего диапазона циклалканов(CH 2)n C(O) -OCH 3 C(O)-OCH 3 Na, t. H+, H 2 O (CH 2)n C-ONa — CH 3 ONa (CH 2)n C-OH (CH 2)n CH-OH C=O (CH 2)n C H 2 CH 2 Zn(Hg) / HCl
6. Ацилоиновая конденсация. Эфиры α , ω -дикарбоновых кислот в присутствии избытка Натрия (4 экв. ) циклизуются в α -гидрокси-кетоны (ацилоины), которые далее восстанавливают в циклоалканы: 4 Ацилоины Метод используют для синтеза всего диапазона циклалканов(CH 2)n C(O) -OCH 3 C(O)-OCH 3 Na, t. H+, H 2 O (CH 2)n C-ONa — CH 3 ONa (CH 2)n C-OH (CH 2)n CH-OH C=O (CH 2)n C H 2 CH 2 Zn(Hg) / HCl
 7. Разширение циклов в циклокетонах. Реакция внедрения метиленкарбена по циклической С-С связи: медленно Циклогексанон быстро Циклогептанон Циклооктанон Метод используют для синтеза циклоалканов С 5 – С 8. Большие по размеру циклы ( до С 15 ) получают в присутствии каталитической системы литий хлорид – этерат борфторида. O + CH 2 N 2 O CH 2 -NN-N 2 O CH 2 N 2 O ++
7. Разширение циклов в циклокетонах. Реакция внедрения метиленкарбена по циклической С-С связи: медленно Циклогексанон быстро Циклогептанон Циклооктанон Метод используют для синтеза циклоалканов С 5 – С 8. Большие по размеру циклы ( до С 15 ) получают в присутствии каталитической системы литий хлорид – этерат борфторида. O + CH 2 N 2 O CH 2 -NN-N 2 O CH 2 N 2 O ++
 Циклопропан в химических процессах напоминает этилен , вступая в реакции присоединения с раскрытием цикла. Для циклобутана и других гомологов характерны реакции радикального замещения с разрывом С-Н связей (нитрование, галогенирование, сульфохлорирование), исключение — процесс гидрирования с раскрытием цикла. Все циклоалканы устойчивы к действию окислителей и окисляются лишь в жестких условиях
Циклопропан в химических процессах напоминает этилен , вступая в реакции присоединения с раскрытием цикла. Для циклобутана и других гомологов характерны реакции радикального замещения с разрывом С-Н связей (нитрование, галогенирование, сульфохлорирование), исключение — процесс гидрирования с раскрытием цикла. Все циклоалканы устойчивы к действию окислителей и окисляются лишь в жестких условиях
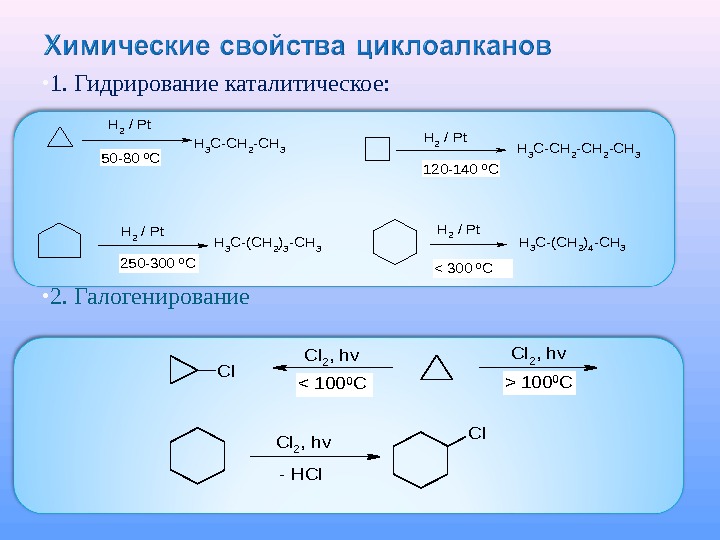
 1. Гидрирование каталитическое: 2. Галогенирование. H 2 / Pt H 3 C-CH 2 -CH 3 H 2 / Pt H 3 C-(CH 2)3 -CH 3 H 2 / Pt H 3 C-(CH 2)4 -CH 3 50 -80 0 C 120 -140 0 C 250 -300 0 C< 300 0 C Cl Cl 2, hv. Cl — HCl
1. Гидрирование каталитическое: 2. Галогенирование. H 2 / Pt H 3 C-CH 2 -CH 3 H 2 / Pt H 3 C-(CH 2)3 -CH 3 H 2 / Pt H 3 C-(CH 2)4 -CH 3 50 -80 0 C 120 -140 0 C 250 -300 0 C< 300 0 C Cl Cl 2, hv. Cl — HCl
 3. Гидрогалогенирование циклопропана. Для замещенных циклопропанов процесс протекает формально по правилу Марковникова 4. Гидратация циклопропана. водн. р-р HCl H 3 C-CH 2 Cl CH 3 HH 3 C-CH 2 -CH 3 Br H 3 C-CH 2 -OH H 2 SO 4 H 2 O
3. Гидрогалогенирование циклопропана. Для замещенных циклопропанов процесс протекает формально по правилу Марковникова 4. Гидратация циклопропана. водн. р-р HCl H 3 C-CH 2 Cl CH 3 HH 3 C-CH 2 -CH 3 Br H 3 C-CH 2 -OH H 2 SO 4 H 2 O
 5. Нитрование (парофазное). 6. Окисление циклогексана. HNO 3 конц. NO 2 H 2 / Pt T, p N — OH 1500 C O 2/Co ( Mn), t OHO COOH O 2/Co ( Mn), t
5. Нитрование (парофазное). 6. Окисление циклогексана. HNO 3 конц. NO 2 H 2 / Pt T, p N — OH 1500 C O 2/Co ( Mn), t OHO COOH O 2/Co ( Mn), t
 Pt. З 1500 C+2 +2 Pd (Pt, Ni) + З Н 2 СН 3 СН(СН 3)2 >
Pt. З 1500 C+2 +2 Pd (Pt, Ni) + З Н 2 СН 3 СН(СН 3)2 >
