щелочноземельные металлы.ppt
- Количество слайдов: 51
 Щелочноземельные металлы ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ 2 -й группы главной подгруппы: бериллий , магний, кальций, стронций , барий и радий(Be, Mg, Ca, Sr, Ba, Ra). Относятся ко 2 -й группе элементов по новой классификации ИЮПАК. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов.
Щелочноземельные металлы ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ 2 -й группы главной подгруппы: бериллий , магний, кальций, стронций , барий и радий(Be, Mg, Ca, Sr, Ba, Ra). Относятся ко 2 -й группе элементов по новой классификации ИЮПАК. Названы так потому, что их оксиды — «земли» (по терминологии алхимиков) — сообщают воде щелочную реакцию. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов.
 Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который самый лёгкий из них (ρ = 1, 55 г/см³), самый тяжёлый — радий
Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Плотность щёлочноземельных металлов с порядковым номером растёт, хотя явно рост наблюдается только начиная с кальция, который самый лёгкий из них (ρ = 1, 55 г/см³), самый тяжёлый — радий
 • Они имеют общую электронную конфигурацию: (n-1) p 6 ns 2.
• Они имеют общую электронную конфигурацию: (n-1) p 6 ns 2.
 ФИЗИЧЕСКИЕ СВОЙСТВА • В ряду Са – Sr – Ba – Ra свойства меняются последовательно. Относительная электроотрицательность в ряду Ве – Ra падает т. к. с увеличением размера атома валентные электроны отдаются охотнее. Свойства элементов IIА подгруппы определяются легкостью отдачи двух ns-электронов. При этом образуются ионы Э 2+. выяснилось, что в некоторых соединениях элементы IIА подгруппы проявляют одновалентность. Примером таких соединения являются ЭГ, которые получаются при добавлении Э к расплаву ЭГ 2. Все элементы этого ряда не встречаются в природе в свободном состоянии ввиду высокой активности.
ФИЗИЧЕСКИЕ СВОЙСТВА • В ряду Са – Sr – Ba – Ra свойства меняются последовательно. Относительная электроотрицательность в ряду Ве – Ra падает т. к. с увеличением размера атома валентные электроны отдаются охотнее. Свойства элементов IIА подгруппы определяются легкостью отдачи двух ns-электронов. При этом образуются ионы Э 2+. выяснилось, что в некоторых соединениях элементы IIА подгруппы проявляют одновалентность. Примером таких соединения являются ЭГ, которые получаются при добавлении Э к расплаву ЭГ 2. Все элементы этого ряда не встречаются в природе в свободном состоянии ввиду высокой активности.
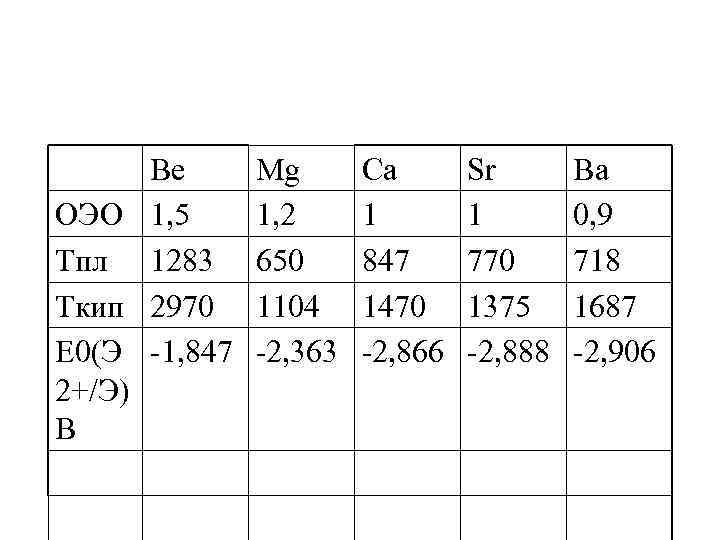 Be ОЭО 1, 5 Тпл 1283 Ткип 2970 Е 0(Э -1, 847 2+/Э) В Mg 1, 2 650 1104 -2, 363 Ca 1 847 1470 -2, 866 Sr 1 770 1375 -2, 888 Ba 0, 9 718 1687 -2, 906
Be ОЭО 1, 5 Тпл 1283 Ткип 2970 Е 0(Э -1, 847 2+/Э) В Mg 1, 2 650 1104 -2, 363 Ca 1 847 1470 -2, 866 Sr 1 770 1375 -2, 888 Ba 0, 9 718 1687 -2, 906
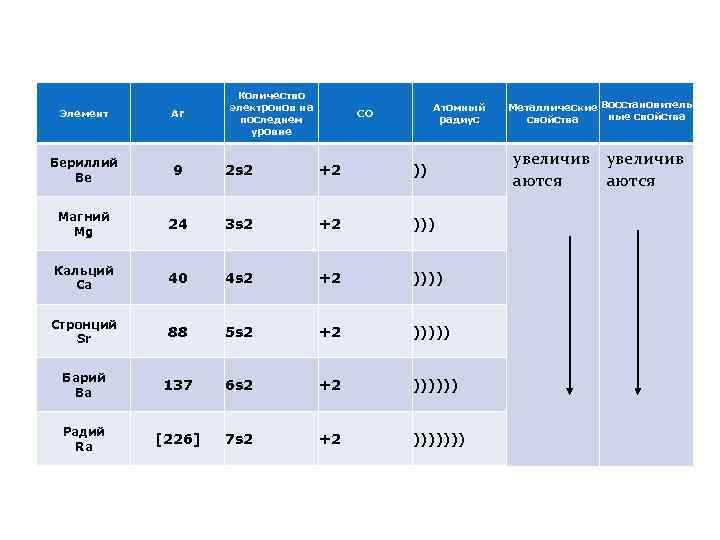 Количество электронов на последнем уровне Атомный радиус Элемент Ar СО Бериллий Be 9 2 s 2 +2 )) Магний Mg 24 3 s 2 +2 ))) Кальций Ca 40 4 s 2 +2 )))) Стронций Sr 88 5 s 2 +2 ))))) Барий Ba 137 6 s 2 +2 )))))) Радий Ra [226] 7 s 2 +2 ))))))) Металлические Восстановитель ные свойства увеличив аются
Количество электронов на последнем уровне Атомный радиус Элемент Ar СО Бериллий Be 9 2 s 2 +2 )) Магний Mg 24 3 s 2 +2 ))) Кальций Ca 40 4 s 2 +2 )))) Стронций Sr 88 5 s 2 +2 ))))) Барий Ba 137 6 s 2 +2 )))))) Радий Ra [226] 7 s 2 +2 ))))))) Металлические Восстановитель ные свойства увеличив аются
 Mg – металл, Сa, Sr, Ba - щёлочноземельные металлы Ra –радиоактивный элемент Ве - амфотерный металл,
Mg – металл, Сa, Sr, Ba - щёлочноземельные металлы Ra –радиоактивный элемент Ве - амфотерный металл,
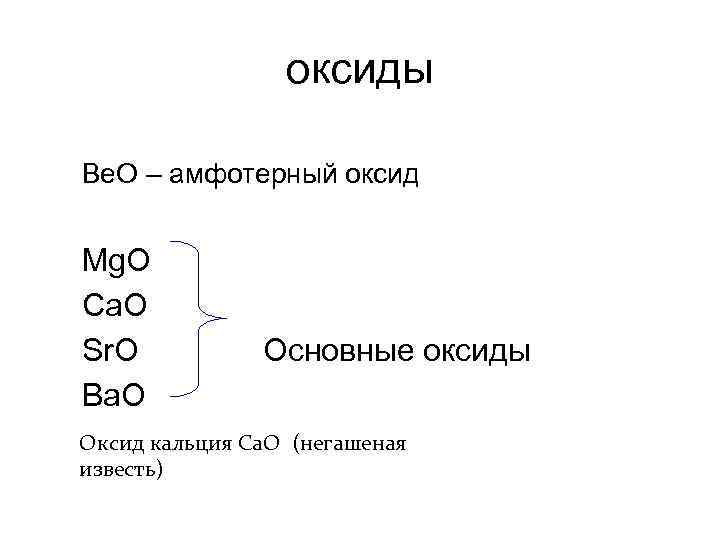 оксиды Be. O – амфотерный оксид Mg. O Ca. O Sr. O Основные оксиды Ba. O Оксид кальция Са. О (негашеная известь)
оксиды Be. O – амфотерный оксид Mg. O Ca. O Sr. O Основные оксиды Ba. O Оксид кальция Са. О (негашеная известь)
 Получения оксидов 1) Окисление металлов (кроме Ba, который образует пероксид) 2 Mg+O 2=2 Mg. O 2) Термическое разложение нитратов или карбонатов Ca. CO 3 –t° ® Ca. O + CO 2 2 Mg(NO 3)2 –t°® 2 Mg. O + 4 NO 2 + O 2
Получения оксидов 1) Окисление металлов (кроме Ba, который образует пероксид) 2 Mg+O 2=2 Mg. O 2) Термическое разложение нитратов или карбонатов Ca. CO 3 –t° ® Ca. O + CO 2 2 Mg(NO 3)2 –t°® 2 Mg. O + 4 NO 2 + O 2
 Химические свойства оксидов Типичные основные оксиды. Реагируют с водой (кроме Be. O), кислотными оксидами и кислотами Mg. O + H 2 O ® Mg(OH)2 3 Ca. O + P 2 O 5 ® Ca 3(PO 4)2 Be. O + 2 HNO 3 ® Be(NO 3)2 + H 2 O Be. O - амфотерный оксид, растворяется в щелочах Be. O + 2 Na. OH + H 2 O ® Na 2[Be(OH)4]
Химические свойства оксидов Типичные основные оксиды. Реагируют с водой (кроме Be. O), кислотными оксидами и кислотами Mg. O + H 2 O ® Mg(OH)2 3 Ca. O + P 2 O 5 ® Ca 3(PO 4)2 Be. O + 2 HNO 3 ® Be(NO 3)2 + H 2 O Be. O - амфотерный оксид, растворяется в щелочах Be. O + 2 Na. OH + H 2 O ® Na 2[Be(OH)4]
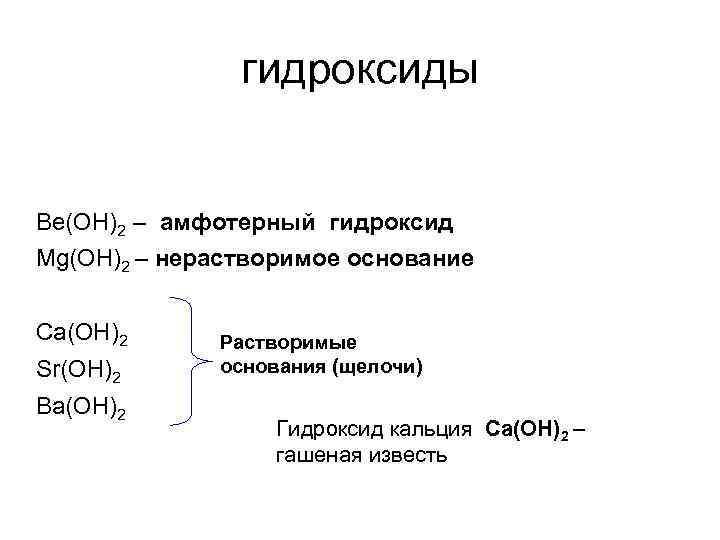 гидроксиды Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания (щелочи) Гидроксид кальция Са(ОН)2 – гашеная известь
гидроксиды Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания (щелочи) Гидроксид кальция Са(ОН)2 – гашеная известь
 Получение гидроксидов Реакции щелочноземельных металлов или их оксидов с водой: Ba + 2 H 2 O = Ba(OH)2 + H 2 Ca. O(негашеная известь) + H 2 O =Ca(OH)2(гашеная известь)
Получение гидроксидов Реакции щелочноземельных металлов или их оксидов с водой: Ba + 2 H 2 O = Ba(OH)2 + H 2 Ca. O(негашеная известь) + H 2 O =Ca(OH)2(гашеная известь)
 Химические свойства Гидроксиды R(OH)2 - белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера
Химические свойства Гидроксиды R(OH)2 - белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основность R(OH)2 увеличивается с увеличением атомного номера
 1) Реакции с кислотными оксидами: Ca(OH)2 + SO 2 ® Ca. SO 3 + H 2 O Ba(OH)2 + CO 2 ® Ba. CO 3 + H 2 O 2) Реакции с кислотами: Mg(OH)2 + 2 CH 3 COOH ® (CH 3 COO)2 Mg + 2 H 2 O Ba(OH)2 + 2 HNO 3 ® Ba(NO 3)2 + 2 H 2 O 3) Реакции обмена с солями: Ba(OH)2 + K 2 SO 4 ® Ba. SO 4+ 2 KOH 4) Реакция гидроксида бериллия со щелочами: Be(OH)2 + 2 Na. OH ® Na 2[Be(OH)4]
1) Реакции с кислотными оксидами: Ca(OH)2 + SO 2 ® Ca. SO 3 + H 2 O Ba(OH)2 + CO 2 ® Ba. CO 3 + H 2 O 2) Реакции с кислотами: Mg(OH)2 + 2 CH 3 COOH ® (CH 3 COO)2 Mg + 2 H 2 O Ba(OH)2 + 2 HNO 3 ® Ba(NO 3)2 + 2 H 2 O 3) Реакции обмена с солями: Ba(OH)2 + K 2 SO 4 ® Ba. SO 4+ 2 KOH 4) Реакция гидроксида бериллия со щелочами: Be(OH)2 + 2 Na. OH ® Na 2[Be(OH)4]
 Бериллий • В природе встречается только один стабильный нуклид 9 Be. Электронная конфигурация атома бериллия 1 s 22 s 2. Атомный радиус 0, 113 нм, радиус иона Ве 2+ — 0, 034 нм. В соединениях проявляет только степень окисления +2 (валентность II). Энергии последовательной ионизации атома Ве равны 9, 3227 и 18, 211 э. В. Значение электроотрицательности по Полингу 1, 57. В свободном виде — серебристо-серый легкий металл.
Бериллий • В природе встречается только один стабильный нуклид 9 Be. Электронная конфигурация атома бериллия 1 s 22 s 2. Атомный радиус 0, 113 нм, радиус иона Ве 2+ — 0, 034 нм. В соединениях проявляет только степень окисления +2 (валентность II). Энергии последовательной ионизации атома Ве равны 9, 3227 и 18, 211 э. В. Значение электроотрицательности по Полингу 1, 57. В свободном виде — серебристо-серый легкий металл.
 Свойства: • металлический бериллий характеризуется высокой хрупкостью. Температура плавления 1278°C, температура кипения около 2470°C, плотность 1, 816 кг/м 3. До температуры 1277°C устойчив a-Ве (гексагональная решетка типа магния (Mg), (1277 -1288°C) — b -Ве с кубической решеткой.
Свойства: • металлический бериллий характеризуется высокой хрупкостью. Температура плавления 1278°C, температура кипения около 2470°C, плотность 1, 816 кг/м 3. До температуры 1277°C устойчив a-Ве (гексагональная решетка типа магния (Mg), (1277 -1288°C) — b -Ве с кубической решеткой.
 • Химические свойства бериллия во многом похожи на свойства магния (Mg) и, особенно, алюминия (Al). Близость свойств бериллия и алюминия объясняется почти одинаковым отношением заряда катиона к его радиусу для ионов Be 2+ и Al 3+. (диагональное сходство)
• Химические свойства бериллия во многом похожи на свойства магния (Mg) и, особенно, алюминия (Al). Близость свойств бериллия и алюминия объясняется почти одинаковым отношением заряда катиона к его радиусу для ионов Be 2+ и Al 3+. (диагональное сходство)
 • На воздухе бериллий, как и алюминий, покрыт оксидной пленкой, придающей бериллию матовый цвет. Наличие оксидной пленки предохраняет металл от дальнейшего разрушения и обусловливает его невысокую химическую активность при комнатной температуре.
• На воздухе бериллий, как и алюминий, покрыт оксидной пленкой, придающей бериллию матовый цвет. Наличие оксидной пленки предохраняет металл от дальнейшего разрушения и обусловливает его невысокую химическую активность при комнатной температуре.
 Химические свойства: • При нагревании бериллий сгорает на воздухе с образованием оксида Be. O, реагирует с серой и азотом. С галогенами бериллий реагирует при обычной температуре или при слабом нагревании, например : • Be + Cl 2 = Ве. Сl 2 • Все эти реакции сопровождаются выделением большого количества теплоты, так как прочность кристаллических решеток возникающих соединений (Be. O, Be. S, Be 3 N 2, Ве. Сl 2 и др. ) довольно велика.
Химические свойства: • При нагревании бериллий сгорает на воздухе с образованием оксида Be. O, реагирует с серой и азотом. С галогенами бериллий реагирует при обычной температуре или при слабом нагревании, например : • Be + Cl 2 = Ве. Сl 2 • Все эти реакции сопровождаются выделением большого количества теплоты, так как прочность кристаллических решеток возникающих соединений (Be. O, Be. S, Be 3 N 2, Ве. Сl 2 и др. ) довольно велика.
 • Благодаря образованию на поверхности прочной пленки оксида бериллий не реагирует с водой, хотя находится в ряду стандартных потенциалов значительно левее водорода. Как и алюминий, бериллий реагирует с кислотами и растворами щелочей: • Be + 2 HCl = Be. Cl 2 + H 2, • Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] + H 2.
• Благодаря образованию на поверхности прочной пленки оксида бериллий не реагирует с водой, хотя находится в ряду стандартных потенциалов значительно левее водорода. Как и алюминий, бериллий реагирует с кислотами и растворами щелочей: • Be + 2 HCl = Be. Cl 2 + H 2, • Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] + H 2.
 • Гидроксид бериллия Be(OH)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: • Be(OH)2 + 2 КOH = К 2[Be(OH)4], • Be(OH)2 + 2 HСl = Be. Сl 2 + 2 H 2 O. • В большинстве соединений бериллий проявляет координационное число 4. Например, в структуре твердого Be. Cl 2 имеются цепочки с мостиковыми атомами хлора. • За счет образования прочных тетраэдрических анионов многие соединения бериллия вступают в реакции с солями других металлов: • Be. F 2 + 2 KF = K 2[Be. F 4]
• Гидроксид бериллия Be(OH)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: • Be(OH)2 + 2 КOH = К 2[Be(OH)4], • Be(OH)2 + 2 HСl = Be. Сl 2 + 2 H 2 O. • В большинстве соединений бериллий проявляет координационное число 4. Например, в структуре твердого Be. Cl 2 имеются цепочки с мостиковыми атомами хлора. • За счет образования прочных тетраэдрических анионов многие соединения бериллия вступают в реакции с солями других металлов: • Be. F 2 + 2 KF = K 2[Be. F 4]
 • С бериллий водородом(Н)непосредственно не взаимодействует. Гидрид бериллия Be. H 2 — полимерное вещество, его получают реакцией. • Be. Cl 2 + 2 Li. H = Be. H 2 + 2 Li. Cl, • проводимой в эфирном растворе. • Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be 4 O(CH 3 COO)6. Эти соединения содержат тетраэдрическую группировку Be 4 O, по шести ребрам этого тетраэдра располагаются ацетатные группы. Такие соединения играют большую роль в процессах очистки бериллия, так как они не растворяются в воде, но хорошо растворяются в органических растворителях и легко возгоняются в вакууме
• С бериллий водородом(Н)непосредственно не взаимодействует. Гидрид бериллия Be. H 2 — полимерное вещество, его получают реакцией. • Be. Cl 2 + 2 Li. H = Be. H 2 + 2 Li. Cl, • проводимой в эфирном растворе. • Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be 4 O(CH 3 COO)6. Эти соединения содержат тетраэдрическую группировку Be 4 O, по шести ребрам этого тетраэдра располагаются ацетатные группы. Такие соединения играют большую роль в процессах очистки бериллия, так как они не растворяются в воде, но хорошо растворяются в органических растворителях и легко возгоняются в вакууме
 Важнейшие соединения: • Оксид бериллия, Be. O встречается в природе в виде редкого минерала бромеллита. Получают термическим разложением сульфата или гидроксида бериллия выше 800° С. Продукт высокой чистоты образуется при разложении основного ацетата [Be 4 O(OOCH 3)6] выше 600°С. Непрокаленный оксид бериллия гигроскопичен, адсорбирует до 34% воды, а прокаленный при 1500° С — лишь 0, 18%. Оксид бериллия, прокаленный не выше 500°С, легко взаимодействует с кислотами, труднее — с растворами щелочей, а прокаленный выше 727° С — лишь со фтороводородной кислотой, горячей концентрированной серной кислотой и расплавами щелочей. Устойчив к воздействию расплавленных лития, натрия, калия, никеля и железа. Оксид бериллия обладает очень высокой теплопроводностью. Считается одним из лучших огнеупорных материалов, используется для изготовления тиглей и других изделий
Важнейшие соединения: • Оксид бериллия, Be. O встречается в природе в виде редкого минерала бромеллита. Получают термическим разложением сульфата или гидроксида бериллия выше 800° С. Продукт высокой чистоты образуется при разложении основного ацетата [Be 4 O(OOCH 3)6] выше 600°С. Непрокаленный оксид бериллия гигроскопичен, адсорбирует до 34% воды, а прокаленный при 1500° С — лишь 0, 18%. Оксид бериллия, прокаленный не выше 500°С, легко взаимодействует с кислотами, труднее — с растворами щелочей, а прокаленный выше 727° С — лишь со фтороводородной кислотой, горячей концентрированной серной кислотой и расплавами щелочей. Устойчив к воздействию расплавленных лития, натрия, калия, никеля и железа. Оксид бериллия обладает очень высокой теплопроводностью. Считается одним из лучших огнеупорных материалов, используется для изготовления тиглей и других изделий
 Гидроксид бериллия, Be(OH)2 • Гидроксид бериллия, Be(OH)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: • Be(OH)2 + 2 КOH = К 2[Be(OH)4], • Be(OH)2 + 2 HCl = Be. Cl 2 + 2 H 2 O. • Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be 4 O(CH 3 COO)6. Галогениды бериллия, бесцв. крист. вещества, расплываются на воздухе, поглощая влагу. Для получения безводного хлорида используется реакция • 2 Be. O + CCl 4 = 2 Be. Cl 2 + CO 2
Гидроксид бериллия, Be(OH)2 • Гидроксид бериллия, Be(OH)2 — полимерное соединение, нерастворимое в воде. Оно проявляет амфотерные свойства: • Be(OH)2 + 2 КOH = К 2[Be(OH)4], • Be(OH)2 + 2 HCl = Be. Cl 2 + 2 H 2 O. • Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be 4 O(CH 3 COO)6. Галогениды бериллия, бесцв. крист. вещества, расплываются на воздухе, поглощая влагу. Для получения безводного хлорида используется реакция • 2 Be. O + CCl 4 = 2 Be. Cl 2 + CO 2
 • Бериллаты, в концентрированных растворах и расплавах щелочей присутствуют бериллаты состава M 2 Be. O 2, M 3 Be. O 4, в разбавленных растворах гидроксобериллаты M 2[Be(OH)4]. Легко гидролизуются до гидроксида бериллия.
• Бериллаты, в концентрированных растворах и расплавах щелочей присутствуют бериллаты состава M 2 Be. O 2, M 3 Be. O 4, в разбавленных растворах гидроксобериллаты M 2[Be(OH)4]. Легко гидролизуются до гидроксида бериллия.
 • Гидрид бериллия, Be. H 2 — полимерное вещество, его получают реакцией: • Be. Cl 2 + 2 Li. H = Be. H 2 + 2 Li. Cl Карбид бериллия, Be 2 С — образуется при взаимодействии бериллия с углеродом. Подобно карбиду алюминия гидролизуется водой с образованием метана.
• Гидрид бериллия, Be. H 2 — полимерное вещество, его получают реакцией: • Be. Cl 2 + 2 Li. H = Be. H 2 + 2 Li. Cl Карбид бериллия, Be 2 С — образуется при взаимодействии бериллия с углеродом. Подобно карбиду алюминия гидролизуется водой с образованием метана.
 • Фторид бериллия – стекловидный материал. Его структура состоит из неупорядоченной сетки из атомов бериллия (КЧ 4), связанных мостиками из атомов фтора, и похожа на структуру кварцевого стекла. Выше 270° С фторид бериллия самопроизвольно кристаллизуется. Подобно кварцу, он существует в низкотемпературной a-форме, которая при 227° С переходит в b-форму. Кроме того, можно получить формы кристобалита и тридимита. Структурное сходство между Be. F 2 и Si. O 2 распространяется также на фторобериллаты (которые образуются при взаимодействии фторида бериллия с фторидами щелочных элементов и аммония) и силикаты. • Фторид бериллия – компонент фторобериллатных стекол и солевой смеси, используемой в ядерных реакторах на расплавленных солях.
• Фторид бериллия – стекловидный материал. Его структура состоит из неупорядоченной сетки из атомов бериллия (КЧ 4), связанных мостиками из атомов фтора, и похожа на структуру кварцевого стекла. Выше 270° С фторид бериллия самопроизвольно кристаллизуется. Подобно кварцу, он существует в низкотемпературной a-форме, которая при 227° С переходит в b-форму. Кроме того, можно получить формы кристобалита и тридимита. Структурное сходство между Be. F 2 и Si. O 2 распространяется также на фторобериллаты (которые образуются при взаимодействии фторида бериллия с фторидами щелочных элементов и аммония) и силикаты. • Фторид бериллия – компонент фторобериллатных стекол и солевой смеси, используемой в ядерных реакторах на расплавленных солях.
 Получение соединений бериллия и металлического бериллия: • извлечение бериллия из его природных минералов (в основном берилла) включает в себя несколько стадий, при этом особенно важно отделить бериллий от сходного по свойствам и сопутствующего бериллию в минералах алюминия. Можно, например, сплавить берилл с гексафторосиликатом натрия Na 2 Si. F 6: • Be 3 Al 2(Si. O 3)6 + 12 Na 2 Si. F 6 = 6 Na 2 Si. O 3 + 2 Na 3 Al. F 6 + 3 Na 2[Be. F 4] + 12 Si. F 4.
Получение соединений бериллия и металлического бериллия: • извлечение бериллия из его природных минералов (в основном берилла) включает в себя несколько стадий, при этом особенно важно отделить бериллий от сходного по свойствам и сопутствующего бериллию в минералах алюминия. Можно, например, сплавить берилл с гексафторосиликатом натрия Na 2 Si. F 6: • Be 3 Al 2(Si. O 3)6 + 12 Na 2 Si. F 6 = 6 Na 2 Si. O 3 + 2 Na 3 Al. F 6 + 3 Na 2[Be. F 4] + 12 Si. F 4.
 • В результате сплавления образуются криолит Na 3 Al. F 6 — плохо растворимое в воде соединение, а также растворимый в воде фторобериллат натрия (Na) Na 2[Be. F 4]. Его далее выщелачивают водой. Для более глубокой очистки бериллия от алюминия (Al) применяют обработку полученного раствора карбонатом аммония (NH 4)2 CO 3. При этом алюминий оседает в виде гидроксида Al(OH)3, а бериллий остается в растворе в виде растворимого комплекса (NH 4)2[Be(CO 3)2]. Этот комплекс затем разлагают до оксида бериллия Ве. О при прокаливании: • (NH 4)2[Be(CO 3)2] = Be. O + 2 CO 2 + 2 NH 3 + H 2 O
• В результате сплавления образуются криолит Na 3 Al. F 6 — плохо растворимое в воде соединение, а также растворимый в воде фторобериллат натрия (Na) Na 2[Be. F 4]. Его далее выщелачивают водой. Для более глубокой очистки бериллия от алюминия (Al) применяют обработку полученного раствора карбонатом аммония (NH 4)2 CO 3. При этом алюминий оседает в виде гидроксида Al(OH)3, а бериллий остается в растворе в виде растворимого комплекса (NH 4)2[Be(CO 3)2]. Этот комплекс затем разлагают до оксида бериллия Ве. О при прокаливании: • (NH 4)2[Be(CO 3)2] = Be. O + 2 CO 2 + 2 NH 3 + H 2 O
 • известен и такой способ переработки берилла. Исходный минерал сначала сплавляют с поташем K 2 CO 3. При этом образуются бериллат K 2 Be. O 2 и алюминат калия KAl. O 2: • Be 3 Al 2(Si. O 3)6 + 10 K 2 CO 3 = 3 K 2 Be. O 2 + 2 KAl. O 2 + 6 K 2 Si. O 3 + 10 CO 2
• известен и такой способ переработки берилла. Исходный минерал сначала сплавляют с поташем K 2 CO 3. При этом образуются бериллат K 2 Be. O 2 и алюминат калия KAl. O 2: • Be 3 Al 2(Si. O 3)6 + 10 K 2 CO 3 = 3 K 2 Be. O 2 + 2 KAl. O 2 + 6 K 2 Si. O 3 + 10 CO 2
 получение • После выщелачивания водой полученный раствор подкисляют серной кислотой. В результате в осадок выпадает кремниевая кислота. Из фильтрата далее осаждают алюмокалиевые квасцы, после чего в растворе из катионов остаются только ионы Ве 2+. • Из полученного тем или иным способом оксида бериллия Ве. О затем получают фторид, из которого магнийтермическим методом восстанавливают металлический бериллий: • Be. F 2 + Mg = Mg. F 2 + Be.
получение • После выщелачивания водой полученный раствор подкисляют серной кислотой. В результате в осадок выпадает кремниевая кислота. Из фильтрата далее осаждают алюмокалиевые квасцы, после чего в растворе из катионов остаются только ионы Ве 2+. • Из полученного тем или иным способом оксида бериллия Ве. О затем получают фторид, из которого магнийтермическим методом восстанавливают металлический бериллий: • Be. F 2 + Mg = Mg. F 2 + Be.
 • Металлический бериллий можно приготовить также электролизом расплава смеси Be. Cl 2 и Na. Cl при температурах около 300°C. Раньше бериллий получали электролизом расплава фторобериллата бария Ba[Be. F 4]: • Ba[Be. F 4] = Ba. F 2 + Be + F 2.
• Металлический бериллий можно приготовить также электролизом расплава смеси Be. Cl 2 и Na. Cl при температурах около 300°C. Раньше бериллий получали электролизом расплава фторобериллата бария Ba[Be. F 4]: • Ba[Be. F 4] = Ba. F 2 + Be + F 2.
 Mg — Магний • химический элемент IIА группы третьего периода периодической системы Менделеева, атомный номер 12, атомная масса 24, 305. Электронная конфигурация нейтрального атома 1 s 22 s 2 p 63 s 2, согласно которой магний в стабильных соединениях двухвалентен (степень окисления +2). Простое вещество магний — легкий, серебристо-белый блестящий металл.
Mg — Магний • химический элемент IIА группы третьего периода периодической системы Менделеева, атомный номер 12, атомная масса 24, 305. Электронная конфигурация нейтрального атома 1 s 22 s 2 p 63 s 2, согласно которой магний в стабильных соединениях двухвалентен (степень окисления +2). Простое вещество магний — легкий, серебристо-белый блестящий металл.
 • металлический магний обладает гексагональной кристаллической решеткой. Температура плавления 650°C, температура кипения 1105°C, плотность 1, 74 г/см 3 (магний — очень легкий металл, легче только кальций и щелочные металлы). Стандартный электродный потенциал магния Mg/Mg 2+ равен – 2, 37 В. В ряду стандартных потенциалов он расположен за натрием перед алюминием.
• металлический магний обладает гексагональной кристаллической решеткой. Температура плавления 650°C, температура кипения 1105°C, плотность 1, 74 г/см 3 (магний — очень легкий металл, легче только кальций и щелочные металлы). Стандартный электродный потенциал магния Mg/Mg 2+ равен – 2, 37 В. В ряду стандартных потенциалов он расположен за натрием перед алюминием.
 • Поверхность магния покрыта плотной пленкой оксида Mg. O, при обычных условиях надежно защищающей металл от дальнейшего разрушения. Только при нагревании металла до температуры выше примерно 600°C он загорается на воздухе. Горит магний с испусканием яркого света, по спектральному составу близкого к солнечному. Поэтому раньше фотографы при недостаточной освещенности проводили съемку в свете горящей ленты магния. При горении магния на воздухе образуется рыхлый белый порошок оксида магния Mg. O: • 2 Mg + O 2 = 2 Mg. O.
• Поверхность магния покрыта плотной пленкой оксида Mg. O, при обычных условиях надежно защищающей металл от дальнейшего разрушения. Только при нагревании металла до температуры выше примерно 600°C он загорается на воздухе. Горит магний с испусканием яркого света, по спектральному составу близкого к солнечному. Поэтому раньше фотографы при недостаточной освещенности проводили съемку в свете горящей ленты магния. При горении магния на воздухе образуется рыхлый белый порошок оксида магния Mg. O: • 2 Mg + O 2 = 2 Mg. O.
 • Одновременно с оксидом образуется и нитрид магния Mg 3 N 2: • 3 Mg + N 2 = Mg 3 N 2. • C холодной водой магний не реагирует (или, точнее, реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие, причем образуется рыхлый белый осадок гидроксида магния Mg(OH)2: • Mg + 2 H 2 O = Mg(OH)2 + H 2.
• Одновременно с оксидом образуется и нитрид магния Mg 3 N 2: • 3 Mg + N 2 = Mg 3 N 2. • C холодной водой магний не реагирует (или, точнее, реагирует, но крайне медленно), а с горячей водой он вступает во взаимодействие, причем образуется рыхлый белый осадок гидроксида магния Mg(OH)2: • Mg + 2 H 2 O = Mg(OH)2 + H 2.
 • Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа: • 2 Mg + CO 2 = 2 Mg. O + C. • Способность магния гореть как в воде, так и в атмосфере углекислого газа существенно усложняет тушение пожаров, при которых горят конструкции из магния или его сплавов.
• Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа: • 2 Mg + CO 2 = 2 Mg. O + C. • Способность магния гореть как в воде, так и в атмосфере углекислого газа существенно усложняет тушение пожаров, при которых горят конструкции из магния или его сплавов.
 • Оксид магния Mg. O представляет собой белый рыхлый порошок, не реагирующий с водой. Раньше его называли жженой магнезией или просто магнезией. Этот оксид обладает основными свойствами, он реагирует с различными кислотами, например: • Mg. O + 2 HNO 3 = Mg(NO 3)2 + H 2 O. • Отвечающее этому оксиду основание Mg(OH)2 — средней силы, но в воде практически нерастворимо. Его можно получить, например, добавляя щелочь к раствору какой-либо соли магния: • 2 Na. OH + Mg. SO 4 = Mg(OH)2 + Na 2 SO 4.
• Оксид магния Mg. O представляет собой белый рыхлый порошок, не реагирующий с водой. Раньше его называли жженой магнезией или просто магнезией. Этот оксид обладает основными свойствами, он реагирует с различными кислотами, например: • Mg. O + 2 HNO 3 = Mg(NO 3)2 + H 2 O. • Отвечающее этому оксиду основание Mg(OH)2 — средней силы, но в воде практически нерастворимо. Его можно получить, например, добавляя щелочь к раствору какой-либо соли магния: • 2 Na. OH + Mg. SO 4 = Mg(OH)2 + Na 2 SO 4.
 • Так как оксид магния Mg. O при взаимодействии с водой щелочей не образует, а основание магния Mg(OH)2 щелочными свойствами не обладает, магний, в отличие от своих «согруппников» — кальция, стронция и бария, не относится к числу щелочноземельных металлов.
• Так как оксид магния Mg. O при взаимодействии с водой щелочей не образует, а основание магния Mg(OH)2 щелочными свойствами не обладает, магний, в отличие от своих «согруппников» — кальция, стронция и бария, не относится к числу щелочноземельных металлов.
 • Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом: • Mg + Br 2 = Mg. Br 2. • При нагревании магний вступает во взаимодействие с серой, давая сульфид магния: • Mg + S = Mg. S.
• Металлический магний при комнатной температуре реагирует с галогенами, например, с бромом: • Mg + Br 2 = Mg. Br 2. • При нагревании магний вступает во взаимодействие с серой, давая сульфид магния: • Mg + S = Mg. S.
 • В поведении магния есть черты сходства с поведением щелочного металла лития (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния: • 3 Mg + N 2= Mg 3 N 2. • Как и нитрид лития, нитрид магния легко разлагается водой: • Mg 3 N 2 + 6 Н 2 О = 3 Mg(ОН)2 + 2 NН 3.
• В поведении магния есть черты сходства с поведением щелочного металла лития (пример диагонального сходства элементов в таблице Менделеева). Так, магний, как и литий, реагирует с азотом (реакция магния с азотом протекает при нагревании), в результате образуется нитрид магния: • 3 Mg + N 2= Mg 3 N 2. • Как и нитрид лития, нитрид магния легко разлагается водой: • Mg 3 N 2 + 6 Н 2 О = 3 Mg(ОН)2 + 2 NН 3.
 • Сходство с литием проявляется у магния и в том, что его карбонат Mg. CO 3 и фосфат Mg 3(PO 4)2 в воде плохо растворимы, как и соответствующие соли лития. • С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды. Как и в случае гидрокарбоната кальция, жесткость, вызванная гидрокарбонатом магния Mg(HCO 3)2, — временная. При кипячении гидрокарбонат магния Mg(HCO 3)2 разлагается и в осадок выпадает его основной карбонат — гидроксокарбонат магния (Mg. OH)2 CO 3: • 2 Mg(HCO 3)2 = (Mg. OH)2 CO 3 + 3 CO 2 + Н 2 О.
• Сходство с литием проявляется у магния и в том, что его карбонат Mg. CO 3 и фосфат Mg 3(PO 4)2 в воде плохо растворимы, как и соответствующие соли лития. • С кальцием магний сближает то, что присутствие в воде растворимых гидрокарбонатов этих элементов обусловливает жесткость воды. Как и в случае гидрокарбоната кальция, жесткость, вызванная гидрокарбонатом магния Mg(HCO 3)2, — временная. При кипячении гидрокарбонат магния Mg(HCO 3)2 разлагается и в осадок выпадает его основной карбонат — гидроксокарбонат магния (Mg. OH)2 CO 3: • 2 Mg(HCO 3)2 = (Mg. OH)2 CO 3 + 3 CO 2 + Н 2 О.
 Получение: • обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния Mg. Cl 2, натрия Na. Cl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния: • Mg. Cl 2 (электролиз) = Mg + Cl 2.
Получение: • обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния Mg. Cl 2, натрия Na. Cl и калия KCl. В этом расплаве электрохимическому восстановлению подвергается хлорид магния: • Mg. Cl 2 (электролиз) = Mg + Cl 2.
 • Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс: • Mg. O + C = Mg + CO • или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит Ca. CO 3·Mg. CO 3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: • Ca. CO 3·Mg. CO 3 = Ca. O + Mg. O + 2 CO 2, • 2 Mg. O + 2 Ca. O + Si = Ca 2 Si. O 4 + 2 Mg. • Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
• Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс: • Mg. O + C = Mg + CO • или кремний. Применение кремния позволяет получать магний из такого сырья, как доломит Ca. CO 3·Mg. CO 3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции: • Ca. CO 3·Mg. CO 3 = Ca. O + Mg. O + 2 CO 2, • 2 Mg. O + 2 Ca. O + Si = Ca 2 Si. O 4 + 2 Mg. • Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
 • Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например: • 2 Mg + Ti. O 2 = 2 Mg. O + Ti. . • Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат.
• Высокая химическая активность металлического магния позволяет использовать его при магниетермическом получении таких металлов, как титан, цирконий, ванадий, уран и др. При этом магний реагирует с оксидом или фторидом получаемого металла, например: • 2 Mg + Ti. O 2 = 2 Mg. O + Ti. . • Широкое применение находят многие соединения магния, особенно его оксид, карбонат и сульфат.
 Карбонаты бериллия и магния Ве. СО 3 -представляет собой бесцветное кристаллическое вещество, карбонат бериллия не имеет запаха, но, как все соединения бериллия, обладает сладковатым вкусом Средний карбонат при н. у. неустойчив , разлагается Be. CO 3=Be. O+CO 2 тетрагидрат основного карбоната (Ве. СО 3 • 4 Н 2 О) — при нормальных условиях сравнительно неустойчив, при нагревании разлаается
Карбонаты бериллия и магния Ве. СО 3 -представляет собой бесцветное кристаллическое вещество, карбонат бериллия не имеет запаха, но, как все соединения бериллия, обладает сладковатым вкусом Средний карбонат при н. у. неустойчив , разлагается Be. CO 3=Be. O+CO 2 тетрагидрат основного карбоната (Ве. СО 3 • 4 Н 2 О) — при нормальных условиях сравнительно неустойчив, при нагревании разлаается
![основной карбонат ([Be. ОН]2 CO 3) — сравнительно устойчив на воздухе, при температуре выше основной карбонат ([Be. ОН]2 CO 3) — сравнительно устойчив на воздухе, при температуре выше](https://present5.com/presentation/3/111676230_84467293.pdf-img/111676230_84467293.pdf-47.jpg) основной карбонат ([Be. ОН]2 CO 3) — сравнительно устойчив на воздухе, при температуре выше 100°С быстро разлагается на Be. O , углекислый газ и воду ([Be. OH]2 CO 3)=Be. O+CO 2+H 2 O
основной карбонат ([Be. ОН]2 CO 3) — сравнительно устойчив на воздухе, при температуре выше 100°С быстро разлагается на Be. O , углекислый газ и воду ([Be. OH]2 CO 3)=Be. O+CO 2+H 2 O
 Получение: • Ве. СО 3 получают путем взаимодействия оксида бериллия и углекислого газа (при повышенном давлении) • Ве. О+СO 2=Be. CO 3 • Ве. СО 3 • 4 Н 2 О образуется при пропускании большого избытка СО 2 через раствор Ве(ОН)2 (полученный осадок фильтруют и высушивают в атмосфере СО 2): Be(OH)2+CO 2+3 H 2 O= Ве. СО 3 • 4 Н 2 О • [Be. ОН]2 CO 3 может быть получен при взаимодействии растворимых солей бериллия (например, сульфата или хлорида бериллия) и карбонатов щелочных металлов или аммония: • Be. Cl 2+2 Na 2 CO 3+H 2 O= [Be. ОН]2 CO 3+4 Na. Cl+CO 2
Получение: • Ве. СО 3 получают путем взаимодействия оксида бериллия и углекислого газа (при повышенном давлении) • Ве. О+СO 2=Be. CO 3 • Ве. СО 3 • 4 Н 2 О образуется при пропускании большого избытка СО 2 через раствор Ве(ОН)2 (полученный осадок фильтруют и высушивают в атмосфере СО 2): Be(OH)2+CO 2+3 H 2 O= Ве. СО 3 • 4 Н 2 О • [Be. ОН]2 CO 3 может быть получен при взаимодействии растворимых солей бериллия (например, сульфата или хлорида бериллия) и карбонатов щелочных металлов или аммония: • Be. Cl 2+2 Na 2 CO 3+H 2 O= [Be. ОН]2 CO 3+4 Na. Cl+CO 2
 Карбонат магния Mg. CO 3 Бесцветные кристаллы, плотность 3, 037 г/см³. При температуре 500 °C заметно, а при 650 °C полностью разлагается: Mg. CO 3=Mg. O+CO 2 При насыщении CO 2 водной суспензии Mg. CO 3 последний растворяется вследствие образования гидрокарбоната Мg(HCO 3)2
Карбонат магния Mg. CO 3 Бесцветные кристаллы, плотность 3, 037 г/см³. При температуре 500 °C заметно, а при 650 °C полностью разлагается: Mg. CO 3=Mg. O+CO 2 При насыщении CO 2 водной суспензии Mg. CO 3 последний растворяется вследствие образования гидрокарбоната Мg(HCO 3)2
 Применение: Основной карбонат магния 3 Mg. CO 3·Mg(OH)2· 3 H 2 O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов. В медицине и в качестве пищевой добавки E 504 используется основной карбонат магния 4 Mg. CO 3·Mg(OH)2·n. H 2 O Спортивная магнезия 4 Mg. CO 3·Mg(OH)2· 4 H 2 O используется для подсушивания рук и, как следствие, увеличения надежности хвата. Карбонат магния необходим в производстве стекла, цемента, кирпича
Применение: Основной карбонат магния 3 Mg. CO 3·Mg(OH)2· 3 H 2 O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов. В медицине и в качестве пищевой добавки E 504 используется основной карбонат магния 4 Mg. CO 3·Mg(OH)2·n. H 2 O Спортивная магнезия 4 Mg. CO 3·Mg(OH)2· 4 H 2 O используется для подсушивания рук и, как следствие, увеличения надежности хвата. Карбонат магния необходим в производстве стекла, цемента, кирпича

