ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ Найважливішими сполуками



18784-geterocikli-vi-13.ppt
- Количество слайдов: 20
 ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ Найважливішими сполуками є піридин, хінолін, ізохінолін, акридин. Піридин і його похідні. Піридин і його гомологи метилпіридини (піколіни) і диметилпіридини (лутидини) oдержують з кісткової олії, кам’яновугільної смоли або сухою перегонкою торфу, деревини тощо. Синтетично – піролізом суміші С2Н2 з HCN: За пропускання акролеїну разом з амоніаком над Al2O3 за 35 °С одержують 3-піколін: Нагріваючи оцтовий альдегід із надлишком амоніаку в автоклаві, одержують 2‑метил-5-етилпіридин: Фізичні та спектральні властивості піридину. Піридин – рідина з неприємним запахом, добре розчинна у воді та в органічних розчинниках. Є розчинником органічних і неорганічних сполук. УФ-спектри піридину мають максимуми поглинання при 170 нм (інтенсивний), 200 і 250 нм. Будова молекули піридину плоска: Піридинове ядро не є рівностороннім шестикутником: довжина зв’язків C–С (0, 139 нм) і C–N (0, 134 нм). N в шестичленному кільці майже не впливає на його стабільність: ‑електронна густина кільця зміщена в бік N і в положеннях 1, 4, 6 (, , ) з’являються позитивні заряди. Енергія спряження його молекули: Ec= 116,7 кДж·моль–1. Отже, за будовою молекула піридину відповідає вимогам правила ароматичності Хюккеля.
ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ Найважливішими сполуками є піридин, хінолін, ізохінолін, акридин. Піридин і його похідні. Піридин і його гомологи метилпіридини (піколіни) і диметилпіридини (лутидини) oдержують з кісткової олії, кам’яновугільної смоли або сухою перегонкою торфу, деревини тощо. Синтетично – піролізом суміші С2Н2 з HCN: За пропускання акролеїну разом з амоніаком над Al2O3 за 35 °С одержують 3-піколін: Нагріваючи оцтовий альдегід із надлишком амоніаку в автоклаві, одержують 2‑метил-5-етилпіридин: Фізичні та спектральні властивості піридину. Піридин – рідина з неприємним запахом, добре розчинна у воді та в органічних розчинниках. Є розчинником органічних і неорганічних сполук. УФ-спектри піридину мають максимуми поглинання при 170 нм (інтенсивний), 200 і 250 нм. Будова молекули піридину плоска: Піридинове ядро не є рівностороннім шестикутником: довжина зв’язків C–С (0, 139 нм) і C–N (0, 134 нм). N в шестичленному кільці майже не впливає на його стабільність: ‑електронна густина кільця зміщена в бік N і в положеннях 1, 4, 6 (, , ) з’являються позитивні заряди. Енергія спряження його молекули: Ec= 116,7 кДж·моль–1. Отже, за будовою молекула піридину відповідає вимогам правила ароматичності Хюккеля.
 Хімічні властивості піридину. Основні властивості. Піридин завдяки вільній парі електронів на атомі Нітрогену виявляє слабкі основні властивості. Основні властивості піридину сильніші, ніж аніліну, але набагато слабкіші, ніж аліфатичних амінів. Основні властивості піридин виявляє в реакції з водою, при взаємодії з кислотами він легко утворює солі: Аналогічні сполуки з водою і кислотами утворюють і гомологи піридину (з пікриновою кислотою утворюють пікрати - це використовують для ідентифікації сполук, що містять піридиновий цикл. Піридин легко приєднує галогеналкани і утворює солі алкілпіридинію, які при нагріванні перегруповуються в солі α- або γ-алкілпіридинію. Наприклад: Атом N в молекулі піридину виявляє –I- і –M-ефекти. Тому піридин значно важче, ніж бензен, вступає в реакції SE-реакції а в реакцію ацилування не вступає зовсім. Реакція нітрування відбувається в ‑положення за більш жорстких умов, ніж для бензену (300 °С в суміші KNO3, H2 SO4, SO3), який при відновленні може перетворюватись у β-амінопіридин: Піридин сульфується олеумом за присутності Hg2+, а хлорується в газовій фазі: На відміну від бензену, піридин вступає в SN-реакції в положення 2, 4 і 6 положення, де нижча електронна густина.
Хімічні властивості піридину. Основні властивості. Піридин завдяки вільній парі електронів на атомі Нітрогену виявляє слабкі основні властивості. Основні властивості піридину сильніші, ніж аніліну, але набагато слабкіші, ніж аліфатичних амінів. Основні властивості піридин виявляє в реакції з водою, при взаємодії з кислотами він легко утворює солі: Аналогічні сполуки з водою і кислотами утворюють і гомологи піридину (з пікриновою кислотою утворюють пікрати - це використовують для ідентифікації сполук, що містять піридиновий цикл. Піридин легко приєднує галогеналкани і утворює солі алкілпіридинію, які при нагріванні перегруповуються в солі α- або γ-алкілпіридинію. Наприклад: Атом N в молекулі піридину виявляє –I- і –M-ефекти. Тому піридин значно важче, ніж бензен, вступає в реакції SE-реакції а в реакцію ацилування не вступає зовсім. Реакція нітрування відбувається в ‑положення за більш жорстких умов, ніж для бензену (300 °С в суміші KNO3, H2 SO4, SO3), який при відновленні може перетворюватись у β-амінопіридин: Піридин сульфується олеумом за присутності Hg2+, а хлорується в газовій фазі: На відміну від бензену, піридин вступає в SN-реакції в положення 2, 4 і 6 положення, де нижча електронна густина.
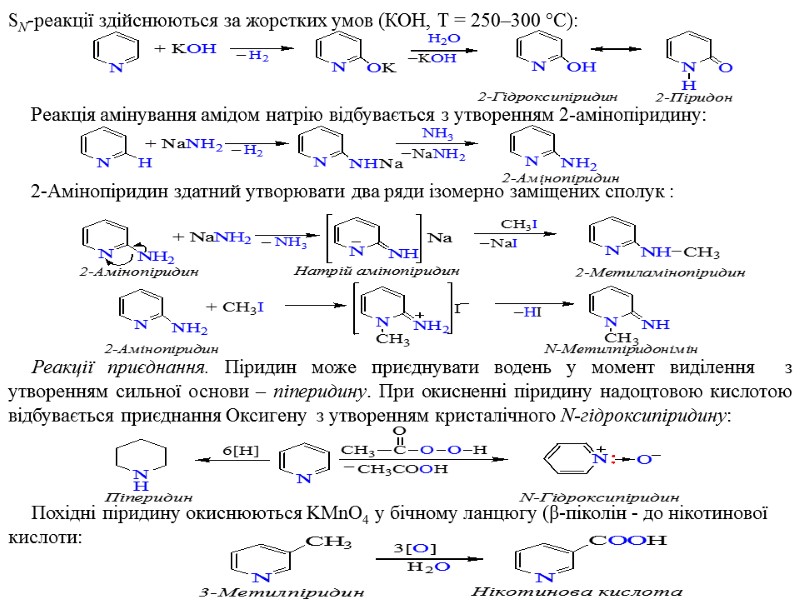
 SN-реакції здійснюються за жорстких умов (КОН, Т = 250–300 °С): Реакція амінування амідом натрію відбувається з утворенням 2-амінопіридину: 2-Амінопіридин здатний утворювати два ряди ізомерно заміщених сполук : Реакції приєднання. Піридин може приєднувати водень у момент виділення з утворенням сильної основи – піперидину. При окисненні піридину надоцтовою кислотою відбувається приєднання Оксигену з утворенням кристалічного N-гідроксипіридину: Похідні піридину окиснюються KMnO4 у бічному ланцюгу (β-піколін - до нікотинової кислоти:
SN-реакції здійснюються за жорстких умов (КОН, Т = 250–300 °С): Реакція амінування амідом натрію відбувається з утворенням 2-амінопіридину: 2-Амінопіридин здатний утворювати два ряди ізомерно заміщених сполук : Реакції приєднання. Піридин може приєднувати водень у момент виділення з утворенням сильної основи – піперидину. При окисненні піридину надоцтовою кислотою відбувається приєднання Оксигену з утворенням кристалічного N-гідроксипіридину: Похідні піридину окиснюються KMnO4 у бічному ланцюгу (β-піколін - до нікотинової кислоти:
 N-Гідроксипіридин значно активніше вступає в реакції електрофільного заміщення з утворенням 4-нітро-N-гідроксипіридину, який при взаємодії з PCl3 перетворюється на 4-нітропіридин: До N-оксипіридину подібний за будовою піридинсульфотриоксид, який є ефективним м’яким сульфуючим реагентом для сульфування органічних речовин. Він утворюється при взаємодії піридину з сульфур(VI) оксидом: Біологічне і практичне значення піридину та його похідних. Похідні амінопіридину (наприклад, сульфідин) є відомими антибактеріальними препаратами, що затримують розвиток мікроорганізмів, особливо менінгококів і пневмококів. Гомологи піридину – піколіни використовують для одержання ‑піридинкарбонової (нікотинової) кислоти. Нікотинова кислота та її амід є вітаміном РР, що застосовуються в медицині для лікування пелагри. Нікотинамід є складовою частиною ферментних систем, що відповідають за окисно-відновні процеси в організмі. Із нікотинової кислоти одержують кордіамін (діетиламід нікотинової кислоти) – ефективний стимулятор центральної нервової системи. До похідних піридину належать також вітаміни групи B6: Біологічну дію мають піридоксаль та піридоксамін, а піридоксальфосфат входить до ряду ферментів, що каталізують перетворення амінокислот в організмі, біосинтез пуринових основ та гемоглобіну. Піперидинове кільце входить до з найефективніших анестетиків – промедолу та деяких алкалоїдів, зокрема піперину, який міститься у перці, алкалоїду коніїну, що міститься у рослині болиголов та інших.
N-Гідроксипіридин значно активніше вступає в реакції електрофільного заміщення з утворенням 4-нітро-N-гідроксипіридину, який при взаємодії з PCl3 перетворюється на 4-нітропіридин: До N-оксипіридину подібний за будовою піридинсульфотриоксид, який є ефективним м’яким сульфуючим реагентом для сульфування органічних речовин. Він утворюється при взаємодії піридину з сульфур(VI) оксидом: Біологічне і практичне значення піридину та його похідних. Похідні амінопіридину (наприклад, сульфідин) є відомими антибактеріальними препаратами, що затримують розвиток мікроорганізмів, особливо менінгококів і пневмококів. Гомологи піридину – піколіни використовують для одержання ‑піридинкарбонової (нікотинової) кислоти. Нікотинова кислота та її амід є вітаміном РР, що застосовуються в медицині для лікування пелагри. Нікотинамід є складовою частиною ферментних систем, що відповідають за окисно-відновні процеси в організмі. Із нікотинової кислоти одержують кордіамін (діетиламід нікотинової кислоти) – ефективний стимулятор центральної нервової системи. До похідних піридину належать також вітаміни групи B6: Біологічну дію мають піридоксаль та піридоксамін, а піридоксальфосфат входить до ряду ферментів, що каталізують перетворення амінокислот в організмі, біосинтез пуринових основ та гемоглобіну. Піперидинове кільце входить до з найефективніших анестетиків – промедолу та деяких алкалоїдів, зокрема піперину, який міститься у перці, алкалоїду коніїну, що міститься у рослині болиголов та інших.
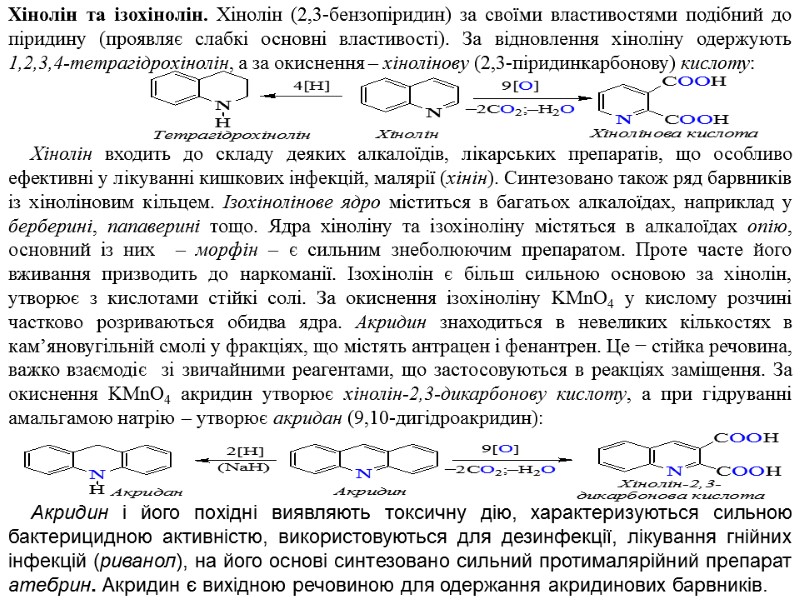
 Хінолін та ізохінолін. Хінолін (2,3‑бензопіридин) за своїми властивостями подібний до піридину (проявляє слабкі основні властивості). За відновлення хіноліну одержують 1,2,3,4-тетрагідрохінолін, а за окиснення – хінолінову (2,3-піридинкарбонову) кислоту: Хінолін входить до складу деяких алкалоїдів, лікарських препаратів, що особливо ефективні у лікуванні кишкових інфекцій, малярії (хінін). Синтезовано також ряд барвників із хіноліновим кільцем. Ізохінолінове ядро міститься в багатьох алкалоїдах, наприклад у берберині, папаверині тощо. Ядра хіноліну та ізохіноліну містяться в алкалоїдах опію, основний із них – морфін – є сильним знеболюючим препаратом. Проте часте його вживання призводить до наркоманії. Ізохінолін є більш сильною основою за хінолін, утворює з кислотами стійкі солі. За окиснення ізохіноліну KMnO4 у кислому розчині частково розриваються обидва ядра. Акридин знаходиться в невеликих кількостях в кам’яновугільній смолі у фракціях, що містять антрацен і фенантрен. Це − стійка речовина, важко взаємодіє зі звичайними реагентами, що застосовуються в реакціях заміщення. За окиснення KMnO4 акридин утворює хінолін-2,3-дикарбонову кислоту, а при гідруванні амальгамою натрію – утворює акридан (9,10‑дигідроакридин): Акридин і його похідні виявляють токсичну дію, характеризуються сильною бактерицидною активністю, використовуються для дезинфекції, лікування гнійних інфекцій (риванол), на його основі синтезовано сильний протималярійний препарат атебрин. Акридин є вихідною речовиною для одержання акридинових барвників.
Хінолін та ізохінолін. Хінолін (2,3‑бензопіридин) за своїми властивостями подібний до піридину (проявляє слабкі основні властивості). За відновлення хіноліну одержують 1,2,3,4-тетрагідрохінолін, а за окиснення – хінолінову (2,3-піридинкарбонову) кислоту: Хінолін входить до складу деяких алкалоїдів, лікарських препаратів, що особливо ефективні у лікуванні кишкових інфекцій, малярії (хінін). Синтезовано також ряд барвників із хіноліновим кільцем. Ізохінолінове ядро міститься в багатьох алкалоїдах, наприклад у берберині, папаверині тощо. Ядра хіноліну та ізохіноліну містяться в алкалоїдах опію, основний із них – морфін – є сильним знеболюючим препаратом. Проте часте його вживання призводить до наркоманії. Ізохінолін є більш сильною основою за хінолін, утворює з кислотами стійкі солі. За окиснення ізохіноліну KMnO4 у кислому розчині частково розриваються обидва ядра. Акридин знаходиться в невеликих кількостях в кам’яновугільній смолі у фракціях, що містять антрацен і фенантрен. Це − стійка речовина, важко взаємодіє зі звичайними реагентами, що застосовуються в реакціях заміщення. За окиснення KMnO4 акридин утворює хінолін-2,3-дикарбонову кислоту, а при гідруванні амальгамою натрію – утворює акридан (9,10‑дигідроакридин): Акридин і його похідні виявляють токсичну дію, характеризуються сильною бактерицидною активністю, використовуються для дезинфекції, лікування гнійних інфекцій (риванол), на його основі синтезовано сильний протималярійний препарат атебрин. Акридин є вихідною речовиною для одержання акридинових барвників.
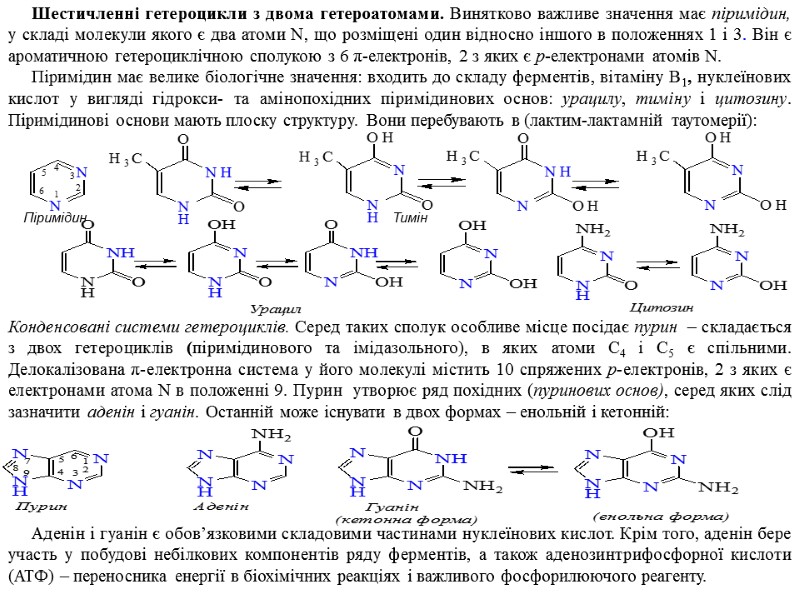
 Шестичленні гетероцикли з двома гетероатомами. Винятково важливе значення має піримідин, у складі молекули якого є два атоми N, що розміщені один відносно іншого в положеннях 1 і 3. Він є ароматичною гетероциклічною сполукою з 6 π-електронів, 2 з яких є р-електронами атомів N. Піримідин має велике біологічне значення: входить до складу ферментів, вітаміну B1, нуклеїнових кислот у вигляді гідрокси- та амінопохідних піримідинових основ: урацилу, тиміну і цитозину. Піримідинові основи мають плоску структуру. Вони перебувають в (лактим-лактамній таутомерії): Піримідин Тимін Конденсовані системи гетероциклів. Серед таких сполук особливе місце посідає пурин – складається з двох гетероциклів (піримідинового та імідазольного), в яких атоми C4 і C5 є спільними. Делокалізована π-електронна система у його молекулі містить 10 спряжених р-електронів, 2 з яких є електронами атома N в положенні 9. Пурин утворює ряд похідних (пуринових основ), серед яких слід зазначити аденін і гуанін. Останній може існувати в двох формах – енольній і кетонній: Аденін і гуанін є обов’язковими складовими частинами нуклеїнових кислот. Крім того, аденін бере участь у побудові небілкових компонентів ряду ферментів, а також аденозинтрифосфорної кислоти (АТФ) – переносника енергії в біохімічних реакціях і важливого фосфорилюючого реагенту.
Шестичленні гетероцикли з двома гетероатомами. Винятково важливе значення має піримідин, у складі молекули якого є два атоми N, що розміщені один відносно іншого в положеннях 1 і 3. Він є ароматичною гетероциклічною сполукою з 6 π-електронів, 2 з яких є р-електронами атомів N. Піримідин має велике біологічне значення: входить до складу ферментів, вітаміну B1, нуклеїнових кислот у вигляді гідрокси- та амінопохідних піримідинових основ: урацилу, тиміну і цитозину. Піримідинові основи мають плоску структуру. Вони перебувають в (лактим-лактамній таутомерії): Піримідин Тимін Конденсовані системи гетероциклів. Серед таких сполук особливе місце посідає пурин – складається з двох гетероциклів (піримідинового та імідазольного), в яких атоми C4 і C5 є спільними. Делокалізована π-електронна система у його молекулі містить 10 спряжених р-електронів, 2 з яких є електронами атома N в положенні 9. Пурин утворює ряд похідних (пуринових основ), серед яких слід зазначити аденін і гуанін. Останній може існувати в двох формах – енольній і кетонній: Аденін і гуанін є обов’язковими складовими частинами нуклеїнових кислот. Крім того, аденін бере участь у побудові небілкових компонентів ряду ферментів, а також аденозинтрифосфорної кислоти (АТФ) – переносника енергії в біохімічних реакціях і важливого фосфорилюючого реагенту.
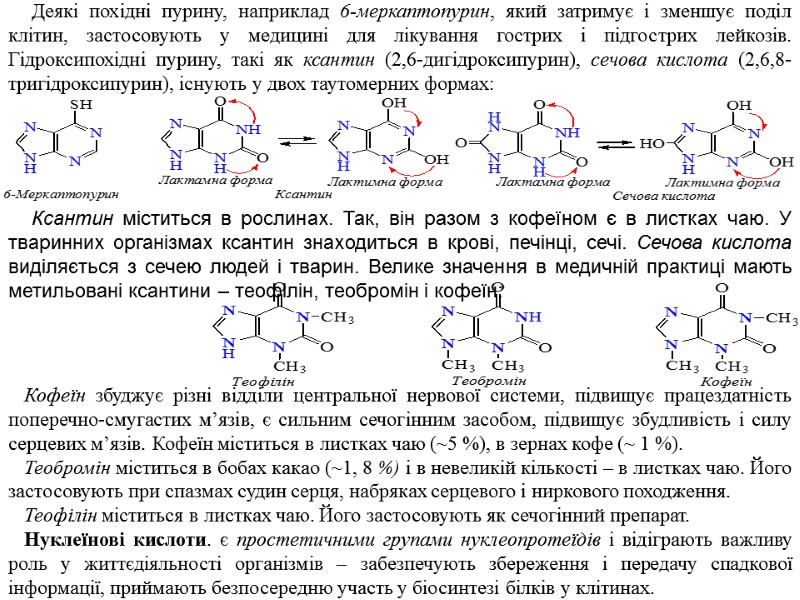
 Деякі похідні пурину, наприклад 6-меркаптопурин, який затримує і зменшує поділ клітин, застосовують у медицині для лікування гострих і підгострих лейкозів. Гідроксипохідні пурину, такі як ксантин (2,6-дигідроксипурин), сечова кислота (2,6,8-тригідроксипурин), існують у двох таутомерних формах: Ксантин міститься в рослинах. Так, він разом з кофеїном є в листках чаю. У тваринних організмах ксантин знаходиться в крові, печінці, сечі. Сечова кислота виділяється з сечею людей і тварин. Велике значення в медичній практиці мають метильовані ксантини – теофілін, теобромін і кофеїн: Кофеїн збуджує різні відділи центральної нервової системи, підвищує працездатність поперечно-смугастих м’язів, є сильним сечогінним засобом, підвищує збудливість і силу серцевих м’язів. Кофеїн міститься в листках чаю (~5 %), в зернах кофе (~ 1 %). Теобромін міститься в бобах какао (~1, 8 %) і в невеликій кількості – в листках чаю. Його застосовують при спазмах судин серця, набряках серцевого і ниркового походження. Теофілін міститься в листках чаю. Його застосовують як сечогінний препарат. Нуклеїнові кислоти. є простетичними групами нуклеопротеїдів і відіграють важливу роль у життєдіяльності організмів – забезпечують збереження і передачу спадкової інформації, приймають безпосередню участь у біосинтезі білків у клітинах.
Деякі похідні пурину, наприклад 6-меркаптопурин, який затримує і зменшує поділ клітин, застосовують у медицині для лікування гострих і підгострих лейкозів. Гідроксипохідні пурину, такі як ксантин (2,6-дигідроксипурин), сечова кислота (2,6,8-тригідроксипурин), існують у двох таутомерних формах: Ксантин міститься в рослинах. Так, він разом з кофеїном є в листках чаю. У тваринних організмах ксантин знаходиться в крові, печінці, сечі. Сечова кислота виділяється з сечею людей і тварин. Велике значення в медичній практиці мають метильовані ксантини – теофілін, теобромін і кофеїн: Кофеїн збуджує різні відділи центральної нервової системи, підвищує працездатність поперечно-смугастих м’язів, є сильним сечогінним засобом, підвищує збудливість і силу серцевих м’язів. Кофеїн міститься в листках чаю (~5 %), в зернах кофе (~ 1 %). Теобромін міститься в бобах какао (~1, 8 %) і в невеликій кількості – в листках чаю. Його застосовують при спазмах судин серця, набряках серцевого і ниркового походження. Теофілін міститься в листках чаю. Його застосовують як сечогінний препарат. Нуклеїнові кислоти. є простетичними групами нуклеопротеїдів і відіграють важливу роль у життєдіяльності організмів – забезпечують збереження і передачу спадкової інформації, приймають безпосередню участь у біосинтезі білків у клітинах.
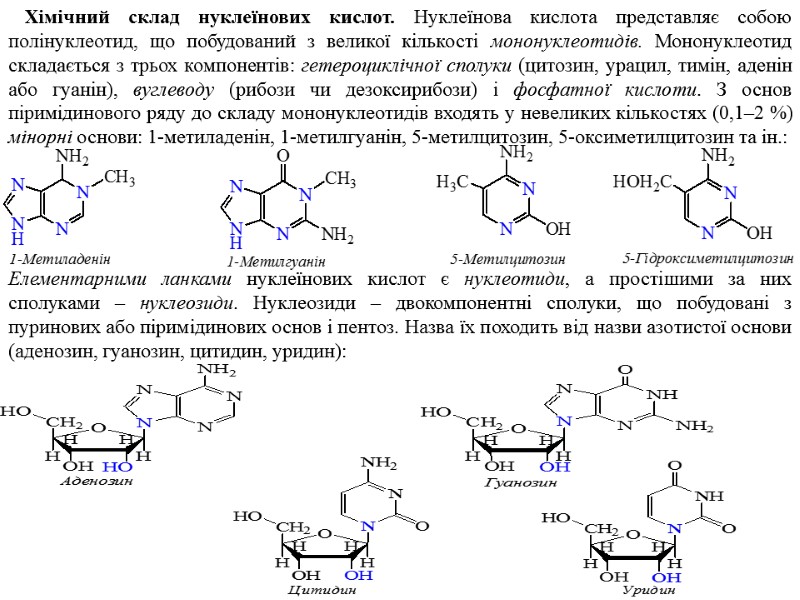
 Хімічний склад нуклеїнових кислот. Нуклеїнова кислота представляє собою полінуклеотид, що побудований з великої кількості мононуклеотидів. Мононуклеотид складається з трьох компонентів: гетероциклічної сполуки (цитозин, урацил, тимін, аденін або гуанін), вуглеводу (рибози чи дезоксирибози) і фосфатної кислоти. З основ піримідинового ряду до складу мононуклеотидів входять у невеликих кількостях (0,1–2 %) мінорні основи: 1-метиладенін, 1-метилгуанін, 5-метилцитозин, 5-оксиметилцитозин та ін.: Елементарними ланками нуклеїнових кислот є нуклеотиди, а простішими за них сполуками – нуклеозиди. Нуклеозиди – двокомпонентні сполуки, що побудовані з пуринових або піримідинових основ і пентоз. Назва їх походить від назви азотистої основи (аденозин, гуанозин, цитидин, уридин):
Хімічний склад нуклеїнових кислот. Нуклеїнова кислота представляє собою полінуклеотид, що побудований з великої кількості мононуклеотидів. Мононуклеотид складається з трьох компонентів: гетероциклічної сполуки (цитозин, урацил, тимін, аденін або гуанін), вуглеводу (рибози чи дезоксирибози) і фосфатної кислоти. З основ піримідинового ряду до складу мононуклеотидів входять у невеликих кількостях (0,1–2 %) мінорні основи: 1-метиладенін, 1-метилгуанін, 5-метилцитозин, 5-оксиметилцитозин та ін.: Елементарними ланками нуклеїнових кислот є нуклеотиди, а простішими за них сполуками – нуклеозиди. Нуклеозиди – двокомпонентні сполуки, що побудовані з пуринових або піримідинових основ і пентоз. Назва їх походить від назви азотистої основи (аденозин, гуанозин, цитидин, уридин):
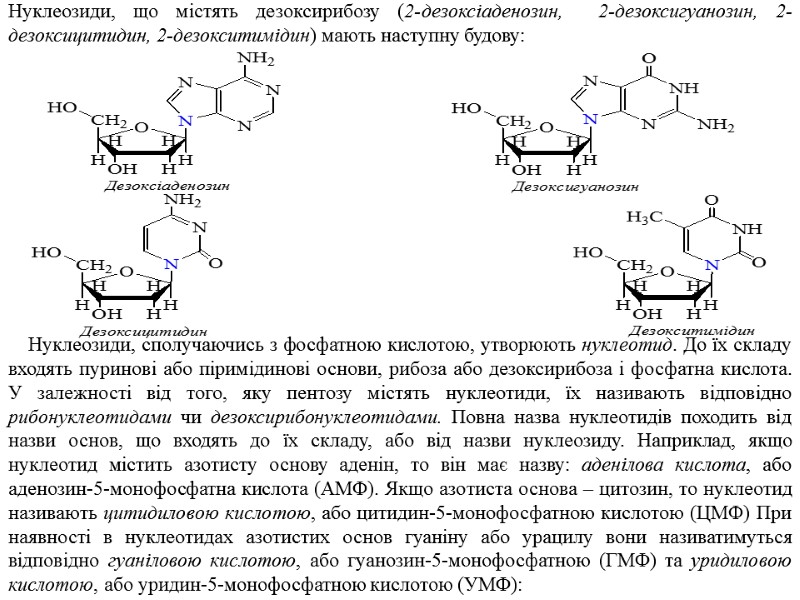
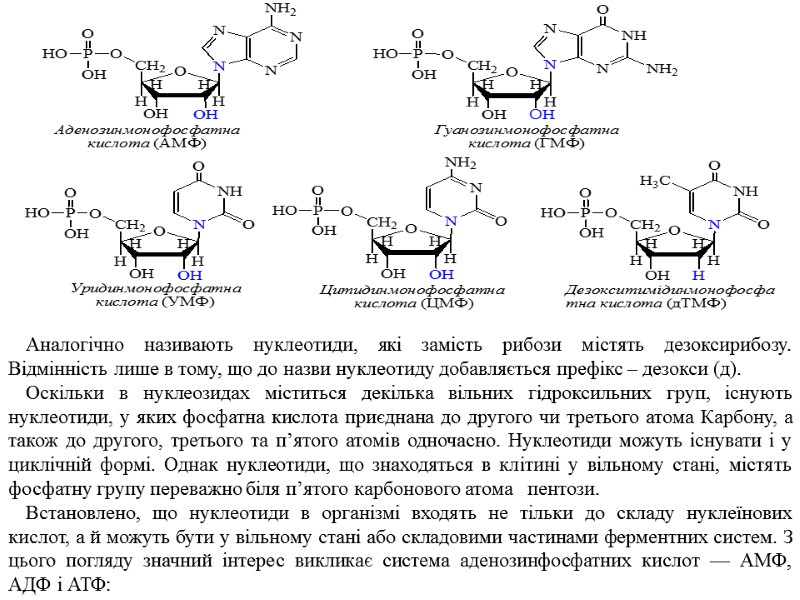
 Нуклеозиди, що містять дезоксирибозу (2-дезоксіаденозин, 2-дезоксигуанозин, 2-дезоксицитидин, 2-дезокситимідин) мають наступну будову: Нуклеозиди, сполучаючись з фосфатною кислотою, утворюють нуклеотид. До їх складу входять пуринові або піримідинові основи, рибоза або дезоксирибоза і фосфатна кислота. У залежності від того, яку пентозу містять нуклеотиди, їх називають відповідно рибонуклеотидами чи дезоксирибонуклеотидами. Повна назва нуклеотидів походить від назви основ, що входять до їх складу, або від назви нуклеозиду. Наприклад, якщо нуклеотид містить азотисту основу аденін, то він має назву: аденілова кислота, або аденозин-5-монофосфатна кислота (АМФ). Якщо азотиста основа – цитозин, то нуклеотид називають цитидиловою кислотою, або цитидин-5-монофосфатною кислотою (ЦМФ) При наявності в нуклеотидах азотистих основ гуаніну або урацилу вони називатимуться відповідно гуаніловою кислотою, або гуанозин-5-монофосфатною (ГМФ) та уридиловою кислотою, або уридин-5-монофосфатною кислотою (УМФ):
Нуклеозиди, що містять дезоксирибозу (2-дезоксіаденозин, 2-дезоксигуанозин, 2-дезоксицитидин, 2-дезокситимідин) мають наступну будову: Нуклеозиди, сполучаючись з фосфатною кислотою, утворюють нуклеотид. До їх складу входять пуринові або піримідинові основи, рибоза або дезоксирибоза і фосфатна кислота. У залежності від того, яку пентозу містять нуклеотиди, їх називають відповідно рибонуклеотидами чи дезоксирибонуклеотидами. Повна назва нуклеотидів походить від назви основ, що входять до їх складу, або від назви нуклеозиду. Наприклад, якщо нуклеотид містить азотисту основу аденін, то він має назву: аденілова кислота, або аденозин-5-монофосфатна кислота (АМФ). Якщо азотиста основа – цитозин, то нуклеотид називають цитидиловою кислотою, або цитидин-5-монофосфатною кислотою (ЦМФ) При наявності в нуклеотидах азотистих основ гуаніну або урацилу вони називатимуться відповідно гуаніловою кислотою, або гуанозин-5-монофосфатною (ГМФ) та уридиловою кислотою, або уридин-5-монофосфатною кислотою (УМФ):
 Аналогічно називають нуклеотиди, які замість рибози містять дезоксирибозу. Відмінність лише в тому, що до назви нуклеотиду добавляється префікс – дезокси (д). Оскільки в нуклеозидах міститься декілька вільних гідроксильних груп, існують нуклеотиди, у яких фосфатна кислота приєднана до другого чи третього атома Карбону, а також до другого, третього та п’ятого атомів одночасно. Нуклеотиди можуть існувати і у циклічній формі. Однак нуклеотиди, що знаходяться в клітині у вільному стані, містять фосфатну групу переважно біля п’ятого карбонового атома пентози. Встановлено, що нуклеотиди в організмі входять не тільки до складу нуклеїнових кислот, а й можуть бути у вільному стані або складовими частинами ферментних систем. З цього погляду значний інтерес викликає система аденозинфосфатних кислот — АМФ, АДФ і АТФ:
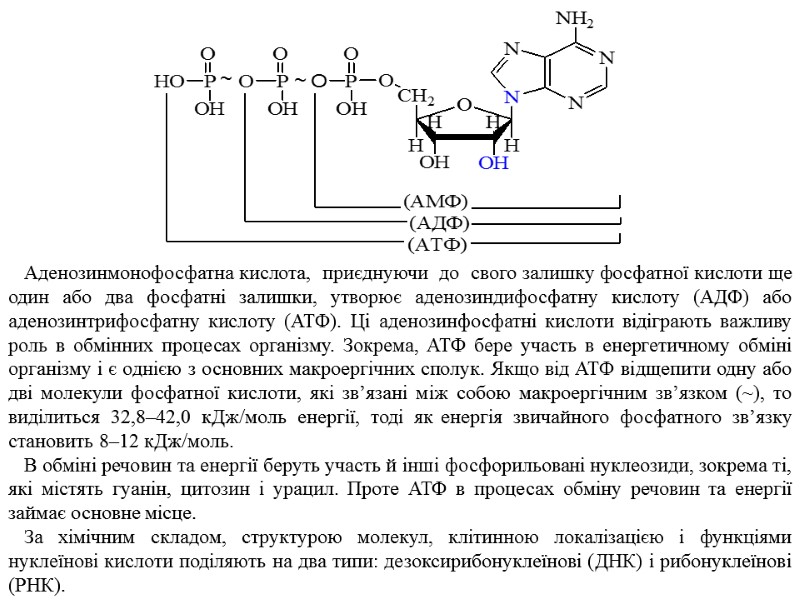
Аналогічно називають нуклеотиди, які замість рибози містять дезоксирибозу. Відмінність лише в тому, що до назви нуклеотиду добавляється префікс – дезокси (д). Оскільки в нуклеозидах міститься декілька вільних гідроксильних груп, існують нуклеотиди, у яких фосфатна кислота приєднана до другого чи третього атома Карбону, а також до другого, третього та п’ятого атомів одночасно. Нуклеотиди можуть існувати і у циклічній формі. Однак нуклеотиди, що знаходяться в клітині у вільному стані, містять фосфатну групу переважно біля п’ятого карбонового атома пентози. Встановлено, що нуклеотиди в організмі входять не тільки до складу нуклеїнових кислот, а й можуть бути у вільному стані або складовими частинами ферментних систем. З цього погляду значний інтерес викликає система аденозинфосфатних кислот — АМФ, АДФ і АТФ:
 Аденозинмонофосфатна кислота, приєднуючи до свого залишку фосфатної кислоти ще один або два фосфатні залишки, утворює аденозиндифосфатну кислоту (АДФ) або аденозинтрифосфатну кислоту (АТФ). Ці аденозинфосфатні кислоти відіграють важливу роль в обмінних процесах організму. Зокрема, АТФ бере участь в енергетичному обміні організму і є однією з основних макроергічних сполук. Якщо від АТФ відщепити одну або дві молекули фосфатної кислоти, які зв’язані між собою макроергічним зв’язком (~), то виділиться 32,8–42,0 кДж/моль енергії, тоді як енергія звичайного фосфатного зв’язку становить 8–12 кДж/моль. В обміні речовин та енергії беруть участь й інші фосфорильовані нуклеозиди, зокрема ті, які містять гуанін, цитозин і урацил. Проте АТФ в процесах обміну речовин та енергії займає основне місце. За хімічним складом, структурою молекул, клітинною локалізацією і функціями нуклеїнові кислоти поділяють на два типи: дезоксирибонуклеїнові (ДНК) і рибонуклеїнові (РНК).
Аденозинмонофосфатна кислота, приєднуючи до свого залишку фосфатної кислоти ще один або два фосфатні залишки, утворює аденозиндифосфатну кислоту (АДФ) або аденозинтрифосфатну кислоту (АТФ). Ці аденозинфосфатні кислоти відіграють важливу роль в обмінних процесах організму. Зокрема, АТФ бере участь в енергетичному обміні організму і є однією з основних макроергічних сполук. Якщо від АТФ відщепити одну або дві молекули фосфатної кислоти, які зв’язані між собою макроергічним зв’язком (~), то виділиться 32,8–42,0 кДж/моль енергії, тоді як енергія звичайного фосфатного зв’язку становить 8–12 кДж/моль. В обміні речовин та енергії беруть участь й інші фосфорильовані нуклеозиди, зокрема ті, які містять гуанін, цитозин і урацил. Проте АТФ в процесах обміну речовин та енергії займає основне місце. За хімічним складом, структурою молекул, клітинною локалізацією і функціями нуклеїнові кислоти поділяють на два типи: дезоксирибонуклеїнові (ДНК) і рибонуклеїнові (РНК).
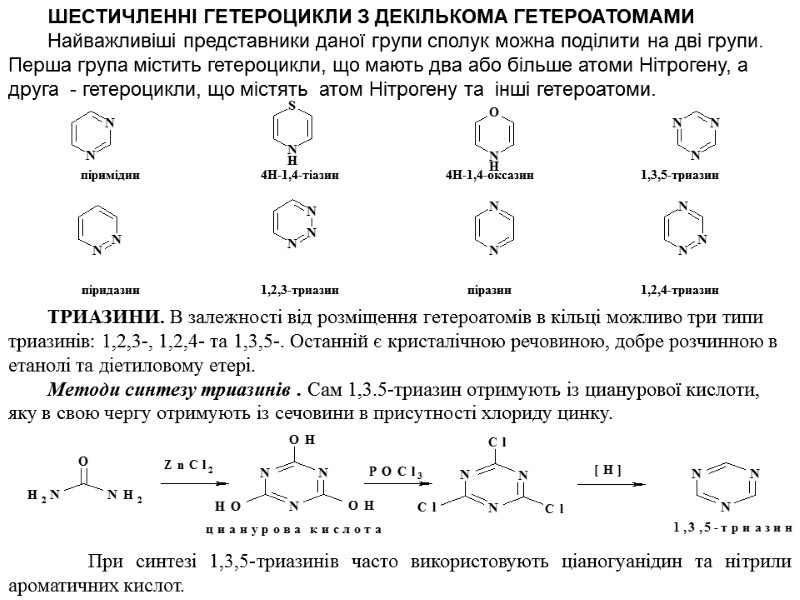
 ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛИ З ДЕКІЛЬКОМА ГЕТЕРОАТОМАМИ Найважливіші представники даної групи сполук можна поділити на дві групи. Перша група містить гетероцикли, що мають два або більше атоми Нітрогену, а друга - гетероцикли, що містять атом Нітрогену та інші гетероатоми. ТРИАЗИНИ. В залежності від розміщення гетероатомів в кільці можливо три типи триазинів: 1,2,3-, 1,2,4- та 1,3,5-. Останній є кристалічною речовиною, добре розчинною в етанолі та діетиловому етері. Методи синтезу триазинів . Сам 1,3.5-триазин отримують із цианурової кислоти, яку в свою чергу отримують із сечовини в присутності хлориду цинку. При синтезі 1,3,5-триазинів часто використовують ціаногуанідин та нітрили ароматичних кислот.
ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛИ З ДЕКІЛЬКОМА ГЕТЕРОАТОМАМИ Найважливіші представники даної групи сполук можна поділити на дві групи. Перша група містить гетероцикли, що мають два або більше атоми Нітрогену, а друга - гетероцикли, що містять атом Нітрогену та інші гетероатоми. ТРИАЗИНИ. В залежності від розміщення гетероатомів в кільці можливо три типи триазинів: 1,2,3-, 1,2,4- та 1,3,5-. Останній є кристалічною речовиною, добре розчинною в етанолі та діетиловому етері. Методи синтезу триазинів . Сам 1,3.5-триазин отримують із цианурової кислоти, яку в свою чергу отримують із сечовини в присутності хлориду цинку. При синтезі 1,3,5-триазинів часто використовують ціаногуанідин та нітрили ароматичних кислот.
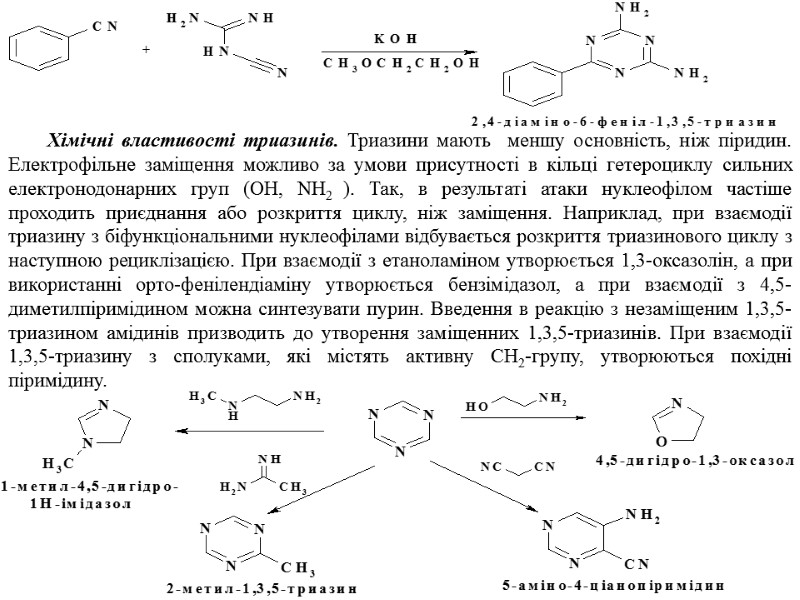
 Хімічні властивості триазинів. Триазини мають меншу основність, ніж піридин. Електрофільне заміщення можливо за умови присутності в кільці гетероциклу сильних електронодонарних груп (OH, NH2 ). Так, в результаті атаки нуклеофілом частіше проходить приєднання або розкриття циклу, ніж заміщення. Наприклад, при взаємодії триазину з біфункціональними нуклеофілами відбувається розкриття триазинового циклу з наступною рециклізацією. При взаємодії з етаноламіном утворюється 1,3-оксазолін, а при використанні орто-фенілендіаміну утворюється бензімідазол, а при взаємодії з 4,5-диметилпіримідином можна синтезувати пурин. Введення в реакцію з незаміщеним 1,3,5-триазином амідинів призводить до утворення заміщенних 1,3,5-триазинів. При взаємодії 1,3,5-триазину з сполуками, які містять активну СН2-групу, утворюються похідні піримідину.
Хімічні властивості триазинів. Триазини мають меншу основність, ніж піридин. Електрофільне заміщення можливо за умови присутності в кільці гетероциклу сильних електронодонарних груп (OH, NH2 ). Так, в результаті атаки нуклеофілом частіше проходить приєднання або розкриття циклу, ніж заміщення. Наприклад, при взаємодії триазину з біфункціональними нуклеофілами відбувається розкриття триазинового циклу з наступною рециклізацією. При взаємодії з етаноламіном утворюється 1,3-оксазолін, а при використанні орто-фенілендіаміну утворюється бензімідазол, а при взаємодії з 4,5-диметилпіримідином можна синтезувати пурин. Введення в реакцію з незаміщеним 1,3,5-триазином амідинів призводить до утворення заміщенних 1,3,5-триазинів. При взаємодії 1,3,5-триазину з сполуками, які містять активну СН2-групу, утворюються похідні піримідину.
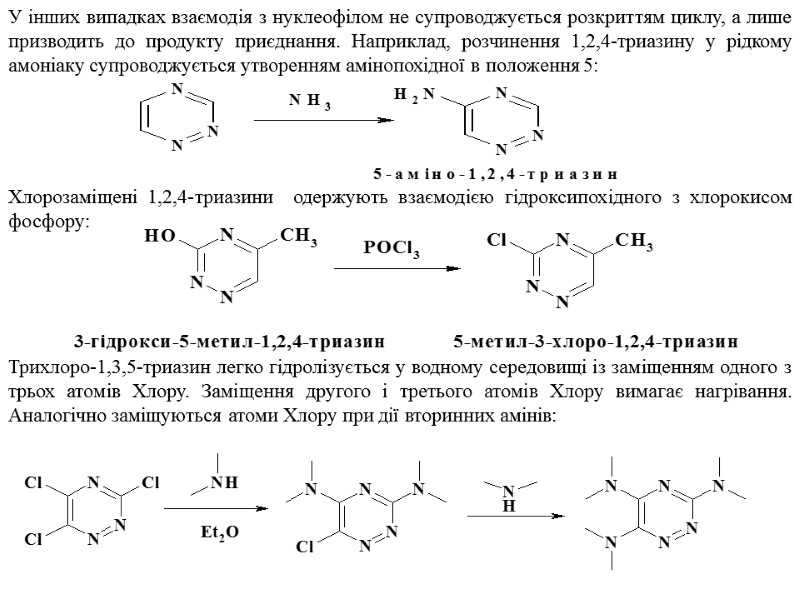
 У інших випадках взаємодія з нуклеофілом не супроводжується розкриттям циклу, а лише призводить до продукту приєднання. Наприклад, розчинення 1,2,4-триазину у рідкому амоніаку супроводжується утворенням амінопохідної в положення 5: Хлорозаміщені 1,2,4-триазини одержують взаємодією гідроксипохідного з хлорокисом фосфору: Трихлоро-1,3,5-триазин легко гідролізується у водному середовищі із заміщенням одного з трьох атомів Хлору. Заміщення другого і третього атомів Хлору вимагає нагрівання. Аналогічно заміщуються атоми Хлору при дії вторинних амінів:
У інших випадках взаємодія з нуклеофілом не супроводжується розкриттям циклу, а лише призводить до продукту приєднання. Наприклад, розчинення 1,2,4-триазину у рідкому амоніаку супроводжується утворенням амінопохідної в положення 5: Хлорозаміщені 1,2,4-триазини одержують взаємодією гідроксипохідного з хлорокисом фосфору: Трихлоро-1,3,5-триазин легко гідролізується у водному середовищі із заміщенням одного з трьох атомів Хлору. Заміщення другого і третього атомів Хлору вимагає нагрівання. Аналогічно заміщуються атоми Хлору при дії вторинних амінів:
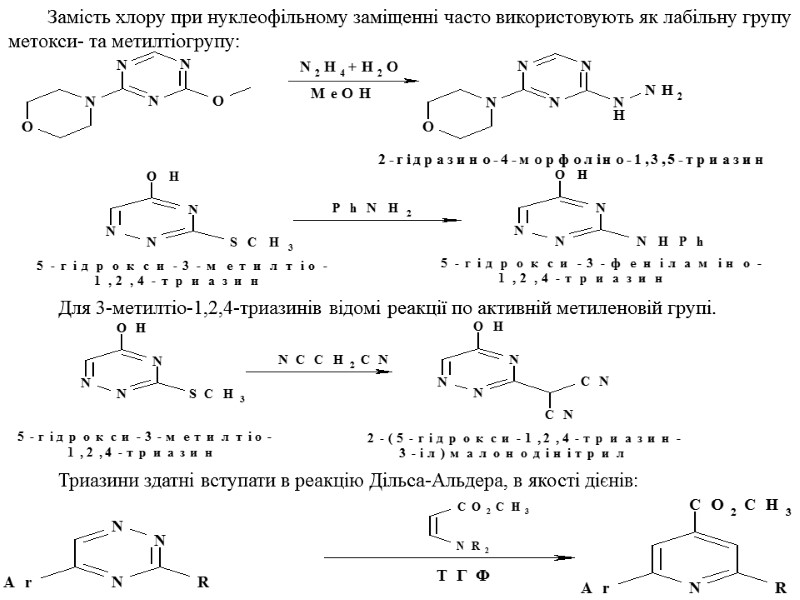
 Замість хлору при нуклеофільному заміщенні часто використовують як лабільну групу метокси- та метилтіогрупу: Для 3-метилтіо-1,2,4-триазинів відомі реакції по активній метиленовій групі. Триазини здатні вступати в реакцію Дільса-Альдера, в якості дієнів:
Замість хлору при нуклеофільному заміщенні часто використовують як лабільну групу метокси- та метилтіогрупу: Для 3-метилтіо-1,2,4-триазинів відомі реакції по активній метиленовій групі. Триазини здатні вступати в реакцію Дільса-Альдера, в якості дієнів:
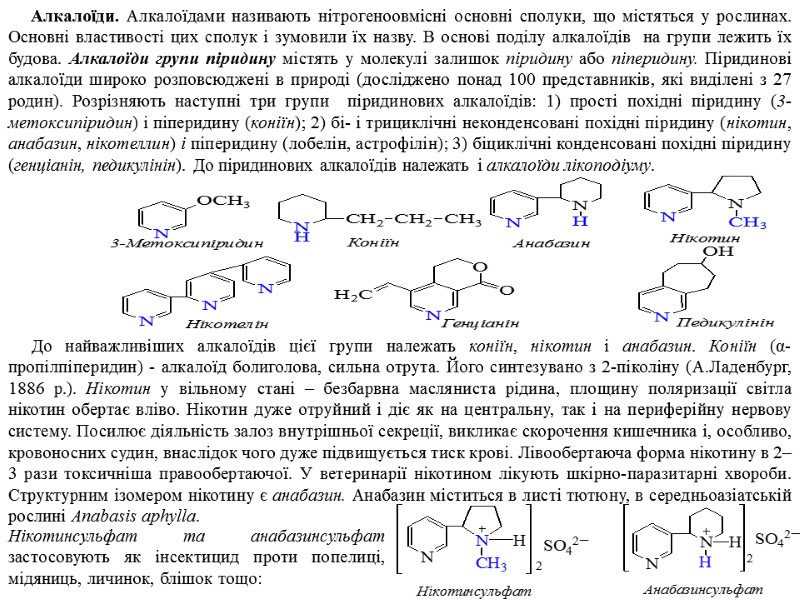
 Алкалоїди. Алкалоїдами називають нітрогеноовмісні основні сполуки, що містяться у рослинах. Основні властивості цих сполук і зумовили їх назву. В основі поділу алкалоїдів на групи лежить їх будова. Алкалоїди групи піридину містять у молекулі залишок піридину або піперидину. Піридинові алкалоїди широко розповсюджені в природі (досліджено понад 100 представників, які виділені з 27 родин). Розрізняють наступні три групи піридинових алкалоїдів: 1) прості похідні піридину (3-метоксипіридин) і піперидину (коніїн); 2) бі- і трициклічні неконденсовані похідні піридину (нікотин, анабазин, нікотеллин) і піперидину (лобелін, астрофілін); 3) біциклічні конденсовані похідні піридину (генціанін, педикулінін). До піридинових алкалоїдів належать і алкалоїди лікоподіуму. До найважливіших алкалоїдів цієї групи належать коніїн, нікотин і анабазин. Коніїн (α-пропілпіперидин) - алкалоїд болиголова, сильна отрута. Його синтезувано з 2-піколіну (А.Ладенбург, 1886 р.). Нікотин у вільному стані – безбарвна масляниста рідина, площину поляризації світла нікотин обертає вліво. Нікотин дуже отруйний і діє як на центральну, так і на периферійну нервову систему. Посилює діяльність залоз внутрішньої секреції, викликає скорочення кишечника і, особливо, кровоносних судин, внаслідок чого дуже підвищується тиск крові. Лівообертаюча форма нікотину в 2–3 рази токсичніша правообертаючої. У ветеринарії нікотином лікують шкірно-паразитарні хвороби. Структурним ізомером нікотину є анабазин. Анабазин міститься в листі тютюну, в середньоазіатській рослині Anabasis aphylla. Нікотинсульфат та анабазинсульфат застосовують як інсектицид проти попелиці, мідяниць, личинок, блішок тощо:
Алкалоїди. Алкалоїдами називають нітрогеноовмісні основні сполуки, що містяться у рослинах. Основні властивості цих сполук і зумовили їх назву. В основі поділу алкалоїдів на групи лежить їх будова. Алкалоїди групи піридину містять у молекулі залишок піридину або піперидину. Піридинові алкалоїди широко розповсюджені в природі (досліджено понад 100 представників, які виділені з 27 родин). Розрізняють наступні три групи піридинових алкалоїдів: 1) прості похідні піридину (3-метоксипіридин) і піперидину (коніїн); 2) бі- і трициклічні неконденсовані похідні піридину (нікотин, анабазин, нікотеллин) і піперидину (лобелін, астрофілін); 3) біциклічні конденсовані похідні піридину (генціанін, педикулінін). До піридинових алкалоїдів належать і алкалоїди лікоподіуму. До найважливіших алкалоїдів цієї групи належать коніїн, нікотин і анабазин. Коніїн (α-пропілпіперидин) - алкалоїд болиголова, сильна отрута. Його синтезувано з 2-піколіну (А.Ладенбург, 1886 р.). Нікотин у вільному стані – безбарвна масляниста рідина, площину поляризації світла нікотин обертає вліво. Нікотин дуже отруйний і діє як на центральну, так і на периферійну нервову систему. Посилює діяльність залоз внутрішньої секреції, викликає скорочення кишечника і, особливо, кровоносних судин, внаслідок чого дуже підвищується тиск крові. Лівообертаюча форма нікотину в 2–3 рази токсичніша правообертаючої. У ветеринарії нікотином лікують шкірно-паразитарні хвороби. Структурним ізомером нікотину є анабазин. Анабазин міститься в листі тютюну, в середньоазіатській рослині Anabasis aphylla. Нікотинсульфат та анабазинсульфат застосовують як інсектицид проти попелиці, мідяниць, личинок, блішок тощо:
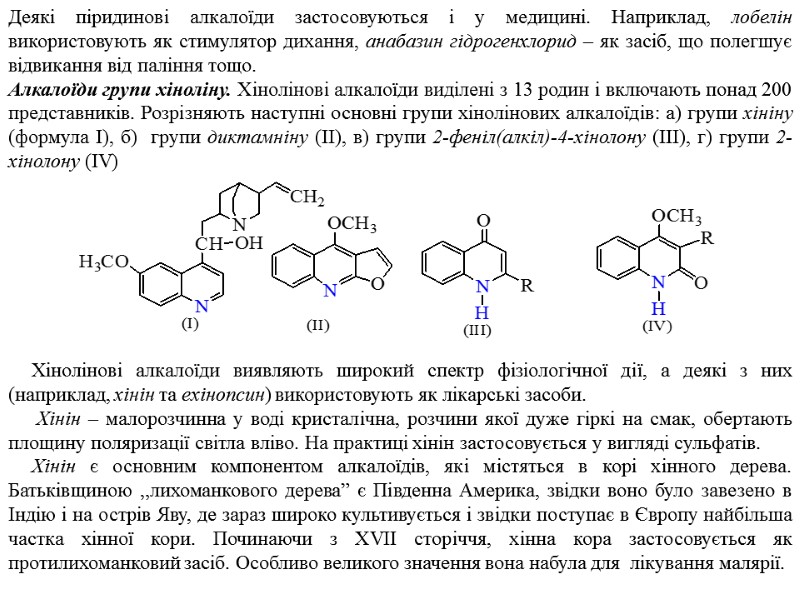
 Хінолінові алкалоїди виявляють широкий спектр фізіологічної дії, а деякі з них (наприклад, хінін та ехінопсин) використовують як лікарські засоби. Хінін – малорозчинна у воді кристалічна, розчини якої дуже гіркі на смак, обертають площину поляризації світла вліво. На практиці хінін застосовується у вигляді сульфатів. Хінін є основним компонентом алкалоїдів, які містяться в корі хінного дерева. Батьківщиною „лихоманкового дерева” є Південна Америка, звідки воно було завезено в Індію і на острів Яву, де зараз широко культивується і звідки поступає в Європу найбільша частка хінної кори. Починаючи з ХVII сторіччя, хінна кора застосовується як протилихоманковий засіб. Особливо великого значення вона набула для лікування малярії. Деякі піридинові алкалоїди застосовуються і у медицині. Наприклад, лобелін використовують як стимулятор дихання, анабазин гідрогенхлорид – як засіб, що полегшує відвикання від паління тощо. Алкалоїди групи хіноліну. Хінолінові алкалоїди виділені з 13 родин і включають понад 200 представників. Розрізняють наступні основні групи хінолінових алкалоїдів: а) групи хініну (формула І), б) групи диктамніну (ІІ), в) групи 2-феніл(алкіл)-4-хінолону (ІІІ), г) групи 2-хінолону (IV)
Хінолінові алкалоїди виявляють широкий спектр фізіологічної дії, а деякі з них (наприклад, хінін та ехінопсин) використовують як лікарські засоби. Хінін – малорозчинна у воді кристалічна, розчини якої дуже гіркі на смак, обертають площину поляризації світла вліво. На практиці хінін застосовується у вигляді сульфатів. Хінін є основним компонентом алкалоїдів, які містяться в корі хінного дерева. Батьківщиною „лихоманкового дерева” є Південна Америка, звідки воно було завезено в Індію і на острів Яву, де зараз широко культивується і звідки поступає в Європу найбільша частка хінної кори. Починаючи з ХVII сторіччя, хінна кора застосовується як протилихоманковий засіб. Особливо великого значення вона набула для лікування малярії. Деякі піридинові алкалоїди застосовуються і у медицині. Наприклад, лобелін використовують як стимулятор дихання, анабазин гідрогенхлорид – як засіб, що полегшує відвикання від паління тощо. Алкалоїди групи хіноліну. Хінолінові алкалоїди виділені з 13 родин і включають понад 200 представників. Розрізняють наступні основні групи хінолінових алкалоїдів: а) групи хініну (формула І), б) групи диктамніну (ІІ), в) групи 2-феніл(алкіл)-4-хінолону (ІІІ), г) групи 2-хінолону (IV)
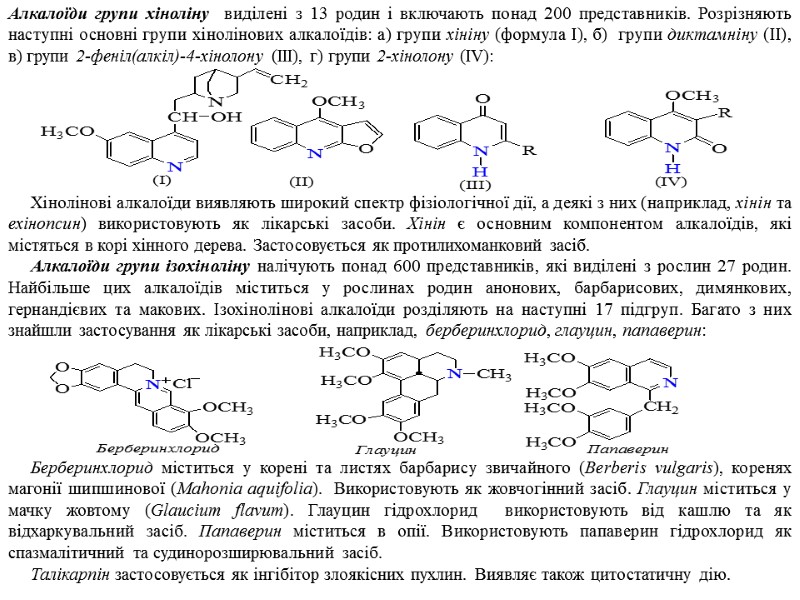
 Алкалоїди групи хіноліну виділені з 13 родин і включають понад 200 представників. Розрізняють наступні основні групи хінолінових алкалоїдів: а) групи хініну (формула І), б) групи диктамніну (ІІ), в) групи 2-феніл(алкіл)-4-хінолону (ІІІ), г) групи 2-хінолону (IV): Хінолінові алкалоїди виявляють широкий спектр фізіологічної дії, а деякі з них (наприклад, хінін та ехінопсин) використовують як лікарські засоби. Хінін є основним компонентом алкалоїдів, які містяться в корі хінного дерева. Застосовується як протилихоманковий засіб. Алкалоїди групи ізохіноліну налічують понад 600 представників, які виділені з рослин 27 родин. Найбільше цих алкалоїдів міститься у рослинах родин анонових, барбарисових, димянкових, гернандієвих та макових. Ізохінолінові алкалоїди розділяють на наступні 17 підгруп. Багато з них знайшли застосування як лікарські засоби, наприклад, берберинхлорид, глауцин, папаверин: Берберинхлорид міститься у корені та листях барбарису звичайного (Berberis vulgaris), коренях магонії шипшинової (Mahonia aquifolia). Використовують як жовчогінний засіб. Глауцин міститься у мачку жовтому (Glaucium flavum). Глауцин гідрохлорид використовують від кашлю та як відхаркувальний засіб. Папаверин міститься в опії. Використовують папаверин гідрохлорид як спазмалітичний та судинорозширювальний засіб. Талікарпін застосовується як інгібітор злоякісних пухлин. Виявляє також цитостатичну дію.
Алкалоїди групи хіноліну виділені з 13 родин і включають понад 200 представників. Розрізняють наступні основні групи хінолінових алкалоїдів: а) групи хініну (формула І), б) групи диктамніну (ІІ), в) групи 2-феніл(алкіл)-4-хінолону (ІІІ), г) групи 2-хінолону (IV): Хінолінові алкалоїди виявляють широкий спектр фізіологічної дії, а деякі з них (наприклад, хінін та ехінопсин) використовують як лікарські засоби. Хінін є основним компонентом алкалоїдів, які містяться в корі хінного дерева. Застосовується як протилихоманковий засіб. Алкалоїди групи ізохіноліну налічують понад 600 представників, які виділені з рослин 27 родин. Найбільше цих алкалоїдів міститься у рослинах родин анонових, барбарисових, димянкових, гернандієвих та макових. Ізохінолінові алкалоїди розділяють на наступні 17 підгруп. Багато з них знайшли застосування як лікарські засоби, наприклад, берберинхлорид, глауцин, папаверин: Берберинхлорид міститься у корені та листях барбарису звичайного (Berberis vulgaris), коренях магонії шипшинової (Mahonia aquifolia). Використовують як жовчогінний засіб. Глауцин міститься у мачку жовтому (Glaucium flavum). Глауцин гідрохлорид використовують від кашлю та як відхаркувальний засіб. Папаверин міститься в опії. Використовують папаверин гідрохлорид як спазмалітичний та судинорозширювальний засіб. Талікарпін застосовується як інгібітор злоякісних пухлин. Виявляє також цитостатичну дію.
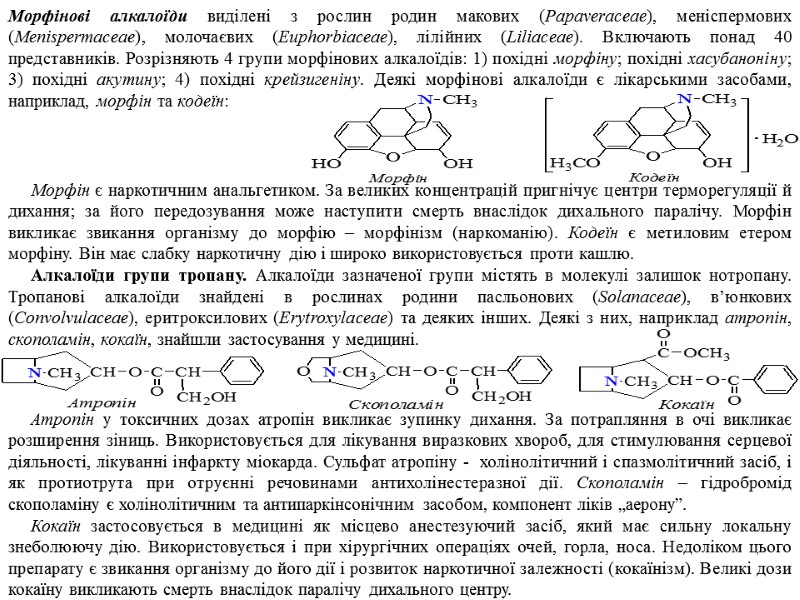
 Морфінові алкалоїди виділені з рослин родин макових (Papaveraceae), меніспермових (Menispermaceae), молочаєвих (Euphorbiaceae), лілійних (Liliaceae). Включають понад 40 представників. Розрізняють 4 групи морфінових алкалоїдів: 1) похідні морфіну; похідні хасубаноніну; 3) похідні акутину; 4) похідні крейзигеніну. Деякі морфінові алкалоїди є лікарськими засобами, наприклад, морфін та кодеїн: Морфін є наркотичним анальгетиком. За великих концентрацій пригнічує центри терморегуляції й дихання; за його передозування може наступити смерть внаслідок дихального паралічу. Морфін викликає звикання організму до морфію – морфінізм (наркоманію). Кодеїн є метиловим етером морфіну. Він має слабку наркотичну дію і широко використовується проти кашлю. Алкалоїди групи тропану. Алкалоїди зазначеної групи містять в молекулі залишок нотропану. Тропанові алкалоїди знайдені в рослинах родини пасльонових (Solanaceae), в’юнкових (Convolvulaceae), еритроксилових (Erytroxylaceae) та деяких інших. Деякі з них, наприклад атропін, скополамін, кокаїн, знайшли застосування у медицині. Атропін у токсичних дозах атропін викликає зупинку дихання. За потрапляння в очі викликає розширення зіниць. Використовується для лікування виразкових хвороб, для стимулювання серцевої діяльності, лікуванні інфаркту міокарда. Сульфат атропіну - холінолітичний і спазмолітичний засіб, і як протиотрута при отруєнні речовинами антихолінестеразної дії. Скополамін – гідробромід скополаміну є холінолітичним та антипаркінсонічним засобом, компонент ліків „аерону”. Кокаїн застосовується в медицині як місцево анестезуючий засіб, який має сильну локальну знеболюючу дію. Використовується і при хірургічних операціях очей, горла, носа. Недоліком цього препарату є звикання організму до його дії і розвиток наркотичної залежності (кокаїнізм). Великі дози кокаїну викликають смерть внаслідок паралічу дихального центру.
Морфінові алкалоїди виділені з рослин родин макових (Papaveraceae), меніспермових (Menispermaceae), молочаєвих (Euphorbiaceae), лілійних (Liliaceae). Включають понад 40 представників. Розрізняють 4 групи морфінових алкалоїдів: 1) похідні морфіну; похідні хасубаноніну; 3) похідні акутину; 4) похідні крейзигеніну. Деякі морфінові алкалоїди є лікарськими засобами, наприклад, морфін та кодеїн: Морфін є наркотичним анальгетиком. За великих концентрацій пригнічує центри терморегуляції й дихання; за його передозування може наступити смерть внаслідок дихального паралічу. Морфін викликає звикання організму до морфію – морфінізм (наркоманію). Кодеїн є метиловим етером морфіну. Він має слабку наркотичну дію і широко використовується проти кашлю. Алкалоїди групи тропану. Алкалоїди зазначеної групи містять в молекулі залишок нотропану. Тропанові алкалоїди знайдені в рослинах родини пасльонових (Solanaceae), в’юнкових (Convolvulaceae), еритроксилових (Erytroxylaceae) та деяких інших. Деякі з них, наприклад атропін, скополамін, кокаїн, знайшли застосування у медицині. Атропін у токсичних дозах атропін викликає зупинку дихання. За потрапляння в очі викликає розширення зіниць. Використовується для лікування виразкових хвороб, для стимулювання серцевої діяльності, лікуванні інфаркту міокарда. Сульфат атропіну - холінолітичний і спазмолітичний засіб, і як протиотрута при отруєнні речовинами антихолінестеразної дії. Скополамін – гідробромід скополаміну є холінолітичним та антипаркінсонічним засобом, компонент ліків „аерону”. Кокаїн застосовується в медицині як місцево анестезуючий засіб, який має сильну локальну знеболюючу дію. Використовується і при хірургічних операціях очей, горла, носа. Недоліком цього препарату є звикання організму до його дії і розвиток наркотичної залежності (кокаїнізм). Великі дози кокаїну викликають смерть внаслідок паралічу дихального центру.
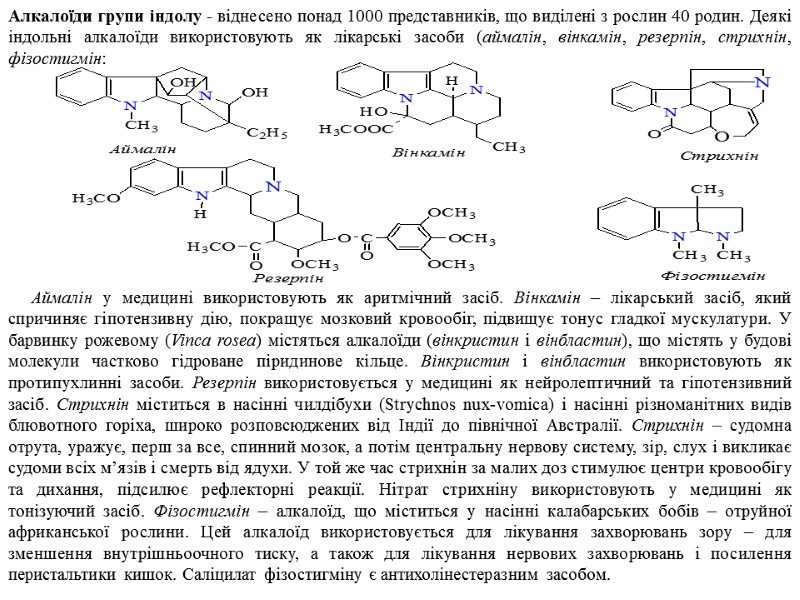
 Алкалоїди групи індолу - віднесено понад 1000 представників, що виділені з рослин 40 родин. Деякі індольні алкалоїди використовують як лікарські засоби (аймалін, вінкамін, резерпін, стрихнін, фізостигмін: Аймалін у медицині використовують як аритмічний засіб. Вінкамін – лікарський засіб, який спричиняє гіпотензивну дію, покращує мозковий кровообіг, підвищує тонус гладкої мускулатури. У барвинку рожевому (Vinca rosea) містяться алкалоїди (вінкристин і вінбластин), що містять у будові молекули частково гідроване піридинове кільце. Вінкристин і вінбластин використовують як протипухлинні засоби. Резерпін використовується у медицині як нейролептичний та гіпотензивний засіб. Стрихнін міститься в насінні чилдібухи (Strychnos nux-vomica) і насінні різноманітних видів блювотного горіха, широко розповсюджених від Індії до північної Австралії. Стрихнін – судомна отрута, уражує, перш за все, спинний мозок, а потім центральну нервову систему, зір, слух і викликає судоми всіх м’язів і смерть від ядухи. У той же час стрихнін за малих доз стимулює центри кровообігу та дихання, підсилює рефлекторні реакції. Нітрат стрихніну використовують у медицині як тонізуючий засіб. Фізостигмін – алкалоїд, що міститься у насінні калабарських бобів – отруйної африканської рослини. Цей алкалоїд використовується для лікування захворювань зору – для зменшення внутрішньоочного тиску, а також для лікування нервових захворювань і посилення перистальтики кишок. Саліцилат фізостигміну є антихолінестеразним засобом.
Алкалоїди групи індолу - віднесено понад 1000 представників, що виділені з рослин 40 родин. Деякі індольні алкалоїди використовують як лікарські засоби (аймалін, вінкамін, резерпін, стрихнін, фізостигмін: Аймалін у медицині використовують як аритмічний засіб. Вінкамін – лікарський засіб, який спричиняє гіпотензивну дію, покращує мозковий кровообіг, підвищує тонус гладкої мускулатури. У барвинку рожевому (Vinca rosea) містяться алкалоїди (вінкристин і вінбластин), що містять у будові молекули частково гідроване піридинове кільце. Вінкристин і вінбластин використовують як протипухлинні засоби. Резерпін використовується у медицині як нейролептичний та гіпотензивний засіб. Стрихнін міститься в насінні чилдібухи (Strychnos nux-vomica) і насінні різноманітних видів блювотного горіха, широко розповсюджених від Індії до північної Австралії. Стрихнін – судомна отрута, уражує, перш за все, спинний мозок, а потім центральну нервову систему, зір, слух і викликає судоми всіх м’язів і смерть від ядухи. У той же час стрихнін за малих доз стимулює центри кровообігу та дихання, підсилює рефлекторні реакції. Нітрат стрихніну використовують у медицині як тонізуючий засіб. Фізостигмін – алкалоїд, що міститься у насінні калабарських бобів – отруйної африканської рослини. Цей алкалоїд використовується для лікування захворювань зору – для зменшення внутрішньоочного тиску, а також для лікування нервових захворювань і посилення перистальтики кишок. Саліцилат фізостигміну є антихолінестеразним засобом.
