livshitz 2.1.ppt
- Количество слайдов: 55
 Сенсорные системы 1. Основные наноструктурные компоненты клетки и их функции 2. Рецепция и преобразование внешних сигналов в клетке. 3. Механизмы фоторецепции 3. 1. Зрительный родопсин и первичные механизмы фоторецепции 3. 2. Фоторецепторные клетки. Палочки и колбочки. Структурные механизмы восприятия цветного зрения. 3. 3. Усилительные каскады и обратные связи в фоторецепторной клетке под действием света 3. 4. Связь с фоторецепторных клеток с нейронами и первичный анализ световой информации 4. Механизмы обонятельной рецепции 4. 1. Строение (макроструктура) обонятельных рецепторов 4. 2. Молекулярные механизмы обонятельной рецепции 4. 3. Передача информации от обонятельных рецепторов нейронам и ее анализ с помощью нейронных сетей 5. Рецепция гормонов и токсинов. 6. Проблемы моделирования рецепторных систем
Сенсорные системы 1. Основные наноструктурные компоненты клетки и их функции 2. Рецепция и преобразование внешних сигналов в клетке. 3. Механизмы фоторецепции 3. 1. Зрительный родопсин и первичные механизмы фоторецепции 3. 2. Фоторецепторные клетки. Палочки и колбочки. Структурные механизмы восприятия цветного зрения. 3. 3. Усилительные каскады и обратные связи в фоторецепторной клетке под действием света 3. 4. Связь с фоторецепторных клеток с нейронами и первичный анализ световой информации 4. Механизмы обонятельной рецепции 4. 1. Строение (макроструктура) обонятельных рецепторов 4. 2. Молекулярные механизмы обонятельной рецепции 4. 3. Передача информации от обонятельных рецепторов нейронам и ее анализ с помощью нейронных сетей 5. Рецепция гормонов и токсинов. 6. Проблемы моделирования рецепторных систем
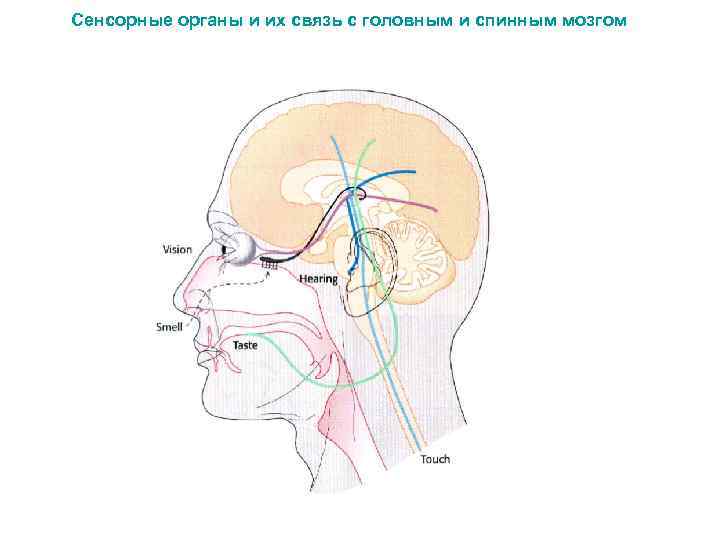 Сенсорные органы и их связь с головным и спинным мозгом
Сенсорные органы и их связь с головным и спинным мозгом
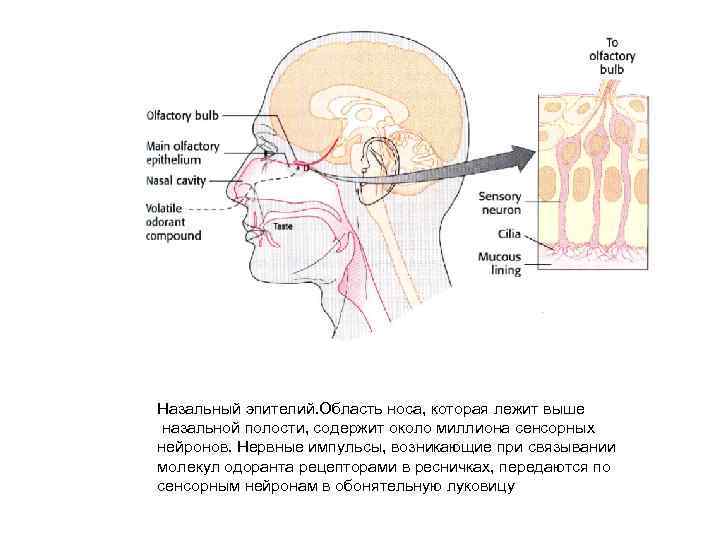 Назальный эпителий. Область носа, которая лежит выше назальной полости, содержит около миллиона сенсорных нейронов. Нервные импульсы, возникающие при связывании молекул одоранта рецепторами в ресничках, передаются по сенсорным нейронам в обонятельную луковицу
Назальный эпителий. Область носа, которая лежит выше назальной полости, содержит около миллиона сенсорных нейронов. Нервные импульсы, возникающие при связывании молекул одоранта рецепторами в ресничках, передаются по сенсорным нейронам в обонятельную луковицу
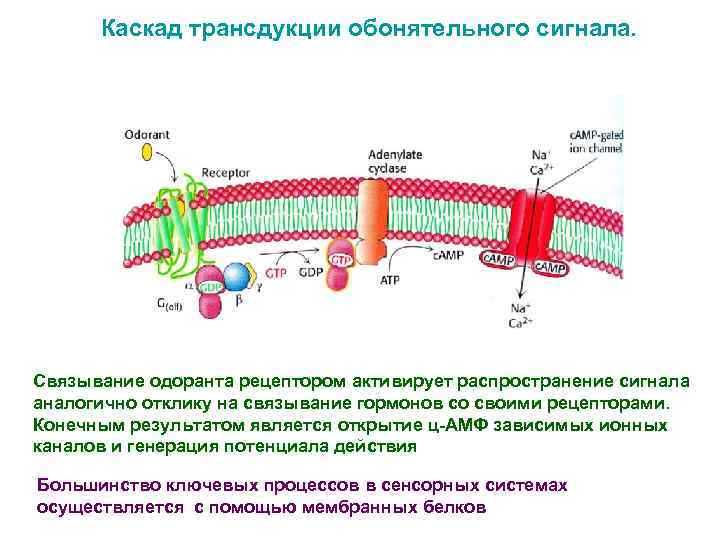 Каскад трансдукции обонятельного сигнала. Связывание одоранта рецептором активирует распространение сигнала аналогично отклику на связывание гормонов со своими рецепторами. Конечным результатом является открытие ц-АМФ зависимых ионных каналов и генерация потенциала действия Большинство ключевых процессов в сенсорных системах осуществляется с помощью мембранных белков
Каскад трансдукции обонятельного сигнала. Связывание одоранта рецептором активирует распространение сигнала аналогично отклику на связывание гормонов со своими рецепторами. Конечным результатом является открытие ц-АМФ зависимых ионных каналов и генерация потенциала действия Большинство ключевых процессов в сенсорных системах осуществляется с помощью мембранных белков
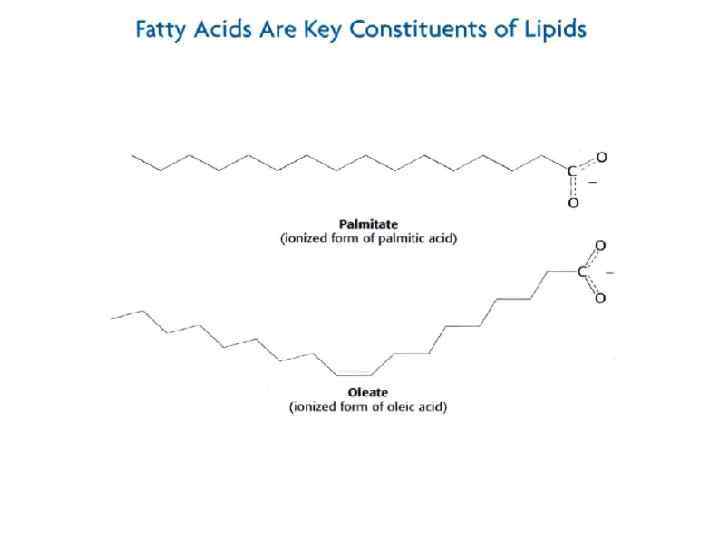
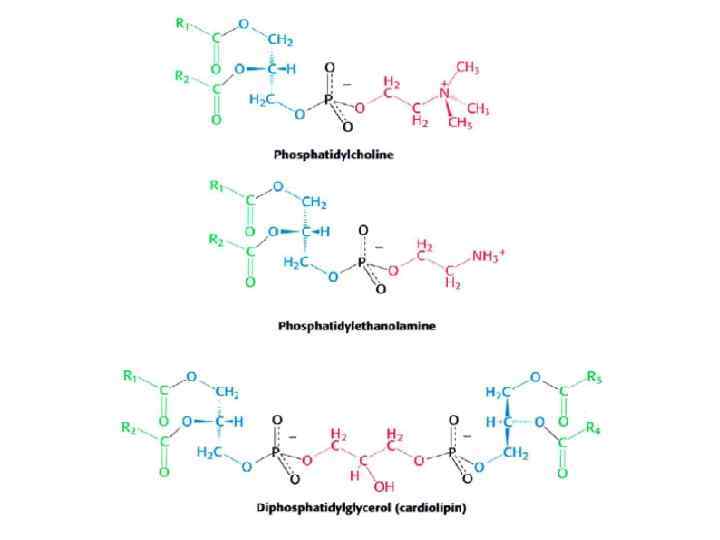
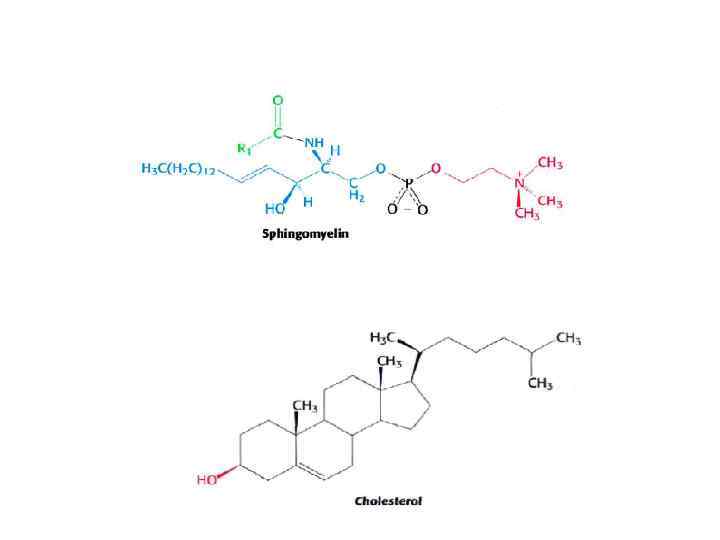
 Липиды и липидные мембраны 1. Биомембраны образуют границы клеток и являются барьерами, которые препятствуют выходу содержимого клетки и входу ненужных молекул извне. Они также содержат системы для транспорта нужных молекул и ионов. 2. БМ являются плоскими структурами толщиной в две молекулы липидов (общей толщиной 6 -10 нм). 3. БМ состоят главным образом из липидов и белков с массовым отношением L/P в интервале 1: 4 – 4: 1. 4. Белки выполняют важнейшие функции БМ: молекулярных насосов, каналов, рецепторов, преобразователей энергии, ферментов. Мембранные белки встроены в липидные бислои, которые обеспечивают оптимальную среду для их действия 5. БМ образуются за счет кооперативных нековалентных взаимодействий 6. БМ асимметричны: два монослоя отличаются по липидному и белковому составу 7. БМ являются анизотропными, но жидкими структурами. Молекулы липидов, как и белки, быстро диффундируют в плоскости мембраны, но очень медленно реориентируются вокруг осей, лежащих в плоскости мембраны 8. Большинство клеточных мембран электрически поляризованы – минус внутри клетки (около 60 мв). Мембранный потенциал играет ключевую роль в транспорте, преобразовании энергии и возбудимости нейронов.
Липиды и липидные мембраны 1. Биомембраны образуют границы клеток и являются барьерами, которые препятствуют выходу содержимого клетки и входу ненужных молекул извне. Они также содержат системы для транспорта нужных молекул и ионов. 2. БМ являются плоскими структурами толщиной в две молекулы липидов (общей толщиной 6 -10 нм). 3. БМ состоят главным образом из липидов и белков с массовым отношением L/P в интервале 1: 4 – 4: 1. 4. Белки выполняют важнейшие функции БМ: молекулярных насосов, каналов, рецепторов, преобразователей энергии, ферментов. Мембранные белки встроены в липидные бислои, которые обеспечивают оптимальную среду для их действия 5. БМ образуются за счет кооперативных нековалентных взаимодействий 6. БМ асимметричны: два монослоя отличаются по липидному и белковому составу 7. БМ являются анизотропными, но жидкими структурами. Молекулы липидов, как и белки, быстро диффундируют в плоскости мембраны, но очень медленно реориентируются вокруг осей, лежащих в плоскости мембраны 8. Большинство клеточных мембран электрически поляризованы – минус внутри клетки (около 60 мв). Мембранный потенциал играет ключевую роль в транспорте, преобразовании энергии и возбудимости нейронов.
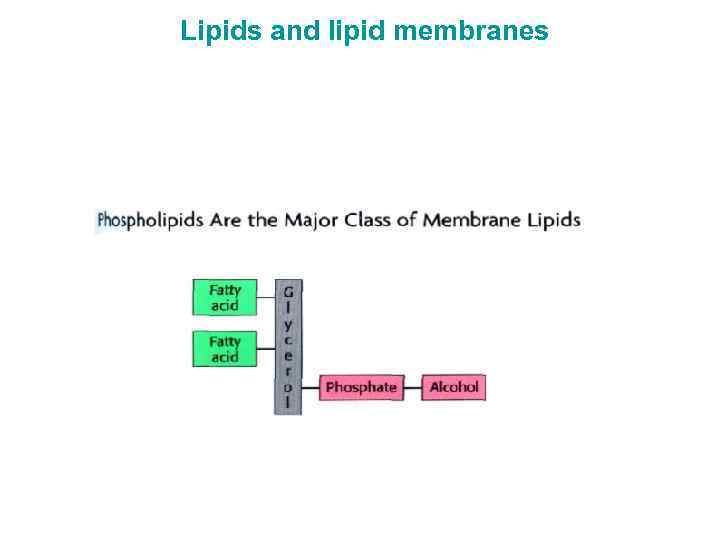 Lipids and lipid membranes
Lipids and lipid membranes
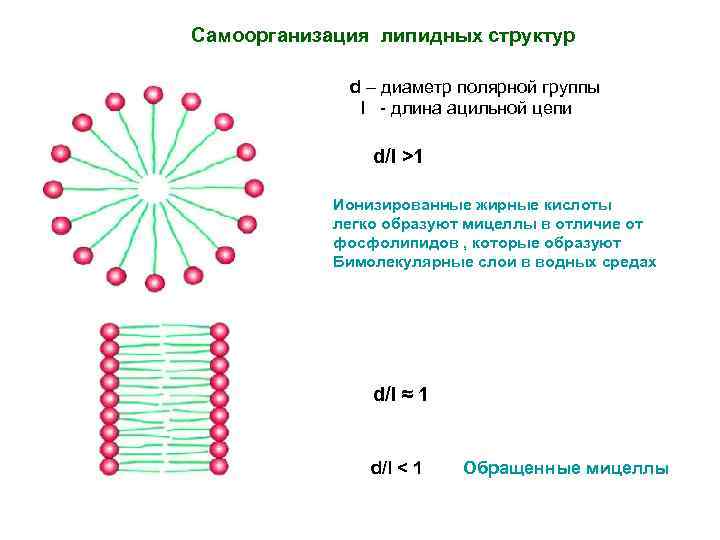 Самоорганизация липидных структур d – диаметр полярной группы l - длина ацильной цепи d/I >1 Ионизированные жирные кислоты легко образуют мицеллы в отличие от фосфолипидов , которые образуют Бимолекулярные слои в водных средах d/l ≈ 1 d/l < 1 Обращенные мицеллы
Самоорганизация липидных структур d – диаметр полярной группы l - длина ацильной цепи d/I >1 Ионизированные жирные кислоты легко образуют мицеллы в отличие от фосфолипидов , которые образуют Бимолекулярные слои в водных средах d/l ≈ 1 d/l < 1 Обращенные мицеллы
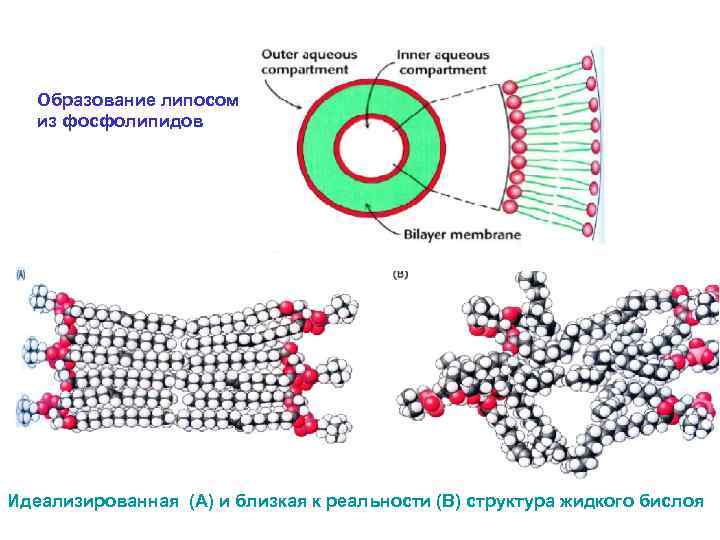 Образование липосом из фосфолипидов Идеализированная (А) и близкая к реальности (В) структура жидкого бислоя
Образование липосом из фосфолипидов Идеализированная (А) и близкая к реальности (В) структура жидкого бислоя
 Коэффициенты проницаемости ионов и молекул через липидный бислой Проницаемость P=D/2 h D- коэффициент диффузии, 2 h – толщина бислоя
Коэффициенты проницаемости ионов и молекул через липидный бислой Проницаемость P=D/2 h D- коэффициент диффузии, 2 h – толщина бислоя
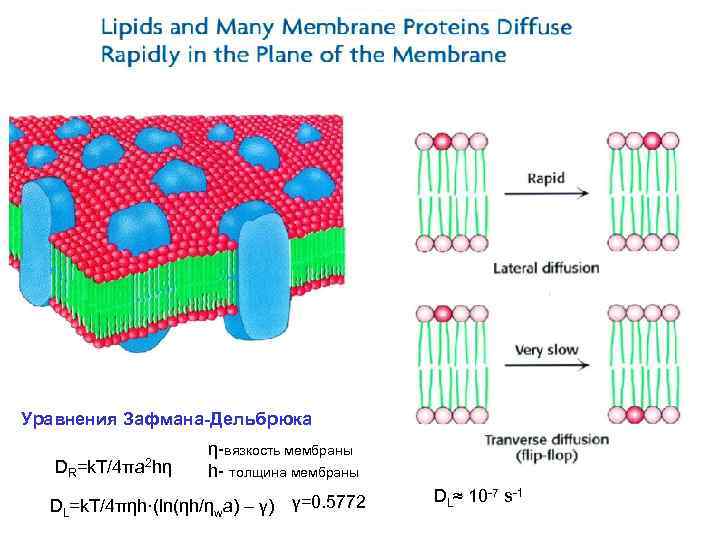 Уравнения Зафмана-Дельбрюка DR =k. T/4πa 2 hη η-вязкость мембраны h- толщина мембраны DL=k. T/4πηh·(ln(ηh/ηwa) – γ) γ=0. 5772 DL≈ 10 -7 s-1
Уравнения Зафмана-Дельбрюка DR =k. T/4πa 2 hη η-вязкость мембраны h- толщина мембраны DL=k. T/4πηh·(ln(ηh/ηwa) – γ) γ=0. 5772 DL≈ 10 -7 s-1
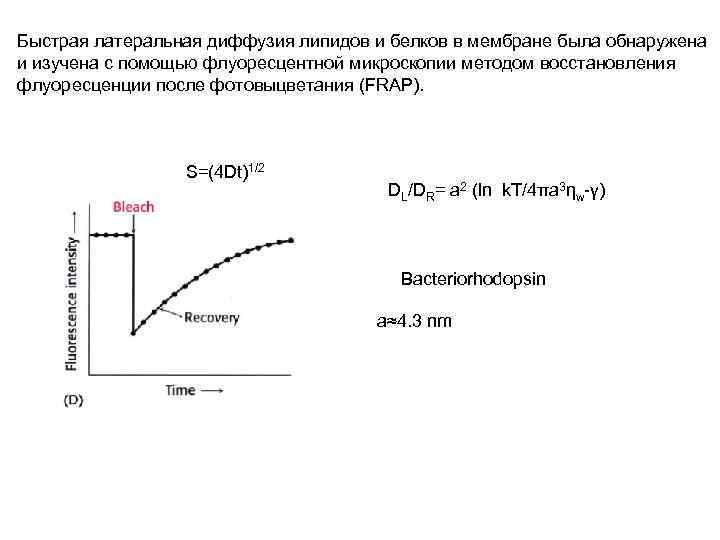 Быстрая латеральная диффузия липидов и белков в мембране была обнаружена и изучена с помощью флуоресцентной микроскопии методом восстановления флуоресценции после фотовыцветания (FRAP). S=(4 Dt)1/2 DL/DR= a 2 (ln k. T/4πa 3ηw-γ) Bacteriorhodopsin a≈4. 3 nm
Быстрая латеральная диффузия липидов и белков в мембране была обнаружена и изучена с помощью флуоресцентной микроскопии методом восстановления флуоресценции после фотовыцветания (FRAP). S=(4 Dt)1/2 DL/DR= a 2 (ln k. T/4πa 3ηw-γ) Bacteriorhodopsin a≈4. 3 nm
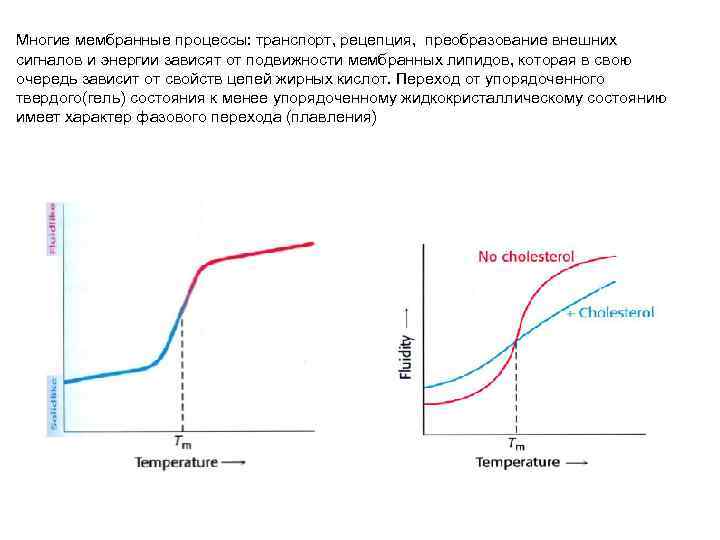 Многие мембранные процессы: транспорт, рецепция, преобразование внешних сигналов и энергии зависят от подвижности мембранных липидов, которая в свою очередь зависит от свойств цепей жирных кислот. Переход от упорядоченного твердого(гель) состояния к менее упорядоченному жидкокристаллическому состоянию имеет характер фазового перехода (плавления)
Многие мембранные процессы: транспорт, рецепция, преобразование внешних сигналов и энергии зависят от подвижности мембранных липидов, которая в свою очередь зависит от свойств цепей жирных кислот. Переход от упорядоченного твердого(гель) состояния к менее упорядоченному жидкокристаллическому состоянию имеет характер фазового перехода (плавления)
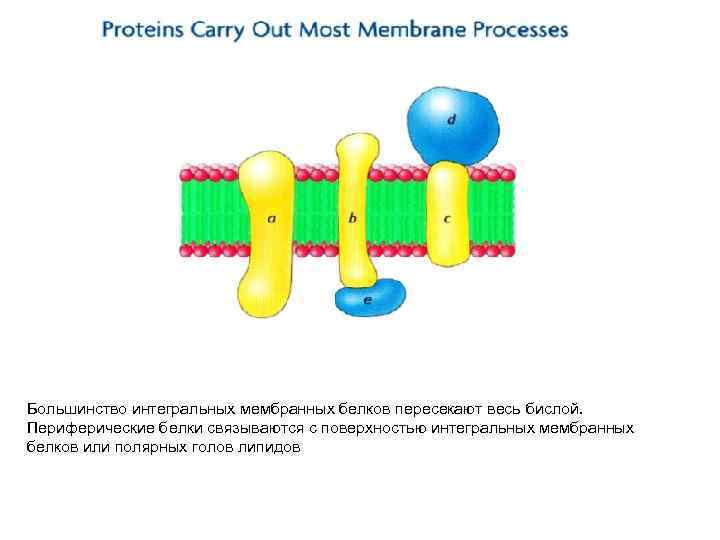 Большинство интегральных мембранных белков пересекают весь бислой. Периферические белки связываются с поверхностью интегральных мембранных белков или полярных голов липидов
Большинство интегральных мембранных белков пересекают весь бислой. Периферические белки связываются с поверхностью интегральных мембранных белков или полярных голов липидов
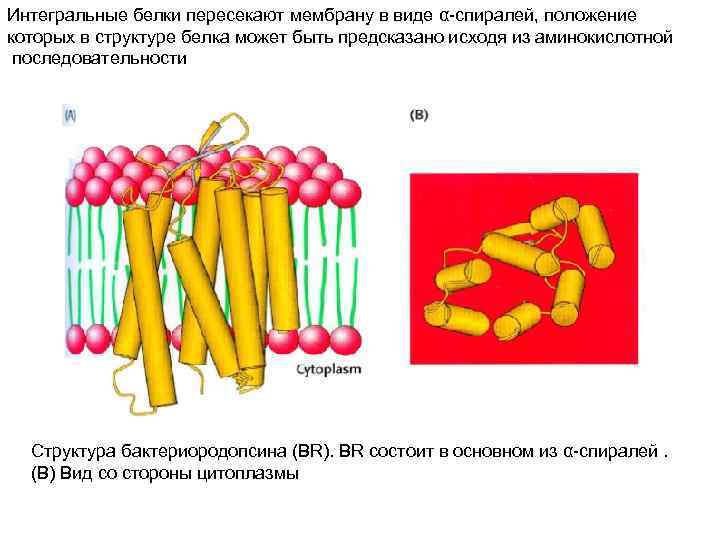 Интегральные белки пересекают мембрану в виде α-спиралей, положение которых в структуре белка может быть предсказано исходя из аминокислотной последовательности Структура бактериородопсина (BR). BR состоит в основном из α-спиралей. (B) Вид со стороны цитоплазмы
Интегральные белки пересекают мембрану в виде α-спиралей, положение которых в структуре белка может быть предсказано исходя из аминокислотной последовательности Структура бактериородопсина (BR). BR состоит в основном из α-спиралей. (B) Вид со стороны цитоплазмы
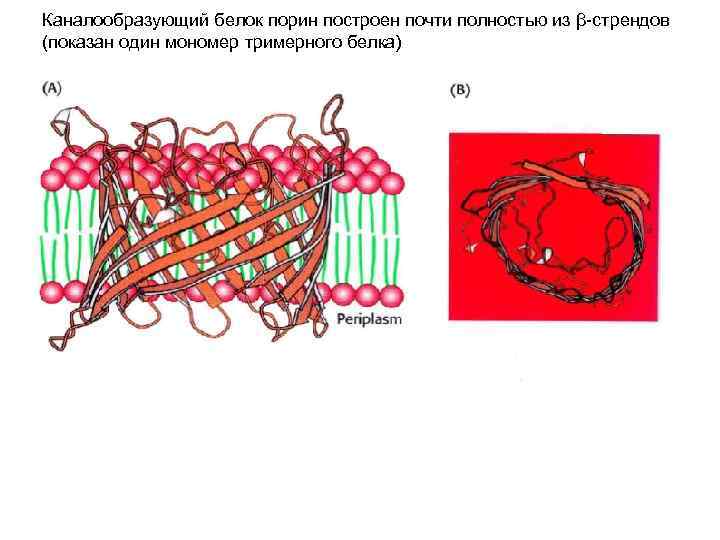 Каналообразующий белок порин построен почти полностью из β-стрендов (показан один мономер тримерного белка)
Каналообразующий белок порин построен почти полностью из β-стрендов (показан один мономер тримерного белка)
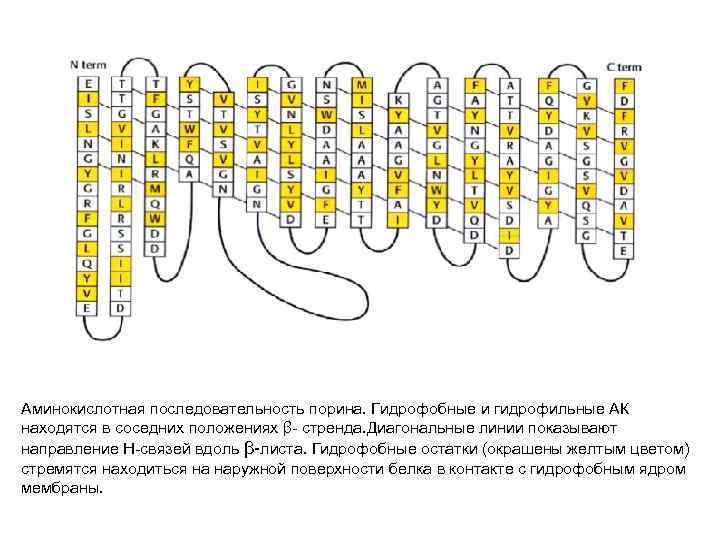 Аминокислотная последовательность порина. Гидрофобные и гидрофильные АК находятся в соседних положениях β- стренда. Диагональные линии показывают направление Н-связей вдоль β-листа. Гидрофобные остатки (окрашены желтым цветом) стремятся находиться на наружной поверхности белка в контакте с гидрофобным ядром мембраны.
Аминокислотная последовательность порина. Гидрофобные и гидрофильные АК находятся в соседних положениях β- стренда. Диагональные линии показывают направление Н-связей вдоль β-листа. Гидрофобные остатки (окрашены желтым цветом) стремятся находиться на наружной поверхности белка в контакте с гидрофобным ядром мембраны.
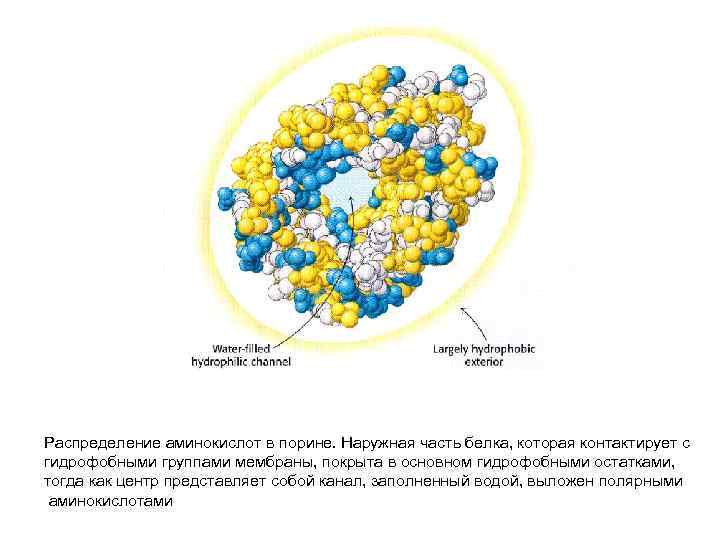 Распределение аминокислот в порине. Наружная часть белка, которая контактирует с гидрофобными группами мембраны, покрыта в основном гидрофобными остатками, тогда как центр представляет собой канал, заполненный водой, выложен полярными аминокислотами
Распределение аминокислот в порине. Наружная часть белка, которая контактирует с гидрофобными группами мембраны, покрыта в основном гидрофобными остатками, тогда как центр представляет собой канал, заполненный водой, выложен полярными аминокислотами
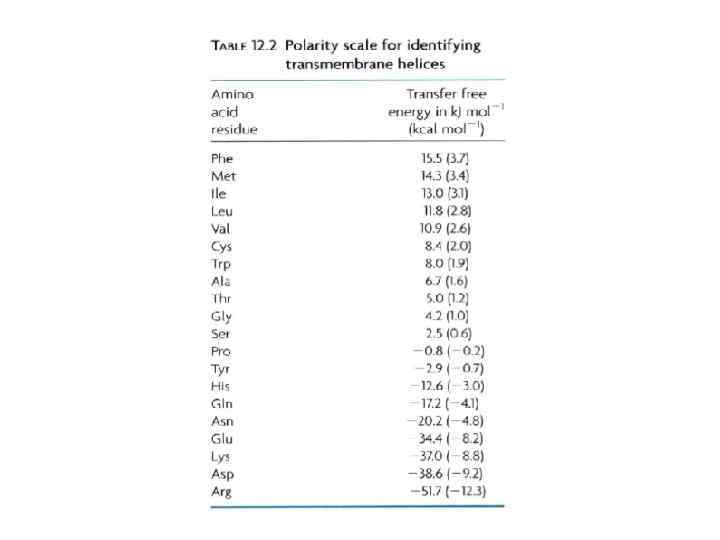
 Мембранные каналы и насосы Селективная проницаемость БМ обеспечивается двумя классами мембранных белков: насосами и каналами. Насосы используют источник свободной энергии – гидролиз АТФ или других макроэргических фосфатов или энергию света (бактериородопсин), чтобы переносить ионы или молекулы через мембрану против градиента их концентраций (активный транспорт). Каналы делают возможным быстрый перенос ионов и молекул по градиенту концентраций (пассивный транспорт или облегченная диффузия).
Мембранные каналы и насосы Селективная проницаемость БМ обеспечивается двумя классами мембранных белков: насосами и каналами. Насосы используют источник свободной энергии – гидролиз АТФ или других макроэргических фосфатов или энергию света (бактериородопсин), чтобы переносить ионы или молекулы через мембрану против градиента их концентраций (активный транспорт). Каналы делают возможным быстрый перенос ионов и молекул по градиенту концентраций (пассивный транспорт или облегченная диффузия).
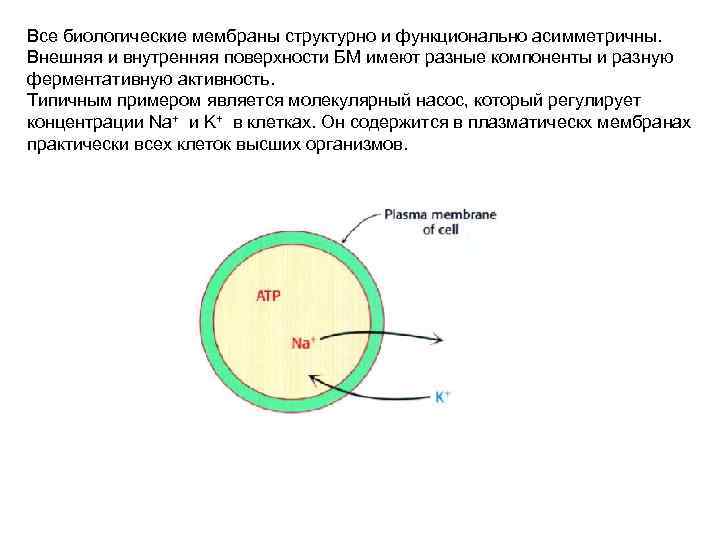 Все биологические мембраны структурно и функционально асимметричны. Внешняя и внутренняя поверхности БМ имеют разные компоненты и разную ферментативную активность. Типичным примером является молекулярный насос, который регулирует концентрации Na+ и K+ в клетках. Он содержится в плазматическх мембранах практически всех клеток высших организмов.
Все биологические мембраны структурно и функционально асимметричны. Внешняя и внутренняя поверхности БМ имеют разные компоненты и разную ферментативную активность. Типичным примером является молекулярный насос, который регулирует концентрации Na+ и K+ в клетках. Он содержится в плазматическх мембранах практически всех клеток высших организмов.
 Неодинаковые концентрации ионов или молекул по обе стороны мембраны представляют собой неравновесное состояние с повышенной свободной энергией, т. к. минимум св. энергии соответствует одинаковым концентрациям. В частности , свободная энергия переноса незаряженной молекулы от концентрации с1 к с2 соответствует изменению энергии на один моль : ΔG =RT ln(c 2/c 1) Для заряженных молекул (ионов) неодинаковые концентрации генерируют наряду с разностью химических потенциалов еще разность электрических потенциалов, так что полное изменение свободной энергии при переносе молекулы из 1 в 2 есть : ΔG=RT ln(c 2/c 1) +z. FΔV Транспорт является активным, т. е. требует затраты энергии если ΔG >0 и пассивным, если ΔG < 0.
Неодинаковые концентрации ионов или молекул по обе стороны мембраны представляют собой неравновесное состояние с повышенной свободной энергией, т. к. минимум св. энергии соответствует одинаковым концентрациям. В частности , свободная энергия переноса незаряженной молекулы от концентрации с1 к с2 соответствует изменению энергии на один моль : ΔG =RT ln(c 2/c 1) Для заряженных молекул (ионов) неодинаковые концентрации генерируют наряду с разностью химических потенциалов еще разность электрических потенциалов, так что полное изменение свободной энергии при переносе молекулы из 1 в 2 есть : ΔG=RT ln(c 2/c 1) +z. FΔV Транспорт является активным, т. е. требует затраты энергии если ΔG >0 и пассивным, если ΔG < 0.
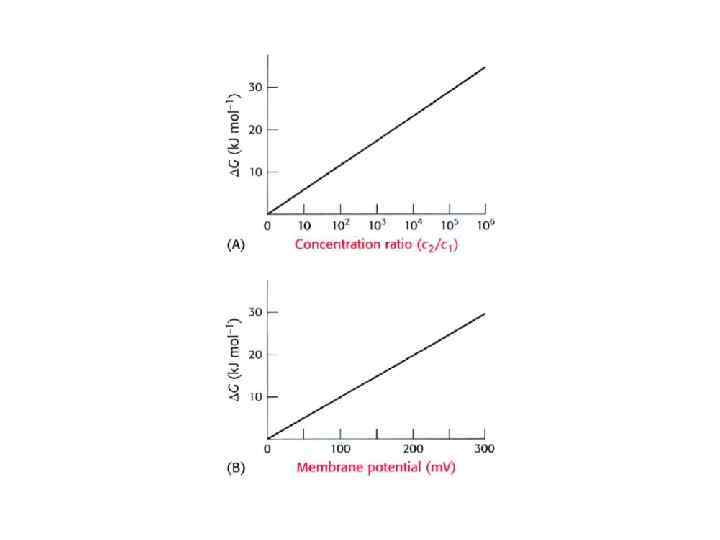
 Внеклеточные концентрации ионов примерно такие, как в морской воде. Однако, клетки должны поддерживать внутриклеточные концентрации ионов, чтобы предотвратить нежелательное воздействие больших концентраций, например, ионов Са или ускорить другие процессы. Большинство клеток животных имеют высокие внутриклеточные концентрации К и низкие концентрации ионов Na относительно внешней среды. Эти ионные градиенты создаются и поддерживаются cпециальными транспортными ферментами - Na, K- АТФазами, которые за счет энергии гидролиза АТФ переносят ионы против градиента их концентраций. Концентрации Na снаружи и внутри клетки соответственно 143 и 4 м. М, а ионов К 4 и 157 м. М. При мембранном потенциале -50 m. V и температуре 37 С свободная энергия переноса 3 молей Na из клетки и 2 молей К в клетку +36. 9 кдж/моль (+8. 8 ккал/моль). Гидролиз одной молекулы АТФ дает достаточно св. энергии для одного транспортного цикла - 50 кдж/моль (12 ккал/моль). Примерно треть всех синтезируемых молекул АТФ используется для создания этих градиентов, которые необходимы для поддержания объема клетки, возбудимости клеток нейронов и мышц, транспорта сахаров и аминокислот.
Внеклеточные концентрации ионов примерно такие, как в морской воде. Однако, клетки должны поддерживать внутриклеточные концентрации ионов, чтобы предотвратить нежелательное воздействие больших концентраций, например, ионов Са или ускорить другие процессы. Большинство клеток животных имеют высокие внутриклеточные концентрации К и низкие концентрации ионов Na относительно внешней среды. Эти ионные градиенты создаются и поддерживаются cпециальными транспортными ферментами - Na, K- АТФазами, которые за счет энергии гидролиза АТФ переносят ионы против градиента их концентраций. Концентрации Na снаружи и внутри клетки соответственно 143 и 4 м. М, а ионов К 4 и 157 м. М. При мембранном потенциале -50 m. V и температуре 37 С свободная энергия переноса 3 молей Na из клетки и 2 молей К в клетку +36. 9 кдж/моль (+8. 8 ккал/моль). Гидролиз одной молекулы АТФ дает достаточно св. энергии для одного транспортного цикла - 50 кдж/моль (12 ккал/моль). Примерно треть всех синтезируемых молекул АТФ используется для создания этих градиентов, которые необходимы для поддержания объема клетки, возбудимости клеток нейронов и мышц, транспорта сахаров и аминокислот.
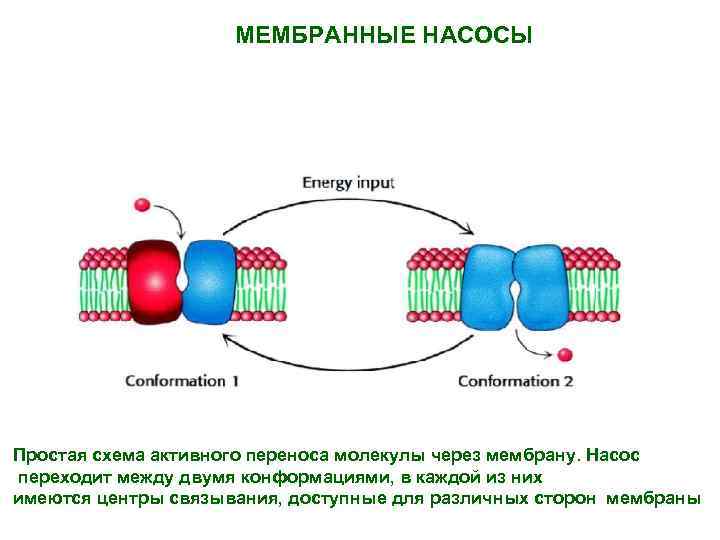 МЕМБРАННЫЕ НАСОСЫ Простая схема активного переноса молекулы через мембрану. Насос переходит между двумя конформациями, в каждой из них имеются центры связывания, доступные для различных сторон мембраны
МЕМБРАННЫЕ НАСОСЫ Простая схема активного переноса молекулы через мембрану. Насос переходит между двумя конформациями, в каждой из них имеются центры связывания, доступные для различных сторон мембраны
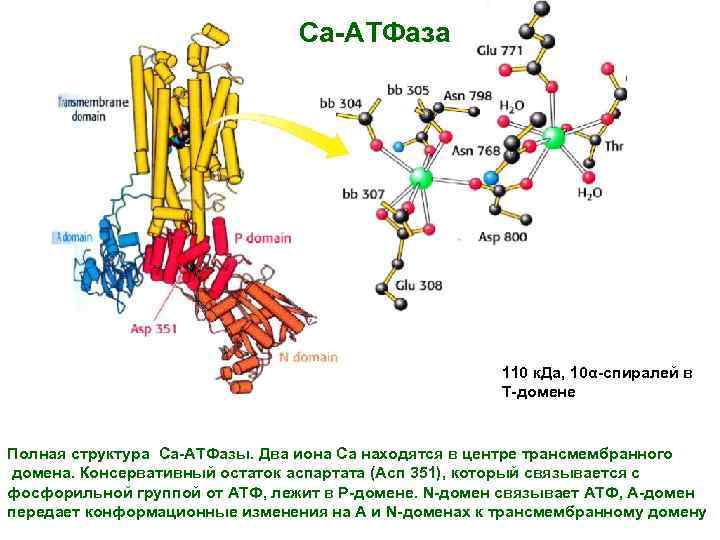 Са-АТФаза 110 к. Да, 10α-спиралей в Т-домене Полная структура Са-АТФазы. Два иона Са находятся в центре трансмембранного домена. Консервативный остаток аспартата (Асп 351), который связывается с фосфорильной группой от АТФ, лежит в Р-домене. N-домен связывает АТФ, А-домен передает конформационные изменения на А и N-доменах к трансмембранному домену
Са-АТФаза 110 к. Да, 10α-спиралей в Т-домене Полная структура Са-АТФазы. Два иона Са находятся в центре трансмембранного домена. Консервативный остаток аспартата (Асп 351), который связывается с фосфорильной группой от АТФ, лежит в Р-домене. N-домен связывает АТФ, А-домен передает конформационные изменения на А и N-доменах к трансмембранному домену
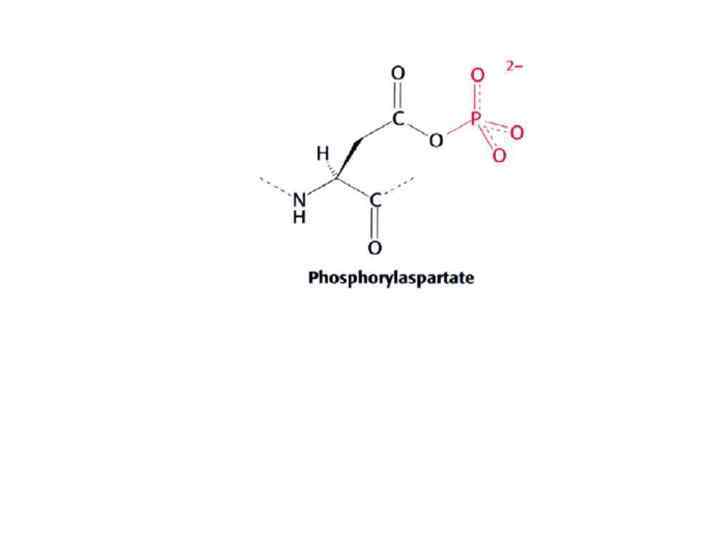
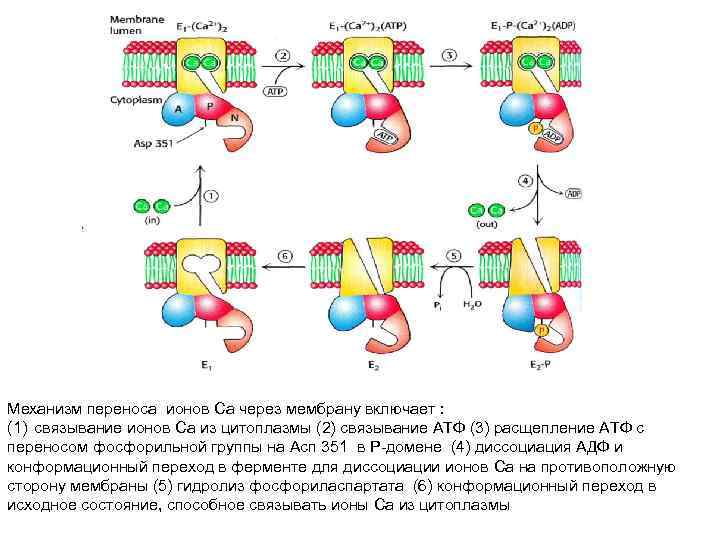 Механизм переноса ионов Са через мембрану включает : (1) связывание ионов Са из цитоплазмы (2) связывание АТФ (3) расщепление АТФ с переносом фосфорильной группы на Асп 351 в Р-домене (4) диссоциация АДФ и конформационный переход в ферменте для диссоциации ионов Са на противоположную сторону мембраны (5) гидролиз фосфориласпартата (6) конформационный переход в исходное состояние, способное связывать ионы Са из цитоплазмы
Механизм переноса ионов Са через мембрану включает : (1) связывание ионов Са из цитоплазмы (2) связывание АТФ (3) расщепление АТФ с переносом фосфорильной группы на Асп 351 в Р-домене (4) диссоциация АДФ и конформационный переход в ферменте для диссоциации ионов Са на противоположную сторону мембраны (5) гидролиз фосфориласпартата (6) конформационный переход в исходное состояние, способное связывать ионы Са из цитоплазмы
 Насосы транспортируют ионы через мембрану со скоростями ~ 1000 ионов/сек Другие мембранные белки, т. н. ионные каналы, за счет пассивного транспорта способны переносить ионы со скоростями в 1000 раз большими. Такие скорости приближаются к cкоростям свободной диффузии в водном растворе. Однако, насосы являются не просто полыми трубками – это молекулярные машины, которые управляются физическими или химическими воздействиями и в результате претерпевают конформационные переходы. .
Насосы транспортируют ионы через мембрану со скоростями ~ 1000 ионов/сек Другие мембранные белки, т. н. ионные каналы, за счет пассивного транспорта способны переносить ионы со скоростями в 1000 раз большими. Такие скорости приближаются к cкоростям свободной диффузии в водном растворе. Однако, насосы являются не просто полыми трубками – это молекулярные машины, которые управляются физическими или химическими воздействиями и в результате претерпевают конформационные переходы. .
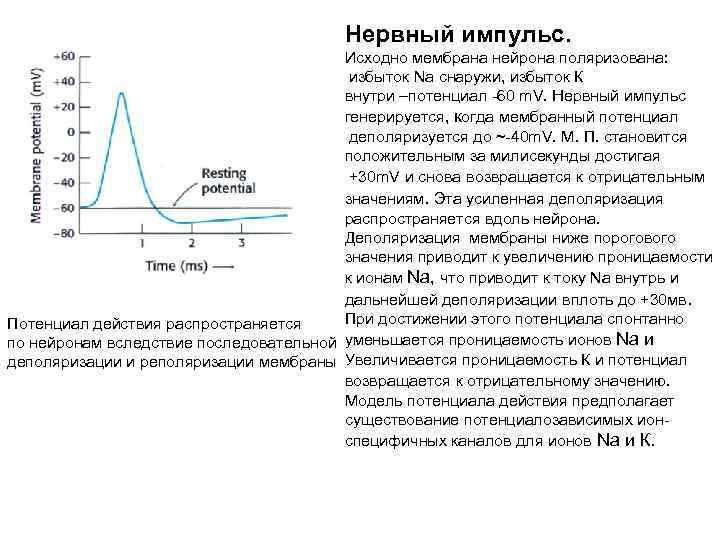 Нервный импульс. Исходно мембрана нейрона поляризована: избыток Na снаружи, избыток К внутри –потенциал -60 m. V. Нервный импульс генерируется, когда мембранный потенциал деполяризуется до ~-40 m. V. М. П. становится положительным за милисекунды достигая +30 m. V и снова возвращается к отрицательным значениям. Эта усиленная деполяризация распространяется вдоль нейрона. Деполяризация мембраны ниже порогового значения приводит к увеличению проницаемости к ионам Na, что приводит к току Na внутрь и дальнейшей деполяризации вплоть до +30 мв. При достижении этого потенциала спонтанно Потенциал действия распространяется по нейронам вследствие последовательной уменьшается проницаемость ионов Na и деполяризации и реполяризации мембраны Увеличивается проницаемость К и потенциал возвращается к отрицательному значению. Модель потенциала действия предполагает существование потенциалозависимых ионспецифичных каналов для ионов Na и К.
Нервный импульс. Исходно мембрана нейрона поляризована: избыток Na снаружи, избыток К внутри –потенциал -60 m. V. Нервный импульс генерируется, когда мембранный потенциал деполяризуется до ~-40 m. V. М. П. становится положительным за милисекунды достигая +30 m. V и снова возвращается к отрицательным значениям. Эта усиленная деполяризация распространяется вдоль нейрона. Деполяризация мембраны ниже порогового значения приводит к увеличению проницаемости к ионам Na, что приводит к току Na внутрь и дальнейшей деполяризации вплоть до +30 мв. При достижении этого потенциала спонтанно Потенциал действия распространяется по нейронам вследствие последовательной уменьшается проницаемость ионов Na и деполяризации и реполяризации мембраны Увеличивается проницаемость К и потенциал возвращается к отрицательному значению. Модель потенциала действия предполагает существование потенциалозависимых ионспецифичных каналов для ионов Na и К.
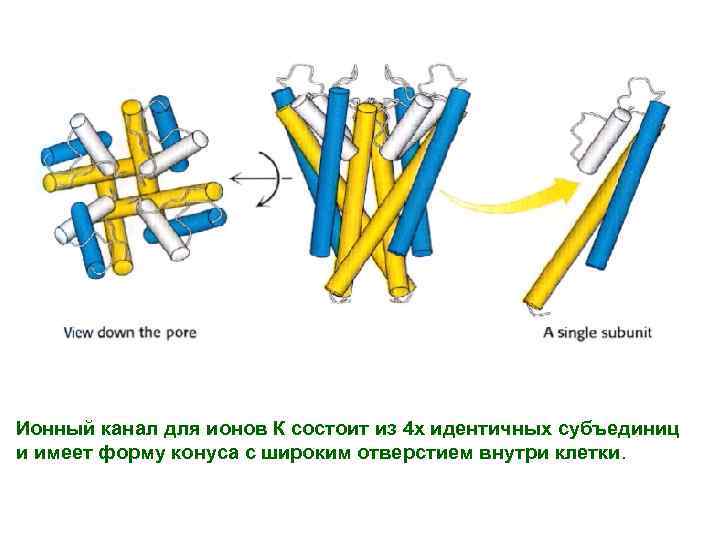 Ионный канал для ионов К состоит из 4 х идентичных субъединиц и имеет форму конуса с широким отверстием внутри клетки.
Ионный канал для ионов К состоит из 4 х идентичных субъединиц и имеет форму конуса с широким отверстием внутри клетки.
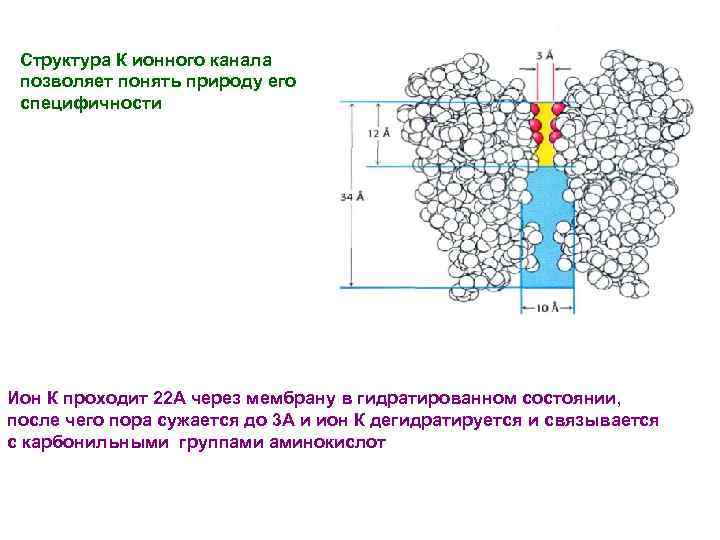 Структура К ионного канала позволяет понять природу его специфичности Ион К проходит 22 А через мембрану в гидратированном состоянии, после чего пора сужается до 3 А и ион К дегидратируется и связывается с карбонильными группами аминокислот
Структура К ионного канала позволяет понять природу его специфичности Ион К проходит 22 А через мембрану в гидратированном состоянии, после чего пора сужается до 3 А и ион К дегидратируется и связывается с карбонильными группами аминокислот
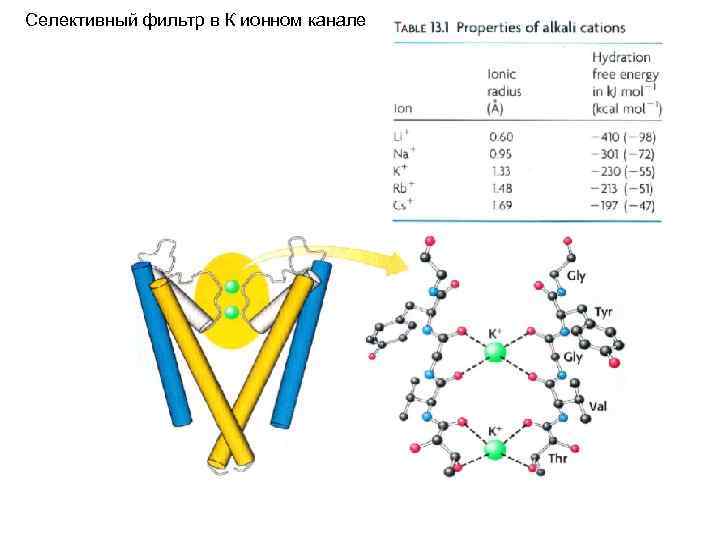 Селективный фильтр в К ионном канале
Селективный фильтр в К ионном канале
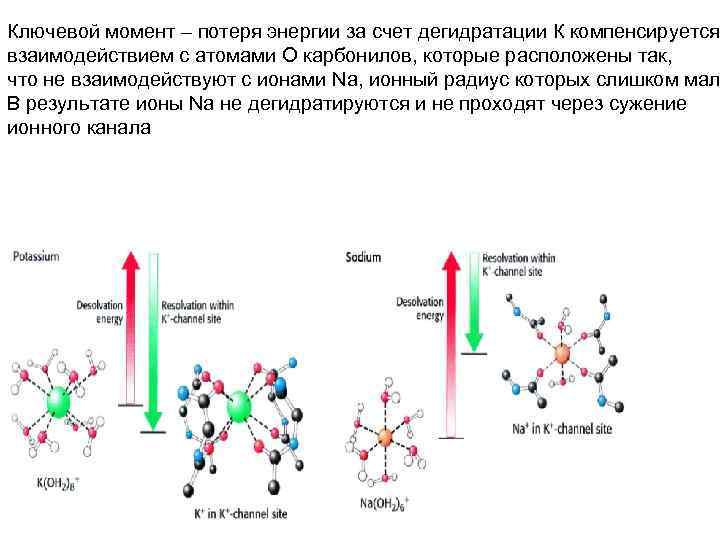 Ключевой момент – потеря энергии за счет дегидратации К компенсируется взаимодействием с атомами О карбонилов, которые расположены так, что не взаимодействуют с ионами Na, ионный радиус которых слишком мал В результате ионы Na не дегидратируются и не проходят через сужение ионного канала
Ключевой момент – потеря энергии за счет дегидратации К компенсируется взаимодействием с атомами О карбонилов, которые расположены так, что не взаимодействуют с ионами Na, ионный радиус которых слишком мал В результате ионы Na не дегидратируются и не проходят через сужение ионного канала
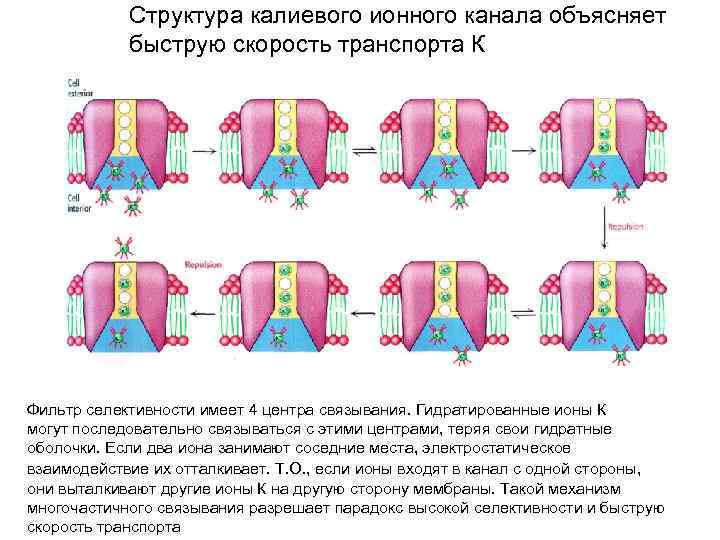 Структура калиевого ионного канала объясняет быструю скорость транспорта К Фильтр селективности имеет 4 центра связывания. Гидратированные ионы К могут последовательно связываться с этими центрами, теряя свои гидратные оболочки. Если два иона занимают соседние места, электростатическое взаимодействие их отталкивает. Т. О. , если ионы входят в канал с одной стороны , они выталкивают другие ионы К на другую сторону мембраны. Такой механизм многочастичного связывания разрешает парадокс высокой селективности и быструю скорость транспорта
Структура калиевого ионного канала объясняет быструю скорость транспорта К Фильтр селективности имеет 4 центра связывания. Гидратированные ионы К могут последовательно связываться с этими центрами, теряя свои гидратные оболочки. Если два иона занимают соседние места, электростатическое взаимодействие их отталкивает. Т. О. , если ионы входят в канал с одной стороны , они выталкивают другие ионы К на другую сторону мембраны. Такой механизм многочастичного связывания разрешает парадокс высокой селективности и быструю скорость транспорта
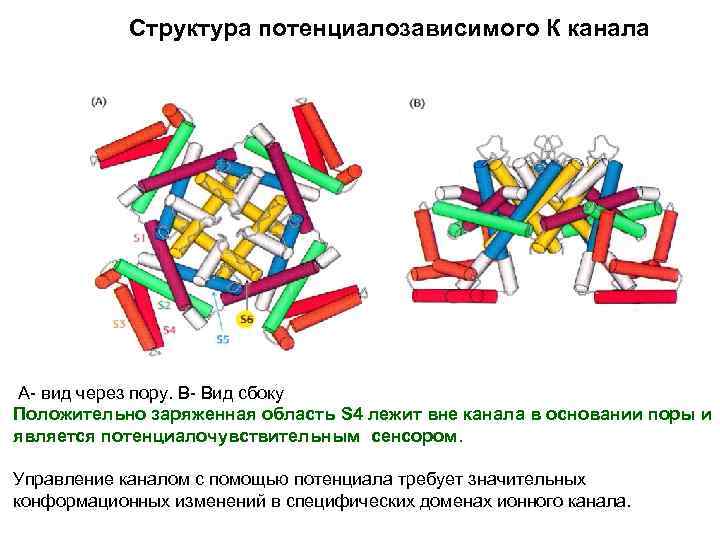 Структура потенциалозависимого К канала А- вид через пору. В- Вид сбоку Положительно заряженная область S 4 лежит вне канала в основании поры и является потенциалочувствительным сенсором. Управление каналом с помощью потенциала требует значительных конформационных изменений в специфических доменах ионного канала.
Структура потенциалозависимого К канала А- вид через пору. В- Вид сбоку Положительно заряженная область S 4 лежит вне канала в основании поры и является потенциалочувствительным сенсором. Управление каналом с помощью потенциала требует значительных конформационных изменений в специфических доменах ионного канала.
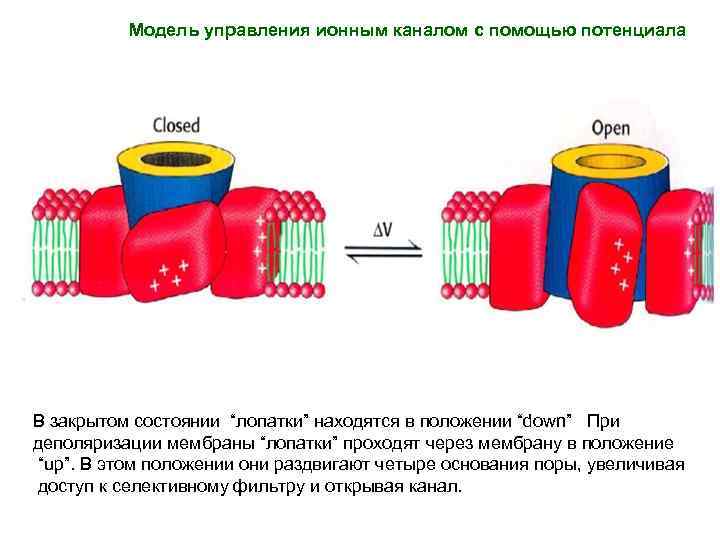 Модель управления ионным каналом с помощью потенциала В закрытом состоянии “лопатки” находятся в положении “down” При деполяризации мембраны “лопатки” проходят через мембрану в положение “up”. В этом положении они раздвигают четыре основания поры, увеличивая доступ к селективному фильтру и открывая канал.
Модель управления ионным каналом с помощью потенциала В закрытом состоянии “лопатки” находятся в положении “down” При деполяризации мембраны “лопатки” проходят через мембрану в положение “up”. В этом положении они раздвигают четыре основания поры, увеличивая доступ к селективному фильтру и открывая канал.
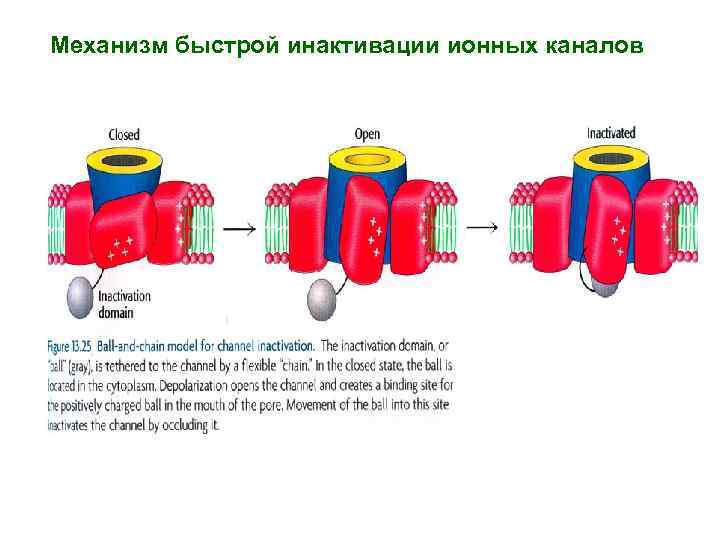 Механизм быстрой инактивации ионных каналов
Механизм быстрой инактивации ионных каналов
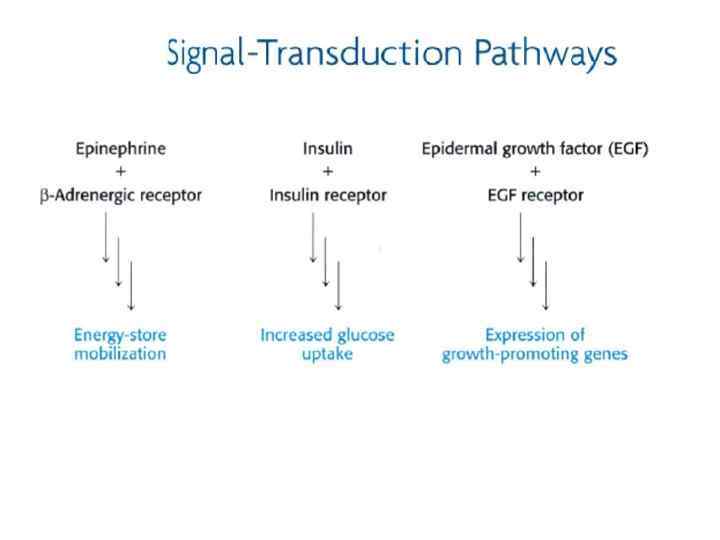
 1. Появление сигнальной молекулы –первичного мессенджера (напр. рана, переваривание еды и др. ) 2. Рецепция сигнальной молекулы 3. Передача сигнала внутрь клетки с помощью второго мессенджера, концентрация которого изменяется в результате взаимодействия сигнальной молекулы с рецептором (циклический АМФ, циклический ГМФ, ионы Са и др. ) Усиление: один рецептор генерирует много вторичных мессенджеров 4. Активация эффекторов, которые непосредственно изменяют физиологический отклик. Конечный эффект внешнего сигнала – активация (или ингибирование насосов, ионных каналов, ферментов, факторов транскрипции генов 5. Окончание действия сигнала необходимо для приема следующих сигналов и сохранения клетки. Отсутствие терминации – в случае действия токсинов, развития ракового процесса
1. Появление сигнальной молекулы –первичного мессенджера (напр. рана, переваривание еды и др. ) 2. Рецепция сигнальной молекулы 3. Передача сигнала внутрь клетки с помощью второго мессенджера, концентрация которого изменяется в результате взаимодействия сигнальной молекулы с рецептором (циклический АМФ, циклический ГМФ, ионы Са и др. ) Усиление: один рецептор генерирует много вторичных мессенджеров 4. Активация эффекторов, которые непосредственно изменяют физиологический отклик. Конечный эффект внешнего сигнала – активация (или ингибирование насосов, ионных каналов, ферментов, факторов транскрипции генов 5. Окончание действия сигнала необходимо для приема следующих сигналов и сохранения клетки. Отсутствие терминации – в случае действия токсинов, развития ракового процесса
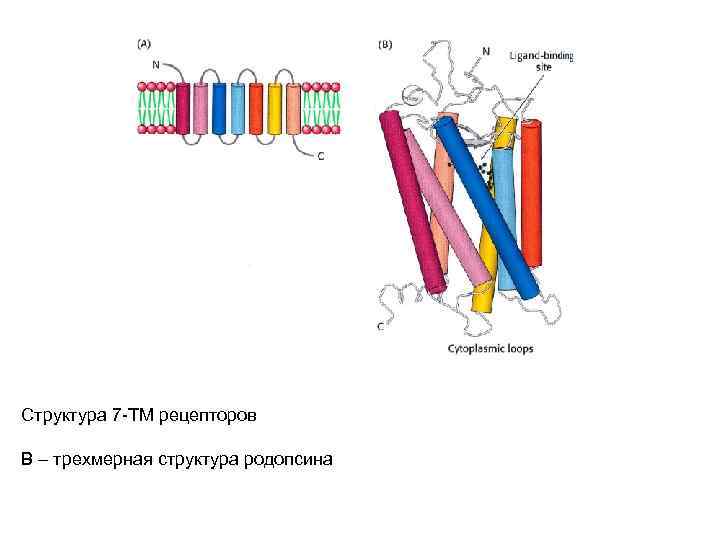 Структура 7 -ТМ рецепторов В – трехмерная структура родопсина
Структура 7 -ТМ рецепторов В – трехмерная структура родопсина
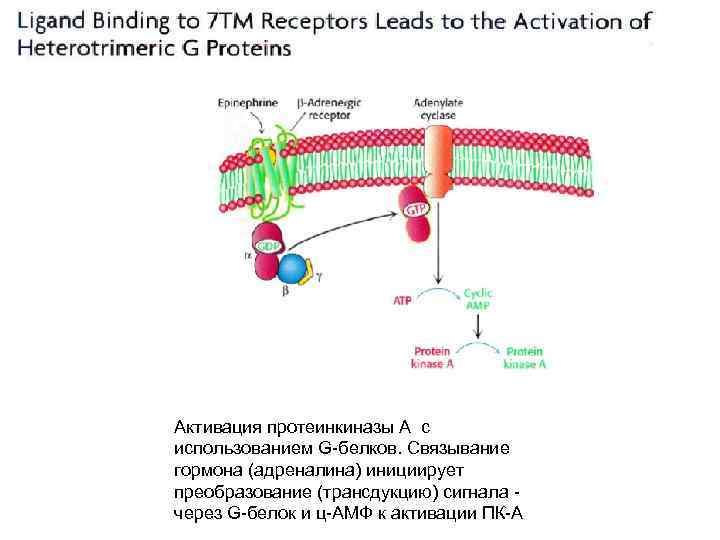 Активация протеинкиназы А с использованием G-белков. Связывание гормона (адреналина) инициирует преобразование (трансдукцию) сигнала через G-белок и ц-АМФ к активации ПК-А
Активация протеинкиназы А с использованием G-белков. Связывание гормона (адреналина) инициирует преобразование (трансдукцию) сигнала через G-белок и ц-АМФ к активации ПК-А
 Сетчатка человека содержит 3 106 колбочек и 108 палочек. Одна палочка производит отклик на один фотон. 10 таких откликов необходимо для мозга чтобы зарегистрировать вспышку света
Сетчатка человека содержит 3 106 колбочек и 108 палочек. Одна палочка производит отклик на один фотон. 10 таких откликов необходимо для мозга чтобы зарегистрировать вспышку света
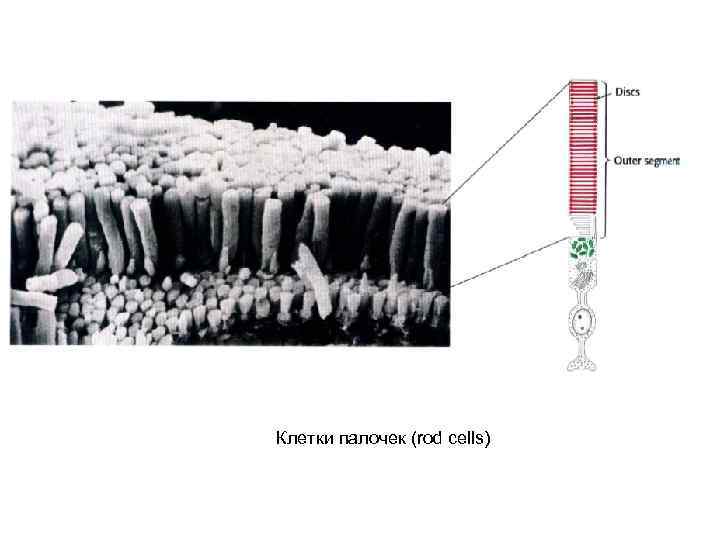 Клетки палочек (rod cells)
Клетки палочек (rod cells)

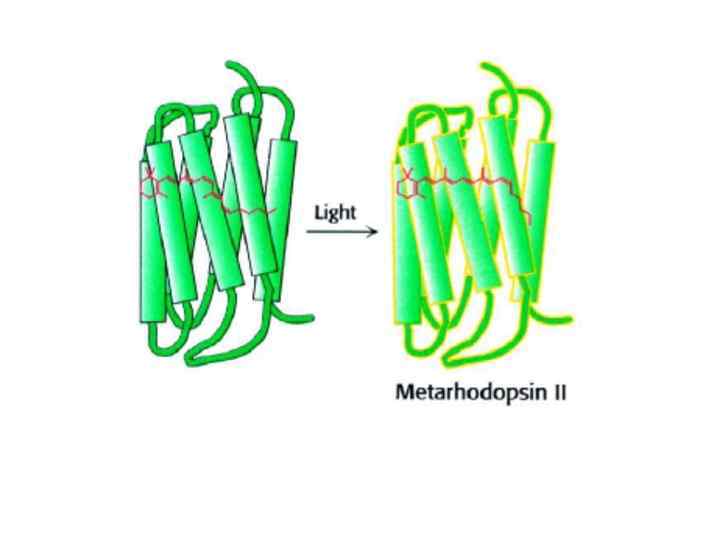
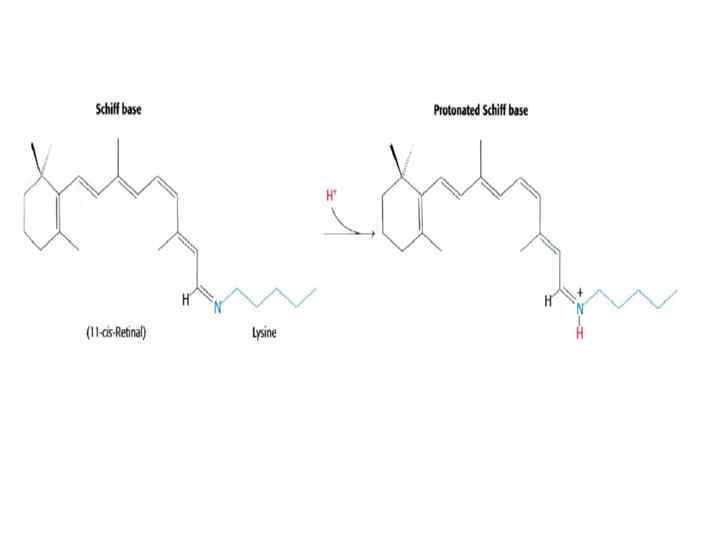
 Светоиндуцированное понижение уровня Са координирует восстановление к исходному состоянию. Зрительная система реагирует на изменения света и цвета за 1/1000 сек. Чтобы достичь такого быстрого отклика, сигнал должен заканчиваться быстро и система возвращаться в исходное состояние. Для этого, во первых, нужно блокировать активирование трансдуцина (Т) активированным родопсином (Р). Родопсин киназа катализирует фосфорилирование Р по сериновым и треониновым остаткам. После этого аррестин связывается с фосфорилированным Р, препятствуя взаимодействию Р с Т. Во вторых, а-субъединицу Т нужно вернуть в исходное неактивное состояние. Наконец, нужно увеличить уровень ц-ГМФ, что делает ГЦ, катализируя первращение ГТФ в ц-ГМФ. Увеличение ц-ГМФ приходит к открыванию ц-ГМФ акивируемых каналов
Светоиндуцированное понижение уровня Са координирует восстановление к исходному состоянию. Зрительная система реагирует на изменения света и цвета за 1/1000 сек. Чтобы достичь такого быстрого отклика, сигнал должен заканчиваться быстро и система возвращаться в исходное состояние. Для этого, во первых, нужно блокировать активирование трансдуцина (Т) активированным родопсином (Р). Родопсин киназа катализирует фосфорилирование Р по сериновым и треониновым остаткам. После этого аррестин связывается с фосфорилированным Р, препятствуя взаимодействию Р с Т. Во вторых, а-субъединицу Т нужно вернуть в исходное неактивное состояние. Наконец, нужно увеличить уровень ц-ГМФ, что делает ГЦ, катализируя первращение ГТФ в ц-ГМФ. Увеличение ц-ГМФ приходит к открыванию ц-ГМФ акивируемых каналов
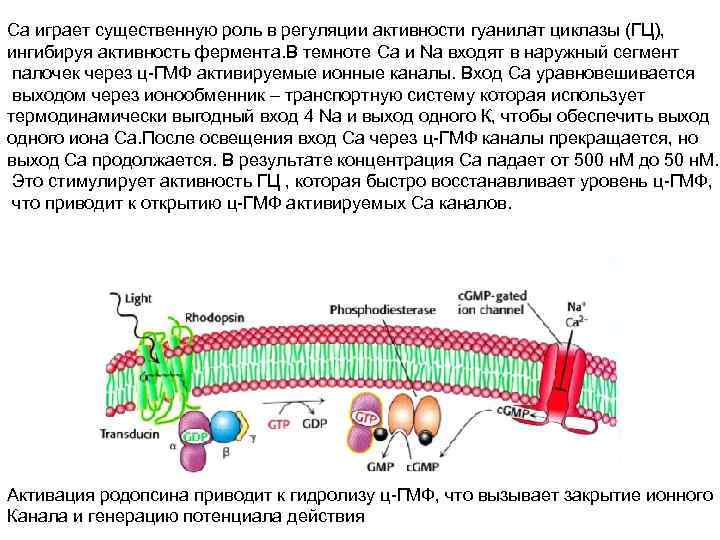 Са играет существенную роль в регуляции активности гуанилат циклазы (ГЦ), ингибируя активность фермента. В темноте Са и Na входят в наружный сегмент палочек через ц-ГМФ активируемые ионные каналы. Вход Са уравновешивается выходом через ионообменник – транспортную систему которая использует термодинамически выгодный вход 4 Na и выход одного К, чтобы обеспечить выход одного иона Са. После освещения вход Са через ц-ГМФ каналы прекращается, но выход Са продолжается. В результате концентрация Са падает от 500 н. M до 50 н. M. Это стимулирует активность ГЦ , которая быстро восстанавливает уровень ц-ГМФ, что приводит к открытию ц-ГМФ активируемых Са каналов. Активация родопсина приводит к гидролизу ц-ГМФ, что вызывает закрытие ионного Канала и генерацию потенциала действия
Са играет существенную роль в регуляции активности гуанилат циклазы (ГЦ), ингибируя активность фермента. В темноте Са и Na входят в наружный сегмент палочек через ц-ГМФ активируемые ионные каналы. Вход Са уравновешивается выходом через ионообменник – транспортную систему которая использует термодинамически выгодный вход 4 Na и выход одного К, чтобы обеспечить выход одного иона Са. После освещения вход Са через ц-ГМФ каналы прекращается, но выход Са продолжается. В результате концентрация Са падает от 500 н. M до 50 н. M. Это стимулирует активность ГЦ , которая быстро восстанавливает уровень ц-ГМФ, что приводит к открытию ц-ГМФ активируемых Са каналов. Активация родопсина приводит к гидролизу ц-ГМФ, что вызывает закрытие ионного Канала и генерацию потенциала действия

