РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ Омская государственная медицинская академия Кафедра

















































38-kursy_rastvory._dissociaciya.pptx
- Количество слайдов: 103
 РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ Омская государственная медицинская академия Кафедра химии Общие свойства растворов. Электролитическая диссоциация в водных растворах. Реакции ионного обмена в растворах электролитов. Лектор: Степанова Ирина Петровна, доктор биологических наук, профессор, зав. кафедрой химии
РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ Омская государственная медицинская академия Кафедра химии Общие свойства растворов. Электролитическая диссоциация в водных растворах. Реакции ионного обмена в растворах электролитов. Лектор: Степанова Ирина Петровна, доктор биологических наук, профессор, зав. кафедрой химии
 Медико-биологическое значение темы Растворы играют большую роль в процессах жизнедеятельности. Важнейшие физиологические жидкости – кровь, лимфа, желудочное и кишечное содержимое, моча, слюна – являются растворами.
Медико-биологическое значение темы Растворы играют большую роль в процессах жизнедеятельности. Важнейшие физиологические жидкости – кровь, лимфа, желудочное и кишечное содержимое, моча, слюна – являются растворами.
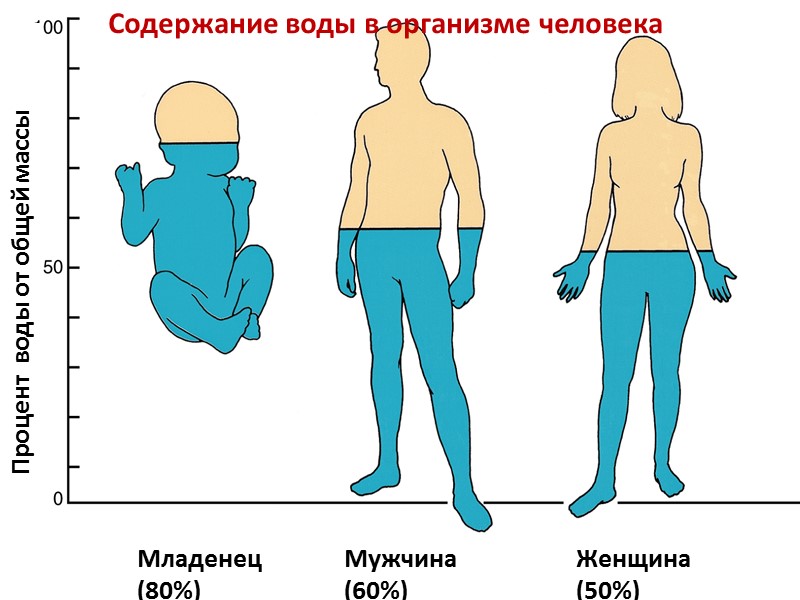
 Содержание воды в организме человека
Содержание воды в организме человека
 Медико-биологическое значение темы Процессы усвоения пищи, действие ферментов, лекарственных препаратов и др. реакции в организме обычно протекают в растворах.
Медико-биологическое значение темы Процессы усвоения пищи, действие ферментов, лекарственных препаратов и др. реакции в организме обычно протекают в растворах.
 Раствор – физико-химическая система, состоящая из двух или большего числа веществ и имеющая переменный состав в некотором интервале соотношения компонентов. Растворы
Раствор – физико-химическая система, состоящая из двух или большего числа веществ и имеющая переменный состав в некотором интервале соотношения компонентов. Растворы
 Растворы Растворы занимают промежуточное положение между смесями веществ и химическими соединениями. С механическими смесями растворы сближает переменность по составу, а с химическими соединениями - тепловые эффекты, сопровождающие растворение большинства веществ.
Растворы Растворы занимают промежуточное положение между смесями веществ и химическими соединениями. С механическими смесями растворы сближает переменность по составу, а с химическими соединениями - тепловые эффекты, сопровождающие растворение большинства веществ.
 Растворы Компоненты раствора Растворитель Растворенное вещество Среда Вещество, равномерно распределяемое в растворителе в виде молекул и ионов.
Растворы Компоненты раствора Растворитель Растворенное вещество Среда Вещество, равномерно распределяемое в растворителе в виде молекул и ионов.
 Растворы В растворах электролитов независимо от концентрации электролит рассматривается как растворенное вещество. Например, в 70%-ном растворе азотной кислоты растворенным веществом является HNO3, хотя HNO3 находится в большем количестве (70% по массе), а растворителем – вода.
Растворы В растворах электролитов независимо от концентрации электролит рассматривается как растворенное вещество. Например, в 70%-ном растворе азотной кислоты растворенным веществом является HNO3, хотя HNO3 находится в большем количестве (70% по массе), а растворителем – вода.
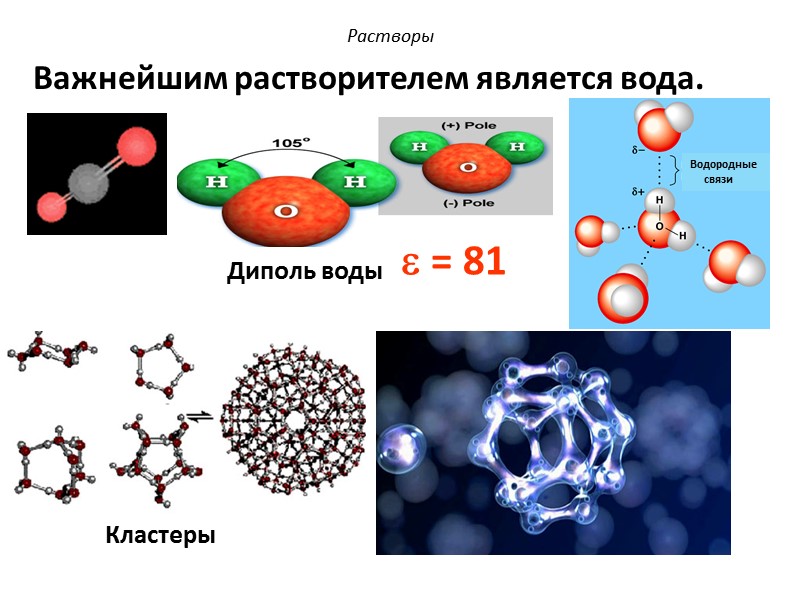
 Растворы Важнейшим растворителем является вода. Водородные связи = 81 Диполь воды Кластеры
Растворы Важнейшим растворителем является вода. Водородные связи = 81 Диполь воды Кластеры
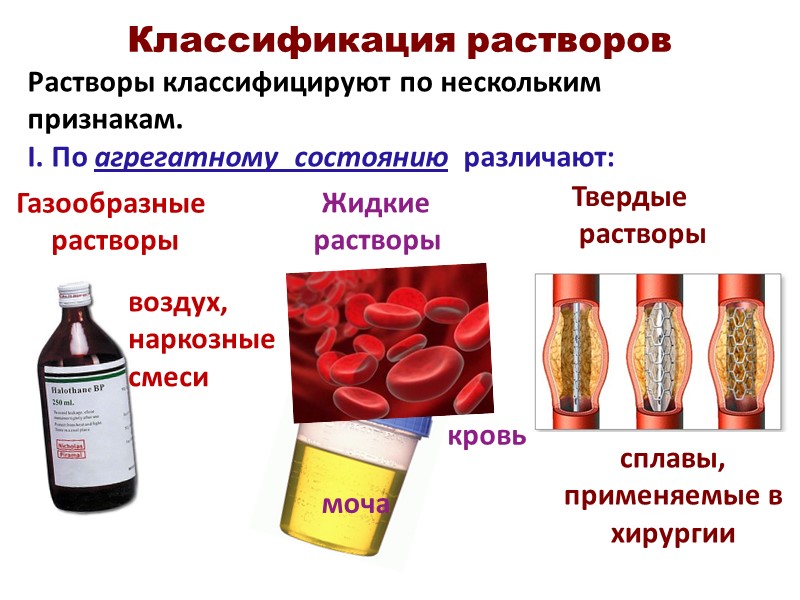
 Классификация растворов Растворы классифицируют по нескольким признакам. I. По агрегатному состоянию различают: кровь моча воздух, наркозные смеси сплавы, применяемые в хирургии Газообразные растворы Жидкие растворы Твердые растворы
Классификация растворов Растворы классифицируют по нескольким признакам. I. По агрегатному состоянию различают: кровь моча воздух, наркозные смеси сплавы, применяемые в хирургии Газообразные растворы Жидкие растворы Твердые растворы
 II. По молярной массе растворенного вещества различают: М(Х) < 5000 г/моль Главной особенностью растворов ВМВ является существенное различие в размерах между макромолекулами полимеров и молекулами низкомолекулярного растворителя. растворы НМВ растворы ВМВ М(Х)> 5000 г/моль Классификация растворов
II. По молярной массе растворенного вещества различают: М(Х) < 5000 г/моль Главной особенностью растворов ВМВ является существенное различие в размерах между макромолекулами полимеров и молекулами низкомолекулярного растворителя. растворы НМВ растворы ВМВ М(Х)> 5000 г/моль Классификация растворов
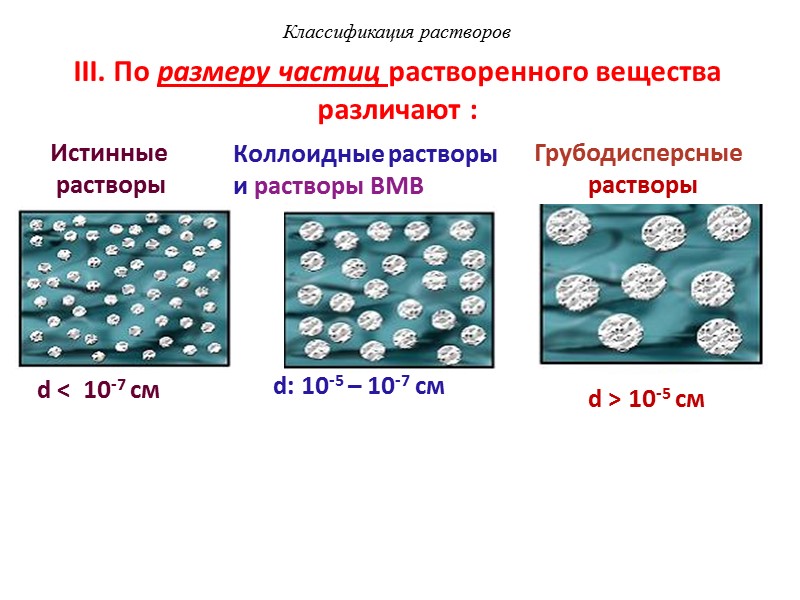
 III. По размеру частиц растворенного вещества различают : Грубодисперсные растворы d ˂ 10-7 см Истинные растворы Коллоидные растворы и растворы ВМВ d ˃ 10-5 см d: 10-5 – 10-7 см Классификация растворов
III. По размеру частиц растворенного вещества различают : Грубодисперсные растворы d ˂ 10-7 см Истинные растворы Коллоидные растворы и растворы ВМВ d ˃ 10-5 см d: 10-5 – 10-7 см Классификация растворов
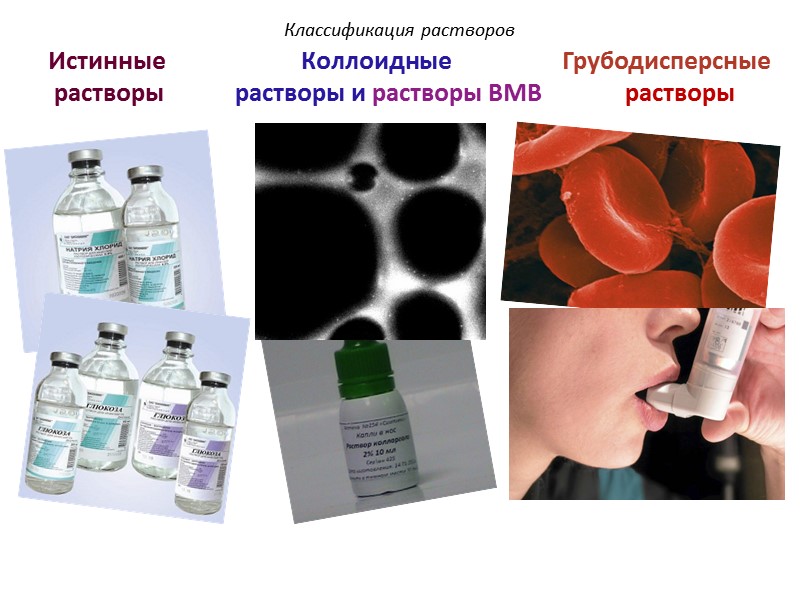
 Классификация растворов Истинные Коллоидные Грубодисперсные растворы растворы и растворы ВМВ растворы
Классификация растворов Истинные Коллоидные Грубодисперсные растворы растворы и растворы ВМВ растворы
 Растворение При растворении образуются: соединения, называемые сольватами; если растворителем является вода, то полученные соединения называются гидратами; если гидратная вода входит в состав кристаллов, то соединения называются кристаллогидратами. Например, Растворение — физико-химический процесс, протекающий между твердой и жидкой фазами и характеризующийся переходами твердого вещества в раствор.
Растворение При растворении образуются: соединения, называемые сольватами; если растворителем является вода, то полученные соединения называются гидратами; если гидратная вода входит в состав кристаллов, то соединения называются кристаллогидратами. Например, Растворение — физико-химический процесс, протекающий между твердой и жидкой фазами и характеризующийся переходами твердого вещества в раствор.
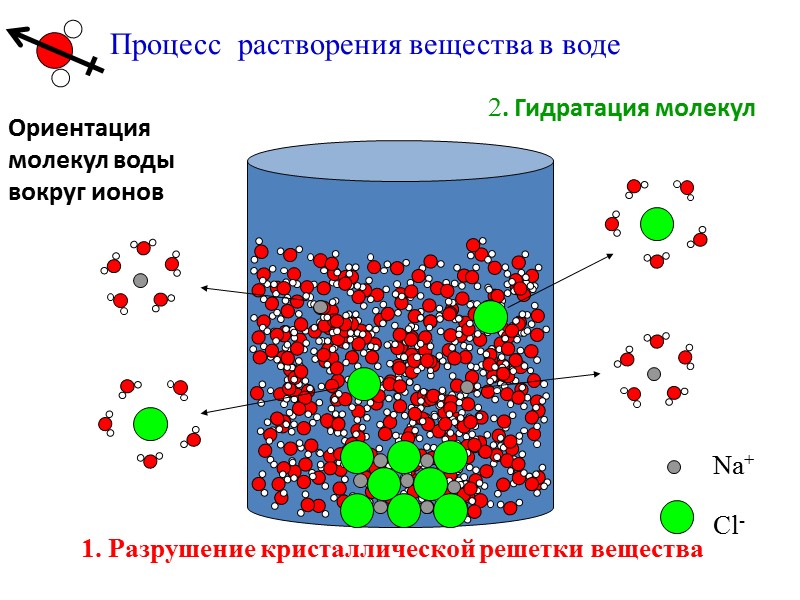
 Процесс растворения вещества в воде 1. Разрушение кристаллической решетки вещества 2. Гидратация молекул Ориентация молекул воды вокруг ионов
Процесс растворения вещества в воде 1. Разрушение кристаллической решетки вещества 2. Гидратация молекул Ориентация молекул воды вокруг ионов
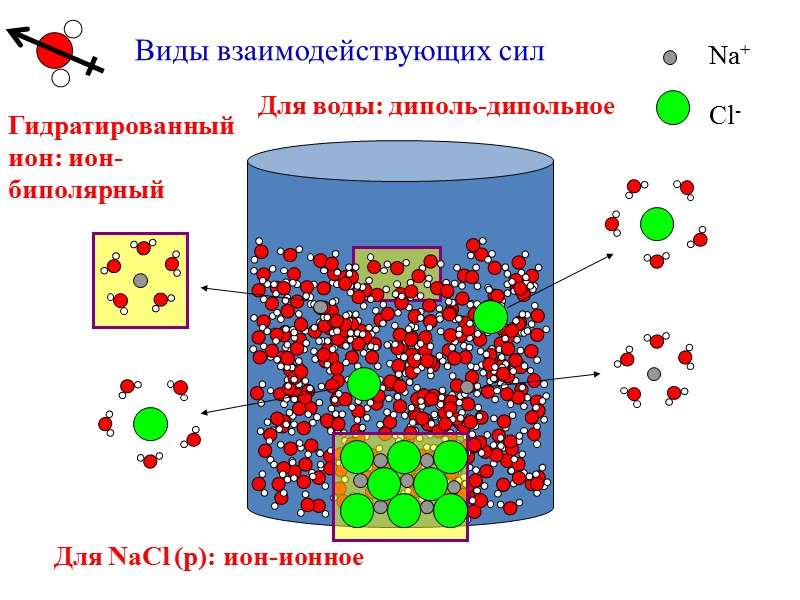
 Виды взаимодействующих сил Для воды: диполь-дипольное Для NaCl (р): ион-ионное Гидратированный ион: ион-биполярный
Виды взаимодействующих сил Для воды: диполь-дипольное Для NaCl (р): ион-ионное Гидратированный ион: ион-биполярный
 Концентрация вещества Концентрация - количество растворенного вещества, сосредоточенное в определенной массе или объеме раствора или растворителя.
Концентрация вещества Концентрация - количество растворенного вещества, сосредоточенное в определенной массе или объеме раствора или растворителя.
 Способы выражения концентрации растворов 1. Массовая доля ω - это отношение массы растворенного вещества к общей массе раствора:
Способы выражения концентрации растворов 1. Массовая доля ω - это отношение массы растворенного вещества к общей массе раствора:
 Растворимость веществ Растворимость - свойство данного вещества растворяться в том или ином растворителе.
Растворимость веществ Растворимость - свойство данного вещества растворяться в том или ином растворителе.
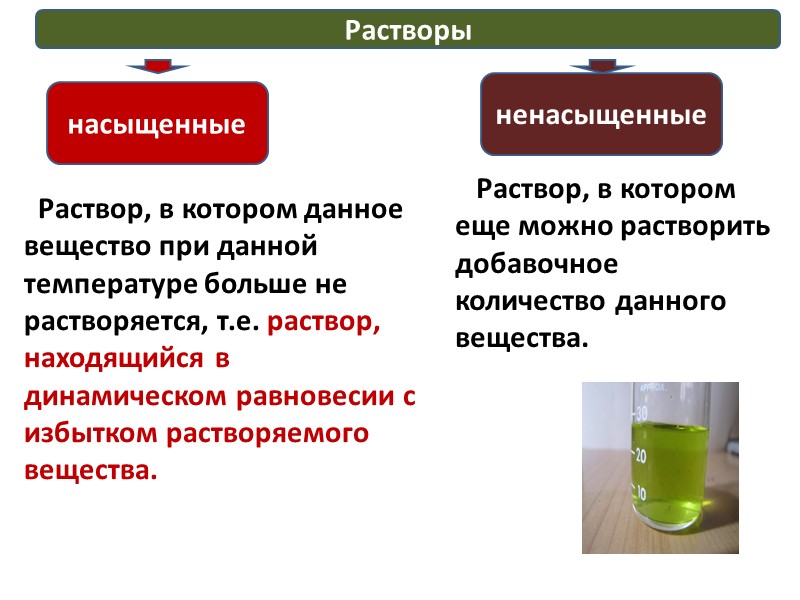
 Растворы насыщенные ненасыщенные Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в динамическом равновесии с избытком растворяемого вещества. Раствор, в котором еще можно растворить добавочное количество данного вещества.
Растворы насыщенные ненасыщенные Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в динамическом равновесии с избытком растворяемого вещества. Раствор, в котором еще можно растворить добавочное количество данного вещества.
 Растворимость веществ Количественно растворимость характеризуют концентрацией насыщенного раствора при определенной температуре и давлении (коэффициент растворимости); выражают в граммах вещества на 100 г растворителя.
Растворимость веществ Количественно растворимость характеризуют концентрацией насыщенного раствора при определенной температуре и давлении (коэффициент растворимости); выражают в граммах вещества на 100 г растворителя.
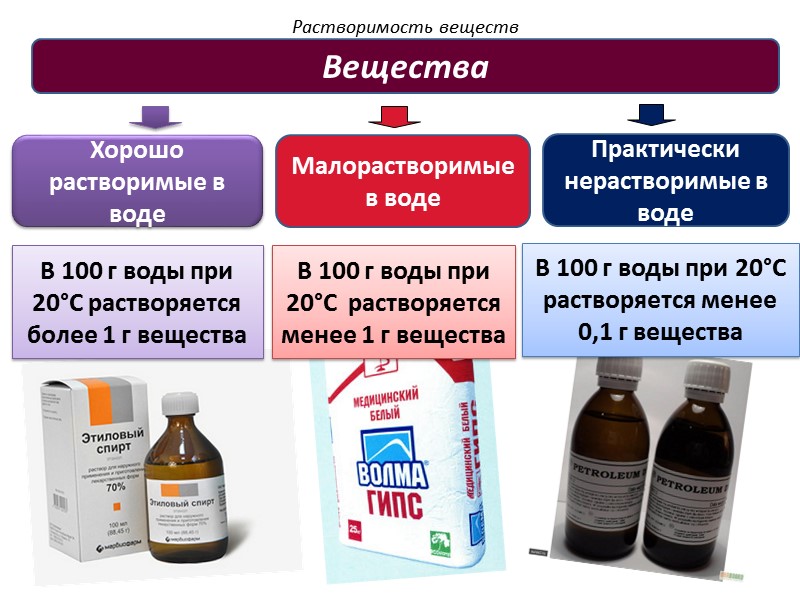
 Растворимость веществ Вещества Хорошо растворимые в воде Практически нерастворимые в воде В 100 г воды при 20°C растворяется более 1 г вещества В 100 г воды при 20°C растворяется менее 0,1 г вещества Малорастворимые в воде В 100 г воды при 20°C растворяется менее 1 г вещества
Растворимость веществ Вещества Хорошо растворимые в воде Практически нерастворимые в воде В 100 г воды при 20°C растворяется более 1 г вещества В 100 г воды при 20°C растворяется менее 0,1 г вещества Малорастворимые в воде В 100 г воды при 20°C растворяется менее 1 г вещества
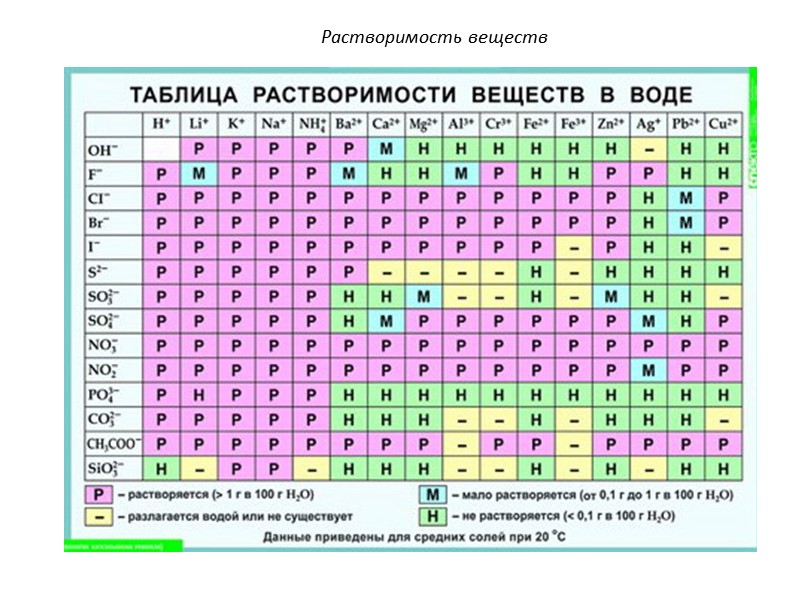
 Растворимость веществ
Растворимость веществ
 Задача 1. Требуется приготовить раствор массой 320г с массовой долей KCl 3%. Рассчитайте массу KCl и массу воды, которые необходимы для приготовления раствора. Решение: 1) Определим массу KCl для приготовления раствора: 2) Найдем массу воды, необходимую для приготовления раствора Ответ: Решение задач
Задача 1. Требуется приготовить раствор массой 320г с массовой долей KCl 3%. Рассчитайте массу KCl и массу воды, которые необходимы для приготовления раствора. Решение: 1) Определим массу KCl для приготовления раствора: 2) Найдем массу воды, необходимую для приготовления раствора Ответ: Решение задач
 Задача 2. Какая масса раствора с массовой долей гидроксида натрия 4% потребуется для полной нейтрализации р-ра соляной кислоты массой 30г с массовой долей соляной кислоты 5%. Решение: 1) Составим уравнение протекающей в растворе реакции: 2) Определим массу и количество соляной кислоты: 4) Найдем массу гидроксида натрия 5) Определяем массу раствора NaOH с массовой долей 4%
Задача 2. Какая масса раствора с массовой долей гидроксида натрия 4% потребуется для полной нейтрализации р-ра соляной кислоты массой 30г с массовой долей соляной кислоты 5%. Решение: 1) Составим уравнение протекающей в растворе реакции: 2) Определим массу и количество соляной кислоты: 4) Найдем массу гидроксида натрия 5) Определяем массу раствора NaOH с массовой долей 4%
 Задача 3. Масса поваренной соли, которую нужно растворить в 200 г воды для получения 8% раствора, равна______г. Пусть m(NaCl) = x г , тогда Записываем формулу массовой доли вещества: Найдем массу поваренной соли х= 16 + 0,08х 0,92х=16 х=17,4 г.
Задача 3. Масса поваренной соли, которую нужно растворить в 200 г воды для получения 8% раствора, равна______г. Пусть m(NaCl) = x г , тогда Записываем формулу массовой доли вещества: Найдем массу поваренной соли х= 16 + 0,08х 0,92х=16 х=17,4 г.
 С4. Смешали 250 мл раствора ортофосфата натрия (ρ=1,03 г/мл) с массовой долей 10% и 100 мл раствора хлорида бария (ρ=1,07 г/мл) с массовой долей 15%. определите массовую долю поваренной соли в образовавшемся растворе. 1) Уравнение химической реакции: 2Na3PO4 + 3BaCl2 = 6NаСl + Ba3(PO4)2↓ 2) Рассчитаем количества веществ реагентов : n(Na3PO4)исх.=250∙1,03∙0,10/164= 0,157 моль – в избытке n(BaCl2)= 100∙1,07∙0,15/208=0,077 моль – в недостатке 3)Рассчитаем массу раствора (с учётом массы выпавшего осадка фосфата бария) : n(Ba3(PO4)2) = 1/3∙n(ВаСl2)= 0,0257 моль m(Ba3(PO4)2)= 0,0257 ∙ 601= 15,45 г m(ра-ра)= 250∙1,03 + 100 ∙ 1,07 – 15,45 = 349,05 г 4)Рассчитаем массовую долю хлорида натрия n(NaCl)= 2n(BaCl2)=0,154 моль m(NaCl)= 0,154 ∙ 58,5= 9,01г ω(NaCl)= 9,01/ 349,05 = 0,026 или 2,6%
С4. Смешали 250 мл раствора ортофосфата натрия (ρ=1,03 г/мл) с массовой долей 10% и 100 мл раствора хлорида бария (ρ=1,07 г/мл) с массовой долей 15%. определите массовую долю поваренной соли в образовавшемся растворе. 1) Уравнение химической реакции: 2Na3PO4 + 3BaCl2 = 6NаСl + Ba3(PO4)2↓ 2) Рассчитаем количества веществ реагентов : n(Na3PO4)исх.=250∙1,03∙0,10/164= 0,157 моль – в избытке n(BaCl2)= 100∙1,07∙0,15/208=0,077 моль – в недостатке 3)Рассчитаем массу раствора (с учётом массы выпавшего осадка фосфата бария) : n(Ba3(PO4)2) = 1/3∙n(ВаСl2)= 0,0257 моль m(Ba3(PO4)2)= 0,0257 ∙ 601= 15,45 г m(ра-ра)= 250∙1,03 + 100 ∙ 1,07 – 15,45 = 349,05 г 4)Рассчитаем массовую долю хлорида натрия n(NaCl)= 2n(BaCl2)=0,154 моль m(NaCl)= 0,154 ∙ 58,5= 9,01г ω(NaCl)= 9,01/ 349,05 = 0,026 или 2,6%
 Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток Электролитическая диссоциация - процесс растворения или плавления электролитов с образованием заряженных частиц под действием молекул растворителя.
Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток Электролитическая диссоциация - процесс растворения или плавления электролитов с образованием заряженных частиц под действием молекул растворителя.
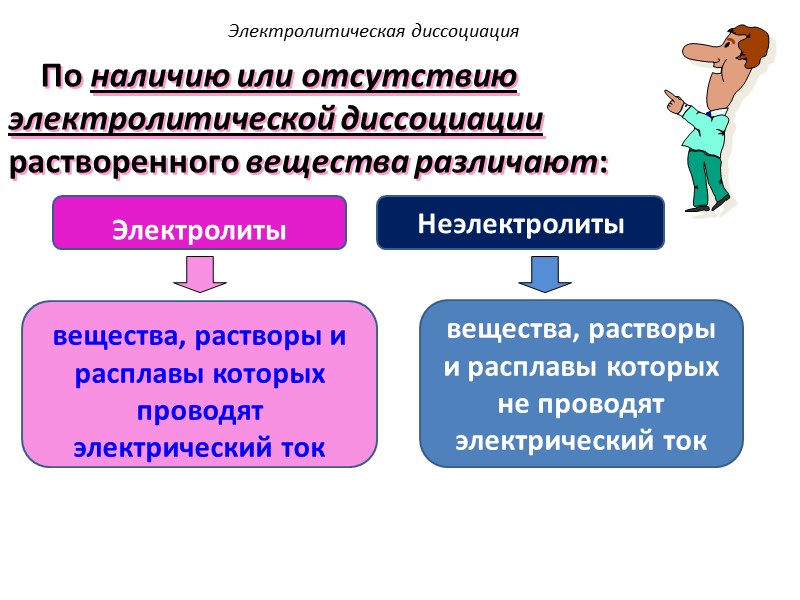
 По наличию или отсутствию электролитической диссоциации растворенного вещества различают: Электролитическая диссоциация вещества, растворы и расплавы которых проводят электрический ток Электролиты вещества, растворы и расплавы которых не проводят электрический ток Неэлектролиты
По наличию или отсутствию электролитической диссоциации растворенного вещества различают: Электролитическая диссоциация вещества, растворы и расплавы которых проводят электрический ток Электролиты вещества, растворы и расплавы которых не проводят электрический ток Неэлектролиты
 Электролиты Неэлектролиты Ионная или сильнополярная ковалентная связь Ковалентная неполярная или малополярная связь Основания Кислоты Соли Органические соединения Газы Неметаллы Электролитическая диссоциация
Электролиты Неэлектролиты Ионная или сильнополярная ковалентная связь Ковалентная неполярная или малополярная связь Основания Кислоты Соли Органические соединения Газы Неметаллы Электролитическая диссоциация
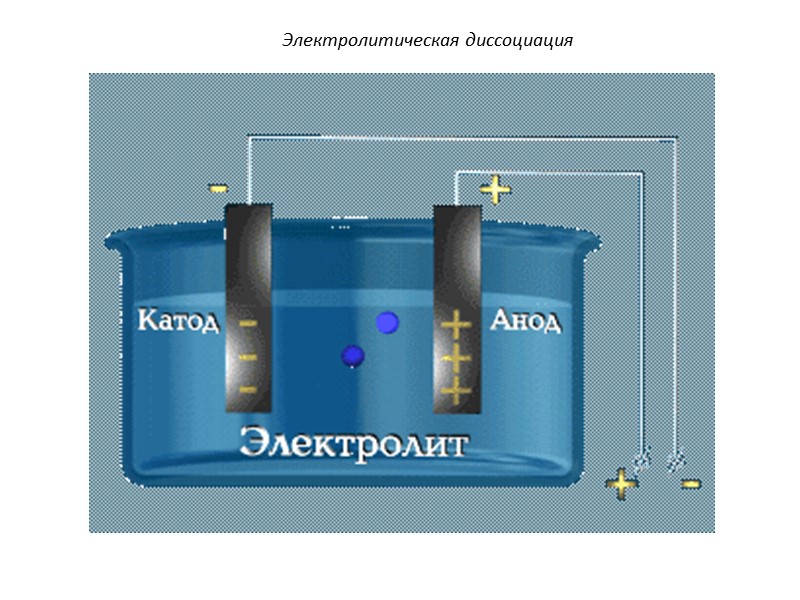
 1. Электролиты при плавлении или растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация. 2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду (катионы), отрицательно заряженные ионы к положительному полюсу - аноду (анионы). 3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы (ассоциация). Основные положения теории электролитической диссоциации
1. Электролиты при плавлении или растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация. 2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду (катионы), отрицательно заряженные ионы к положительному полюсу - аноду (анионы). 3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы (ассоциация). Основные положения теории электролитической диссоциации
 Электролитическая диссоциация
Электролитическая диссоциация
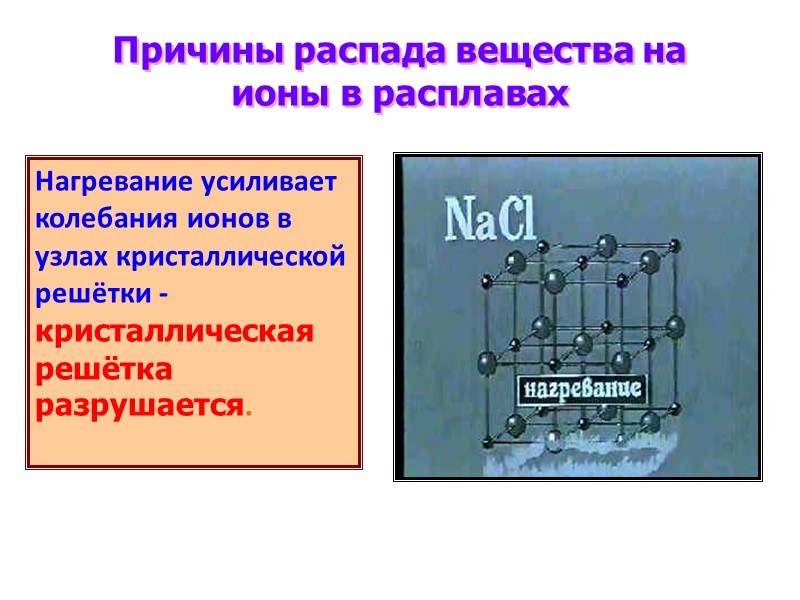
 Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается.
Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка разрушается.
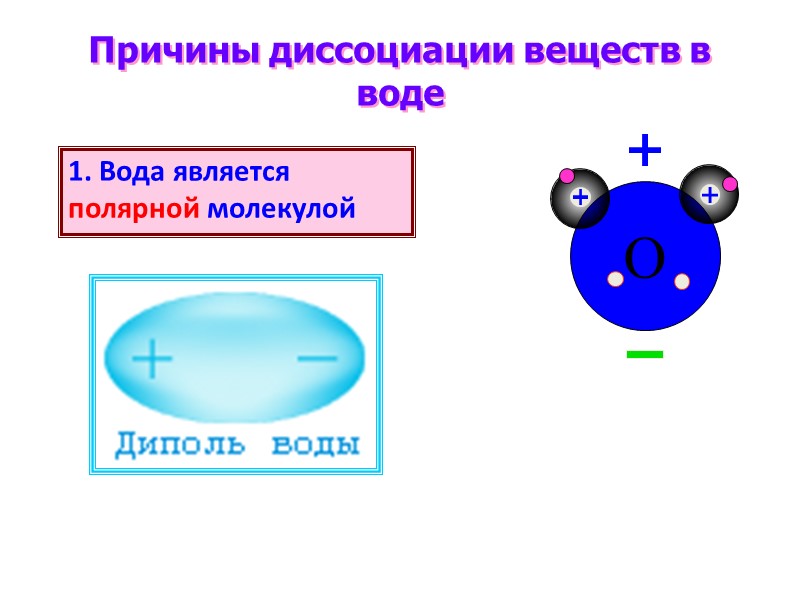
 O Причины диссоциации веществ в воде 1. Вода является полярной молекулой
O Причины диссоциации веществ в воде 1. Вода является полярной молекулой
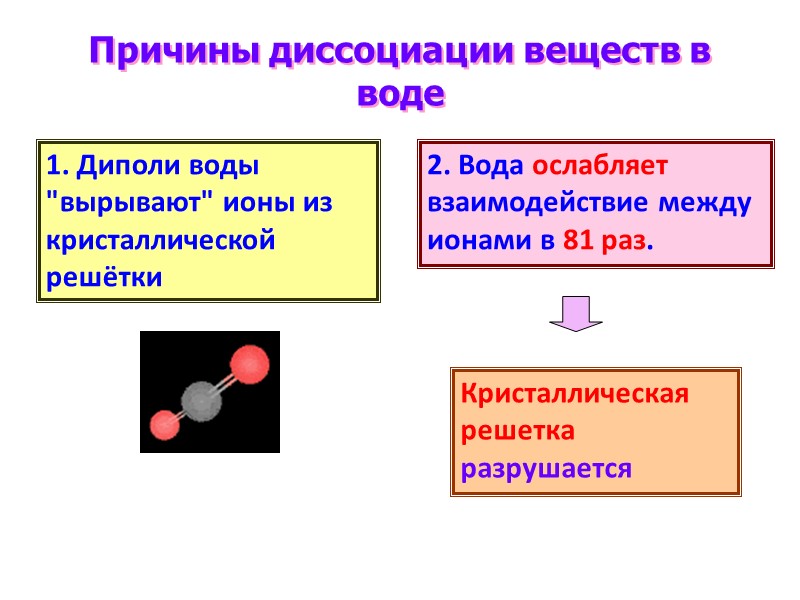
 Причины диссоциации веществ в воде 2. Вода ослабляет взаимодействие между ионами в 81 раз. 1. Диполи воды "вырывают" ионы из кристаллической решётки Кристаллическая решетка разрушается
Причины диссоциации веществ в воде 2. Вода ослабляет взаимодействие между ионами в 81 раз. 1. Диполи воды "вырывают" ионы из кристаллической решётки Кристаллическая решетка разрушается
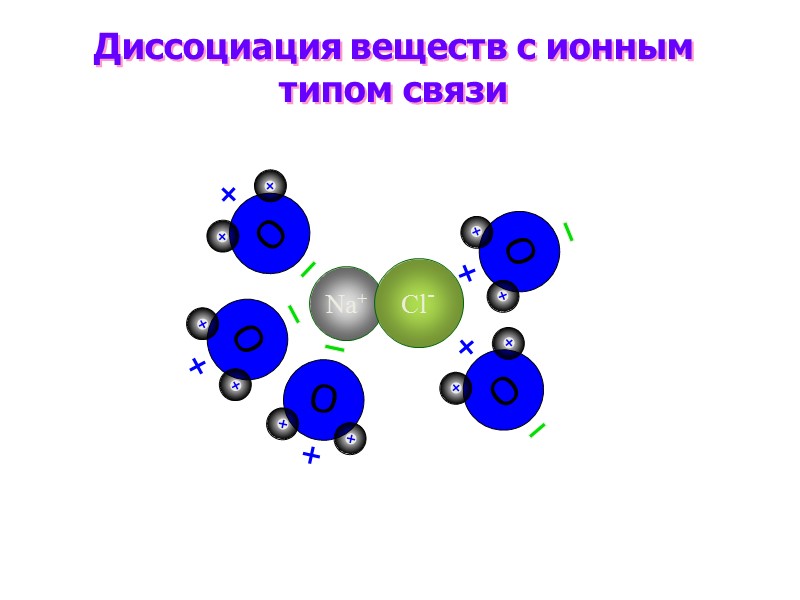
 Na+ Cl- Диссоциация веществ с ионным типом связи
Na+ Cl- Диссоциация веществ с ионным типом связи
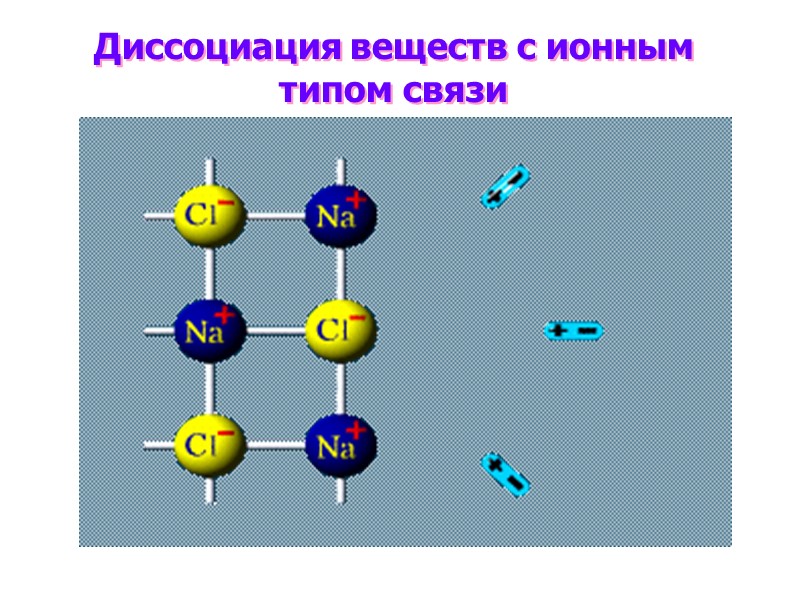
 Диссоциация веществ с ионным типом связи
Диссоциация веществ с ионным типом связи
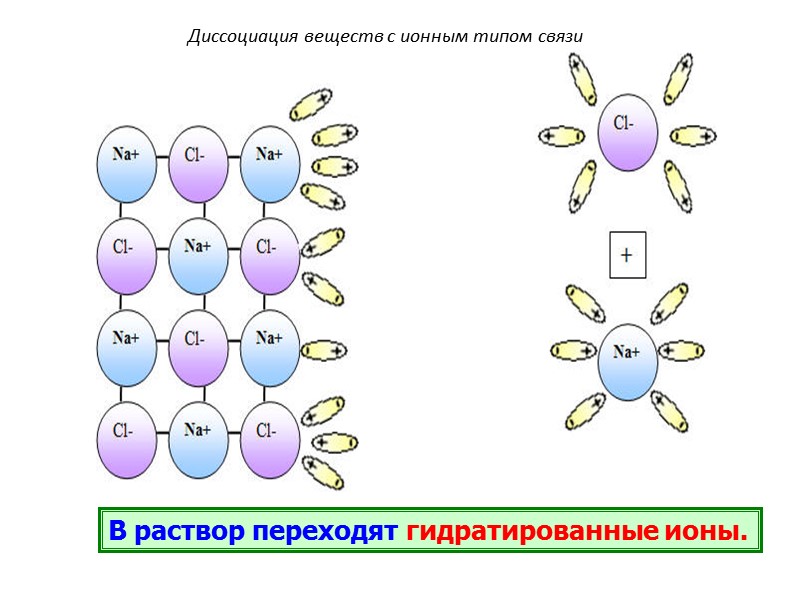
 Диссоциация веществ с ионным типом связи В раствор переходят гидратированные ионы.
Диссоциация веществ с ионным типом связи В раствор переходят гидратированные ионы.
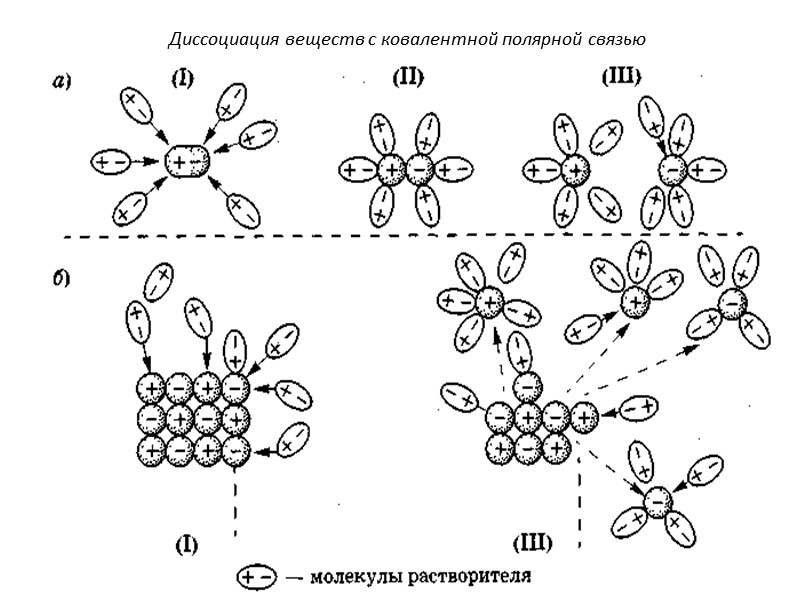
 Диссоциация веществ с ковалентной полярной связью
Диссоциация веществ с ковалентной полярной связью
 Диссоциация веществ с ковалентной полярной связью
Диссоциация веществ с ковалентной полярной связью
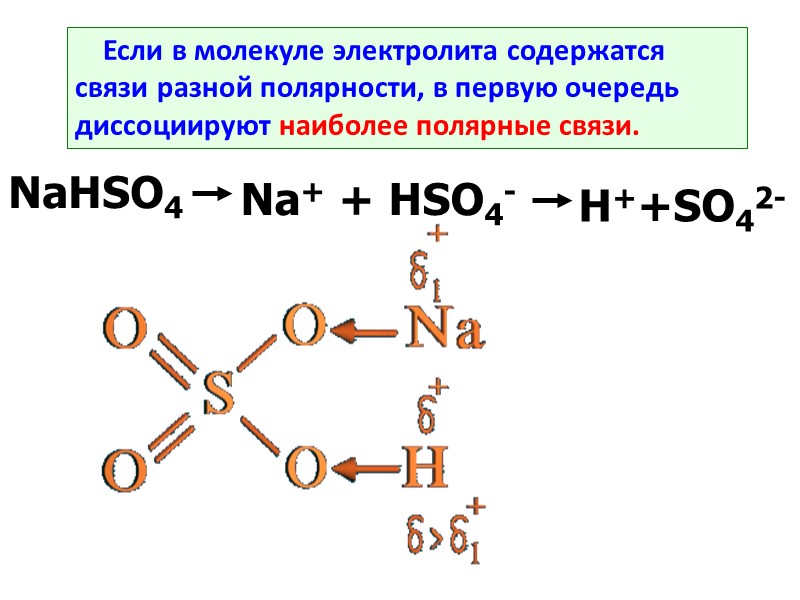
 Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи. NaHSO4 Na+ + HSO4- H++SO42-
Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи. NaHSO4 Na+ + HSO4- H++SO42-
 Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме Уравнения электролитической диссоциации
Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме Уравнения электролитической диссоциации
 Степень диссоциации электролита (α) - отношение числа распавшихся молекул (n) к общему числу молекул (N) в растворе: Сила электролита или Количественная характеристика процесса диссоциации Величина α зависит от природы электролита, температуры и концентрации вещества в растворе.
Степень диссоциации электролита (α) - отношение числа распавшихся молекул (n) к общему числу молекул (N) в растворе: Сила электролита или Количественная характеристика процесса диссоциации Величина α зависит от природы электролита, температуры и концентрации вещества в растворе.
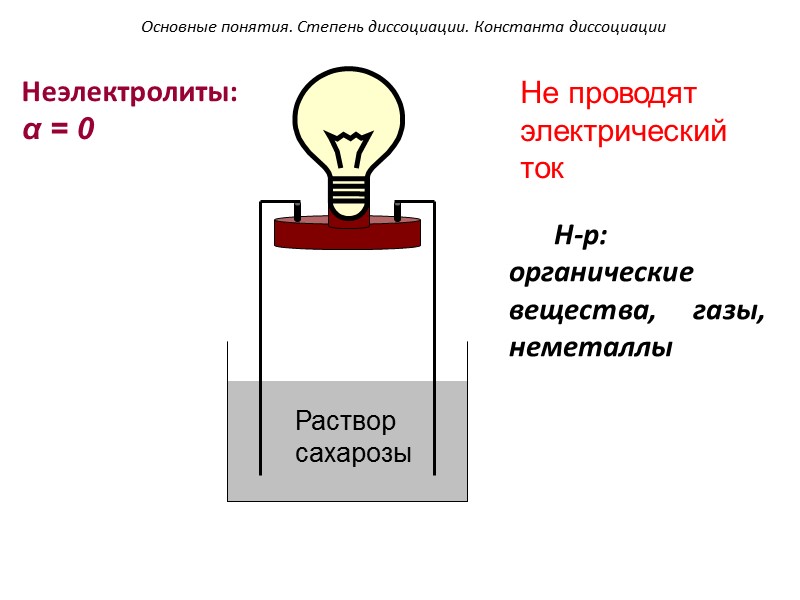
 Раствор сахарозы Неэлектролиты: α = 0 Не проводят электрический ток Основные понятия. Степень диссоциации. Константа диссоциации Н-р: органические вещества, газы, неметаллы
Раствор сахарозы Неэлектролиты: α = 0 Не проводят электрический ток Основные понятия. Степень диссоциации. Константа диссоциации Н-р: органические вещества, газы, неметаллы
 По величине α электролиты классифицируют на: 1. Сильные электролиты: α > 0,3 (больше 30%), в разбавленных растворах α → 1 (100%) Н-р: НCl, HBr, HI, H2SO4, HNO3, HMnO4, HClO4; Растворимые основания - щелочи; все растворимые соли. Основные понятия. Степень диссоциации. Константа диссоциации
По величине α электролиты классифицируют на: 1. Сильные электролиты: α > 0,3 (больше 30%), в разбавленных растворах α → 1 (100%) Н-р: НCl, HBr, HI, H2SO4, HNO3, HMnO4, HClO4; Растворимые основания - щелочи; все растворимые соли. Основные понятия. Степень диссоциации. Константа диссоциации
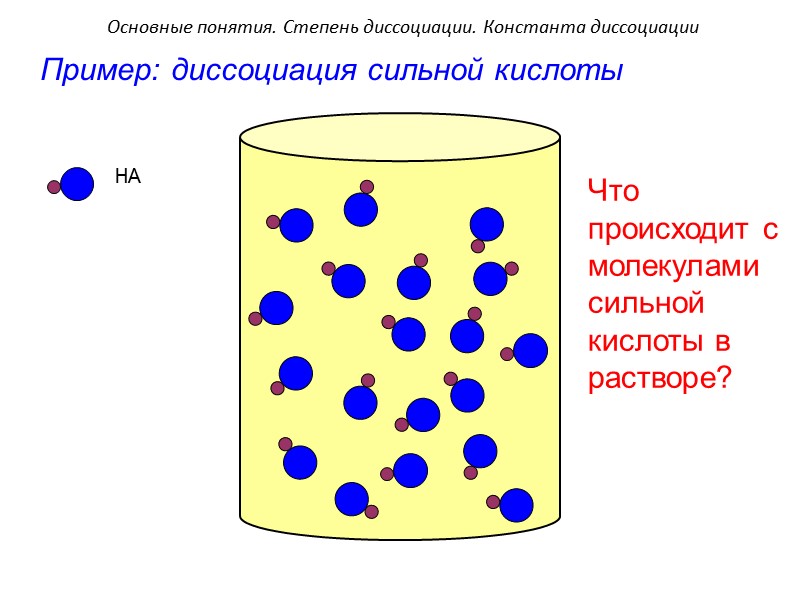
 HA Пример: диссоциация сильной кислоты Что происходит с молекулами сильной кислоты в растворе? Основные понятия. Степень диссоциации. Константа диссоциации
HA Пример: диссоциация сильной кислоты Что происходит с молекулами сильной кислоты в растворе? Основные понятия. Степень диссоциации. Константа диссоциации
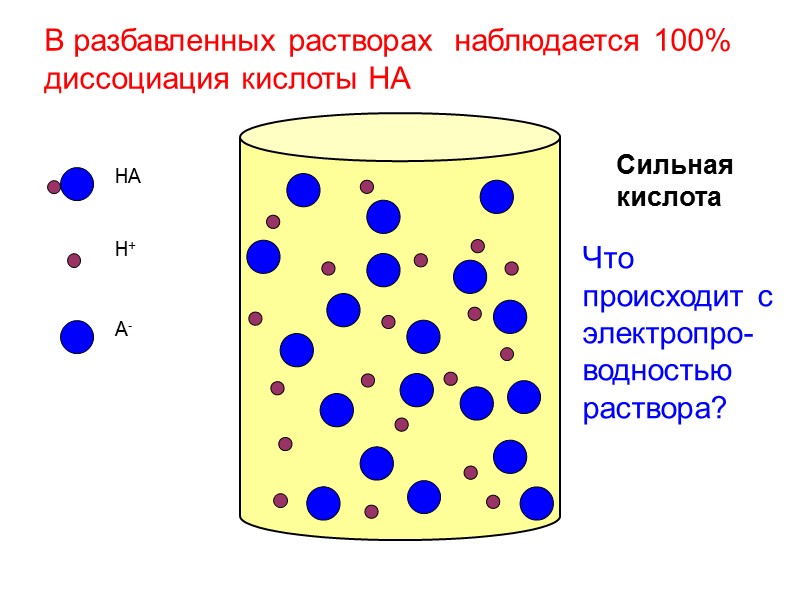
 HA H+ A- Сильная кислота В разбавленных растворах наблюдается 100% диссоциация кислоты HA Что происходит с электропро-водностью раствора?
HA H+ A- Сильная кислота В разбавленных растворах наблюдается 100% диссоциация кислоты HA Что происходит с электропро-водностью раствора?
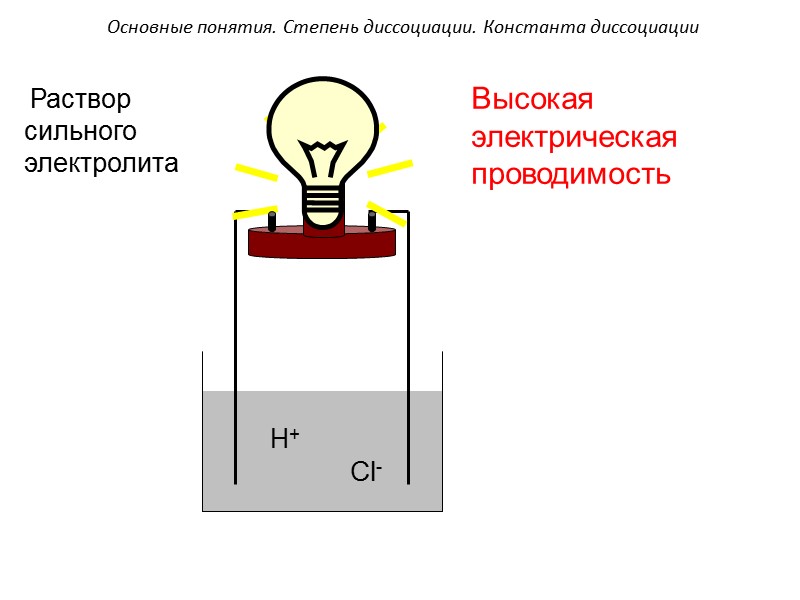
 H+ Cl- Высокая электрическая проводимость Основные понятия. Степень диссоциации. Константа диссоциации Раствор сильного электролита
H+ Cl- Высокая электрическая проводимость Основные понятия. Степень диссоциации. Константа диссоциации Раствор сильного электролита
 2. Средней силы электролиты 0,3 > α > 0,03 (от 3 до 30 %) Н-р: H3PO4, H2SO3, НF, H2C2O4 и др. Основные понятия. Степень диссоциации. Константа диссоциации Средняя электрическая проводимость
2. Средней силы электролиты 0,3 > α > 0,03 (от 3 до 30 %) Н-р: H3PO4, H2SO3, НF, H2C2O4 и др. Основные понятия. Степень диссоциации. Константа диссоциации Средняя электрическая проводимость
 Слабые электролиты α < 0,03 (меньше 3%) Основные понятия. Степень диссоциации. Константа диссоциации Н-р: H2CO3, H2S, H2SiO3, HNO2, CH3COOH и др. органические кислоты, NH4OH и др. нерастворимые основания и соли.
Слабые электролиты α < 0,03 (меньше 3%) Основные понятия. Степень диссоциации. Константа диссоциации Н-р: H2CO3, H2S, H2SiO3, HNO2, CH3COOH и др. органические кислоты, NH4OH и др. нерастворимые основания и соли.
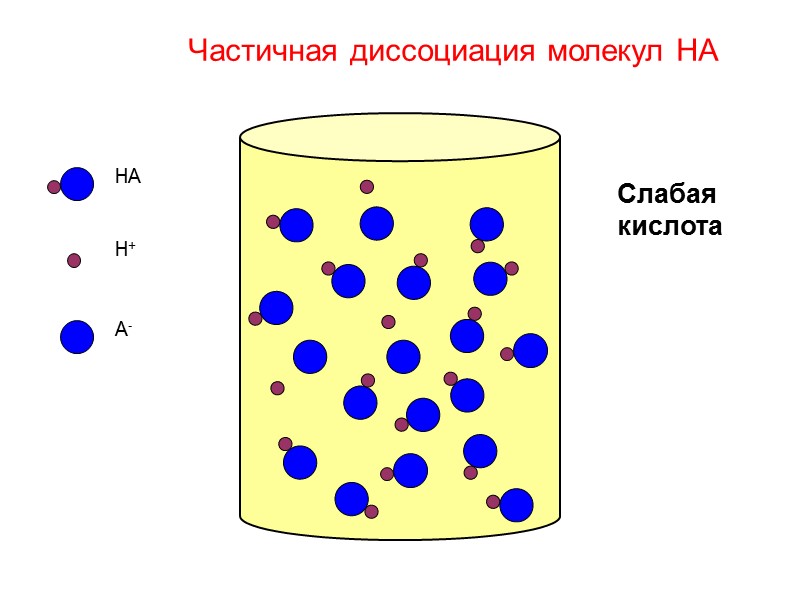
 HA H+ A- Слабая кислота Частичная диссоциация молекул HA
HA H+ A- Слабая кислота Частичная диссоциация молекул HA
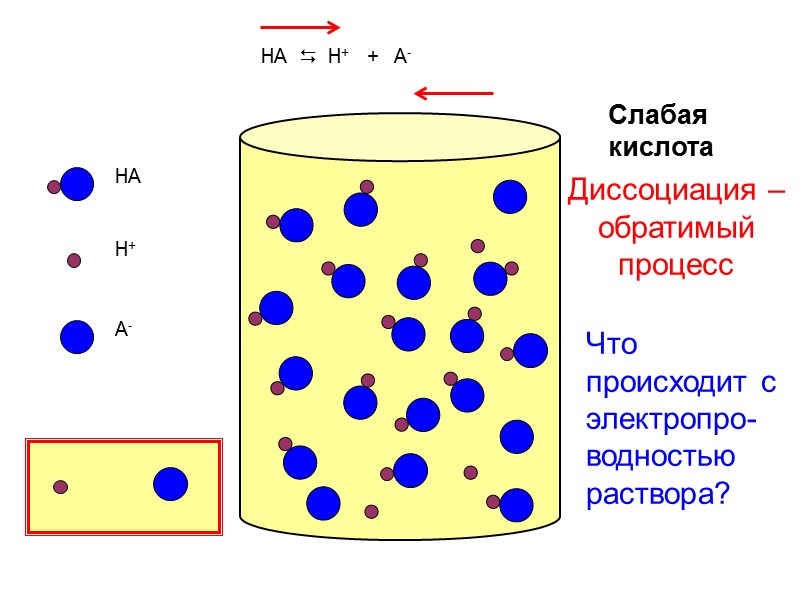
 HA H+ A- Слабая кислота HA H+ + A- Диссоциация – обратимый процесс Что происходит с электропро-водностью раствора?
HA H+ A- Слабая кислота HA H+ + A- Диссоциация – обратимый процесс Что происходит с электропро-водностью раствора?
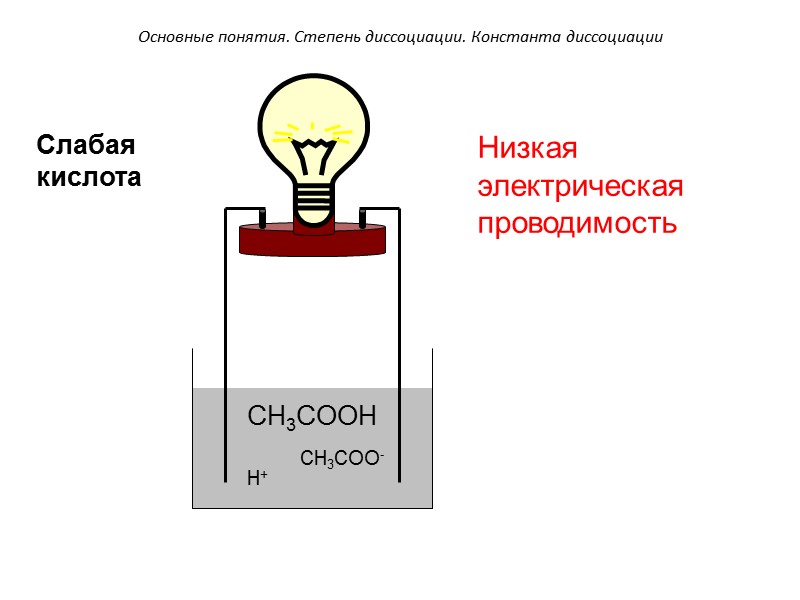
 CH3COOH CH3COO- H+ Низкая электрическая проводимость Основные понятия. Степень диссоциации. Константа диссоциации Слабая кислота
CH3COOH CH3COO- H+ Низкая электрическая проводимость Основные понятия. Степень диссоциации. Константа диссоциации Слабая кислота
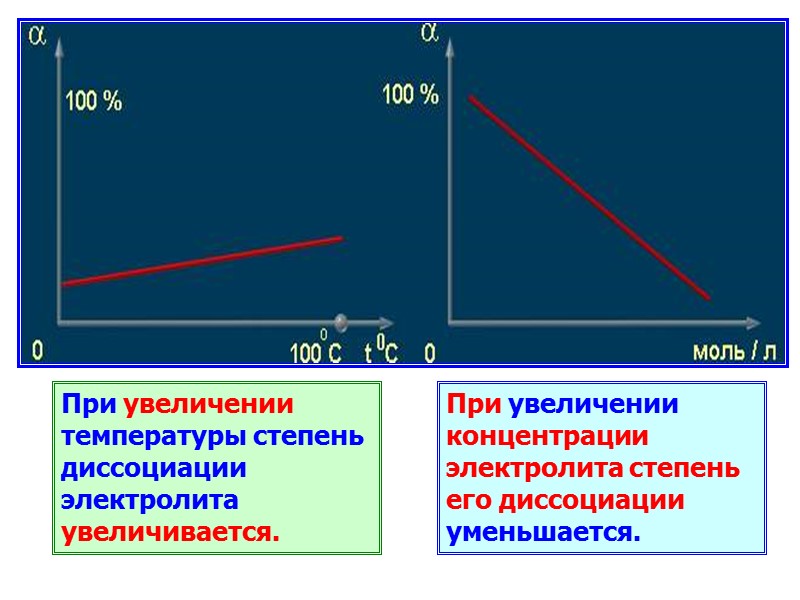
 При увеличении температуры степень диссоциации электролита увеличивается. При увеличении концентрации электролита степень его диссоциации уменьшается.
При увеличении температуры степень диссоциации электролита увеличивается. При увеличении концентрации электролита степень его диссоциации уменьшается.
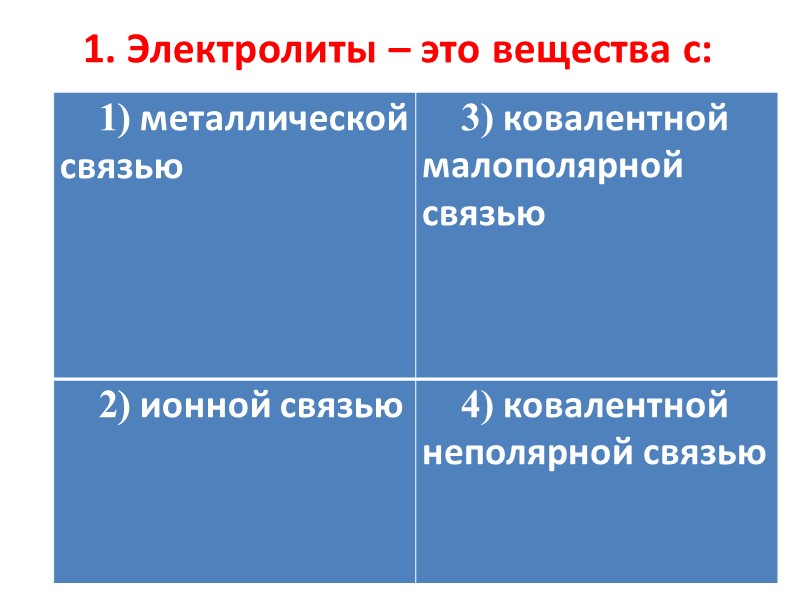
 1. Электролиты – это вещества с:
1. Электролиты – это вещества с:
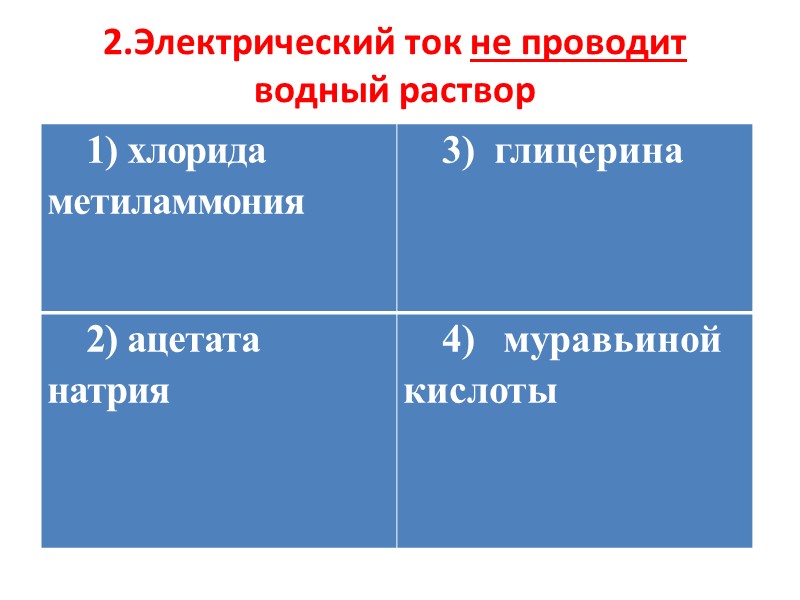
 2.Электрический ток не проводит водный раствор
2.Электрический ток не проводит водный раствор
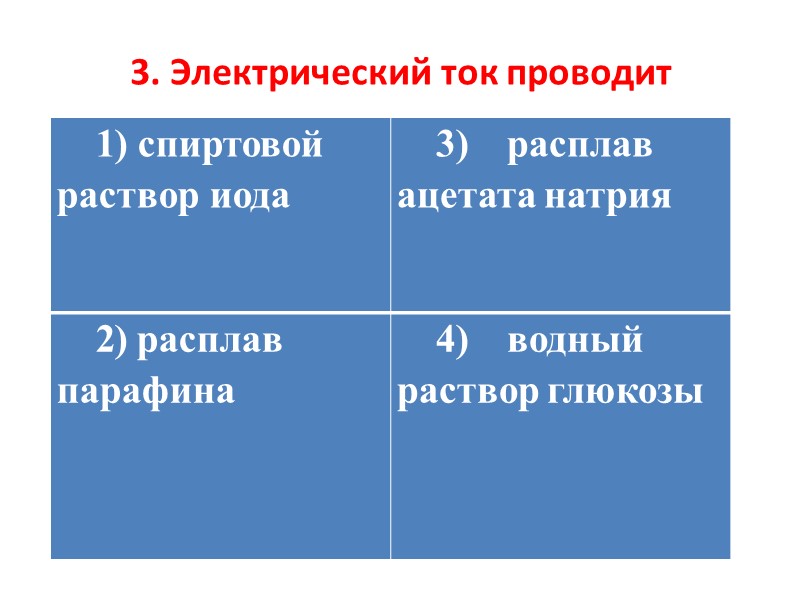
 3. Электрический ток проводит
3. Электрический ток проводит
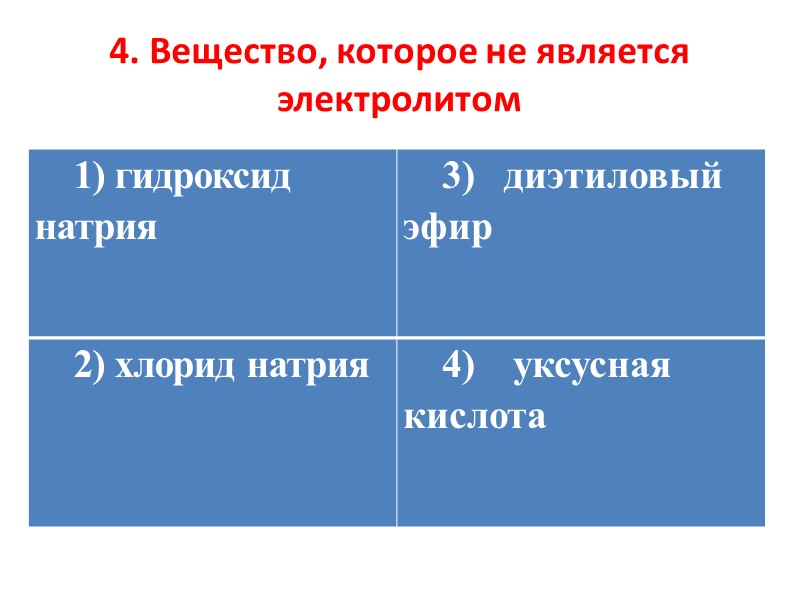
 4. Вещество, которое не является электролитом
4. Вещество, которое не является электролитом
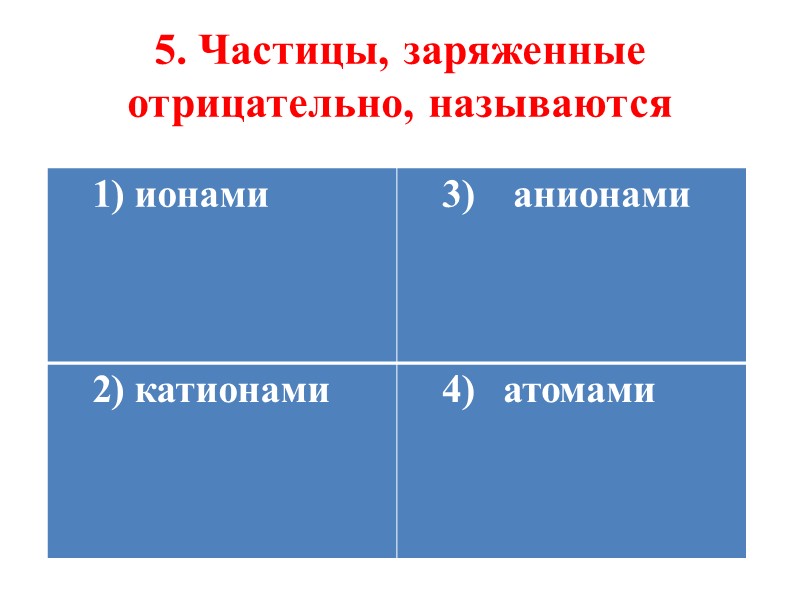
 5. Частицы, заряженные отрицательно, называются
5. Частицы, заряженные отрицательно, называются
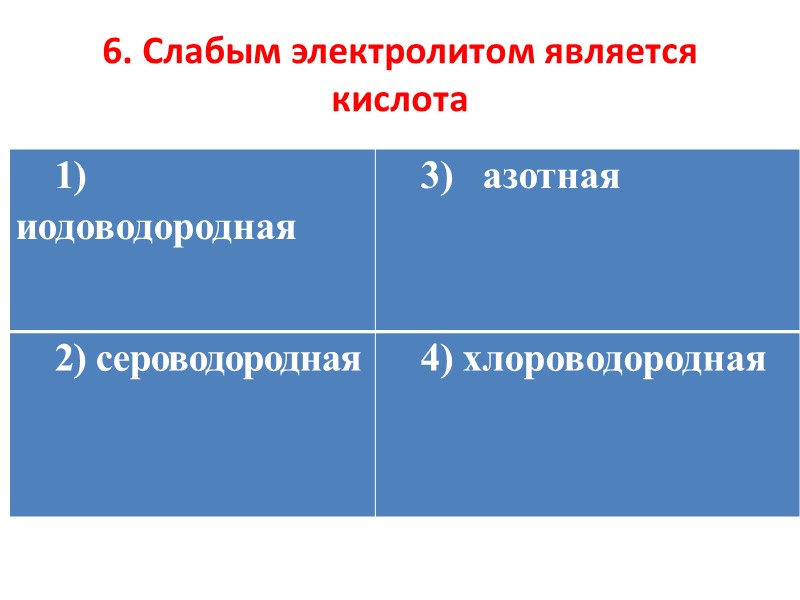
 6. Слабым электролитом является кислота
6. Слабым электролитом является кислота
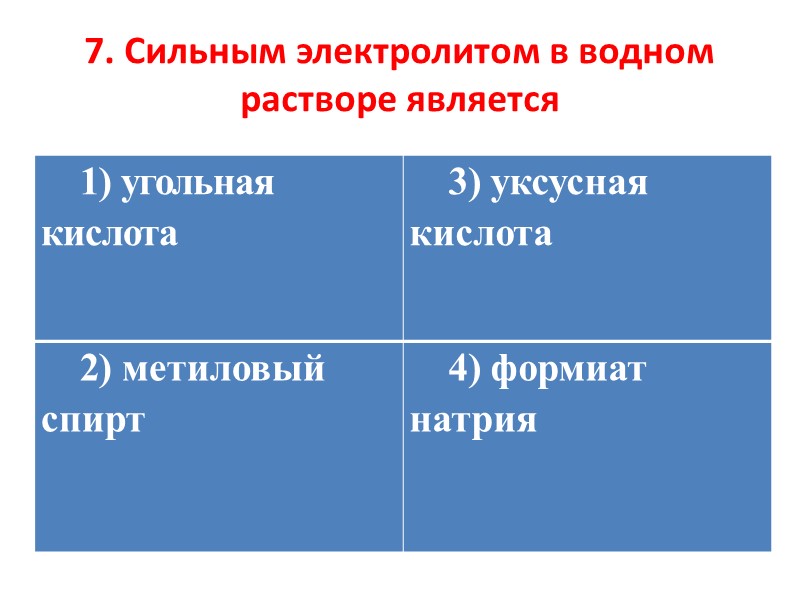
 7. Сильным электролитом в водном растворе является
7. Сильным электролитом в водном растворе является
 8. Электролитом является каждое вещество в ряду
8. Электролитом является каждое вещество в ряду
 9. Сильными электролитами являются все вещества, указанные в ряду
9. Сильными электролитами являются все вещества, указанные в ряду
 10. Слабыми электролитами являются все вещества группы
10. Слабыми электролитами являются все вещества группы
 Основания – электролиты, диссоциирующие в водных растворах с отщеплением гидроксид-ионов и не дающие никаких других отрицательно заряженных ионов. Носителем основных свойств является гидроксид-ион. Чем больше концентрация гидроксид-ионов в растворе, тем сильнее основание. Диссоциация кислот, оснований и солей NaOH ↔ Na+ + OH-
Основания – электролиты, диссоциирующие в водных растворах с отщеплением гидроксид-ионов и не дающие никаких других отрицательно заряженных ионов. Носителем основных свойств является гидроксид-ион. Чем больше концентрация гидроксид-ионов в растворе, тем сильнее основание. Диссоциация кислот, оснований и солей NaOH ↔ Na+ + OH-
 Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. При диссоциации средних солей в растворе образуются катионы металла и анионы кислотного остатка. Диссоциация кислот, оснований и солей
Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. При диссоциации средних солей в растворе образуются катионы металла и анионы кислотного остатка. Диссоциация кислот, оснований и солей
 12. Кислоты в растворе и расплаве диссоциируют на
12. Кислоты в растворе и расплаве диссоциируют на
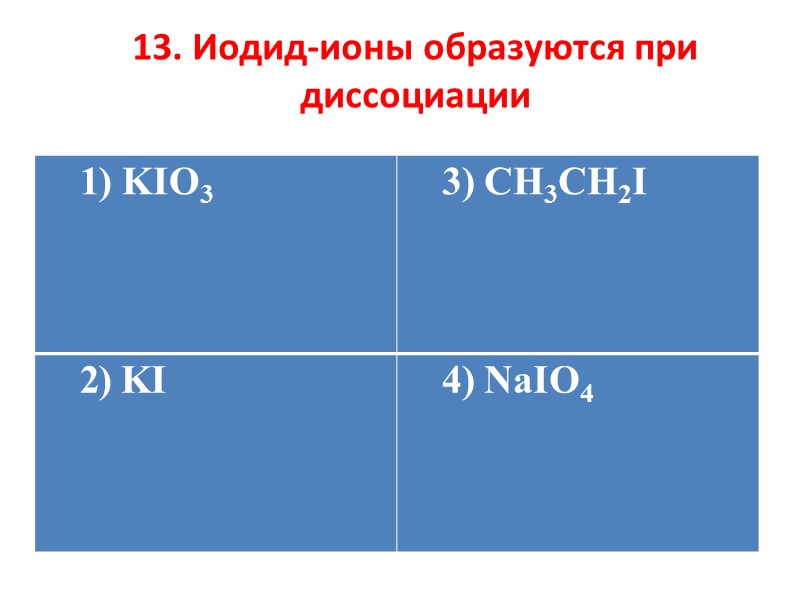
 13. Иодид-ионы образуются при диссоциации
13. Иодид-ионы образуются при диссоциации
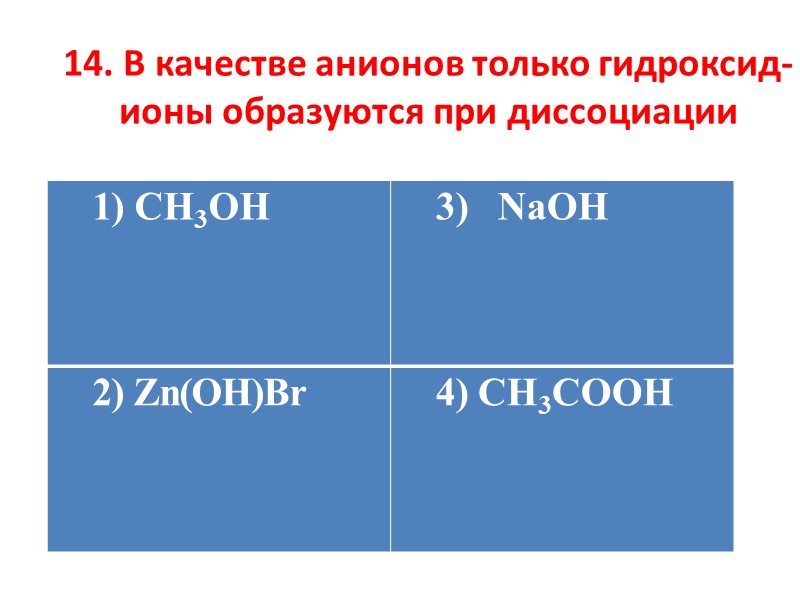
 14. В качестве анионов только гидроксид-ионы образуются при диссоциации
14. В качестве анионов только гидроксид-ионы образуются при диссоциации
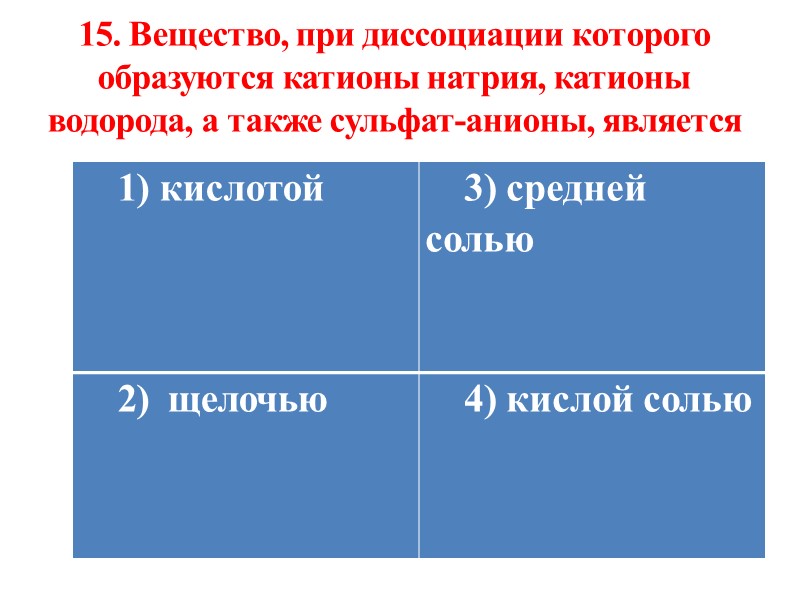
 15. Вещество, при диссоциации которого образуются катионы натрия, катионы водорода, а также сульфат-анионы, является
15. Вещество, при диссоциации которого образуются катионы натрия, катионы водорода, а также сульфат-анионы, является
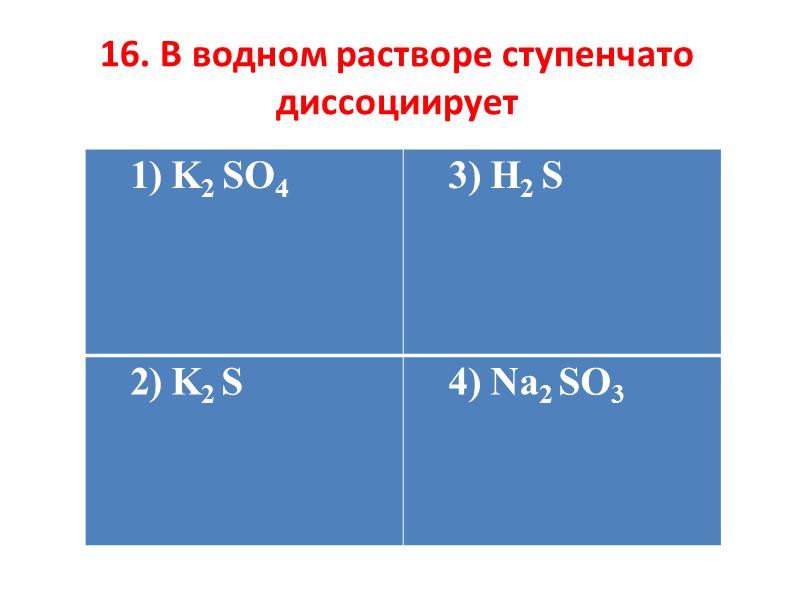
 16. В водном растворе ступенчато диссоциирует
16. В водном растворе ступенчато диссоциирует
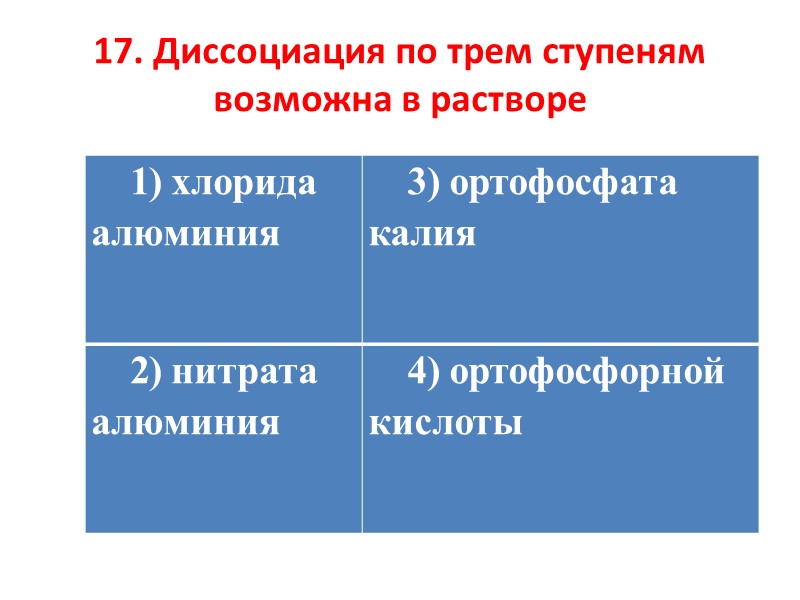
 17. Диссоциация по трем ступеням возможна в растворе
17. Диссоциация по трем ступеням возможна в растворе
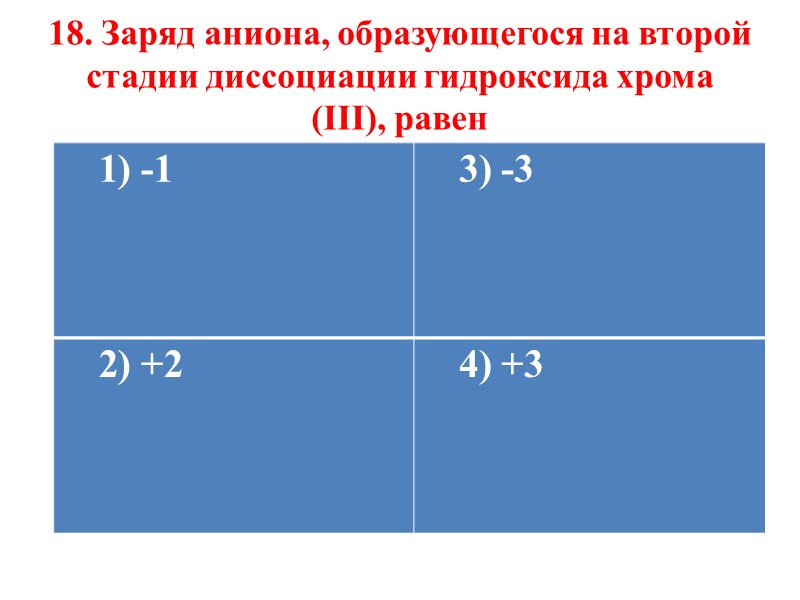
 18. Заряд аниона, образующегося на второй стадии диссоциации гидроксида хрома (III), равен
18. Заряд аниона, образующегося на второй стадии диссоциации гидроксида хрома (III), равен
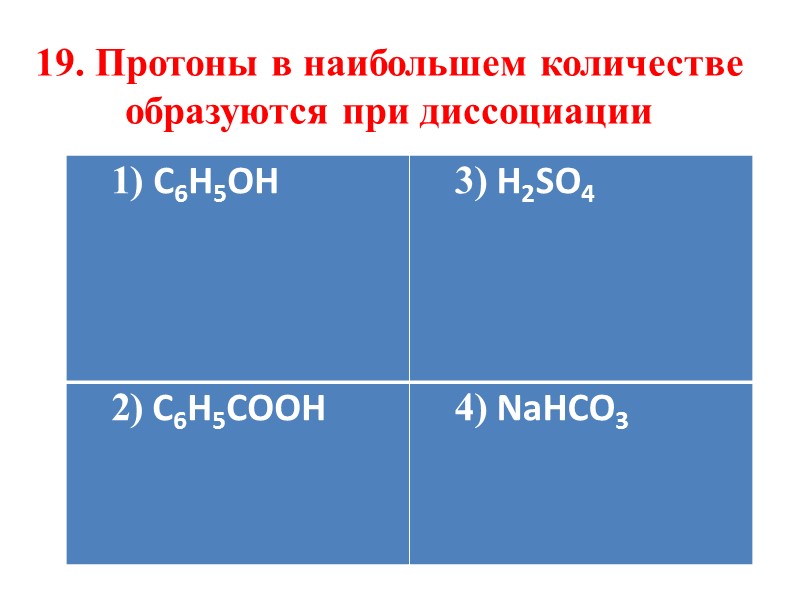
 19. Протоны в наибольшем количестве образуются при диссоциации
19. Протоны в наибольшем количестве образуются при диссоциации
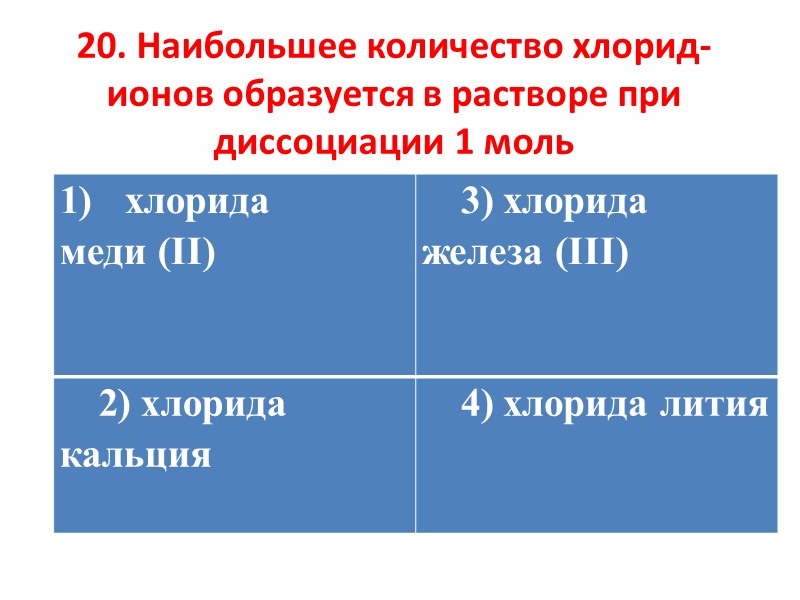
 20. Наибольшее количество хлорид-ионов образуется в растворе при диссоциации 1 моль
20. Наибольшее количество хлорид-ионов образуется в растворе при диссоциации 1 моль
 22. Какие из утверждений о диссоциации оснований в водных растворах верны? А. Основания в воде диссоциируют на катионы металла (или подобный им катион-аммония) и гидроксид-анионы. Б. Никаких других анионов, кроме гидроксид-анионов, основания не образуют.
22. Какие из утверждений о диссоциации оснований в водных растворах верны? А. Основания в воде диссоциируют на катионы металла (или подобный им катион-аммония) и гидроксид-анионы. Б. Никаких других анионов, кроме гидроксид-анионов, основания не образуют.
 Реакции ионного обмена в растворах электролитов Реакции в растворах электролитов протекают между ионами. Их выражают в виде ионных уравнений. Факторы протекания реакций обмена в растворах электролитов: Связывание ионов в молекулы труднорастворимых соединений. Образование слабодиссоциирующих соединений (воды, слабой кислоты, слабого основания). Связывание ионов в молекулы газообразных веществ.
Реакции ионного обмена в растворах электролитов Реакции в растворах электролитов протекают между ионами. Их выражают в виде ионных уравнений. Факторы протекания реакций обмена в растворах электролитов: Связывание ионов в молекулы труднорастворимых соединений. Образование слабодиссоциирующих соединений (воды, слабой кислоты, слабого основания). Связывание ионов в молекулы газообразных веществ.
 Пример1. Нейтрализация сильной кислоты HCl сильным основанием NaOH Полная нейтрализация pH=7 Ионообменные реакции
Пример1. Нейтрализация сильной кислоты HCl сильным основанием NaOH Полная нейтрализация pH=7 Ионообменные реакции
 Пример 3. Нейтрализация слабого основания NH4OH сильной кислотой HNO3: pH <7 Ионообменные реакции
Пример 3. Нейтрализация слабого основания NH4OH сильной кислотой HNO3: pH <7 Ионообменные реакции
 Пример 4. Действие сильной кислоты HCl на соль слабой кислоты и сильного основания KCN: Ионообменные реакции pH ˃7
Пример 4. Действие сильной кислоты HCl на соль слабой кислоты и сильного основания KCN: Ионообменные реакции pH ˃7
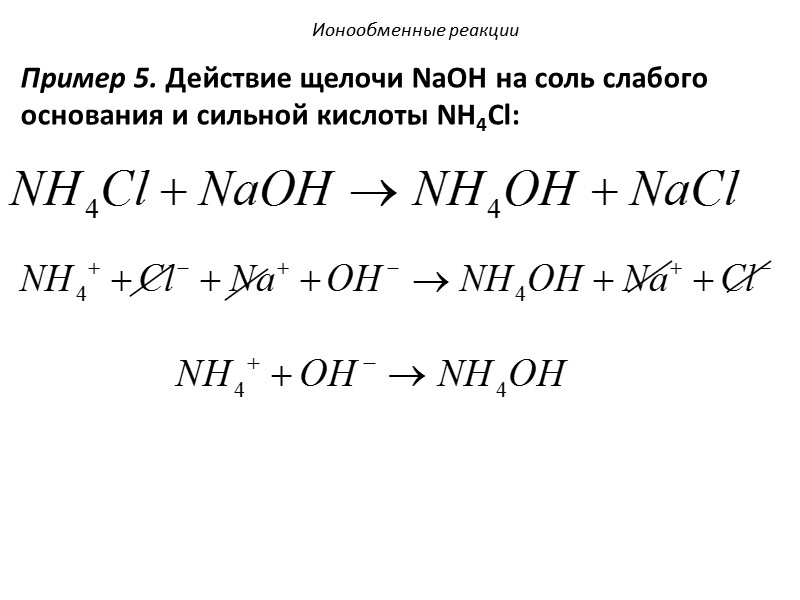
 Пример 5. Действие щелочи NaOH на соль слабого основания и сильной кислоты NH4Cl: Ионообменные реакции
Пример 5. Действие щелочи NaOH на соль слабого основания и сильной кислоты NH4Cl: Ионообменные реакции
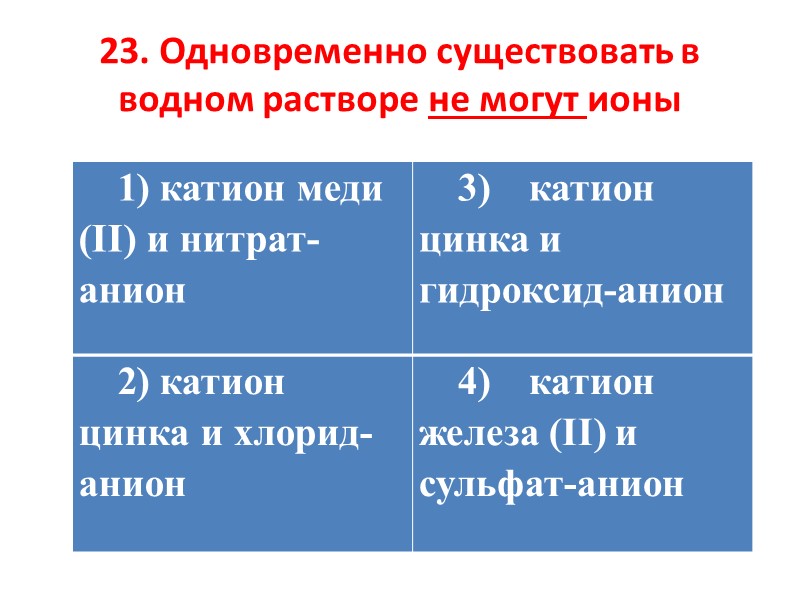
 23. Одновременно существовать в водном растворе не могут ионы
23. Одновременно существовать в водном растворе не могут ионы
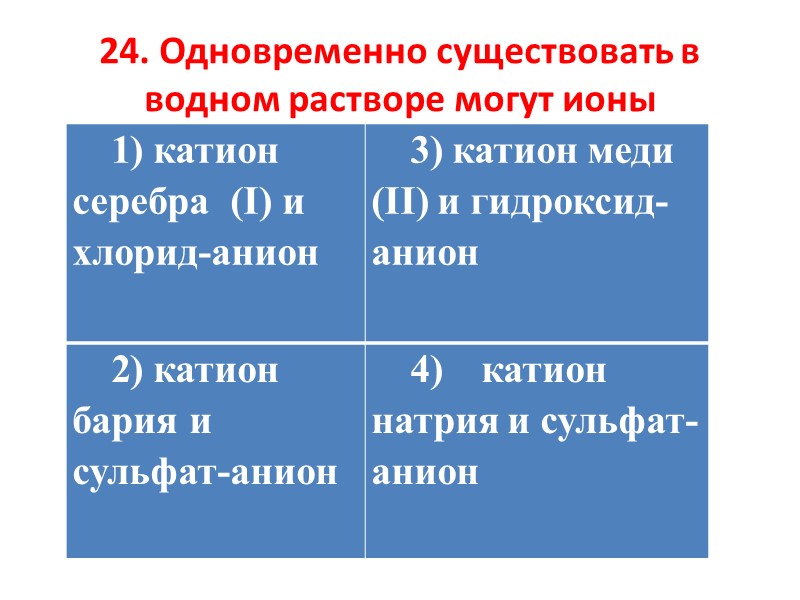
 24. Одновременно существовать в водном растворе могут ионы
24. Одновременно существовать в водном растворе могут ионы
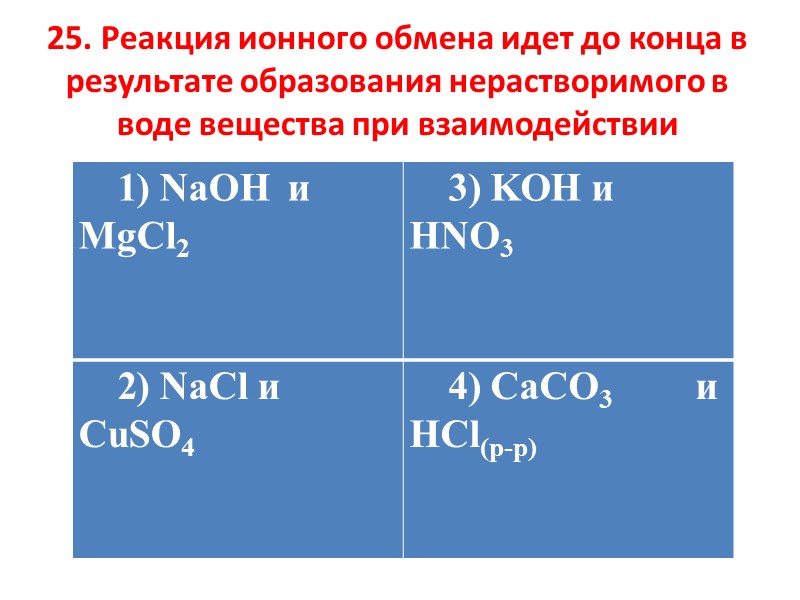
 25. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии
25. Реакция ионного обмена идет до конца в результате образования нерастворимого в воде вещества при взаимодействии
 26. Практически до конца идет реакция
26. Практически до конца идет реакция
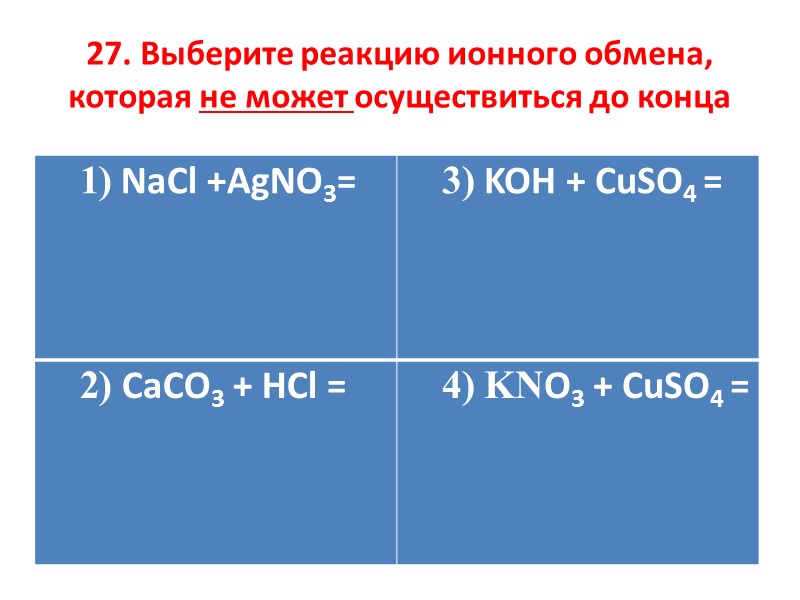
 27. Выберите реакцию ионного обмена, которая не может осуществиться до конца
27. Выберите реакцию ионного обмена, которая не может осуществиться до конца
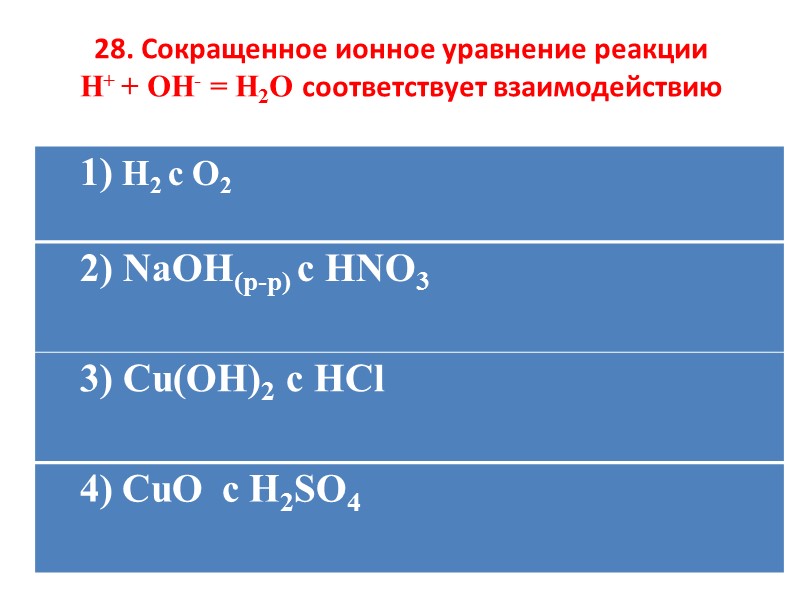
 28. Сокращенное ионное уравнение реакции H+ + OH- = H2O соответствует взаимодействию
28. Сокращенное ионное уравнение реакции H+ + OH- = H2O соответствует взаимодействию
 29. Выберите реакцию ионного обмена, которая соответствует сокращенному ионному уравнению 2H+ + CO32- = H2O + CO2
29. Выберите реакцию ионного обмена, которая соответствует сокращенному ионному уравнению 2H+ + CO32- = H2O + CO2
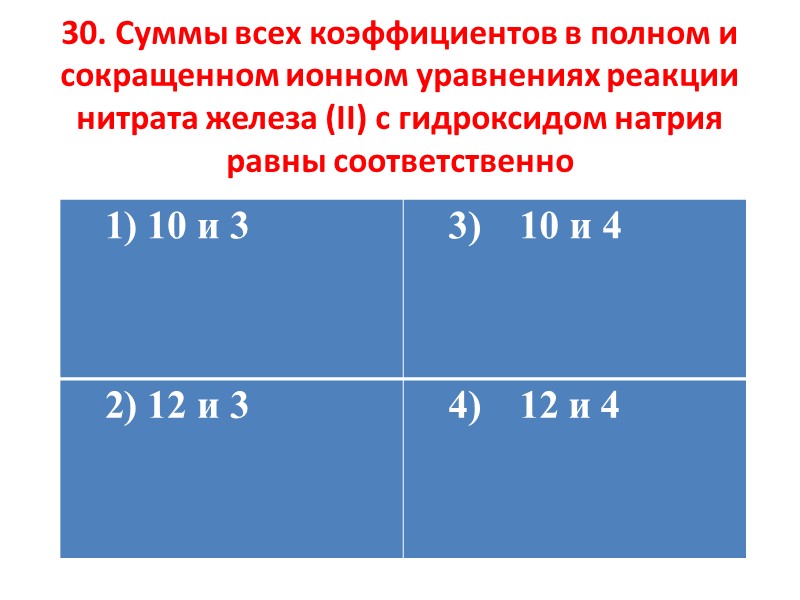
 30. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции нитрата железа (II) с гидроксидом натрия равны соответственно
30. Суммы всех коэффициентов в полном и сокращенном ионном уравнениях реакции нитрата железа (II) с гидроксидом натрия равны соответственно
 31. Реакция ионного обмена протекает до конца при сливании растворов
31. Реакция ионного обмена протекает до конца при сливании растворов
 32. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенным ионным
32. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенным ионным
 33. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями
33. Установите соответствие между исходными веществами, вступающими в реакции обмена, и сокращенными ионными уравнениями
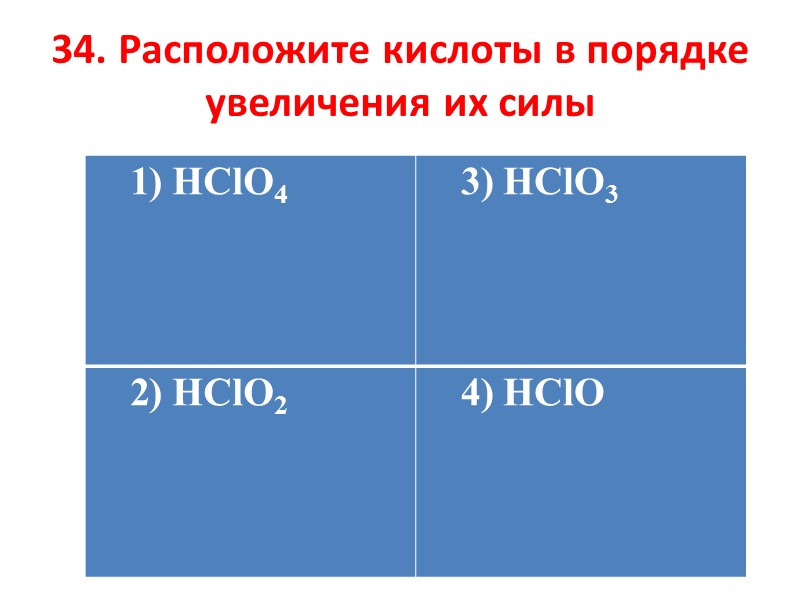
 34. Расположите кислоты в порядке увеличения их силы
34. Расположите кислоты в порядке увеличения их силы
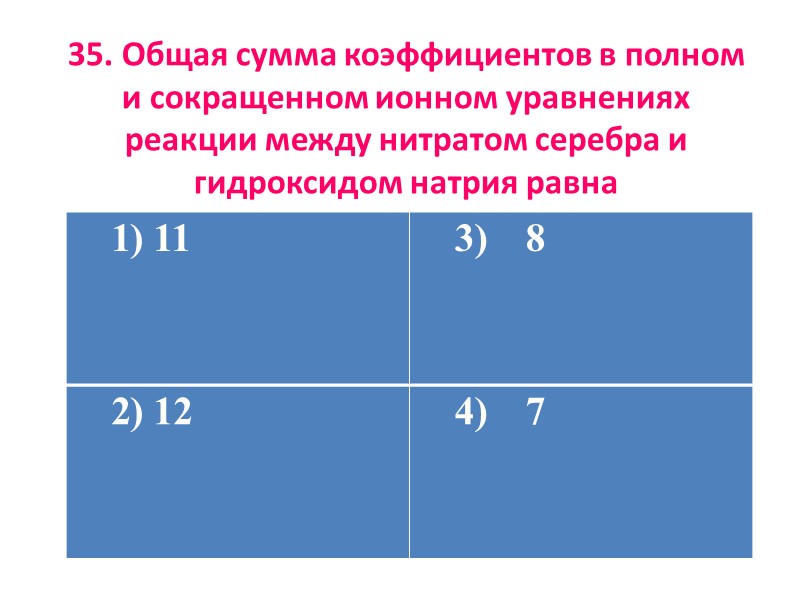
 35. Общая сумма коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна
35. Общая сумма коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна
 С4. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (ρ=1,04г/мл) с массовой долей 9%. Какова массовая доля хлорида кальция в образовавшемся растворе? 1) Составим уравнение химической реакции: CaCO3+2HCl=H2O+CaCl2+CO2↑ 2) Рассчитаем количества веществ реагентов: n(HCL)исх.=150∙1,04∙0,009/36,5= 0,385 моль в избытке n(CaCO3)= 10/100=0,1 моль 3)Рассчитаем массу раствора (с учётом массы выделившегося углекислого газа) : n(CO2) = n(CaCO3)= 0,1 моль m(CO2)= 0,1 ∙ 44= 4,4 г m(ра-ра)= (V ∙q) + m(CaCO3 ) – m(CO2 ) =(150∙1,04 + 10- 4,4 = 161,6 г 4)Рассчитаем массовую долю хлорида кальция n(CaCl2)= n(CaCO3)=0,1 моль m(CaCl2)= 0,1 ∙ 111= 11,1г ω(CaCl2)= 11,1/ 161,6 = 0,069 или 6,9%
С4. Карбонат кальция массой 10 г растворили при нагревании в 150 мл хлороводородной кислоты (ρ=1,04г/мл) с массовой долей 9%. Какова массовая доля хлорида кальция в образовавшемся растворе? 1) Составим уравнение химической реакции: CaCO3+2HCl=H2O+CaCl2+CO2↑ 2) Рассчитаем количества веществ реагентов: n(HCL)исх.=150∙1,04∙0,009/36,5= 0,385 моль в избытке n(CaCO3)= 10/100=0,1 моль 3)Рассчитаем массу раствора (с учётом массы выделившегося углекислого газа) : n(CO2) = n(CaCO3)= 0,1 моль m(CO2)= 0,1 ∙ 44= 4,4 г m(ра-ра)= (V ∙q) + m(CaCO3 ) – m(CO2 ) =(150∙1,04 + 10- 4,4 = 161,6 г 4)Рассчитаем массовую долю хлорида кальция n(CaCl2)= n(CaCO3)=0,1 моль m(CaCl2)= 0,1 ∙ 111= 11,1г ω(CaCl2)= 11,1/ 161,6 = 0,069 или 6,9%
 Задача 16,8 л сероводорода (н.у.) прореагировали без остатка с 221 мл 12%-ного раствора гидроксида натрия (плотность 1,131 г/мл). Определите, какое соединение образовалось в растворе и рассчитаете его массовую долю в этом растворе.
Задача 16,8 л сероводорода (н.у.) прореагировали без остатка с 221 мл 12%-ного раствора гидроксида натрия (плотность 1,131 г/мл). Определите, какое соединение образовалось в растворе и рассчитаете его массовую долю в этом растворе.
 Задача Какую массу гидрида лития нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида 5%?
Задача Какую массу гидрида лития нужно растворить в 100 мл воды, чтобы получить раствор с массовой долей гидроксида 5%?






