Вступительная лекция.ppt
- Количество слайдов: 153
 Профессор Дранник Георгий Николаевич Заведующий кафедрой клинической иммунологии и аллергологии Национального медицинского университета им. академика А. А. Богомольца, заведующий лабораторией иммунологии Института урологии АМН Украины, Президент Украинского общества специалистов по иммунологии, аллергологии и иммунореабилитации
Профессор Дранник Георгий Николаевич Заведующий кафедрой клинической иммунологии и аллергологии Национального медицинского университета им. академика А. А. Богомольца, заведующий лабораторией иммунологии Института урологии АМН Украины, Президент Украинского общества специалистов по иммунологии, аллергологии и иммунореабилитации

 Основные задачи учреждений клинической иммунологии
Основные задачи учреждений клинической иммунологии
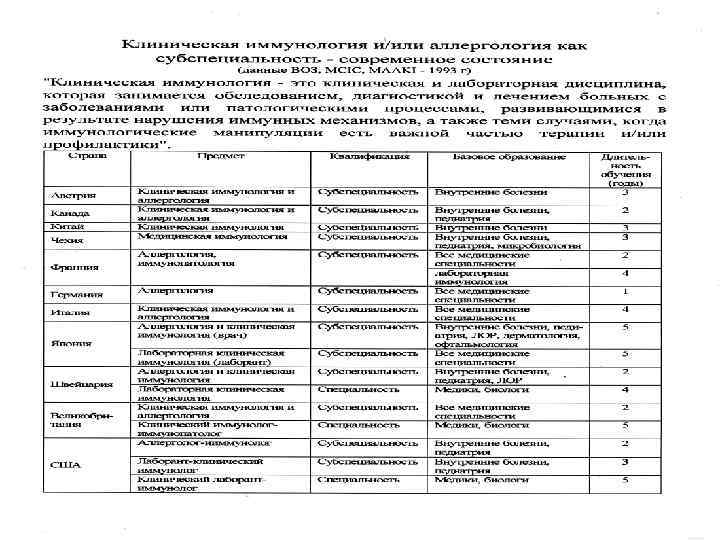


 Нарушения иммунной системы Аутоиммунные Аллергические Иммунодефициты заболевания 1. Системная красная 1. Бронхиальная астма волчанка 2. Поллиноз первичные вторичные, 2. Ревматоидный артрит (аллергический в том числе, 3. Сахарный диабет риноконъюнктивит) СПИД 4. Заболевания щитовидной 3. Атопический дерматит железы 4. Крапивница, отек Квинке (Частые инфекционные Заболевая, опухоли)
Нарушения иммунной системы Аутоиммунные Аллергические Иммунодефициты заболевания 1. Системная красная 1. Бронхиальная астма волчанка 2. Поллиноз первичные вторичные, 2. Ревматоидный артрит (аллергический в том числе, 3. Сахарный диабет риноконъюнктивит) СПИД 4. Заболевания щитовидной 3. Атопический дерматит железы 4. Крапивница, отек Квинке (Частые инфекционные Заболевая, опухоли)

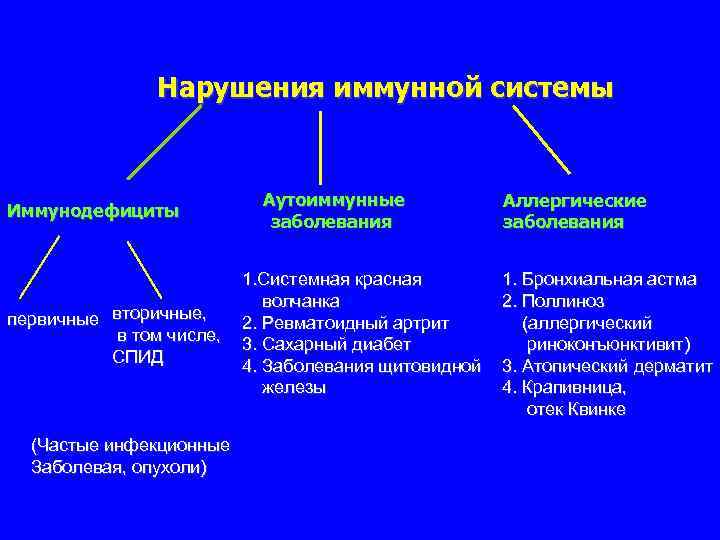
 Органы иммунной системы tonsils Центральные (первичные) thymus костный мозг вилочковая железа thoracic duct spleen Peyer’s patches mesenteric nodes Периферические inguinal nodes - селезенка - лимф. узлы bone marrow лимфоидная ткань слизистых lymphatic vessels - клетки
Органы иммунной системы tonsils Центральные (первичные) thymus костный мозг вилочковая железа thoracic duct spleen Peyer’s patches mesenteric nodes Периферические inguinal nodes - селезенка - лимф. узлы bone marrow лимфоидная ткань слизистых lymphatic vessels - клетки
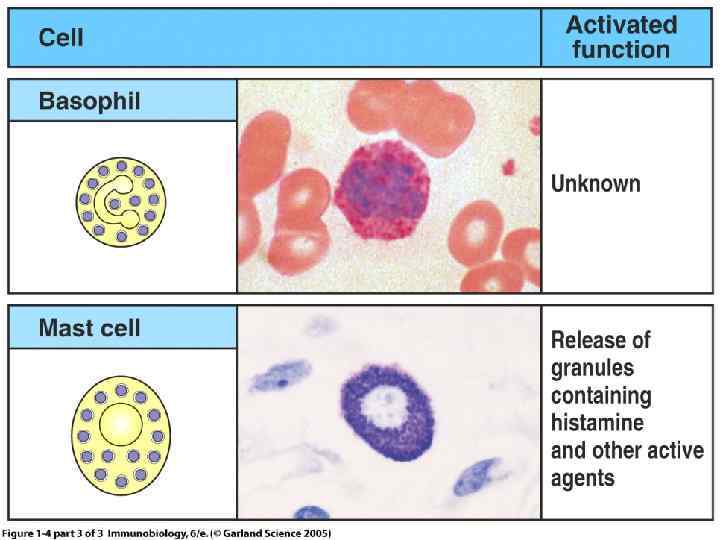
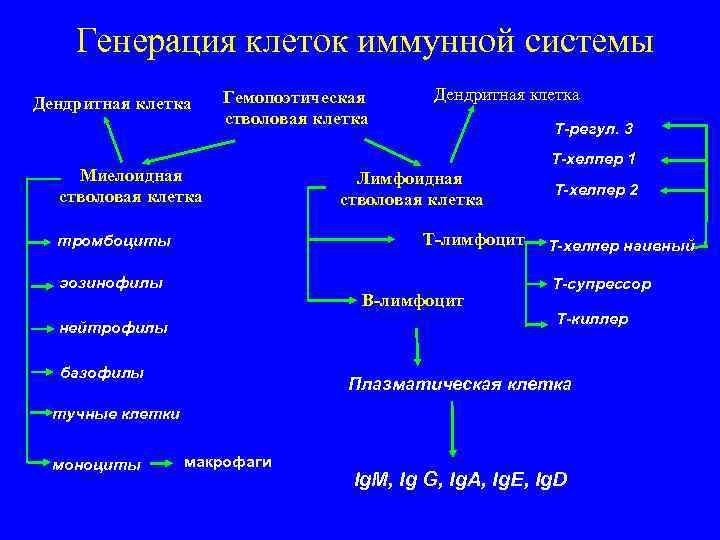 Генерация клеток иммунной системы Гемопоэтическая Дендритная клетка стволовая клетка Т-регул. 3 Т-хелпер 1 Миелоидная Лимфоидная стволовая клетка Т-хелпер 2 стволовая клетка тромбоциты Т-лимфоцит Т-хелпер наивный эозинофилы Т-супрессор В-лимфоцит Т-киллер нейтрофилы базофилы Плазматическая клетка тучные клетки моноциты макрофаги Ig. M, Ig G, Ig. A, Ig. E, Ig. D
Генерация клеток иммунной системы Гемопоэтическая Дендритная клетка стволовая клетка Т-регул. 3 Т-хелпер 1 Миелоидная Лимфоидная стволовая клетка Т-хелпер 2 стволовая клетка тромбоциты Т-лимфоцит Т-хелпер наивный эозинофилы Т-супрессор В-лимфоцит Т-киллер нейтрофилы базофилы Плазматическая клетка тучные клетки моноциты макрофаги Ig. M, Ig G, Ig. A, Ig. E, Ig. D
 Иммунитет способность иммунной системы распознавать и нейтрализовать «чужое» и измененное «свое» Основная функция иммунной системы состоит в поддержании антигенного гомеостаза (функция иммунного надзора) Способность к миграции – одно из отличительных свойств клеток иммунной системы, позволяющих им выполнять свою основную функцию Иммунная система организма способна развивать два типа (2 вида иммунного ответа): – неспецифический (естественный врожденный иммунитет) – специфический (приобретенный адаптивный иммунитет)
Иммунитет способность иммунной системы распознавать и нейтрализовать «чужое» и измененное «свое» Основная функция иммунной системы состоит в поддержании антигенного гомеостаза (функция иммунного надзора) Способность к миграции – одно из отличительных свойств клеток иммунной системы, позволяющих им выполнять свою основную функцию Иммунная система организма способна развивать два типа (2 вида иммунного ответа): – неспецифический (естественный врожденный иммунитет) – специфический (приобретенный адаптивный иммунитет)
 Основная функция иммунной системы – контроль за антигенным гомеостазом организма – реализуется за счет способности иммуноцитов мигрировать и распознать «своё» , отличая его от «чужого» или измененного «своего» .
Основная функция иммунной системы – контроль за антигенным гомеостазом организма – реализуется за счет способности иммуноцитов мигрировать и распознать «своё» , отличая его от «чужого» или измененного «своего» .
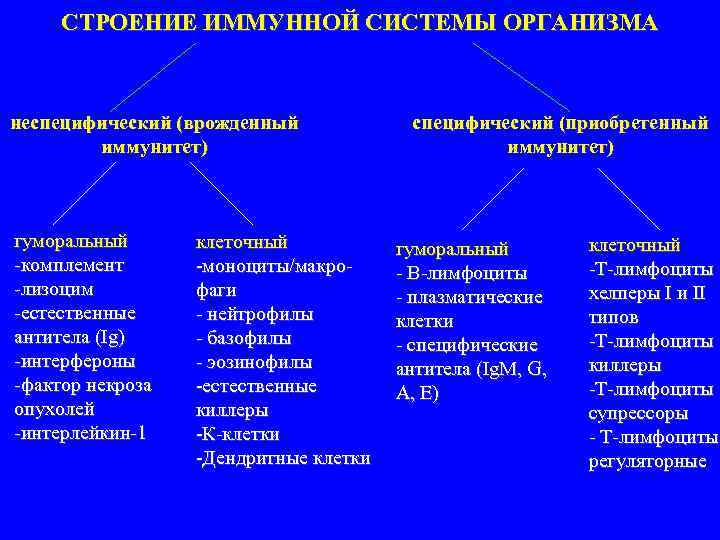 СТРОЕНИЕ ИММУННОЙ СИСТЕМЫ ОРГАНИЗМА неспецифический (врожденный специфический (приобретенный иммунитет) гуморальный клеточный гуморальный клеточный комплемент моноциты/макро В лимфоциты Т лимфоциты лизоцим фаги плазматические хелперы І и ІІ естественные нейтрофилы клетки типов антитела (Ig) базофилы специфические Т лимфоциты интерфероны эозинофилы антитела (Ig. M, G, киллеры фактор некроза естественные A, E) Т лимфоциты опухолей киллеры супрессоры интерлейкин 1 К клетки Т лимфоциты Дендритные клетки регуляторные
СТРОЕНИЕ ИММУННОЙ СИСТЕМЫ ОРГАНИЗМА неспецифический (врожденный специфический (приобретенный иммунитет) гуморальный клеточный гуморальный клеточный комплемент моноциты/макро В лимфоциты Т лимфоциты лизоцим фаги плазматические хелперы І и ІІ естественные нейтрофилы клетки типов антитела (Ig) базофилы специфические Т лимфоциты интерфероны эозинофилы антитела (Ig. M, G, киллеры фактор некроза естественные A, E) Т лимфоциты опухолей киллеры супрессоры интерлейкин 1 К клетки Т лимфоциты Дендритные клетки регуляторные
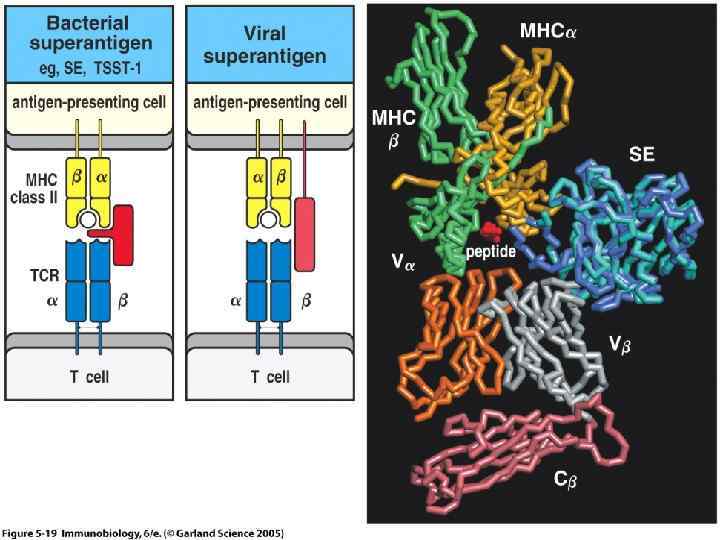
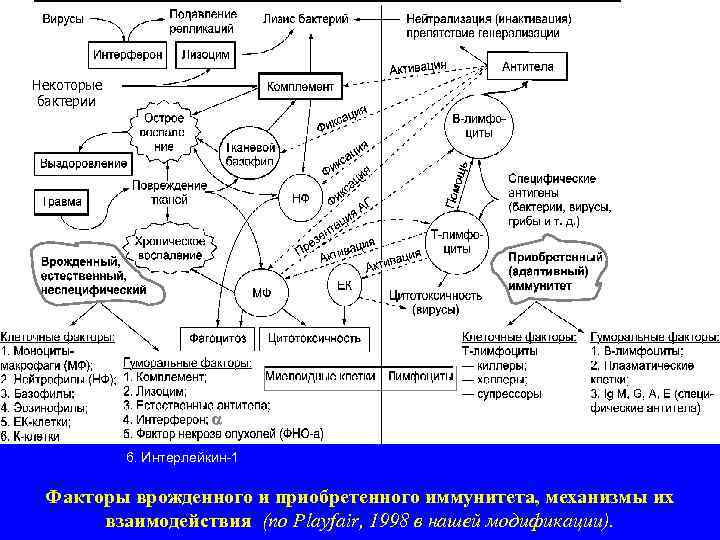 Некоторые бактерии 6. Интерлейкин-1 Факторы врожденного и приобретенного иммунитета, механизмы их взаимодействия (по Playfair, 1998 в нашей модификации).
Некоторые бактерии 6. Интерлейкин-1 Факторы врожденного и приобретенного иммунитета, механизмы их взаимодействия (по Playfair, 1998 в нашей модификации).
 Цитокины • Клеточные медиаторы белковой природы, которые секретируются клетками крови и иммунной системы и служат для передачи информации • Для передачи информации цитокины связываются со специфическими рецепторами
Цитокины • Клеточные медиаторы белковой природы, которые секретируются клетками крови и иммунной системы и служат для передачи информации • Для передачи информации цитокины связываются со специфическими рецепторами
 Семейства цитокинов • интерлейкины (от ИЛ 1 до ИЛ 31) • интерфероны ( , и ) • ростовые факторы (эпидермальный, эндотели альный, инсулин подобный, фактор роста нервов) • опухоль некротизирующие факторы (ОНФ и ) • хемокины • трансформирующие факторы роста (ТРФ и )
Семейства цитокинов • интерлейкины (от ИЛ 1 до ИЛ 31) • интерфероны ( , и ) • ростовые факторы (эпидермальный, эндотели альный, инсулин подобный, фактор роста нервов) • опухоль некротизирующие факторы (ОНФ и ) • хемокины • трансформирующие факторы роста (ТРФ и )
 БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЦИТОКИНОВ. 1. Пролиферация (деление клеток – ИЛ 2; эпидермальный, эндотелиальный, инсулин подобный и др. факторы роста). 2. Дифференцировка (созревание клеток – Тх1, Тх2, В лимфоциты и др. ). 3. Апоптоз (программированная гибель клеток – ОНФ и др. ). 4. Жизнеспособность клеток (анти апоптотический сигнал – bcl 2; ИЛ 2 и др. ). 5. Адгезия (миграция). 6. Индукция воспаления. Про-воспалительные цитокины: ИЛ 1; 2; 6; 8; 12; ИНФ; ОНФ Анти-воспалительные цитокины: ИЛ 4; 10; 13; ТФР
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЦИТОКИНОВ. 1. Пролиферация (деление клеток – ИЛ 2; эпидермальный, эндотелиальный, инсулин подобный и др. факторы роста). 2. Дифференцировка (созревание клеток – Тх1, Тх2, В лимфоциты и др. ). 3. Апоптоз (программированная гибель клеток – ОНФ и др. ). 4. Жизнеспособность клеток (анти апоптотический сигнал – bcl 2; ИЛ 2 и др. ). 5. Адгезия (миграция). 6. Индукция воспаления. Про-воспалительные цитокины: ИЛ 1; 2; 6; 8; 12; ИНФ; ОНФ Анти-воспалительные цитокины: ИЛ 4; 10; 13; ТФР
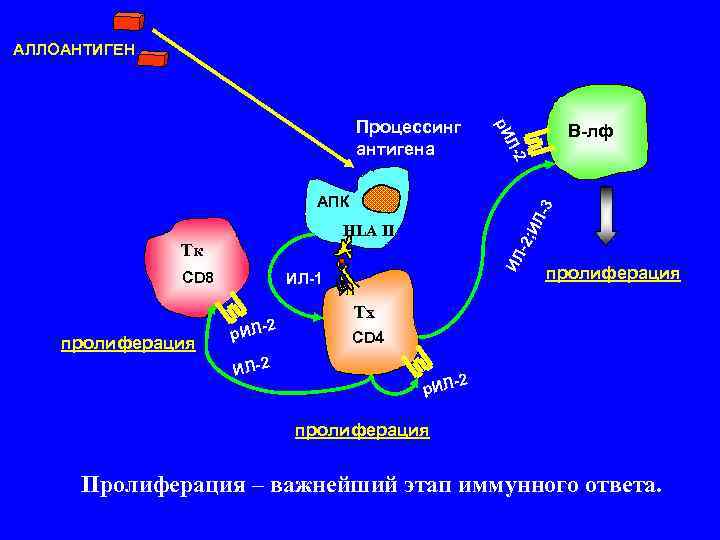 АЛЛОАНТИГЕН Процессинг В-лф р. И антигена Л- 2 АПК 3 Л- HLA IІ И -2; Тк ИЛ СD 8 ИЛ-1 пролиферация Тх 2 р. ИЛ- CD 4 пролиферация ИЛ-2 р. ИЛ- пролиферация Пролиферация – важнейший этап иммунного ответа.
АЛЛОАНТИГЕН Процессинг В-лф р. И антигена Л- 2 АПК 3 Л- HLA IІ И -2; Тк ИЛ СD 8 ИЛ-1 пролиферация Тх 2 р. ИЛ- CD 4 пролиферация ИЛ-2 р. ИЛ- пролиферация Пролиферация – важнейший этап иммунного ответа.
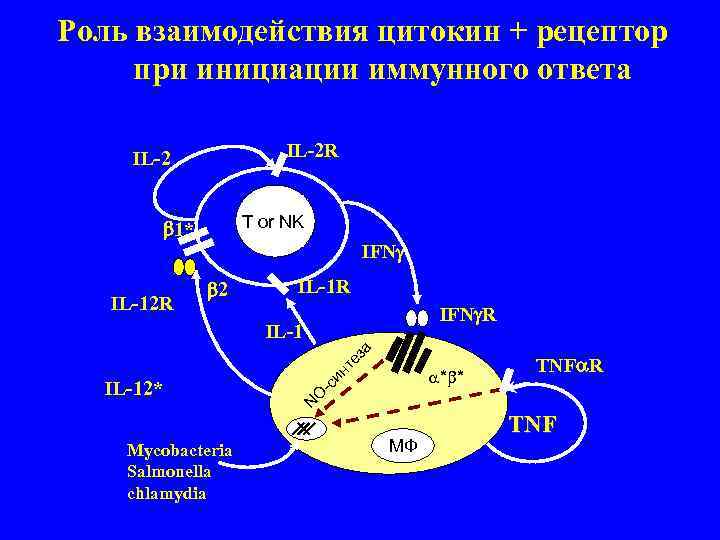 Роль взаимодействия цитокин + рецептор при инициации иммунного ответа IL-2 R 1* T or NK IFN 2 IL-1 R IL-12 R IFN R IL-1 за TNF R те * * ин IL-12* -с O N TNF Mycobacteria МФ Salmonella chlamydia
Роль взаимодействия цитокин + рецептор при инициации иммунного ответа IL-2 R 1* T or NK IFN 2 IL-1 R IL-12 R IFN R IL-1 за TNF R те * * ин IL-12* -с O N TNF Mycobacteria МФ Salmonella chlamydia
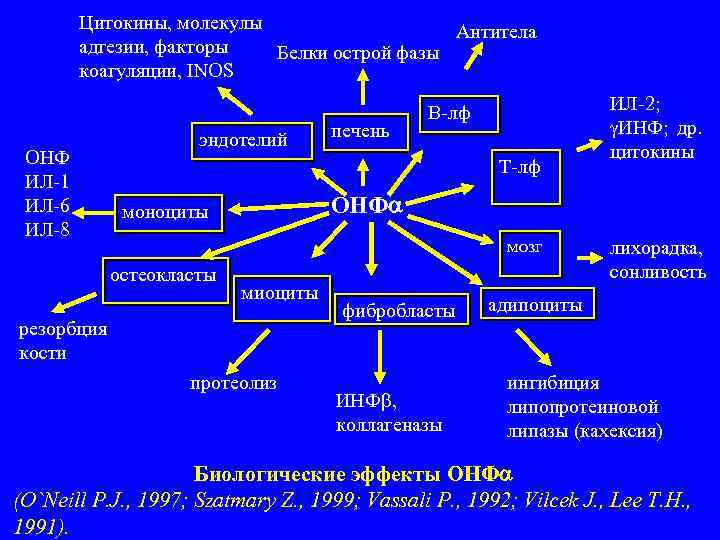 Цитокины, молекулы Антитела адгезии, факторы Белки острой фазы коагуляции, INOS В лф ИЛ 2; печень ИНФ; др. эндотелий ОНФ цитокины Т лф ИЛ 1 ИЛ 6 моноциты ОНФ ИЛ 8 мозг лихорадка, остеокласты сонливость миоциты фибробласты адипоциты резорбция кости протеолиз ингибиция ИНФ , липопротеиновой коллагеназы липазы (кахексия) Биологические эффекты ОНФ (O`Neill P. J. , 1997; Szatmary Z. , 1999; Vassali P. , 1992; Vilcek J. , Lee T. H. , 1991).
Цитокины, молекулы Антитела адгезии, факторы Белки острой фазы коагуляции, INOS В лф ИЛ 2; печень ИНФ; др. эндотелий ОНФ цитокины Т лф ИЛ 1 ИЛ 6 моноциты ОНФ ИЛ 8 мозг лихорадка, остеокласты сонливость миоциты фибробласты адипоциты резорбция кости протеолиз ингибиция ИНФ , липопротеиновой коллагеназы липазы (кахексия) Биологические эффекты ОНФ (O`Neill P. J. , 1997; Szatmary Z. , 1999; Vassali P. , 1992; Vilcek J. , Lee T. H. , 1991).
 Классификация цитокинов Про- Анти- Регуляторные воспалительные цитокины ИЛ-1, 2, 6, 8, 12, ИЛ-4, ИЛ-10 -ИНФ, ОНФ- ИЛ-5 ТФР- ИЛ-13
Классификация цитокинов Про- Анти- Регуляторные воспалительные цитокины ИЛ-1, 2, 6, 8, 12, ИЛ-4, ИЛ-10 -ИНФ, ОНФ- ИЛ-5 ТФР- ИЛ-13
 Адгезивные молекулы. I. Селектины 1. LECAM 1 lectin like cell adhesion molecule. 2. GMP 140 granule membrane protein. 3. ELAM 1 endotelial leukocyte adhesion molecule. 4. PECAM platelet endotelial cell adhesion molecule ІI. Суперсемейство иммуноглобулинов 1. ICAM 1 intercellular adhesion molecule. 2. LFA 3 limphocyte function associated antigen. 3. VCAM 1 vascular cell adhesion molecule. 4. N CAM neural cell adhesion molecule. III. Интегрины 1. LFA 1 limphocyte function associated antigen. 2. VLA 1 very late activation antigen. 3. VNR vitronectin receptor. 4. MAC 1 monocyte adhesion complex.
Адгезивные молекулы. I. Селектины 1. LECAM 1 lectin like cell adhesion molecule. 2. GMP 140 granule membrane protein. 3. ELAM 1 endotelial leukocyte adhesion molecule. 4. PECAM platelet endotelial cell adhesion molecule ІI. Суперсемейство иммуноглобулинов 1. ICAM 1 intercellular adhesion molecule. 2. LFA 3 limphocyte function associated antigen. 3. VCAM 1 vascular cell adhesion molecule. 4. N CAM neural cell adhesion molecule. III. Интегрины 1. LFA 1 limphocyte function associated antigen. 2. VLA 1 very late activation antigen. 3. VNR vitronectin receptor. 4. MAC 1 monocyte adhesion complex.
 Адгезивные молекулы обеспечивают следующие процессы: Для лейкоцитов: 1. Прикрепление к сосудистому эндотелию; 2. Трансмиграцию через эндотелий; 3. Прикрепление к экстрацеллюлярному матриксу (фибронектин, ламинин, коллаген). Для лимфоцитов: 1. Прикрепление друг к другу; 2. Реализацию хомминг эффекта (миграцию в Т и В зоны в периферических лимфоидных органах); 3. Прикрепление к антигенпредставляющим клеткам. Для тромбоцитов: 1. Прикрепление к лейкоцитам; 2. Прикрепление к эндотелиальным клеткам.
Адгезивные молекулы обеспечивают следующие процессы: Для лейкоцитов: 1. Прикрепление к сосудистому эндотелию; 2. Трансмиграцию через эндотелий; 3. Прикрепление к экстрацеллюлярному матриксу (фибронектин, ламинин, коллаген). Для лимфоцитов: 1. Прикрепление друг к другу; 2. Реализацию хомминг эффекта (миграцию в Т и В зоны в периферических лимфоидных органах); 3. Прикрепление к антигенпредставляющим клеткам. Для тромбоцитов: 1. Прикрепление к лейкоцитам; 2. Прикрепление к эндотелиальным клеткам.
 Роль цитокинов и адгезивных молекул в миграции клеток. Адгезивные молекулы: 1. Селектины (Е , L , P selectin) 2. Интегрины (LFA 1; VLA 4) 3. Суперсемейство иммуноглобулинов (ICAM-3; VCAM) I. Этап атаки. Под влиянием цитокинов на поверхности эндотелия и клеток воспаления появляются молекулы семейства селектинов. Клетки замедляют движение, приближаются к эндотелию и начинают "катиться" (rolling) по его поверхности. Происходит изменение анти адгезивного статуса эндотелия на про адгезивный. II. Этап адгезии (прикрепления). По мере приближения под влиянием β хемокинов к месту воспаления, клетки прилипают (распластываются) к эндотелию. Эндотелий ICAM 1; лимфоциты LFA 1. III. Этап трансмиграции. На этом этапе клетки воспаления с помощью интегринов проникают между клетками эндотелия и попадают в ткань.
Роль цитокинов и адгезивных молекул в миграции клеток. Адгезивные молекулы: 1. Селектины (Е , L , P selectin) 2. Интегрины (LFA 1; VLA 4) 3. Суперсемейство иммуноглобулинов (ICAM-3; VCAM) I. Этап атаки. Под влиянием цитокинов на поверхности эндотелия и клеток воспаления появляются молекулы семейства селектинов. Клетки замедляют движение, приближаются к эндотелию и начинают "катиться" (rolling) по его поверхности. Происходит изменение анти адгезивного статуса эндотелия на про адгезивный. II. Этап адгезии (прикрепления). По мере приближения под влиянием β хемокинов к месту воспаления, клетки прилипают (распластываются) к эндотелию. Эндотелий ICAM 1; лимфоциты LFA 1. III. Этап трансмиграции. На этом этапе клетки воспаления с помощью интегринов проникают между клетками эндотелия и попадают в ткань.
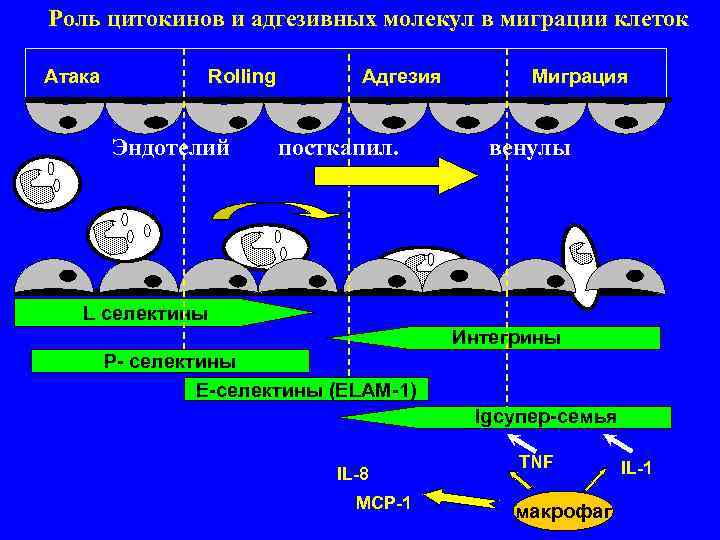 Роль цитокинов и адгезивных молекул в миграции клеток Атака Rolling Адгезия Миграция Эндотелий посткапил. венулы L селектины Интегрины Р- селектины Е-селектины (ELAM-1) Igсупер-семья TNF IL-1 IL-8 MCP-1 макрофаг
Роль цитокинов и адгезивных молекул в миграции клеток Атака Rolling Адгезия Миграция Эндотелий посткапил. венулы L селектины Интегрины Р- селектины Е-селектины (ELAM-1) Igсупер-семья TNF IL-1 IL-8 MCP-1 макрофаг
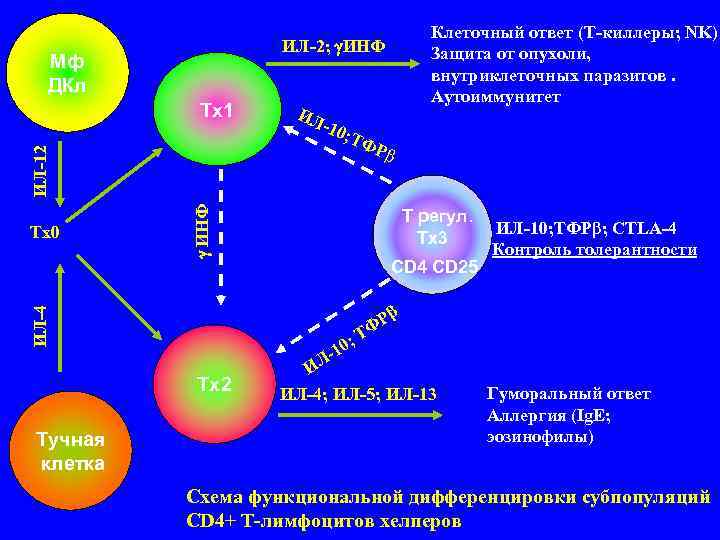 Клеточный ответ (Т-киллеры; NK) ИЛ-2; ИНФ Защита от опухоли, Мф внутриклеточных паразитов. ДКл Аутоиммунитет Тх1 ИЛ -10 ; ТФ Рβ ИЛ-12 ИНФ Т регул. Tх0 ИЛ-10; ТФРβ; CTLA-4 Тх3 Контроль толерантности CD 4 CD 25 Рβ ИЛ-4 ТФ ; -10 ИЛ Тх2 ИЛ-4; ИЛ-5; ИЛ-13 Гуморальный ответ Аллергия (Ig. E; Тучная эозинофилы) клетка Схема функциональной дифференцировки субпопуляций CD 4+ Т-лимфоцитов хелперов
Клеточный ответ (Т-киллеры; NK) ИЛ-2; ИНФ Защита от опухоли, Мф внутриклеточных паразитов. ДКл Аутоиммунитет Тх1 ИЛ -10 ; ТФ Рβ ИЛ-12 ИНФ Т регул. Tх0 ИЛ-10; ТФРβ; CTLA-4 Тх3 Контроль толерантности CD 4 CD 25 Рβ ИЛ-4 ТФ ; -10 ИЛ Тх2 ИЛ-4; ИЛ-5; ИЛ-13 Гуморальный ответ Аллергия (Ig. E; Тучная эозинофилы) клетка Схема функциональной дифференцировки субпопуляций CD 4+ Т-лимфоцитов хелперов
 CD 4+ CD 25+ T-reg Механизмы действия 1) CTLA 4, связываясь с СД 80 и СД 86 на Д клетках, подавляет их активность по индукции Th). 2) CTLA 4 продуцируют ИЛ I 0 и TGF. Предотвращают утоиммунитет, тторжение. а о Их подавление усиливает противоопухолевый иммунитет.
CD 4+ CD 25+ T-reg Механизмы действия 1) CTLA 4, связываясь с СД 80 и СД 86 на Д клетках, подавляет их активность по индукции Th). 2) CTLA 4 продуцируют ИЛ I 0 и TGF. Предотвращают утоиммунитет, тторжение. а о Их подавление усиливает противоопухолевый иммунитет.
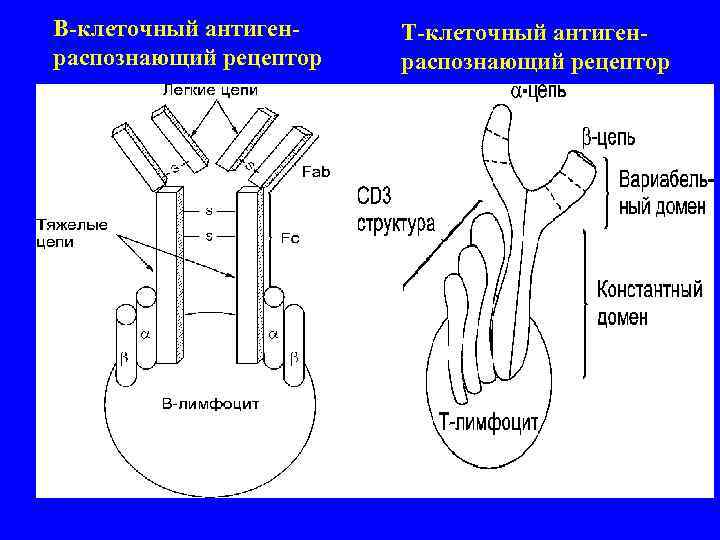 В-клеточный антиген- Т-клеточный антиген- распознающий рецептор
В-клеточный антиген- Т-клеточный антиген- распознающий рецептор
 В 1903 г. А. Каррель впервые предположил существование трансплантационных антигенов, определяющих выраженность реакции отторжения В 1957 г. G. Dausset описал первый антиген гистосовместимости. Впоследствии эта группа генов получила название «Главный комплекс гистосовместимости» - ГКГ Роль молекул ГКГ чрезвычайно важна. Набор этих молекул для каждого человека абсолютно специфичен. Это делает людей индивидуальными во многих отношениях, вплоть до поведенческих реакций
В 1903 г. А. Каррель впервые предположил существование трансплантационных антигенов, определяющих выраженность реакции отторжения В 1957 г. G. Dausset описал первый антиген гистосовместимости. Впоследствии эта группа генов получила название «Главный комплекс гистосовместимости» - ГКГ Роль молекул ГКГ чрезвычайно важна. Набор этих молекул для каждого человека абсолютно специфичен. Это делает людей индивидуальными во многих отношениях, вплоть до поведенческих реакций
 Определены две основные функции ГКГ 1. Участие в межклеточных взаимодействиях при реализации иммунного ответа и презентации чужеродного антигенного материала для распознавании 2. Функция региона ГКГ, связанная с иммунологической резистентностью в целом и с предрасположенностью к ряду иммуно- зависимых заболеваний
Определены две основные функции ГКГ 1. Участие в межклеточных взаимодействиях при реализации иммунного ответа и презентации чужеродного антигенного материала для распознавании 2. Функция региона ГКГ, связанная с иммунологической резистентностью в целом и с предрасположенностью к ряду иммуно- зависимых заболеваний
 Терминология МНС – Major Histocompatebility Complex – Главный Комплекс Гистосовместимости –для всех млекопитающих HLA – Human Leukocyte Antigens – Лейкоцитарные Антигены Человека Трансплантационные антигены – сохранившийся исторический термин
Терминология МНС – Major Histocompatebility Complex – Главный Комплекс Гистосовместимости –для всех млекопитающих HLA – Human Leukocyte Antigens – Лейкоцитарные Антигены Человека Трансплантационные антигены – сохранившийся исторический термин
 Гены системы НLА отличаются большим разнообразием и полиморфизмом -В настоящее время описано 43 гена в локусе А, 108 – в локусе В и 33 – в локусе С -Кроме того, некоторые гены имеют по несколько аллельных вариантов. Например, ген НLА-А 2 –имеет 47 аллелей, ген В 35 – 46, а ген В 27 – 23 аллеля. -Аллельный полиморфизм лежит в основе строгой индивидуализации набора НLА-антигенов у конкретного человека и во многом определяет различие в протекании одного и того же иммуно- зависимого заболевания (клинические маски)
Гены системы НLА отличаются большим разнообразием и полиморфизмом -В настоящее время описано 43 гена в локусе А, 108 – в локусе В и 33 – в локусе С -Кроме того, некоторые гены имеют по несколько аллельных вариантов. Например, ген НLА-А 2 –имеет 47 аллелей, ген В 35 – 46, а ген В 27 – 23 аллеля. -Аллельный полиморфизм лежит в основе строгой индивидуализации набора НLА-антигенов у конкретного человека и во многом определяет различие в протекании одного и того же иммуно- зависимого заболевания (клинические маски)
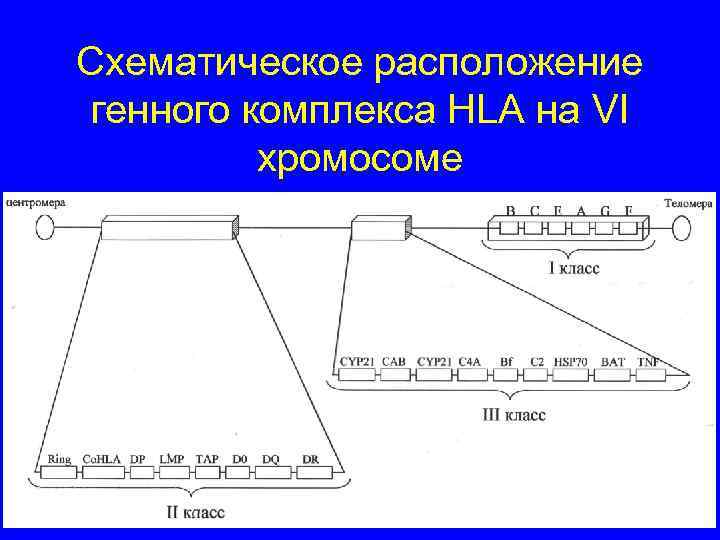 Схематическое расположение генного комплекса HLA на VI хромосоме
Схематическое расположение генного комплекса HLA на VI хромосоме
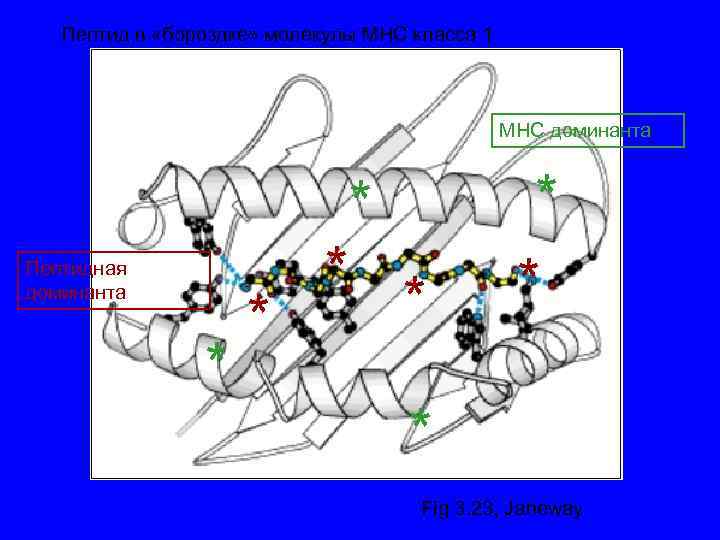 Пептид в «бороздке» молекулы МНС класса 1 МНС доминанта * Пептидная доминанта * * * Fig 3. 23, Janeway
Пептид в «бороздке» молекулы МНС класса 1 МНС доминанта * Пептидная доминанта * * * Fig 3. 23, Janeway
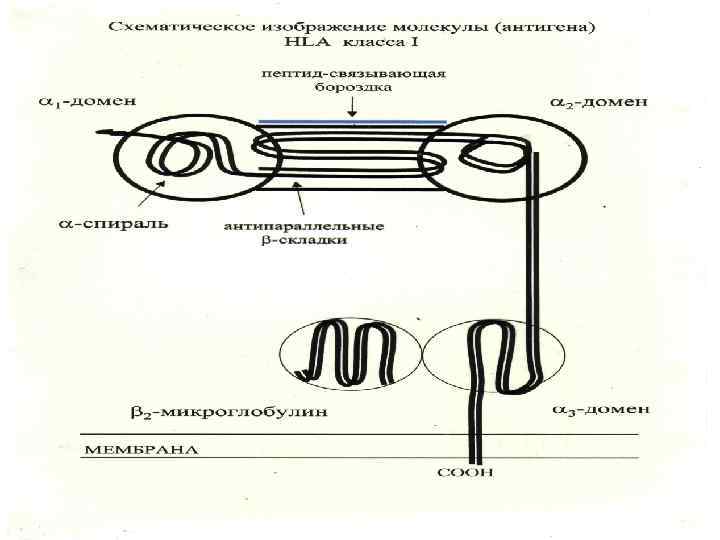
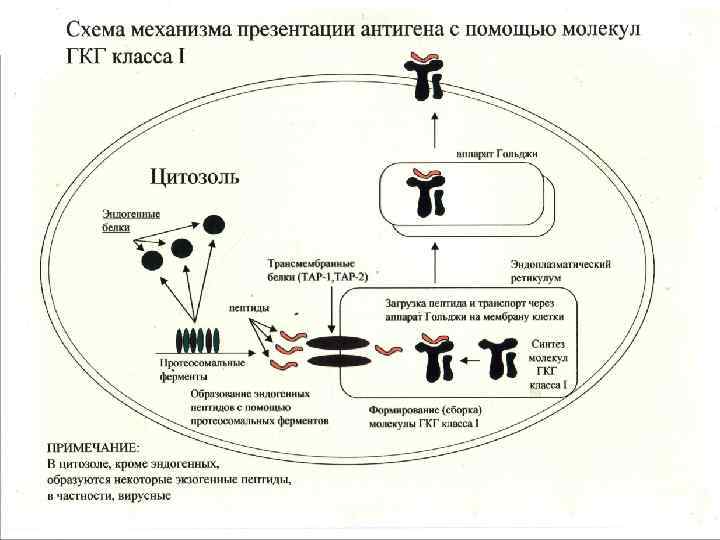
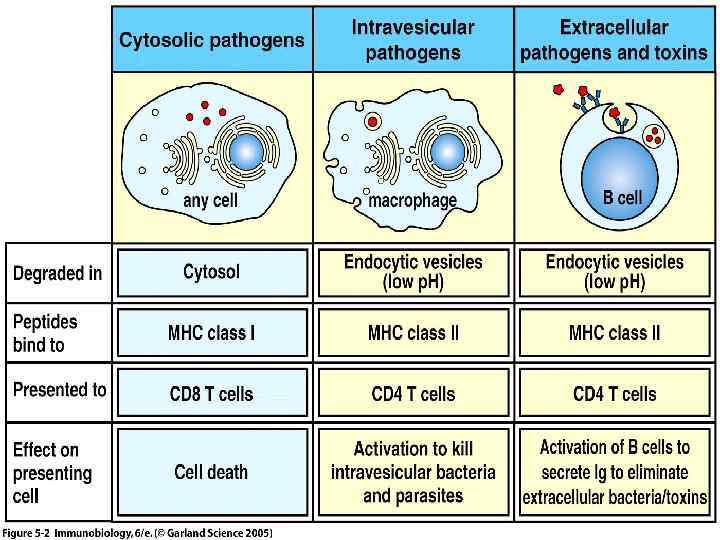
 Молекулы ГКГ класса I -Экспрессируются на всех ядерных клетках организма -Выраженность экспрессии зависит от типа клеток и цитокинового фона -В «бороздке» молекул ГКГ класса I присутствуют эндогенные пептиды (собственного организма или «сделанные» из внутриклеточных возбудителей, например, вирус, хламидия) -Эндогенные пептиды в молекуле ГКГ класса I распознаются наивными СД 8+ Т- лимфоцтьами киллерами
Молекулы ГКГ класса I -Экспрессируются на всех ядерных клетках организма -Выраженность экспрессии зависит от типа клеток и цитокинового фона -В «бороздке» молекул ГКГ класса I присутствуют эндогенные пептиды (собственного организма или «сделанные» из внутриклеточных возбудителей, например, вирус, хламидия) -Эндогенные пептиды в молекуле ГКГ класса I распознаются наивными СД 8+ Т- лимфоцтьами киллерами
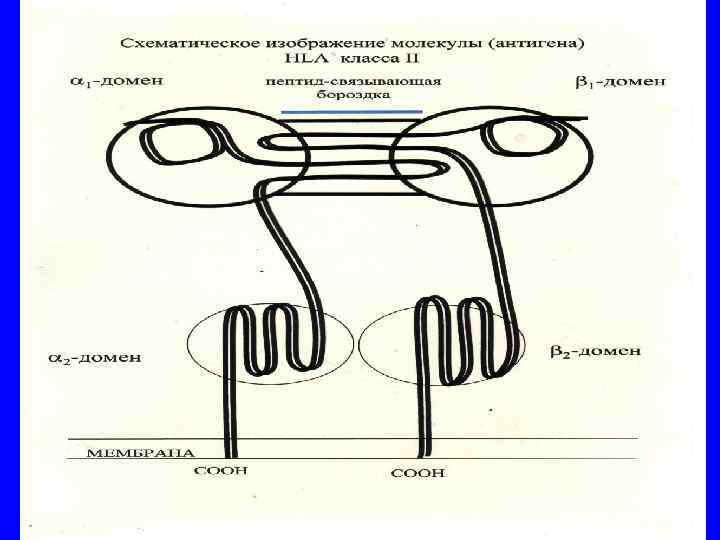
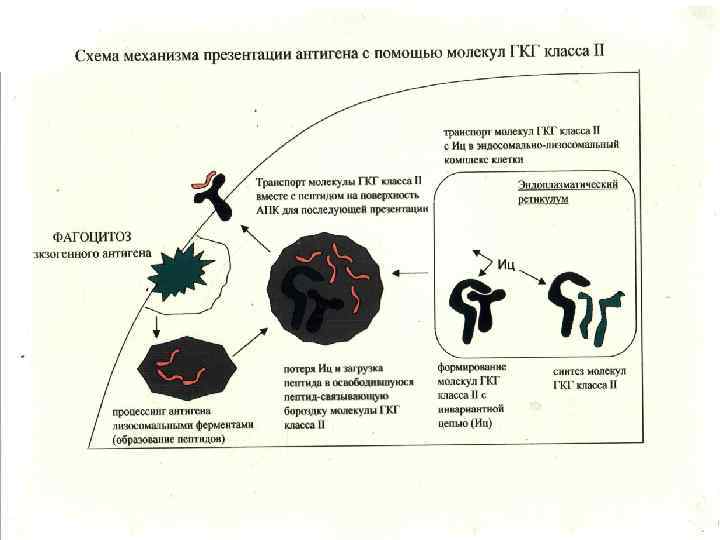
 Молекулы ГКГ класса II -Экспрессируются на антиген-презентирующих клетках (дендритные клетки, макрофаги. В- лимфоциты) -Выраженность экспрессии зависит от типа клеток и цитокинового фона -В «бороздке» молекулы ГКГ присутствуют экзогенные пептиды -Экзогенные пептиды в молекуле ГКГ класса II рапознаются наивными СД 4+ Т-лимфоцитами хелперами
Молекулы ГКГ класса II -Экспрессируются на антиген-презентирующих клетках (дендритные клетки, макрофаги. В- лимфоциты) -Выраженность экспрессии зависит от типа клеток и цитокинового фона -В «бороздке» молекулы ГКГ присутствуют экзогенные пептиды -Экзогенные пептиды в молекуле ГКГ класса II рапознаются наивными СД 4+ Т-лимфоцитами хелперами
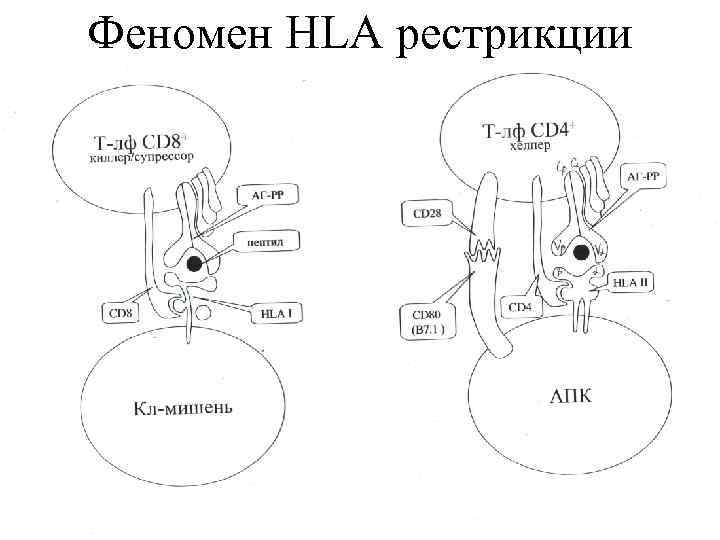 Феномен HLA рестрикции
Феномен HLA рестрикции
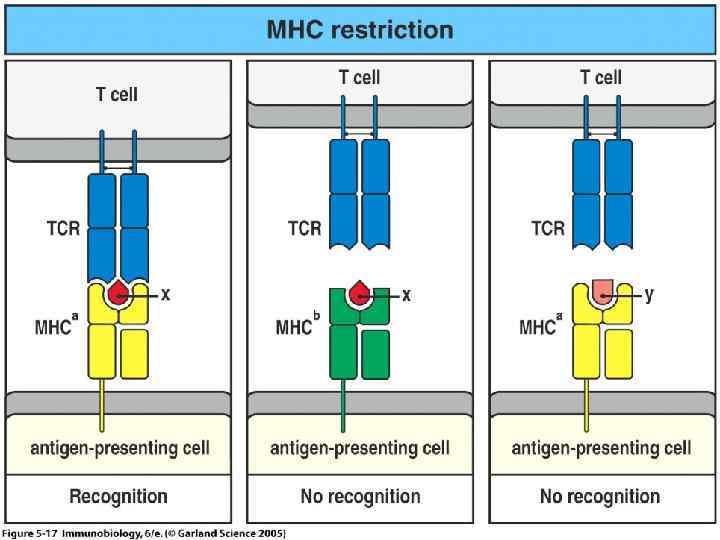
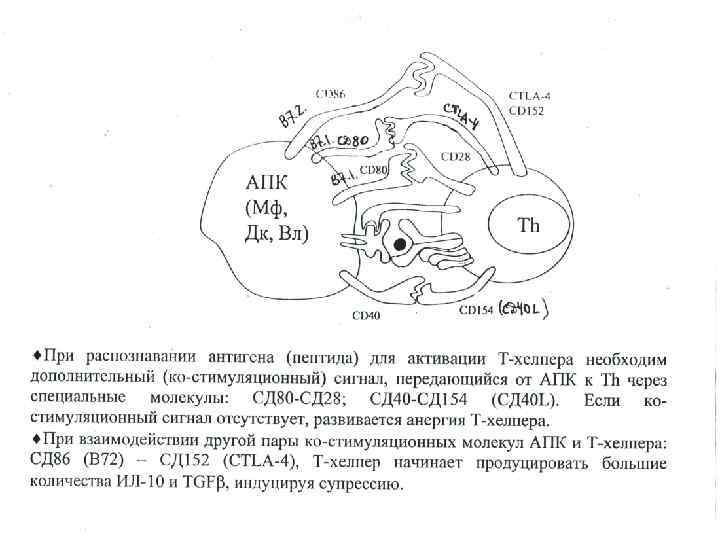
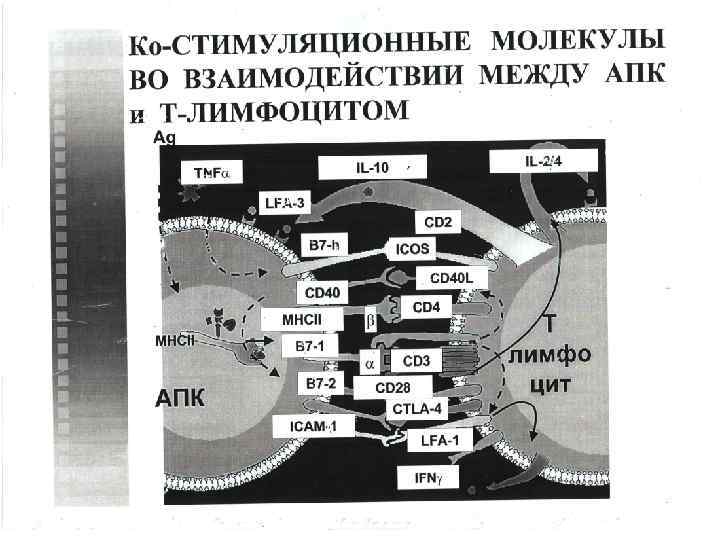
 Условия реализации интегральной функции иммунного распознавания: Во первых, необходимо, чтобы антиген презентирующая клетка смогла «сделать» оптимальное количество пептидов изчужеродного антигенного материала, а её «пептид связывающие бороздки» смогли связать эти пептиды; этот этап назван селекцией антигенных детерминант. Во вторых, необходимо, чтобы иммунная система конкретного человека имела достаточный репертуар Т лимфоцитов с антиген распознающим рецептором, способным распознать чужеродный пептид. Если же такие Т лимфоциты отсутствуют (т. е. имеются «дыры» в репертуаре Т лимфоцитов), то создаются. условия, при которых иммунная система не способна распознать некоторые экзогенные антигены. В третьих, предполагается, что на конечном этапе распознавания включатся (с помощью всё того же пептида) разные механизмы, приводящие в одном случае к индукции иммунного ответа, а в другом – к его супрессии.
Условия реализации интегральной функции иммунного распознавания: Во первых, необходимо, чтобы антиген презентирующая клетка смогла «сделать» оптимальное количество пептидов изчужеродного антигенного материала, а её «пептид связывающие бороздки» смогли связать эти пептиды; этот этап назван селекцией антигенных детерминант. Во вторых, необходимо, чтобы иммунная система конкретного человека имела достаточный репертуар Т лимфоцитов с антиген распознающим рецептором, способным распознать чужеродный пептид. Если же такие Т лимфоциты отсутствуют (т. е. имеются «дыры» в репертуаре Т лимфоцитов), то создаются. условия, при которых иммунная система не способна распознать некоторые экзогенные антигены. В третьих, предполагается, что на конечном этапе распознавания включатся (с помощью всё того же пептида) разные механизмы, приводящие в одном случае к индукции иммунного ответа, а в другом – к его супрессии.

 I II III
I II III
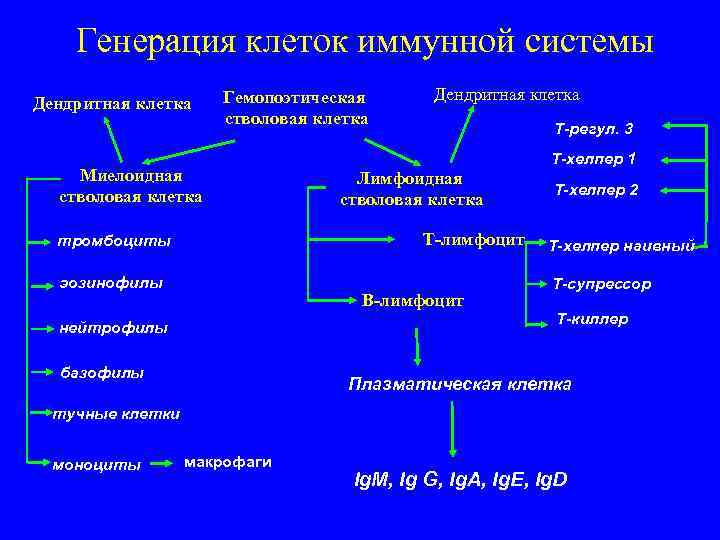 Генерация клеток иммунной системы Гемопоэтическая Дендритная клетка стволовая клетка Т-регул. 3 Т-хелпер 1 Миелоидная Лимфоидная стволовая клетка Т-хелпер 2 стволовая клетка тромбоциты Т-лимфоцит Т-хелпер наивный эозинофилы Т-супрессор В-лимфоцит Т-киллер нейтрофилы базофилы Плазматическая клетка тучные клетки моноциты макрофаги Ig. M, Ig G, Ig. A, Ig. E, Ig. D
Генерация клеток иммунной системы Гемопоэтическая Дендритная клетка стволовая клетка Т-регул. 3 Т-хелпер 1 Миелоидная Лимфоидная стволовая клетка Т-хелпер 2 стволовая клетка тромбоциты Т-лимфоцит Т-хелпер наивный эозинофилы Т-супрессор В-лимфоцит Т-киллер нейтрофилы базофилы Плазматическая клетка тучные клетки моноциты макрофаги Ig. M, Ig G, Ig. A, Ig. E, Ig. D
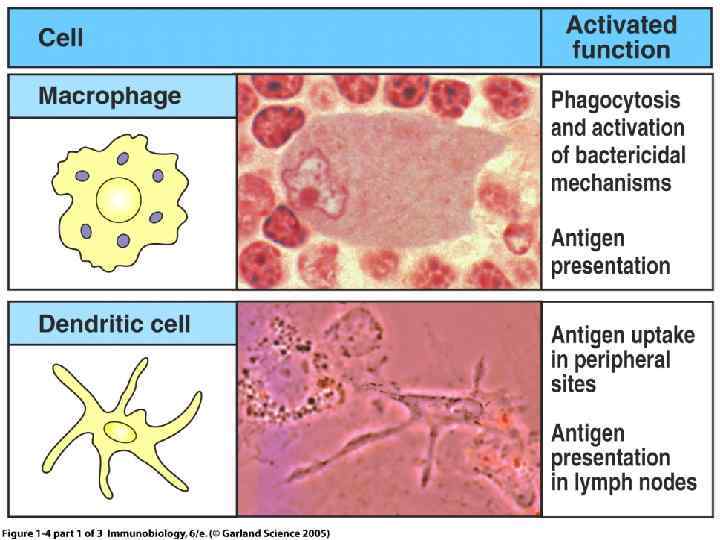
 Дендритные клетки (ДКл) Дендритные клетки относятся к клеткам врожденного, неспецифического иммунитета и по своей функции являются профессиональными антигенпрезентирующими клетками. Эти специализированные фагоцитирующие клетки присутствуют в крови и в большинстве тканей, являются долгоживущими, по сравнению с другими клетками белой крови, обладают высокой антигенперерабатывающей способностью, длительно сохраняют антигенную информацию и способны презентировать антиген для распознавания Т лимфоцитам (пример внутриэпителиальные макрофагоциты (клетки Лангерганса) кожи)
Дендритные клетки (ДКл) Дендритные клетки относятся к клеткам врожденного, неспецифического иммунитета и по своей функции являются профессиональными антигенпрезентирующими клетками. Эти специализированные фагоцитирующие клетки присутствуют в крови и в большинстве тканей, являются долгоживущими, по сравнению с другими клетками белой крови, обладают высокой антигенперерабатывающей способностью, длительно сохраняют антигенную информацию и способны презентировать антиген для распознавания Т лимфоцитам (пример внутриэпителиальные макрофагоциты (клетки Лангерганса) кожи)
 Характеристика дендритных клеток Миелоидная дендритная Лимфоидная дендритная клетка CD 11 c (β-интегрин) CD 123 (рецептор к интерлейкину 3) Интерлейкин 12 Интерфероны , β Индуцирует созревание Th 1 Индуцирует созревание Th 2
Характеристика дендритных клеток Миелоидная дендритная Лимфоидная дендритная клетка CD 11 c (β-интегрин) CD 123 (рецептор к интерлейкину 3) Интерлейкин 12 Интерфероны , β Индуцирует созревание Th 1 Индуцирует созревание Th 2
 Описаны две стадии созревания ДКл на протяжении их жизни: стадия незрелой и стадия зрелой ДКл. Для каждой стадии созревания характерна своя функция и свой набор рецепторов.
Описаны две стадии созревания ДКл на протяжении их жизни: стадия незрелой и стадия зрелой ДКл. Для каждой стадии созревания характерна своя функция и свой набор рецепторов.
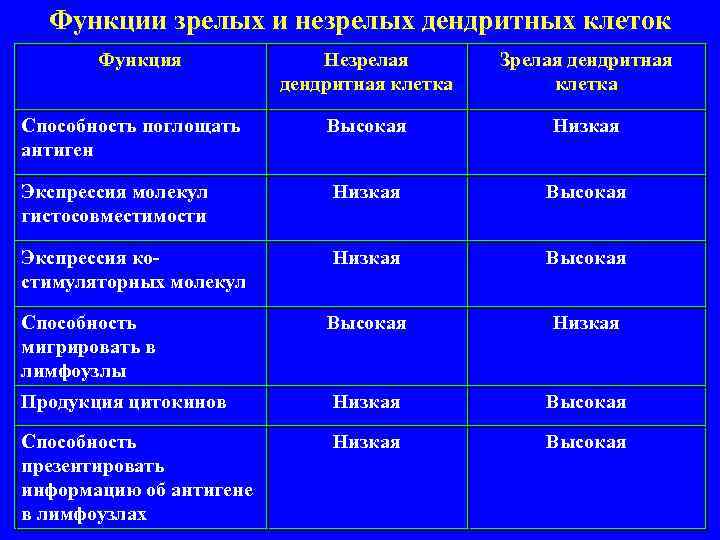 Функции зрелых и незрелых дендритных клеток Функция Незрелая Зрелая дендритная дендритная клетка Способность поглощать Высокая Низкая антиген Экспрессия молекул Низкая Высокая гистосовместимости Экспрессия ко- Низкая Высокая стимуляторных молекул Способность Высокая Низкая мигрировать в лимфоузлы Продукция цитокинов Низкая Высокая Способность Низкая Высокая презентировать информацию об антигене в лимфоузлах
Функции зрелых и незрелых дендритных клеток Функция Незрелая Зрелая дендритная дендритная клетка Способность поглощать Высокая Низкая антиген Экспрессия молекул Низкая Высокая гистосовместимости Экспрессия ко- Низкая Высокая стимуляторных молекул Способность Высокая Низкая мигрировать в лимфоузлы Продукция цитокинов Низкая Высокая Способность Низкая Высокая презентировать информацию об антигене в лимфоузлах
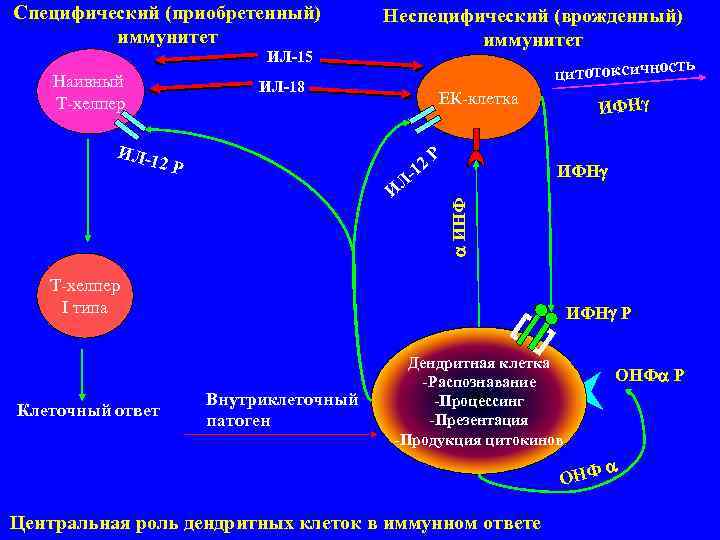 Специфический (приобретенный) Неспецифический (врожденный) иммунитет ИЛ-15 ть Наивный цитотоксичнос ИЛ-18 Т хелпер ЕК клетка ИФНγ ИЛ- 12 Р 1 2 Р ИФН Л- ИНФ Т хелпер I типа ИФН Р Дендритная клетка ОНФ Р Распознавание Внутриклеточный Процессинг Клеточный ответ патоген Презентация Продукция цитокинов ОНФ Центральная роль дендритных клеток в иммунном ответе
Специфический (приобретенный) Неспецифический (врожденный) иммунитет ИЛ-15 ть Наивный цитотоксичнос ИЛ-18 Т хелпер ЕК клетка ИФНγ ИЛ- 12 Р 1 2 Р ИФН Л- ИНФ Т хелпер I типа ИФН Р Дендритная клетка ОНФ Р Распознавание Внутриклеточный Процессинг Клеточный ответ патоген Презентация Продукция цитокинов ОНФ Центральная роль дендритных клеток в иммунном ответе
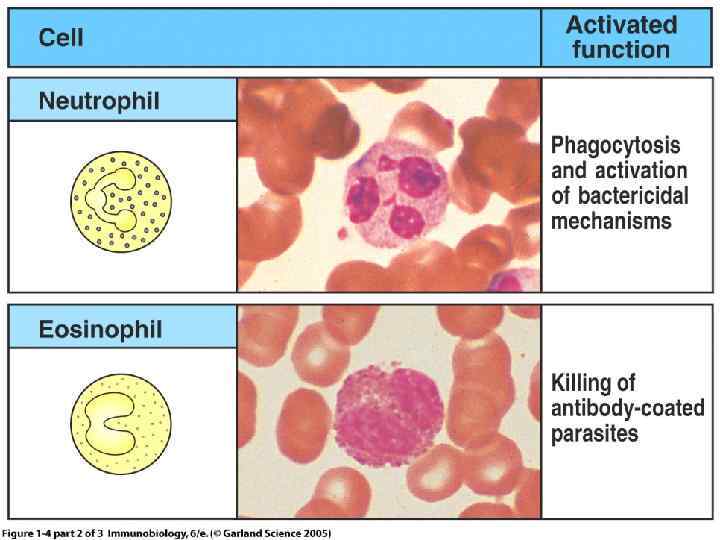
 Нейтрофилы
Нейтрофилы
 Макрофаги
Макрофаги
 Дендритные клетки
Дендритные клетки
 Toll-like-рецепторы – рецепторы тревоги В 1996 году было обнаружено, что мушки дрозофилы обладают белком, который впоследствии получил название Toll, способным включать иммунные механизмы, защищающие мушек от инфекции, в частности, от грибков (Aspergillus fumigatus). В последующем белки с подобной функцией были обнаружены у млекопитающих, в том числе у человека, и они получили название Toll-like рецепторы (TLR). Toll-like рецепторы представляют собой семейство одно спиральных рецепторов, цитоплазматический домен которых имеет высокую гомологию между собой и между рецептором к ИЛ 1. Этот цитоплазматический домен назван TIR и он необходим для сигнальной трансдукции, т. е. для передачи сигнала внутрь клетки. TLR присутствуют прежде всего на клетках врожденного (неспецифического) иммунитета.
Toll-like-рецепторы – рецепторы тревоги В 1996 году было обнаружено, что мушки дрозофилы обладают белком, который впоследствии получил название Toll, способным включать иммунные механизмы, защищающие мушек от инфекции, в частности, от грибков (Aspergillus fumigatus). В последующем белки с подобной функцией были обнаружены у млекопитающих, в том числе у человека, и они получили название Toll-like рецепторы (TLR). Toll-like рецепторы представляют собой семейство одно спиральных рецепторов, цитоплазматический домен которых имеет высокую гомологию между собой и между рецептором к ИЛ 1. Этот цитоплазматический домен назван TIR и он необходим для сигнальной трансдукции, т. е. для передачи сигнала внутрь клетки. TLR присутствуют прежде всего на клетках врожденного (неспецифического) иммунитета.
 Toll-like-рецепторы – рецепторы тревоги (продолжение) TLR ответственны за распознавание огромного количества микробных компонентов, которые экспрессируются инфекционными агентами. Клетки моноцитарно макрофагального ряда распознают эти компоненты, что приводит к включению продукции целого ряда провоспалительных цитокинов и ко стимуляционных молекул. В итоге развивается воспаление как защитная реакция организма со стороны неспецифического иммунитета и делаются первые шаги по развитию специфического (адаптивного) иммунитета.
Toll-like-рецепторы – рецепторы тревоги (продолжение) TLR ответственны за распознавание огромного количества микробных компонентов, которые экспрессируются инфекционными агентами. Клетки моноцитарно макрофагального ряда распознают эти компоненты, что приводит к включению продукции целого ряда провоспалительных цитокинов и ко стимуляционных молекул. В итоге развивается воспаление как защитная реакция организма со стороны неспецифического иммунитета и делаются первые шаги по развитию специфического (адаптивного) иммунитета.
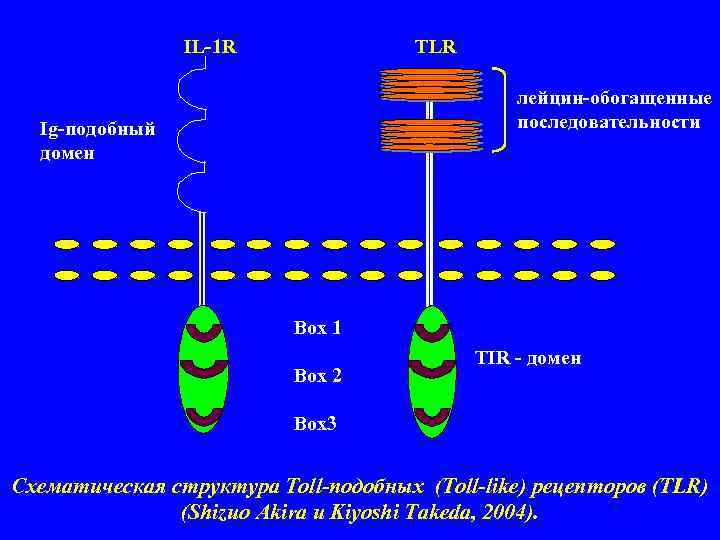 IL-1 R TLR лейцин-обогащенные Ig-подобный последовательности домен Box 1 TIR - домен Box 2 Box 3 Схематическая структура Toll-подобных (Toll-like) рецепторов (TLR) (Shizuo Akira и Kiyoshi Takeda, 2004).
IL-1 R TLR лейцин-обогащенные Ig-подобный последовательности домен Box 1 TIR - домен Box 2 Box 3 Схематическая структура Toll-подобных (Toll-like) рецепторов (TLR) (Shizuo Akira и Kiyoshi Takeda, 2004).
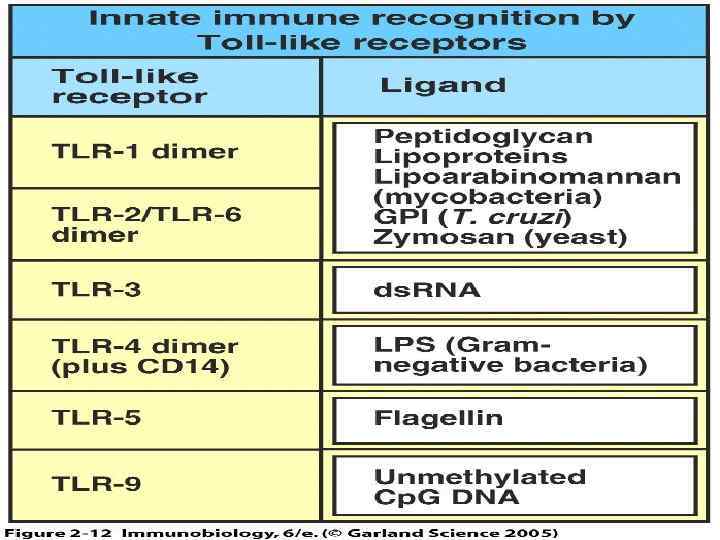
 HSV-½ Peptidoglican Gram- LPS; Lipid. A; Gram+ HSP-60, Hyaluronic Uropatho- Cp. G; ss. RNA Lipopeptide, Lipotei- acid Poly inosine: flagellin cytosine genic choic acid, zymozan, Fibrinogen, Fibro- CMV, HSV nectin ds RNA bacteria TLR 2 TLR 1 TLR 9, TLR 6 TLR 3 TLR-11 TLR 7, TLR 4 TLR 5 My. D 88 MAL TRAM TRIF TIRAP IRAK 4 IRAK IRF 3 TRAF 6 NFk. B STAT 1 Воспаление, индукция костимуляции и адаптивного иммунитета ОНФ , ИЛ-1, ИЛ-6, 8, 12, 18, ИНФ / , SOCS, IP-10, COX 2, NO, CD 80, CD 86, CD 150, CD 83, CD 40
HSV-½ Peptidoglican Gram- LPS; Lipid. A; Gram+ HSP-60, Hyaluronic Uropatho- Cp. G; ss. RNA Lipopeptide, Lipotei- acid Poly inosine: flagellin cytosine genic choic acid, zymozan, Fibrinogen, Fibro- CMV, HSV nectin ds RNA bacteria TLR 2 TLR 1 TLR 9, TLR 6 TLR 3 TLR-11 TLR 7, TLR 4 TLR 5 My. D 88 MAL TRAM TRIF TIRAP IRAK 4 IRAK IRF 3 TRAF 6 NFk. B STAT 1 Воспаление, индукция костимуляции и адаптивного иммунитета ОНФ , ИЛ-1, ИЛ-6, 8, 12, 18, ИНФ / , SOCS, IP-10, COX 2, NO, CD 80, CD 86, CD 150, CD 83, CD 40
 Активация дендритных клеток через Toll-like рецепторы. TLR-3 ds. RNA LPS TLR-4 ДКл NFk. B ИЛ 1; 12; 8; ОНФ R 1 ОНФ каспазы киназы МНС ИНФ, ИНФ Фагоцитоз апоптоз провоспапи- тельные цитокины
Активация дендритных клеток через Toll-like рецепторы. TLR-3 ds. RNA LPS TLR-4 ДКл NFk. B ИЛ 1; 12; 8; ОНФ R 1 ОНФ каспазы киназы МНС ИНФ, ИНФ Фагоцитоз апоптоз провоспапи- тельные цитокины
 Атопия как системное страдание Терминология. Термин «атопия» (от греческого atopia – странность) был впервые использован Coca и Cooke (1923) при описании повышенной способности развивать реакцию ГНТ по отношению к обычным аллергенам. После открытия Ig. E было доказано, что реакция ГНТ реализуется под влиянием связывания Ig. E со специфическим аллергеном. Атопия – это мультифакториальная генетически обусловленная предрасположенность, главным проявлением которой является повышенная продукция общего и специфического Ig. E. Атопические заболевания – заболевания, обусловленные Ig. E опосредованным механизмом развития, реализующимся под воздействием определенных условий окружающей среды (дерматит, ринит, астма, конъюнктивит, крапивница, отек Квинке, анафилаксия).
Атопия как системное страдание Терминология. Термин «атопия» (от греческого atopia – странность) был впервые использован Coca и Cooke (1923) при описании повышенной способности развивать реакцию ГНТ по отношению к обычным аллергенам. После открытия Ig. E было доказано, что реакция ГНТ реализуется под влиянием связывания Ig. E со специфическим аллергеном. Атопия – это мультифакториальная генетически обусловленная предрасположенность, главным проявлением которой является повышенная продукция общего и специфического Ig. E. Атопические заболевания – заболевания, обусловленные Ig. E опосредованным механизмом развития, реализующимся под воздействием определенных условий окружающей среды (дерматит, ринит, астма, конъюнктивит, крапивница, отек Квинке, анафилаксия).
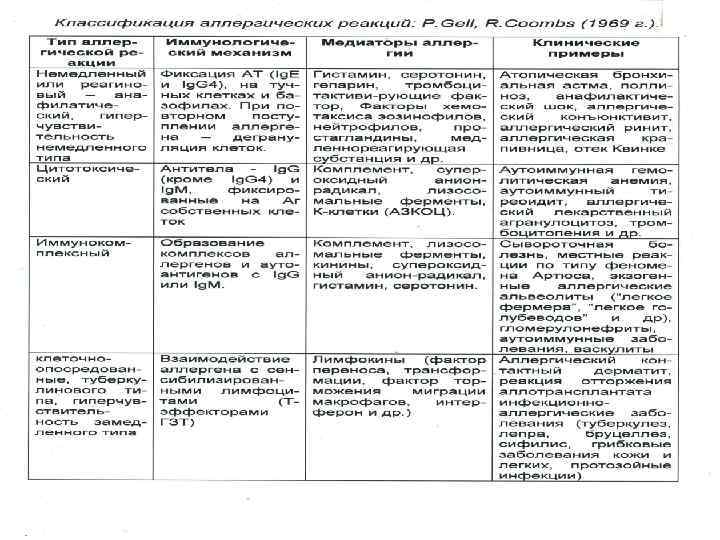
 Атопия как системное страдание Терминология Аллергия – измененная реактивность (К. Пирке). Аллергические заболевания – более широкое понятие, чем атопическая патология, включает не только Ig. E опосредованный механизм, но и другие, как правило, ІІІ или IV типы реакции по классификации Джела и Кумбса (аллергический альвеолит, целиакия, контактный дерматит и др. ).
Атопия как системное страдание Терминология Аллергия – измененная реактивность (К. Пирке). Аллергические заболевания – более широкое понятие, чем атопическая патология, включает не только Ig. E опосредованный механизм, но и другие, как правило, ІІІ или IV типы реакции по классификации Джела и Кумбса (аллергический альвеолит, целиакия, контактный дерматит и др. ).
 Атопия как системное страдание Терминология Существуют противоречия в точном определении понятия «атопический больной» . Доминирующая точка зрения. Все лица, у которых выявляется положительная кожная проба на аллерген, независимо от того, есть ли у них клиническая симптоматика, относятся к атопическим больным. Другая точка зрения. Определение «атопический больной» может быть использовано только тогда, когда есть клинические проявления атопического заболевания. Допускается, что у некоторых из них могут быть отрицательные кожные пробы.
Атопия как системное страдание Терминология Существуют противоречия в точном определении понятия «атопический больной» . Доминирующая точка зрения. Все лица, у которых выявляется положительная кожная проба на аллерген, независимо от того, есть ли у них клиническая симптоматика, относятся к атопическим больным. Другая точка зрения. Определение «атопический больной» может быть использовано только тогда, когда есть клинические проявления атопического заболевания. Допускается, что у некоторых из них могут быть отрицательные кожные пробы.
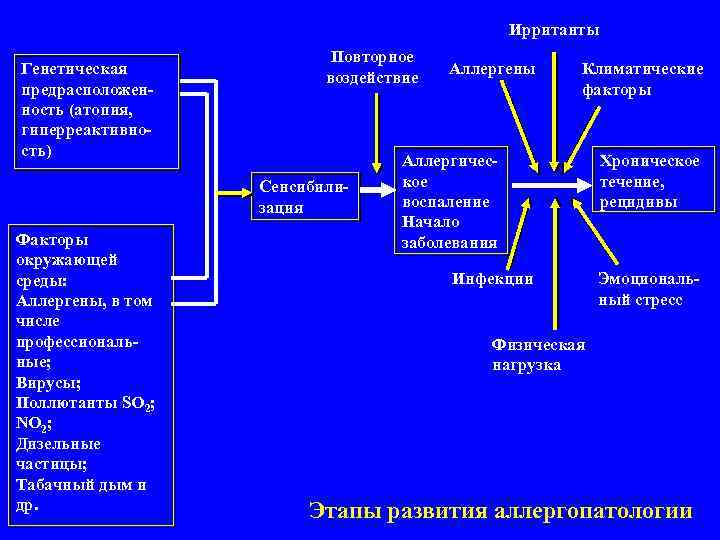 Ирританты Повторное Генетическая воздействие Аллергены Климатические предрасположен- факторы ность (атопия, гиперреактивно- сть) Аллергичес- Хроническое Сенсибили- кое течение, зация воспаление рецидивы Начало Факторы заболевания окружающей среды: Инфекции Эмоциональ- Аллергены, в том ный стресс числе профессиональ- Физическая ные; нагрузка Вирусы; Поллютанты SO 2; NO 2; Дизельные частицы; Табачный дым и др. Этапы развития аллергопатологии
Ирританты Повторное Генетическая воздействие Аллергены Климатические предрасположен- факторы ность (атопия, гиперреактивно- сть) Аллергичес- Хроническое Сенсибили- кое течение, зация воспаление рецидивы Начало Факторы заболевания окружающей среды: Инфекции Эмоциональ- Аллергены, в том ный стресс числе профессиональ- Физическая ные; нагрузка Вирусы; Поллютанты SO 2; NO 2; Дизельные частицы; Табачный дым и др. Этапы развития аллергопатологии
 Атопия как системное страдание Важнейшее условие реализации атопии в атопическое заболевание – окружающая среда и стиль жизни. Симптомы атопических заболеваний, как правило, проявляются в первое десятилетие жизни и это обусловлено особенностями иммунной системы ребенка. Ринит частота Астма Дерматит Пищевая аллергия (Prof. Wahn, German multicenter atopy study). Различные виды атопической патологии стартуют в различном возрасте, поражая различные органы (кожа, нос, глаза, бронхи, ЖКТ). По данным Küster et al (1990) у детей на фоне АД: симптомы ринита выявляются у 36% симптомы астмы выявляются у 28% симптомы ринита и астмы выявляются у 15%
Атопия как системное страдание Важнейшее условие реализации атопии в атопическое заболевание – окружающая среда и стиль жизни. Симптомы атопических заболеваний, как правило, проявляются в первое десятилетие жизни и это обусловлено особенностями иммунной системы ребенка. Ринит частота Астма Дерматит Пищевая аллергия (Prof. Wahn, German multicenter atopy study). Различные виды атопической патологии стартуют в различном возрасте, поражая различные органы (кожа, нос, глаза, бронхи, ЖКТ). По данным Küster et al (1990) у детей на фоне АД: симптомы ринита выявляются у 36% симптомы астмы выявляются у 28% симптомы ринита и астмы выявляются у 15%

 Характерные признаки атопической болезни 1. Генетическая детерминированность. 2. Наличие триггеров (факторы окружающей среды). 3. Ig. E опосредованный механизм развития. 4. Эозинофильно лимфоцитарный тип воспаления. 5. Системность поражения (кожа, слизистые). 6. Возрастная динамика. 7. Атопическое заболевание не может «пройти» или «быть вылеченным» ; можно говорить о ремиссии спонтанной или индуцированной, кратковременной или длительной.
Характерные признаки атопической болезни 1. Генетическая детерминированность. 2. Наличие триггеров (факторы окружающей среды). 3. Ig. E опосредованный механизм развития. 4. Эозинофильно лимфоцитарный тип воспаления. 5. Системность поражения (кожа, слизистые). 6. Возрастная динамика. 7. Атопическое заболевание не может «пройти» или «быть вылеченным» ; можно говорить о ремиссии спонтанной или индуцированной, кратковременной или длительной.


 Атопия как системное страдание Современные принципы предотвращения атопической патологии. U. Wahn (Университет Гумбольта, Германия). 1. Прежде всего пользоваться семейным анамнезом для выявления детей с риском развития атопии. Строго рекомендовать в таких случаях в качестве первичной профилактики: кормление грудью; прикорм не ранее 4 месяца (твердая пища); исключение курения матери и пассивного курения у ребенка. 2. В семьях у детей из групп риска рекомендовать мероприятия по снижению уровня бытовых аллергенов. 3. В качестве вторичной профилактики считать методом выбора максимально полное снижение контакта с бытовыми аллергенами, а также с табачным дымом. 4. При необходимости: ранняя фармакотерапия (антигистамины системные и топические, топические стероиды, кромоны) и/или ранняя иммунотерапия
Атопия как системное страдание Современные принципы предотвращения атопической патологии. U. Wahn (Университет Гумбольта, Германия). 1. Прежде всего пользоваться семейным анамнезом для выявления детей с риском развития атопии. Строго рекомендовать в таких случаях в качестве первичной профилактики: кормление грудью; прикорм не ранее 4 месяца (твердая пища); исключение курения матери и пассивного курения у ребенка. 2. В семьях у детей из групп риска рекомендовать мероприятия по снижению уровня бытовых аллергенов. 3. В качестве вторичной профилактики считать методом выбора максимально полное снижение контакта с бытовыми аллергенами, а также с табачным дымом. 4. При необходимости: ранняя фармакотерапия (антигистамины системные и топические, топические стероиды, кромоны) и/или ранняя иммунотерапия

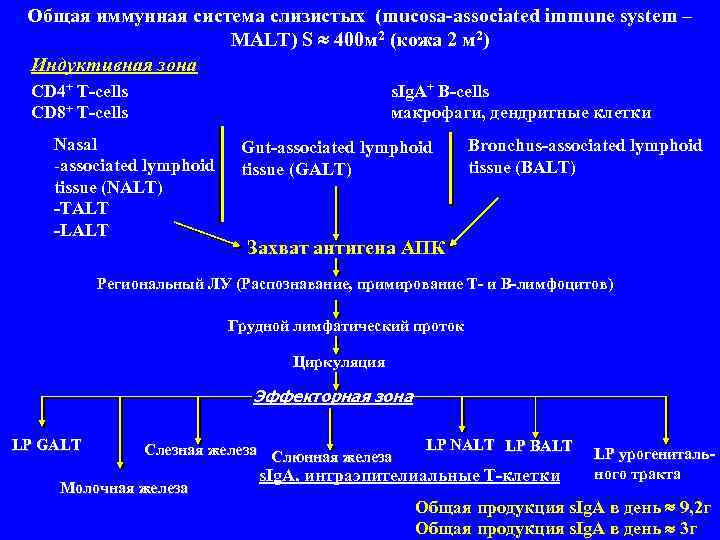 Общая иммунная система слизистых (mucosa-associated immune system – MALT) S 400 м 2 (кожа 2 м 2) Индуктивная зона CD 4+ T-cells s. Ig. A+ B-cells CD 8+ T-cells макрофаги, дендритные клетки Nasal Gut-associated lymphoid Bronchus-associated lymphoid tissue (GALT) tissue (BALT) tissue (NALT) -TALT -LALT Захват антигена АПК Региональный ЛУ (Распознавание, примирование Т- и В-лимфоцитов) Грудной лимфатический проток Циркуляция Эффекторная зона LP GALT Слезная железа Слюнная железа LP NALT LP BALT LP урогениталь- s. Ig. A, интраэпителиальные Т-клетки ного тракта Молочная железа Общая продукция s. Ig. A в день 9, 2 г Общая продукция s. Ig. A в день 3 г
Общая иммунная система слизистых (mucosa-associated immune system – MALT) S 400 м 2 (кожа 2 м 2) Индуктивная зона CD 4+ T-cells s. Ig. A+ B-cells CD 8+ T-cells макрофаги, дендритные клетки Nasal Gut-associated lymphoid Bronchus-associated lymphoid tissue (GALT) tissue (BALT) tissue (NALT) -TALT -LALT Захват антигена АПК Региональный ЛУ (Распознавание, примирование Т- и В-лимфоцитов) Грудной лимфатический проток Циркуляция Эффекторная зона LP GALT Слезная железа Слюнная железа LP NALT LP BALT LP урогениталь- s. Ig. A, интраэпителиальные Т-клетки ного тракта Молочная железа Общая продукция s. Ig. A в день 9, 2 г Общая продукция s. Ig. A в день 3 г
 Функциональные характеристики секреторного Ig. A
Функциональные характеристики секреторного Ig. A
 Основные гипотетические механизмы индукции аутоиммунных заболеваний. 1. Поликлональная активация В или Т лимфоцитов. 2. Усиление экспрессии HLA молекул класса I и II. 3. Митогены и суперантигены. 4. Продукция цитокинов, активирующих иммунную систему. 5. Нарушение количества и функции лимфоцитов (CD 4+CD 25+ Т лф). 6. Активация апоптоза (Fas + Fas. L). 7. Появление модифицированных, скрытых или новых антигенных детерминант. 8. Молекулярная мимикрия.
Основные гипотетические механизмы индукции аутоиммунных заболеваний. 1. Поликлональная активация В или Т лимфоцитов. 2. Усиление экспрессии HLA молекул класса I и II. 3. Митогены и суперантигены. 4. Продукция цитокинов, активирующих иммунную систему. 5. Нарушение количества и функции лимфоцитов (CD 4+CD 25+ Т лф). 6. Активация апоптоза (Fas + Fas. L). 7. Появление модифицированных, скрытых или новых антигенных детерминант. 8. Молекулярная мимикрия.
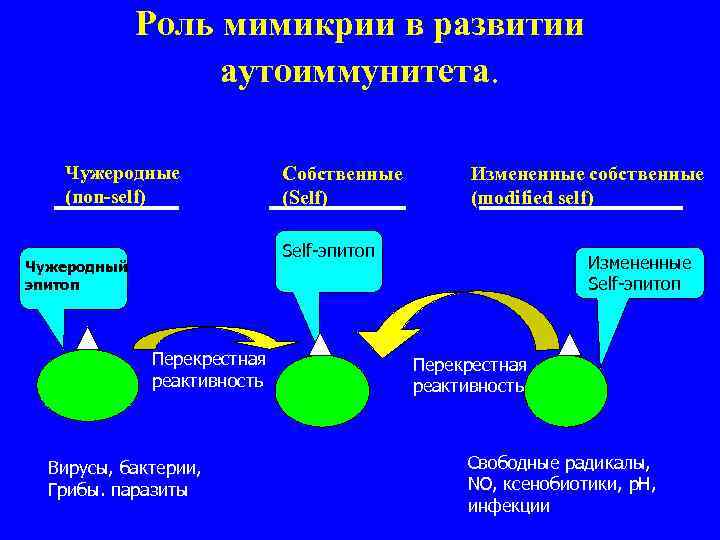 Роль мимикрии в развитии аутоиммунитета. Чужеродные Собственные Измененные собственные (non-self) (Self) (modified self) Self-эпитоп Чужеродный Измененные эпитоп Self-эпитоп Перекрестная реактивность Вирусы, бактерии, Свободные радикалы, Грибы. паразиты NO, ксенобиотики, р. Н, инфекции
Роль мимикрии в развитии аутоиммунитета. Чужеродные Собственные Измененные собственные (non-self) (Self) (modified self) Self-эпитоп Чужеродный Измененные эпитоп Self-эпитоп Перекрестная реактивность Вирусы, бактерии, Свободные радикалы, Грибы. паразиты NO, ксенобиотики, р. Н, инфекции
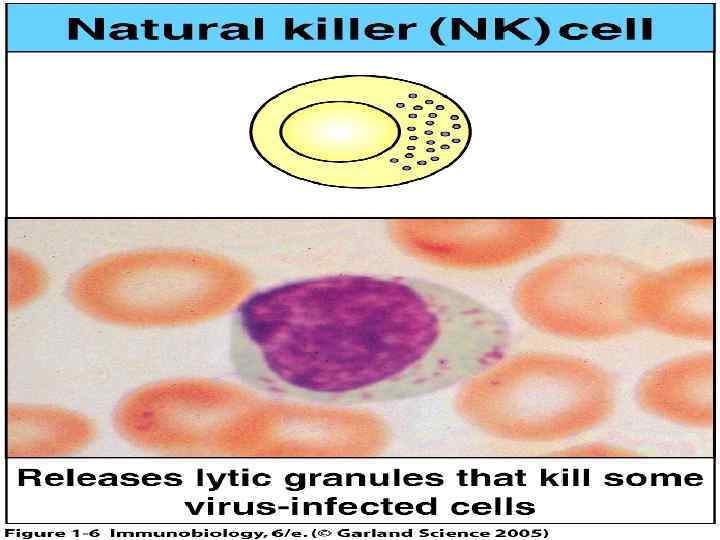
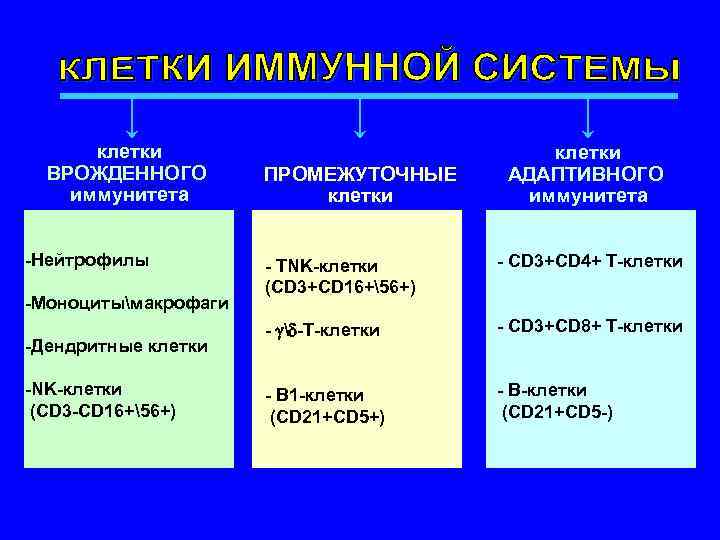 клетки клетки ВРОЖДЕННОГО ПРОМЕЖУТОЧНЫЕ АДАПТИВНОГО иммунитета клетки иммунитета -Нейтрофилы - TNK-клетки - CD 3+CD 4+ Т-клетки (CD 3+CD 16+56+) -Моноцитымакрофаги - -Т-клетки - CD 3+CD 8+ Т-клетки -Дендритные клетки -NK-клетки - В 1 -клетки - В-клетки (CD 3 -CD 16+56+) (CD 21+CD 5 -)
клетки клетки ВРОЖДЕННОГО ПРОМЕЖУТОЧНЫЕ АДАПТИВНОГО иммунитета клетки иммунитета -Нейтрофилы - TNK-клетки - CD 3+CD 4+ Т-клетки (CD 3+CD 16+56+) -Моноцитымакрофаги - -Т-клетки - CD 3+CD 8+ Т-клетки -Дендритные клетки -NK-клетки - В 1 -клетки - В-клетки (CD 3 -CD 16+56+) (CD 21+CD 5 -)
 НОРМАЛЬНЫЕ ХАРАКТЕРИСТИКИ ФАГОЦИТАРНОЙ АКТИВНОСТИ Показатель Ед. изм. Норма Фагоцитарный индекс % 70 -95 нейтрофилов Фагоцитарный индекс % 60 -90 моноцитов Бактерицидность % 23 -35 фагоцитов Спонтанная м. В/мин 10 -30 хемилюминесценция Индуцированная м. В/мин 100 -350 зимозаном хемилюминесценция Индекс стимуляции Усл. ед. 10 -60
НОРМАЛЬНЫЕ ХАРАКТЕРИСТИКИ ФАГОЦИТАРНОЙ АКТИВНОСТИ Показатель Ед. изм. Норма Фагоцитарный индекс % 70 -95 нейтрофилов Фагоцитарный индекс % 60 -90 моноцитов Бактерицидность % 23 -35 фагоцитов Спонтанная м. В/мин 10 -30 хемилюминесценция Индуцированная м. В/мин 100 -350 зимозаном хемилюминесценция Индекс стимуляции Усл. ед. 10 -60
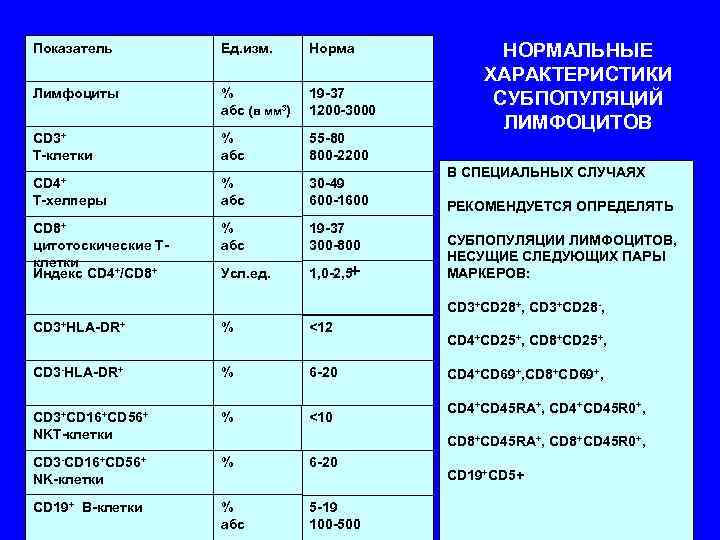 Показатель Ед. изм. Норма НОРМАЛЬНЫЕ ХАРАКТЕРИСТИКИ Лимфоциты % 19 -37 СУБПОПУЛЯЦИЙ абс (в мм 3) 1200 -3000 ЛИМФОЦИТОВ CD 3+ % 55 -80 Т-клетки абс 800 -2200 В СПЕЦИАЛЬНЫХ СЛУЧАЯХ CD 4+ % 30 -49 Т-хелперы абс 600 -1600 РЕКОМЕНДУЕТСЯ ОПРЕДЕЛЯТЬ СD 8+ % 19 -37 цитотоскические Т- абс 300 -800 СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ, клетки НЕСУЩИЕ СЛЕДУЮЩИХ ПАРЫ Индекс CD 4+/CD 8+ Усл. ед. 1, 0 -2, 5+ МАРКЕРОВ: CD 3+CD 28+, CD 3+CD 28 -, СD 3+HLA-DR+ % <12 CD 4+CD 25+, CD 8+CD 25+, СD 3 -HLA-DR+ % 6 -20 CD 4+CD 69+, CD 8+CD 69+, CD 4+CD 45 RA+, CD 4+CD 45 R 0+, СD 3+CD 16+CD 56+ % <10 NKT-клетки CD 8+CD 45 RA+, CD 8+CD 45 R 0+, СD 3 -CD 16+CD 56+ % 6 -20 NK-клетки CD 19+CD 5+ СD 19+ В-клетки % 5 -19 абс 100 -500
Показатель Ед. изм. Норма НОРМАЛЬНЫЕ ХАРАКТЕРИСТИКИ Лимфоциты % 19 -37 СУБПОПУЛЯЦИЙ абс (в мм 3) 1200 -3000 ЛИМФОЦИТОВ CD 3+ % 55 -80 Т-клетки абс 800 -2200 В СПЕЦИАЛЬНЫХ СЛУЧАЯХ CD 4+ % 30 -49 Т-хелперы абс 600 -1600 РЕКОМЕНДУЕТСЯ ОПРЕДЕЛЯТЬ СD 8+ % 19 -37 цитотоскические Т- абс 300 -800 СУБПОПУЛЯЦИИ ЛИМФОЦИТОВ, клетки НЕСУЩИЕ СЛЕДУЮЩИХ ПАРЫ Индекс CD 4+/CD 8+ Усл. ед. 1, 0 -2, 5+ МАРКЕРОВ: CD 3+CD 28+, CD 3+CD 28 -, СD 3+HLA-DR+ % <12 CD 4+CD 25+, CD 8+CD 25+, СD 3 -HLA-DR+ % 6 -20 CD 4+CD 69+, CD 8+CD 69+, CD 4+CD 45 RA+, CD 4+CD 45 R 0+, СD 3+CD 16+CD 56+ % <10 NKT-клетки CD 8+CD 45 RA+, CD 8+CD 45 R 0+, СD 3 -CD 16+CD 56+ % 6 -20 NK-клетки CD 19+CD 5+ СD 19+ В-клетки % 5 -19 абс 100 -500
 ТРАКТОВКА ИЗМЕНЕНИЙ ЧИСЛЕННОСТИ СУБПОПУЛЯЦИЙ ЛИМФОЦИТОВ Повышение/понижение Наиболее вероятная причина – численности клеток в соответствующее по направленности субпопуляциях: изменение: CD 4+CD 45 RA+ и CD 8+CD 45 RA+ содержания IL-7 во вторичных (однонаправленные изменения) лимфоидных органах CD 4+CD 45 RA+ содержания МНС-II+ дендритных клеток во вторичных лимфоидных органах CD 8+CD 45 RA+ экспрессии МНС-I на антигенпрезентирующих клетках CD 8+CD 45 R 0+ и CD 56+ содержания IL-15 во вторичных (однонаправленные изменения) лимфоидных органах CD 19+ содержания BAFF во вторичных лимфоидных органах
ТРАКТОВКА ИЗМЕНЕНИЙ ЧИСЛЕННОСТИ СУБПОПУЛЯЦИЙ ЛИМФОЦИТОВ Повышение/понижение Наиболее вероятная причина – численности клеток в соответствующее по направленности субпопуляциях: изменение: CD 4+CD 45 RA+ и CD 8+CD 45 RA+ содержания IL-7 во вторичных (однонаправленные изменения) лимфоидных органах CD 4+CD 45 RA+ содержания МНС-II+ дендритных клеток во вторичных лимфоидных органах CD 8+CD 45 RA+ экспрессии МНС-I на антигенпрезентирующих клетках CD 8+CD 45 R 0+ и CD 56+ содержания IL-15 во вторичных (однонаправленные изменения) лимфоидных органах CD 19+ содержания BAFF во вторичных лимфоидных органах
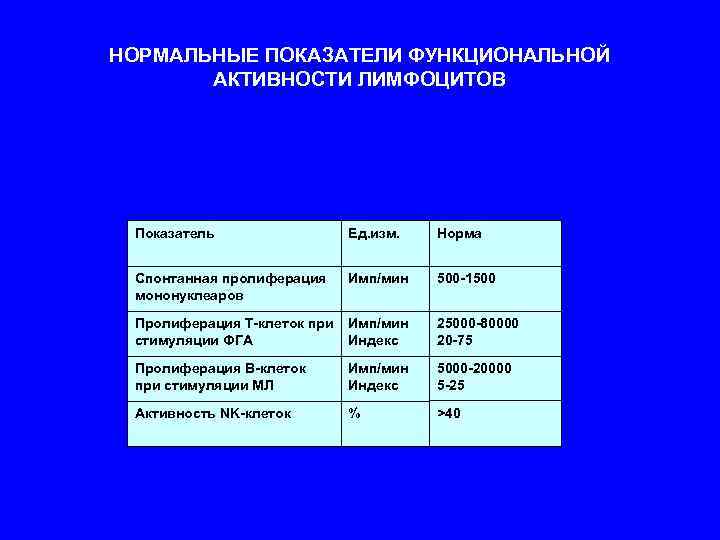 НОРМАЛЬНЫЕ ПОКАЗАТЕЛИ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ Показатель Ед. изм. Норма Спонтанная пролиферация Имп/мин 500 -1500 мононуклеаров Пролиферация Т-клеток при Имп/мин 25000 -80000 стимуляции ФГА Индекс 20 -75 Пролиферация В-клеток Имп/мин 5000 -20000 при стимуляции МЛ Индекс 5 -25 Активность NK-клеток % >40
НОРМАЛЬНЫЕ ПОКАЗАТЕЛИ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ЛИМФОЦИТОВ Показатель Ед. изм. Норма Спонтанная пролиферация Имп/мин 500 -1500 мононуклеаров Пролиферация Т-клеток при Имп/мин 25000 -80000 стимуляции ФГА Индекс 20 -75 Пролиферация В-клеток Имп/мин 5000 -20000 при стимуляции МЛ Индекс 5 -25 Активность NK-клеток % >40
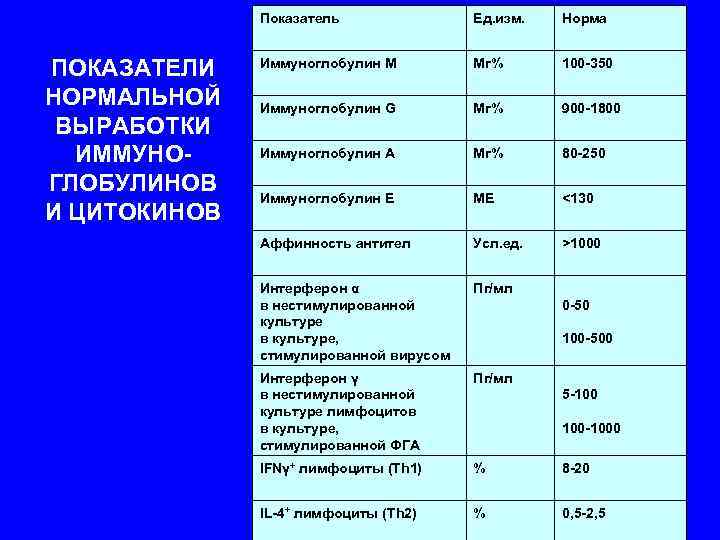 Показатель Ед. изм. Норма ПОКАЗАТЕЛИ Иммуноглобулин М Мг% 100 -350 НОРМАЛЬНОЙ Иммуноглобулин G Мг% 900 -1800 ВЫРАБОТКИ ИММУНО- Иммуноглобулин А Мг% 80 -250 ГЛОБУЛИНОВ Иммуноглобулин Е МЕ <130 И ЦИТОКИНОВ Аффинность антител Усл. ед. >1000 Интерферон α Пг/мл в нестимулированной 0 -50 культуре в культуре, 100 -500 стимулированной вирусом Интерферон γ Пг/мл в нестимулированной 5 -100 культуре лимфоцитов в культуре, 100 -1000 стимулированной ФГА IFNγ+ лимфоциты (Th 1) % 8 -20 IL-4+ лимфоциты (Th 2) % 0, 5 -2, 5
Показатель Ед. изм. Норма ПОКАЗАТЕЛИ Иммуноглобулин М Мг% 100 -350 НОРМАЛЬНОЙ Иммуноглобулин G Мг% 900 -1800 ВЫРАБОТКИ ИММУНО- Иммуноглобулин А Мг% 80 -250 ГЛОБУЛИНОВ Иммуноглобулин Е МЕ <130 И ЦИТОКИНОВ Аффинность антител Усл. ед. >1000 Интерферон α Пг/мл в нестимулированной 0 -50 культуре в культуре, 100 -500 стимулированной вирусом Интерферон γ Пг/мл в нестимулированной 5 -100 культуре лимфоцитов в культуре, 100 -1000 стимулированной ФГА IFNγ+ лимфоциты (Th 1) % 8 -20 IL-4+ лимфоциты (Th 2) % 0, 5 -2, 5
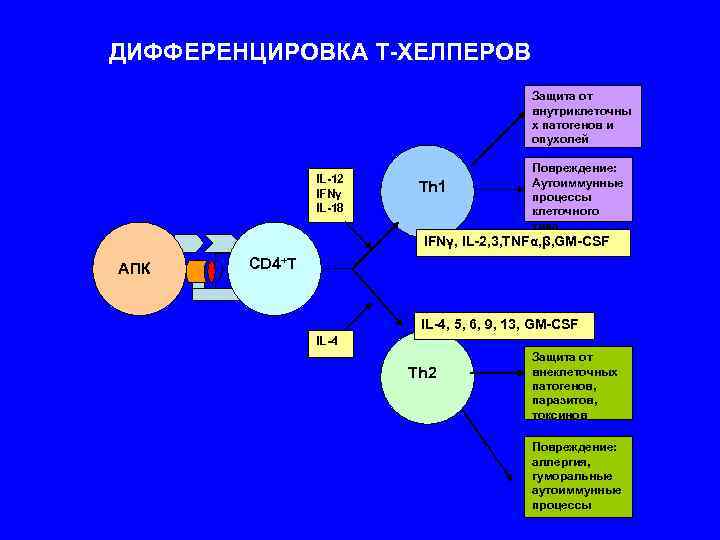 ДИФФЕРЕНЦИРОВКА Т-ХЕЛПЕРОВ Защита от внутриклеточны х патогенов и опухолей Повреждение: IL-12 Аутоиммунные IFNγ Th 1 процессы IL-18 клеточного типа IFNγ, IL-2, 3, TNFα, β, GM-CSF AПК CD 4+T IL-4, 5, 6, 9, 13, GM-CSF IL-4 Защита от Th 2 внеклеточных патогенов, паразитов, токсинов Повреждение: аллергия, гуморальные аутоиммунные процессы
ДИФФЕРЕНЦИРОВКА Т-ХЕЛПЕРОВ Защита от внутриклеточны х патогенов и опухолей Повреждение: IL-12 Аутоиммунные IFNγ Th 1 процессы IL-18 клеточного типа IFNγ, IL-2, 3, TNFα, β, GM-CSF AПК CD 4+T IL-4, 5, 6, 9, 13, GM-CSF IL-4 Защита от Th 2 внеклеточных патогенов, паразитов, токсинов Повреждение: аллергия, гуморальные аутоиммунные процессы
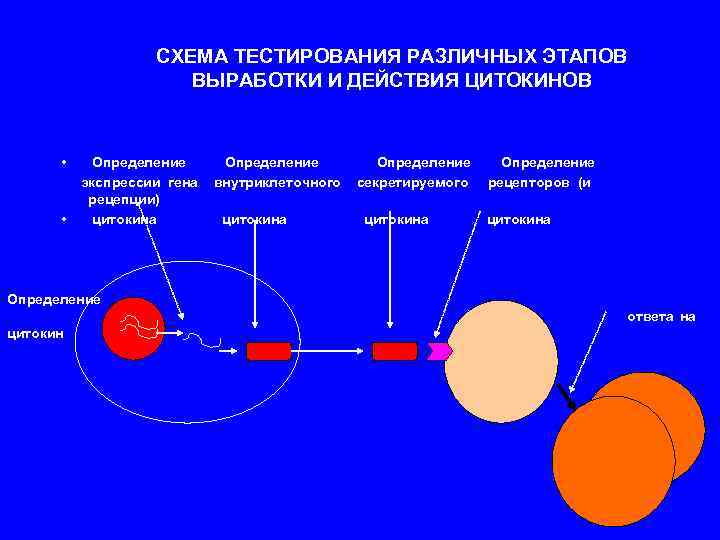 СХЕМА ТЕСТИРОВАНИЯ РАЗЛИЧНЫХ ЭТАПОВ ВЫРАБОТКИ И ДЕЙСТВИЯ ЦИТОКИНОВ • Определение экспрессии гена внутриклеточного секретируемого рецепторов (и рецепции) • цитокина цитокина Определение ответа на цитокин
СХЕМА ТЕСТИРОВАНИЯ РАЗЛИЧНЫХ ЭТАПОВ ВЫРАБОТКИ И ДЕЙСТВИЯ ЦИТОКИНОВ • Определение экспрессии гена внутриклеточного секретируемого рецепторов (и рецепции) • цитокина цитокина Определение ответа на цитокин
 План стандартного иммуно- лабораторного обследования СD 3; СD 4; СD 8 СD 19; СD 22
План стандартного иммуно- лабораторного обследования СD 3; СD 4; СD 8 СD 19; СD 22
 План стандартного иммуно- лабораторного обследования
План стандартного иммуно- лабораторного обследования
 План углублённого иммуно- лабораторного обследования , (ИЛ 1, ИЛ 6) 7. Продукцию регуляторных цитокинов (ИЛ 10, TGFβ). 8. Оценка интерферонового статуса.
План углублённого иммуно- лабораторного обследования , (ИЛ 1, ИЛ 6) 7. Продукцию регуляторных цитокинов (ИЛ 10, TGFβ). 8. Оценка интерферонового статуса.
 Задачи иммунолабораторного обследования
Задачи иммунолабораторного обследования

 Рекомендации по интерпретации иммунограм.
Рекомендации по интерпретации иммунограм.
 Рекомендации по интерпретации иммунограм.
Рекомендации по интерпретации иммунограм.
 Признаки, предполагающие наличие иммунодефицита.
Признаки, предполагающие наличие иммунодефицита.
 Признаки, предполагающие наличие иммунодефицита.
Признаки, предполагающие наличие иммунодефицита.
 10 клинических признаков нарушения функции иммунной системы Национальный институт здоровья, США 1. Более 8 случаев инфекционной патологии в текущем году. 2. Более двух рецидивов синусита в текущем году. 3. Более двух месяцев лечения антибиотиками с незначительным эффектом. 4. Более двух пневмоний в текущем году. 5. Отставание ребенка в весе, росте и умственном развитии. 6. Рецидивирующие глубокие абсцессы кожи или внутренних органов.
10 клинических признаков нарушения функции иммунной системы Национальный институт здоровья, США 1. Более 8 случаев инфекционной патологии в текущем году. 2. Более двух рецидивов синусита в текущем году. 3. Более двух месяцев лечения антибиотиками с незначительным эффектом. 4. Более двух пневмоний в текущем году. 5. Отставание ребенка в весе, росте и умственном развитии. 6. Рецидивирующие глубокие абсцессы кожи или внутренних органов.
 10 клинических признаков нарушения функции иммунной системы Национальный институт здоровья, США 7. Персистирующий афтозный стоматит или поражение кожи. 8. Необходимость в/в введения антибиотиков для эрадикации инфекционного агента. 9. Два и более эпизодов таких инфекционных заболеваний, как менингит, остеомиелит, целлюлит или сепсис. 10. Наличие в семье больных с первичными иммунодефицитами. Если у пациента обнаруживаются два и более из указанных выше симптомов, диагноз первичного (вторичного) иммунодефицита вероятен.
10 клинических признаков нарушения функции иммунной системы Национальный институт здоровья, США 7. Персистирующий афтозный стоматит или поражение кожи. 8. Необходимость в/в введения антибиотиков для эрадикации инфекционного агента. 9. Два и более эпизодов таких инфекционных заболеваний, как менингит, остеомиелит, целлюлит или сепсис. 10. Наличие в семье больных с первичными иммунодефицитами. Если у пациента обнаруживаются два и более из указанных выше симптомов, диагноз первичного (вторичного) иммунодефицита вероятен.
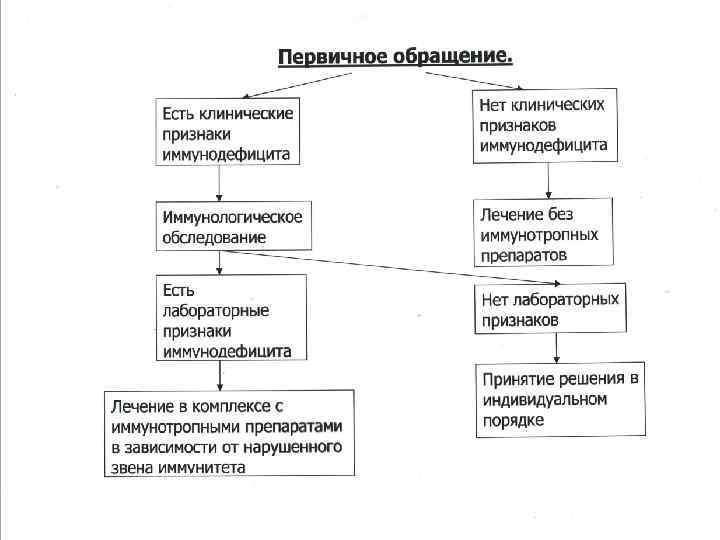
 Определение понятия вторичного иммунодефицита.
Определение понятия вторичного иммунодефицита.
 Особенности вторичного иммунодефицита.
Особенности вторичного иммунодефицита.

 Классификация иммунотропных препаратов. 1. Продукты физиологического (биологического) происхождения: тактивин, тимостимулин, тималин, тимувокал, тимомодулин, тимактид, тимоптин, вилозен, миелопид, спленин, лейкинферон, вм и вв иммуноглобулины, алкимер, полибиолин, КИП. 2. Продукты микробного происхождения: 2. 1. Живые бактерии – БЦЖ. 2. 2. Экстракты – биостим, пицибанил. 2. 3. Лизаты – бронхомунал, дирибиотин, риновак, респивакс, уростим, уроваксом, имудон, IRS 19, паспат, солкотриховак. 2. 4. Липополисахариды – пирогенал, продигиозан. 2. 5. Дрожжевые полисахариды – зимозан, нуклеинат натрия. 2. 6. Грибковые полисахариды – крестин, бестатин, лентинан, глюкан. 2. 7. Рибосомы+протеогликаны – рибомунил. 2. 8. Пробиотики – бластен, биоспорин, линекс.
Классификация иммунотропных препаратов. 1. Продукты физиологического (биологического) происхождения: тактивин, тимостимулин, тималин, тимувокал, тимомодулин, тимактид, тимоптин, вилозен, миелопид, спленин, лейкинферон, вм и вв иммуноглобулины, алкимер, полибиолин, КИП. 2. Продукты микробного происхождения: 2. 1. Живые бактерии – БЦЖ. 2. 2. Экстракты – биостим, пицибанил. 2. 3. Лизаты – бронхомунал, дирибиотин, риновак, респивакс, уростим, уроваксом, имудон, IRS 19, паспат, солкотриховак. 2. 4. Липополисахариды – пирогенал, продигиозан. 2. 5. Дрожжевые полисахариды – зимозан, нуклеинат натрия. 2. 6. Грибковые полисахариды – крестин, бестатин, лентинан, глюкан. 2. 7. Рибосомы+протеогликаны – рибомунил. 2. 8. Пробиотики – бластен, биоспорин, линекс.
 Классификация иммунотропных препаратов (продолжение). 3. Синтетические и рекомбинантные препараты: тимоген, ликопид, диуцифон, левамизол (декарис), кемантан, диуцирон, дитиокарбсимутиол, нейтростим, леакадин, полиоксидоний, гропринозин, неовир, циклоферон, кополимер1 (копаксон), изопринозин, имунофан, лаферон, реаферон, роферон. А, интрон А, имукин, лейкомакс, граноцит, пролейкин, глутоксим, реальдирон ( 2 b), ребиф ( 1 а), пегинтрон ( 2 b), ронколейкин, беталейкин (ИЛ 1 ). 4. Витамины и витаминные препараты; антиоксиданты; Zn. 5. Растительные препараты: иммунофлам, манакс, иммунал, цефарантин.
Классификация иммунотропных препаратов (продолжение). 3. Синтетические и рекомбинантные препараты: тимоген, ликопид, диуцифон, левамизол (декарис), кемантан, диуцирон, дитиокарбсимутиол, нейтростим, леакадин, полиоксидоний, гропринозин, неовир, циклоферон, кополимер1 (копаксон), изопринозин, имунофан, лаферон, реаферон, роферон. А, интрон А, имукин, лейкомакс, граноцит, пролейкин, глутоксим, реальдирон ( 2 b), ребиф ( 1 а), пегинтрон ( 2 b), ронколейкин, беталейкин (ИЛ 1 ). 4. Витамины и витаминные препараты; антиоксиданты; Zn. 5. Растительные препараты: иммунофлам, манакс, иммунал, цефарантин.
 Классификация иммунотропных препаратов (продолжение). 6. Энтеросорбенты: белосорб, энсорал, микотон, силлард, антрален. 7. Иммуносупрессоры: глюкокортикоиды, азатиоприн (имуран), сандиммун, програф, селсепт, рапамицин (сиролимус), мизорибин, бреквинар, деоксиспергуалин, лефлюномид (арава), тимоглобин, лимфоглобин, ОКТЗ, тимоглобулин, FTJ 720. 8. Комплексные ферментные препараты: вобензим, флогензим, вобемугос. 9. Антигистаминные препараты: телфаст, эриус. 10. Препараты на основе моноклональных антител: даклизумаб (анти СД 25), базиликсимаб (симулект – анти СД 25), инфликсимаб (ремикейд – анти ОНФ), этанерцепт (растворимый рецептор к ОНФ), ритуксимаб – анти СД 20 (В клеточная лимфома).
Классификация иммунотропных препаратов (продолжение). 6. Энтеросорбенты: белосорб, энсорал, микотон, силлард, антрален. 7. Иммуносупрессоры: глюкокортикоиды, азатиоприн (имуран), сандиммун, програф, селсепт, рапамицин (сиролимус), мизорибин, бреквинар, деоксиспергуалин, лефлюномид (арава), тимоглобин, лимфоглобин, ОКТЗ, тимоглобулин, FTJ 720. 8. Комплексные ферментные препараты: вобензим, флогензим, вобемугос. 9. Антигистаминные препараты: телфаст, эриус. 10. Препараты на основе моноклональных антител: даклизумаб (анти СД 25), базиликсимаб (симулект – анти СД 25), инфликсимаб (ремикейд – анти ОНФ), этанерцепт (растворимый рецептор к ОНФ), ритуксимаб – анти СД 20 (В клеточная лимфома).
 Принципы и национальные особенности клинического применения иммуномодуляторов. Онкологические заболевания: профилактика рецидивов заболевания и стимуляция лейкопоэза (США, Япония и др. ). ХНЗЛ (Европа). Вторичные иммунодефициты: комплексное лечение хронических инфекционно-воспалительных процессов (Украина, Россия). Иммунореабилитация (страны СНГ).
Принципы и национальные особенности клинического применения иммуномодуляторов. Онкологические заболевания: профилактика рецидивов заболевания и стимуляция лейкопоэза (США, Япония и др. ). ХНЗЛ (Европа). Вторичные иммунодефициты: комплексное лечение хронических инфекционно-воспалительных процессов (Украина, Россия). Иммунореабилитация (страны СНГ).
 Принцип «двойного удара» в комплексной терапии хронических инфекционных процессов активаторами фагоцитарного звена иммунитета и антимикробными препаратами. 1. Иммуномодуляторы целесообразно назначать одновременно с антимикробными препаратами: антибиотиками, противогрибковыми или противовирусными средствами. 2. Иммуномодуляторы повышают функциональную активность фагоцитов, усиливая поглощение и киллинг ими внеклеточных бактерий. 3. Активация под влиянием фагоцитарных цитокинов (ИЛ 1, ИЛ 6, ФНО, ИНФ) Т лимфоцитов и NK клеток, усиливает разрушение ими клеток, инфицированных внутриклеточными возбудителями. 4. Антимикробные препараты, убивая или подавляя функциональную активность возбудителя, делают их более чувствительными к действию защитных сил организма: фагоцитов, NK клеток, Т лимфоцитов.
Принцип «двойного удара» в комплексной терапии хронических инфекционных процессов активаторами фагоцитарного звена иммунитета и антимикробными препаратами. 1. Иммуномодуляторы целесообразно назначать одновременно с антимикробными препаратами: антибиотиками, противогрибковыми или противовирусными средствами. 2. Иммуномодуляторы повышают функциональную активность фагоцитов, усиливая поглощение и киллинг ими внеклеточных бактерий. 3. Активация под влиянием фагоцитарных цитокинов (ИЛ 1, ИЛ 6, ФНО, ИНФ) Т лимфоцитов и NK клеток, усиливает разрушение ими клеток, инфицированных внутриклеточными возбудителями. 4. Антимикробные препараты, убивая или подавляя функциональную активность возбудителя, делают их более чувствительными к действию защитных сил организма: фагоцитов, NK клеток, Т лимфоцитов.
 НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (собственный опыт и литературные данные) 1. Обязательно следует предварительно оценивать характер иммунных нарушений и степени их выраженности. 2. Необходимо учитывать, на какую популяцию клеток воздействует данный препарат, степень и селективность его воздействия, его направленность (активация, супрессия, модуляция). 3. Для достижения максимального эффекта от назначенного препарата необходимо определить оптимальную дозу, частоту приема, пути введения в организм, время начала лечения в зависимости от стадии болезни. 4. При оценке иммунограммы и выборе препарата следует принимать во внимание возраст больного, пол, биоритмы, нейроэндокринные факторы, генетический фон и др. 5. Как правило иммунотропные препараты не применяются само стоятельно, а дополняют традиционную терапию. При этом важно учитывать эффект традиционных лекарственных средств на иммунную систему.
НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (собственный опыт и литературные данные) 1. Обязательно следует предварительно оценивать характер иммунных нарушений и степени их выраженности. 2. Необходимо учитывать, на какую популяцию клеток воздействует данный препарат, степень и селективность его воздействия, его направленность (активация, супрессия, модуляция). 3. Для достижения максимального эффекта от назначенного препарата необходимо определить оптимальную дозу, частоту приема, пути введения в организм, время начала лечения в зависимости от стадии болезни. 4. При оценке иммунограммы и выборе препарата следует принимать во внимание возраст больного, пол, биоритмы, нейроэндокринные факторы, генетический фон и др. 5. Как правило иммунотропные препараты не применяются само стоятельно, а дополняют традиционную терапию. При этом важно учитывать эффект традиционных лекарственных средств на иммунную систему.
 НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 6. Считают, что иммунотропные препараты стимулирующего действия, как правило, не влияют на неизмененные иммунологические показатели. 7. Профильность действия иммунотропных препаратов сохраняется при различных заболеваниях, но только при наличии однотип ных иммунных расстройств. 8. Необходимо учитывать побочные эффекты иммунотропных препаратов (например, развитие агранулоцитоза применении декариса; развитие состояния, подобного синдрому хронической усталости, при длительном лечении большими дозами интерферонов). 9. Возможно одновременное использование нескольких препаратов, воздействующих на разные звенья иммунной системы. 10. Необходимо одновременно с иммунотропными назначать и препараты, содержащие витамины и микроэлементы, антиоксиданты.
НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 6. Считают, что иммунотропные препараты стимулирующего действия, как правило, не влияют на неизмененные иммунологические показатели. 7. Профильность действия иммунотропных препаратов сохраняется при различных заболеваниях, но только при наличии однотип ных иммунных расстройств. 8. Необходимо учитывать побочные эффекты иммунотропных препаратов (например, развитие агранулоцитоза применении декариса; развитие состояния, подобного синдрому хронической усталости, при длительном лечении большими дозами интерферонов). 9. Возможно одновременное использование нескольких препаратов, воздействующих на разные звенья иммунной системы. 10. Необходимо одновременно с иммунотропными назначать и препараты, содержащие витамины и микроэлементы, антиоксиданты.
 НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 11. Важным, если не обязательным, дополнением иммунотропной терапии является снижение степени эндогенной интоксикации с помощью сорбционной терапии. 12. Важным является этапный контроль иммунограммы; анализ иммунограммы в динамике более информативен как в диагностическом, так и в прогностическом отношении, чем однократно полученная иммунограмма. 13. Полноценную информацию можно получить, проводя анализ иммунограммы в комплексе с оценкой клинической картины у данного пациента. 14. Комплексный анализ иммунограмм более информативен, чем оценка каждого показателя в отдельности; 15. Реальную информацию в иммунограмме несут только устойчивые выраженные сдвиги показателей. 16. В подавляющем большинстве случаев анализ только одной иммунограммы дает возможность сделать лишь ориентировочные, а не безусловные выводы диагностического и прогностического характера.
НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 11. Важным, если не обязательным, дополнением иммунотропной терапии является снижение степени эндогенной интоксикации с помощью сорбционной терапии. 12. Важным является этапный контроль иммунограммы; анализ иммунограммы в динамике более информативен как в диагностическом, так и в прогностическом отношении, чем однократно полученная иммунограмма. 13. Полноценную информацию можно получить, проводя анализ иммунограммы в комплексе с оценкой клинической картины у данного пациента. 14. Комплексный анализ иммунограмм более информативен, чем оценка каждого показателя в отдельности; 15. Реальную информацию в иммунограмме несут только устойчивые выраженные сдвиги показателей. 16. В подавляющем большинстве случаев анализ только одной иммунограммы дает возможность сделать лишь ориентировочные, а не безусловные выводы диагностического и прогностического характера.
 НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 17. В заключении, составляемом на основании клинической картины и анализа иммунограммы, ведущим должен быть клинический диагноз. 18. Отсутствие сдвигов иммунограммы при наличии клинической картины воспалительного процесса должно трактоваться как атипичная реакция иммунной системы и является отягощающим признаком течения процесса. 19. Оценка иммунного статуса – не единственный, но один из важнейших этапов выявления болезней, в основе которых лежат нарушения в иммунной системе человека. 20. При невозможности провести иммунологическое обследование, соответствующие иммунотропные препараты в виде исключения могут быть назначены на основании клинических признаков, свидетельствующих о наличии того или иного дефекта в "работе" иммунной системы. 21. При явно выраженных клинических признаках болезни, но без наличия указаний на нарушение иммунной системы в анамнезе и отсутствии лабораторных признаков иммунодефицита рекомендуется динамический мониторинг.
НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 17. В заключении, составляемом на основании клинической картины и анализа иммунограммы, ведущим должен быть клинический диагноз. 18. Отсутствие сдвигов иммунограммы при наличии клинической картины воспалительного процесса должно трактоваться как атипичная реакция иммунной системы и является отягощающим признаком течения процесса. 19. Оценка иммунного статуса – не единственный, но один из важнейших этапов выявления болезней, в основе которых лежат нарушения в иммунной системе человека. 20. При невозможности провести иммунологическое обследование, соответствующие иммунотропные препараты в виде исключения могут быть назначены на основании клинических признаков, свидетельствующих о наличии того или иного дефекта в "работе" иммунной системы. 21. При явно выраженных клинических признаках болезни, но без наличия указаний на нарушение иммунной системы в анамнезе и отсутствии лабораторных признаков иммунодефицита рекомендуется динамический мониторинг.
 НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 22. При явно выраженных клинических и лабораторных признаках нарушения функции иммунной системы назначение иммунотропных препаратов обязательно; 23. Применение иммунотропных препаратов без оценки иммунного статуса возможно: - при ожидании эпидемии какого-либо инфекционного заболевания (например, гриппа); - перед проведением хирургического вмешательства у пожилых лиц; - у больных СПИДом и ВИЧ-инфицированных; - у тяжелых онкологических больных.
НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 22. При явно выраженных клинических и лабораторных признаках нарушения функции иммунной системы назначение иммунотропных препаратов обязательно; 23. Применение иммунотропных препаратов без оценки иммунного статуса возможно: - при ожидании эпидемии какого-либо инфекционного заболевания (например, гриппа); - перед проведением хирургического вмешательства у пожилых лиц; - у больных СПИДом и ВИЧ-инфицированных; - у тяжелых онкологических больных.
 НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 24. Следует помнить, что выраженный клинический эффект от применения иммуностимулирующих препаратов может быть получен в тех случаях, когда клинико иммунологическое состояние больных наиболее тяжелое. 25. С целью проведения иммунореабилитационных мероприятий, уменьшения числа рецидивов и хронизации заболеваний, перед вы пиской из клиники больному необходимо провести иммунологическое обследование. В случае выявления значительных отклонений от установленных норм, а также с учетом анамнеза, такому больному необходимо назначить иммунотропное лечение с повторным обследованием и консультацией у клинического иммунолога через 3 и 6 месяцев.
НЕКОТОРЫЕ РЕКОМЕНДАЦИИ ПО ПРИНЦИПАМ ПРИМЕНЕНИЯ ИММУНОТРОПНЫХ ПРЕПАРАТОВ (продолжение) 24. Следует помнить, что выраженный клинический эффект от применения иммуностимулирующих препаратов может быть получен в тех случаях, когда клинико иммунологическое состояние больных наиболее тяжелое. 25. С целью проведения иммунореабилитационных мероприятий, уменьшения числа рецидивов и хронизации заболеваний, перед вы пиской из клиники больному необходимо провести иммунологическое обследование. В случае выявления значительных отклонений от установленных норм, а также с учетом анамнеза, такому больному необходимо назначить иммунотропное лечение с повторным обследованием и консультацией у клинического иммунолога через 3 и 6 месяцев.
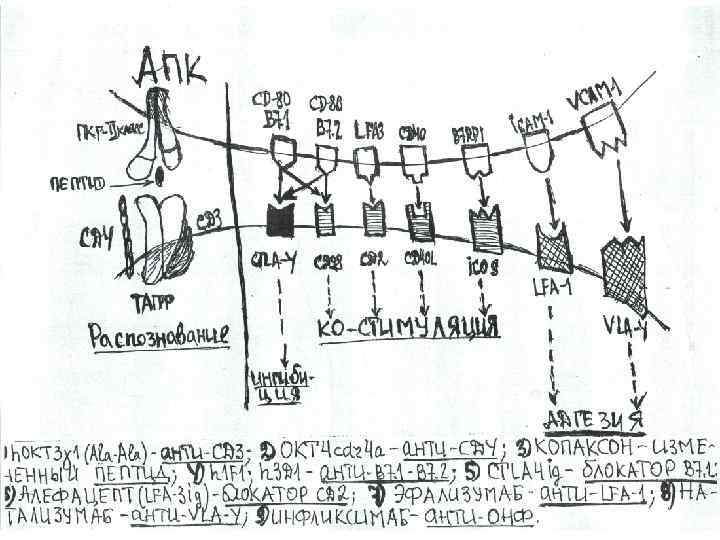
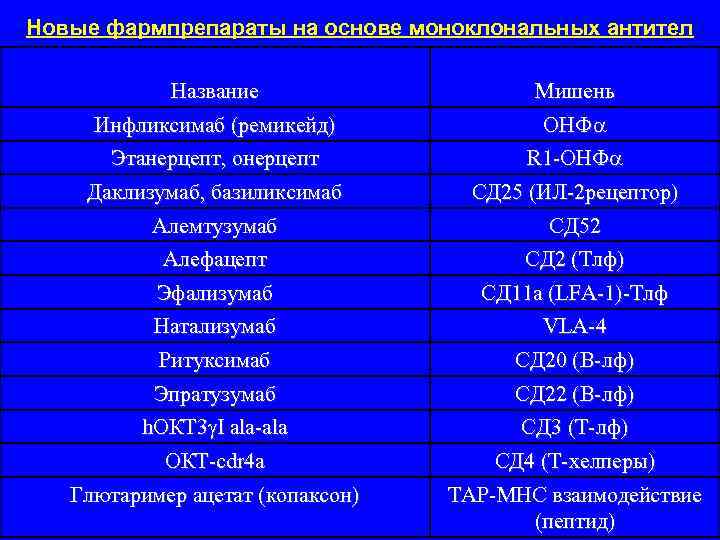 Новые фармпрепараты на основе моноклональных антител Название Мишень Инфликсимаб (ремикейд) ОНФ Этанерцепт, онерцепт R 1 ОНФ Даклизумаб, базиликсимаб СД 25 (ИЛ 2 рецептор) Алемтузумаб СД 52 Алефацепт СД 2 (Тлф) Эфализумаб СД 11 а (LFA 1) Тлф Натализумаб VLA 4 Ритуксимаб СД 20 (В лф) Эпратузумаб СД 22 (В лф) h. ОКТ 3 I ala СД 3 (Т лф) ОКТ cdr 4 a СД 4 (Т хелперы) Глютаример ацетат (копаксон) ТАР МНС взаимодействие (пептид)
Новые фармпрепараты на основе моноклональных антител Название Мишень Инфликсимаб (ремикейд) ОНФ Этанерцепт, онерцепт R 1 ОНФ Даклизумаб, базиликсимаб СД 25 (ИЛ 2 рецептор) Алемтузумаб СД 52 Алефацепт СД 2 (Тлф) Эфализумаб СД 11 а (LFA 1) Тлф Натализумаб VLA 4 Ритуксимаб СД 20 (В лф) Эпратузумаб СД 22 (В лф) h. ОКТ 3 I ala СД 3 (Т лф) ОКТ cdr 4 a СД 4 (Т хелперы) Глютаример ацетат (копаксон) ТАР МНС взаимодействие (пептид)





 (Н) (N)
(Н) (N)


 Интерфероны человека ИФН-α ИФН-β ИФН-γ Т-лимфоциты Клетки-продуценты Лейкоциты Фибробласты NK Макрофаги Вирусы, природные и и синтетические нуклеиновые Митогены, Индукторы ИФН нуклеиновые специфические кислоты, низкомолекулярные антигены, соединения микроорганизмы (полифенолы и др. ) Локализация генов 9 -я хромосома 12 -я хромосома Число кодирующих 14 -20 1 генов Мол. масса 17 -20 к. Д 40 -50 к. Д (димер) Гликозилирование Нет Есть Стабильность в Да Нет кислой среде (р. Н 2, 0)
Интерфероны человека ИФН-α ИФН-β ИФН-γ Т-лимфоциты Клетки-продуценты Лейкоциты Фибробласты NK Макрофаги Вирусы, природные и и синтетические нуклеиновые Митогены, Индукторы ИФН нуклеиновые специфические кислоты, низкомолекулярные антигены, соединения микроорганизмы (полифенолы и др. ) Локализация генов 9 -я хромосома 12 -я хромосома Число кодирующих 14 -20 1 генов Мол. масса 17 -20 к. Д 40 -50 к. Д (димер) Гликозилирование Нет Есть Стабильность в Да Нет кислой среде (р. Н 2, 0)
 Физиологические функции интерферона (ИФН) • Противовирусные • Антимикробные • Антипролиферативные • Иммуномодулирующие • Радиопротективные • Система ИФН играет контрольно-регуляторную роль в сохранении гомеостаза. • Система ИФН сравнима с системой иммунитета. • Универсальность системы ИФН делает ее важнейшим фактором неспецифической резистентности.
Физиологические функции интерферона (ИФН) • Противовирусные • Антимикробные • Антипролиферативные • Иммуномодулирующие • Радиопротективные • Система ИФН играет контрольно-регуляторную роль в сохранении гомеостаза. • Система ИФН сравнима с системой иммунитета. • Универсальность системы ИФН делает ее важнейшим фактором неспецифической резистентности.
 Механизм действия интерферона (ИФН) Универсальность системы ИФН заключается в том, что основные механизмы противовирусного действия ИФН осуществляются путем влияния на регуляцию синтеза чужеродных нуклеиновых кислот, при этом происходит: • Активация ферментов и ингибиторов, блокирующих трансляцию вирусных нуклеиновых кислот, то есть блокирование синтеза вирусспецифических белков и репликации вирусов • Активация нуклеаз, разрушающих свободные (вирусные) нуклеиновые кислоты • Предотвращение инфицирования вирусами здоровых клеток
Механизм действия интерферона (ИФН) Универсальность системы ИФН заключается в том, что основные механизмы противовирусного действия ИФН осуществляются путем влияния на регуляцию синтеза чужеродных нуклеиновых кислот, при этом происходит: • Активация ферментов и ингибиторов, блокирующих трансляцию вирусных нуклеиновых кислот, то есть блокирование синтеза вирусспецифических белков и репликации вирусов • Активация нуклеаз, разрушающих свободные (вирусные) нуклеиновые кислоты • Предотвращение инфицирования вирусами здоровых клеток
 Связь системы интерферона и иммунной системы ИФН обычно относят к цитокинам (действует через рецепторы клеточной мембраны) § ИНФ стимулируют фагоцитоз § ИФН стимулируют активность естественных киллеров (NK) § ИФН стимулируют экспрессию антигенов главного комплекса гистосовместимости § ИФН угнетают образование антител § ИФН угнетают пролиферацию лимфоцитов § ИФН подавляют развитие анафилактического шока § ИФН угнетают реакции гиперчувствительности замедленного типа § ИФН подавляют реакции на чужеродный трансплантант и реакции связывания комплемента
Связь системы интерферона и иммунной системы ИФН обычно относят к цитокинам (действует через рецепторы клеточной мембраны) § ИНФ стимулируют фагоцитоз § ИФН стимулируют активность естественных киллеров (NK) § ИФН стимулируют экспрессию антигенов главного комплекса гистосовместимости § ИФН угнетают образование антител § ИФН угнетают пролиферацию лимфоцитов § ИФН подавляют развитие анафилактического шока § ИФН угнетают реакции гиперчувствительности замедленного типа § ИФН подавляют реакции на чужеродный трансплантант и реакции связывания комплемента
 Препараты интерферона, применяемые в клинической практике • Природные интерфероны (ИФН) ИФН α – человеческий лейкоцитарный ИФН β – человеческий фибробластный ИФН ИФН γ – человеческий иммунный ИФН § Рекомбинантные интерфероны (ИФН) α 2 а – реаферон, α 2 в – интрон, α 2 с – берофор β – бета ферон γ – гамма ферон Основные проблемы – 1) выраженные побочные эффекты высокодозированных препаратов ИФН; 2) сенсибилизация пациентов при многократном применении прерывистыми курсами; 3) высокая стоимость препаратов ИФН.
Препараты интерферона, применяемые в клинической практике • Природные интерфероны (ИФН) ИФН α – человеческий лейкоцитарный ИФН β – человеческий фибробластный ИФН ИФН γ – человеческий иммунный ИФН § Рекомбинантные интерфероны (ИФН) α 2 а – реаферон, α 2 в – интрон, α 2 с – берофор β – бета ферон γ – гамма ферон Основные проблемы – 1) выраженные побочные эффекты высокодозированных препаратов ИФН; 2) сенсибилизация пациентов при многократном применении прерывистыми курсами; 3) высокая стоимость препаратов ИФН.
 Концепция применения препаратов интерферона в клинической практике § Препараты ИФН рассматриваются прежде всего как иммуномодуляторы, влияющие на процесс дифференцировки, рекрутирования, а также на функциональную активность клеток иммунной системы и прежде всего Т-лимфоцитов, моноцитов и макрофагов. В результате действия ИФН повышается эффективность иммунного распознавания антигенов и усиливается фагоцитарная и цитолитическая функция, направленные на элиминацию возбудителя или антигенно- измененных клеток. § При инфекционных заболеваниях, особенно вирусной природы, клиническое применение препаратов ИФН определяется спецификой патологического процесса и должно быть достаточным для проявления иммуностимулирующего и коррегирующего ИФН.
Концепция применения препаратов интерферона в клинической практике § Препараты ИФН рассматриваются прежде всего как иммуномодуляторы, влияющие на процесс дифференцировки, рекрутирования, а также на функциональную активность клеток иммунной системы и прежде всего Т-лимфоцитов, моноцитов и макрофагов. В результате действия ИФН повышается эффективность иммунного распознавания антигенов и усиливается фагоцитарная и цитолитическая функция, направленные на элиминацию возбудителя или антигенно- измененных клеток. § При инфекционных заболеваниях, особенно вирусной природы, клиническое применение препаратов ИФН определяется спецификой патологического процесса и должно быть достаточным для проявления иммуностимулирующего и коррегирующего ИФН.
 Индукторы интерферона • Образование эндогенного ИФН является более физиологичным процессом, чем постоянное введение больших доз ИФН, которые к тому же быстро выводятся из организма. • Индукторы ИФН, в отличие от экзогенных препаратов рекомбинантных ИНФ не приводят к образованию в организме пациента антител к ИФН, сами большей частью низко аллергенны. • Индукторы ИФН вызывают пролонгированную продукцию эндогенного ИФН в физиологических дозах, достаточных для достижения терапевтических и профилактических эффектов. • Индукторы ИФН обладают не только антивирусным, но и иммунокоррегирующим эффектом, что позволяет отнести их к новому поколению препаратов универсально широкого спектра действия.
Индукторы интерферона • Образование эндогенного ИФН является более физиологичным процессом, чем постоянное введение больших доз ИФН, которые к тому же быстро выводятся из организма. • Индукторы ИФН, в отличие от экзогенных препаратов рекомбинантных ИНФ не приводят к образованию в организме пациента антител к ИФН, сами большей частью низко аллергенны. • Индукторы ИФН вызывают пролонгированную продукцию эндогенного ИФН в физиологических дозах, достаточных для достижения терапевтических и профилактических эффектов. • Индукторы ИФН обладают не только антивирусным, но и иммунокоррегирующим эффектом, что позволяет отнести их к новому поколению препаратов универсально широкого спектра действия.
 Индукторы интерферона вызывают синтез в организме смеси ИФН-α и ИФН-β • Синтетические соединения - Низкомолекулярные ароматические углеводороды – Амиксин, Неовир, Циклоферон - Полимеры (двуспиральная РНК) – Полудан • Природные соединения - Низкомолекулярные (полифенолы) – Госсипол (Мегасин, Саврац, Рогасин) - Высокомолекулярные производные полифенолов – Каг. Оцел - Полимеры – сшитые двуспиральные РНК – Ридостин (Ларифан) • Иммуномодулирующие и иммуностимулирующие противовирусные средства со слабо выраженной интерферониндуцирующей активностью Синтетические соединения 1. Низкомолекулярные: - ароматические углеводороды – Арбидол, Дибазол, Цитовир-3 - полусинтетические гликопротеиды – Ликопид Природные соединения 2. Высокомолекулярные - производные нуклеиновых кислот – Нуклеинат натрия, Деринат
Индукторы интерферона вызывают синтез в организме смеси ИФН-α и ИФН-β • Синтетические соединения - Низкомолекулярные ароматические углеводороды – Амиксин, Неовир, Циклоферон - Полимеры (двуспиральная РНК) – Полудан • Природные соединения - Низкомолекулярные (полифенолы) – Госсипол (Мегасин, Саврац, Рогасин) - Высокомолекулярные производные полифенолов – Каг. Оцел - Полимеры – сшитые двуспиральные РНК – Ридостин (Ларифан) • Иммуномодулирующие и иммуностимулирующие противовирусные средства со слабо выраженной интерферониндуцирующей активностью Синтетические соединения 1. Низкомолекулярные: - ароматические углеводороды – Арбидол, Дибазол, Цитовир-3 - полусинтетические гликопротеиды – Ликопид Природные соединения 2. Высокомолекулярные - производные нуклеиновых кислот – Нуклеинат натрия, Деринат
 Индукторы интерферона в зависимости от динамики синтеза ИФН относят к «ранним» и «поздним» • «Ранние» индукторы вызывают синтез высоких пиков эндогенных ИФН через 4 -18 часов, снижающихся к 24 -48 часам (Циклоферон, Арбидол) • «Поздние» индукторы вызывают синтез эндогенных ИФН с пиком активности через 18 - 24 ч. , постепенно снижающейся к 120 часам. (Каг. Оцел, Амиксин- ч/з 72 часа)
Индукторы интерферона в зависимости от динамики синтеза ИФН относят к «ранним» и «поздним» • «Ранние» индукторы вызывают синтез высоких пиков эндогенных ИФН через 4 -18 часов, снижающихся к 24 -48 часам (Циклоферон, Арбидол) • «Поздние» индукторы вызывают синтез эндогенных ИФН с пиком активности через 18 - 24 ч. , постепенно снижающейся к 120 часам. (Каг. Оцел, Амиксин- ч/з 72 часа)
 Каг. Оцел –новый индуктор интерферона • Каг. Оцел - гетероцепный полимер на основе целлюлозы, получаемый из растительного сырья (хлопчатник) путем химического синтеза. • Каг. Оцел - пероральный индуктор интерферона, вызывает синтез эндогенных ИНФ-α и ИФН-β с пиком активности через 18 -24 часа с последующей циркуляцией до 4 -5 дней. • Каг. Оцел регулирует выработку иммунокомпетентными клетками других цитокинов, принимающих участие в противовирусной защите • Каг. Оцел – нерастворимый препарат, действующий на уровне тонкого кишечника, безопасен, нетоксичен, без побочных эффектов
Каг. Оцел –новый индуктор интерферона • Каг. Оцел - гетероцепный полимер на основе целлюлозы, получаемый из растительного сырья (хлопчатник) путем химического синтеза. • Каг. Оцел - пероральный индуктор интерферона, вызывает синтез эндогенных ИНФ-α и ИФН-β с пиком активности через 18 -24 часа с последующей циркуляцией до 4 -5 дней. • Каг. Оцел регулирует выработку иммунокомпетентными клетками других цитокинов, принимающих участие в противовирусной защите • Каг. Оцел – нерастворимый препарат, действующий на уровне тонкого кишечника, безопасен, нетоксичен, без побочных эффектов
 Геном – совокупность генов конкретного организма. Протеом – совокупность протеинов, экспрессированных (продуцированных) в реальном времени и реальной структуре (клетка, ткань, организм). Протеомика – это область исследований, изучающая протеины, как продукты соответствующих генов, их взаимодействие и функцию.
Геном – совокупность генов конкретного организма. Протеом – совокупность протеинов, экспрессированных (продуцированных) в реальном времени и реальной структуре (клетка, ткань, организм). Протеомика – это область исследований, изучающая протеины, как продукты соответствующих генов, их взаимодействие и функцию.
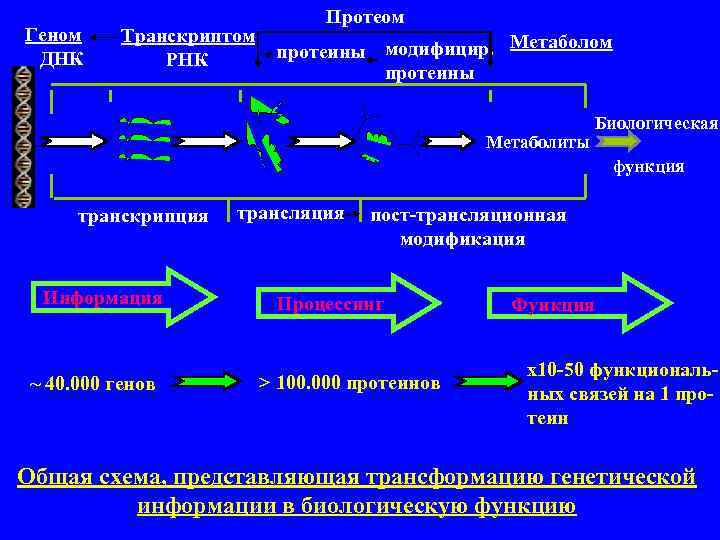 Протеом Геном Транскриптом ДНК РНК протеины модифицир. Метаболом протеины Биологическая Метаболиты функция транскрипция трансляция пост-трансляционная модификация Информация Процессинг Функция х10 -50 функциональ- ~ 40. 000 генов > 100. 000 протеинов ных связей на 1 про- теин Общая схема, представляющая трансформацию генетической информации в биологическую функцию
Протеом Геном Транскриптом ДНК РНК протеины модифицир. Метаболом протеины Биологическая Метаболиты функция транскрипция трансляция пост-трансляционная модификация Информация Процессинг Функция х10 -50 функциональ- ~ 40. 000 генов > 100. 000 протеинов ных связей на 1 про- теин Общая схема, представляющая трансформацию генетической информации в биологическую функцию
 Возможности протеомики в клинических исследованиях: идентификация протеинов (или протеина), принимающих участие в развитии заболевания; - идентификация модифицированных протеинов, являющихся причиной осложнений, например, неэнзиматическое гликозилирование протеинов при диабете и стурктурные модификации (изменение укладки);
Возможности протеомики в клинических исследованиях: идентификация протеинов (или протеина), принимающих участие в развитии заболевания; - идентификация модифицированных протеинов, являющихся причиной осложнений, например, неэнзиматическое гликозилирование протеинов при диабете и стурктурные модификации (изменение укладки);
 Возможности протеомики в клинических исследованиях (продолжение): идентификация молекулярных патологических путей, приводящих к функциональным изменениям, например, при трансдукции сигнала; идентификация препаратов, специфически действующих на определенные мишени протеины или патогенетические звенья заболевания.
Возможности протеомики в клинических исследованиях (продолжение): идентификация молекулярных патологических путей, приводящих к функциональным изменениям, например, при трансдукции сигнала; идентификация препаратов, специфически действующих на определенные мишени протеины или патогенетические звенья заболевания.
