Презентация solids































































- Размер: 2.2 Mегабайта
- Количество слайдов: 73
Описание презентации Презентация solids по слайдам
 Московская государственная академия тонкой химической технологии им. М. В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О. В. Утверждено библиотечным Советом МИТХТ им. М. В. Ломоносова Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2006 г. ХИМИЯ РАСТВОРОВ
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова ВСПОМОГАТЕЛЬНЫЕ СХЕМЫ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ Сорокина О. В. Утверждено библиотечным Советом МИТХТ им. М. В. Ломоносова Московская Государственная академия тонкой химической технологии им. М. В. Ломоносова (МИТХТ), 2006 г. ХИМИЯ РАСТВОРОВ
 Растворы – однородные системы переменного состава. Дисперсные системы Взвеси r >100 нм Коллоидные растворы 1< r <100 нм Истинные Растворы < 1 нм (10 -9 м) В зависимости от размера частиц различают: ΔH m =ΔH разрушен. хим. связи +ΔН гидр. (сольватации) Образования новых связейΔG m =ΔH m -TΔS m. Энтальпия растворения
Растворы – однородные системы переменного состава. Дисперсные системы Взвеси r >100 нм Коллоидные растворы 1< r <100 нм Истинные Растворы < 1 нм (10 -9 м) В зависимости от размера частиц различают: ΔH m =ΔH разрушен. хим. связи +ΔН гидр. (сольватации) Образования новых связейΔG m =ΔH m -TΔS m. Энтальпия растворения
 Растворы в результате: ΔН разр. св. < ΔH гидрат. ; ΔH m Δ H гидрат. ΔH m > 0; э ндо : наиболее частый случай
Растворы в результате: ΔН разр. св. < ΔH гидрат. ; ΔH m Δ H гидрат. ΔH m > 0; э ндо : наиболее частый случай
 Растворитель. Растворенное вещество)(p B в V n С моль/л (М) )(p eq. B вeq V n С моль/л ( N ) )(рителярs B вm m n С моль / кг )(P B в m m ( б. р. , %) ; i B в n n X sвinnn. Состав растворов
Растворитель. Растворенное вещество)(p B в V n С моль/л (М) )(p eq. B вeq V n С моль/л ( N ) )(рителярs B вm m n С моль / кг )(P B в m m ( б. р. , %) ; i B в n n X sвinnn. Состав растворов
 Состав растворов)(P B в m m ( б. р. , %) )( )( P P Р V m (г/л; г/мл) )(p B в V n С (моль/л); Молярность р-ра (М) В РВ в М С )( (ρ (Р) в г/л) k s t = m B , растворяющаяся в 100 г Н 2 О С образованием насыщенного раствора при t 0 C 100 s s в k k )( )( рителярs B Bm m n C моляльность )(p eq. B eq V n С (моль/л) , нормальность(н. , N ) ; i B В n n Х мольная доля для газов совпад. с объемной долей
Состав растворов)(P B в m m ( б. р. , %) )( )( P P Р V m (г/л; г/мл) )(p B в V n С (моль/л); Молярность р-ра (М) В РВ в М С )( (ρ (Р) в г/л) k s t = m B , растворяющаяся в 100 г Н 2 О С образованием насыщенного раствора при t 0 C 100 s s в k k )( )( рителярs B Bm m n C моляльность )(p eq. B eq V n С (моль/л) , нормальность(н. , N ) ; i B В n n Х мольная доля для газов совпад. с объемной долей
 Растворимость Ca. SO 4 H 2 O T = const Ca. SO 4(P) Ca. SO 4(T) [Ca 2+ (P) +SO 4 2 — (P) ]
Растворимость Ca. SO 4 H 2 O T = const Ca. SO 4(P) Ca. SO 4(T) [Ca 2+ (P) +SO 4 2 — (P) ]
 Растворимость Насыщенным назыв. раствор, находящийся в подвижном гетерогенном равновесии с растворяемым веществом. B (T) B (р) ; B (г) В (р) Растворимость – это концентрация вещества в его насыщенном растворе (С внасыщ )=[B])( ][ p насыщ. B V n B при данной температуре. Растворы: разбавленные Св ≤ 0, 1 моль/л концентрированные Св > 0, 1 моль/л ненасыщенные С B [B] гомогенные
Растворимость Насыщенным назыв. раствор, находящийся в подвижном гетерогенном равновесии с растворяемым веществом. B (T) B (р) ; B (г) В (р) Растворимость – это концентрация вещества в его насыщенном растворе (С внасыщ )=[B])( ][ p насыщ. B V n B при данной температуре. Растворы: разбавленные Св ≤ 0, 1 моль/л концентрированные Св > 0, 1 моль/л ненасыщенные С B [B] гомогенные
 Кривая растворимости (политерма)
Кривая растворимости (политерма)
 I. Из ненасыщенного р-ра → в пересыщен. р-р 1) Т↓ (а → f) 2) испарение растворителя (а → К) II. Из ненасыщенного → в насыщенный 1)Т↓ (а → d) 2) добавление растворенного вещества (а → В) 3) или испарение растворителя III. Из пересыщенного → в насыщенный 1) добавл. р-ренного вещества 2) Различные механические воздействия с → с/ f → f/ IV. Из насыщенного→ в н е на сыщенный 1) удалить кристаллы р-ренного вещества 2 ) затем добавить растворител ь
I. Из ненасыщенного р-ра → в пересыщен. р-р 1) Т↓ (а → f) 2) испарение растворителя (а → К) II. Из ненасыщенного → в насыщенный 1)Т↓ (а → d) 2) добавление растворенного вещества (а → В) 3) или испарение растворителя III. Из пересыщенного → в насыщенный 1) добавл. р-ренного вещества 2) Различные механические воздействия с → с/ f → f/ IV. Из насыщенного→ в н е на сыщенный 1) удалить кристаллы р-ренного вещества 2 ) затем добавить растворител ь
 0° 10° 20° 30° 40 º 50° 700 80° 90° 100 С
0° 10° 20° 30° 40 º 50° 700 80° 90° 100 С
 Кривая растворимости (политерма) ∆ H 0 см. = ∆H 0 разр. крист. реш. + ∆H 0 гидр. ионов ∆ H 0 разр. < ∆ H 0 гидр. ∆ H 0 см. < 0 (экзотерм. ) [ B ] ∆ H 0 см. < 0 ( экзо ) газы, Na. OH, Li 2 CO 3 T I. Из ненасыщенного р-ра → в пересыщен. р-р — повышать Т II. Из ненасыщенного → в насыщенный — повышать Т
Кривая растворимости (политерма) ∆ H 0 см. = ∆H 0 разр. крист. реш. + ∆H 0 гидр. ионов ∆ H 0 разр. < ∆ H 0 гидр. ∆ H 0 см. < 0 (экзотерм. ) [ B ] ∆ H 0 см. < 0 ( экзо ) газы, Na. OH, Li 2 CO 3 T I. Из ненасыщенного р-ра → в пересыщен. р-р — повышать Т II. Из ненасыщенного → в насыщенный — повышать Т
 Кривая растворимости (политерма) ∆ H 0 см. = ∆H 0 разр. крист. реш. + ∆H 0 гидр. ионов ∆ H 0 разр. > ∆ H 0 гидр. ∆ H 0 см. > 0 (эндотерм. ) [ B ] ∆ H 0 см. > 0 KNO 3 эндо T
Кривая растворимости (политерма) ∆ H 0 см. = ∆H 0 разр. крист. реш. + ∆H 0 гидр. ионов ∆ H 0 разр. > ∆ H 0 гидр. ∆ H 0 см. > 0 (эндотерм. ) [ B ] ∆ H 0 см. > 0 KNO 3 эндо T
 ∆ H 0 разр. ~ ∆ H 0 гидр. ∆ H 0 см. ~ 0 Кривая растворимости (политерма) ∆ H 0 см. = ∆H 0 разр. крист. реш. + ∆H 0 гидр. ионов [ B ] KCl Na. Cl T
∆ H 0 разр. ~ ∆ H 0 гидр. ∆ H 0 см. ~ 0 Кривая растворимости (политерма) ∆ H 0 см. = ∆H 0 разр. крист. реш. + ∆H 0 гидр. ионов [ B ] KCl Na. Cl T
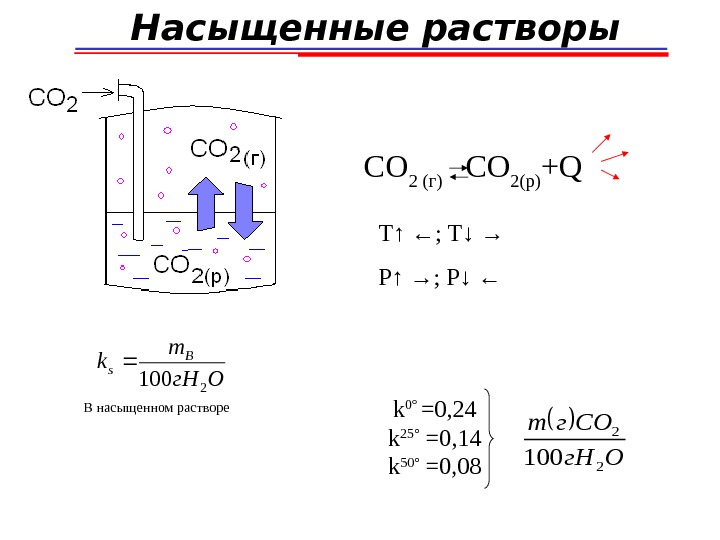
 Насыщенные растворы СO 2 (г) CO 2(р) +Q Т ↑ ←; T↓ → P ↑ → ; P↓ ← Ог. Нm k. B s 2 100 В насыщенном растворе k 0° =0 , 24 k 25° =0 , 14 k 50° =0 , 08 Ог. Н СОгm
Насыщенные растворы СO 2 (г) CO 2(р) +Q Т ↑ ←; T↓ → P ↑ → ; P↓ ← Ог. Нm k. B s 2 100 В насыщенном растворе k 0° =0 , 24 k 25° =0 , 14 k 50° =0 , 08 Ог. Н СОгm
 Насыщенные растворы сахар (т) сахар (р) -Q эндо ∆ H m > 0 T ↑ →; T↓ ← P ↑ или P↓ ≠ k 0° = 0 , 24 k 25° = 0 , 4 1 k 50° = 0 , 8 3 K 100 = 4 , 87 Ог. Н сахарагm
Насыщенные растворы сахар (т) сахар (р) -Q эндо ∆ H m > 0 T ↑ →; T↓ ← P ↑ или P↓ ≠ k 0° = 0 , 24 k 25° = 0 , 4 1 k 50° = 0 , 8 3 K 100 = 4 , 87 Ог. Н сахарагm
 Электролитическая диссоциация Сванте Август Аррениус (1859 -1927)Шведский физико — химик, член Королевской шведской Академии Наук (с 1901). Родился в имении Вейк (близ Упсалы). Окончил Упсальский университет (1878). В 1881– 1883 совершенствовал образование в Физическом институте Королевской шведской Академии Наук в Стокгольме. Основные работы посвящены учению о растворах и кинетике химических реакций. На основании своих исследований высказал идею об электролитической диссоциации. Впервые объяснил сущность температурной зависимости скорости реакций. Ввел понятие энергии активации ΔE и вывел уравнение зависимости скорости реакции от фактора частоты столкновения молекул A, температуры и ΔE, ставшее одним из основных в химической кинетике ( уравнение Аррениуса ). Нобелевская премия (1903).
Электролитическая диссоциация Сванте Август Аррениус (1859 -1927)Шведский физико — химик, член Королевской шведской Академии Наук (с 1901). Родился в имении Вейк (близ Упсалы). Окончил Упсальский университет (1878). В 1881– 1883 совершенствовал образование в Физическом институте Королевской шведской Академии Наук в Стокгольме. Основные работы посвящены учению о растворах и кинетике химических реакций. На основании своих исследований высказал идею об электролитической диссоциации. Впервые объяснил сущность температурной зависимости скорости реакций. Ввел понятие энергии активации ΔE и вывел уравнение зависимости скорости реакции от фактора частоты столкновения молекул A, температуры и ΔE, ставшее одним из основных в химической кинетике ( уравнение Аррениуса ). Нобелевская премия (1903).
 1. По отношению к электрическому току вещества бывают : проводящие электрический ток (электролиты) не проводящие электрический ток (неэлектролиты) • Основные положения учения Арениуса: 2. По степени электролитической диссоциации электролиты: д ≈ 1 – сильные 0 < α д 10 -1 -сильный электролит остальные – слабые. Электролитическая диссоциация
1. По отношению к электрическому току вещества бывают : проводящие электрический ток (электролиты) не проводящие электрический ток (неэлектролиты) • Основные положения учения Арениуса: 2. По степени электролитической диссоциации электролиты: д ≈ 1 – сильные 0 < α д 10 -1 -сильный электролит остальные – слабые. Электролитическая диссоциация
 Электролитическая диссоциация Степень диссоциации – отношение числа диссоциированных молекул к общему числу растворенных молекул. ). (. . исхобщ дис С С n n N N = f(T, C); K дис = f(T) AB (p) A + (p) + B — (p) исх. С 0 0 0 дисс. αС 0 [ ] (C 0 — αС 0 ) αС 0 C 0 (1 — α) ][ ]][[ AB BA Kд
Электролитическая диссоциация Степень диссоциации – отношение числа диссоциированных молекул к общему числу растворенных молекул. ). (. . исхобщ дис С С n n N N = f(T, C); K дис = f(T) AB (p) A + (p) + B — (p) исх. С 0 0 0 дисс. αС 0 [ ] (C 0 — αС 0 ) αС 0 C 0 (1 — α) ][ ]][[ AB BA Kд
 0 2 0 00 )1()1( C C CC Kдис Электролитическая диссоциация закон разбавления Оствальда если α<<1, (1 — α)~1 тогда К дисс. ~ α 2 С 0 ; 0. С Кдисс ( K дисс ≤ 10 -3 ) 1. T ↑ →; д ↑ T↓ ← ; д ↓ 2. Р≠ С АВ ↑→; α д ↓ С АВ ↓←; α д ↑ С А + , С В — ↑← ; α д ↓ С А + , С В — ↓ → ; α д ↑AB (p) A + (p) + B — (p)
0 2 0 00 )1()1( C C CC Kдис Электролитическая диссоциация закон разбавления Оствальда если α<<1, (1 — α)~1 тогда К дисс. ~ α 2 С 0 ; 0. С Кдисс ( K дисс ≤ 10 -3 ) 1. T ↑ →; д ↑ T↓ ← ; д ↓ 2. Р≠ С АВ ↑→; α д ↓ С АВ ↓←; α д ↑ С А + , С В — ↑← ; α д ↓ С А + , С В — ↓ → ; α д ↑AB (p) A + (p) + B — (p)
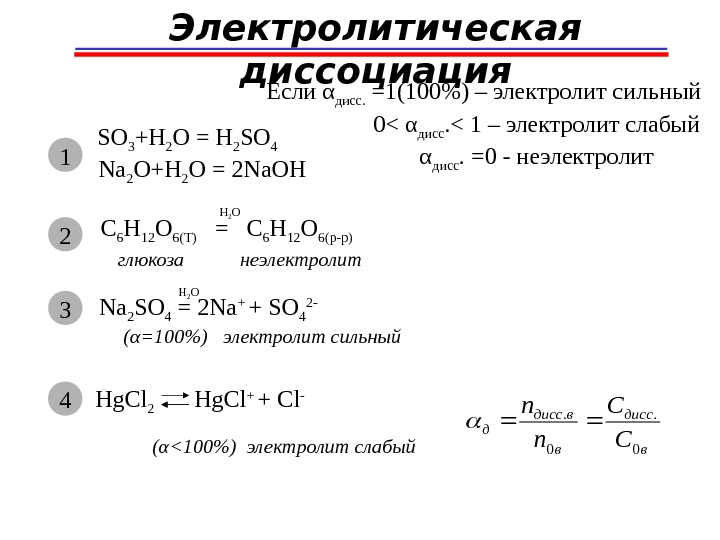
 SO 3 +H 2 O = H 2 SO 4 Na 2 O+H 2 O = 2 Na. OHЭлектролитическая диссоциация 1 C 6 H 12 O 6(T) = C 6 H 12 O 6(p-p)H 2 O глюкоза неэлектролит 2 Na 2 SO 4 = 2 Na + + SO 4 2 — H 2 O 3 (α=100%) электролит сильный Hg. Cl 2 Hg. Cl + + Cl — ( α <100%) электролит слабый 4 в дисс в вдисс д С C n n 0. 0. Если α дисс. =1(100%) – электролит сильный 0< α дисс. < 1 – электролит слабый α дисс. =0 — неэлектролит
SO 3 +H 2 O = H 2 SO 4 Na 2 O+H 2 O = 2 Na. OHЭлектролитическая диссоциация 1 C 6 H 12 O 6(T) = C 6 H 12 O 6(p-p)H 2 O глюкоза неэлектролит 2 Na 2 SO 4 = 2 Na + + SO 4 2 — H 2 O 3 (α=100%) электролит сильный Hg. Cl 2 Hg. Cl + + Cl — ( α <100%) электролит слабый 4 в дисс в вдисс д С C n n 0. 0. Если α дисс. =1(100%) – электролит сильный 0< α дисс. < 1 – электролит слабый α дисс. =0 — неэлектролит
 Слабые электролиты Гидроксиды: NH 3. H 2 O NH 4 + +OH — Be(OH) 2 Be. OH + +OH — Fe(OH) 2 Fe. OH + +OH — Zn(OH) 2 Zn. OH + +OH — Zn(OH) + Zn 2+ +OH — и гидроксокомплексы [Al(OH) 4 ] — Al(OH) 3 +OH — [Be(OH) 4 ] 2 — [Be(OH) 3 ] — +OH -[Be(OH) 3 ] — Be(OH) 2 +OH — [Zn(OH) 4 ] 2 — [Zn(OH) 3 ] — +OH — [Zn(OH) 3 ] — Zn(OH) 2 +OH —
Слабые электролиты Гидроксиды: NH 3. H 2 O NH 4 + +OH — Be(OH) 2 Be. OH + +OH — Fe(OH) 2 Fe. OH + +OH — Zn(OH) 2 Zn. OH + +OH — Zn(OH) + Zn 2+ +OH — и гидроксокомплексы [Al(OH) 4 ] — Al(OH) 3 +OH — [Be(OH) 4 ] 2 — [Be(OH) 3 ] — +OH -[Be(OH) 3 ] — Be(OH) 2 +OH — [Zn(OH) 4 ] 2 — [Zn(OH) 3 ] — +OH — [Zn(OH) 3 ] — Zn(OH) 2 +OH —
 B = N 2 , O 2 CO, CH 4 B (г) В (р)Слабые электролиты Δ H 0 см. = Δ H 0 разр. + Δ H 0 гидрат. (сольватации) > 0 < 0 для газов ΔH 0 разр. ~ 0 Δ H 0 см. ~ Δ H 0 гидр. < 0 ( экзо )
B = N 2 , O 2 CO, CH 4 B (г) В (р)Слабые электролиты Δ H 0 см. = Δ H 0 разр. + Δ H 0 гидрат. (сольватации) > 0 < 0 для газов ΔH 0 разр. ~ 0 Δ H 0 см. ~ Δ H 0 гидр. < 0 ( экзо )
 Сильные электролиты Na 2 SO 4 (тв) = 2 Na + (p) + SO 4 2 — (p) Δ H 0 см. = Δ H 0 разр. крист. реш + Δ H 0 гидрат. ионов > 0 <
Сильные электролиты Na 2 SO 4 (тв) = 2 Na + (p) + SO 4 2 — (p) Δ H 0 см. = Δ H 0 разр. крист. реш + Δ H 0 гидрат. ионов > 0 <
 Произведение растворимости ( ПР ) — произведение равновесных концентраций ионов сильных малорастворимых электролитов в их насыщенном растворе в степенях, равных стехиометрическим коэффициентам. Ba. SO 4(T) Ba 2+ (p) + SO 4 2 — (p) гетерогенное равновесие, фазовое равновесие Кс = [Ba 2+ ][SO 4 2 — ] = ПРBa. SO 4 ПР Ba. SO 4 = ƒ (T) Дано: ПР Ba. SO 4 ~ 1 , 8 ∙ 10 -10 [Ba 2+ ] — ? [SO 4 2 — ] — ? LBa. SO 4 — ? [Ba 2+ ]=[SO 4 2 — ] [Ba 2+ ] 2 = ПР Ba. SO 4 [Ba 2+ ]=[SO 4 2 — ]=Lлмоль ПРBa. SO /103. 1 108.
Произведение растворимости ( ПР ) — произведение равновесных концентраций ионов сильных малорастворимых электролитов в их насыщенном растворе в степенях, равных стехиометрическим коэффициентам. Ba. SO 4(T) Ba 2+ (p) + SO 4 2 — (p) гетерогенное равновесие, фазовое равновесие Кс = [Ba 2+ ][SO 4 2 — ] = ПРBa. SO 4 ПР Ba. SO 4 = ƒ (T) Дано: ПР Ba. SO 4 ~ 1 , 8 ∙ 10 -10 [Ba 2+ ] — ? [SO 4 2 — ] — ? LBa. SO 4 — ? [Ba 2+ ]=[SO 4 2 — ] [Ba 2+ ] 2 = ПР Ba. SO 4 [Ba 2+ ]=[SO 4 2 — ]=Lлмоль ПРBa. SO /103. 1 108.
![Произведение растворимости [S 2 - ] 1 ∙ 10 -18 8 ∙ 10 -18 9 Произведение растворимости [S 2 - ] 1 ∙ 10 -18 8 ∙ 10 -18 9](/docs//solids_images/solids_24.jpg) Произведение растворимости [S 2 — ] 1 ∙ 10 -18 8 ∙ 10 -18 9 ∙ 10 -13 моль/л. Cu. S Ag 2 S Sb 2 S 3 ПР 10 -36 10 -52 10 -60 Сu. S (T) Cu 2+ (p) +S 2 — (p) ПР Cu. S =[Cu 2+ ][S 2 — ]=L 2 [S 2 — ]=L=Cu. SПР =10 -18 моль/л лмоль ПРSAg/108. 0 4 173 52 32 Ag 2 S (T) 2 Ag + (p) +S 2 — (p) ПР Ag 2 S =4 L 3 ; [S 2 — ]=L= лмоль ПРSSb /109108 10 3 108 3 13 5 60 532 Sb 2 S 3(T) 2 Sb 3+ (p) +3 S 2 — (p) L 2 L 3 L ПР Sb 2 S 3 =[Sb 3+ ] 2 [S 2 — ] 3 =(2 L) 2 (3 L) 3 =108 L 5 ; [S 2 — ]=
Произведение растворимости [S 2 — ] 1 ∙ 10 -18 8 ∙ 10 -18 9 ∙ 10 -13 моль/л. Cu. S Ag 2 S Sb 2 S 3 ПР 10 -36 10 -52 10 -60 Сu. S (T) Cu 2+ (p) +S 2 — (p) ПР Cu. S =[Cu 2+ ][S 2 — ]=L 2 [S 2 — ]=L=Cu. SПР =10 -18 моль/л лмоль ПРSAg/108. 0 4 173 52 32 Ag 2 S (T) 2 Ag + (p) +S 2 — (p) ПР Ag 2 S =4 L 3 ; [S 2 — ]=L= лмоль ПРSSb /109108 10 3 108 3 13 5 60 532 Sb 2 S 3(T) 2 Sb 3+ (p) +3 S 2 — (p) L 2 L 3 L ПР Sb 2 S 3 =[Sb 3+ ] 2 [S 2 — ] 3 =(2 L) 2 (3 L) 3 =108 L 5 ; [S 2 — ]=
 Произведение растворимости S 2 — Ag 2 CO 3 Ag 2 S CO 3 2 — ПР В 10 -13 10 -5253 13 3103 4 10 4 ПР С 2 Аg+. C S 2 — ≥ПР Ag 2 S Ag 2 CO 3(T) 2 Ag + (p) +CO 3 2 — (p) 4 L 2. L=ПР Ag 2 CO 3 =4 L 3 L Ag 2 CO 3 = С Аg+ = 2 L ≈ 6. 10 -5 моль/л С S 2 — ≥ лмоль C ПР Ag SAg/10 1036 1043 10 52 2 2 183 52 3108 4 10 4 2 SAg. ПР С 2 Ag+. C ≥ ПР =10 -13 Аg 2 S (T) 2 Ag + (p) +S 2 — (p) 4 L 2. L=ПР Ag 2 S =4 L 3 ; L= C Ag+ =2 L=1. 6. 10 -17 лмоль C ПР Ag COAg/10 10 10 )106. 1( 1021 34 13 217 13 2 32 СО 3 2 -C ≥ СО 3 2 — Ag 2 СО
Произведение растворимости S 2 — Ag 2 CO 3 Ag 2 S CO 3 2 — ПР В 10 -13 10 -5253 13 3103 4 10 4 ПР С 2 Аg+. C S 2 — ≥ПР Ag 2 S Ag 2 CO 3(T) 2 Ag + (p) +CO 3 2 — (p) 4 L 2. L=ПР Ag 2 CO 3 =4 L 3 L Ag 2 CO 3 = С Аg+ = 2 L ≈ 6. 10 -5 моль/л С S 2 — ≥ лмоль C ПР Ag SAg/10 1036 1043 10 52 2 2 183 52 3108 4 10 4 2 SAg. ПР С 2 Ag+. C ≥ ПР =10 -13 Аg 2 S (T) 2 Ag + (p) +S 2 — (p) 4 L 2. L=ПР Ag 2 S =4 L 3 ; L= C Ag+ =2 L=1. 6. 10 -17 лмоль C ПР Ag COAg/10 10 10 )106. 1( 1021 34 13 217 13 2 32 СО 3 2 -C ≥ СО 3 2 — Ag 2 СО
 Смещение ионных равновесий малорастворимых веществ Pb. Cl 2(T) Pb 2+ (p) +2 Cl — (p) ПР Pb. Cl 2 =1 , 7. 10 -5 (25 0 C) [Pb 2+ ][Cl — ] 2 =1 , 7. 10 -5 (25 0 C)
Смещение ионных равновесий малорастворимых веществ Pb. Cl 2(T) Pb 2+ (p) +2 Cl — (p) ПР Pb. Cl 2 =1 , 7. 10 -5 (25 0 C) [Pb 2+ ][Cl — ] 2 =1 , 7. 10 -5 (25 0 C)
 Влияние одноименных ионов 1. ) Na. Cl = Na + (p) + Cl — (p) C Cl — ; C Pb 2+ L =[Pb 2+ ] ’ Новое равновесие ([Pb 2+ ]’)([Cl — ]’) ∙ 2 = ПР Pb. Cl 2 Pb(NO 3 ) 2 =Pb 2+ (p) + 2 NO 3 — (p) C Pb 2+ ; C Cl — L = 1 / 2 [Cl — ] ’Pb. Cl 2(T) Pb 2+ (p) + 2 Cl — (p)
Влияние одноименных ионов 1. ) Na. Cl = Na + (p) + Cl — (p) C Cl — ; C Pb 2+ L =[Pb 2+ ] ’ Новое равновесие ([Pb 2+ ]’)([Cl — ]’) ∙ 2 = ПР Pb. Cl 2 Pb(NO 3 ) 2 =Pb 2+ (p) + 2 NO 3 — (p) C Pb 2+ ; C Cl — L = 1 / 2 [Cl — ] ’Pb. Cl 2(T) Pb 2+ (p) + 2 Cl — (p)
 Pb. Cl 2(T) Pb 2+ (p) + 2 Cl — (p) Влияние одноименных ионов 2. ) Введем S 2 — — ионы (Na 2 S) ПР Pb. S =8 , 7. 10 -29 Pb 2+ + S 2 — Pb. S (T) осадок Pb. Cl 2 растворяется, переходя в тв. Pb. S С Pb 2+ ; равнов. (растворение Pb. Cl 2 ) добавим р-р Na. NO 3 =Na + (p) + NO 3 — (p) исходное равновесие не смещается Т , смещ. , т. к. ПР
Pb. Cl 2(T) Pb 2+ (p) + 2 Cl — (p) Влияние одноименных ионов 2. ) Введем S 2 — — ионы (Na 2 S) ПР Pb. S =8 , 7. 10 -29 Pb 2+ + S 2 — Pb. S (T) осадок Pb. Cl 2 растворяется, переходя в тв. Pb. S С Pb 2+ ; равнов. (растворение Pb. Cl 2 ) добавим р-р Na. NO 3 =Na + (p) + NO 3 — (p) исходное равновесие не смещается Т , смещ. , т. к. ПР
 Условие выпадения осадка n. A m+ (p) + m. B n- (p) A n B m(T) C n (A m+ ) ∙ C m (B n- ) > ПР A n B m (↓) Ca(NO 3 ) 2 = Ca 2+ (p) + 2 NO 3 — (p) Na 2 CO 3 = 2 Na + (p) + C О 3 2 — (p) C 0 Ca(NO 3 ) 2 = 0. 1 моль/л С 0 Na 2 CO 3 = 1 ∙ 10 -5 моль/л V 1 =V 2 Ca 2+ (p) +CO 3 2 — (p) Ca. CO 3(T) ПР Ca. CO 3 = 4 , 4 ∙ 10 -9 7 50)(0 105. 2 4 101. 0 22 3223 CONa. NOСa. CС > ПР, → вып. осадок
Условие выпадения осадка n. A m+ (p) + m. B n- (p) A n B m(T) C n (A m+ ) ∙ C m (B n- ) > ПР A n B m (↓) Ca(NO 3 ) 2 = Ca 2+ (p) + 2 NO 3 — (p) Na 2 CO 3 = 2 Na + (p) + C О 3 2 — (p) C 0 Ca(NO 3 ) 2 = 0. 1 моль/л С 0 Na 2 CO 3 = 1 ∙ 10 -5 моль/л V 1 =V 2 Ca 2+ (p) +CO 3 2 — (p) Ca. CO 3(T) ПР Ca. CO 3 = 4 , 4 ∙ 10 -9 7 50)(0 105. 2 4 101. 0 22 3223 CONa. NOСa. CС > ПР, → вып. осадок
 Условие выпадения осадка Ag 2 SO 4 ↓ = ? a) C Ag+ = 10 -2 моль/л C SO 4 2 — = 10 -3 моль/л б) C Ag+ = 10 -2 моль/л C SO 4 2 — = 10 -1 моль/л. ПР Ag 2 SO 4 = 1, 2 ∙ 10 -6 Ag 2 SO 4(T) 2 Ag + (p) + SO 4 2 — (p) ПР = [Ag + ] 2. [SO 4 2 — ] = 10 -6 а) С 2 ∙ C = (10 — 2 ) 2 ∙ 10 -3 = = 10 -7 < ПРAg + SO 4 2 — б ) С 2 ∙ C = (10 — 2 ) 2 ∙ 10 — 1 = = 10 — 5 ≥ ПРAg + SO 4 2 — Ag 2 SO 4 ↓
Условие выпадения осадка Ag 2 SO 4 ↓ = ? a) C Ag+ = 10 -2 моль/л C SO 4 2 — = 10 -3 моль/л б) C Ag+ = 10 -2 моль/л C SO 4 2 — = 10 -1 моль/л. ПР Ag 2 SO 4 = 1, 2 ∙ 10 -6 Ag 2 SO 4(T) 2 Ag + (p) + SO 4 2 — (p) ПР = [Ag + ] 2. [SO 4 2 — ] = 10 -6 а) С 2 ∙ C = (10 — 2 ) 2 ∙ 10 -3 = = 10 -7 < ПРAg + SO 4 2 — б ) С 2 ∙ C = (10 — 2 ) 2 ∙ 10 — 1 = = 10 — 5 ≥ ПРAg + SO 4 2 — Ag 2 SO 4 ↓
 Предсказать возможные направления превращений Ba. Cr. O 4 Sr. Cr. O 4(T) Ca. Cr. O 4(T) +Sr 2+ +Ca 2+ +Ba 2+ +Sr 2+ ? ? ? ПР 1, 1 ∙ 10 -10 2, 7 ∙ 10 -5 ( k s =13, 2 г/100 г. Н 2 О)
Предсказать возможные направления превращений Ba. Cr. O 4 Sr. Cr. O 4(T) Ca. Cr. O 4(T) +Sr 2+ +Ca 2+ +Ba 2+ +Sr 2+ ? ? ? ПР 1, 1 ∙ 10 -10 2, 7 ∙ 10 -5 ( k s =13, 2 г/100 г. Н 2 О)
 Электролитическая диссоциация Идеальные растворы – растворы, образованные данным веществом, находящимся в одном и том же с раствором агрегатном состоянии, без изменения объема и без изменения энтальпии в процессе растворения ∆ V m = 0; ∆H m = 0; степень диссоциации – отношение числа диссоциированных молекул к общему числу растворенных молекул: . . общ дисс С С Произведение растворимости – произведение равновесных концентраций ионов малорастворимых электролитов в их насыщенном растворе.
Электролитическая диссоциация Идеальные растворы – растворы, образованные данным веществом, находящимся в одном и том же с раствором агрегатном состоянии, без изменения объема и без изменения энтальпии в процессе растворения ∆ V m = 0; ∆H m = 0; степень диссоциации – отношение числа диссоциированных молекул к общему числу растворенных молекул: . . общ дисс С С Произведение растворимости – произведение равновесных концентраций ионов малорастворимых электролитов в их насыщенном растворе.
 Протолитические равновесия • Кислота – источник (донор) протонов • Основание – приемник (акцептор) протонов • Протолиз – перенос протонов от одной частицы к другой в растворе (перенос протонов между частицами растворителя и растворенного вещества). • Сравните с определениями кислоты и основания по Аррениусу
Протолитические равновесия • Кислота – источник (донор) протонов • Основание – приемник (акцептор) протонов • Протолиз – перенос протонов от одной частицы к другой в растворе (перенос протонов между частицами растворителя и растворенного вещества). • Сравните с определениями кислоты и основания по Аррениусу
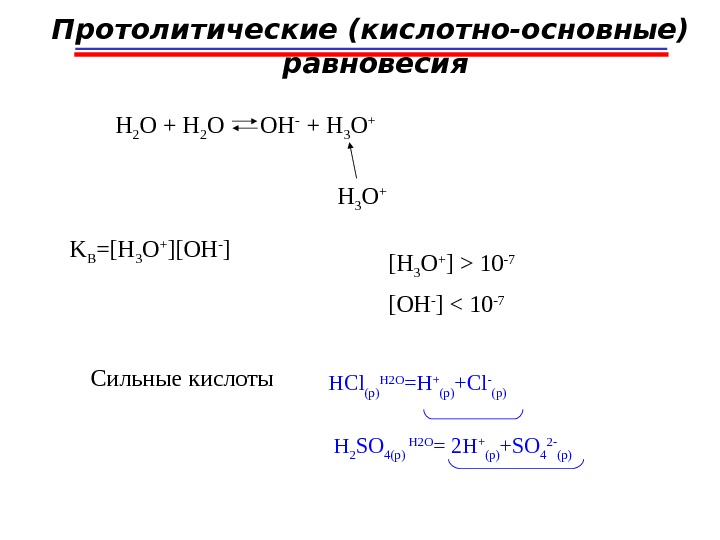
 Протолитические (кислотно-основные) равновесия HA + L HL + +A -H + кт 1 ос 2 ос 1 кт 2 ; HA A — HL + L HCN + H 2 O СN — + H 3 O +H + H + ; HCN СN- H 2 OH 3 O + кт 1 ос 2 ос 1 кт 2 NH 3. H 2 O + H 2 O NH 4 +. H 2 O + OH — H + ; NH 4 + NH 3 H 2 O OH —
Протолитические (кислотно-основные) равновесия HA + L HL + +A -H + кт 1 ос 2 ос 1 кт 2 ; HA A — HL + L HCN + H 2 O СN — + H 3 O +H + H + ; HCN СN- H 2 OH 3 O + кт 1 ос 2 ос 1 кт 2 NH 3. H 2 O + H 2 O NH 4 +. H 2 O + OH — H + ; NH 4 + NH 3 H 2 O OH —
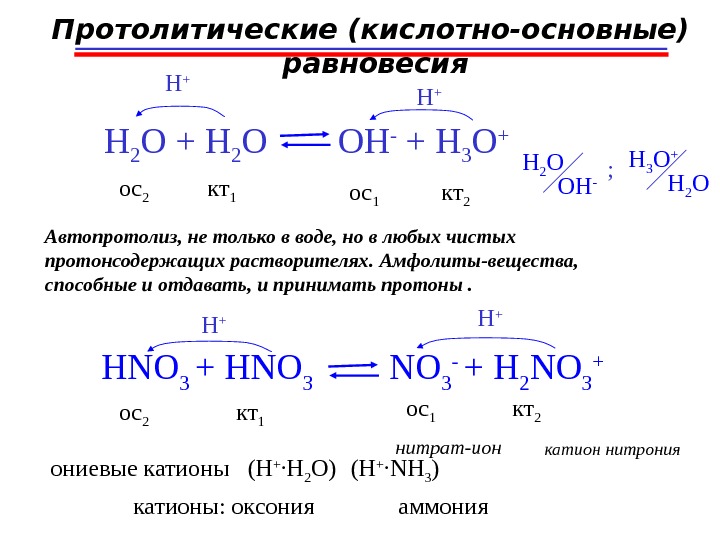
 H 2 O + H 2 O OH — + H 3 O + H + кт 1 ос 2 ос 1 кт 2 Протолитические (кислотно-основные) равновесия ; H 2 O OH — H 2 OH 3 O + Автопротолиз, не только в воде, но в любых чистых протонсодержащих растворителях. Амфолиты-вещества, способные и отдавать, и принимать протоны. HNO 3 + HNO 3 — + H 2 NO 3 +H + кт 1 ос 2 ос 1 кт 2 катион нитрония ониевы е катионы (H + ∙ H 2 O) (H + ∙ NH 3 ) катионы: о ксония аммониянитрат-ион
H 2 O + H 2 O OH — + H 3 O + H + кт 1 ос 2 ос 1 кт 2 Протолитические (кислотно-основные) равновесия ; H 2 O OH — H 2 OH 3 O + Автопротолиз, не только в воде, но в любых чистых протонсодержащих растворителях. Амфолиты-вещества, способные и отдавать, и принимать протоны. HNO 3 + HNO 3 — + H 2 NO 3 +H + кт 1 ос 2 ос 1 кт 2 катион нитрония ониевы е катионы (H + ∙ H 2 O) (H + ∙ NH 3 ) катионы: о ксония аммониянитрат-ион
 Протолитические (кислотно-основные) равновесия C 2 H 5 OH + C 2 H 5 OH C 2 H 5 O — + C 2 H 5 OH 2 +H + кт 1 ос 2 ос 1 кт 2 . ][ ]][[ 2 52 25252 пост. OHHCOHC Кс )(][][ 25252 52 Tf. OHHCOHCKs OHHC константа автопротолиза : ионное произведение растворителя (этанола)
Протолитические (кислотно-основные) равновесия C 2 H 5 OH + C 2 H 5 OH C 2 H 5 O — + C 2 H 5 OH 2 +H + кт 1 ос 2 ос 1 кт 2 . ][ ]][[ 2 52 25252 пост. OHHCOHC Кс )(][][ 25252 52 Tf. OHHCOHCKs OHHC константа автопротолиза : ионное произведение растворителя (этанола)
 Протолитические (кислотно-основные) равновесия H 2 O + H 2 O OH — + H 3 O + H +)(25 10 )(][][ 0 -14 3 Tf. OHOHКв ионное произведение воды Kв. OHOH][][3 Кв t, 0 C 10 -14 25 Кв t, 0 C 10 -12 80 [H 3 O + ] = [OH — ] = ~10 —
Протолитические (кислотно-основные) равновесия H 2 O + H 2 O OH — + H 3 O + H +)(25 10 )(][][ 0 -14 3 Tf. OHOHКв ионное произведение воды Kв. OHOH][][3 Кв t, 0 C 10 -14 25 Кв t, 0 C 10 -12 80 [H 3 O + ] = [OH — ] = ~10 —
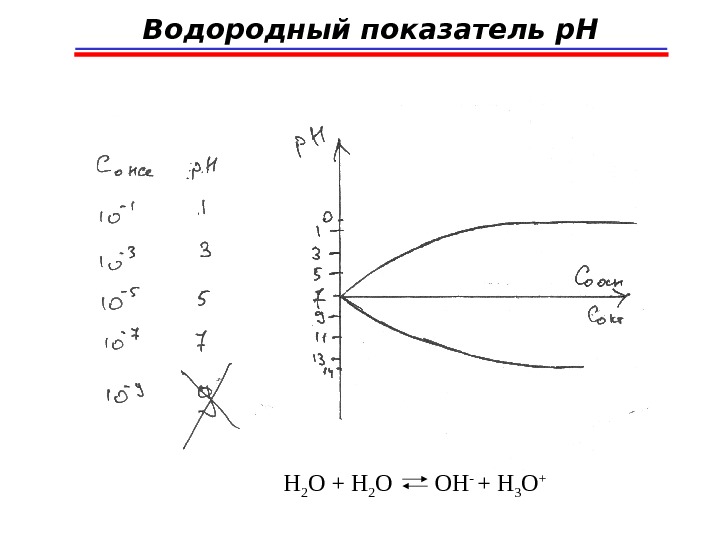
![Водородный показатель p. H = -lg[H 3 O + ] p. OH = -lg[OH - ] Водородный показатель p. H = -lg[H 3 O + ] p. OH = -lg[OH - ]](/docs//solids_images/solids_38.jpg) Водородный показатель p. H = -lg[H 3 O + ] p. OH = -lg[OH — ] p. H= 1 ÷ 13 т. к. K B = [H 3 O + ][OH — ] = 1 ∙ 10 -14 (25 0 С) В чистой воде: [H 3 O + ] = [OH — ] = 10 -7 моль/л p. H=7; p. OH=
Водородный показатель p. H = -lg[H 3 O + ] p. OH = -lg[OH — ] p. H= 1 ÷ 13 т. к. K B = [H 3 O + ][OH — ] = 1 ∙ 10 -14 (25 0 С) В чистой воде: [H 3 O + ] = [OH — ] = 10 -7 моль/л p. H=7; p. OH=
![Водородный показатель p. H Кислые растворы: [H 3 O + ] 10 -7 : Водородный показатель p. H Кислые растворы: [H 3 O + ] 10 -7 :](/docs//solids_images/solids_39.jpg) Водородный показатель p. H Кислые растворы: [H 3 O + ] > 10 -7 : 10 -6 ÷ 10 -1 моль/лp. H = 1 ÷ 7 Если [H 3 O + ] > 10 -1 , то К В ≠ 10 -14 ≠ соnst p. H = 0 и меньше – нет смысла Щелочные растворы: p. H = 7 ÷ 13 [H 3 O + ] 10 -7 10 -5 ÷ 10 -1 ; p. H = 7÷ 13 Если [OH — ] > 10 -1 моль/л, K B ≠ const p. H = 14 и больше – нет смысла
Водородный показатель p. H Кислые растворы: [H 3 O + ] > 10 -7 : 10 -6 ÷ 10 -1 моль/лp. H = 1 ÷ 7 Если [H 3 O + ] > 10 -1 , то К В ≠ 10 -14 ≠ соnst p. H = 0 и меньше – нет смысла Щелочные растворы: p. H = 7 ÷ 13 [H 3 O + ] 10 -7 10 -5 ÷ 10 -1 ; p. H = 7÷ 13 Если [OH — ] > 10 -1 моль/л, K B ≠ const p. H = 14 и больше – нет смысла
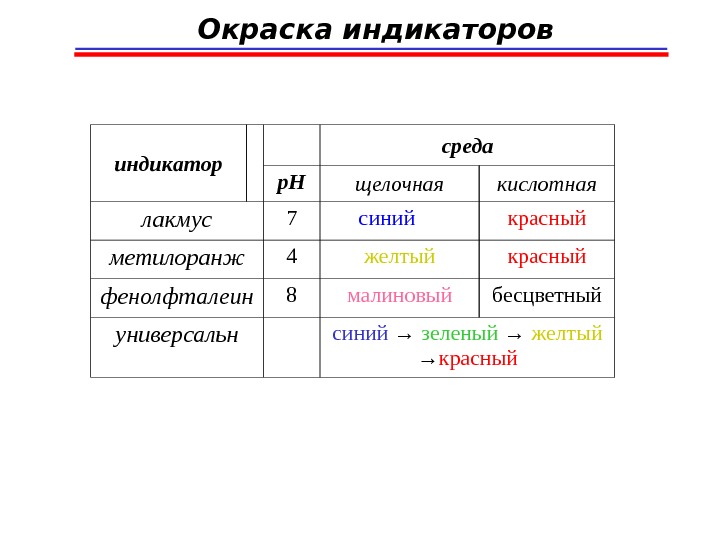
 Окраска индикаторов инди к атор среда p. H щелочная кислотная лакмус 7 синий красный метилоранж 4 желтый красный фенолфталеин 8 малиновый бесцветный универсальн синий → зеленый → желтый → красный
Окраска индикаторов инди к атор среда p. H щелочная кислотная лакмус 7 синий красный метилоранж 4 желтый красный фенолфталеин 8 малиновый бесцветный универсальн синий → зеленый → желтый → красный
 Протолитические (кислотно-основные) равновесия H 2 O + H 2 O OH — + H 3 O + K B =[H 3 O + ][OH — ] [H 3 O + ] > 10 -7 [OH — ] < 10 -7 Сильные кислоты HCl (p) H 2 O =H + (p) +Cl — (p) H 2 SO 4(p) H 2 O = 2 H + (p) +SO 4 2 — (p)
Протолитические (кислотно-основные) равновесия H 2 O + H 2 O OH — + H 3 O + K B =[H 3 O + ][OH — ] [H 3 O + ] > 10 -7 [OH — ] < 10 -7 Сильные кислоты HCl (p) H 2 O =H + (p) +Cl — (p) H 2 SO 4(p) H 2 O = 2 H + (p) +SO 4 2 — (p)
 Водородный показатель p. H Правило Полинга H n ЭO m (m-n) ≥ 2 кислота сильная HCl. O 4 , HNO 3 … (m-n) = 1 кислота слабая H 3 PO 4 , HNO 2 m ≤ n кислота очень слабая B(OH) 3 Американский ученый. Внес большой вклад в исследование природы химической связи, разработал метод валентных связей, теорию резонанса. В 1954 г. За «исследование природы химической связи» получил Нобелевскую премию. В 1962 г. Нобелевская премия мира. Лайнус Полинг (1901 — 1994)
Водородный показатель p. H Правило Полинга H n ЭO m (m-n) ≥ 2 кислота сильная HCl. O 4 , HNO 3 … (m-n) = 1 кислота слабая H 3 PO 4 , HNO 2 m ≤ n кислота очень слабая B(OH) 3 Американский ученый. Внес большой вклад в исследование природы химической связи, разработал метод валентных связей, теорию резонанса. В 1954 г. За «исследование природы химической связи» получил Нобелевскую премию. В 1962 г. Нобелевская премия мира. Лайнус Полинг (1901 — 1994)
 Водородный показатель p. H I. Сильные кислоты HCl + H 2 O = Cl — + H 3 O +H + Дано : p. H = ? C 0 HCl = 0, 1 моль/л [H 3 O+] — ? p. H = -lg[H 3 O + ] = = -lg. C 0 HCl= -lg 1 ∙ 10 -1 = 1 [H 3 O + ] = С 0 HCl = 0 , 1 моль/д
Водородный показатель p. H I. Сильные кислоты HCl + H 2 O = Cl — + H 3 O +H + Дано : p. H = ? C 0 HCl = 0, 1 моль/л [H 3 O+] — ? p. H = -lg[H 3 O + ] = = -lg. C 0 HCl= -lg 1 ∙ 10 -1 = 1 [H 3 O + ] = С 0 HCl = 0 , 1 моль/д
 Кислоты H 2 SO 4 + 2 H 2 O = SO 4 2 — + 2 H 3 O + 2 H + [H 3 O + ] = 2 C 0 H 2 SO 4 p. H = -lg[H 3 O + ] = -lg 2 C 0 H 2 SO 4 HSO 4 — + H 2 O = SO 4 2 — + H 3 O + H + p. H = -lg[H 3 O + ] = -lg. C 0 HSO 4 —
Кислоты H 2 SO 4 + 2 H 2 O = SO 4 2 — + 2 H 3 O + 2 H + [H 3 O + ] = 2 C 0 H 2 SO 4 p. H = -lg[H 3 O + ] = -lg 2 C 0 H 2 SO 4 HSO 4 — + H 2 O = SO 4 2 — + H 3 O + H + p. H = -lg[H 3 O + ] = -lg. C 0 HSO 4 —
 Протолитические (кислотно-основные) равновесия HA + H 2 O A — + H 3 O + H + Для слабых кислот НА ; Кк — )( ][][ ][ ]][[ 0 2 33 tf C A C OH HA OHA K HAHA K константа кислотности т. к. [A — ] = [H 3 O + ]; [HA] = C 0 — αC 0 ~ C 0 HA для α<<1 при Кк 10 -3 α — степень протолиза
Протолитические (кислотно-основные) равновесия HA + H 2 O A — + H 3 O + H + Для слабых кислот НА ; Кк — )( ][][ ][ ]][[ 0 2 33 tf C A C OH HA OHA K HAHA K константа кислотности т. к. [A — ] = [H 3 O + ]; [HA] = C 0 — αC 0 ~ C 0 HA для α<<1 при Кк 10 -3 α — степень протолиза
 Кислоты H 3 PO 4 + H 2 O H 2 PO 4 — + H 3 O + H + Кк = 7, 5 ∙ 10 -3 H 2 PO 4 — + H 2 O HPO 4 2 — + H 3 O + H + HPO 4 2 — + H 2 O PO 4 3 — + H 3 O + H + Кк = 6, 3 ∙ 10 -8 Кк = 2, ∙ 10 -13 α 1 >> α 2 >> α
Кислоты H 3 PO 4 + H 2 O H 2 PO 4 — + H 3 O + H + Кк = 7, 5 ∙ 10 -3 H 2 PO 4 — + H 2 O HPO 4 2 — + H 3 O + H + HPO 4 2 — + H 2 O PO 4 3 — + H 3 O + H + Кк = 6, 3 ∙ 10 -8 Кк = 2, ∙ 10 -13 α 1 >> α 2 >> α
![Кислоты [Al(H 2 O) 6 ] 3+ + H 2 O [Al(H 2 Кислоты [Al(H 2 O) 6 ] 3+ + H 2 O [Al(H 2](/docs//solids_images/solids_47.jpg) Кислоты [Al(H 2 O) 6 ] 3+ + H 2 O [Al(H 2 O) 5 (OH)] 2+ + H 3 O + . . H + ( Al ∙ H 2 O ) 3+ + H 2 O ( Al. OH ) 2+ + H 3 O + H + Кк = 7, 3 ∙ 10 —
Кислоты [Al(H 2 O) 6 ] 3+ + H 2 O [Al(H 2 O) 5 (OH)] 2+ + H 3 O + . . H + ( Al ∙ H 2 O ) 3+ + H 2 O ( Al. OH ) 2+ + H 3 O + H + Кк = 7, 3 ∙ 10 —
 Основания Na. OH = Na + + OH — p. OH = -lg[OH — ] =-lg. C 0 Na. OH p. H = 14 – p. OH = 14 + lg. C 0 Na. OH Ba(OH) 2 = Ba 2+ + 2 OH — p. OH = -lg 2 C 0 Ba(OH)
Основания Na. OH = Na + + OH — p. OH = -lg[OH — ] =-lg. C 0 Na. OH p. H = 14 – p. OH = 14 + lg. C 0 Na. OH Ba(OH) 2 = Ba 2+ + 2 OH — p. OH = -lg 2 C 0 Ba(OH)
 H 2 O+NH 3 ∙ H 2 O OH — + (NH 4 ∙ H 2 O) +H + Основания 51075, 1 4 NH О Кк Кв К К о = OHNHC OHNH 23230 2 4 ~ ][ ~ ]][[ [OH — ]= ; 230 OHNHCKo p. OH =-lg[OH — ] = -lg. 0 осн. СКо
H 2 O+NH 3 ∙ H 2 O OH — + (NH 4 ∙ H 2 O) +H + Основания 51075, 1 4 NH О Кк Кв К К о = OHNHC OHNH 23230 2 4 ~ ][ ~ ]][[ [OH — ]= ; 230 OHNHCKo p. OH =-lg[OH — ] = -lg. 0 осн. СКо
 HPO 4 2 — + H 2 O PO 4 3 — +H 3 O +H + Амфолиты7 8 14 / 103. 1 103. 6 10 24 42 HPO POНКк Кв КО Ко (1) = 0 ]][[ C OHA p. OH = — lg 240 HPOСКо p. H = — lg 1 2 К КК К K к ( HPO 4 2 — /PO 4 3 — ) =2, 2 · 10 -13 HPO 4 2 — + H 2 O H 2 PO 4 — + OH — > K к(2)H + H +(1) (2) (Ко) (Кк)
HPO 4 2 — + H 2 O PO 4 3 — +H 3 O +H + Амфолиты7 8 14 / 103. 1 103. 6 10 24 42 HPO POНКк Кв КО Ко (1) = 0 ]][[ C OHA p. OH = — lg 240 HPOСКо p. H = — lg 1 2 К КК К K к ( HPO 4 2 — /PO 4 3 — ) =2, 2 · 10 -13 HPO 4 2 — + H 2 O H 2 PO 4 — + OH — > K к(2)H + H +(1) (2) (Ко) (Кк)
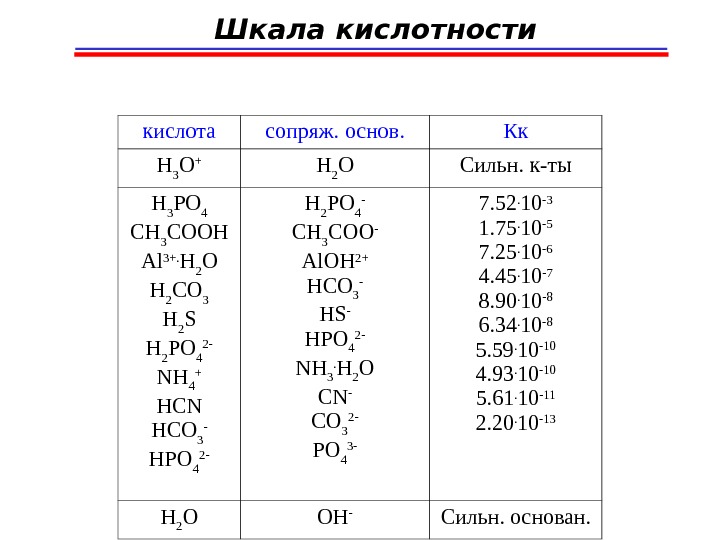
 Шкала кислотности кислота сопряж. основ. Кк H 3 O + H 2 O Сильн. к-ты H 3 PO 4 CH 3 COOH Al 3+. H 2 O H 2 CO 3 H 2 S H 2 PO 4 2 — NH 4 + HCN HCO 3 — HPO 4 2 — H 2 PO 4 — CH 3 COO — Al. OH 2+ HCO 3 — HS — HPO 4 2 — NH 3. H 2 O CN — CO 3 2 — PO 4 3 — 7. 52. 10 -3 1. 75. 10 -5 7. 25. 10 -6 4. 45. 10 -7 8. 90. 10 -8 6. 34. 10 -8 5. 59. 10 -10 4. 93. 10 -10 5. 61. 10 -11 2. 20. 10 -13 H 2 O OH — Сильн. основан.
Шкала кислотности кислота сопряж. основ. Кк H 3 O + H 2 O Сильн. к-ты H 3 PO 4 CH 3 COOH Al 3+. H 2 O H 2 CO 3 H 2 S H 2 PO 4 2 — NH 4 + HCN HCO 3 — HPO 4 2 — H 2 PO 4 — CH 3 COO — Al. OH 2+ HCO 3 — HS — HPO 4 2 — NH 3. H 2 O CN — CO 3 2 — PO 4 3 — 7. 52. 10 -3 1. 75. 10 -5 7. 25. 10 -6 4. 45. 10 -7 8. 90. 10 -8 6. 34. 10 -8 5. 59. 10 -10 4. 93. 10 -10 5. 61. 10 -11 2. 20. 10 -13 H 2 O OH — Сильн. основан.
 Протолитические (кислотно-основные) равновесия Рост степени протолиза анионов (ряд основности) F — < NO 2 — < HCO 3 — < SO 3 2 — < HPO 4 2 — < CN — < CO 3 2 — < PO 4 3 — < S 2 — α = 1 ÷ 2% α = 80 — 90 % Рост степени протолиза катионов (ряд кислотности ) α = 1 ÷ 2% α = 30 % Mg 2+ < NH 4 + < Zn 2+ < Cu 2+ < Fe 2+ <Al 3+ < Cr 3+ < Fe 3+Увеличение констант основности Увеличение констант кислотности
Протолитические (кислотно-основные) равновесия Рост степени протолиза анионов (ряд основности) F — < NO 2 — < HCO 3 — < SO 3 2 — < HPO 4 2 — < CN — < CO 3 2 — < PO 4 3 — < S 2 — α = 1 ÷ 2% α = 80 — 90 % Рост степени протолиза катионов (ряд кислотности ) α = 1 ÷ 2% α = 30 % Mg 2+ < NH 4 + < Zn 2+ < Cu 2+ < Fe 2+ <Al 3+ < Cr 3+ < Fe 3+Увеличение констант основности Увеличение констант кислотности
 Протолитические (кислотно-основные) равновесия α HA при разбавлении HCN + H 2 O CN — + H 3 O +H + К к HCN = 4 , 9 ∙ 10 -10 H 2 O + H 2 O OH — +H 3 O +H + HCNHCNC CN C OH 00 3][][ )1( )10( ][ ]][[ 0 7 003 C CC HCN OHCN Kk. Кк (1 -α) = α 2 С 0 + 10 -7 α Кк = α 2 С 0 + α (10 -7 +Кк) 7010 lim 0 Kк KK C если Кк > 10 -7 lim α=1 если Кк < 10 -7 lim α≠ 1 3 710 10109, 4 lim HCN
Протолитические (кислотно-основные) равновесия α HA при разбавлении HCN + H 2 O CN — + H 3 O +H + К к HCN = 4 , 9 ∙ 10 -10 H 2 O + H 2 O OH — +H 3 O +H + HCNHCNC CN C OH 00 3][][ )1( )10( ][ ]][[ 0 7 003 C CC HCN OHCN Kk. Кк (1 -α) = α 2 С 0 + 10 -7 α Кк = α 2 С 0 + α (10 -7 +Кк) 7010 lim 0 Kк KK C если Кк > 10 -7 lim α=1 если Кк < 10 -7 lim α≠ 1 3 710 10109, 4 lim HCN
 Протолитические (кислотно-основные) равновесия Для слабых оснований А — A — + H 2 O HA + OH -H + )( ][][ ][ ]][[ 0 2 tf C HA C OH A OHHA К AA О )1( 0 2 C КО константа основности т. к. [HA] = [OH — ], a[A — ] = C 0 -αC 0 ≈ C 0 A — для α<<1 АAA АС Ко C HA C OH 000 ][][ BAОHAКKOHOH A OHHA HA OHA КК ]][[ ][ ]][[
Протолитические (кислотно-основные) равновесия Для слабых оснований А — A — + H 2 O HA + OH -H + )( ][][ ][ ]][[ 0 2 tf C HA C OH A OHHA К AA О )1( 0 2 C КО константа основности т. к. [HA] = [OH — ], a[A — ] = C 0 -αC 0 ≈ C 0 A — для α<<1 АAA АС Ко C HA C OH 000 ][][ BAОHAКKOHOH A OHHA HA OHA КК ]][[ ][ ]][[
 С H 3 COOH + H 2 O CH 3 COO — + H 3 O + H + Протолитические (кислотно-основные) равновесия Дано: С 0 СH 3 COOH = 10 -1 моль/л [CH 3 COO-] — ? αСH 3 COOH = ? Кк СH 3 COOH = 1, 75 ∙ 10 -5 (25 0 С) p. H = -lg[H 3 O + ] 5 3 331075, 1 ][ ]][[ COOHCH OHCOOCH КК Kк C OH COOHCH 30 2 3][ кт. СКк. OH 03 lg][ p. H=-lg 9, 2103, 1 lg 101075. 1 lg 315 0 кт. СКк [H 3 O + ]=[CH 3 COO — ]= лмоль/103, 1101075, 1315 α СH 3 COOH = 2 1 3 0 3103, 1 10 103, 1][ кт. C COOCHp. H=-lg
С H 3 COOH + H 2 O CH 3 COO — + H 3 O + H + Протолитические (кислотно-основные) равновесия Дано: С 0 СH 3 COOH = 10 -1 моль/л [CH 3 COO-] — ? αСH 3 COOH = ? Кк СH 3 COOH = 1, 75 ∙ 10 -5 (25 0 С) p. H = -lg[H 3 O + ] 5 3 331075, 1 ][ ]][[ COOHCH OHCOOCH КК Kк C OH COOHCH 30 2 3][ кт. СКк. OH 03 lg][ p. H=-lg 9, 2103, 1 lg 101075. 1 lg 315 0 кт. СКк [H 3 O + ]=[CH 3 COO — ]= лмоль/103, 1101075, 1315 α СH 3 COOH = 2 1 3 0 3103, 1 10 103, 1][ кт. C COOCHp. H=-lg
 Водородный показатель p. H H 2 O + H 2 O OH — + H 3 O +
Водородный показатель p. H H 2 O + H 2 O OH — + H 3 O +
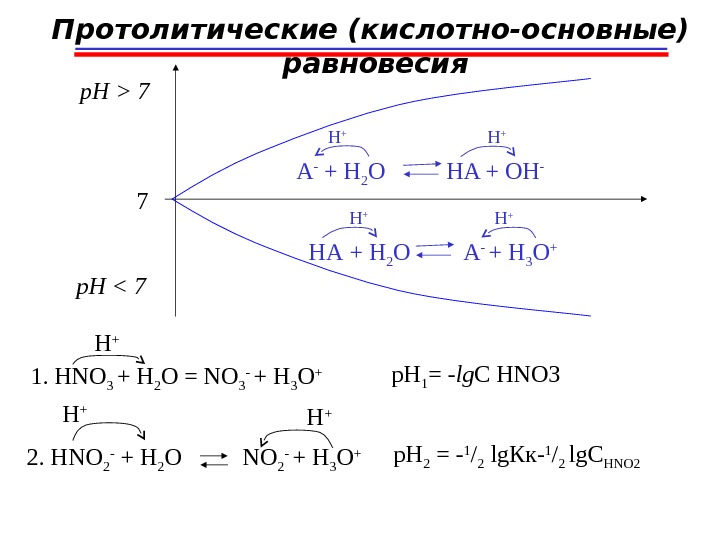
 Протолитические (кислотно-основные) равновесия 7 p. H > 7 p. H < 7 A — + H 2 O HA + OH — H + HA + H 2 O A — + H 3 O + H + 1. HNO 3 + H 2 O = NO 3 — + H 3 O + 2. HNO 2 — + H 2 O NO 2 — + H 3 O + H + p. H 2 = — 1 / 2 lg Кк — 1 / 2 lg С HNO 2 p. H 1 = — lg C HNO
Протолитические (кислотно-основные) равновесия 7 p. H > 7 p. H < 7 A — + H 2 O HA + OH — H + HA + H 2 O A — + H 3 O + H + 1. HNO 3 + H 2 O = NO 3 — + H 3 O + 2. HNO 2 — + H 2 O NO 2 — + H 3 O + H + p. H 2 = — 1 / 2 lg Кк — 1 / 2 lg С HNO 2 p. H 1 = — lg C HNO
 Протолитические (кислотно-основные) равновесия 7 1 2 3 4 5 6 -lg. C кт HNO 2 HNO 3 p. H<
Протолитические (кислотно-основные) равновесия 7 1 2 3 4 5 6 -lg. C кт HNO 2 HNO 3 p. H<
 Растворы Сольволиз – хим. реакция вещества с протонсодержащим растворителем, приводящая к изменению концентрации ионов растворителя Гидролиз – хим. реакция между бинарным соединением или солью с водой, приводящая к изменению концентрации ОН — и Н 3 О + — ионов (изменение р. Н раствора)
Растворы Сольволиз – хим. реакция вещества с протонсодержащим растворителем, приводящая к изменению концентрации ионов растворителя Гидролиз – хим. реакция между бинарным соединением или солью с водой, приводящая к изменению концентрации ОН — и Н 3 О + — ионов (изменение р. Н раствора)
 Растворы 13 p. H A — +H 2 O HA + OH — 7 область разбавленных растворов HA+H 2 O H 3 O + + A — C 0 ≈10 -1(25 0 C) C 0 A — или С 0 НА
Растворы 13 p. H A — +H 2 O HA + OH — 7 область разбавленных растворов HA+H 2 O H 3 O + + A — C 0 ≈10 -1(25 0 C) C 0 A — или С 0 НА
 Сольволиз и гидролиз I. необратимый галогениды неметаллов Si. Cl 4 , NF 3 , PBr 5 , PCl 3 O и ме т аллов d-элементов Ti. Cl 4 , WCl 6 (в высоких степенях окисления)А) Si. Cl 4( ж ) + 4 H 2 O = H 4 Si. O 4(T) + 4 HCl H + δ- (Si. O 2 ∙ n. H 2 O) HCl + H 2 O = Cl — + H 3 O +H + H 4 Si. O 4(T) + H 2 O H 3 Si. O 4 — + H 3 O +H + p. H <<
Сольволиз и гидролиз I. необратимый галогениды неметаллов Si. Cl 4 , NF 3 , PBr 5 , PCl 3 O и ме т аллов d-элементов Ti. Cl 4 , WCl 6 (в высоких степенях окисления)А) Si. Cl 4( ж ) + 4 H 2 O = H 4 Si. O 4(T) + 4 HCl H + δ- (Si. O 2 ∙ n. H 2 O) HCl + H 2 O = Cl — + H 3 O +H + H 4 Si. O 4(T) + H 2 O H 3 Si. O 4 — + H 3 O +H + p. H <<
 Сольволиз и гидролиз карбиды, фосфиды и нитриды s- элементов Ca. C 2 , Li 3 N, Mg 3 N 2 , Mg 3 P 2 Б) Mg 3 N 2 +8 H 2 O = 2 NH 3. H 2 O+3 Mg(OH) 2 ↓δ + δ- Mg(OH) 2(T) Mg 2+ + 2 OH — NH 3 ∙ H 2 O + H 2 O NH 4 + ∙ H 2 O + OH — H +
Сольволиз и гидролиз карбиды, фосфиды и нитриды s- элементов Ca. C 2 , Li 3 N, Mg 3 N 2 , Mg 3 P 2 Б) Mg 3 N 2 +8 H 2 O = 2 NH 3. H 2 O+3 Mg(OH) 2 ↓δ + δ- Mg(OH) 2(T) Mg 2+ + 2 OH — NH 3 ∙ H 2 O + H 2 O NH 4 + ∙ H 2 O + OH — H +
 Сольволиз и гидролиз Mg 3 P 2 +6 H 2 O = 2 PH 3 ↑ +3 Mg(OH) 2(T) Mg 2+ (p) +2 OH — (p) x / 2 x [ Mg 2+ ][ OH — ] 2 ≈ 10 -12 =ПР Mg ( OH ) 2 x / 2 x 2 ][3 OH ПР Mg(OH)2 ≈ 10 -12 [OH — ]= лмоль. ПРOHMg/10102243123)(2 p. OH = -lg[OH — ] = -lg 10 -4 = 4 p. H = 14 – p. OH = 14 – 4 =
Сольволиз и гидролиз Mg 3 P 2 +6 H 2 O = 2 PH 3 ↑ +3 Mg(OH) 2(T) Mg 2+ (p) +2 OH — (p) x / 2 x [ Mg 2+ ][ OH — ] 2 ≈ 10 -12 =ПР Mg ( OH ) 2 x / 2 x 2 ][3 OH ПР Mg(OH)2 ≈ 10 -12 [OH — ]= лмоль. ПРOHMg/10102243123)(2 p. OH = -lg[OH — ] = -lg 10 -4 = 4 p. H = 14 – p. OH = 14 – 4 =
 Сольволиз и гидролиз В) некоторые соли: Al 2 S 3 , Al 2 ( CO 3 ) 3 и т. д. 2 Al + 3 S = Al 2 S 3 + 6 H 2 O = 2 Al(OH) 3 ↓ + 3 H 2 S↑
Сольволиз и гидролиз В) некоторые соли: Al 2 S 3 , Al 2 ( CO 3 ) 3 и т. д. 2 Al + 3 S = Al 2 S 3 + 6 H 2 O = 2 Al(OH) 3 ↓ + 3 H 2 S↑
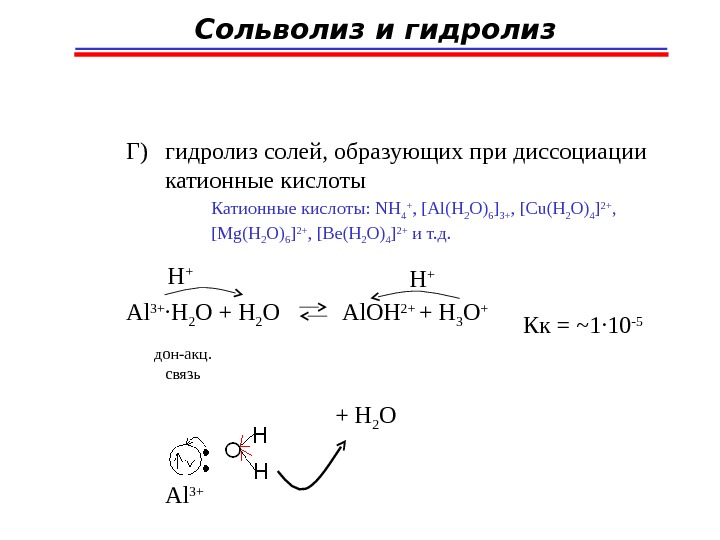
 Сольволиз и гидролиз Г) гидролиз солей, образующих при диссоциации катионные кислоты Катионные кислоты: NH 4 + , [Al(H 2 O) 6 ] 3+ , [Cu(H 2 O) 4 ] 2+ , [Mg(H 2 O) 6 ] 2+ , [Be(H 2 O) 4 ] 2+ и т. д. Al 3+ ∙ H 2 O + H 2 O Al. OH 2+ + H 3 O + H + дон-акц. связь Кк = ~1 ∙ 10 -5 Al 3+ + H 2 O
Сольволиз и гидролиз Г) гидролиз солей, образующих при диссоциации катионные кислоты Катионные кислоты: NH 4 + , [Al(H 2 O) 6 ] 3+ , [Cu(H 2 O) 4 ] 2+ , [Mg(H 2 O) 6 ] 2+ , [Be(H 2 O) 4 ] 2+ и т. д. Al 3+ ∙ H 2 O + H 2 O Al. OH 2+ + H 3 O + H + дон-акц. связь Кк = ~1 ∙ 10 -5 Al 3+ + H 2 O
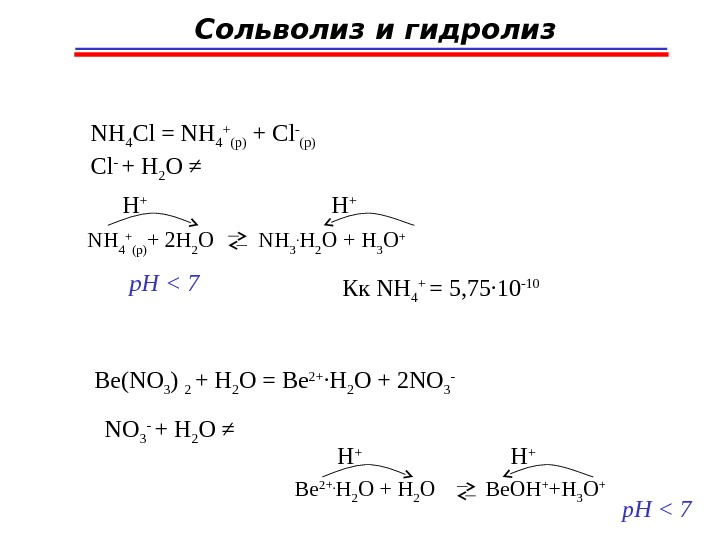
 Сольволиз и гидролиз NH 4 Cl = NH 4 + (p) + Cl — (p) Cl — + H 2 O ≠ NH 4 + (p) + 2 H 2 O NH 3. H 2 O + H 3 O +H + p. H < 7 Кк NH 4 + = 5 , 75 ∙ 10 -10 Be(NO 3 ) 2 + H 2 O = Be 2+ ∙ H 2 O + 2 NO 3 — + H 2 O ≠ Be 2+. H 2 O + H 2 O Be. OH + +H 3 O +H + p. H <
Сольволиз и гидролиз NH 4 Cl = NH 4 + (p) + Cl — (p) Cl — + H 2 O ≠ NH 4 + (p) + 2 H 2 O NH 3. H 2 O + H 3 O +H + p. H < 7 Кк NH 4 + = 5 , 75 ∙ 10 -10 Be(NO 3 ) 2 + H 2 O = Be 2+ ∙ H 2 O + 2 NO 3 — + H 2 O ≠ Be 2+. H 2 O + H 2 O Be. OH + +H 3 O +H + p. H <
 Сольволиз и гидролиз II. обратимый KNO 2 = K + (p) + NO 2 — (p) K + (p) + H 2 O ≠ H 2 O + NO 2 — OH — + HNO 2 ; H + 2 2 2 0. . 0 0 0 2 2 2 ][ ][ ][ ]][[ KNO NOпротгидр НNO KNO B KNO C Ko Кк СKв СКо. OH Кк K Ко C OH NO OHHNO
Сольволиз и гидролиз II. обратимый KNO 2 = K + (p) + NO 2 — (p) K + (p) + H 2 O ≠ H 2 O + NO 2 — OH — + HNO 2 ; H + 2 2 2 0. . 0 0 0 2 2 2 ][ ][ ][ ]][[ KNO NOпротгидр НNO KNO B KNO C Ko Кк СKв СКо. OH Кк K Ко C OH NO OHHNO
 Сольволиз и гидролиз Na. Cl = Na + (p) + Cl — (p) Na + (p) + H 2 O ≠ Cl — (p) + H 2 O ≠ p. H=7 (25 0 C)α гидр. = 0 α прот. =
Сольволиз и гидролиз Na. Cl = Na + (p) + Cl — (p) Na + (p) + H 2 O ≠ Cl — (p) + H 2 O ≠ p. H=7 (25 0 C)α гидр. = 0 α прот. =
 Сольволиз и гидролиз II. г идролиз солей, которые при диссоциации образуют ионы-амфолиты (которые могут проявлять свойства и кислот и оснований) Амфолит – это любая частица, способная проявлять свойства кислоты и основания. HS — , HCO 3 — , H 2 PO 4 — , HPO 4 2 — …
Сольволиз и гидролиз II. г идролиз солей, которые при диссоциации образуют ионы-амфолиты (которые могут проявлять свойства и кислот и оснований) Амфолит – это любая частица, способная проявлять свойства кислоты и основания. HS — , HCO 3 — , H 2 PO 4 — , HPO 4 2 — …
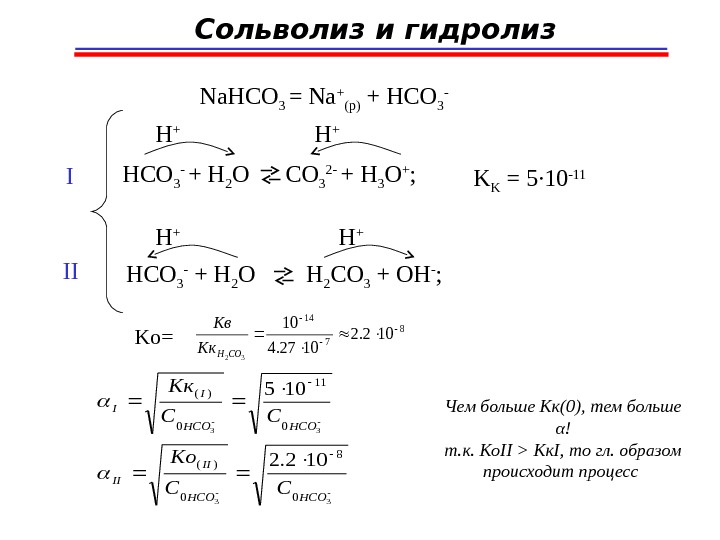
 Сольволиз и гидролиз Na. HCO 3 = Na + (p) + HCO 3 — + H 2 O CO 3 2 — + H 3 O + ; H + HCO 3 — + H 2 O H 2 CO 3 + OH — ; H + I II K K = 5 ∙ 10 -11 Ko=8 7 14 102. 2 1027. 4 10 32 COHКк Кв 33 33 0 8 0 )( 0 11 0 )( 102. 2 105 HCOHCO II II HCOHCO I I CC Ko CC Kк Чем больше Кк(0), тем больше α! т. к. Ко II > K к I , то гл. образом происходит процесс
Сольволиз и гидролиз Na. HCO 3 = Na + (p) + HCO 3 — + H 2 O CO 3 2 — + H 3 O + ; H + HCO 3 — + H 2 O H 2 CO 3 + OH — ; H + I II K K = 5 ∙ 10 -11 Ko=8 7 14 102. 2 1027. 4 10 32 COHКк Кв 33 33 0 8 0 )( 0 11 0 )( 102. 2 105 HCOHCO II II HCOHCO I I CC Ko CC Kк Чем больше Кк(0), тем больше α! т. к. Ко II > K к I , то гл. образом происходит процесс
![a) [NH 4 + ] = [OH - ] = ? C o NH 3 ∙ a) [NH 4 + ] = [OH - ] = ? C o NH 3 ∙](/docs//solids_images/solids_71.jpg) a) [NH 4 + ] = [OH — ] = ? C o NH 3 ∙ H 2 O = 0 , 025 M б ) [NH 4 + ] = ? C 0 NH 4 NO 3 = 0 , 025 M NH 3 ∙ H 2 O + H 2 O NH 4 + + OH — + H 2 O Сольволиз и гидролиз H + Ko=OHNHC NH OHNH 230 2 4 23 4][ ][ ]][[ a) [NH 4 + ] = [OH — ] = 30 NHСКо = лмоль. C Кк Кв NH NHNH /107. 0025. 0 106 103 10 14 0 / 3 34 = NH 4 NO 3 H 2 O = NH 4 + + NO 3 — C 0 → C 0 [ NH 4 + ] = C 0 = 0, 025 моль/л б )
a) [NH 4 + ] = [OH — ] = ? C o NH 3 ∙ H 2 O = 0 , 025 M б ) [NH 4 + ] = ? C 0 NH 4 NO 3 = 0 , 025 M NH 3 ∙ H 2 O + H 2 O NH 4 + + OH — + H 2 O Сольволиз и гидролиз H + Ko=OHNHC NH OHNH 230 2 4 23 4][ ][ ]][[ a) [NH 4 + ] = [OH — ] = 30 NHСКо = лмоль. C Кк Кв NH NHNH /107. 0025. 0 106 103 10 14 0 / 3 34 = NH 4 NO 3 H 2 O = NH 4 + + NO 3 — C 0 → C 0 [ NH 4 + ] = C 0 = 0, 025 моль/л б )
 Сольволиз и гидролиз V / p = ? ω / HCl = 26 , 2% = 0 , 262 ρ / p = 1. 13 г/мл V доб. H 2 O = 0 , 025 л. = 25 мл. ω // = 10% = 0, 1 m / HCl = m // HCl ω / =// / pp HCl V m ω // = OHOHp HCl VV m m m 22 // // V / p ∙ ρ / p ∙ ω / = ω // ( V / p ∙ ρ / p + V H 2 O. ρ H 2 O ) V / p = ]]. . . [//. . . [ 13. 1)1. 0262. 0( 0. 125262. 0 ///// // 22 млгмл V pp OHOH
Сольволиз и гидролиз V / p = ? ω / HCl = 26 , 2% = 0 , 262 ρ / p = 1. 13 г/мл V доб. H 2 O = 0 , 025 л. = 25 мл. ω // = 10% = 0, 1 m / HCl = m // HCl ω / =// / pp HCl V m ω // = OHOHp HCl VV m m m 22 // // V / p ∙ ρ / p ∙ ω / = ω // ( V / p ∙ ρ / p + V H 2 O. ρ H 2 O ) V / p = ]]. . . [//. . . [ 13. 1)1. 0262. 0( 0. 125262. 0 ///// // 22 млгмл V pp OHOH

