Презентация презентация для Михайловой А.М.


































- Размер: 1.9 Mегабайта
- Количество слайдов: 39
Описание презентации Презентация презентация для Михайловой А.М. по слайдам
 СУПЕРИОННОЕ СОСТОЯНИЕ ИНТЕРФАЗ В СИСТЕМАХ ПРЯМОГОКОНТАКТА ОДНОВАЛЕНТНЫЙ МЕТАЛЛ – ПОЛУПРОВОДНИК p-ТИПА Михайлова А. М. 1 , Сигейкин Г. И. 2 , Симаков В. В. 3 , Ефанова В. В. 1 1 ФГОУ ВПО «Саратовский государственный технический университет имени Гагарина Ю. А. » , г. Саратов, Россия 2 Учреждение Российской академии наук Межведомственный центр аналитических исследований в области физики, химии и биологии при Президиуме РАН, г. Москва, Россия 3 ФГБОУ ВПО «Саратовский государственный аграрный университет имени Н. И. Вавилова» , г. Саратов, Россия
СУПЕРИОННОЕ СОСТОЯНИЕ ИНТЕРФАЗ В СИСТЕМАХ ПРЯМОГОКОНТАКТА ОДНОВАЛЕНТНЫЙ МЕТАЛЛ – ПОЛУПРОВОДНИК p-ТИПА Михайлова А. М. 1 , Сигейкин Г. И. 2 , Симаков В. В. 3 , Ефанова В. В. 1 1 ФГОУ ВПО «Саратовский государственный технический университет имени Гагарина Ю. А. » , г. Саратов, Россия 2 Учреждение Российской академии наук Межведомственный центр аналитических исследований в области физики, химии и биологии при Президиуме РАН, г. Москва, Россия 3 ФГБОУ ВПО «Саратовский государственный аграрный университет имени Н. И. Вавилова» , г. Саратов, Россия
 Цель работы: Установление закономерностей механизма и кинетики ионного переноса в твердофазных электрохимических системах металл | твердый электролит | органический полупроводник и в «короткозамкнутых» , организованных путем непосредственного контакта катода и анода, определения возможности использования органических полупроводников (производных гетероциклических соединений фенотиазина, фульвалена, тиопирилия и пиридиния) в качестве активных электродных материалов в твердофазных преобразователях энергии.
Цель работы: Установление закономерностей механизма и кинетики ионного переноса в твердофазных электрохимических системах металл | твердый электролит | органический полупроводник и в «короткозамкнутых» , организованных путем непосредственного контакта катода и анода, определения возможности использования органических полупроводников (производных гетероциклических соединений фенотиазина, фульвалена, тиопирилия и пиридиния) в качестве активных электродных материалов в твердофазных преобразователях энергии.
 Химические формулы и названия органических полупроводников (298 К)C(CN)2 NH SI 3 S S C C SSНазвание соединения Структурная формула Темпера-ту ра плавления, К Электро- провод-н ость, См. см -1 C 16 H 14 S 4 7, 7, 8, 8-тетрациано-хин одиметан (ТЦХМ) 563 10 -8 C 12 H 9 NS фенотиазин (ФТА) 455 < 10 -8 C 12 H 9 NSI 3 трииодид фенотиазина (ФТА I 3 ) 431 0 , 3 C 14 H 8 S 4 дибензотетратиа-фульв ален (ТФ) 515 < 10 —
Химические формулы и названия органических полупроводников (298 К)C(CN)2 NH SI 3 S S C C SSНазвание соединения Структурная формула Темпера-ту ра плавления, К Электро- провод-н ость, См. см -1 C 16 H 14 S 4 7, 7, 8, 8-тетрациано-хин одиметан (ТЦХМ) 563 10 -8 C 12 H 9 NS фенотиазин (ФТА) 455 < 10 -8 C 12 H 9 NSI 3 трииодид фенотиазина (ФТА I 3 ) 431 0 , 3 C 14 H 8 S 4 дибензотетратиа-фульв ален (ТФ) 515 < 10 —
 Химические формулы и названия органических полупроводников (298 К)SC 6H 5 + 0. 5Sn. Cl 2-6 C 6H 5 S+ Cl. O 4- S S CC S SH 3C CH 3 I 3 SC 6H 5 + 0. 5Sn. Cl 2-6 H 3CCH 3 C 16 H 14 S 4 I 3 трииодид диметилдибензо-тетрат иофульвалена (ДМДБТТФ I 3 ) 526 < 10 -8 ( C 17 H 13 S ) 2 Sn. Cl 6 гексахлорстаннат 2, 6-дифенилтиопирили я (ТП 1) 2 Sn. Cl 6 550 2 10 -2 ( C 19 H 17 S ) 2 Sn. Cl 6 гексахлорстаннат 2, 6-дифенил-3, 5-димет илтиопирилия (ТП 2) 2 Sn. Cl 6 490 10 -6 C 25 H 19 S Cl. O 4 перхлорат 2, 4-дифенил-7, 8-бензо- 5, 6-дигидротиохромил ия ТП 3 Cl. O 4 486 3, 3. 10 —
Химические формулы и названия органических полупроводников (298 К)SC 6H 5 + 0. 5Sn. Cl 2-6 C 6H 5 S+ Cl. O 4- S S CC S SH 3C CH 3 I 3 SC 6H 5 + 0. 5Sn. Cl 2-6 H 3CCH 3 C 16 H 14 S 4 I 3 трииодид диметилдибензо-тетрат иофульвалена (ДМДБТТФ I 3 ) 526 < 10 -8 ( C 17 H 13 S ) 2 Sn. Cl 6 гексахлорстаннат 2, 6-дифенилтиопирили я (ТП 1) 2 Sn. Cl 6 550 2 10 -2 ( C 19 H 17 S ) 2 Sn. Cl 6 гексахлорстаннат 2, 6-дифенил-3, 5-димет илтиопирилия (ТП 2) 2 Sn. Cl 6 490 10 -6 C 25 H 19 S Cl. O 4 перхлорат 2, 4-дифенил-7, 8-бензо- 5, 6-дигидротиохромил ия ТП 3 Cl. O 4 486 3, 3. 10 —
 Химические формулы и названия органических полупроводников (298 К)+ C 6H 5S H 3C C 6H 4NO 2 Cl. O 4- -4Cl. O + C 6H 5S C 6H 4OCH 3 SC 6 H 5+ I — , I 3 — , I 5 -C 26 H 20 S NO 2 Cl. O 4 перхлорат 2-фенил-4(м-нитрофен ил)-6-метил-7, 8-бензо- 5, 6-дигидротиохромил ия ТП 4 Cl. O 4 493 5, 6. 10 -4 C 25 H 21 SOCl. O 4 перхлорат 2-фенил-4( n -метоксифе нил)-7, 8-бензо-5, 6-диг идротиохромилия ТП 5 Cl. O 4 520-523 1, 2. 10 -4 C 25 H 19 S I n иодид, (трииодид), (пентаиодид) 2, 4-дифенил-7, 8-бензо- 5, 6-дигидротиохромил ия ТП 3 I n 490-493 4, 2. 10 —
Химические формулы и названия органических полупроводников (298 К)+ C 6H 5S H 3C C 6H 4NO 2 Cl. O 4- -4Cl. O + C 6H 5S C 6H 4OCH 3 SC 6 H 5+ I — , I 3 — , I 5 -C 26 H 20 S NO 2 Cl. O 4 перхлорат 2-фенил-4(м-нитрофен ил)-6-метил-7, 8-бензо- 5, 6-дигидротиохромил ия ТП 4 Cl. O 4 493 5, 6. 10 -4 C 25 H 21 SOCl. O 4 перхлорат 2-фенил-4( n -метоксифе нил)-7, 8-бензо-5, 6-диг идротиохромилия ТП 5 Cl. O 4 520-523 1, 2. 10 -4 C 25 H 19 S I n иодид, (трииодид), (пентаиодид) 2, 4-дифенил-7, 8-бензо- 5, 6-дигидротиохромил ия ТП 3 I n 490-493 4, 2. 10 —
 Химические формулы и названия органических полупроводников (298 К)N C 6H 5 H 3CO 4H 6C(CH 2)6++C 6H 4OCH 3 5H 6C N Cl. O 4- N(CH 2) 6 CH 3 H 3C + CH 3Cl. O 4-+ CH 3 H 3C N H 3CC 30 H 50 N 2 O 2 Cl. O 4 перхлорат N , N΄ -гексаметилен-бис( 2, 6-дифенил-4-метокси- фенилпиридиния) П 1 Cl. O 4 483-492 2, 3. 10 -6 C 22 H 34 N 2 Cl. O 4 перхлорат N , N΄ -гексаметилен-бис( 2, 4, 6-триметилпиридини я) П 2 Cl. O 4 480-483 3, 0. 10 -6 6 ТКЦ — 3, 3-диэтилтиокарбоцианин; ТЦХМ — 7, 7`, 8, 8`-тетрацианохиноиметан; ТФ — 2, 2`, 6, 6` диметилдибензотетратиофульвален (Синтез осуществлялся в соответствии с методиками, разработанными Любовской Р. Б. и сотр. в ИХФ АН СССР). ТП 1; ТП 2, ТП 3, ТП 4, П 1, П 2 — (Синтез осуществлялся в соответствии с методиками, разработанными на каф. органической химии СГУ Харченко В. Г. и сотр. )
Химические формулы и названия органических полупроводников (298 К)N C 6H 5 H 3CO 4H 6C(CH 2)6++C 6H 4OCH 3 5H 6C N Cl. O 4- N(CH 2) 6 CH 3 H 3C + CH 3Cl. O 4-+ CH 3 H 3C N H 3CC 30 H 50 N 2 O 2 Cl. O 4 перхлорат N , N΄ -гексаметилен-бис( 2, 6-дифенил-4-метокси- фенилпиридиния) П 1 Cl. O 4 483-492 2, 3. 10 -6 C 22 H 34 N 2 Cl. O 4 перхлорат N , N΄ -гексаметилен-бис( 2, 4, 6-триметилпиридини я) П 2 Cl. O 4 480-483 3, 0. 10 -6 6 ТКЦ — 3, 3-диэтилтиокарбоцианин; ТЦХМ — 7, 7`, 8, 8`-тетрацианохиноиметан; ТФ — 2, 2`, 6, 6` диметилдибензотетратиофульвален (Синтез осуществлялся в соответствии с методиками, разработанными Любовской Р. Б. и сотр. в ИХФ АН СССР). ТП 1; ТП 2, ТП 3, ТП 4, П 1, П 2 — (Синтез осуществлялся в соответствии с методиками, разработанными на каф. органической химии СГУ Харченко В. Г. и сотр. )
 Фрагменты структур КПЗ и ИРС Рис. 1. проекция структуры ТЭА·(ТЦХМ)2 вдоль оси с. Рис. 3. Фрагмент структуры тетрагидротиоксантилия (ТПI 3 ). Рис. 4. Фрагмент структуры ( BEDT — TTF ) 3 · Ag x I 8 Рис 2. Проекция структуры трииодида 2, 2΄, 6, 6΄-диметилдибензотетратио- фульвалена вдоль оси с. Рис. 5. Фрагмент структуры гексахлорстаннат дибензотетратиофульвалена. 7 I I
Фрагменты структур КПЗ и ИРС Рис. 1. проекция структуры ТЭА·(ТЦХМ)2 вдоль оси с. Рис. 3. Фрагмент структуры тетрагидротиоксантилия (ТПI 3 ). Рис. 4. Фрагмент структуры ( BEDT — TTF ) 3 · Ag x I 8 Рис 2. Проекция структуры трииодида 2, 2΄, 6, 6΄-диметилдибензотетратио- фульвалена вдоль оси с. Рис. 5. Фрагмент структуры гексахлорстаннат дибензотетратиофульвалена. 7 I I
 Структурные параметры комплексов с переносом заряда В е щ е с т в о Параметры элементарной ячейки, Å Число молекул в ячейке Длины связей, Å 1 2 3 4 Д БТТФI 3 a =19, 888 b =14, 551 c = 9, 204 6 I 1 — I 4 2 , 095 I 1 – I 3 2, 017 I 5 – I 2 4, 120 I 5 — I 4 2, 941 ДБТТФ 8 (Sn. Cl 6 ) 3 a =14, 991 b =14, 991 c =27, 885 2 Sn — Cl 2, 510 Cl — Cl 4, 270 Cl — S 3, 170 ТТФ I 2 a =14, 991 b =14, 991 2 ТТФ — ТТФ 3, 55-3, 61 I — I 4, 10 ТПI 3 a = 9, 679 b = 7, 842 c = 7, 278 1 I 1 — I 2 2, 91 I 2 — I 3 2, 91 ТЭА( ТЦХМ ) 2 a = 13. 22 b = 14, 44 c = 7, 89 2 D — D 3, 34; 3, 32; 3, 33 ( ТФ ) 3 Ag х I 8 а =4, 357 в =16, 873 с =21, 115 1 I — — I — 4, 32 S — S 3, 6 Ag — Ag 3,
Структурные параметры комплексов с переносом заряда В е щ е с т в о Параметры элементарной ячейки, Å Число молекул в ячейке Длины связей, Å 1 2 3 4 Д БТТФI 3 a =19, 888 b =14, 551 c = 9, 204 6 I 1 — I 4 2 , 095 I 1 – I 3 2, 017 I 5 – I 2 4, 120 I 5 — I 4 2, 941 ДБТТФ 8 (Sn. Cl 6 ) 3 a =14, 991 b =14, 991 c =27, 885 2 Sn — Cl 2, 510 Cl — Cl 4, 270 Cl — S 3, 170 ТТФ I 2 a =14, 991 b =14, 991 2 ТТФ — ТТФ 3, 55-3, 61 I — I 4, 10 ТПI 3 a = 9, 679 b = 7, 842 c = 7, 278 1 I 1 — I 2 2, 91 I 2 — I 3 2, 91 ТЭА( ТЦХМ ) 2 a = 13. 22 b = 14, 44 c = 7, 89 2 D — D 3, 34; 3, 32; 3, 33 ( ТФ ) 3 Ag х I 8 а =4, 357 в =16, 873 с =21, 115 1 I — — I — 4, 32 S — S 3, 6 Ag — Ag 3,
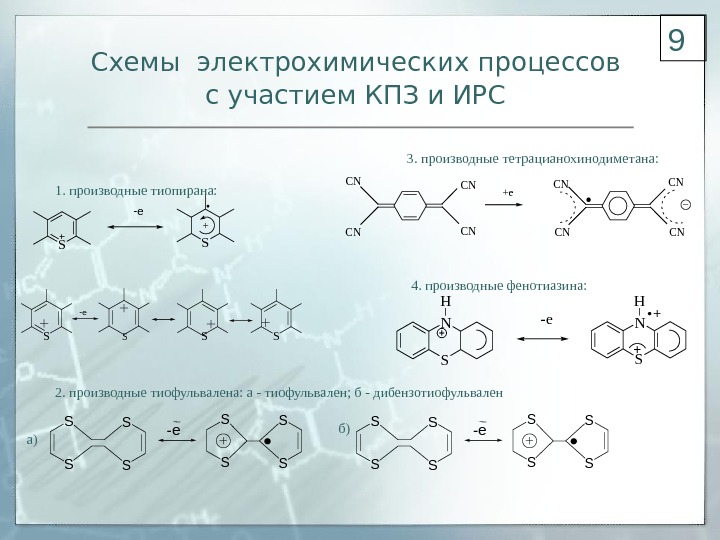
 Схемы электрохимических процессов с участием КПЗ и ИРС SSSS — e S+ -e S 1. производные тиопирана: 2. производные тиофульвалена: а — тиофульвален; б — дибензотиофульвален 3. производные тетрацианохинодиметана: CN CNCN CN +e 4. производные фенотиазина: SNH — e S S S S -e а) б)
Схемы электрохимических процессов с участием КПЗ и ИРС SSSS — e S+ -e S 1. производные тиопирана: 2. производные тиофульвалена: а — тиофульвален; б — дибензотиофульвален 3. производные тетрацианохинодиметана: CN CNCN CN +e 4. производные фенотиазина: SNH — e S S S S -e а) б)
 Уравнения температурной зависимости э. д. с. систем Na | Na + — — Al 2 O 3 | йодный КПЗ I 2 (крист. ) Е=2, 992 + 0, 00019(Т-298) (1) 2ФТА. 3 I 3 Е=2, 944 — 0, 00110(Т-298) (2) 2ФТА. I 3 Е=2, 874 + 0, 00167(Т-298) (3) ДМДБТТФ I 3 Е=2, 871 — 0, 00106(Т-298) (4)
Уравнения температурной зависимости э. д. с. систем Na | Na + — — Al 2 O 3 | йодный КПЗ I 2 (крист. ) Е=2, 992 + 0, 00019(Т-298) (1) 2ФТА. 3 I 3 Е=2, 944 — 0, 00110(Т-298) (2) 2ФТА. I 3 Е=2, 874 + 0, 00167(Т-298) (3) ДМДБТТФ I 3 Е=2, 871 — 0, 00106(Т-298) (4)
 Энергия Гиббса и направленность химических реакций в системе: Na |β-А l 2 O 3 | I 2 ; С Состав -глинозема: Na 2 O · 5 Al 2 O 3 · 0, 1 Ti. O 2 · 0, 8 Co. O. Энергия Гиббса образования Na. I , Na 2 О· 5 Al 2 O 3 , Na 2 О· 11 Al 2 O 3 : Свободная энергия Гиббса для реакций ( 7) – 62, 154 к. Дж; (8) — 88, 106 к. Дж. : Уравнение температурной зависимости э. д. с. системы Na | Na. I | I 2 :
Энергия Гиббса и направленность химических реакций в системе: Na |β-А l 2 O 3 | I 2 ; С Состав -глинозема: Na 2 O · 5 Al 2 O 3 · 0, 1 Ti. O 2 · 0, 8 Co. O. Энергия Гиббса образования Na. I , Na 2 О· 5 Al 2 O 3 , Na 2 О· 11 Al 2 O 3 : Свободная энергия Гиббса для реакций ( 7) – 62, 154 к. Дж; (8) — 88, 106 к. Дж. : Уравнение температурной зависимости э. д. с. системы Na | Na. I | I 2 :
 Переходные слои на границе йодный комплекс — -глинозем 1 2 3 4 5 6 7 8 9 10 i, A/cм м 2 1, 0 0, 8 0, 6 0, 4 0, 2 00, 81, 62, 0Е, В Рис. 1. Анодные поляризационные кривые переходных слоев на границе β-А l 2 O 3 |иодный комплекс; I 2 ; (С, Тi) при V p =2 м. В/с, Т=298 К: а) ДМДБТТФ I 3 : 1-первый цикл; 2 — после катодной поляризации; 3 — через 2 часа после катодной поляризации; б) 2ФТА · 3 I 3 : 4 — первый цикл; 5 — повторно; в) БФ I 3 : 6 — с добавкой С; 7 — на Ti ; г) ТТФ I 3 : 8 — первый цикл; д) I 2 : 9 — на С; 10 — на Ti. 12 Рис. 2. Конструкция трехэлектродной ячейки, герметичный вариант: 1 — металлическая обойма; 2, 4 — эбонитовая втулка; 3 – мембрана (керамический твердый электролит); 5 – корпус; 6 – анод; 8 – катод; 7, 9 – пуансоны; 10 – герметик.
Переходные слои на границе йодный комплекс — -глинозем 1 2 3 4 5 6 7 8 9 10 i, A/cм м 2 1, 0 0, 8 0, 6 0, 4 0, 2 00, 81, 62, 0Е, В Рис. 1. Анодные поляризационные кривые переходных слоев на границе β-А l 2 O 3 |иодный комплекс; I 2 ; (С, Тi) при V p =2 м. В/с, Т=298 К: а) ДМДБТТФ I 3 : 1-первый цикл; 2 — после катодной поляризации; 3 — через 2 часа после катодной поляризации; б) 2ФТА · 3 I 3 : 4 — первый цикл; 5 — повторно; в) БФ I 3 : 6 — с добавкой С; 7 — на Ti ; г) ТТФ I 3 : 8 — первый цикл; д) I 2 : 9 — на С; 10 — на Ti. 12 Рис. 2. Конструкция трехэлектродной ячейки, герметичный вариант: 1 — металлическая обойма; 2, 4 — эбонитовая втулка; 3 – мембрана (керамический твердый электролит); 5 – корпус; 6 – анод; 8 – катод; 7, 9 – пуансоны; 10 – герметик.
 Электрические характеристики переходных слоев границы — Al 2 O 3 | I 2 , иодный комплекс Q , Кл№ пп Система Δ Е пка анод. , В 1 Ti | Na | — Al 2 O 3 | C | Ti — — 0 , 19-0 , 25 2 Ti | Na | -Al 2 O 3 | I 2 , C | Ti 0 , 483 0 , 051 0 , 17-0 , 27 3 (2)(после гальваностатич. катод. вкл. Q =10 -2 -10 -4 Кл) 0, 776 0, 036 0, 14-0, 11 4 Ti | Na | -Al 2 O 3 | I 2 | Ti 1, 769 0, 510 0, 13 5 Ti | Na | -l 2 O 3 | 2 ФТА. 3I 3 | Ti 0, 448 0, 400 0, 50-0, 56 6 (5)(после гальваностатич. катодного включения Q =10 -2 Кл) 0, 500 — 0, 81-0, 21 7 Ti | Na | -l 2 O 3 | 2 ФТА. 3I 3 , С | Ti 0, 486 0, 030 0, 54 8 Ti | Na | -Al 2 O 3 | ДМДБТТФ I 3 | Ti 0, 301 0, 068 1, 00-1, 20 9 (9)(после гальваностатич. катодного включения Q =10 -2 Кл) 0, 510 — 0, 30 10 Ti | Na | — Al 2 O 3 | ДМДБТТФ I 3, С | Ti 0, 382 0, 120 0, 19 11 (11) (после гальваностатич. катодного включения Q =10 -2 Кл) 0, 695 — 0, 12 12 (12) После выдержки 2 часа 0, 450 — 0,
Электрические характеристики переходных слоев границы — Al 2 O 3 | I 2 , иодный комплекс Q , Кл№ пп Система Δ Е пка анод. , В 1 Ti | Na | — Al 2 O 3 | C | Ti — — 0 , 19-0 , 25 2 Ti | Na | -Al 2 O 3 | I 2 , C | Ti 0 , 483 0 , 051 0 , 17-0 , 27 3 (2)(после гальваностатич. катод. вкл. Q =10 -2 -10 -4 Кл) 0, 776 0, 036 0, 14-0, 11 4 Ti | Na | -Al 2 O 3 | I 2 | Ti 1, 769 0, 510 0, 13 5 Ti | Na | -l 2 O 3 | 2 ФТА. 3I 3 | Ti 0, 448 0, 400 0, 50-0, 56 6 (5)(после гальваностатич. катодного включения Q =10 -2 Кл) 0, 500 — 0, 81-0, 21 7 Ti | Na | -l 2 O 3 | 2 ФТА. 3I 3 , С | Ti 0, 486 0, 030 0, 54 8 Ti | Na | -Al 2 O 3 | ДМДБТТФ I 3 | Ti 0, 301 0, 068 1, 00-1, 20 9 (9)(после гальваностатич. катодного включения Q =10 -2 Кл) 0, 510 — 0, 30 10 Ti | Na | — Al 2 O 3 | ДМДБТТФ I 3, С | Ti 0, 382 0, 120 0, 19 11 (11) (после гальваностатич. катодного включения Q =10 -2 Кл) 0, 695 — 0, 12 12 (12) После выдержки 2 часа 0, 450 — 0,
 1Е , В i , м А / с м 2 — 1 , 6- 0 , 8 0 , 40 , 8 8 , 0 4 , 0 1 2 3 4 ik. Поляризационные кривые границы: а: ФТА I 3 / — Al 2 O 3 ; б, в: ДМДБТТФ I х / β- Al 2 O 3 а б в а — ФТА I 3 / — Al 2 O 3 при Vp , м. В/с: 1 – 1; 2 – 2; 3– 4, 4 – 8. б — катодная область поляризации; в — анодная область поляризации ДМДБТТФ I х / β- Al 2 O 3 при х=3 кривые 1, 2, 3; при х=5 кривые 1’, 2’, 3’; при V p , м. В/с: 1, 1’; – 2; 2, 2’ – 4; 3, 3’ – 8; . 4 — I 2 , C | β- Al 2 O 3 , V p =2 м. В/с
1Е , В i , м А / с м 2 — 1 , 6- 0 , 8 0 , 40 , 8 8 , 0 4 , 0 1 2 3 4 ik. Поляризационные кривые границы: а: ФТА I 3 / — Al 2 O 3 ; б, в: ДМДБТТФ I х / β- Al 2 O 3 а б в а — ФТА I 3 / — Al 2 O 3 при Vp , м. В/с: 1 – 1; 2 – 2; 3– 4, 4 – 8. б — катодная область поляризации; в — анодная область поляризации ДМДБТТФ I х / β- Al 2 O 3 при х=3 кривые 1, 2, 3; при х=5 кривые 1’, 2’, 3’; при V p , м. В/с: 1, 1’; – 2; 2, 2’ – 4; 3, 3’ – 8; . 4 — I 2 , C | β- Al 2 O 3 , V p =2 м. В/с
 Рис. 2. Шрихдифрактограммы электрода 2ФТА · 3 I 2 : 1 – исходный 2ФТА · 3 I 2 ; 2 – разряженный до 50% (инертная атмосфера); 3 – разряженный до 50% (воздушная атмосфера)Рис. 1. Разрядные кривые систем Ti | Na ( Hg )| — Al 2 O 3 |2ФТА · n. I 2 , С| Ti , 298К: 1- n =3, i =0, 05 м. А/см 2 ; 2 – n =3, i =2, 5 м. А/см 2 ; 3 — n =5, i =1, 0 м. А/см 2 ; 4 — n =5, i =0, 1 м. А/см 2 (Т=273К). 1568101214162Q хх х х ххх х
Рис. 2. Шрихдифрактограммы электрода 2ФТА · 3 I 2 : 1 – исходный 2ФТА · 3 I 2 ; 2 – разряженный до 50% (инертная атмосфера); 3 – разряженный до 50% (воздушная атмосфера)Рис. 1. Разрядные кривые систем Ti | Na ( Hg )| — Al 2 O 3 |2ФТА · n. I 2 , С| Ti , 298К: 1- n =3, i =0, 05 м. А/см 2 ; 2 – n =3, i =2, 5 м. А/см 2 ; 3 — n =5, i =1, 0 м. А/см 2 ; 4 — n =5, i =0, 1 м. А/см 2 (Т=273К). 1568101214162Q хх х х ххх х
 Изменение сопротивления продукта реакции от емкости: Na /β- Al 2 O 3 / ДМДБТТФ I 3. 75 70 65 60 0 10 20 30 40 2 52 01 51 05 3 2 1степень разряженности: 1 – 45%, 2 – 30%, 3 – исходный. Штрихдифрактограмма электрода ДМДБТТФ I 3 , 2 θ ° 16 * **
Изменение сопротивления продукта реакции от емкости: Na /β- Al 2 O 3 / ДМДБТТФ I 3. 75 70 65 60 0 10 20 30 40 2 52 01 51 05 3 2 1степень разряженности: 1 – 45%, 2 – 30%, 3 – исходный. Штрихдифрактограмма электрода ДМДБТТФ I 3 , 2 θ ° 16 * **
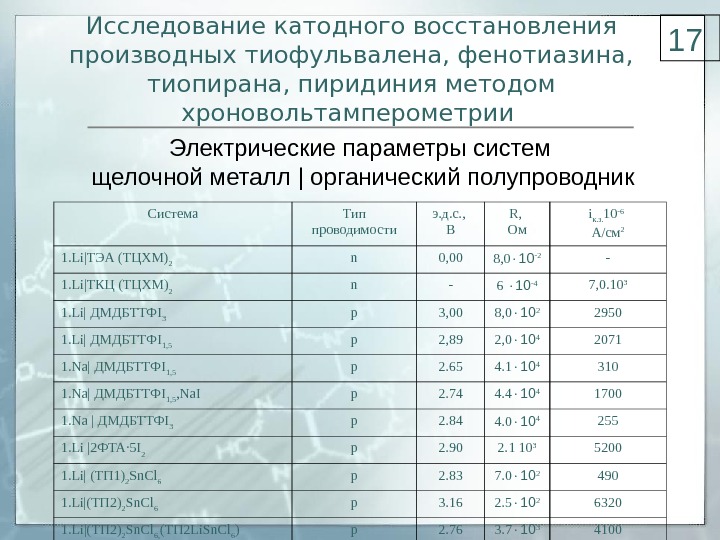
 Исследование катодного восстановления производных тиофульвалена, фенотиазина, тиопирана, пиридиния методом хроновольтамперометрии Система Тип проводимости э. д. с. , В R, Ом i к. з. 10 -6 А / см 2 1. Li | ТЭА (ТЦХМ) 2 n 0, 00 8, 0 10 -2 — 1. Li | ТКЦ (ТЦХМ) 2 n — 6 10 -4 7, 0. 10 3 1. Li| ДМДБТТФ I 3 p 3, 00 8, 0 10 2 2950 1. Li| ДМДБТТФ I 1, 5 p 2, 89 2, 0 10 4 2071 1. Na | ДМДБТТФ I 1 , 5 р 2. 65 4. 1 10 4 310 1. Na | ДМДБТТФ I 1 , 5 , Na. I р 2. 74 4. 4 10 4 17 00 1. Na | ДМДБТТФ I 3 р 2. 84 4. 0 10 4 255 1. Li | 2ФТА· 5 I 2 р 2. 90 2. 1 10 3 5200 1. Li| (ТП 1) 2 Sn. Cl 6 p 2. 83 7. 0 10 2 490 1. Li|(ТП 2) 2 Sn. Cl 6 р 3. 16 2. 5 10 2 632 0 1. Li | (ТП 2) 2 Sn. Cl 6, (ТП 2 Li. Sn. Cl 6 ) p 2. 76 3. 7 10 3 4100Электрические параметры систем щелочной металл | органический полупроводник
Исследование катодного восстановления производных тиофульвалена, фенотиазина, тиопирана, пиридиния методом хроновольтамперометрии Система Тип проводимости э. д. с. , В R, Ом i к. з. 10 -6 А / см 2 1. Li | ТЭА (ТЦХМ) 2 n 0, 00 8, 0 10 -2 — 1. Li | ТКЦ (ТЦХМ) 2 n — 6 10 -4 7, 0. 10 3 1. Li| ДМДБТТФ I 3 p 3, 00 8, 0 10 2 2950 1. Li| ДМДБТТФ I 1, 5 p 2, 89 2, 0 10 4 2071 1. Na | ДМДБТТФ I 1 , 5 р 2. 65 4. 1 10 4 310 1. Na | ДМДБТТФ I 1 , 5 , Na. I р 2. 74 4. 4 10 4 17 00 1. Na | ДМДБТТФ I 3 р 2. 84 4. 0 10 4 255 1. Li | 2ФТА· 5 I 2 р 2. 90 2. 1 10 3 5200 1. Li| (ТП 1) 2 Sn. Cl 6 p 2. 83 7. 0 10 2 490 1. Li|(ТП 2) 2 Sn. Cl 6 р 3. 16 2. 5 10 2 632 0 1. Li | (ТП 2) 2 Sn. Cl 6, (ТП 2 Li. Sn. Cl 6 ) p 2. 76 3. 7 10 3 4100Электрические параметры систем щелочной металл | органический полупроводник
 Система Тип проводимости э. д. с. , В R, Ом i к. з. 10 -6 А / см 2 1. Li | ТП 3 Cl. O 4 р 3. 25 6. 0 10 2 170 0 1. Li | ТП 3I | Li р 2, 89 2, 0. 10 4 2070 1. Na| ТП 3I р 2, 65 4, 1. 10 4 31 00 1. Na|Na. I| ТП 3I р 2, 74 4, 4. 10 4 17 00 1. Na | ТП 3I 5 р 2, 84 4, 0. 10 4 225 0 1. Na|Na. I| ТП 3I 5 р 2, 81 3, 1. 10 4 21 00 1. Li | ТП 3I 3 р 3, 00 8, 0. 10 4 2950 1. Li | ТП 4Cl. O 4 р 2, 80 1, 2. 10 3 2250 1. Li | ТП 4 Cl. O 4 , (Li. Cl. O 4 ) р 3. 19 2. 0· 10 2 550 0 1. Li | П 1Cl. O 4 р 2, 30 2, 0· 10 6 1150 1. Li | П 2Cl. O 4 р 2, 50 2, 2· 10 6 1230 Примечание. ТКЦ 3, 3-диэтилтиокарбоцианин; ТЭА – триэтиламин.
Система Тип проводимости э. д. с. , В R, Ом i к. з. 10 -6 А / см 2 1. Li | ТП 3 Cl. O 4 р 3. 25 6. 0 10 2 170 0 1. Li | ТП 3I | Li р 2, 89 2, 0. 10 4 2070 1. Na| ТП 3I р 2, 65 4, 1. 10 4 31 00 1. Na|Na. I| ТП 3I р 2, 74 4, 4. 10 4 17 00 1. Na | ТП 3I 5 р 2, 84 4, 0. 10 4 225 0 1. Na|Na. I| ТП 3I 5 р 2, 81 3, 1. 10 4 21 00 1. Li | ТП 3I 3 р 3, 00 8, 0. 10 4 2950 1. Li | ТП 4Cl. O 4 р 2, 80 1, 2. 10 3 2250 1. Li | ТП 4 Cl. O 4 , (Li. Cl. O 4 ) р 3. 19 2. 0· 10 2 550 0 1. Li | П 1Cl. O 4 р 2, 30 2, 0· 10 6 1150 1. Li | П 2Cl. O 4 р 2, 50 2, 2· 10 6 1230 Примечание. ТКЦ 3, 3-диэтилтиокарбоцианин; ТЭА – триэтиламин.
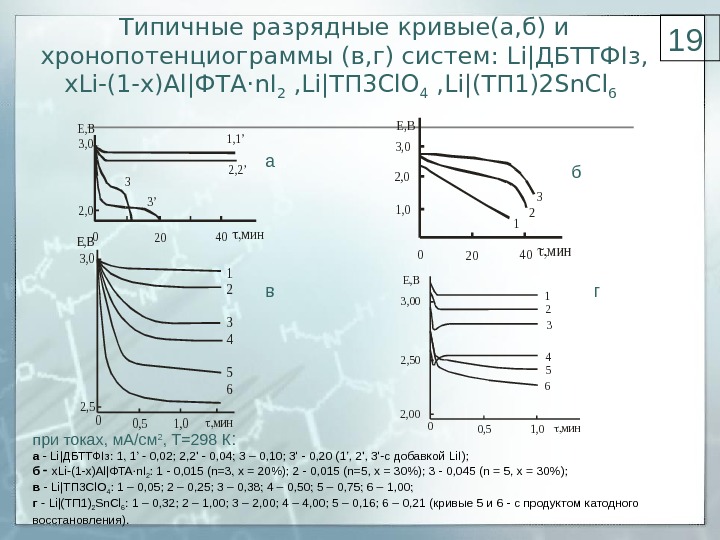
 Типичные разрядные кривые(а, б) и хронопотенциограммы (в, г) систем: Li |ДБТТФ I з, x. Li ( 1 -х)А l |ФТА ·n. I 2 , Li |ТП 3 Cl. O 4 , Li |(ТП 1)2 Sn. Cl 6 Е, В 2, 0 3, 0 t, мин 02040 1, 1’ 2, 2’ 3 3’ Е, В 2, 0 2 3, 0 3 t, мин 02040 1, 0 1 Е, В 2, 5 3, 0 t, мин 00, 51, 0 1 2 3 4 5 6 Е, В 2, 00 3, 00 2, 50 t, мин 00, 51, 0 1 2 3 4 5 6 при токах, м. А/см 2 , Т=298 К : а Li |ДБТТФ I з: 1, 1’ 0, 02; 2, 2′ 0, 04; 3 – 0, 10; 3′ 0, 20 (1’, 2′, 3′ с добавкой Li. I ); б x. Li (1-х)А l |ФТА · n. I 2 : 1 0, 015 ( n =3, x = 20%); 2 0, 015 ( n =5, x = 30%); 3 0, 045 ( n = 5, х = 30%); в Li |ТП 3 Cl. O 4 : 1 – 0, 05; 2 – 0, 25; 3 – 0, 38; 4 – 0, 50; 5 – 0, 75; 6 – 1, 00; г Li |(ТП 1) 2 Sn. Cl 6 : 1 – 0, 32; 2 – 1, 00; 3 – 2, 00; 4 – 4, 00; 5 – 0, 16; 6 – 0, 21 (кривые 5 и 6 — с продуктом катодного восстановления). а б в г
Типичные разрядные кривые(а, б) и хронопотенциограммы (в, г) систем: Li |ДБТТФ I з, x. Li ( 1 -х)А l |ФТА ·n. I 2 , Li |ТП 3 Cl. O 4 , Li |(ТП 1)2 Sn. Cl 6 Е, В 2, 0 3, 0 t, мин 02040 1, 1’ 2, 2’ 3 3’ Е, В 2, 0 2 3, 0 3 t, мин 02040 1, 0 1 Е, В 2, 5 3, 0 t, мин 00, 51, 0 1 2 3 4 5 6 Е, В 2, 00 3, 00 2, 50 t, мин 00, 51, 0 1 2 3 4 5 6 при токах, м. А/см 2 , Т=298 К : а Li |ДБТТФ I з: 1, 1’ 0, 02; 2, 2′ 0, 04; 3 – 0, 10; 3′ 0, 20 (1’, 2′, 3′ с добавкой Li. I ); б x. Li (1-х)А l |ФТА · n. I 2 : 1 0, 015 ( n =3, x = 20%); 2 0, 015 ( n =5, x = 30%); 3 0, 045 ( n = 5, х = 30%); в Li |ТП 3 Cl. O 4 : 1 – 0, 05; 2 – 0, 25; 3 – 0, 38; 4 – 0, 50; 5 – 0, 75; 6 – 1, 00; г Li |(ТП 1) 2 Sn. Cl 6 : 1 – 0, 32; 2 – 1, 00; 3 – 2, 00; 4 – 4, 00; 5 – 0, 16; 6 – 0, 21 (кривые 5 и 6 — с продуктом катодного восстановления). а б в г
 2 3 2 1 Q кл, 00, 040, 08 E/ Q, В/кл. Рис. 1. Зависимость наклона гальваностатических кривых от количества пропущенного электричества в системах: 1 — Li — Al |2Ф TA • 5 I 2 ; 2 — Li — Al | ДБТТФ I з. Сплав: 30% Li -70% Al 01, 00, 5 2, 60 2, 55 2, 50 Е, В I II lg[I-(t/t) ]1/2 Рис. 2. Хронопотенциограммы в координатах Делахея-Берзинса системы Li |ТП 3 Cl. O 4 с продуктом разряда при токе 0, 16 м. А/см 2 . 2 0 Δ Е >> RT / n.
2 3 2 1 Q кл, 00, 040, 08 E/ Q, В/кл. Рис. 1. Зависимость наклона гальваностатических кривых от количества пропущенного электричества в системах: 1 — Li — Al |2Ф TA • 5 I 2 ; 2 — Li — Al | ДБТТФ I з. Сплав: 30% Li -70% Al 01, 00, 5 2, 60 2, 55 2, 50 Е, В I II lg[I-(t/t) ]1/2 Рис. 2. Хронопотенциограммы в координатах Делахея-Берзинса системы Li |ТП 3 Cl. O 4 с продуктом разряда при токе 0, 16 м. А/см 2 . 2 0 Δ Е >> RT / n.
 Исследование катодного восстановления систем щелочной металл/органический полупроводник методом циклической вольтамперометрии 0 , 10 0 , 0 5 — 0 , 10 4 0, 3 0, 2 0, 1 0, E , B i a 3 1 2 Рис. 2 Циклические поляризационных кривые системы Li/ТП 4Сl. O 4 при скорости развертки В/с: 1 – 0, 004; 2 – 0, 008; 3 – 0, 02 0, 10 0, 15 0, 05 -0, 10 E, B ia 2, 52, 0 12345 Рис. 3. Циклические поляризационные кривые системы Li/П 1Сl. O 4 при скорости развертки В/с: 1-0, 001; 2-0, 002; 3-0, 004; Рис. 1. Конструкция корпуса трехэлектродной ячейки, герметичный вариант: 1, 6 – пуансоны (токоотводы); 2 – корпус; 3 – электрод сравнения; 4, 5 – анодный и катодный материалы; 7 – герметизирующая прокладка. 2 1 I a p / I к p <1 Ох+ne↔Rеd↔М Лимитирующей стадия -перенос заряда
Исследование катодного восстановления систем щелочной металл/органический полупроводник методом циклической вольтамперометрии 0 , 10 0 , 0 5 — 0 , 10 4 0, 3 0, 2 0, 1 0, E , B i a 3 1 2 Рис. 2 Циклические поляризационных кривые системы Li/ТП 4Сl. O 4 при скорости развертки В/с: 1 – 0, 004; 2 – 0, 008; 3 – 0, 02 0, 10 0, 15 0, 05 -0, 10 E, B ia 2, 52, 0 12345 Рис. 3. Циклические поляризационные кривые системы Li/П 1Сl. O 4 при скорости развертки В/с: 1-0, 001; 2-0, 002; 3-0, 004; Рис. 1. Конструкция корпуса трехэлектродной ячейки, герметичный вариант: 1, 6 – пуансоны (токоотводы); 2 – корпус; 3 – электрод сравнения; 4, 5 – анодный и катодный материалы; 7 – герметизирующая прокладка. 2 1 I a p / I к p <1 Ох+ne↔Rеd↔М Лимитирующей стадия -перенос заряда
![lg[-lg(1 )] 0 -1 -2 -3 1 234 5 6 0, 5 1, 0 lgt, lg[-lg(1 )] 0 -1 -2 -3 1 234 5 6 0, 5 1, 0 lgt,](/docs//prezentaciya_dlya_mihaylovoy_a.m._images/prezentaciya_dlya_mihaylovoy_a.m._21.jpg) lg[-lg(1 )] 0 -1 -2 -3 1 234 5 6 0, 5 1, 0 lgt, мин. Рис. 1. Зависимость константы скорости электрохимической реакции от потенциала системы Li |БФIз. lg. K E , В- 3, 0 -2, 0 -1, 0 3, 4 3, 2 3, 0 2, 8 Рис. 2. Приложимость уравнения Ерофеева-Колмогорова-Аврами к кинетике твердофазных электрохимических реакций: 1 – Li — Al /ФТА I 5; 2-β- Al 2 O 3 /ФТА I 5 ; 3– Li /ДМДБТТФ, 10% C ; 4– i /ТФ 2 SOCl 2 ; 5 – Li / ТП 3 Cl. O 4 ; 6 — Li /ТП 3 Sn. Cl 6. Коэффициент К и n уравнения Ерофеева-Колмогорова-Авра ми в системах с литиевым анодом Система K , мин -1 n Li| ТФ I 3 3, 8· 10 -2 1, 22 Li| ТФ SOCl 2 2, 4· 10 -2 1, 21 Li| ТФ SOCl 2 2, 1· 10 -2 1, 21 Li| ДБТТФ I 3 , 10% С 1, 5· 10 -2 1, 05 Li |ДБТТФ I 3 , 10%С , 2% Li. I 3 , 8 · 10 -2 1, 22 Li| ДБТТФ 8 (Sn. Cl 6 ) 3 , 10% С 1 , 2 · 10 -2 1, 03 Li-Al|2 ФТА· 5I 5 1, 1· 10 -2 1, 20 Li |(ТП 1) 2 Sn. Cl 6 2 , 4· 10 -3 1 , 20 Li |(ТП 2) 2 Sn. Cl 6 2 , 8· 10 -3 1 , 27 Li| ТП 3 Cl. O 4 3, 1· 10 -3 1,
lg[-lg(1 )] 0 -1 -2 -3 1 234 5 6 0, 5 1, 0 lgt, мин. Рис. 1. Зависимость константы скорости электрохимической реакции от потенциала системы Li |БФIз. lg. K E , В- 3, 0 -2, 0 -1, 0 3, 4 3, 2 3, 0 2, 8 Рис. 2. Приложимость уравнения Ерофеева-Колмогорова-Аврами к кинетике твердофазных электрохимических реакций: 1 – Li — Al /ФТА I 5; 2-β- Al 2 O 3 /ФТА I 5 ; 3– Li /ДМДБТТФ, 10% C ; 4– i /ТФ 2 SOCl 2 ; 5 – Li / ТП 3 Cl. O 4 ; 6 — Li /ТП 3 Sn. Cl 6. Коэффициент К и n уравнения Ерофеева-Колмогорова-Авра ми в системах с литиевым анодом Система K , мин -1 n Li| ТФ I 3 3, 8· 10 -2 1, 22 Li| ТФ SOCl 2 2, 4· 10 -2 1, 21 Li| ТФ SOCl 2 2, 1· 10 -2 1, 21 Li| ДБТТФ I 3 , 10% С 1, 5· 10 -2 1, 05 Li |ДБТТФ I 3 , 10%С , 2% Li. I 3 , 8 · 10 -2 1, 22 Li| ДБТТФ 8 (Sn. Cl 6 ) 3 , 10% С 1 , 2 · 10 -2 1, 03 Li-Al|2 ФТА· 5I 5 1, 1· 10 -2 1, 20 Li |(ТП 1) 2 Sn. Cl 6 2 , 4· 10 -3 1 , 20 Li |(ТП 2) 2 Sn. Cl 6 2 , 8· 10 -3 1 , 27 Li| ТП 3 Cl. O 4 3, 1· 10 -3 1,
 Топоэлектрохимические процессы, протекающие на границах лития с органическим полупроводником. Основные уравнения модели ТОПЗntеγ 1 t n ln )]1ln(ln[ RT n. A nen B o. L η 2 ξση i Fz ti. ML ) nte 1(L t. M z. Fr 0 M tz. Fr L 0 Mz. Fr L t 0 Loη ξσ 2η i 1)2 i(L M z. F t 2) t (2 i 2 1 z. F МL t lg 1 n F 2F RTLi.
Топоэлектрохимические процессы, протекающие на границах лития с органическим полупроводником. Основные уравнения модели ТОПЗntеγ 1 t n ln )]1ln(ln[ RT n. A nen B o. L η 2 ξση i Fz ti. ML ) nte 1(L t. M z. Fr 0 M tz. Fr L 0 Mz. Fr L t 0 Loη ξσ 2η i 1)2 i(L M z. F t 2) t (2 i 2 1 z. F МL t lg 1 n F 2F RTLi.
 Катодное гальваностатическое включение системы прямого контакта Li|(ТП 2)2Sn. Cl 64030201002 Q 0 Рис. 1 Рентгеновские штрихдиффрактограмы: 1 – исходный (ТП 2)2 Sn. Cl 6 ; 2 – с продуктом катодного гальваностатического включения системы Li |(ТП 2)2 Sn. Cl 6 t, мин 0, 5 1, 0 0, 51, 0 1, 5 2, 0 2, 5 3, 0 Е, В 1 2 3 4 5 6 Рис. 2. Кривые Е– t катодного гальваностатического включения системы Li / (ТП 2)2 Sn. Cl 6 при 298К и плотностях тока (А/см 2 ): 1 – 0, 016; 2 – 0, 039; 3 – 0, 046; 4 – 0, 110; 5 – 0, 140; 6 – 0, 175.
Катодное гальваностатическое включение системы прямого контакта Li|(ТП 2)2Sn. Cl 64030201002 Q 0 Рис. 1 Рентгеновские штрихдиффрактограмы: 1 – исходный (ТП 2)2 Sn. Cl 6 ; 2 – с продуктом катодного гальваностатического включения системы Li |(ТП 2)2 Sn. Cl 6 t, мин 0, 5 1, 0 0, 51, 0 1, 5 2, 0 2, 5 3, 0 Е, В 1 2 3 4 5 6 Рис. 2. Кривые Е– t катодного гальваностатического включения системы Li / (ТП 2)2 Sn. Cl 6 при 298К и плотностях тока (А/см 2 ): 1 – 0, 016; 2 – 0, 039; 3 – 0, 046; 4 – 0, 110; 5 – 0, 140; 6 – 0, 175.
 Катодное гальваностатическое включение системы прямого контакта Li|(ТП 2) 2 Sn. Cl 6010 1 1, 5 0, 5 2030405060708090t, c , В 1 23 5 6 4 Рис. 1. Зависимость ή – t катодного гальваностатического включения системы Li / (ТП 2) 2 Sn. Cl 6 при 298К и плотностях тока (А/см 2 ): 1 – 0, 016; 2 – 0, 039; 3 – 0, 046; 4 – 0, 110; 5 – 0, 140; 6 – 0, 175. Рис. 2. Зависимость ( a ): – t ; (б): tlg)]1lg(lg[ для катодного гальваностатиче ского включения системы Li / (ТП) 2 Sn. Cl 6 при 298К и плотностях тока (А/см 2 ): 1– 0, 016; 2 – 0, 039; 3 – 0, 046; 4 – 0, 110; 5 – 0, 140; 6 – 0, 175. а б 2 5 0 10 20 30 40 50 60 70 80 90 t, c-1 -2 -3 -4 -5 -6 0, 5 l g [ — l g ( 1 ) ] 0 — 1 — 2 — 3 12 34 56 0 , 5 1 , 0l g t , м и н
Катодное гальваностатическое включение системы прямого контакта Li|(ТП 2) 2 Sn. Cl 6010 1 1, 5 0, 5 2030405060708090t, c , В 1 23 5 6 4 Рис. 1. Зависимость ή – t катодного гальваностатического включения системы Li / (ТП 2) 2 Sn. Cl 6 при 298К и плотностях тока (А/см 2 ): 1 – 0, 016; 2 – 0, 039; 3 – 0, 046; 4 – 0, 110; 5 – 0, 140; 6 – 0, 175. Рис. 2. Зависимость ( a ): – t ; (б): tlg)]1lg(lg[ для катодного гальваностатиче ского включения системы Li / (ТП) 2 Sn. Cl 6 при 298К и плотностях тока (А/см 2 ): 1– 0, 016; 2 – 0, 039; 3 – 0, 046; 4 – 0, 110; 5 – 0, 140; 6 – 0, 175. а б 2 5 0 10 20 30 40 50 60 70 80 90 t, c-1 -2 -3 -4 -5 -6 0, 5 l g [ — l g ( 1 ) ] 0 — 1 — 2 — 3 12 34 56 0 , 5 1 , 0l g t , м и н
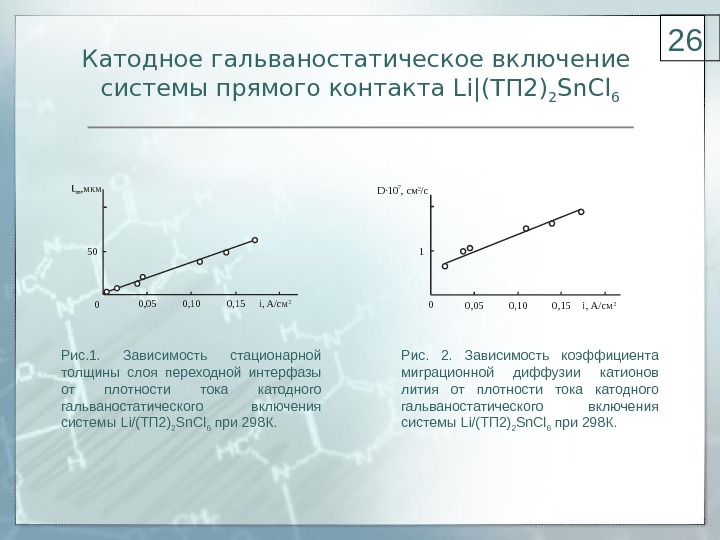
 Катодное гальваностатическое включение системы прямого контакта Li|(ТП 2) 2 Sn. Cl 6 i , мкм i, A/c м 250 0, 05 0, 10 0, 15 0 Рис. 1. Зависимость стационарной толщины слоя переходной интерфазы от плотности тока катодного гальваностатического включения системы Li /(ТП 2) 2 Sn. Cl 6 при 298К. i, A/c м 21 0 0, 05 0, 10 0, 15D 10 , см /с. 7 2 Рис. 2. Зависимость коэффициента миграционной диффузии катионов лития от плотности тока катодного гальваностатического включения системы Li /(ТП 2) 2 Sn. Cl 6 при 298К.
Катодное гальваностатическое включение системы прямого контакта Li|(ТП 2) 2 Sn. Cl 6 i , мкм i, A/c м 250 0, 05 0, 10 0, 15 0 Рис. 1. Зависимость стационарной толщины слоя переходной интерфазы от плотности тока катодного гальваностатического включения системы Li /(ТП 2) 2 Sn. Cl 6 при 298К. i, A/c м 21 0 0, 05 0, 10 0, 15D 10 , см /с. 7 2 Рис. 2. Зависимость коэффициента миграционной диффузии катионов лития от плотности тока катодного гальваностатического включения системы Li /(ТП 2) 2 Sn. Cl 6 при 298К.
 Некоторые параметры исследуемых систем прямого контакта литий|органический полупроводник по данным катодной хронопотенциометрии
Некоторые параметры исследуемых систем прямого контакта литий|органический полупроводник по данным катодной хронопотенциометрии
 Предполагаемый механизм катодного процесса. S SC 6H 5C 6H 5 + + Sn. Cl 62-+ 2e _ S SC 6H 5C 6H 5 Sn. Cl 62-+ H 3CCH 3H 3C CH 3 6 Sn. Cl 2 Li 2 6 Sn. Cl. Li
Предполагаемый механизм катодного процесса. S SC 6H 5C 6H 5 + + Sn. Cl 62-+ 2e _ S SC 6H 5C 6H 5 Sn. Cl 62-+ H 3CCH 3H 3C CH 3 6 Sn. Cl 2 Li 2 6 Sn. Cl. Li
 Механизм образования переходного слоя короткозамкнутой системы литий-органический полупроводник 2 Li + + 2ē, (квантово-химический расчет функционала плотности в варианте В 3LYP) S +P h 2 S P h + 2 L i I+ 2 e_ I — I SP h 2 I I I — P h I I – катион органической соли; II – радикал ; III — димер ; Ph = C 6 H 5.
Механизм образования переходного слоя короткозамкнутой системы литий-органический полупроводник 2 Li + + 2ē, (квантово-химический расчет функционала плотности в варианте В 3LYP) S +P h 2 S P h + 2 L i I+ 2 e_ I — I SP h 2 I I I — P h I I – катион органической соли; II – радикал ; III — димер ; Ph = C 6 H 5.
 Температурная зависимость электропроводности ( σ 0 ) синтезированных продуктов (ТФI 1, 5 — Li. I) Т =(5, 51 9, 04)х10 4 exp -(0, 275 0, 044)/k. Т ] (1) (ТФI — Li. I) Т =(0, 64 1, 41)х10 5 exp -(0, 281 0, 059)/k. Т ] (2) (ТФI 1, 5 -Na. I) Т =(6, 10 3, 76)х10 3 exp -(0, 184 0, 016)/k. Т ] (3) (ТФI — Na. I) Т =(1, 04 3, 32)х10 7 exp -(0, 396 0, 085)/k. Т ] (4) (ТП 1I — Li. I) Т =(0, 47 1, 25)х10 11 exp -(0, 587 0, 071)/k. Т ] (5) (ТП 1I — Na. I) Т =(0, 37 1, 95)х10 13 exp -(0, 703 0, 059)/k. Т ] (6)
Температурная зависимость электропроводности ( σ 0 ) синтезированных продуктов (ТФI 1, 5 — Li. I) Т =(5, 51 9, 04)х10 4 exp -(0, 275 0, 044)/k. Т ] (1) (ТФI — Li. I) Т =(0, 64 1, 41)х10 5 exp -(0, 281 0, 059)/k. Т ] (2) (ТФI 1, 5 -Na. I) Т =(6, 10 3, 76)х10 3 exp -(0, 184 0, 016)/k. Т ] (3) (ТФI — Na. I) Т =(1, 04 3, 32)х10 7 exp -(0, 396 0, 085)/k. Т ] (4) (ТП 1I — Li. I) Т =(0, 47 1, 25)х10 11 exp -(0, 587 0, 071)/k. Т ] (5) (ТП 1I — Na. I) Т =(0, 37 1, 95)х10 13 exp -(0, 703 0, 059)/k. Т ] (6)
 Твердофазный и электрохимический синтез ТЭЛ Рис. 2. Частотная зависимость годографа 1/ώ C S — R S продукта электролиза в ячейке Na | β- Al 2 O 3 |ТФ I 3. 0 1, 2 2, 4 1, 22, 43, 6 (1/ к. Омc )10 , w s -3 s R 10 , к. Ом -3. (1/ w C )10 -4 S S 1/ к. Ом w C , 1, 3(1)(2) 0 0, 5 1, 0 1, 5 5, 23, 92, 61, 3 12 R 10 , Ом s. -4R 10 , Ом s. — 250 Рис. 1. Частотная зависимость годографа 1/ώ C S — R S систем 1 – ТФ I 3 — Li. I ; 2 –ТФ I 3 — Na. I (твердофазный синтез)
Твердофазный и электрохимический синтез ТЭЛ Рис. 2. Частотная зависимость годографа 1/ώ C S — R S продукта электролиза в ячейке Na | β- Al 2 O 3 |ТФ I 3. 0 1, 2 2, 4 1, 22, 43, 6 (1/ к. Омc )10 , w s -3 s R 10 , к. Ом -3. (1/ w C )10 -4 S S 1/ к. Ом w C , 1, 3(1)(2) 0 0, 5 1, 0 1, 5 5, 23, 92, 61, 3 12 R 10 , Ом s. -4R 10 , Ом s. — 250 Рис. 1. Частотная зависимость годографа 1/ώ C S — R S систем 1 – ТФ I 3 — Li. I ; 2 –ТФ I 3 — Na. I (твердофазный синтез)
 Параметры общей ( общ. ) и электронной ( е ) проводимостей продуктов электрохимических реакций короткозамкнутых систем (298 К) Система общ. . , См/см е , См/см M х R y I z М-Li, Na; R-производные ФТА; 0, 25<х<0, 75; 3<у<5; 0, 5<z<0, 75 (0, 7 1, 7) 10 -3 (Li + ) (1, 2 5, 0) 10 -4 (Na + ) 5 10 -5 M x R y I z R – производные ТФ; М — Li, Na, 1<х<1, 5 (10 -З 10 -4 ) (Na + ) 10 — 3 2, 9 10 -2 (Li + ) (5, 2 6, 1) 10 -4 M x RI x +1 R – производные ТП М — Li, Na; 1<x<4 (0, 7 3, 0) 10 -2 ( Li + ) ( 10 — 3 0, 9 10 -5 ) (Na + ) 10 -4 10 —
Параметры общей ( общ. ) и электронной ( е ) проводимостей продуктов электрохимических реакций короткозамкнутых систем (298 К) Система общ. . , См/см е , См/см M х R y I z М-Li, Na; R-производные ФТА; 0, 25<х<0, 75; 3<у<5; 0, 5<z<0, 75 (0, 7 1, 7) 10 -3 (Li + ) (1, 2 5, 0) 10 -4 (Na + ) 5 10 -5 M x R y I z R – производные ТФ; М — Li, Na, 1<х<1, 5 (10 -З 10 -4 ) (Na + ) 10 — 3 2, 9 10 -2 (Li + ) (5, 2 6, 1) 10 -4 M x RI x +1 R – производные ТП М — Li, Na; 1<x<4 (0, 7 3, 0) 10 -2 ( Li + ) ( 10 — 3 0, 9 10 -5 ) (Na + ) 10 -4 10 —
 t , мин 32 2 1 13 0 60 120Е, ВРис. 1. Изменение сопротивления во времени при твердофазном синтезе (Т=298 К) в системах: 1 – Li. I -ТП I ; 2 – Na. I -ТП I. Рис. 2. Разрядные кривые электрохимических систем 1, 2 — Li |ТП 1-х Li х I 3 |ТФ I 3 ; 3 — Na |ТП 1-х Na х I 3 |Т i при плотностях тока, м. А/см 2 : 1 — 250; 2 — 400; 3 – 25 0, 20, 40, 6 0, 81, 01, 21, 4 0 24 6 04 8 12 11 22R, к. Ом t , сут
t , мин 32 2 1 13 0 60 120Е, ВРис. 1. Изменение сопротивления во времени при твердофазном синтезе (Т=298 К) в системах: 1 – Li. I -ТП I ; 2 – Na. I -ТП I. Рис. 2. Разрядные кривые электрохимических систем 1, 2 — Li |ТП 1-х Li х I 3 |ТФ I 3 ; 3 — Na |ТП 1-х Na х I 3 |Т i при плотностях тока, м. А/см 2 : 1 — 250; 2 — 400; 3 – 25 0, 20, 40, 6 0, 81, 01, 21, 4 0 24 6 04 8 12 11 22R, к. Ом t , сут
![Схемы механизмов реакций [R Me+] + Me. A ( Схемы механизмов реакций [R Me+] + Me. A (](/docs//prezentaciya_dlya_mihaylovoy_a.m._images/prezentaciya_dlya_mihaylovoy_a.m._33.jpg) Схемы механизмов реакций [R Me+] + Me. A ( I ) R + A — + Me [R Me + ]A — ; R — R 0 R + ( II ) 2[R + • ] + 2Me. A 2R 0 + 2Me. A ( III ) R – ТП , ТФ ; А — анионы Cl. O -4 , Sn. Cl -2 6 , I — n (1<n<3) ; Me – Li, Na.
Схемы механизмов реакций [R Me+] + Me. A ( I ) R + A — + Me [R Me + ]A — ; R — R 0 R + ( II ) 2[R + • ] + 2Me. A 2R 0 + 2Me. A ( III ) R – ТП , ТФ ; А — анионы Cl. O -4 , Sn. Cl -2 6 , I — n (1<n<3) ; Me – Li, Na.
 Спектральные характеристики систем: 1700 1300 900 500 1700 1200 700Поглощение, % n , см -111 1 22 3 400100 80 80 60 40 6080 70 60 60 40 2020 » » » а – Li |ТП 3 Cl. O 4 : 1- исходный ТП 3 Cl О 4 ; 2 — продукт электрохимической реакции; б — Na |ТФ I 3 : 1- нейтральный ТФ 0 ; 2 – исходный ТФ I 3 ; 3 – продукт электросинтеза в ячейке Na | — Al 2 O 3 | ТФ I 3 3 5 а б
Спектральные характеристики систем: 1700 1300 900 500 1700 1200 700Поглощение, % n , см -111 1 22 3 400100 80 80 60 40 6080 70 60 60 40 2020 » » » а – Li |ТП 3 Cl. O 4 : 1- исходный ТП 3 Cl О 4 ; 2 — продукт электрохимической реакции; б — Na |ТФ I 3 : 1- нейтральный ТФ 0 ; 2 – исходный ТФ I 3 ; 3 – продукт электросинтеза в ячейке Na | — Al 2 O 3 | ТФ I 3 3 5 а б
 ИК-спектры продукта химической реакции Li +ТФ в ацетонитриле: 1 – в инертной атмосфере; 2 – на воздухе, н м
ИК-спектры продукта химической реакции Li +ТФ в ацетонитриле: 1 – в инертной атмосфере; 2 – на воздухе, н м
 ТВЕРДОТЕЛЬНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ ЭНЕРГИИ 1 2 34 5 6 7 8 1 2 3 4 5 Рис. 2. конструкция ХИТ: а – с мембраной из β-глинозема: 1- корпус; 2 – изоляционное кольцо; 3 — β-глинозем; 4 – катод; 5 – анод; 6, 7 – изолятор; 8 — токоотвод; б – без электролита: 1 – корпус; 2 – анод; 3 – катод; 4 – крышка; 5 – изолятор. Е, В t , мин 2, 03, 04, 0 20 40 60 1 2 31′ 2’3’Е, В t , мин 3 2 0 20 40 60 1’ 2’ 1 2 Рис. 1. Типичных разрядно-зарядные кривых систем при 298К и токах, м. А/см 2 : а – Li |П 3I 3 : 1, 1’ – 0, 05; 2, 2’ – 0, 10; б — Li / ТП 3Cl. O 4 : 1, 1’ – 0, 05; 2, 2’ – 0, 10; 3, 3’ -0, 5. (1’, 2’, 3’- заряд). а б
ТВЕРДОТЕЛЬНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ ЭНЕРГИИ 1 2 34 5 6 7 8 1 2 3 4 5 Рис. 2. конструкция ХИТ: а – с мембраной из β-глинозема: 1- корпус; 2 – изоляционное кольцо; 3 — β-глинозем; 4 – катод; 5 – анод; 6, 7 – изолятор; 8 — токоотвод; б – без электролита: 1 – корпус; 2 – анод; 3 – катод; 4 – крышка; 5 – изолятор. Е, В t , мин 2, 03, 04, 0 20 40 60 1 2 31′ 2’3’Е, В t , мин 3 2 0 20 40 60 1’ 2’ 1 2 Рис. 1. Типичных разрядно-зарядные кривых систем при 298К и токах, м. А/см 2 : а – Li |П 3I 3 : 1, 1’ – 0, 05; 2, 2’ – 0, 10; б — Li / ТП 3Cl. O 4 : 1, 1’ – 0, 05; 2, 2’ – 0, 10; 3, 3’ -0, 5. (1’, 2’, 3’- заряд). а б
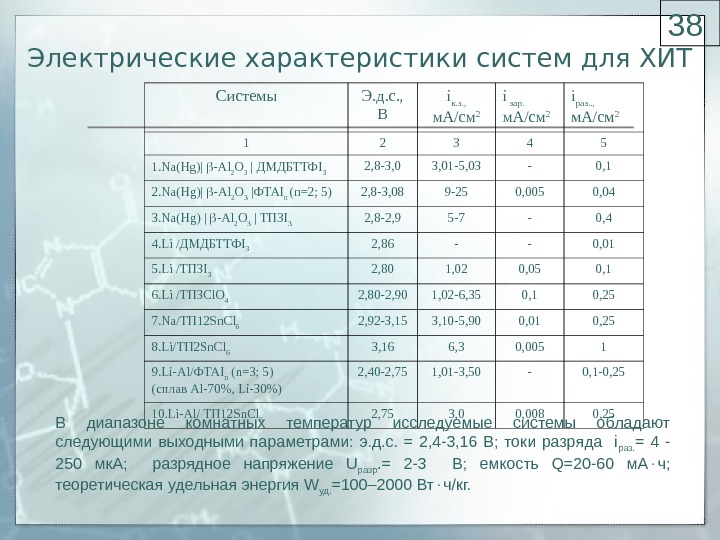
 Электрические характеристики систем для ХИТ Системы Э. д. с. , В i к. з. , м. А/см 2 i зар. м. А/см 2 i раз. . , м. А/см 2 1 2 3 4 5 1. Na(Hg) | — Al 2 O 3 | ДМДБТТФ I 3 2, 8-3, 01-5, 03 — 0, 1 2. Na ( Hg )| — Al 2 O 3 |ФТА I n ( n =2; 5) 2 , 8-3 , 08 9-25 0, 005 0, 04 3. Na(Hg) | — Al 2 O 3 | ТП 3 I 3 2, 8-2, 9 5-7 — 0, 4 4. Li /ДМДБТТФI 3 2, 86 — — 0, 01 5. Li /ТП 3I 3 2, 80 1, 02 0, 05 0, 1 6. Li /ТП 3Cl. O 4 2, 80-2, 90 1, 02-6, 35 0, 1 0, 25 7. Na/ТП 12Sn. Cl 6 2, 92-3, 15 3, 10-5, 90 0, 01 0, 25 8. Li/ТП 2Sn. Cl 6 3, 16 6, 3 0, 005 1 9. Li — Al /ФТАI n ( n =3; 5) (сплав Al -70%, Li -30%) 2, 40-2, 75 1, 01-3, 50 — 0, 1-0, 25 10. Li-Al/ ТП 12Sn. Cl 6 2, 75 3, 0 0, 008 0, 25 В диапазоне комнатных температур исследуемые системы обладают следующими выходными параметрами: э. д. с. = 2, 4-3, 16 В; токи разряда i раз. = 4 — 250 мк. А; разрядное напряжение U разр. = 2-3 В; емкость Q=20-60 м. А ч; теоретическая удельная энергия W уд. =100– 2000 Вт ч/кг.
Электрические характеристики систем для ХИТ Системы Э. д. с. , В i к. з. , м. А/см 2 i зар. м. А/см 2 i раз. . , м. А/см 2 1 2 3 4 5 1. Na(Hg) | — Al 2 O 3 | ДМДБТТФ I 3 2, 8-3, 01-5, 03 — 0, 1 2. Na ( Hg )| — Al 2 O 3 |ФТА I n ( n =2; 5) 2 , 8-3 , 08 9-25 0, 005 0, 04 3. Na(Hg) | — Al 2 O 3 | ТП 3 I 3 2, 8-2, 9 5-7 — 0, 4 4. Li /ДМДБТТФI 3 2, 86 — — 0, 01 5. Li /ТП 3I 3 2, 80 1, 02 0, 05 0, 1 6. Li /ТП 3Cl. O 4 2, 80-2, 90 1, 02-6, 35 0, 1 0, 25 7. Na/ТП 12Sn. Cl 6 2, 92-3, 15 3, 10-5, 90 0, 01 0, 25 8. Li/ТП 2Sn. Cl 6 3, 16 6, 3 0, 005 1 9. Li — Al /ФТАI n ( n =3; 5) (сплав Al -70%, Li -30%) 2, 40-2, 75 1, 01-3, 50 — 0, 1-0, 25 10. Li-Al/ ТП 12Sn. Cl 6 2, 75 3, 0 0, 008 0, 25 В диапазоне комнатных температур исследуемые системы обладают следующими выходными параметрами: э. д. с. = 2, 4-3, 16 В; токи разряда i раз. = 4 — 250 мк. А; разрядное напряжение U разр. = 2-3 В; емкость Q=20-60 м. А ч; теоретическая удельная энергия W уд. =100– 2000 Вт ч/кг.
 Спасибо за внимание
Спасибо за внимание
