Презентация Лекция N10-new




































- Размер: 14.2 Mегабайта
- Количество слайдов: 41
Описание презентации Презентация Лекция N10-new по слайдам
 Лекція № 10 Мультисенсори на основі прямого ферментного аналізу. Мультисенсори на основі ферментного інгібіторного аналізу. Використання мікроорганізмів як природних мультиферментних систем. Мультисенсори та мультиферментні масиви 26. 0 4.
Лекція № 10 Мультисенсори на основі прямого ферментного аналізу. Мультисенсори на основі ферментного інгібіторного аналізу. Використання мікроорганізмів як природних мультиферментних систем. Мультисенсори та мультиферментні масиви 26. 0 4.
 Біосенсором, як правило, можна визначати лише один тип речовин, тоді як будь-який зразок може містити їхню суміш. Проблему одночасного визначення кількох речовин можна вирішити шляхом створення мультисенсорної системи , коли використовується кілька сенсорів, селективних до різних речовин за рахунок використання різних ферментів. Ще більш прогресивна система – це один датчик з розміщеними на ньому кількома перетворювачами з різними біоселективними мембранами, за допомогою якого можна визначати кілька речовин одночасно.
Біосенсором, як правило, можна визначати лише один тип речовин, тоді як будь-який зразок може містити їхню суміш. Проблему одночасного визначення кількох речовин можна вирішити шляхом створення мультисенсорної системи , коли використовується кілька сенсорів, селективних до різних речовин за рахунок використання різних ферментів. Ще більш прогресивна система – це один датчик з розміщеними на ньому кількома перетворювачами з різними біоселективними мембранами, за допомогою якого можна визначати кілька речовин одночасно.
 В літературі описано мультибіосенсори на основі напівпровідникових структур для одночасного визначення концентрацій глюкози і сечовини у фізіологічних рідинах. Описано аналогічний мультисенсор для визначення глюкози, сечовини та іонів калію на основі тонкоплівчастих електродів. Також описано хімічні мультисенсори, так звані “електронні язики” і “електронні носи”, що застосовували для визначення якості вина й інших харчових продуктів. Мультисенсори на основі прямого ферментного аналізу
В літературі описано мультибіосенсори на основі напівпровідникових структур для одночасного визначення концентрацій глюкози і сечовини у фізіологічних рідинах. Описано аналогічний мультисенсор для визначення глюкози, сечовини та іонів калію на основі тонкоплівчастих електродів. Також описано хімічні мультисенсори, так звані “електронні язики” і “електронні носи”, що застосовували для визначення якості вина й інших харчових продуктів. Мультисенсори на основі прямого ферментного аналізу
 Зовнішній вигляд мультиперетворювачів виробництва Інституту хемо- і біосенсорики м. Мюнстер, Німеччина.
Зовнішній вигляд мультиперетворювачів виробництва Інституту хемо- і біосенсорики м. Мюнстер, Німеччина.
 Кремнієва лінійка з 6 -елементним масивом р-канальних іоноселективних польових транзисторів, виготовлених в Інституті фізики напівпровідників
Кремнієва лінійка з 6 -елементним масивом р-канальних іоноселективних польових транзисторів, виготовлених в Інституті фізики напівпровідників
 Зовнішній вигляд приладу для роботи з мультисенсором на основі лінійки р. Н-ПТ.
Зовнішній вигляд приладу для роботи з мультисенсором на основі лінійки р. Н-ПТ.
 Зовнішній вигляд та схематичне зображення амперометричних мультиперетворювачів, розроблених в Інституті молекулярної біології і генетики та Інституті електродинаміки 0. 75 12, 02, 51, 00. 8 5 0. 21. 6 1 8, 0 29, 0 Auxiliary elec trode. Referenc e e lec trode 0. 8 5 0. 2 2 9 O 65 O R=2. 5 R= 1. 75 R= 1. 0 29, 01. 6 D=0. 75 18, 0 Re fere nc e elec trode. Auxilia ry elec trode. A Б
Зовнішній вигляд та схематичне зображення амперометричних мультиперетворювачів, розроблених в Інституті молекулярної біології і генетики та Інституті електродинаміки 0. 75 12, 02, 51, 00. 8 5 0. 21. 6 1 8, 0 29, 0 Auxiliary elec trode. Referenc e e lec trode 0. 8 5 0. 2 2 9 O 65 O R=2. 5 R= 1. 75 R= 1. 0 29, 01. 6 D=0. 75 18, 0 Re fere nc e elec trode. Auxilia ry elec trode. A Б
 Для підключення му льти сенсору до установки було розроблено та виготовлено контактний пристрій, який мав у своєму складі допоміжний платиновий електрод та електрод порівняння
Для підключення му льти сенсору до установки було розроблено та виготовлено контактний пристрій, який мав у своєму складі допоміжний платиновий електрод та електрод порівняння
 Зовнішній вигляд портативної системи для роботи з амперометричними мультибіосенсорами
Зовнішній вигляд портативної системи для роботи з амперометричними мультибіосенсорами
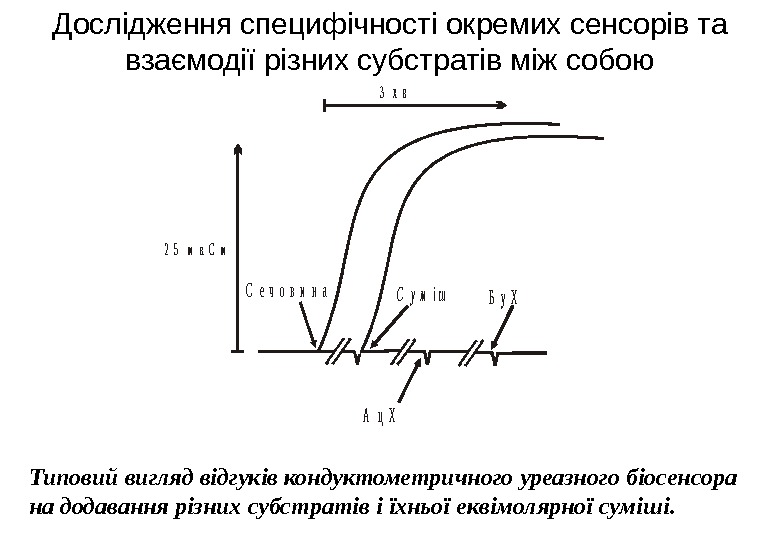
 Дослідження специфічності окремих сенсорів та взаємодії різних субстратів між собою Типовий вигляд відгуків кондуктометричного уреазного біосенсора на додавання різних субстратів і їхньої еквімолярної суміші. С е ч о в и н а. С у м і ш А ц Х Б у Х 2 5 м к С м 3 х в
Дослідження специфічності окремих сенсорів та взаємодії різних субстратів між собою Типовий вигляд відгуків кондуктометричного уреазного біосенсора на додавання різних субстратів і їхньої еквімолярної суміші. С е ч о в и н а. С у м і ш А ц Х Б у Х 2 5 м к С м 3 х в
 Залежність відгуку кондуктометричного (a) і потенціометричного ( б ) уреазного сенсорів від концентрації сечовини (1) і еквімолярної суміші субстратів (2). 1 2 3 4510152025302 1 Субстрати, м. М Провідність, мк. См 0 1 2 3 40102030405060 1 2 U, м. В Субстрати, м. М (a) ( б )
Залежність відгуку кондуктометричного (a) і потенціометричного ( б ) уреазного сенсорів від концентрації сечовини (1) і еквімолярної суміші субстратів (2). 1 2 3 4510152025302 1 Субстрати, м. М Провідність, мк. См 0 1 2 3 40102030405060 1 2 U, м. В Субстрати, м. М (a) ( б )
 Залежність відгуку потенціометричних біосенсорів на основі ацетилхолінестерази ( а ) і бутирилхолінестерази ( б ) від концентрації субстратів (1 – Ац. Х , 2 – Бу. Х ) і їхньої еквімолярної суміші (3). (a) ( б )0123 0 10 20 30 401 2 3 U, м. В Субстрати, м. М 0123 0 5 10 15 20 1 2 3 U, м. В Субстрати, м. М
Залежність відгуку потенціометричних біосенсорів на основі ацетилхолінестерази ( а ) і бутирилхолінестерази ( б ) від концентрації субстратів (1 – Ац. Х , 2 – Бу. Х ) і їхньої еквімолярної суміші (3). (a) ( б )0123 0 10 20 30 401 2 3 U, м. В Субстрати, м. М 0123 0 5 10 15 20 1 2 3 U, м. В Субстрати, м. М
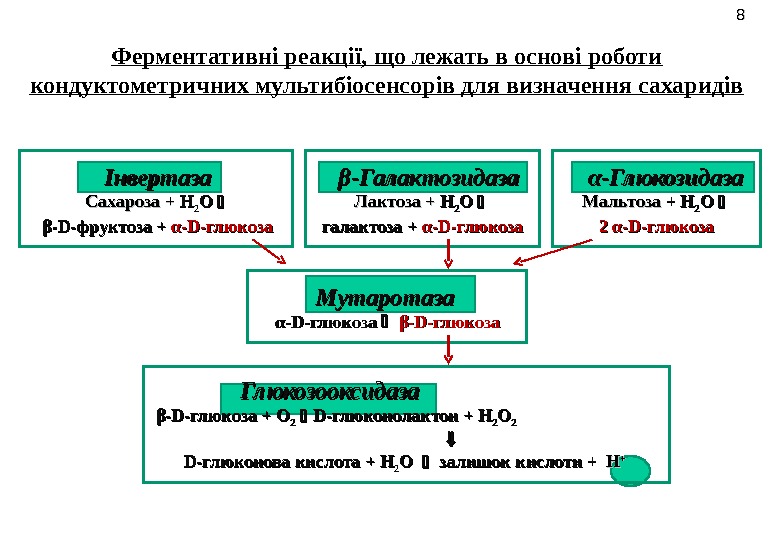
 Ферментативні реакції, що лежать в основі роботи кондуктометричних мультибіосенсорів для визначення сахаридів 88 Інвертаза Сахароза + Н Н 22 О О β-D-фруктоза + α-D-глюкоза β-Галактозидаза Лактоза + Н Н 22 О О галактоза + α-D-глюкоза α-Глюкозидаза Мальтоза + Н+ Н 22 О О 2 α-D-глюкоза Мутаротаза α-D-глюкоза β-D-глюкоза Глюкозооксидаза β-D-глюкоза + О 22 D-глюконолактон + Н 22 ОО 22 D-глюконова кислота + Н 22 О О залишок кислоти + НН ++
Ферментативні реакції, що лежать в основі роботи кондуктометричних мультибіосенсорів для визначення сахаридів 88 Інвертаза Сахароза + Н Н 22 О О β-D-фруктоза + α-D-глюкоза β-Галактозидаза Лактоза + Н Н 22 О О галактоза + α-D-глюкоза α-Глюкозидаза Мальтоза + Н+ Н 22 О О 2 α-D-глюкоза Мутаротаза α-D-глюкоза β-D-глюкоза Глюкозооксидаза β-D-глюкоза + О 22 D-глюконолактон + Н 22 ОО 22 D-глюконова кислота + Н 22 О О залишок кислоти + НН ++
 Випробування роботи біоселективних елементів для визначення сахарози, мальтози, лактози та глюкози в режимі одночасного визначення сахаридів обробка сигналу комп’ютерною програмою
Випробування роботи біоселективних елементів для визначення сахарози, мальтози, лактози та глюкози в режимі одночасного визначення сахаридів обробка сигналу комп’ютерною програмою
 Мультисенсори на основі ферментного інгібіторного аналізу
Мультисенсори на основі ферментного інгібіторного аналізу
 Калібрувальні криві інгібування різних ферментів (1 -уреаза, 2 -Ац. ХЕ, 3 -Бу. ХЕ) фосфорорганічним пестицидом трихлорфоном. Час інгібування – 20 хв. Вимірювання проводили в 5 м. М калій-фосфатному буфері, р. Н 7, 4, еквімолярна концентрація суміші субстратів – 2 м. М. 1101001000 20 40 60 80 100 1 3 2 Залиш кова активність, % Трихлорфон, мк. М
Калібрувальні криві інгібування різних ферментів (1 -уреаза, 2 -Ац. ХЕ, 3 -Бу. ХЕ) фосфорорганічним пестицидом трихлорфоном. Час інгібування – 20 хв. Вимірювання проводили в 5 м. М калій-фосфатному буфері, р. Н 7, 4, еквімолярна концентрація суміші субстратів – 2 м. М. 1101001000 20 40 60 80 100 1 3 2 Залиш кова активність, % Трихлорфон, мк. М
 Відгуки мультибіосенсора на основі ІСПТ на додавання суміші субстратів до та після інгібування ферментів іонами ртуті
Відгуки мультибіосенсора на основі ІСПТ на додавання суміші субстратів до та після інгібування ферментів іонами ртуті
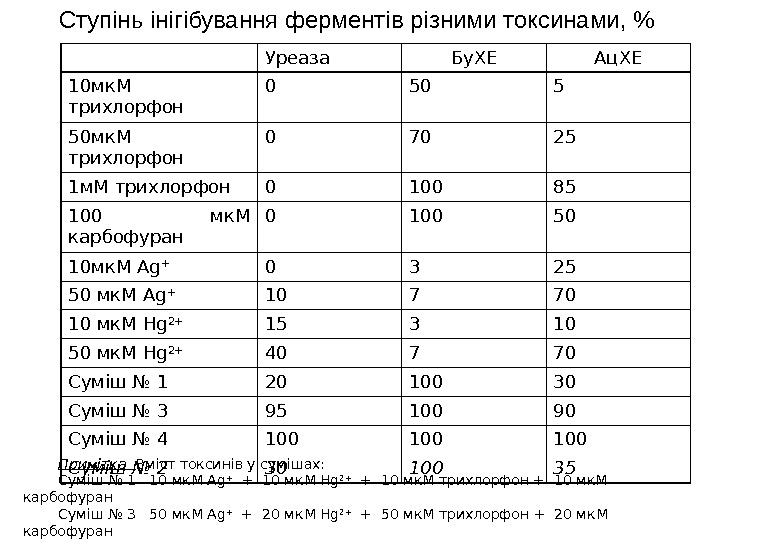
 Ступінь інігібування ферментів різними токсинами, % Уреаза Бу. ХЕ Ац. ХЕ 10 мк. M трихлорфон 0 50 5 50 мк. M трихлорфон 0 70 25 1 м. M трихлорфон 0 100 85 100 мк. M карбофуран 0 100 50 10 мк. M Ag + 0 3 25 50 мк. M Ag + 10 7 70 10 мк. M Hg 2+ 15 3 10 50 мк. M Hg 2+ 40 7 70 Суміш № 1 20 100 30 Суміш № 3 95 100 90 Суміш № 4 100 100 Суміш № 2 30 100 35 Примітка Вміст токсинів у сумішах: Суміш № 1 10 мк. М Ag + + 10 мк. М Hg 2+ + 10 мк. М трихлорфон + 10 мк. М карбофуран Суміш № 3 50 мк. М Ag + + 20 мк. М Hg 2+ + 50 мк. М трихлорфон + 20 мк. М карбофуран Суміш № 4 50 мк. М Ag + + 50 мк. М Hg 2+ + 50 мк. М трихлорфон + 50 мк. М карбофуран Суміш № 2 – умовно невідома суміш токсичних речовин
Ступінь інігібування ферментів різними токсинами, % Уреаза Бу. ХЕ Ац. ХЕ 10 мк. M трихлорфон 0 50 5 50 мк. M трихлорфон 0 70 25 1 м. M трихлорфон 0 100 85 100 мк. M карбофуран 0 100 50 10 мк. M Ag + 0 3 25 50 мк. M Ag + 10 7 70 10 мк. M Hg 2+ 15 3 10 50 мк. M Hg 2+ 40 7 70 Суміш № 1 20 100 30 Суміш № 3 95 100 90 Суміш № 4 100 100 Суміш № 2 30 100 35 Примітка Вміст токсинів у сумішах: Суміш № 1 10 мк. М Ag + + 10 мк. М Hg 2+ + 10 мк. М трихлорфон + 10 мк. М карбофуран Суміш № 3 50 мк. М Ag + + 20 мк. М Hg 2+ + 50 мк. М трихлорфон + 20 мк. М карбофуран Суміш № 4 50 мк. М Ag + + 50 мк. М Hg 2+ + 50 мк. М трихлорфон + 50 мк. М карбофуран Суміш № 2 – умовно невідома суміш токсичних речовин
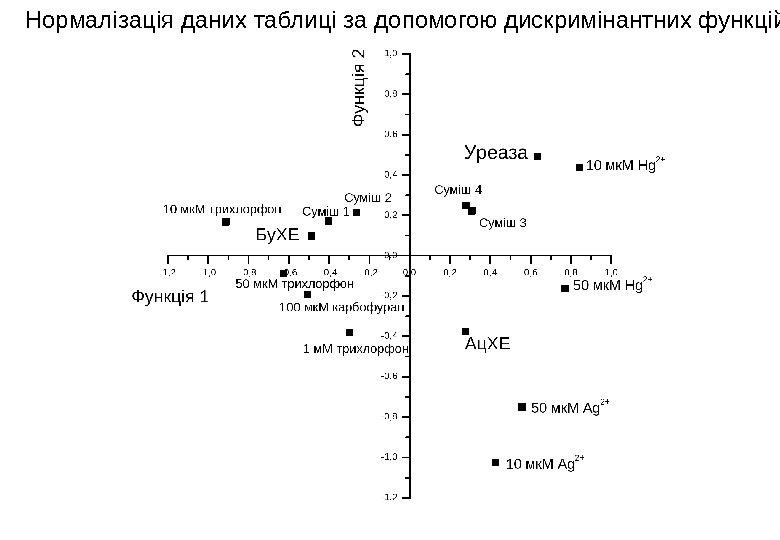
 Для кількісного визначення суміші токсичних речовин у досліджуваній пробі користувалися дискримінантним функціональним аналізом. У цьому випадку виконували попередні експерименти з інгібування ферментів не тільки окремими токсичними речовинами, але й різними їхніми сумішами. Отримані результати заносилися до таблиці-матриці, що містила дані щодо ступеня інгібування ферментів різними токсичними речовинами та їхніми сумішами. Змінними для математичної обробки в цьому випадку є ферменти. Спершу необхідно було нормалізувати дані. Для цього застосовується дискримінантна функція – лінійна комбінація векторів ознак, що характеризують об’єкт і якнайкраще розрізняють сукупність вибраних точок. За допомогою спеціального математичного пакету комп’ютерних програм для дискримінантного аналізу Sirius 6. 0 for Windows (Pattern Recognition Systems A/S, Норвегія) отримали дискримінантні функції як лінійні суперпозиції незалежних змінних.
Для кількісного визначення суміші токсичних речовин у досліджуваній пробі користувалися дискримінантним функціональним аналізом. У цьому випадку виконували попередні експерименти з інгібування ферментів не тільки окремими токсичними речовинами, але й різними їхніми сумішами. Отримані результати заносилися до таблиці-матриці, що містила дані щодо ступеня інгібування ферментів різними токсичними речовинами та їхніми сумішами. Змінними для математичної обробки в цьому випадку є ферменти. Спершу необхідно було нормалізувати дані. Для цього застосовується дискримінантна функція – лінійна комбінація векторів ознак, що характеризують об’єкт і якнайкраще розрізняють сукупність вибраних точок. За допомогою спеціального математичного пакету комп’ютерних програм для дискримінантного аналізу Sirius 6. 0 for Windows (Pattern Recognition Systems A/S, Норвегія) отримали дискримінантні функції як лінійні суперпозиції незалежних змінних.
 Нормалізація даних таблиці за допомогою дискримінантних функцій
Нормалізація даних таблиці за допомогою дискримінантних функцій
 Найбільш точне кількісне визначення складу суміші отримується за допомогою самонавчального методу штучних нейронних мереж. У цьому випадку сукупність вихідних параметрів (вхідні нормалізовані дані) надходять до спеціальних пристроїв обробки (штучні нейрони), які здійснюють порівняння і нормалізацію вхідних даних, використовуючи спеціальні функції, що постійно адаптуються впродовж роботи (навчання). Зважені значення підсумовуються, після чого за допомогою активаційної функції формується вихідний сигнал нейрону. Вихідні сигнали всіх нейронів, що формують даний шар, є вхідними сигналами для кожного наступного шару. В результаті обробки створюється вихідний шар з кількістю нейронів, що відповідає кількості токсичних речовин, що визначаються. Застосовуючи такий метод, можна проводити точний розрахунок складу суміші.
Найбільш точне кількісне визначення складу суміші отримується за допомогою самонавчального методу штучних нейронних мереж. У цьому випадку сукупність вихідних параметрів (вхідні нормалізовані дані) надходять до спеціальних пристроїв обробки (штучні нейрони), які здійснюють порівняння і нормалізацію вхідних даних, використовуючи спеціальні функції, що постійно адаптуються впродовж роботи (навчання). Зважені значення підсумовуються, після чого за допомогою активаційної функції формується вихідний сигнал нейрону. Вихідні сигнали всіх нейронів, що формують даний шар, є вхідними сигналами для кожного наступного шару. В результаті обробки створюється вихідний шар з кількістю нейронів, що відповідає кількості токсичних речовин, що визначаються. Застосовуючи такий метод, можна проводити точний розрахунок складу суміші.
 Узагальнена схема визначення токсичних речовин за допомогою мультибіосенсора на основі ферментного інгібіторного аналізу С у м і ш с у б с т р а т і в О б р о б к а р е з у л ь т а т і в І н г і б у в а н н я С у м і ш с у б с т р а т і в
Узагальнена схема визначення токсичних речовин за допомогою мультибіосенсора на основі ферментного інгібіторного аналізу С у м і ш с у б с т р а т і в О б р о б к а р е з у л ь т а т і в І н г і б у в а н н я С у м і ш с у б с т р а т і в
 Використання мікроорганізмів може призвести до вирішення частини проблем. Всі ферменти, що використовуються, повинні функціонувати одночасно в одних і тих же умовах. Стабільність кожного окремого фермента. Ціна окремих препаратів ферментів залишається дуже високою. Вони можуть бути використані як природні мультиферментні системи, які функціонують в оптимальних умовах. Можлива оцінка впливу на їх властивості різних токсикологічних ефектів забруднювачів. Проблеми створення мультисенсорів
Використання мікроорганізмів може призвести до вирішення частини проблем. Всі ферменти, що використовуються, повинні функціонувати одночасно в одних і тих же умовах. Стабільність кожного окремого фермента. Ціна окремих препаратів ферментів залишається дуже високою. Вони можуть бути використані як природні мультиферментні системи, які функціонують в оптимальних умовах. Можлива оцінка впливу на їх властивості різних токсикологічних ефектів забруднювачів. Проблеми створення мультисенсорів
 Використання мікроорганізмів як природних мультиферментних систем Електрохімічні біосенсори на основі зелених мікроводоростей Chlorella vulgaris
Використання мікроорганізмів як природних мультиферментних систем Електрохімічні біосенсори на основі зелених мікроводоростей Chlorella vulgaris
 М ікроводорості Chlorella vulgaris можна розглядати як природні мультиферментні системи, за допомогою яких після їхньої оптимізації можна визначати токсичні речовини. При цьому функціонують вони в своїх природніх умовах. До того ж завдяки використанню живих організмів можлива оцінка впливу на їхні властивості екотоксикологічних ефектів різних забруднювачів.
М ікроводорості Chlorella vulgaris можна розглядати як природні мультиферментні системи, за допомогою яких після їхньої оптимізації можна визначати токсичні речовини. При цьому функціонують вони в своїх природніх умовах. До того ж завдяки використанню живих організмів можлива оцінка впливу на їхні властивості екотоксикологічних ефектів різних забруднювачів.
 Принцип роботи біосенсора на основі зелених мікроводоростей Chlorella vulgaris базується на такій ферментативній реакції: фосфатаза субстрат продукт + PO 4 — + H + В ході реакції продукуються протони та іони, що дає можливість використати для створення біосенсорів кондуктометричні чи потенціометричні перетворювачі.
Принцип роботи біосенсора на основі зелених мікроводоростей Chlorella vulgaris базується на такій ферментативній реакції: фосфатаза субстрат продукт + PO 4 — + H + В ході реакції продукуються протони та іони, що дає можливість використати для створення біосенсорів кондуктометричні чи потенціометричні перетворювачі.
 Вимірювання лужної фосфатазної активності проводили в T ris -HCl буфері, p. H 8, 5 з 1 м. M Mg. Cl 2. Концентрація, субстрату була 1 м. M для біосенсора і 10 м. M для флуоресцентної біосистем и. Калібрувальні криві для визначення 4 -метилумбелліферил — фосфат у , отримані за допомогою флуоресцентної біосистеми і кондуктометричного біосенсора 05101520 0 1 2 3 4 5 Біосенсор Флуоресцентна система П р о в iд н iс ть , м к. С м MUP, мк. М 0 5000 10000 15000 20000 25000 30000 Ф л ю о р е с ц е н ц iя , А О
Вимірювання лужної фосфатазної активності проводили в T ris -HCl буфері, p. H 8, 5 з 1 м. M Mg. Cl 2. Концентрація, субстрату була 1 м. M для біосенсора і 10 м. M для флуоресцентної біосистем и. Калібрувальні криві для визначення 4 -метилумбелліферил — фосфат у , отримані за допомогою флуоресцентної біосистеми і кондуктометричного біосенсора 05101520 0 1 2 3 4 5 Біосенсор Флуоресцентна система П р о в iд н iс ть , м к. С м MUP, мк. М 0 5000 10000 15000 20000 25000 30000 Ф л ю о р е с ц е н ц iя , А О
 Порівняння p. NPP і MUP як субстратів для застосування в біосенсорах для вимірювання лужної фосфатазної активності. Діапазон концентрацій Чутливість Тривалість відгуку p. NPP 0 -1 м. M 100 мк. См/ м M <5 хв MUP 0 -20 мк. M 0. 1 мк. См/мк. M <5 хв
Порівняння p. NPP і MUP як субстратів для застосування в біосенсорах для вимірювання лужної фосфатазної активності. Діапазон концентрацій Чутливість Тривалість відгуку p. NPP 0 -1 м. M 100 мк. См/ м M <5 хв MUP 0 -20 мк. M 0. 1 мк. См/мк. M <5 хв
 Калібрувальні криві для визначення p. NPP , отримані за допомогою кондуктометричного біосенсора з БСА (1) і кальцій — альгінатною (2) мембранами. 020406080100120140 0 0, 086 0, 172 0, 258 0, 344 0, 43 0, 516 0, 602 0, 688 0, 774 0, 86 p. NPP, m. MП ровідність, м к. С м
Калібрувальні криві для визначення p. NPP , отримані за допомогою кондуктометричного біосенсора з БСА (1) і кальцій — альгінатною (2) мембранами. 020406080100120140 0 0, 086 0, 172 0, 258 0, 344 0, 43 0, 516 0, 602 0, 688 0, 774 0, 86 p. NPP, m. MП ровідність, м к. С м
 Як показано на Рис. , сигнал біосенсора на основі кальцій-альгінатної мембрани зменшується при високих концентраціях p. NPP (>0. 3 м M ), на відміну від сигналу біосенсора на основі БС A мембрани, який має явно виражений кінетичний показник Міхаеліса з рівнем насичення від 0, 5 м M p. NPP. Таке зменшення величини відгуку біосенсора з альгінатною мембраною можна пояснити тим, що катіонові хелатні агенти, такі як фосфат, можуть викликати руйнування або розчинення альгінатної матриці, а в результаті ферментативної реакції за участю лужної фосфатази продукуються іони фосфату. Також було показано, що мембрани з альгінату кальцію були стабільні при р. Н до 5, 5 і низьких концентраціях фосфату, проте при підвищенні р. Н і концентрацій ступінь розчинення збільшувався. В нашому випадку, лужну фосфатазну активність вимірювали при р. Н 8, 5, який знаходиться явно поза діапазоном оптимальної стабільності р. Н для альгінатного гелю. Отже, мембрани з альгінату кальцію є непридатними для створення біосенсорів на основі мікроводоростей.
Як показано на Рис. , сигнал біосенсора на основі кальцій-альгінатної мембрани зменшується при високих концентраціях p. NPP (>0. 3 м M ), на відміну від сигналу біосенсора на основі БС A мембрани, який має явно виражений кінетичний показник Міхаеліса з рівнем насичення від 0, 5 м M p. NPP. Таке зменшення величини відгуку біосенсора з альгінатною мембраною можна пояснити тим, що катіонові хелатні агенти, такі як фосфат, можуть викликати руйнування або розчинення альгінатної матриці, а в результаті ферментативної реакції за участю лужної фосфатази продукуються іони фосфату. Також було показано, що мембрани з альгінату кальцію були стабільні при р. Н до 5, 5 і низьких концентраціях фосфату, проте при підвищенні р. Н і концентрацій ступінь розчинення збільшувався. В нашому випадку, лужну фосфатазну активність вимірювали при р. Н 8, 5, який знаходиться явно поза діапазоном оптимальної стабільності р. Н для альгінатного гелю. Отже, мембрани з альгінату кальцію є непридатними для створення біосенсорів на основі мікроводоростей.
 Залежність відгуку кондуктометричного біосенсора на додавання 40 м. М p. NPP від часу експонування в парах глутарового альдегіду при іммобілізації водоростей 0 10 20 30 40 50 60 70 80 102025 Експозиція в па ра х ГА, х в П ровідність, м к. С м
Залежність відгуку кондуктометричного біосенсора на додавання 40 м. М p. NPP від часу експонування в парах глутарового альдегіду при іммобілізації водоростей 0 10 20 30 40 50 60 70 80 102025 Експозиція в па ра х ГА, х в П ровідність, м к. С м
 Стабільність кондуктометричного біосенсора на основі зелених водоростей Chlorella vulgaris. 02468101214161820 50 60 70 80 90 100 А ктивнicть, % Час, днi
Стабільність кондуктометричного біосенсора на основі зелених водоростей Chlorella vulgaris. 02468101214161820 50 60 70 80 90 100 А ктивнicть, % Час, днi
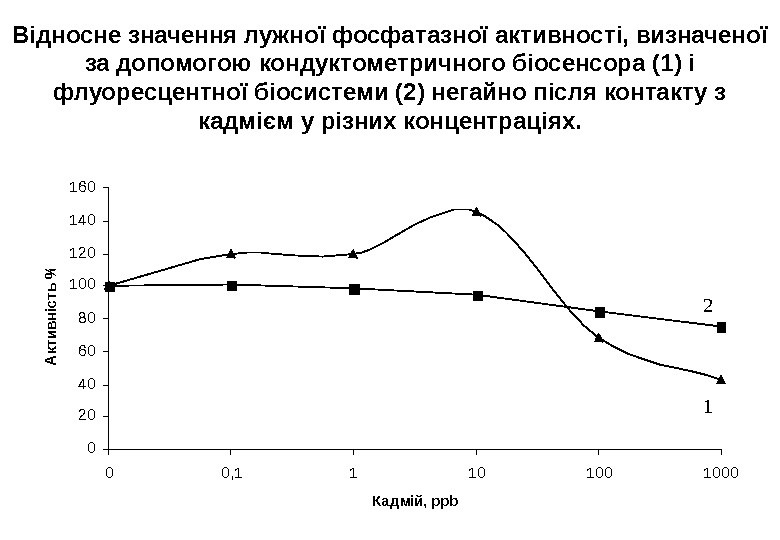
 Відносне значення лужної фосфатазної активності, визначеної за допомогою кондуктометричного біосенсора (1) і флуоресцентної біосистеми (2) негайно після контакту з кадмієм у різних концентраціях. 0 20 40 60 80 100 120 140 160 00, 11101001000 Кадмій, ppb А ктивність %
Відносне значення лужної фосфатазної активності, визначеної за допомогою кондуктометричного біосенсора (1) і флуоресцентної біосистеми (2) негайно після контакту з кадмієм у різних концентраціях. 0 20 40 60 80 100 120 140 160 00, 11101001000 Кадмій, ppb А ктивність %
 В обох випадках для малих концентрацій кадмію (1 години) іншими авторами, які пояснюють її клітинним стресом. В цьому випадку, щоб запобігти руйнуванню клітини кадмієм, в клітині виробляються промотори стресу, що підвищують активність ферментів.
В обох випадках для малих концентрацій кадмію (1 години) іншими авторами, які пояснюють її клітинним стресом. В цьому випадку, щоб запобігти руйнуванню клітини кадмієм, в клітині виробляються промотори стресу, що підвищують активність ферментів.
 Порівняння інгібування лужної фосфатазної активності кадмієм для біосенсорів і флуоресцентної біосистеми. Тривалість експонування з кадмієм Флуоресцентна б іосистем а , % Кондуктометричні біосенсори , % 10 ppb 100 ppb 1 година 100 >70 0 2 години 95 90 30 -50 0 4 години
Порівняння інгібування лужної фосфатазної активності кадмієм для біосенсорів і флуоресцентної біосистеми. Тривалість експонування з кадмієм Флуоресцентна б іосистем а , % Кондуктометричні біосенсори , % 10 ppb 100 ppb 1 година 100 >70 0 2 години 95 90 30 -50 0 4 години
 При тривалому експонуванні спостерігали більш швидке інгібування, отримане за допомогою біосенсорів, ніж флуоресцентої біосистеми. Те ж саме можна сказати про збільшення інгібування для високих концентрацій кадмію при короткому експонуванні. Це можна пояснити різним співвідношенням кількості клітин водоростей і кадмію в цих двох випадках. Справді, в мембранах іммобілізується невелика кількість водоростей у порівнянні з біосистемами із застосуванням вільних водоростей. В біосенсорах відношення водорості/кадмій є меншим, ніж у біосистемах, а швидкість інгібування зворотньо пропорційна до цього співвідношення. Внаслідок цього, біосенсори забезпечують більш високі швидкості інгібування і тому чутливіші при визначенні токсинів.
При тривалому експонуванні спостерігали більш швидке інгібування, отримане за допомогою біосенсорів, ніж флуоресцентої біосистеми. Те ж саме можна сказати про збільшення інгібування для високих концентрацій кадмію при короткому експонуванні. Це можна пояснити різним співвідношенням кількості клітин водоростей і кадмію в цих двох випадках. Справді, в мембранах іммобілізується невелика кількість водоростей у порівнянні з біосистемами із застосуванням вільних водоростей. В біосенсорах відношення водорості/кадмій є меншим, ніж у біосистемах, а швидкість інгібування зворотньо пропорційна до цього співвідношення. Внаслідок цього, біосенсори забезпечують більш високі швидкості інгібування і тому чутливіші при визначенні токсинів.
 Показано, що за допомогою такої мультиферментної системи можна вивчати лужну фосфатазну активність Chlorella vulgaris та вплив на цю активність іонів важких металів, зокрема, іонів кадмію. Також показано, що для створення таких біосенсорів більш придатні кондуктометричні перетворювачі. Продемонстровано кореляцію результатів, отриманих за допомогою кондуктометричного біосенсора на основі зелених мікроводоростей Chlorella vulgaris та біосистеми на основі визначенн я флуоресценції.
Показано, що за допомогою такої мультиферментної системи можна вивчати лужну фосфатазну активність Chlorella vulgaris та вплив на цю активність іонів важких металів, зокрема, іонів кадмію. Також показано, що для створення таких біосенсорів більш придатні кондуктометричні перетворювачі. Продемонстровано кореляцію результатів, отриманих за допомогою кондуктометричного біосенсора на основі зелених мікроводоростей Chlorella vulgaris та біосистеми на основі визначенн я флуоресценції.
 Мульти-ферментна електрохімічна система для експресної діагностики токсичних речовин Селективна мембрана – бутирил холінестераза, ацетилхолінестераза, уреаза Перетворювач – ємнісний датчик на основі польового ефекту
Мульти-ферментна електрохімічна система для експресної діагностики токсичних речовин Селективна мембрана – бутирил холінестераза, ацетилхолінестераза, уреаза Перетворювач – ємнісний датчик на основі польового ефекту
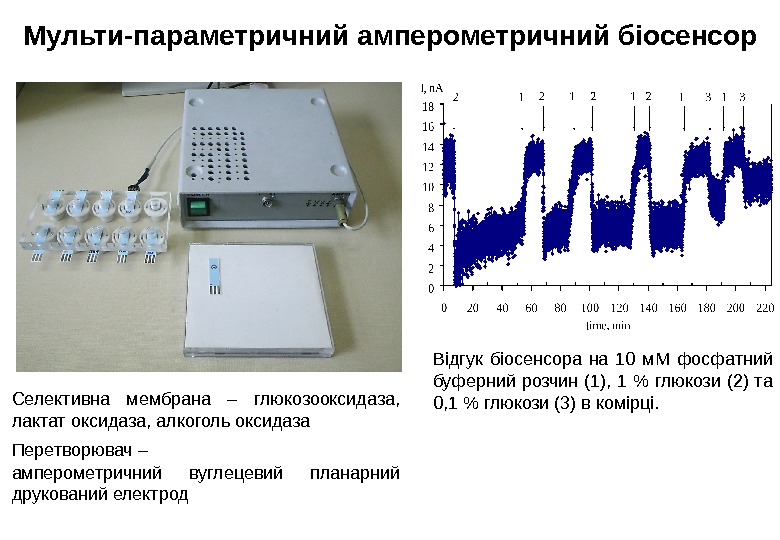
 Відгук біосенсора на 10 м. М фосфатний буферний розчин (1), 1 % глюкози (2) та 0, 1 % глюкози (3) в комірці. Мульти-параметричний амперометричний біосенсор Селективна мембрана – глюкозооксидаза, лактат оксидаза, алкоголь оксидаза Перетворювач – амперометричний вуглецевий планарний друкований електрод
Відгук біосенсора на 10 м. М фосфатний буферний розчин (1), 1 % глюкози (2) та 0, 1 % глюкози (3) в комірці. Мульти-параметричний амперометричний біосенсор Селективна мембрана – глюкозооксидаза, лактат оксидаза, алкоголь оксидаза Перетворювач – амперометричний вуглецевий планарний друкований електрод
 Електронний ніс ГАЗ -1 Розпізнавання хімічних образів Масив сенсорів (8) являє собою набір кварцевих резонаторів, поверхя кожного з яких вкрита тонким шаром абсорбуючої речовини (каліксарени, полімери, тощо). Він приводиться в контакт з аналізованою газовою сумішшю, в результаті чого чутливі шари вбирають певну кількість газу. Завдяки різниці до адсорбції різних молекул, що реєструються, частота кварцевих резонаторів зменшується по-різному. В результаті можна створити багатовимірну базу даних та навчити систему відрізняти один хімічний склад від іншого, тобто реєструвати запах газового середовища. Для математичної обробки даних та розпізнавання використовується кілька алгоритмів. Селективна мембрана – каліксарени, полімери Перетворювач – кварцеві резонатори
Електронний ніс ГАЗ -1 Розпізнавання хімічних образів Масив сенсорів (8) являє собою набір кварцевих резонаторів, поверхя кожного з яких вкрита тонким шаром абсорбуючої речовини (каліксарени, полімери, тощо). Він приводиться в контакт з аналізованою газовою сумішшю, в результаті чого чутливі шари вбирають певну кількість газу. Завдяки різниці до адсорбції різних молекул, що реєструються, частота кварцевих резонаторів зменшується по-різному. В результаті можна створити багатовимірну базу даних та навчити систему відрізняти один хімічний склад від іншого, тобто реєструвати запах газового середовища. Для математичної обробки даних та розпізнавання використовується кілька алгоритмів. Селективна мембрана – каліксарени, полімери Перетворювач – кварцеві резонатори
 В цей отвір вводиться газ для аналізу Результат розпізнавання – максимальне значення відповідає речовині, що розпізнається (в даному випадку – коньяк Хеннесі)
В цей отвір вводиться газ для аналізу Результат розпізнавання – максимальне значення відповідає речовині, що розпізнається (в даному випадку – коньяк Хеннесі)

