Презентация Благородные газы He Ne Ar












- Размер: 996.5 Кб
- Количество слайдов: 14
Описание презентации Презентация Благородные газы He Ne Ar по слайдам
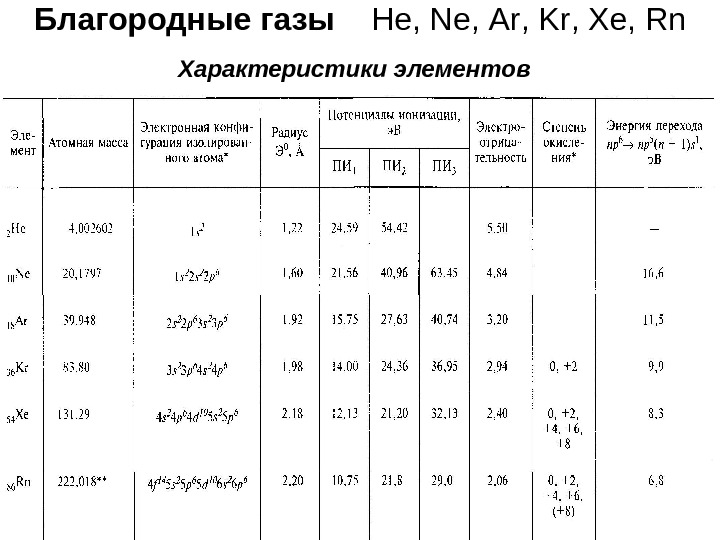
 Благородные газы He , Ne , Ar , Kr , Xe , Rn Характеристики элементов
Благородные газы He , Ne , Ar , Kr , Xe , Rn Характеристики элементов
 • Последствия завершенности электронных оболочек: • 1) Молекулы одноатомны • 2) Высокие значения Еи, следовательно, высокая прочность электронных оболочек и значит низкая реакционная способность. (Но с ростом порядкового номера Еи существенно уменьшается и увеличивается вероятность образования хим. соединений). • Нахождение в природе • Атмосфера (%) Ar – 0, 9 ; Ne – 103 ; Н e , Kr – 104 ; Xe – 105 • Гелий сопутствует природному газу и нефти (т. к. является продуктом радиоактивного распада). • Огромные количества гелия на Солнце и в звездах (2 -й элемент вселенной) • Rn содержится в урановых минералах и природных водах (т. к. является продуктом радиоактивного распада). Т 1/2 =3, 8 суток (самый долгоживущий изотоп)
• Последствия завершенности электронных оболочек: • 1) Молекулы одноатомны • 2) Высокие значения Еи, следовательно, высокая прочность электронных оболочек и значит низкая реакционная способность. (Но с ростом порядкового номера Еи существенно уменьшается и увеличивается вероятность образования хим. соединений). • Нахождение в природе • Атмосфера (%) Ar – 0, 9 ; Ne – 103 ; Н e , Kr – 104 ; Xe – 105 • Гелий сопутствует природному газу и нефти (т. к. является продуктом радиоактивного распада). • Огромные количества гелия на Солнце и в звездах (2 -й элемент вселенной) • Rn содержится в урановых минералах и природных водах (т. к. является продуктом радиоактивного распада). Т 1/2 =3, 8 суток (самый долгоживущий изотоп)
 Физические свойства Газы без цвета и запаха. С ростом порядкового № • увеличиваются Т кип и Т пл , растворимость в воде, т. к. увеличивается R и значит деформируемость электронных оболочек. Но межмолекулярное взаимодействие слабое, поэтому узкий t °-ый интервал жидкого состояния. • Особые свойства гелия : • при t °> 250°С при расширении не охлаждается, как все газы, а нагревается (отсутствие взаимодействия между атомами) • при Т 2, 19 К не кристаллизуется без повышенного p даже при Т 0 К, теплопроводность в десятки раз больше, чем у меди (“спокойное кипение”), почти полное отсутствие вязкости (сверхтекучесть). • .
Физические свойства Газы без цвета и запаха. С ростом порядкового № • увеличиваются Т кип и Т пл , растворимость в воде, т. к. увеличивается R и значит деформируемость электронных оболочек. Но межмолекулярное взаимодействие слабое, поэтому узкий t °-ый интервал жидкого состояния. • Особые свойства гелия : • при t °> 250°С при расширении не охлаждается, как все газы, а нагревается (отсутствие взаимодействия между атомами) • при Т 2, 19 К не кристаллизуется без повышенного p даже при Т 0 К, теплопроводность в десятки раз больше, чем у меди (“спокойное кипение”), почти полное отсутствие вязкости (сверхтекучесть). • .
 • Получение • В больших количествах Ar и He. • Все ректификацией жидкого воздуха. Гелий –глубоким охлаждением природного газа. • Соединения благородных газов • Клатраты – соединения образующиеся в результате включения атомов одного вещества “гостя”, в пустоты кристаллических решеток другого “хозяина”. • Известны гидраты благородных газов Ar , Kr , Xe , Rn состава Э· 5, 75 H 2 O или, правильнее [Э 8( H 2 O )46]. • Известны клатраты с фенолом, гидрохиноном и др. • Ne и He клатратов не образуют, т. к. малые размеры атомов не позволяют им удерживаться в пустотах.
• Получение • В больших количествах Ar и He. • Все ректификацией жидкого воздуха. Гелий –глубоким охлаждением природного газа. • Соединения благородных газов • Клатраты – соединения образующиеся в результате включения атомов одного вещества “гостя”, в пустоты кристаллических решеток другого “хозяина”. • Известны гидраты благородных газов Ar , Kr , Xe , Rn состава Э· 5, 75 H 2 O или, правильнее [Э 8( H 2 O )46]. • Известны клатраты с фенолом, гидрохиноном и др. • Ne и He клатратов не образуют, т. к. малые размеры атомов не позволяют им удерживаться в пустотах.
 Химические соединения • Известны для Kr , Xe , Rn наиболее изучены для Xe. • Должно быть много соединений Rn , но их исследованию мешает радиоактивность. • 1962 г. Бартлетт (США). Pt. F 6 (очень сильный окислитель) окисляет O 2 до O 2 [ Pt. F 6 ], • но Е и ( O 2 )= 12, 06 э. В Е и (Хе)= 12, 13 э. В, значит должен окислять и Хе! • Синтез первого истинного хим. соединения благородных газов: Xe + Pt. F 6 = Xe [ Pt. F 6 ] • Затем относительно быстро были получены многие соединения. Сейчас для Хе около 200 соединений, несколько для К r и Rn
Химические соединения • Известны для Kr , Xe , Rn наиболее изучены для Xe. • Должно быть много соединений Rn , но их исследованию мешает радиоактивность. • 1962 г. Бартлетт (США). Pt. F 6 (очень сильный окислитель) окисляет O 2 до O 2 [ Pt. F 6 ], • но Е и ( O 2 )= 12, 06 э. В Е и (Хе)= 12, 13 э. В, значит должен окислять и Хе! • Синтез первого истинного хим. соединения благородных газов: Xe + Pt. F 6 = Xe [ Pt. F 6 ] • Затем относительно быстро были получены многие соединения. Сейчас для Хе около 200 соединений, несколько для К r и Rn

 • Фториды Xe ( Kr ) • Получение Xe + F 2 = Xe. F 2 ( Xe. F 4 , Xe. F 6 ) • Различный режим р и Т для разных фторидов ( для Xe. F 4 • р – атмосферное). • Фториды Xe бесцветные кристаллы, легкоплавкие (Т ПЛ °С 140 Xe. F 2 , 117 Xe. F 4 , 49 Xe. F 6 ), легколетучие. • Xe. F 2 молекула линейная. • Хорошо растворим в воде, но растворы неустойчивы • 2 Xe. F 2 + 2 H 2 O = 2 Xe + 4 HF + O 2 • Водные растворы Xe. F 2 сильные окислители (в кислой среде φ = 2, 64 В, поэтому например, окисляет Br. O 3 в Br. O 4 и т. д. ) • Удобный фторирующий агент: мягче, чем F 2 (возможно избирательное замещение Н на F во фторируемых органических молекулах), менее агрессивен, чем F 2 , легче дозировать (взвешиванием).
• Фториды Xe ( Kr ) • Получение Xe + F 2 = Xe. F 2 ( Xe. F 4 , Xe. F 6 ) • Различный режим р и Т для разных фторидов ( для Xe. F 4 • р – атмосферное). • Фториды Xe бесцветные кристаллы, легкоплавкие (Т ПЛ °С 140 Xe. F 2 , 117 Xe. F 4 , 49 Xe. F 6 ), легколетучие. • Xe. F 2 молекула линейная. • Хорошо растворим в воде, но растворы неустойчивы • 2 Xe. F 2 + 2 H 2 O = 2 Xe + 4 HF + O 2 • Водные растворы Xe. F 2 сильные окислители (в кислой среде φ = 2, 64 В, поэтому например, окисляет Br. O 3 в Br. O 4 и т. д. ) • Удобный фторирующий агент: мягче, чем F 2 (возможно избирательное замещение Н на F во фторируемых органических молекулах), менее агрессивен, чем F 2 , легче дозировать (взвешиванием).
 • Xe. F 4 молекула квадратная, • Xe. F 6 молекула пятиугольная пирамида. • Xe. F 4 , Xe. F 6 активно гидролизуются: • 6 Xe. F 4 + 12 H 2 O = 2 Xe. O 3 + 4 Xe + 3 O 2 + 24 HF • Xe. F 6 + 3 H 2 O = Xe. O 3 + 6 HF • Xe. F 4 более сильный окислитель, чем Xe. F 2. • Мгновенно окисляет Mn 2+ в Mn. O 4 , Hg в Hg. F 2, Pt в Pt. F 4 , SF 4 в SF 6 и т. д. Органические вещества при соприкосновении с твердым Xe. F 4 воспламеняются, часть — взрывается. • Xe. F 6 ещё более активен, с ним нельзя работать в стеклянной и кварцевой посуде, т. к. реагирует ступенчато с Si. O 2 , с образованием взрывчатого Xe. O 3 • 2 Xe. F 6 + Si. O 2 = 2 Xe. OF 4 + Si. F 4 • 2 Xe. OF 4 + Si. O 2 = 2 Xe. O 2 F 2 + Si. F 4 • 2 Xe. O 2 F 2 + Si. O 2 = 2 Xe. O 3 + Si. F 4 • Итого : 2 Xe. F 6 + 3 Si. O 2 = 2 Xe. O 3 + 3 Si.
• Xe. F 4 молекула квадратная, • Xe. F 6 молекула пятиугольная пирамида. • Xe. F 4 , Xe. F 6 активно гидролизуются: • 6 Xe. F 4 + 12 H 2 O = 2 Xe. O 3 + 4 Xe + 3 O 2 + 24 HF • Xe. F 6 + 3 H 2 O = Xe. O 3 + 6 HF • Xe. F 4 более сильный окислитель, чем Xe. F 2. • Мгновенно окисляет Mn 2+ в Mn. O 4 , Hg в Hg. F 2, Pt в Pt. F 4 , SF 4 в SF 6 и т. д. Органические вещества при соприкосновении с твердым Xe. F 4 воспламеняются, часть — взрывается. • Xe. F 6 ещё более активен, с ним нельзя работать в стеклянной и кварцевой посуде, т. к. реагирует ступенчато с Si. O 2 , с образованием взрывчатого Xe. O 3 • 2 Xe. F 6 + Si. O 2 = 2 Xe. OF 4 + Si. F 4 • 2 Xe. OF 4 + Si. O 2 = 2 Xe. O 2 F 2 + Si. F 4 • 2 Xe. O 2 F 2 + Si. O 2 = 2 Xe. O 3 + Si. F 4 • Итого : 2 Xe. F 6 + 3 Si. O 2 = 2 Xe. O 3 + 3 Si.
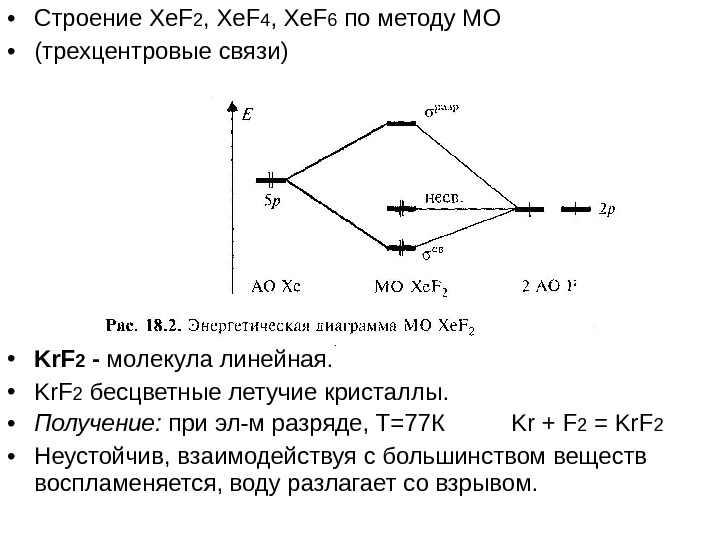
 • Строение Xe. F 2 , Xe. F 4 , Xe. F 6 по методу МО • (трехцентровые связи) • Kr. F 2 — молекула линейная. • Kr. F 2 бесцветные летучие кристаллы. • Получение: при эл-м разряде, Т=77 К Kr + F 2 = Kr. F 2 • Неустойчив, взаимодействуя с большинством веществ воспламеняется, воду разлагает со взрывом.
• Строение Xe. F 2 , Xe. F 4 , Xe. F 6 по методу МО • (трехцентровые связи) • Kr. F 2 — молекула линейная. • Kr. F 2 бесцветные летучие кристаллы. • Получение: при эл-м разряде, Т=77 К Kr + F 2 = Kr. F 2 • Неустойчив, взаимодействуя с большинством веществ воспламеняется, воду разлагает со взрывом.
 • Реакции с участием фторидов Xe • 1) Фториды Xe проявляют свойства кислот и оснований Льюиса (реакции присоединения): • Кислотные свойства: Xe. F 6 + Cs. F = Cs[Xe. F] 7 • Основные свойства: Xe. F 6 + Sb. F 5 = [ Xe. F 5 ][ Sb. F 6 ] • 2) Разложение и диспропорционирование при нагревании: • 3 Xe. F 6 = Xe. F 2 + 2 Xe. F 8 2 Xe. F 2 = Xe. F 4 + Xe • 3) Гидролиз и диспропорционирование при контакте с водой: • Xe. F 6 + H 2 O = Xe. OF 4 +2 HF • Xe. OF 4 + H 2 O = Xe. O 2 F 2 +2 HF • Xe. O 2 F 2 + H 2 O = Xe. O 3 + 2 HF • Итого : Xe. F 6 + 3 H 2 O = Xe. O 3 + 6 HF • 6 Xe. F 4 + 12 H 2 O = 2 Xe. O 3 + 4 Xe + 3 O 2 + 24 HF • Xe. F 4 + 2 H 2 O = Xe + O 2 + 4 HF • 3 Xe. F 4 = 2 Xe. F 6 + Xe (при контакте с H 2 O ) • 2 Xe. F 2 + 2 H 2 O = 2 Xe + 4 HF + O 2 • Состав продуктов определяется условиями проведения реакции ( t °, пропорции реагентов).
• Реакции с участием фторидов Xe • 1) Фториды Xe проявляют свойства кислот и оснований Льюиса (реакции присоединения): • Кислотные свойства: Xe. F 6 + Cs. F = Cs[Xe. F] 7 • Основные свойства: Xe. F 6 + Sb. F 5 = [ Xe. F 5 ][ Sb. F 6 ] • 2) Разложение и диспропорционирование при нагревании: • 3 Xe. F 6 = Xe. F 2 + 2 Xe. F 8 2 Xe. F 2 = Xe. F 4 + Xe • 3) Гидролиз и диспропорционирование при контакте с водой: • Xe. F 6 + H 2 O = Xe. OF 4 +2 HF • Xe. OF 4 + H 2 O = Xe. O 2 F 2 +2 HF • Xe. O 2 F 2 + H 2 O = Xe. O 3 + 2 HF • Итого : Xe. F 6 + 3 H 2 O = Xe. O 3 + 6 HF • 6 Xe. F 4 + 12 H 2 O = 2 Xe. O 3 + 4 Xe + 3 O 2 + 24 HF • Xe. F 4 + 2 H 2 O = Xe + O 2 + 4 HF • 3 Xe. F 4 = 2 Xe. F 6 + Xe (при контакте с H 2 O ) • 2 Xe. F 2 + 2 H 2 O = 2 Xe + 4 HF + O 2 • Состав продуктов определяется условиями проведения реакции ( t °, пропорции реагентов).
 • Кислородсодержащие соединения Хе Xe. O 3 — триоксид Хе — бесцветные кристаллы, легко и мощно взрывающиеся (взрыв происходит при массе >20 мг). • Получение – низкотемпературный гидролиз Xe. F 4 , Xe. F 6. • Хорошо растворим в воде, где предполагают образование ксеноновой кислоты Н 2 Xe О 4 • Водные растворы Xe. O 3 не проводят эл-й ток, поэтому до сих пор не ясно, есть в растворе Н 2 Xe О 4 (Н 6 Xe О 6 ) или нет. • Предполагают существование равновесия: • Xe. O 3 + H 2 O ↔ Н 2 Xe О 4 ↔ Н+ + Н Xe О 4 • которое в нейтральной среде сильно смещено влево, • в сильнощелочной вправо, с образованием ксенатов состава: М + Н Xe О 4 , М 2+ Xe О 4, известен плохо растворимый Ва 3 Xe О 6 • Xe. O 3 +КО H = КН Xe О 4 • Xe. O 3 +Ва(О H ) 2 = Ва Xe О 4 + H 2 O (или Ва 3 Xe О 6 ) • Ксенаты – бесцветные кристаллы, устойчивые до t ° 150° С (Ва 3 Xe О 6 до t > 250° С)
• Кислородсодержащие соединения Хе Xe. O 3 — триоксид Хе — бесцветные кристаллы, легко и мощно взрывающиеся (взрыв происходит при массе >20 мг). • Получение – низкотемпературный гидролиз Xe. F 4 , Xe. F 6. • Хорошо растворим в воде, где предполагают образование ксеноновой кислоты Н 2 Xe О 4 • Водные растворы Xe. O 3 не проводят эл-й ток, поэтому до сих пор не ясно, есть в растворе Н 2 Xe О 4 (Н 6 Xe О 6 ) или нет. • Предполагают существование равновесия: • Xe. O 3 + H 2 O ↔ Н 2 Xe О 4 ↔ Н+ + Н Xe О 4 • которое в нейтральной среде сильно смещено влево, • в сильнощелочной вправо, с образованием ксенатов состава: М + Н Xe О 4 , М 2+ Xe О 4, известен плохо растворимый Ва 3 Xe О 6 • Xe. O 3 +КО H = КН Xe О 4 • Xe. O 3 +Ва(О H ) 2 = Ва Xe О 4 + H 2 O (или Ва 3 Xe О 6 ) • Ксенаты – бесцветные кристаллы, устойчивые до t ° 150° С (Ва 3 Xe О 6 до t > 250° С)
 • Все кислородсодержащие соединения Хе+6 сильные окислители, особенно в кислой среде, например: • 5 Xe. O 3 + 6 Mn. SO 4 + 9 H 2 O = 5 Xe + 6 HMn. O 4 + 6 Н 2 S О 4 • Xe. O 3 + 6 Fe. SO 4 + 3 Н 2 S О 4 = Xe + 3 Fe 2 (S О 4 ) 3 + 3 H 2 O • Но с более сильными окислителями (например, O 3 ) Xe. O 3 проявляет восстановительные свойства. • Xe О 4 — тетраоксид Хе — Светло-желтый взрывчатый газ • Получение : • при t °= 5°С: B а 2 Xe О 6 +2 Н 2 S О 4 (к)=2 Ba. S О 4 ↓+ Xe О 4 ↑+2 H 2 O • Неустойчив, при t °=0°С разлагается: • 3 Xe О 4 =2 Xe. O 3 + Хе +3 O 2 • При растворении в воде образуется перксеноновая кислота Н 4 Xe О 6 • К 1 =10 -2 , К 2 =10 -6 , К 3 =10 -11 (достаточно сильная по сравнению с кислотами “соседей” Хе по периоду (Н 5 I О 6 и Н 6 Т e О 6 ) • В индивидуальном состоянии не выделена; разлагается с выделением O 2 : 2 Н 4 Xe О 6 = 2 Xe. O 3 +O 2 +4 H 2 O • Получены соли Н 4 Xe О 6 — перксенаты состава М + Н Xe О 6 , М 2 + Xe О 6, М 2+ Xe О 6 (М: K , Rb , Cs – растворимы в воде, Li , Na , Ba , Ag , Zn , Pb , La , Th – нерастворимы)
• Все кислородсодержащие соединения Хе+6 сильные окислители, особенно в кислой среде, например: • 5 Xe. O 3 + 6 Mn. SO 4 + 9 H 2 O = 5 Xe + 6 HMn. O 4 + 6 Н 2 S О 4 • Xe. O 3 + 6 Fe. SO 4 + 3 Н 2 S О 4 = Xe + 3 Fe 2 (S О 4 ) 3 + 3 H 2 O • Но с более сильными окислителями (например, O 3 ) Xe. O 3 проявляет восстановительные свойства. • Xe О 4 — тетраоксид Хе — Светло-желтый взрывчатый газ • Получение : • при t °= 5°С: B а 2 Xe О 6 +2 Н 2 S О 4 (к)=2 Ba. S О 4 ↓+ Xe О 4 ↑+2 H 2 O • Неустойчив, при t °=0°С разлагается: • 3 Xe О 4 =2 Xe. O 3 + Хе +3 O 2 • При растворении в воде образуется перксеноновая кислота Н 4 Xe О 6 • К 1 =10 -2 , К 2 =10 -6 , К 3 =10 -11 (достаточно сильная по сравнению с кислотами “соседей” Хе по периоду (Н 5 I О 6 и Н 6 Т e О 6 ) • В индивидуальном состоянии не выделена; разлагается с выделением O 2 : 2 Н 4 Xe О 6 = 2 Xe. O 3 +O 2 +4 H 2 O • Получены соли Н 4 Xe О 6 — перксенаты состава М + Н Xe О 6 , М 2 + Xe О 6, М 2+ Xe О 6 (М: K , Rb , Cs – растворимы в воде, Li , Na , Ba , Ag , Zn , Pb , La , Th – нерастворимы)
 • Способы получения перксенатов : • 1) окисление ксенатов озоном, • 3 Xe. O 3 +12 Na О H + O 3 = 3 N а 4 Xe О 6 +6 H 2 O или Xe. O 3 +4 Na О H + O 3 = N а 4 Xe О 6 + O 2 +2 H 2 O • Ва 3 Xe О 6 + O 3 = Ва 2 Xe О 6 (Ва 3 Xe О 5 )+ O 2 • 2) щелочной гидролиз Xe. F 6 • 2 Xe. F 6 + 16 Na О H = N а 4 Xe О 6 +12 Na. F + Xe + 3 O 2 +8 H 2 O • 4 Xe. F 6 + 18 Ва(О H ) 2 = 3 Ba 2 Xe О 6 +12 Ba. F 2 + Xe + 18 H 2 O • 3) диспропорционирование Xe. O 3 в щелочной среде • 2 Xe. O 3 +4 Na О H = N а 4 Xe О 6 + Xe + 3 O 2 +2 H 2 O • медленно протекает диспропорционирование ксенатов в растворе: КН Xe О 4 +2 K О H = K 4 Xe О 6 + Xe + 3 O 2 +2 H 2 O • Перксенаты (обычно кристаллогидраты) довольно устойчивы. При нагревании перксенаты разлагаются, например: Li 4 Xe О 6 = Li 2 О+ Xe + 2 O 2 • Кислородсодержащие соединения Хе+8 очень сильные окислители (в кислой среде более сильные ( φ = 2, 3 -3, 0 В), чем в щелочной ( φ = 0, 9 В)). Окисляют Mn 2+ в Mn. O 4 , IO 3 в IO 4 и т. д.
• Способы получения перксенатов : • 1) окисление ксенатов озоном, • 3 Xe. O 3 +12 Na О H + O 3 = 3 N а 4 Xe О 6 +6 H 2 O или Xe. O 3 +4 Na О H + O 3 = N а 4 Xe О 6 + O 2 +2 H 2 O • Ва 3 Xe О 6 + O 3 = Ва 2 Xe О 6 (Ва 3 Xe О 5 )+ O 2 • 2) щелочной гидролиз Xe. F 6 • 2 Xe. F 6 + 16 Na О H = N а 4 Xe О 6 +12 Na. F + Xe + 3 O 2 +8 H 2 O • 4 Xe. F 6 + 18 Ва(О H ) 2 = 3 Ba 2 Xe О 6 +12 Ba. F 2 + Xe + 18 H 2 O • 3) диспропорционирование Xe. O 3 в щелочной среде • 2 Xe. O 3 +4 Na О H = N а 4 Xe О 6 + Xe + 3 O 2 +2 H 2 O • медленно протекает диспропорционирование ксенатов в растворе: КН Xe О 4 +2 K О H = K 4 Xe О 6 + Xe + 3 O 2 +2 H 2 O • Перксенаты (обычно кристаллогидраты) довольно устойчивы. При нагревании перксенаты разлагаются, например: Li 4 Xe О 6 = Li 2 О+ Xe + 2 O 2 • Кислородсодержащие соединения Хе+8 очень сильные окислители (в кислой среде более сильные ( φ = 2, 3 -3, 0 В), чем в щелочной ( φ = 0, 9 В)). Окисляют Mn 2+ в Mn. O 4 , IO 3 в IO 4 и т. д.
 • Применение благородных газов и их соединений • Не, Кr, Xe — электровакуумная техника (лампы); Не – метеорологические зонды; Не, Аr – создание инертной атмосферы; смесь гелия и кислорода – газ для дыхания водолазов (не вызывает кессонной болезни). • Соединения Хе, Кr – окислители, фторирующие агенты. • Биологическая роль • Заметной биол. активности нет, кроме радона. “Радоновые ванны” помогают излечить некоторые болезни. В больших дозах радон опасен из-за радиоактивности (больше, чем уран и радий вместе). • Проблема: присутствие радона в горных породах, грунтовых водах и, особенно, во всех строительных материалах приводит к его накоплению в помещениях и необходимости снижения его концентрации. • При работе АЭС с реакторами на уране и плутонии распад ядерного топлива дает радионуклиды Хе, трудно поглощаемые обычными сорбентами, что приводит к выбросу их в атмосферу. Для поглощения используют поглотители O 2 [ Sb. F 6 ], которые связывают Хе и Rn в твердые комплексы, например [Хе F ] [ Sb 2 F 11 ].
• Применение благородных газов и их соединений • Не, Кr, Xe — электровакуумная техника (лампы); Не – метеорологические зонды; Не, Аr – создание инертной атмосферы; смесь гелия и кислорода – газ для дыхания водолазов (не вызывает кессонной болезни). • Соединения Хе, Кr – окислители, фторирующие агенты. • Биологическая роль • Заметной биол. активности нет, кроме радона. “Радоновые ванны” помогают излечить некоторые болезни. В больших дозах радон опасен из-за радиоактивности (больше, чем уран и радий вместе). • Проблема: присутствие радона в горных породах, грунтовых водах и, особенно, во всех строительных материалах приводит к его накоплению в помещениях и необходимости снижения его концентрации. • При работе АЭС с реакторами на уране и плутонии распад ядерного топлива дает радионуклиды Хе, трудно поглощаемые обычными сорбентами, что приводит к выбросу их в атмосферу. Для поглощения используют поглотители O 2 [ Sb. F 6 ], которые связывают Хе и Rn в твердые комплексы, например [Хе F ] [ Sb 2 F 11 ].
