Презентация АМИНОКИСЛОТЫ MY 1



























- Размер: 6.7 Mегабайта
- Количество слайдов: 94
Описание презентации Презентация АМИНОКИСЛОТЫ MY 1 по слайдам
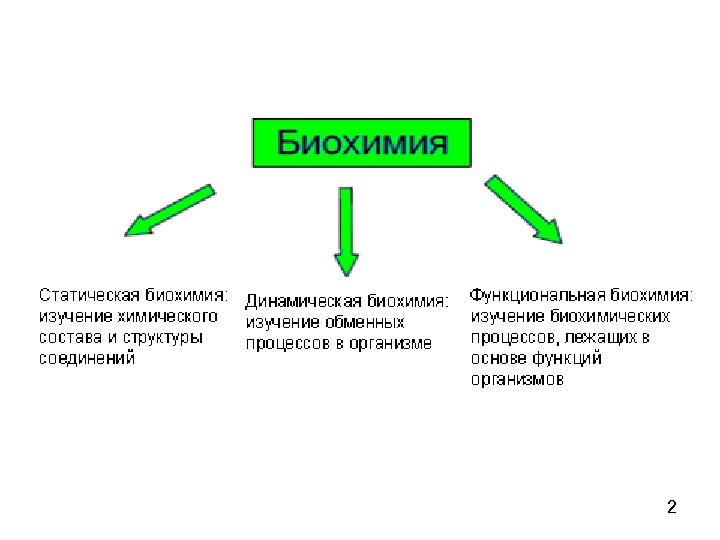
 1 Биохимия – биологическая химия, изучает химический состав и структуру веществ, содержащихся в живых организмах, пути и способы регуляции их метаболизма, а также энергетическое обеспечение процессов, происходящих в клетке и организме. Становление биохимии как науки произошло на рубеже IXIX и и XXXX вв. ; термин «биохимия» предложен в 1903 К. Нейбергом.
1 Биохимия – биологическая химия, изучает химический состав и структуру веществ, содержащихся в живых организмах, пути и способы регуляции их метаболизма, а также энергетическое обеспечение процессов, происходящих в клетке и организме. Становление биохимии как науки произошло на рубеже IXIX и и XXXX вв. ; термин «биохимия» предложен в 1903 К. Нейбергом.


 4 АМИНОКИСЛОТЫ
4 АМИНОКИСЛОТЫ

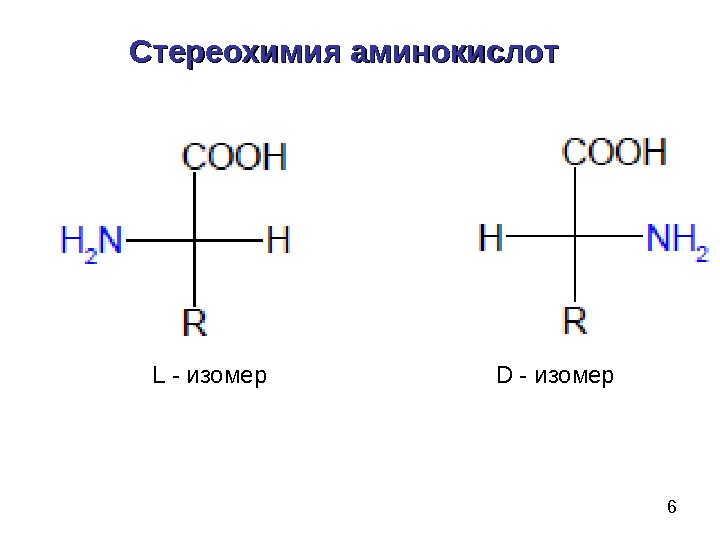
 6 Стереохимия аминокислот L — изомер D — изомер
6 Стереохимия аминокислот L — изомер D — изомер
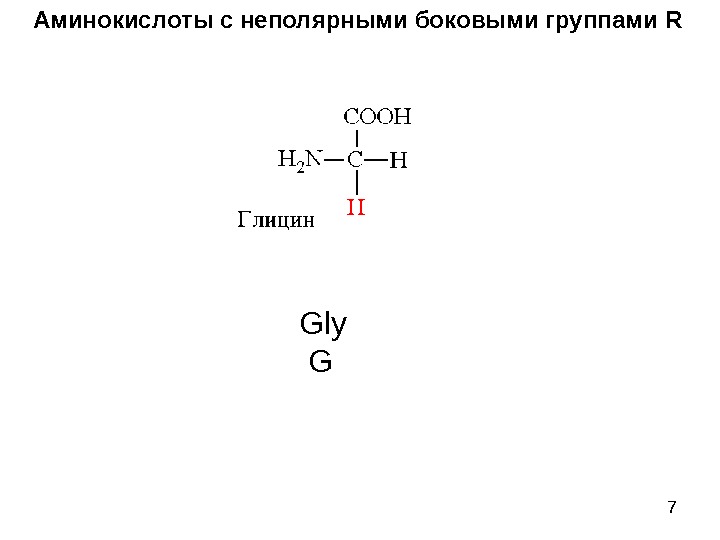
 7 Аминокислоты с неполярными боковыми группами R Gly G
7 Аминокислоты с неполярными боковыми группами R Gly G
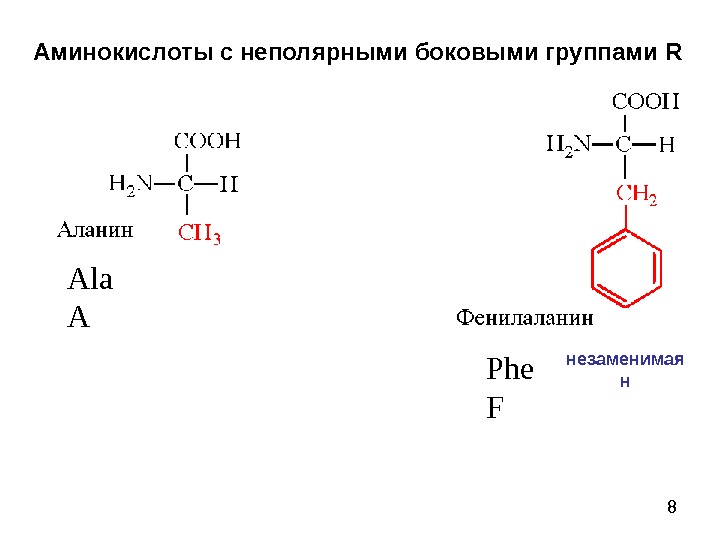
 8 Аминокислоты с неполярными боковыми группами R Ala A Phe F незаменимая н
8 Аминокислоты с неполярными боковыми группами R Ala A Phe F незаменимая н
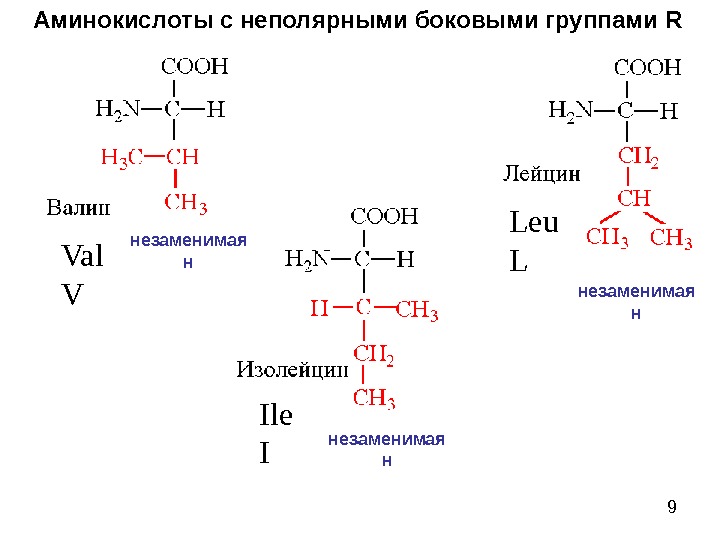
 9 Аминокислоты с неполярными боковыми группами R Val V Leu L Ile I незаменимая ннезаменимая н
9 Аминокислоты с неполярными боковыми группами R Val V Leu L Ile I незаменимая ннезаменимая н
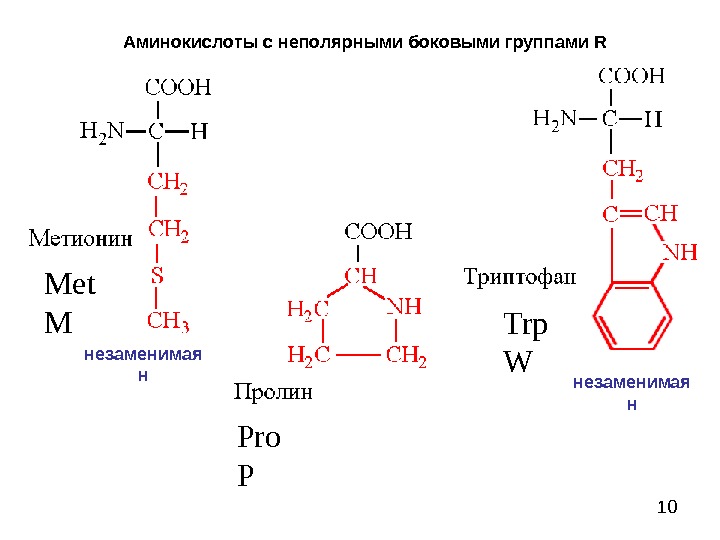
 10 Аминокислоты с неполярными боковыми группами R Met M Pro P Trp Wнезаменимая н
10 Аминокислоты с неполярными боковыми группами R Met M Pro P Trp Wнезаменимая н
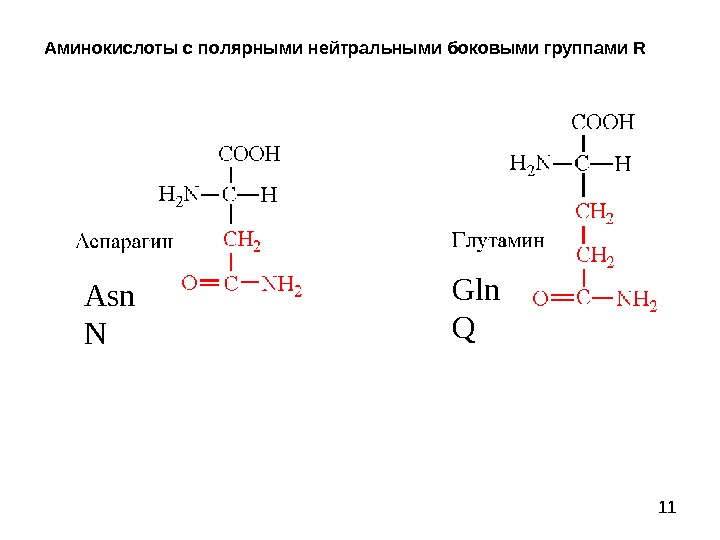
 11 Аминокислоты с полярными нейтральными боковыми группами R Asn N Gln Q
11 Аминокислоты с полярными нейтральными боковыми группами R Asn N Gln Q
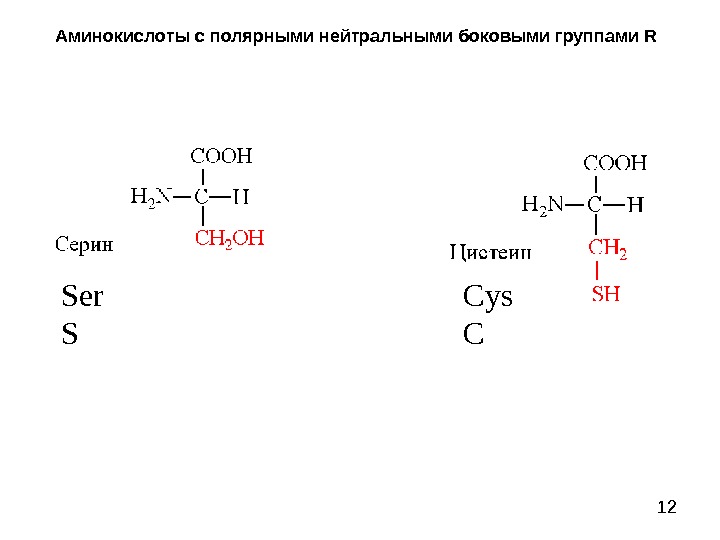
 12 Аминокислоты с полярными нейтральными боковыми группами R Ser S Cys
12 Аминокислоты с полярными нейтральными боковыми группами R Ser S Cys
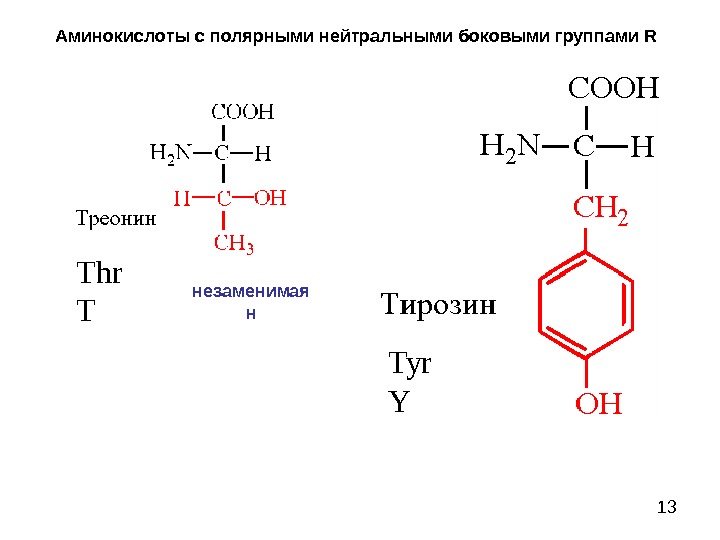
 13 Аминокислоты с полярными нейтральными боковыми группами R Thr T Tyr Yнезаменимая н
13 Аминокислоты с полярными нейтральными боковыми группами R Thr T Tyr Yнезаменимая н
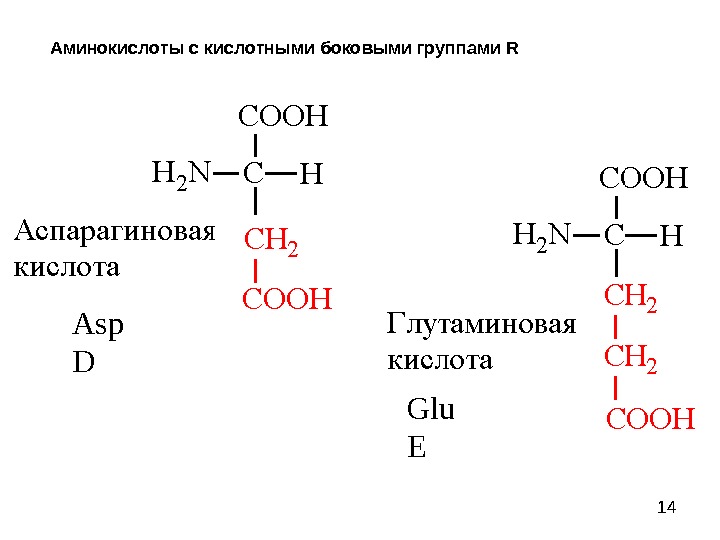
 14 Аминокислоты с кислотными боковыми группами R Asp D Glu
14 Аминокислоты с кислотными боковыми группами R Asp D Glu
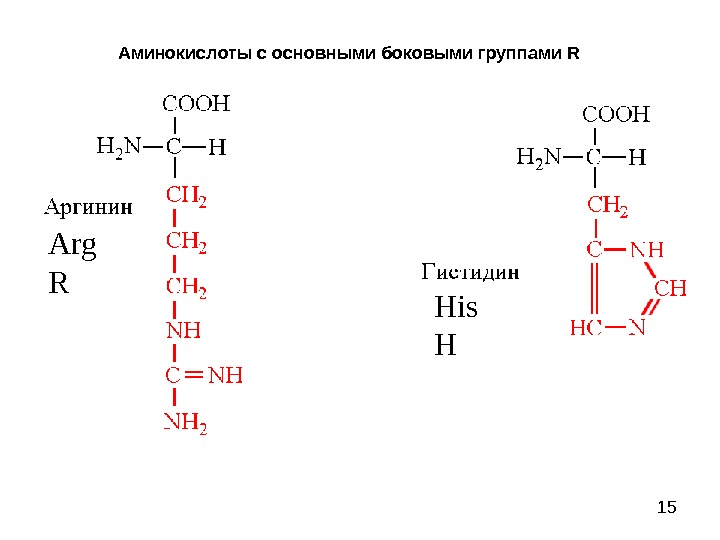
 15 Аминокислоты с основными боковыми группами R Arg R His H
15 Аминокислоты с основными боковыми группами R Arg R His H
 16 Аминокислоты с основными боковыми группами Lys K незаменимая н
16 Аминокислоты с основными боковыми группами Lys K незаменимая н


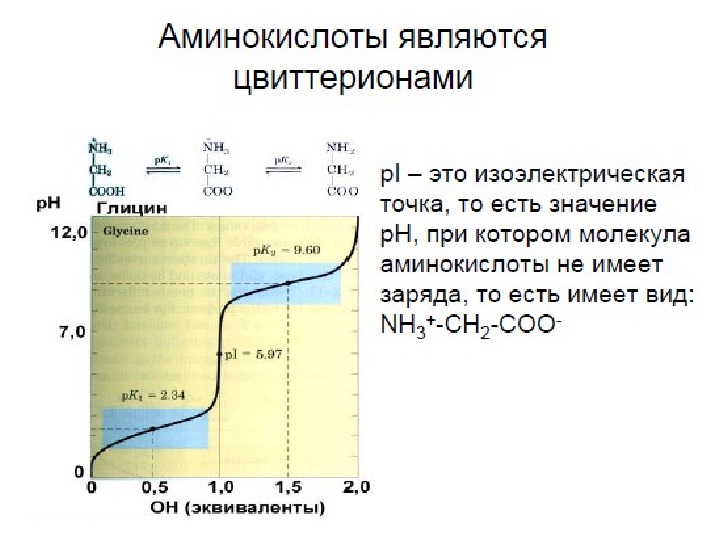
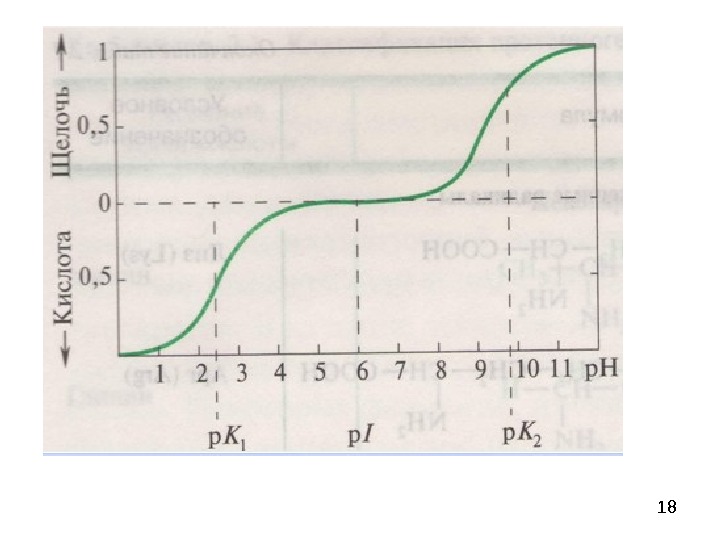
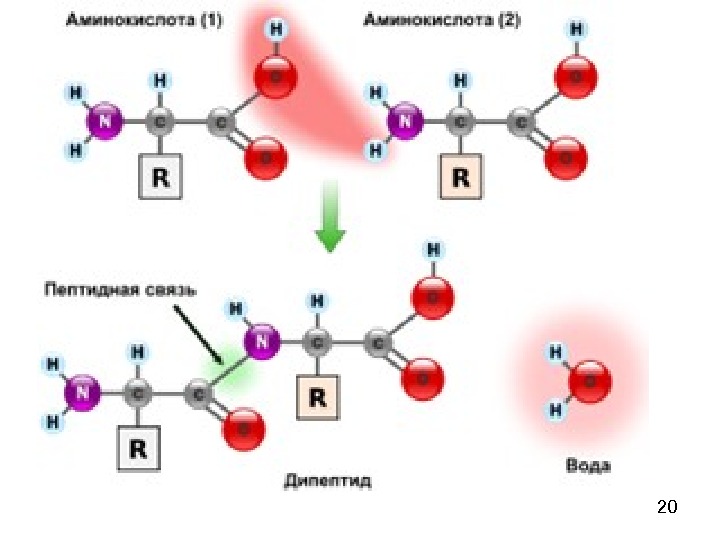
 19 Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь ПЕПТИДНЫМИ (АМИДНЫМИ) СВЯЗЯМИ — C(O)NH—. Это природные или синтетические соединения, содержащие десятки, сотни или тысячи мономерных звеньев – аминокислот. Простые пептиды содержат до 10 аминокислот. Олигопептиды состоят из 10 -50 аминокислот. Полипептиды состоят из сотен аминокислот.
19 Пептиды (греч. πεπτος — питательный) — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь ПЕПТИДНЫМИ (АМИДНЫМИ) СВЯЗЯМИ — C(O)NH—. Это природные или синтетические соединения, содержащие десятки, сотни или тысячи мономерных звеньев – аминокислот. Простые пептиды содержат до 10 аминокислот. Олигопептиды состоят из 10 -50 аминокислот. Полипептиды состоят из сотен аминокислот.

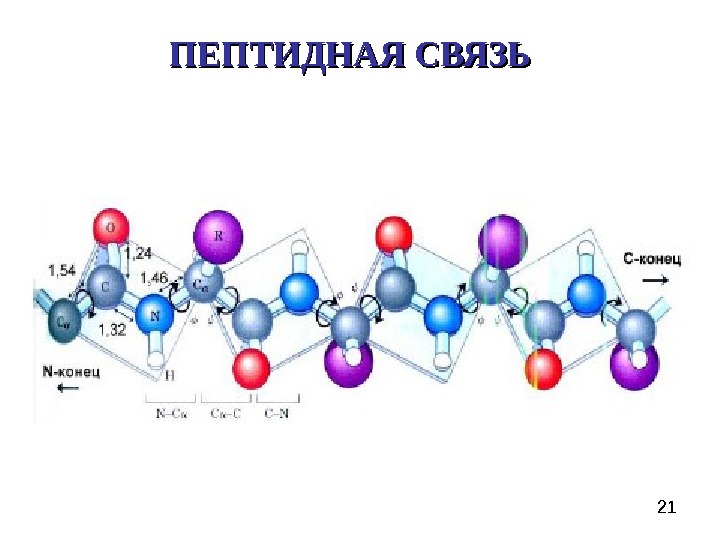
 21 ПЕПТИДНАЯ СВЯЗЬ
21 ПЕПТИДНАЯ СВЯЗЬ
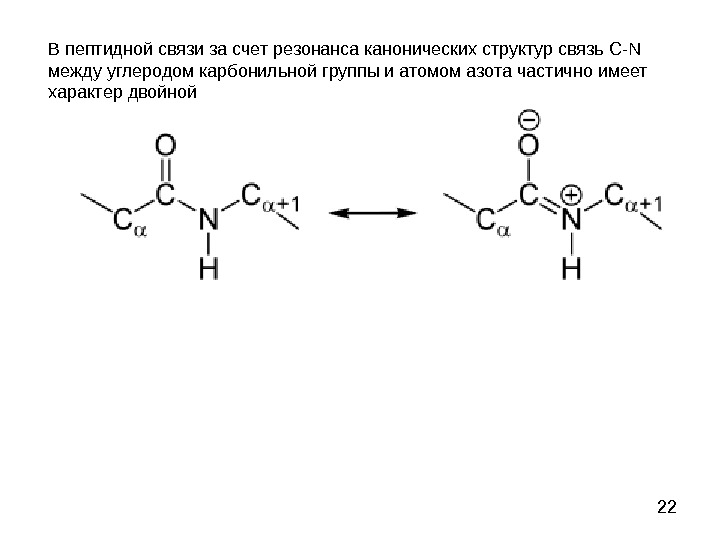
 22 В пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной
22 В пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной
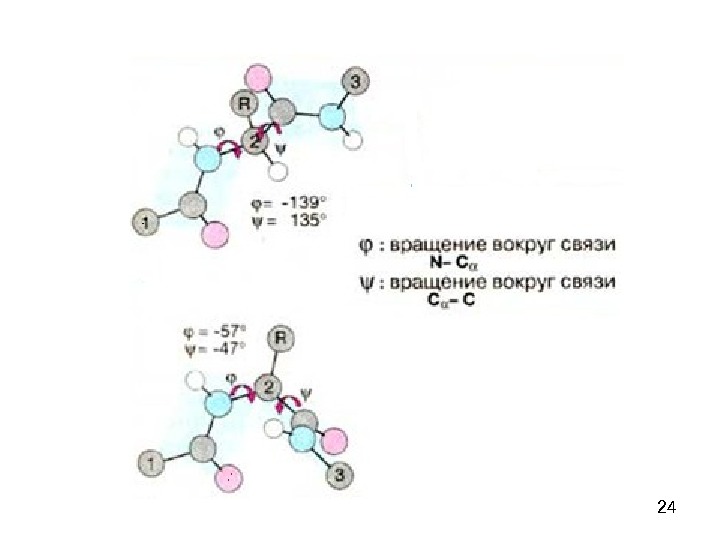
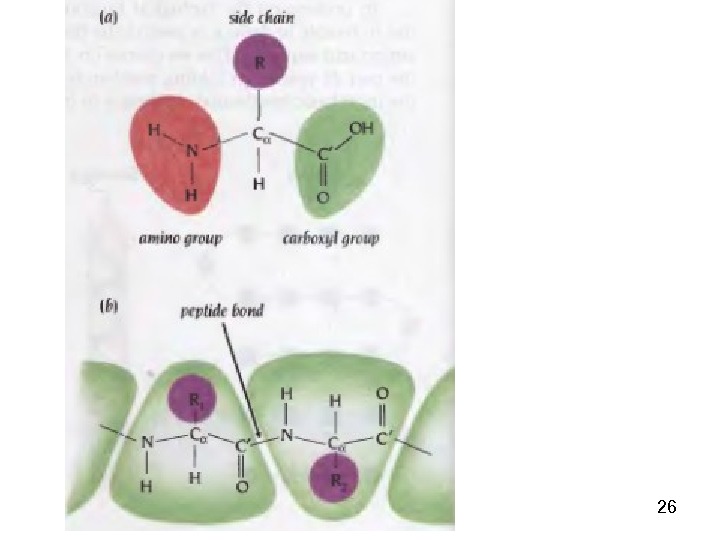
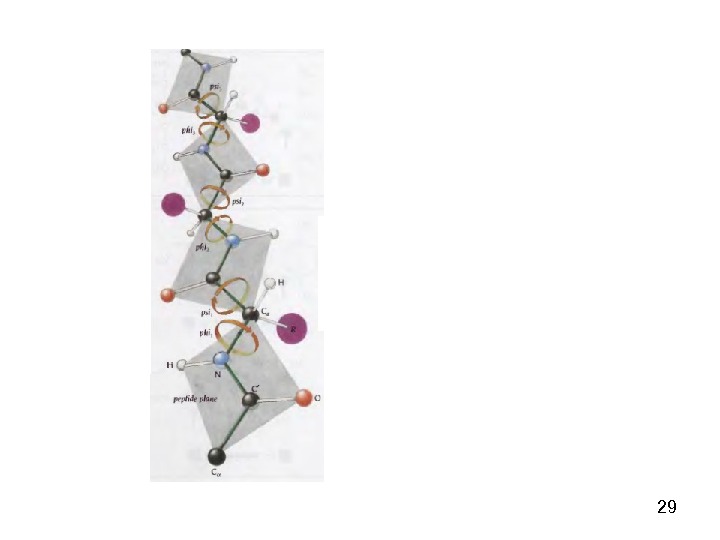
 23 Пептидная связь представляет собой связь, с длиной 1, 32 А, вращение вокруг нее невозможно. 6 атомов, расположенных рядом с пептидной связью (2 Сα, О, N, H), находятся в одной плоскости. Пептидную связь можно рассматривать как диполь, поскольку на карбонильном кислороде есть δ−, а на N – δ+.
23 Пептидная связь представляет собой связь, с длиной 1, 32 А, вращение вокруг нее невозможно. 6 атомов, расположенных рядом с пептидной связью (2 Сα, О, N, H), находятся в одной плоскости. Пептидную связь можно рассматривать как диполь, поскольку на карбонильном кислороде есть δ−, а на N – δ+.

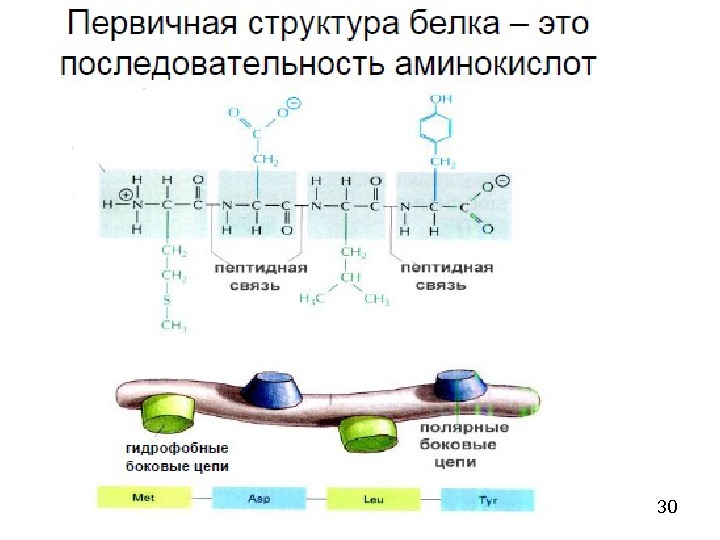
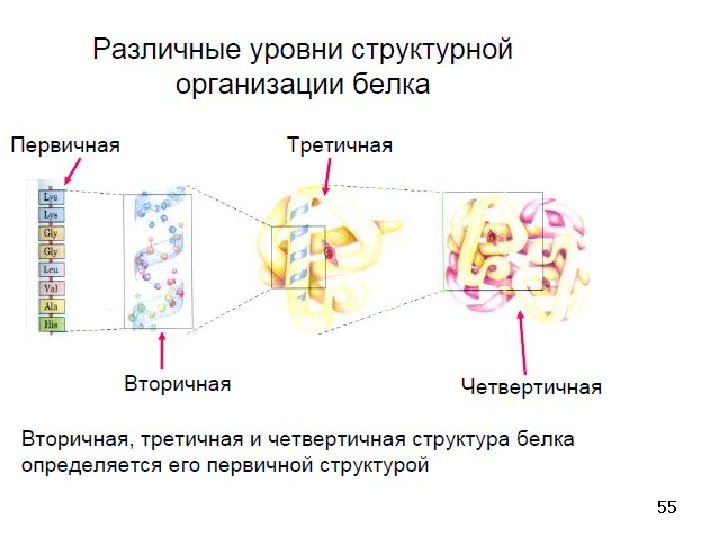
 25 Пептиды классифицируются в соответствии с числом аминокислотных остатков в цепи: дипептиды, трипептиды, тетрапептиды и т. д. Аминокислота со свободной аминогруппой записывается с левой стороны и называется N-концевой аминокислотой, а аминокислота со свободной карбоксильной группой располагается в правой части формулы пептида и называется C-концевой аминокислотой. Пептиды называют как производные С-концевой аминокислоты. При этом первой пишут название N-концевой аминокислоты с суффиксом -ил, затем таким же образом перечисляют всю последовательность аминокислот пептидной цепи и в последнюю очередь называют С-концевую аминокислоту с суффиксом -ин. Таким образом, названия всех изомерных пептидов отличаются, даже если использовать только трехбуквенные обозначения аминокислот (см. часть 1. Аминокислоты). Число изомерных пептидов ( N ) можно определить по формуле: n — количество аминокислотных остатков в цепи; m — количество одинаковых аминокислот в цепи
25 Пептиды классифицируются в соответствии с числом аминокислотных остатков в цепи: дипептиды, трипептиды, тетрапептиды и т. д. Аминокислота со свободной аминогруппой записывается с левой стороны и называется N-концевой аминокислотой, а аминокислота со свободной карбоксильной группой располагается в правой части формулы пептида и называется C-концевой аминокислотой. Пептиды называют как производные С-концевой аминокислоты. При этом первой пишут название N-концевой аминокислоты с суффиксом -ил, затем таким же образом перечисляют всю последовательность аминокислот пептидной цепи и в последнюю очередь называют С-концевую аминокислоту с суффиксом -ин. Таким образом, названия всех изомерных пептидов отличаются, даже если использовать только трехбуквенные обозначения аминокислот (см. часть 1. Аминокислоты). Число изомерных пептидов ( N ) можно определить по формуле: n — количество аминокислотных остатков в цепи; m — количество одинаковых аминокислот в цепи





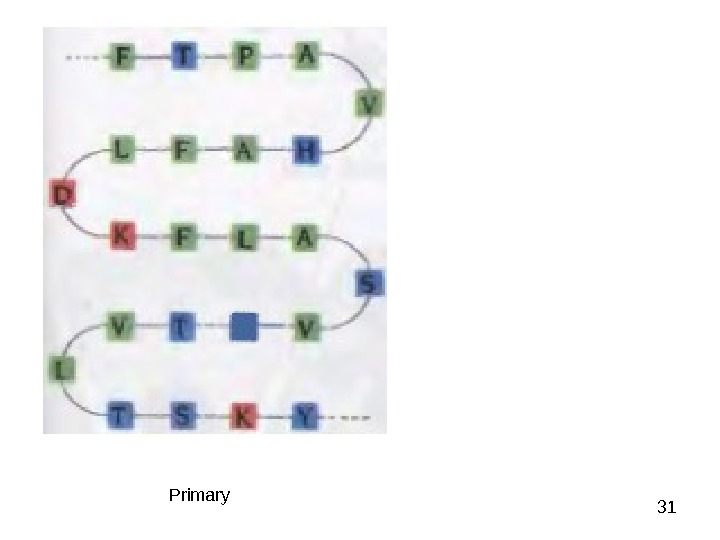
 31 Primary
31 Primary


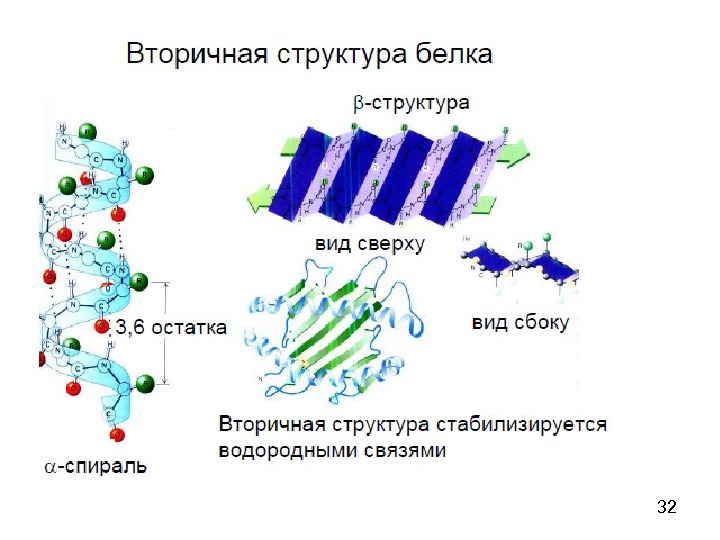
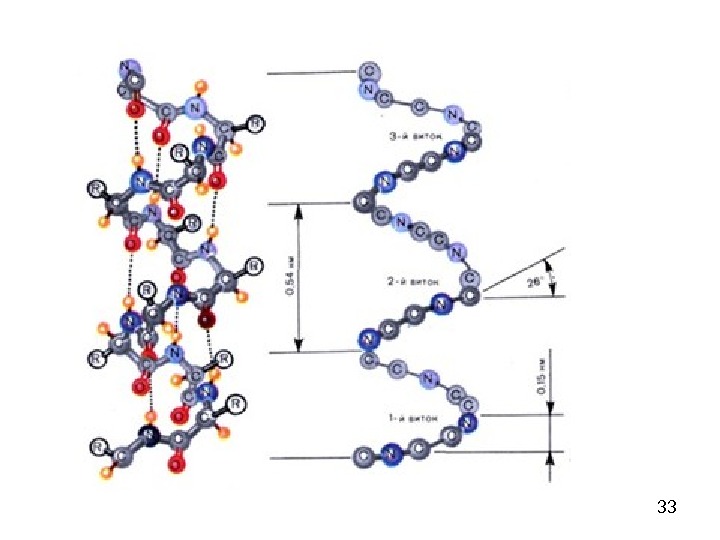
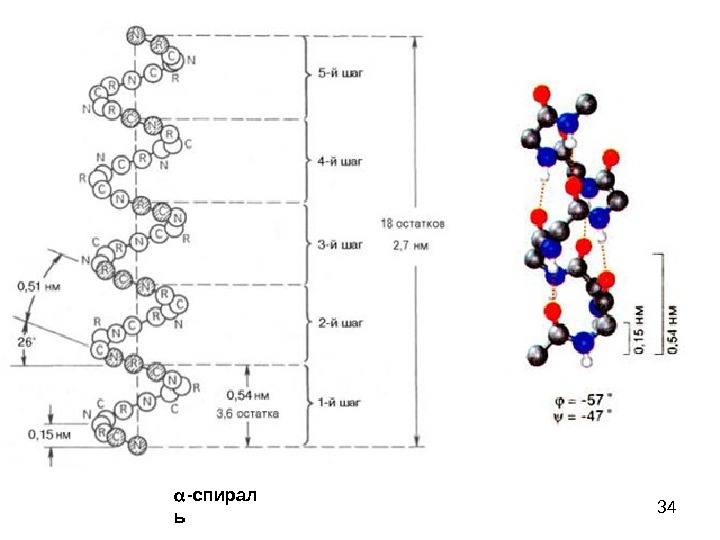
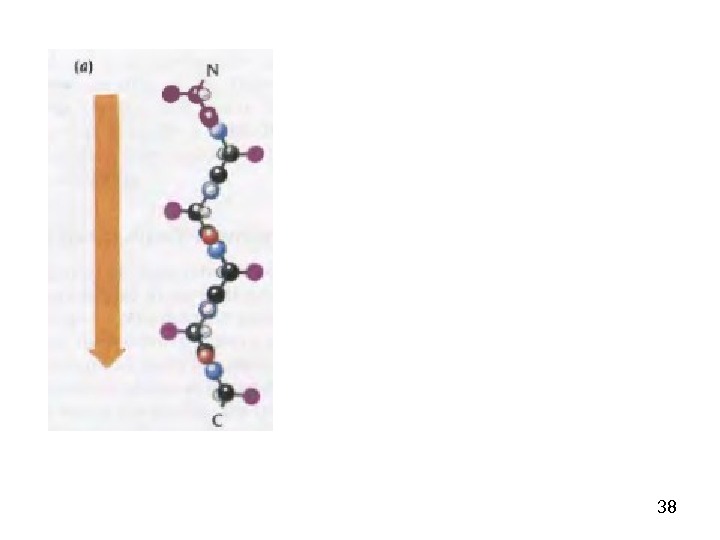
 34 — спирал ь
34 — спирал ь


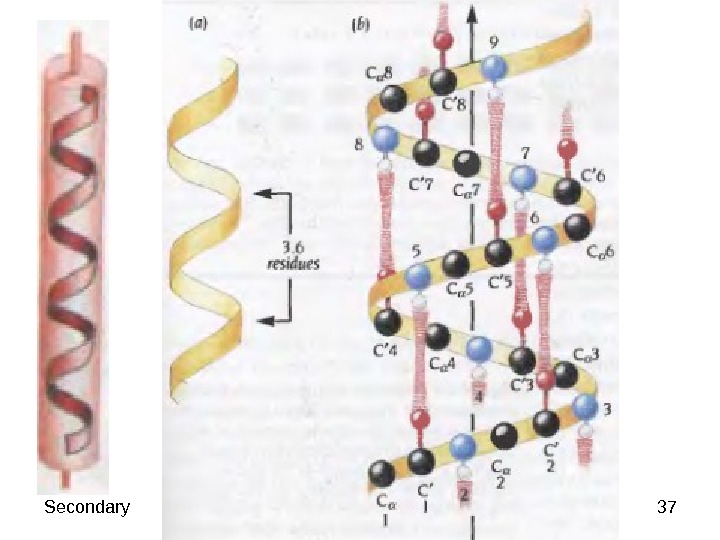
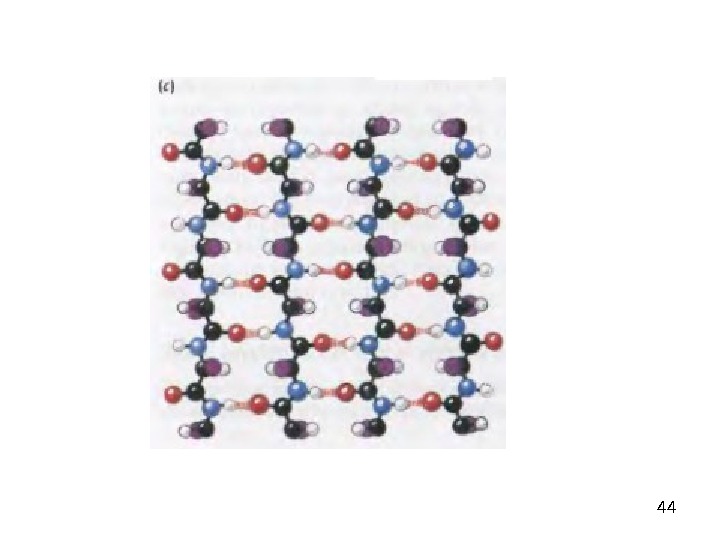
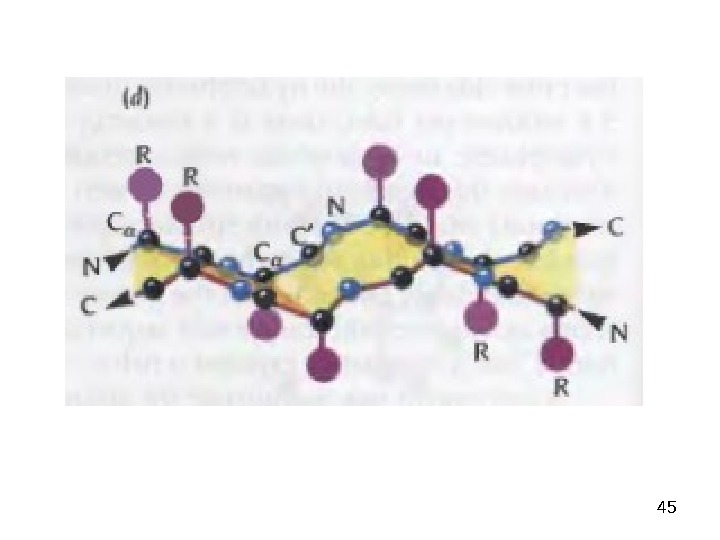
 37 Secondary
37 Secondary

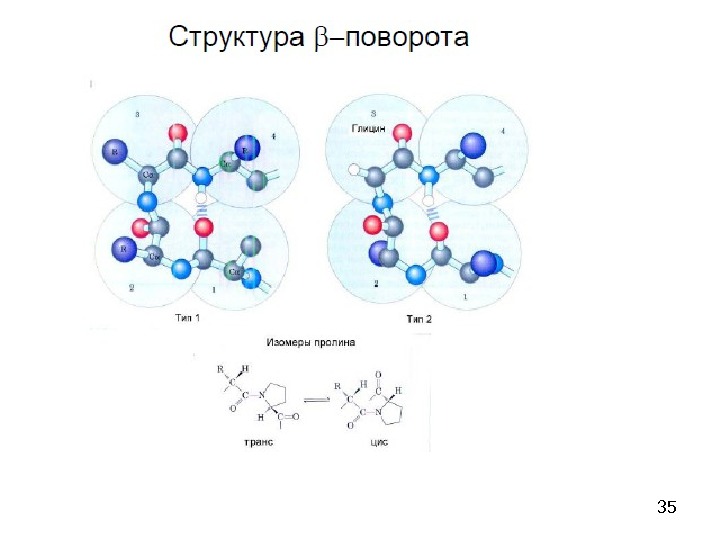
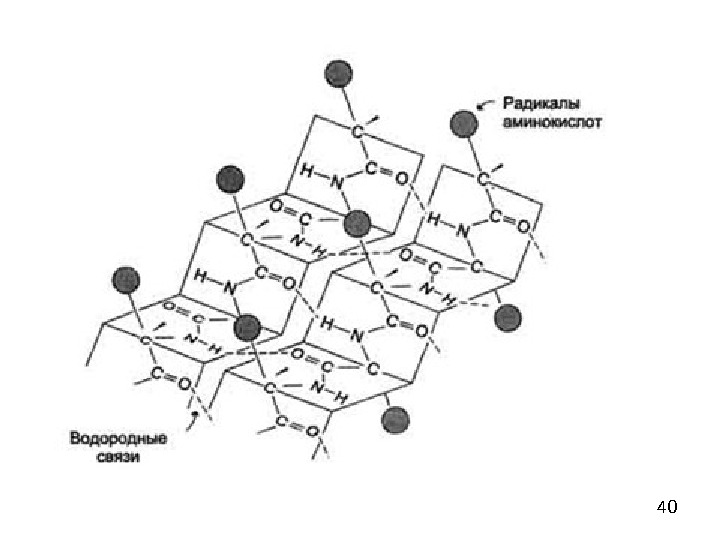
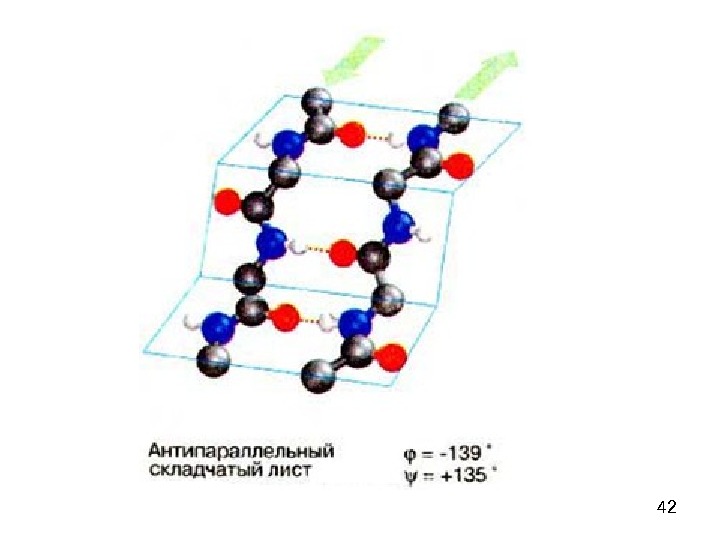
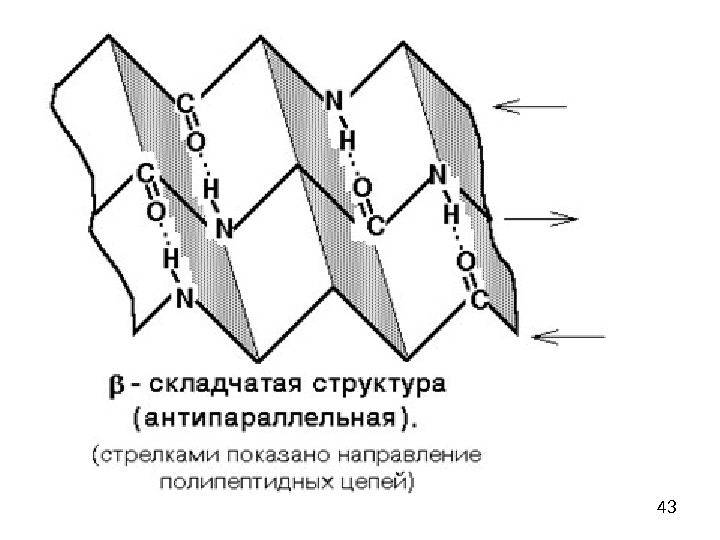
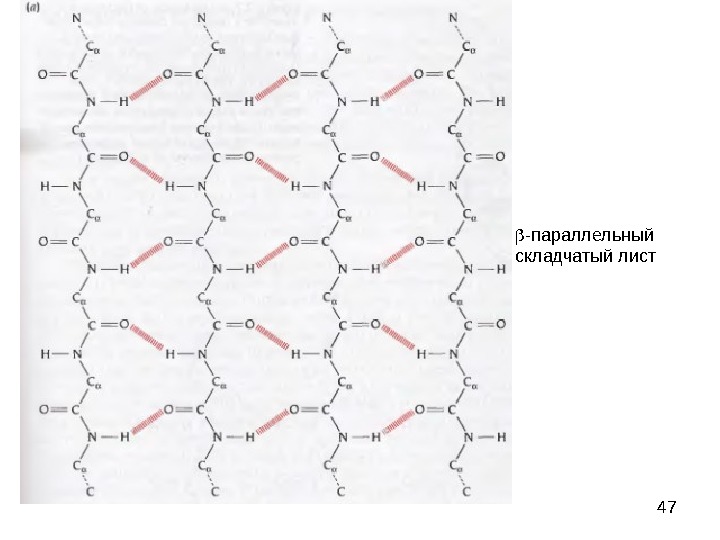
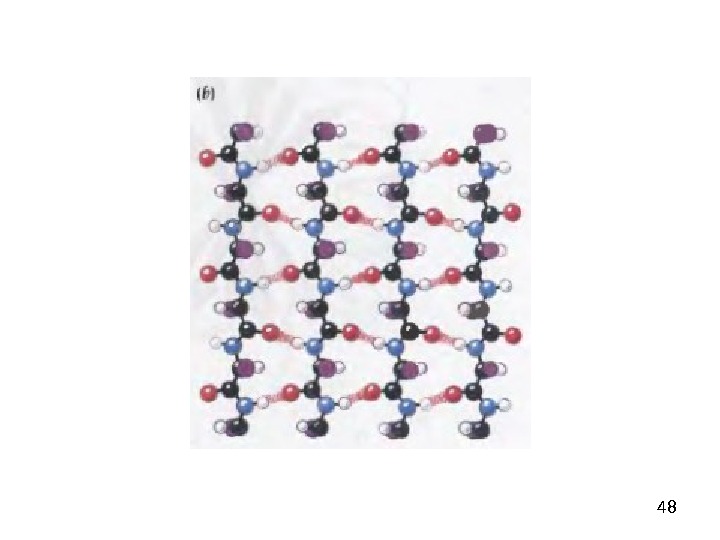
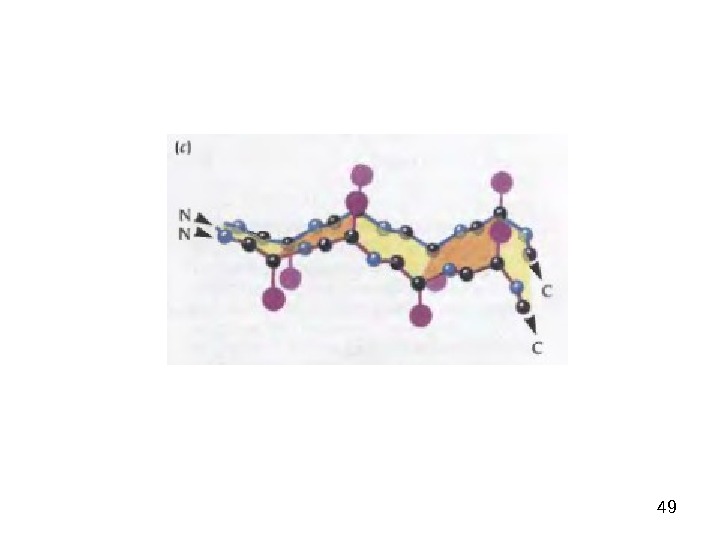
 39β-складчатый лист» — плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B складчатых структурах также образуются поперечные межцепочечные водородные связи. Если цепи ориентированы в противоположных направлениях, структура называется антипараллельным складчатым листом (βα), а если цепи ориентированы в одном направлении, структура называется параллельным складчатым листом (βn). В складчатых структурах α-С-атомы располагаются на перегибах, а боковые цепи ориентированы почти перпендикулярно средней плоскости листа, попеременно вверх и вниз. Энергетически более предпочтительной оказывается βα-складчатая структура с почти линейными H-мостиками. В растянутых складчатых листах отдельные цепи чаще всего не параллельны, а несколько изогнуты относительно друга.
39β-складчатый лист» — плоскости пептидных связей расположены в пространстве подобно равномерным складкам листа бумаги. B складчатых структурах также образуются поперечные межцепочечные водородные связи. Если цепи ориентированы в противоположных направлениях, структура называется антипараллельным складчатым листом (βα), а если цепи ориентированы в одном направлении, структура называется параллельным складчатым листом (βn). В складчатых структурах α-С-атомы располагаются на перегибах, а боковые цепи ориентированы почти перпендикулярно средней плоскости листа, попеременно вверх и вниз. Энергетически более предпочтительной оказывается βα-складчатая структура с почти линейными H-мостиками. В растянутых складчатых листах отдельные цепи чаще всего не параллельны, а несколько изогнуты относительно друга.

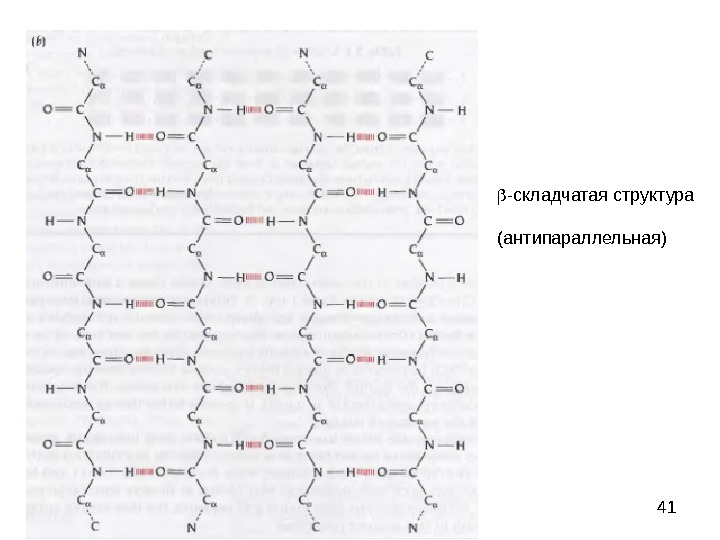
 41 — складчатая структура (антипараллельная)
41 — складчатая структура (антипараллельная)





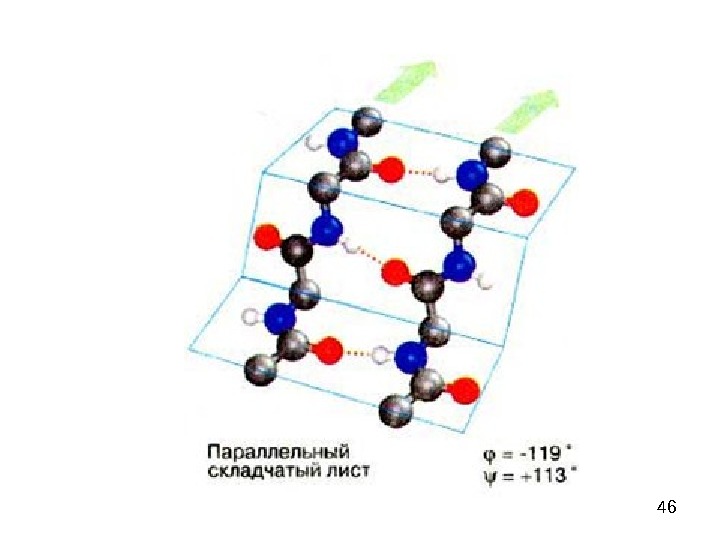
 47 — параллельный складчатый лист
47 — параллельный складчатый лист


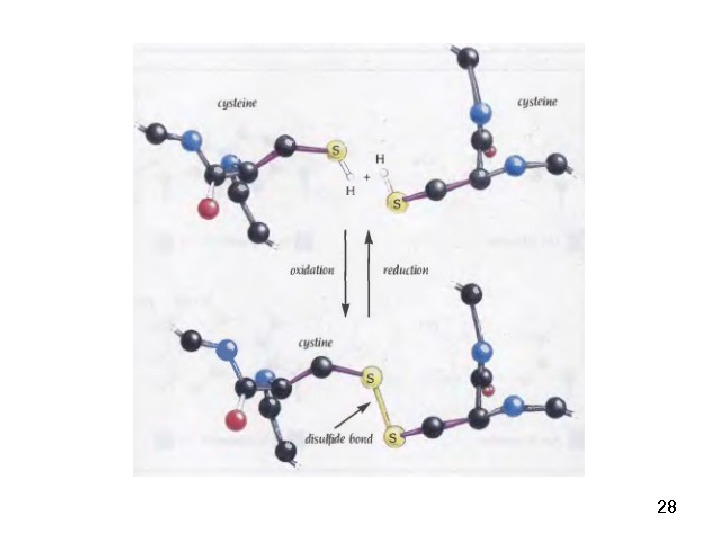
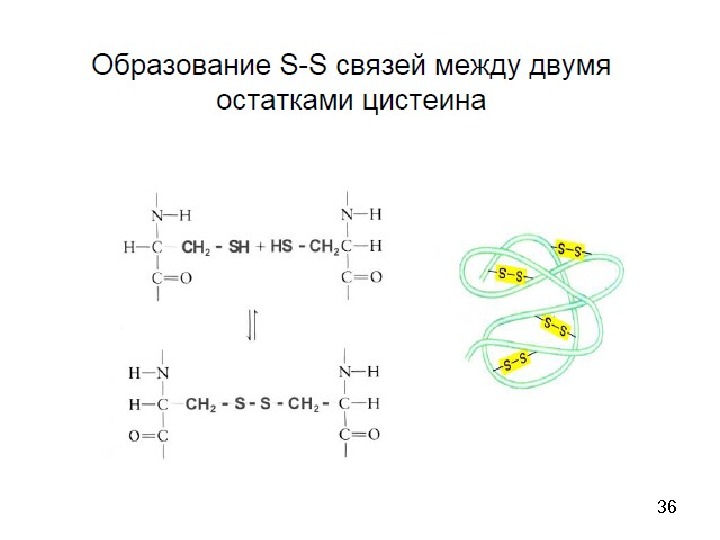
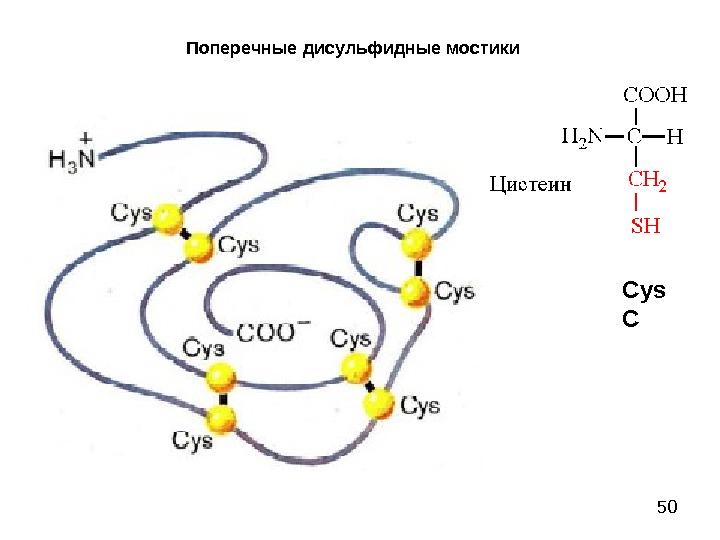
 50 Поперечные дисульфидные мостики Cys
50 Поперечные дисульфидные мостики Cys

 52 Tertiary
52 Tertiary

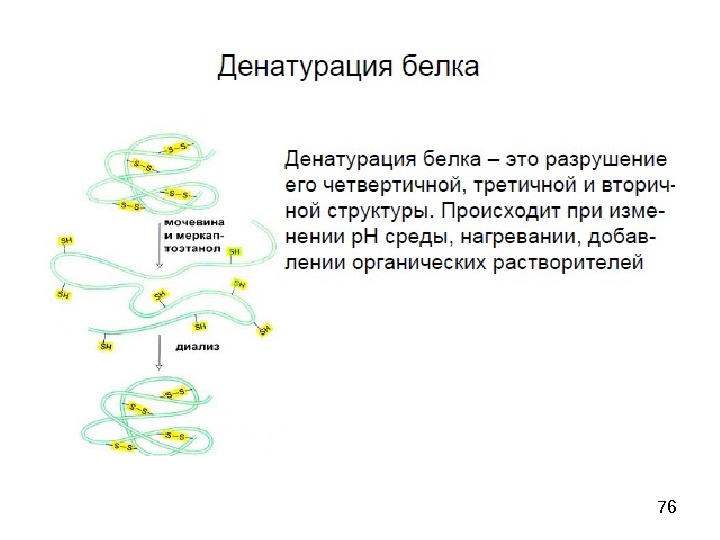
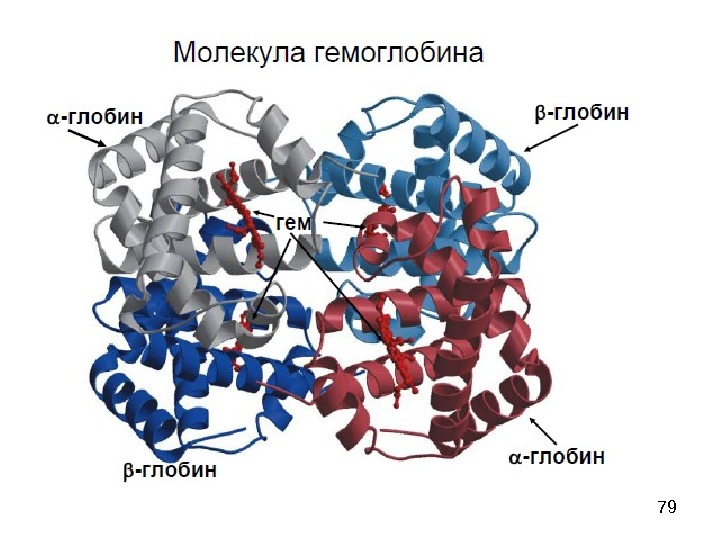
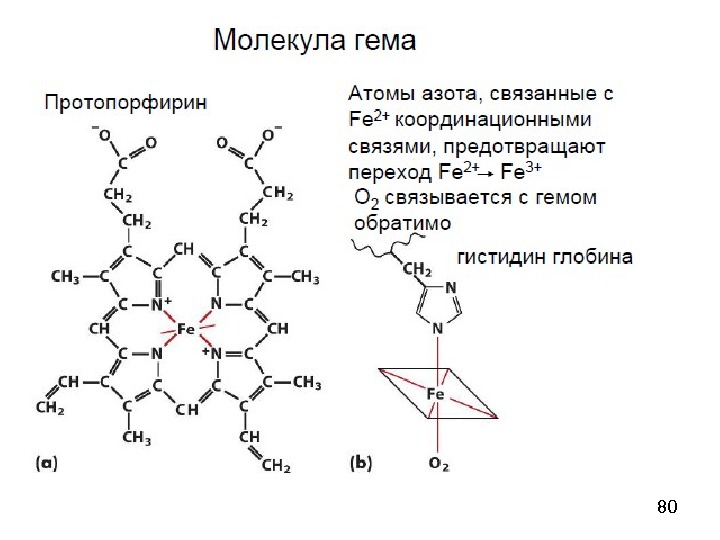
 54 Quaternary
54 Quaternary



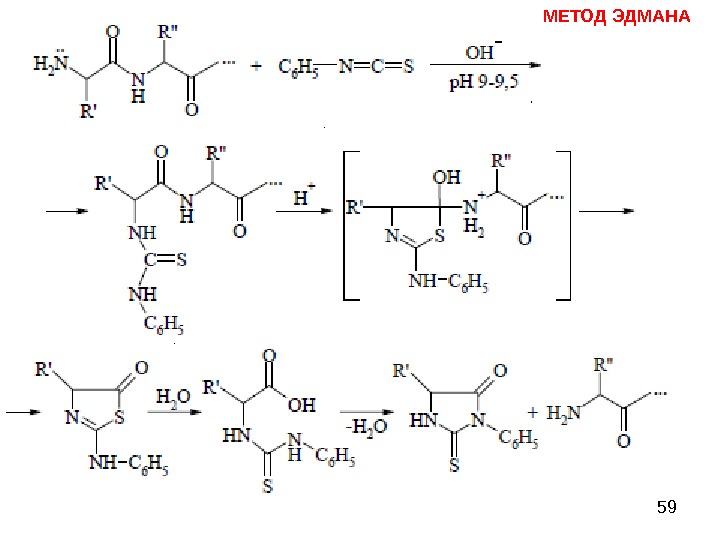
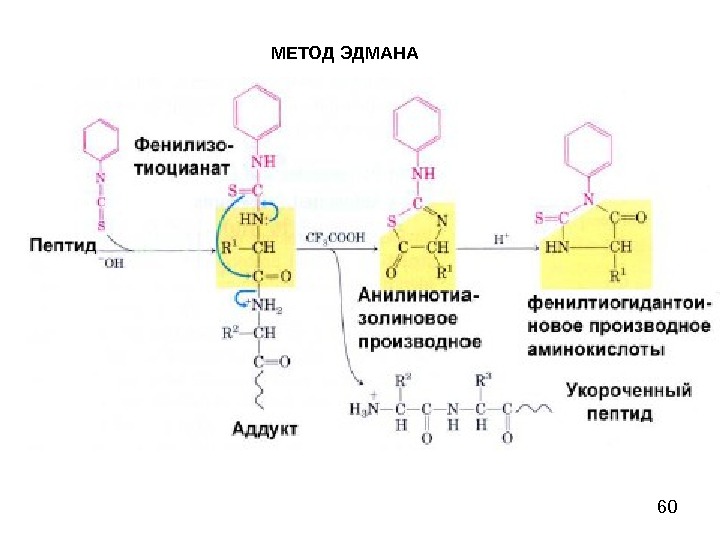
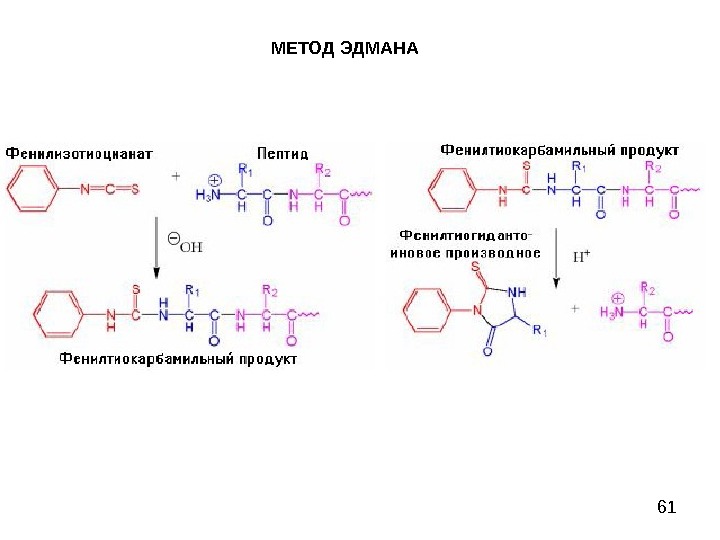
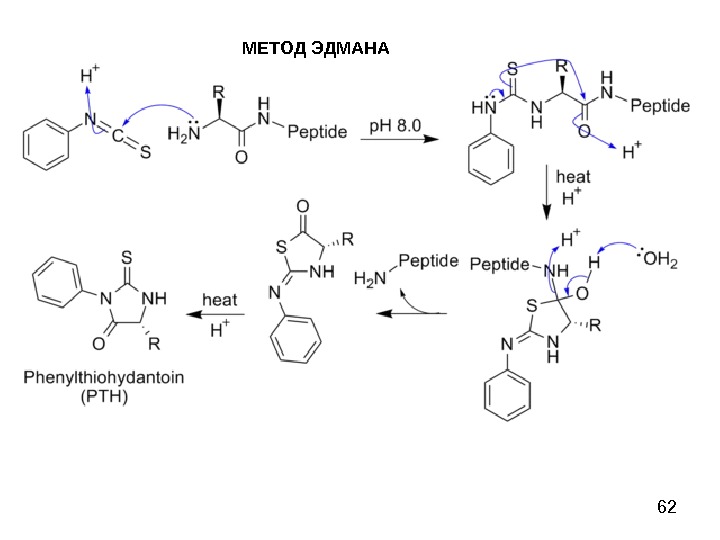
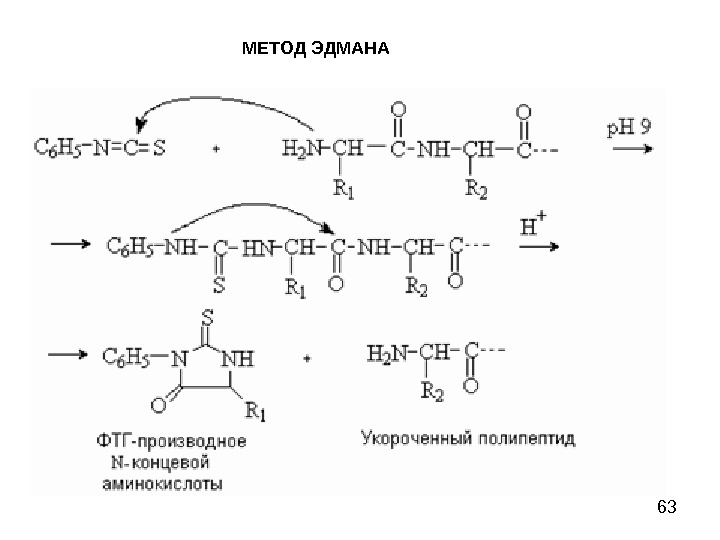
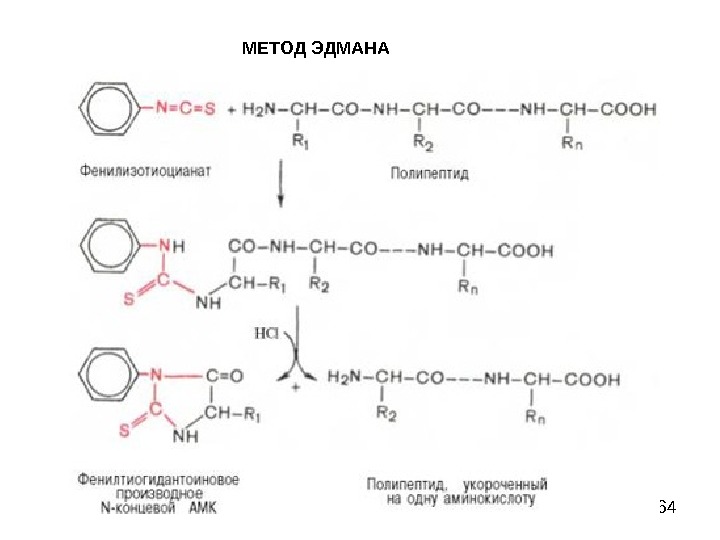
 58 МЕТОД ЭДМАНА Метод Эдмана (метод ступенчатой деструкции, 1950 г. ) К аминогруппе Ν-концевой α-аминокислоты присоединяют фенилизотиоцианат (ФИТЦ), каждый цикл деградации включает в себя 3 стадии: 1) образование фенилтиокарбамоилпептида (ФТК); 2) отщепление Ν-концевого остатка аминокислоты в виде тиазолинона; 3) изомеризация тиазолинона в фенилтиогидантоин (ФТГ) и идентификация его.
58 МЕТОД ЭДМАНА Метод Эдмана (метод ступенчатой деструкции, 1950 г. ) К аминогруппе Ν-концевой α-аминокислоты присоединяют фенилизотиоцианат (ФИТЦ), каждый цикл деградации включает в себя 3 стадии: 1) образование фенилтиокарбамоилпептида (ФТК); 2) отщепление Ν-концевого остатка аминокислоты в виде тиазолинона; 3) изомеризация тиазолинона в фенилтиогидантоин (ФТГ) и идентификация его.
 59 МЕТОД ЭДМАНА
59 МЕТОД ЭДМАНА
 60 МЕТОД ЭДМАНА
60 МЕТОД ЭДМАНА
 61 МЕТОД ЭДМАНА
61 МЕТОД ЭДМАНА
 62 МЕТОД ЭДМАНА
62 МЕТОД ЭДМАНА
 63 МЕТОД ЭДМАНА
63 МЕТОД ЭДМАНА
 64 МЕТОД ЭДМАНА
64 МЕТОД ЭДМАНА
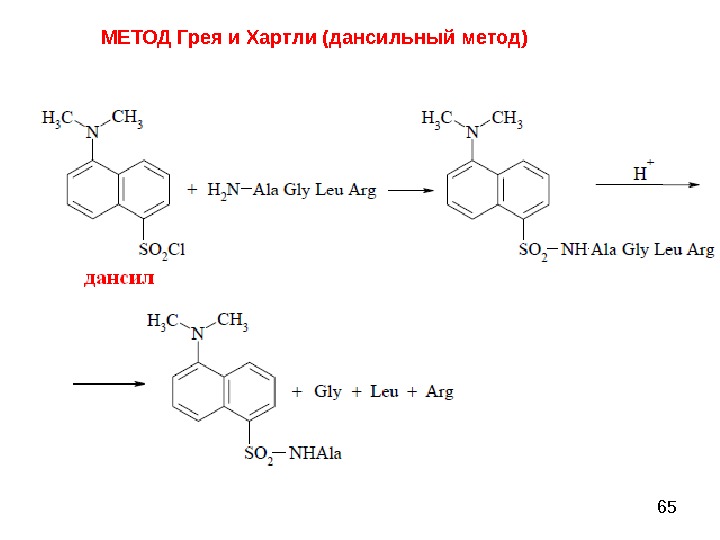
 65 МЕТОД Грея и Хартли (дансильный метод)
65 МЕТОД Грея и Хартли (дансильный метод)
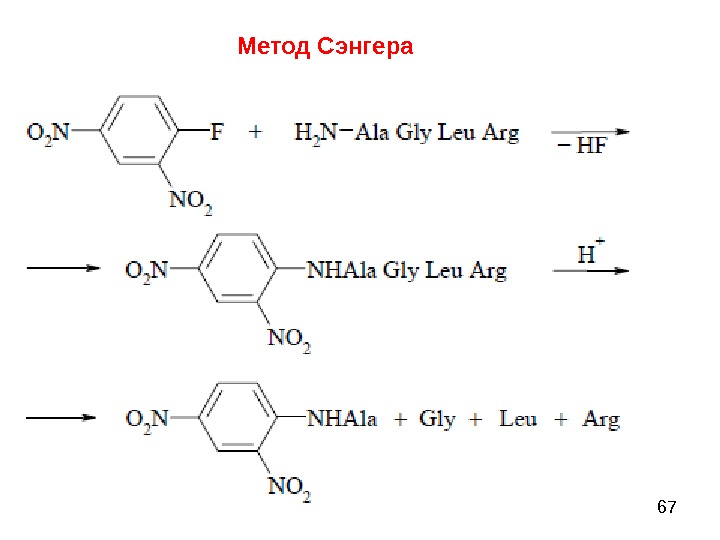
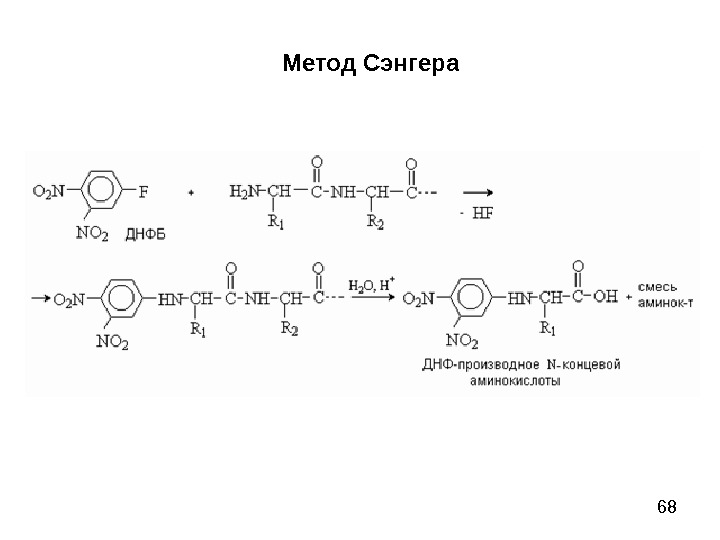
 66 Метод Сэнгера (F. Sanger) основан на реакции арилирования полипептида 2, 4 -динитрофторбензолом (ДНФБ), что приводит к образованию окрашенного в желтый цвет 2, 4 -динитрофенильного производного N-концевой аминокислоты. Раствор полипептида обрабатывают ДНФБ, который взаимодействует со свободной NH 2 -группой N-концевой аминокислоты пептида.
66 Метод Сэнгера (F. Sanger) основан на реакции арилирования полипептида 2, 4 -динитрофторбензолом (ДНФБ), что приводит к образованию окрашенного в желтый цвет 2, 4 -динитрофенильного производного N-концевой аминокислоты. Раствор полипептида обрабатывают ДНФБ, который взаимодействует со свободной NH 2 -группой N-концевой аминокислоты пептида.
 67 Метод Сэнгера
67 Метод Сэнгера
 68 Метод Сэнгера
68 Метод Сэнгера
 69 Метод Сэнгера
69 Метод Сэнгера
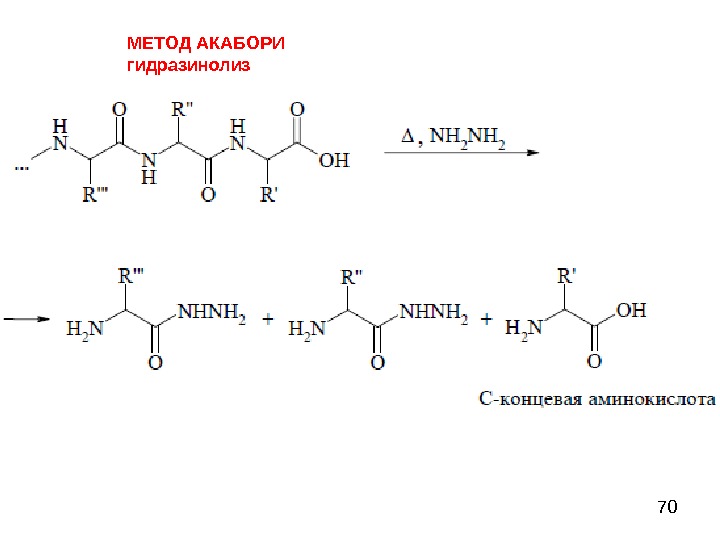
 70 МЕТОД АКАБОРИ гидразинолиз
70 МЕТОД АКАБОРИ гидразинолиз
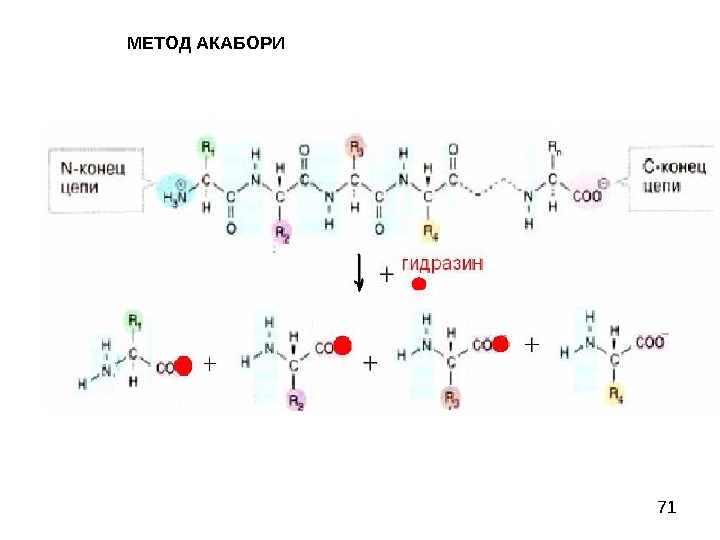
 71 МЕТОД АКАБОРИ
71 МЕТОД АКАБОРИ
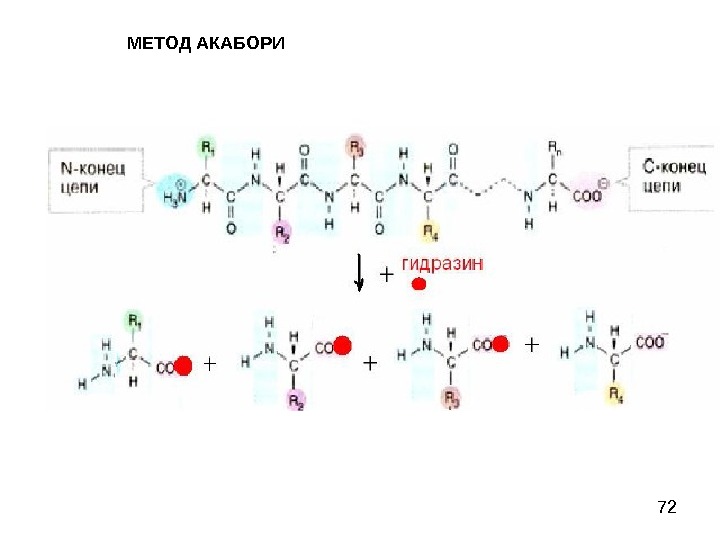
 72 МЕТОД АКАБОРИ
72 МЕТОД АКАБОРИ
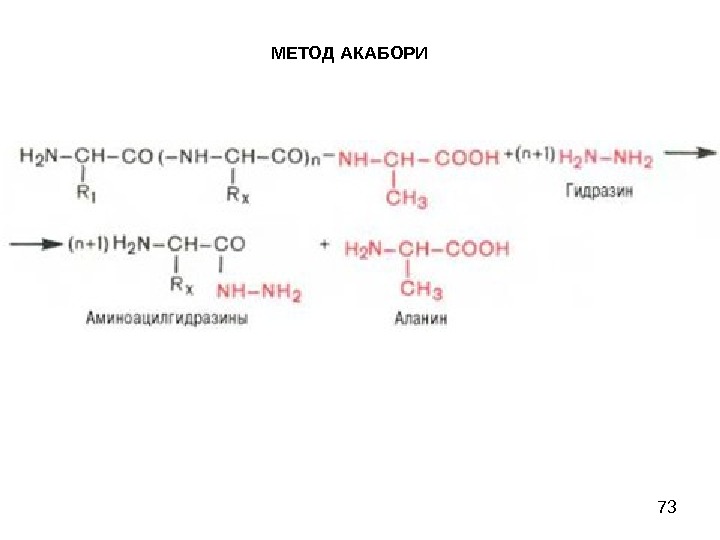
 73 МЕТОД АКАБОРИ
73 МЕТОД АКАБОРИ

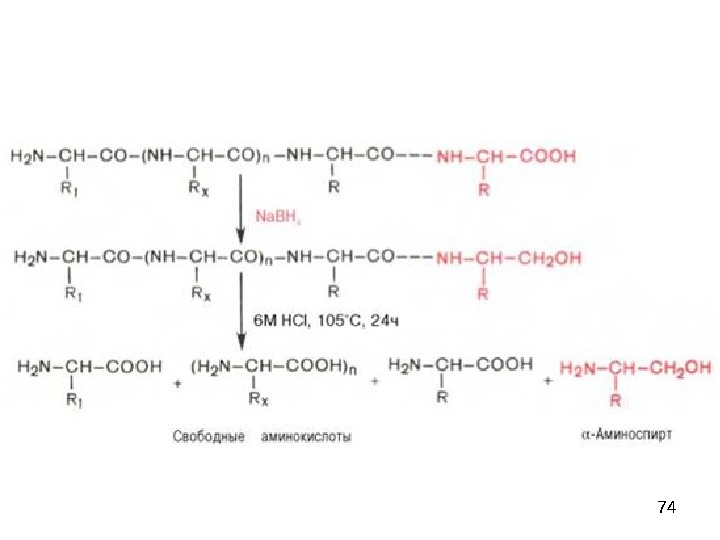
 75 Метод Матсуо (оксазалоновый метод, метод тритиевой метки )
75 Метод Матсуо (оксазалоновый метод, метод тритиевой метки )




















