Презентация alport end















- Размер: 515.5 Кб
- Количество слайдов: 17
Описание презентации Презентация alport end по слайдам
 25. 12. 2010 Синдром Альпорта Карпов Дмитрий Оленчук Владислав Огороднищук Максим Щербакова Ольга
25. 12. 2010 Синдром Альпорта Карпов Дмитрий Оленчук Владислав Огороднищук Максим Щербакова Ольга
 25. 12. 2010 Синдром Альпорта. Историческаясправка: Первое упоминаниепатологии, известнойкаксиндром. Альпорта, принадлежит L. Guthrie, которыйв 1902 г. описалсемьюсгематуриейвнесколькихпоколениях. A. Hurst в 1915 г. вэтойжесемьенаблюдалразвитиеуремии. В 1927 г. A. Alport, описывая глухотуунесколькихродственниковсгематурией, отметил, чтоу мужчин уремияразвиваласьраньше, чемуженщин. В 1972 г. выявленонеравномерноерасширениеирасслоениеплотнойпластинки гломерулярных базальныхмембранприсиндроме. Альпорта, выраженность которых коррелироваласвозрастомиполом, определяяпрогрессирование болезни. В 70 егоды. М. С. Игнатовойи. В. В. Фокеевойнаосновенаблюденияза 200 детьми высказывалась гипотезаоважнейшейроливразвитиинаследственногонефрита патологии соединительнойткани, вкачествекритериясостояниягломерулярных базальных мембранисследоваласьэкскрециягидроксилизингликозидов.
25. 12. 2010 Синдром Альпорта. Историческаясправка: Первое упоминаниепатологии, известнойкаксиндром. Альпорта, принадлежит L. Guthrie, которыйв 1902 г. описалсемьюсгематуриейвнесколькихпоколениях. A. Hurst в 1915 г. вэтойжесемьенаблюдалразвитиеуремии. В 1927 г. A. Alport, описывая глухотуунесколькихродственниковсгематурией, отметил, чтоу мужчин уремияразвиваласьраньше, чемуженщин. В 1972 г. выявленонеравномерноерасширениеирасслоениеплотнойпластинки гломерулярных базальныхмембранприсиндроме. Альпорта, выраженность которых коррелироваласвозрастомиполом, определяяпрогрессирование болезни. В 70 егоды. М. С. Игнатовойи. В. В. Фокеевойнаосновенаблюденияза 200 детьми высказывалась гипотезаоважнейшейроливразвитиинаследственногонефрита патологии соединительнойткани, вкачествекритериясостояниягломерулярных базальных мембранисследоваласьэкскрециягидроксилизингликозидов.
 25. 12. 2010 Синдром Альпорта. Генетика: Гены : Col. IVAIII Col. IVAIV Col. IVAVI Расположение хромосомы: Col. IVAIII, AIV локализуетсяна 2 хромосомечеловекавпозицииq 3537 Col. IVAV локализуетсяв. Ххромосомевпозицииq 2223 Наследственность : C индром. Альпортанаследуетсяпосцепленномус. Ххромосомой доминантному илирецессивномутипу. IIIтип, илиаутосомнодоминантному, или аутосомнорецессивномутипу. Iи. IIтип Тип клеток, местоэкспрессии: Базальная гломерулярнаямембрана. Этобесклеточныйматрикстолщинойв 300500 нм, который представляетсобойструктурнуюопорудлякапиллярнойстенки. Ееглавными компонентами являютсяколлаген. IVтипа, протеогликаны, ламинининидоген. Коллаген плода свозрастомзаменяетсяколлагеномвзрослых. Вслучаяхмутациипроисходит искажение структурыбазальноймембраныгломерулубольныхсиндромом. Альпорта, что ведет кпоявлениюгематурии, какпризнакапочечнойпатологии, агематурияявляется причиной легкойпротеинурии.
25. 12. 2010 Синдром Альпорта. Генетика: Гены : Col. IVAIII Col. IVAIV Col. IVAVI Расположение хромосомы: Col. IVAIII, AIV локализуетсяна 2 хромосомечеловекавпозицииq 3537 Col. IVAV локализуетсяв. Ххромосомевпозицииq 2223 Наследственность : C индром. Альпортанаследуетсяпосцепленномус. Ххромосомой доминантному илирецессивномутипу. IIIтип, илиаутосомнодоминантному, или аутосомнорецессивномутипу. Iи. IIтип Тип клеток, местоэкспрессии: Базальная гломерулярнаямембрана. Этобесклеточныйматрикстолщинойв 300500 нм, который представляетсобойструктурнуюопорудлякапиллярнойстенки. Ееглавными компонентами являютсяколлаген. IVтипа, протеогликаны, ламинининидоген. Коллаген плода свозрастомзаменяетсяколлагеномвзрослых. Вслучаяхмутациипроисходит искажение структурыбазальноймембраныгломерулубольныхсиндромом. Альпорта, что ведет кпоявлениюгематурии, какпризнакапочечнойпатологии, агематурияявляется причиной легкойпротеинурии.
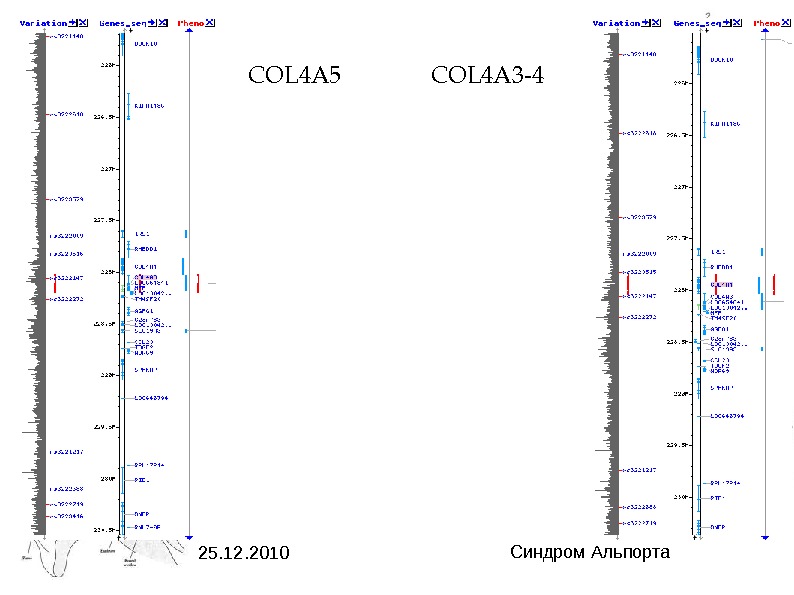
 25. 12. 2010 Синдром Альпорта. COL 4 A 5 COL
25. 12. 2010 Синдром Альпорта. COL 4 A 5 COL
 25. 12. 2010 Синдром Альпорта. Генетика: Число итипмутаций: Коллаген IVтипасостоитизтрехдоменов, плотноскрученныхдругсдругомвнормальном состоянии. Примутациигена(чаще. COL 4 A 5)наблюдаютсяаномалиискручивания коллагена IVтипа. Еслинаблюдаетсяделеция. COL 4 A 5, чтобылоотмеченонамив. ДНК 5 из 16 обследованныхсемей, происходитвыпадениебольшойчастиэкзоновгена. Вэтих случаях нарушаетсяскручиваниедоменов. Заболеваниеимееттяжелоепрогрессирующее течение сразвитиемэкстраренальныхпроявленийиформированием. ХПН. Также наблюдается резкаядеформациягломерулярных. БМ. Приэлектронноймикроскопии(ЭМ) почечного биоптатаотмечаютсявыраженныедистрофическиеизменения. БМсучастками просветления ископлениемтонкогранулярноговещества. Этоприводиткпоявлению протеинурии споследующимиизменениямивсистемеангиотензина. IIи трансформирующего фактораростабета(ТФР ). Экспериментальныеданныеβ подтверждают значимость. ТФР впрогрессированиисиндрома. Альпорта]. Втехслучаях, β когда отмечаетсятолькооднонуклеотиднаязаменавгене, т. е. происходитточечная мутация , нарушенияскручиванияколлагенавыявляютсялишьвотдельныхучастках, БМ остается тонкойиклиническиубольногоимеетместоизолированнаягематурия. Именно подобные случаи. САи. БТБМпредставляютбольшиесложностиприпроведении дифференциального диагноза.
25. 12. 2010 Синдром Альпорта. Генетика: Число итипмутаций: Коллаген IVтипасостоитизтрехдоменов, плотноскрученныхдругсдругомвнормальном состоянии. Примутациигена(чаще. COL 4 A 5)наблюдаютсяаномалиискручивания коллагена IVтипа. Еслинаблюдаетсяделеция. COL 4 A 5, чтобылоотмеченонамив. ДНК 5 из 16 обследованныхсемей, происходитвыпадениебольшойчастиэкзоновгена. Вэтих случаях нарушаетсяскручиваниедоменов. Заболеваниеимееттяжелоепрогрессирующее течение сразвитиемэкстраренальныхпроявленийиформированием. ХПН. Также наблюдается резкаядеформациягломерулярных. БМ. Приэлектронноймикроскопии(ЭМ) почечного биоптатаотмечаютсявыраженныедистрофическиеизменения. БМсучастками просветления ископлениемтонкогранулярноговещества. Этоприводиткпоявлению протеинурии споследующимиизменениямивсистемеангиотензина. IIи трансформирующего фактораростабета(ТФР ). Экспериментальныеданныеβ подтверждают значимость. ТФР впрогрессированиисиндрома. Альпорта]. Втехслучаях, β когда отмечаетсятолькооднонуклеотиднаязаменавгене, т. е. происходитточечная мутация , нарушенияскручиванияколлагенавыявляютсялишьвотдельныхучастках, БМ остается тонкойиклиническиубольногоимеетместоизолированнаягематурия. Именно подобные случаи. САи. БТБМпредставляютбольшиесложностиприпроведении дифференциального диагноза.
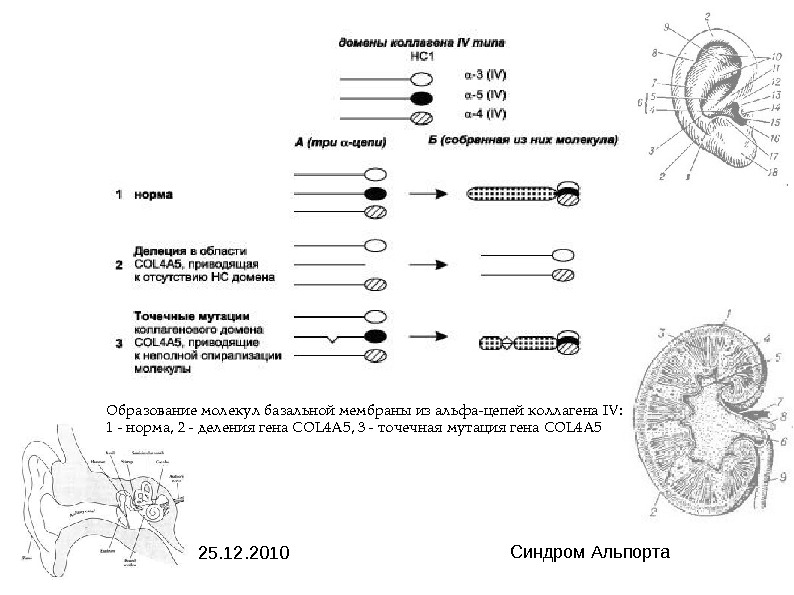
 25. 12. 2010 Синдром Альпорта. Образованиемолекулбазальноймембраныизальфацепейколлагена. IV: 1 норма, 2 делениягена. COL 4 A 5, 3 точечнаямутациягена. COL
25. 12. 2010 Синдром Альпорта. Образованиемолекулбазальноймембраныизальфацепейколлагена. IV: 1 норма, 2 делениягена. COL 4 A 5, 3 точечнаямутациягена. COL
 25. 12. 2010 Синдром Альпорта. Белок: Состав : Коллаген 4 типа Состав Col. IVAIII 1260 аминокислотныхостатков Col. IVAIV 1690 аминокислотныхостатков, включая 38 аминокислот сигнального пептида, отщепляющегосявпроцессесозревания Расположение : Col. IV находитсявбазальныхмембранах. Базальнаямембранаимеет толщину около 1 мкмисостоитиздвухпластинок: светлой(laminalucida) и темной(laminadensa). Основнымикомпонентамибазальныхмембран являются коллаген. IVтипа, ламинин, гепарансульфатсодержащие протеогликаны (ГСПГ). При этомнерастворимостьимеханическуюстабильностьбазальных мембран обеспечиваютмолекулыколлагена. IVтипа, которые организуются вопорнуюсеть. Этаэластичнаятрёхмернаясетьобразует структурный остов, ккоторомуприкрепляютсядругиекомпоненты базальных мембран. В почечныхклубочкахбазальнаямембранаслужитполупроницаемым фильтром , препятствующимпереходумакромолекулизплазмыв первичную мочу.
25. 12. 2010 Синдром Альпорта. Белок: Состав : Коллаген 4 типа Состав Col. IVAIII 1260 аминокислотныхостатков Col. IVAIV 1690 аминокислотныхостатков, включая 38 аминокислот сигнального пептида, отщепляющегосявпроцессесозревания Расположение : Col. IV находитсявбазальныхмембранах. Базальнаямембранаимеет толщину около 1 мкмисостоитиздвухпластинок: светлой(laminalucida) и темной(laminadensa). Основнымикомпонентамибазальныхмембран являются коллаген. IVтипа, ламинин, гепарансульфатсодержащие протеогликаны (ГСПГ). При этомнерастворимостьимеханическуюстабильностьбазальных мембран обеспечиваютмолекулыколлагена. IVтипа, которые организуются вопорнуюсеть. Этаэластичнаятрёхмернаясетьобразует структурный остов, ккоторомуприкрепляютсядругиекомпоненты базальных мембран. В почечныхклубочкахбазальнаямембранаслужитполупроницаемым фильтром , препятствующимпереходумакромолекулизплазмыв первичную мочу.
 25. 12. 2010 Синдром Альпорта. Белок: Структурные особенности: Молекула коллагенапредставляетсобойправозакрученнуюспиральизтрёх цепей. α Один витокспирали цеписодержиттриаминокислотныхостатка. α Молекулярная массаколлагенаоколо 300 к. Да, длина 300 нм, толщина 1, 5 нм. цеписостоитизтриадаминокислот. Втриадахтретьяаминокислотавсегдаα глицин , вторая—пролинилилизин, первая—любаядругаяаминокислота, кроме трёхперечисленных. Первичная структураколлагенахарактеризуетсяпоследовательным расположением аминокислотныхостатковиихколичествомвегополипептидных цепях. Аминокислотымогутотноситьсякалифатическим, карбоциклическими гетероциклическим. Взависимостиотстроениябоковойцепиаминокислотные остатки подразделяютнатипы, составкоторых, %отобщегочисла аминокислотных остатков, данниже. Без боковойцепи(гликоколь)33, 34 С гидрофильнойбоковойцепью: кислотного характера(аспарагиноваяиглютаминоваяаминокислоты)12, 38 основного характера(лизин, оксилизин, аргинин, гистидин)8, 96 Серосодержащие (метионин)0, 70 Содержащие гидроксил, заисключениемоксилизина ( оксипролин, тирозин, серии, треонин)13, 54 Не содержащиеазотикислородвбоковойцепи ( аланин, лейцин, изолейцин, валин, фенилаланин, пролин)31, 48 С иминогруппой(пролиниоксипролин)21, 40 Элементы вторичнойструктурыколлагена–спиральныеполипептидыбелка, так называемые цепи, –являютсяосновнойединицейтретичнойструктуры–α тропоколлагеновой частицы, состоящейизтрехполипептидныхцепейсобщей осью.
25. 12. 2010 Синдром Альпорта. Белок: Структурные особенности: Молекула коллагенапредставляетсобойправозакрученнуюспиральизтрёх цепей. α Один витокспирали цеписодержиттриаминокислотныхостатка. α Молекулярная массаколлагенаоколо 300 к. Да, длина 300 нм, толщина 1, 5 нм. цеписостоитизтриадаминокислот. Втриадахтретьяаминокислотавсегдаα глицин , вторая—пролинилилизин, первая—любаядругаяаминокислота, кроме трёхперечисленных. Первичная структураколлагенахарактеризуетсяпоследовательным расположением аминокислотныхостатковиихколичествомвегополипептидных цепях. Аминокислотымогутотноситьсякалифатическим, карбоциклическими гетероциклическим. Взависимостиотстроениябоковойцепиаминокислотные остатки подразделяютнатипы, составкоторых, %отобщегочисла аминокислотных остатков, данниже. Без боковойцепи(гликоколь)33, 34 С гидрофильнойбоковойцепью: кислотного характера(аспарагиноваяиглютаминоваяаминокислоты)12, 38 основного характера(лизин, оксилизин, аргинин, гистидин)8, 96 Серосодержащие (метионин)0, 70 Содержащие гидроксил, заисключениемоксилизина ( оксипролин, тирозин, серии, треонин)13, 54 Не содержащиеазотикислородвбоковойцепи ( аланин, лейцин, изолейцин, валин, фенилаланин, пролин)31, 48 С иминогруппой(пролиниоксипролин)21, 40 Элементы вторичнойструктурыколлагена–спиральныеполипептидыбелка, так называемые цепи, –являютсяосновнойединицейтретичнойструктуры–α тропоколлагеновой частицы, состоящейизтрехполипептидныхцепейсобщей осью.
 25. 12. 2010 Синдром Альпорта
25. 12. 2010 Синдром Альпорта
 25. 12. 2010 Синдром Альпорта. Белок: Функциональность : Белок (молекулыколлагена. IVтипа)обеспечиваетнерастворимостьи механическую стабильностьбазальныхмембран, которыеорганизуютсяв опорную сеть. Этаэластичнаятрёхмернаясетьобразуетструктурныйостов, к которому прикрепляютсядругиекомпонентыбазальныхмембран. В почечныхклубочкахбазальнаямембранаслужитполупроницаемым фильтром , препятствующимпереходумакромолекулизплазмывпервичную мочу. В какихорганизмахприсутствует: Колаген четвертоготипасодержитсяпреимущественновэукариотах.
25. 12. 2010 Синдром Альпорта. Белок: Функциональность : Белок (молекулыколлагена. IVтипа)обеспечиваетнерастворимостьи механическую стабильностьбазальныхмембран, которыеорганизуютсяв опорную сеть. Этаэластичнаятрёхмернаясетьобразуетструктурныйостов, к которому прикрепляютсядругиекомпонентыбазальныхмембран. В почечныхклубочкахбазальнаямембранаслужитполупроницаемым фильтром , препятствующимпереходумакромолекулизплазмывпервичную мочу. В какихорганизмахприсутствует: Колаген четвертоготипасодержитсяпреимущественновэукариотах.
 25. 12. 2010 Синдром Альпорта. Признакиболезниворганизме: Основные симптомы: Клиническая картинасиндрома. Альпорта, регулярноповторяющаясявсемье, обычно соответствует какомулибофенотипу, хотявыраженностьсимптомовможетменятьсяот человека кчеловекуивзависимостиотвозрастаипола. Большинствосемейсэтой патологией хорошовписываютсявследующуюклассификацию: • Доминантный юношескийнефритстугоухостью. • Х сцепленныйнефритстугоухостьюувзрослых. • Х сцепленныйнефритбезэкстраренальныхпроявлений. • Аутосомно доминантныйнефритстугоухостьюитромбоцитопатией, соответствующий по Mc. Kusickкатегории. N 15365(синдром. Эпштейна). • Аутосомно доминантныйнефритюношескоготипастугоухостью. Юношеским вариантомсиндрома. Альпортасчитаютсятеслучаи, когдахроническая почечная недостаточностьразвиваетсяраньше 31 года.
25. 12. 2010 Синдром Альпорта. Признакиболезниворганизме: Основные симптомы: Клиническая картинасиндрома. Альпорта, регулярноповторяющаясявсемье, обычно соответствует какомулибофенотипу, хотявыраженностьсимптомовможетменятьсяот человека кчеловекуивзависимостиотвозрастаипола. Большинствосемейсэтой патологией хорошовписываютсявследующуюклассификацию: • Доминантный юношескийнефритстугоухостью. • Х сцепленныйнефритстугоухостьюувзрослых. • Х сцепленныйнефритбезэкстраренальныхпроявлений. • Аутосомно доминантныйнефритстугоухостьюитромбоцитопатией, соответствующий по Mc. Kusickкатегории. N 15365(синдром. Эпштейна). • Аутосомно доминантныйнефритюношескоготипастугоухостью. Юношеским вариантомсиндрома. Альпортасчитаютсятеслучаи, когдахроническая почечная недостаточностьразвиваетсяраньше 31 года.
 25. 12. 2010 Синдром Альпорта. Признакиболезниворганизме: Связь сгенетическимизаболеваниями: При болезни. Шарко. Мари. Тутасемейноесочетаниенефропатии, тугоухости, фокально сегментарногогломерулосклерозаирасслоенияплотнойпластинки гломерулярных базальныхмембрансопровождаетсямышечнойатрофией. Нефропатияи тугоухость присиндроме. Branchio. Oto. Renalсочетаетсясрудиментарнымиостатками жаберных щелей. Длясиндрома. Макла. Уэльсахарактерныаутосомнодоминантное наследование , повышение. СОЭ, частоеразвитиехроническойпочечнойнедостаточности, озноб иуртикарнаясыпь(вдебюте), тугоухость, глаукомаинефротическийсиндром ( впоследствии). Присиндроме. Альстремапигментнаядегенерациясетчатки, нейросенсорная тугоухостьинефропатиясочетаютсяссахарнымдиабетомиожирением. Синдром Sebastianтруднодифференцируетсяот. Vтипасиндрома. Альпортавсвязис общей гематологическойкартиной. В сочетаниистугоухостьюописаныинтерстициальныйнефритаутосомнодоминантного генеза сразвитиемхроническойпочечнойнедостаточностивзреломвозрасте, почечный тубулярный ацидозисемейныеслучаи. Ig. Aнефропатии. Средисемейныхслучаев гломерулонефрита чащевстречаютсянаблюденияаутосомнодоминантногонаследования этой патологии. Гематуриейсопровождаетсяиврожденныйдефицит3 йфракции комплемента. Хсцепленноенаследованиепрогрессирующейтугоухостичасто мимикрирует синдром. Альпортавсвязисаллельностьюихгенов
25. 12. 2010 Синдром Альпорта. Признакиболезниворганизме: Связь сгенетическимизаболеваниями: При болезни. Шарко. Мари. Тутасемейноесочетаниенефропатии, тугоухости, фокально сегментарногогломерулосклерозаирасслоенияплотнойпластинки гломерулярных базальныхмембрансопровождаетсямышечнойатрофией. Нефропатияи тугоухость присиндроме. Branchio. Oto. Renalсочетаетсясрудиментарнымиостатками жаберных щелей. Длясиндрома. Макла. Уэльсахарактерныаутосомнодоминантное наследование , повышение. СОЭ, частоеразвитиехроническойпочечнойнедостаточности, озноб иуртикарнаясыпь(вдебюте), тугоухость, глаукомаинефротическийсиндром ( впоследствии). Присиндроме. Альстремапигментнаядегенерациясетчатки, нейросенсорная тугоухостьинефропатиясочетаютсяссахарнымдиабетомиожирением. Синдром Sebastianтруднодифференцируетсяот. Vтипасиндрома. Альпортавсвязис общей гематологическойкартиной. В сочетаниистугоухостьюописаныинтерстициальныйнефритаутосомнодоминантного генеза сразвитиемхроническойпочечнойнедостаточностивзреломвозрасте, почечный тубулярный ацидозисемейныеслучаи. Ig. Aнефропатии. Средисемейныхслучаев гломерулонефрита чащевстречаютсянаблюденияаутосомнодоминантногонаследования этой патологии. Гематуриейсопровождаетсяиврожденныйдефицит3 йфракции комплемента. Хсцепленноенаследованиепрогрессирующейтугоухостичасто мимикрирует синдром. Альпортавсвязисаллельностьюихгенов
 25. 12. 2010 Синдром Альпорта. Признакиболезниворганизме: Типы пораженныхклеток: Нейроны , волосяныеклетки Необычные особенностиболезни: • Поражение нервов(полиневропатия), • Миастения , • Потеря памятииинтеллекта, • Тромбоцитопения. Модель животногодлязаболевания: Белые крысыбеспороднойлинии.
25. 12. 2010 Синдром Альпорта. Признакиболезниворганизме: Типы пораженныхклеток: Нейроны , волосяныеклетки Необычные особенностиболезни: • Поражение нервов(полиневропатия), • Миастения , • Потеря памятииинтеллекта, • Тромбоцитопения. Модель животногодлязаболевания: Белые крысыбеспороднойлинии.
 25. 12. 2010 Синдром Альпорта. Клеточнаяимолекулярнаябиология: Поражение органелл: Поражаются базальныемембраны. Базальная мембранаэтоплотноебесклеточноеобразование, накотором располагаются клеткиэпителияилиэндотелия. Всоставбазальноймембраны входят гликопротеиды, гликозаминогликаныиколлаген. Базальнаямембрана выполняет опорнуюфункцию, поддерживаяформуоргановисосудов. Патология тканейиклиническиеособенностиприсиндроме. Альпортеэто результат , экспрессииколлагена 3, 4, 5, и, возможно, 6(IV)цепейвα α базальной мембране. Этицепи, какправило, отсутствуетилинедостаточно выраженные вбазальныхмембранахлицссиндромом. Альпорте, такчтосети которые ониобразуютотсутствуютили, еслиониприсутствуют, дефективныпо структуре ифункции.
25. 12. 2010 Синдром Альпорта. Клеточнаяимолекулярнаябиология: Поражение органелл: Поражаются базальныемембраны. Базальная мембранаэтоплотноебесклеточноеобразование, накотором располагаются клеткиэпителияилиэндотелия. Всоставбазальноймембраны входят гликопротеиды, гликозаминогликаныиколлаген. Базальнаямембрана выполняет опорнуюфункцию, поддерживаяформуоргановисосудов. Патология тканейиклиническиеособенностиприсиндроме. Альпортеэто результат , экспрессииколлагена 3, 4, 5, и, возможно, 6(IV)цепейвα α базальной мембране. Этицепи, какправило, отсутствуетилинедостаточно выраженные вбазальныхмембранахлицссиндромом. Альпорте, такчтосети которые ониобразуютотсутствуютили, еслиониприсутствуют, дефективныпо структуре ифункции.
 25. 12. 2010 Синдром Альпорта. Клеточнаяимолекулярнаябиология: Нормальные функции: В нормальноразвивающейсяпочке, изначальноколлаген 1(IV)иколлаген 2(IV)α α цепи преобладаютвгломерулярнойбазальноймембраненезрелыхпочечных клубочках. Формированиекапиллярныхпетельвтечениесозреванияклубочков связано споявлениемколлагена 3, 4, и 5(IV)цепейвгломерулярнойα α α базальной мембраны. Втовремякаксозреваниепрогрессирует, 3, 4, и 5(IV)α α α цепи становятсяпреобладающимтипомколлагена. IVвцепяхгломерулярной базальной мембраны. Этотпроцессбылназванкак»изотипныепереключения» (isotypeswitching). Протеинурия ипочечнаянедостаточность, атакженейросенсорнаяглухота, произошли врезультатепроцессов, инициируемыхотсутствиеколлагена 3 4 5(IV) цепи, аневытекаетнепосредственноиззаотсутствияэтихцепей. α α α
25. 12. 2010 Синдром Альпорта. Клеточнаяимолекулярнаябиология: Нормальные функции: В нормальноразвивающейсяпочке, изначальноколлаген 1(IV)иколлаген 2(IV)α α цепи преобладаютвгломерулярнойбазальноймембраненезрелыхпочечных клубочках. Формированиекапиллярныхпетельвтечениесозреванияклубочков связано споявлениемколлагена 3, 4, и 5(IV)цепейвгломерулярнойα α α базальной мембраны. Втовремякаксозреваниепрогрессирует, 3, 4, и 5(IV)α α α цепи становятсяпреобладающимтипомколлагена. IVвцепяхгломерулярной базальной мембраны. Этотпроцессбылназванкак»изотипныепереключения» (isotypeswitching). Протеинурия ипочечнаянедостаточность, атакженейросенсорнаяглухота, произошли врезультатепроцессов, инициируемыхотсутствиеколлагена 3 4 5(IV) цепи, аневытекаетнепосредственноиззаотсутствияэтихцепей. α α α
 25. 12. 2010 Синдром Альпорта. Клеточнаяимолекулярнаябиология: Как мутацииизменяютфункцииорганеллы : Патология аллельныхвариантов Подавляющее большинствомутаций. COL 4 A 5 этогуаниновыезаменывпервой или второйпозицииглициновыхкодонов. Такиемутации, каксчитается, мешают нормальному сплетениюмутировавшего 5 коллагена(IV)сдругимитипамиα коллагена. Боковойцепинехватаетглицина, иприсутствиегромоздкой аминокислоты вглицинпозициипредположительносоздаетизломилитройная спираль разворачивается. Заменaгицинавколлагене 1(I)цепивызываетα несовершенный остеогенез. Неправильносложеннаятройнаяспиратьколлагена обладает повышеннойвосприимчивостьюкпротеолитическойдеградации. Мутации вгенах. Col. IVAIIICol. IVAIVCol. IVAVIимеюттужеразновидность.
25. 12. 2010 Синдром Альпорта. Клеточнаяимолекулярнаябиология: Как мутацииизменяютфункцииорганеллы : Патология аллельныхвариантов Подавляющее большинствомутаций. COL 4 A 5 этогуаниновыезаменывпервой или второйпозицииглициновыхкодонов. Такиемутации, каксчитается, мешают нормальному сплетениюмутировавшего 5 коллагена(IV)сдругимитипамиα коллагена. Боковойцепинехватаетглицина, иприсутствиегромоздкой аминокислоты вглицинпозициипредположительносоздаетизломилитройная спираль разворачивается. Заменaгицинавколлагене 1(I)цепивызываетα несовершенный остеогенез. Неправильносложеннаятройнаяспиратьколлагена обладает повышеннойвосприимчивостьюкпротеолитическойдеградации. Мутации вгенах. Col. IVAIIICol. IVAIVCol. IVAVIимеюттужеразновидность.
 25. 12. 2010 Синдром Альпорта. Спасибозавнимание!
25. 12. 2010 Синдром Альпорта. Спасибозавнимание!

