Поверхностные явления и дисперсные системы









1. Особенности ДС. ppt.ppt
- Количество слайдов: 11
 Поверхностные явления и дисперсные системы
Поверхностные явления и дисперсные системы
 Особенности коллоидных растворов 1. Опалесценция (светорассеяние) – наблюдается «конус Тиндаля» - светящийся конус при пропускании пучка света через коллоидный раствор. Светорассеяние наблюдается когда λ > d. 2. Малая скорость диффузии. Так коэффициент диффузии обратно пропорционален размеру частицы, то в коллоидных системах частицы имеют большие размеры по сравнению с размерами молекул и ионов (rколл > rмолекул). 3. Способность к диализу – коллоидные частицы могут быть отделены от низкомолекулярных примесей (молекул, ионов) с помощью полупроницаемой мембраны. (rколл > rмолекул). 4. Способность к электрофорезу – перемещение коллоидных частиц в электрическом поле. Следовательно, коллоидные частицы имеют электрический заряд. 2
Особенности коллоидных растворов 1. Опалесценция (светорассеяние) – наблюдается «конус Тиндаля» - светящийся конус при пропускании пучка света через коллоидный раствор. Светорассеяние наблюдается когда λ > d. 2. Малая скорость диффузии. Так коэффициент диффузии обратно пропорционален размеру частицы, то в коллоидных системах частицы имеют большие размеры по сравнению с размерами молекул и ионов (rколл > rмолекул). 3. Способность к диализу – коллоидные частицы могут быть отделены от низкомолекулярных примесей (молекул, ионов) с помощью полупроницаемой мембраны. (rколл > rмолекул). 4. Способность к электрофорезу – перемещение коллоидных частиц в электрическом поле. Следовательно, коллоидные частицы имеют электрический заряд. 2
 Коллоидное состояние вещества - высокодисперсное (сильно раздробленное) состояние, в котором отдельные частицы представляют собой агрегаты, состоящие из множества молекул. Такие агрегаты из молекул называют мицеллами. Коллоиды – гетерогенные системы, содержащие вещества в высокодисперсном состоянии. Истинный раствор – дробление вещества до молекул (атомов, ионов) – Na. Cl в воде, канифоль в спирте. Коллоидный раствор – дробление до микрочастиц (агрегатов из молекул) – Na. Cl в спирте, канифоль в воде. 3
Коллоидное состояние вещества - высокодисперсное (сильно раздробленное) состояние, в котором отдельные частицы представляют собой агрегаты, состоящие из множества молекул. Такие агрегаты из молекул называют мицеллами. Коллоиды – гетерогенные системы, содержащие вещества в высокодисперсном состоянии. Истинный раствор – дробление вещества до молекул (атомов, ионов) – Na. Cl в воде, канифоль в спирте. Коллоидный раствор – дробление до микрочастиц (агрегатов из молекул) – Na. Cl в спирте, канифоль в воде. 3
 Признаки объектов коллоидной химии (Песков 1934 г) Для дисперсных систем характерны два основных признака: 1. Гетерогенность (многофазность) – дисперсная система состоит из дисперсной фазы (ДФ) и дисперсионной среды (ДС). Дисперсная фаза – фаза дисперсной системы, раздробленная до мельчайших частиц и находящаяся в непрерывной дисперсионной среде. • качественная характеристика – наличие межфазной поверхности или поверхностного слоя; • количественная характеристика – величина поверхностного натяжения (σ) на границе раздела фаз. 4
Признаки объектов коллоидной химии (Песков 1934 г) Для дисперсных систем характерны два основных признака: 1. Гетерогенность (многофазность) – дисперсная система состоит из дисперсной фазы (ДФ) и дисперсионной среды (ДС). Дисперсная фаза – фаза дисперсной системы, раздробленная до мельчайших частиц и находящаяся в непрерывной дисперсионной среде. • качественная характеристика – наличие межфазной поверхности или поверхностного слоя; • количественная характеристика – величина поверхностного натяжения (σ) на границе раздела фаз. 4
 2. Дисперсность (раздробленность) – определяется размерами тела в трех измерениях. Меры дисперсности: 1. Поперечный размер частиц (а) , м, см (для сферических частиц – диаметр d, для частиц, имеющих форму куба – длина ребра l ). 2. Дисперсность ( D ) – величина, обратная поперечному размеру частицы 3. Удельная поверхность ( S уд ) – межфазная поверхность, приходящаяся на единицу объема дисперсной фазы Объем дисперсной фазы часто не известен, вместо него используют массу дисперсной фазы 5
2. Дисперсность (раздробленность) – определяется размерами тела в трех измерениях. Меры дисперсности: 1. Поперечный размер частиц (а) , м, см (для сферических частиц – диаметр d, для частиц, имеющих форму куба – длина ребра l ). 2. Дисперсность ( D ) – величина, обратная поперечному размеру частицы 3. Удельная поверхность ( S уд ) – межфазная поверхность, приходящаяся на единицу объема дисперсной фазы Объем дисперсной фазы часто не известен, вместо него используют массу дисперсной фазы 5
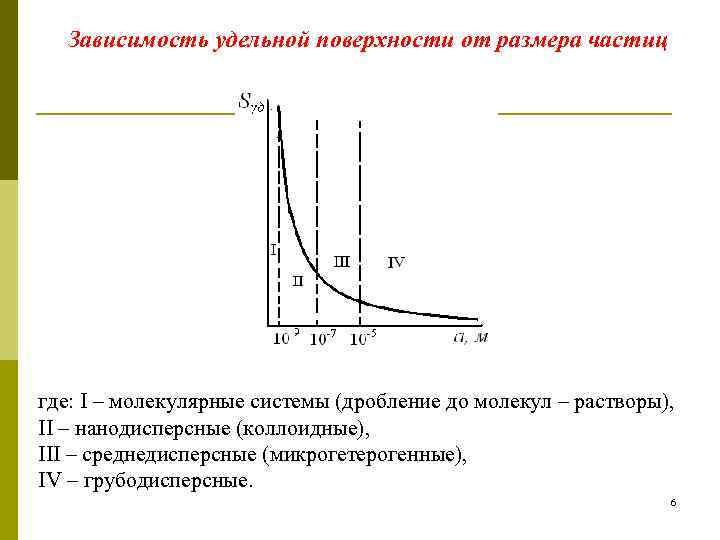
 Зависимость удельной поверхности от размера частиц где: I – молекулярные системы (дробление до молекул – растворы), II – нанодисперсные (коллоидные), III – среднедисперсные (микрогетерогенные), IV – грубодисперсные. 6
Зависимость удельной поверхности от размера частиц где: I – молекулярные системы (дробление до молекул – растворы), II – нанодисперсные (коллоидные), III – среднедисперсные (микрогетерогенные), IV – грубодисперсные. 6
 Специфические особенности коллоидных систем 1. Избыточная поверхностная энергия GS. 60. 000 см 2/см 3 = 6000 м 2/см 3 при длине ребра частицы 1 нм. При увеличении дисперсности резко увеличивается удельная поверхность дисперсной фазы, то есть большая часть всех молекул или атомов, составляющих вещество, находится на поверхности раздела фаз. Поверхностные молекулы находятся в несимметричном силовом поле, что приводит к возникновению избыточной поверхностной энергии, которая обуславливает все своеобразие высокодисперсных систем. 7
Специфические особенности коллоидных систем 1. Избыточная поверхностная энергия GS. 60. 000 см 2/см 3 = 6000 м 2/см 3 при длине ребра частицы 1 нм. При увеличении дисперсности резко увеличивается удельная поверхность дисперсной фазы, то есть большая часть всех молекул или атомов, составляющих вещество, находится на поверхности раздела фаз. Поверхностные молекулы находятся в несимметричном силовом поле, что приводит к возникновению избыточной поверхностной энергии, которая обуславливает все своеобразие высокодисперсных систем. 7
 2. Термодинамическая неустойчивость Из-за высокого значения избыточной поверхностной энергии дисперсные системы термодинамически неустойчивы. 3. Невоспроизводимость (индивидуальность) Поверхность реальной частицы твердого тела состоит из выступов, впадин, участков различной кривизны с различными значениями поверхностной энергии G S. Поэтому две системы одного и того же состава с одинаковой удельной поверхностью могут быть энергетически неравноценны. 4. Структурообразование Любая система стремится к образованию ориентированных структур, чтобы быть термодинамической устойчивой. 8
2. Термодинамическая неустойчивость Из-за высокого значения избыточной поверхностной энергии дисперсные системы термодинамически неустойчивы. 3. Невоспроизводимость (индивидуальность) Поверхность реальной частицы твердого тела состоит из выступов, впадин, участков различной кривизны с различными значениями поверхностной энергии G S. Поэтому две системы одного и того же состава с одинаковой удельной поверхностью могут быть энергетически неравноценны. 4. Структурообразование Любая система стремится к образованию ориентированных структур, чтобы быть термодинамической устойчивой. 8
 Классификации дисперсных систем 1. Классификация по размерам частиц 2. дисперсной фазы • грубодисперсные ГД ( r > 10 -5 м) – частицы видны в обычный микроскоп, оседают под действием силы тяжести, не проходят через бумажные фильтры; • среднедисперсные (микрогетерогенные) (r ≈ 10 -5 ÷ 10 -7 м); • высокодисперсные ВД (коллоидные) ( r ≈ 10 -7 ÷ 10 -9 м), частицы имеют наноразмеры. 9
Классификации дисперсных систем 1. Классификация по размерам частиц 2. дисперсной фазы • грубодисперсные ГД ( r > 10 -5 м) – частицы видны в обычный микроскоп, оседают под действием силы тяжести, не проходят через бумажные фильтры; • среднедисперсные (микрогетерогенные) (r ≈ 10 -5 ÷ 10 -7 м); • высокодисперсные ВД (коллоидные) ( r ≈ 10 -7 ÷ 10 -9 м), частицы имеют наноразмеры. 9
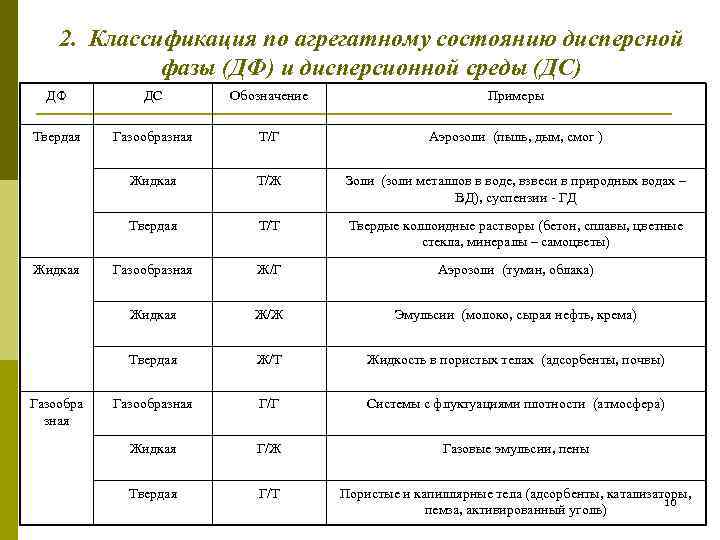
 2. Классификация по агрегатному состоянию дисперсной фазы (ДФ) и дисперсионной среды (ДС) ДФ ДС Обозначение Примеры Твердая Газообразная Т/Г Аэрозоли (пыль, дым, смог ) Жидкая Т/Ж Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД Твердая Т/Т Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы) Жидкая Газообразная Ж/Г Аэрозоли (туман, облака) Жидкая Ж/Ж Эмульсии (молоко, сырая нефть, крема) Твердая Ж/Т Жидкость в пористых телах (адсорбенты, почвы) Газообразная Г/Г Системы с флуктуациями плотности (атмосфера) зная Жидкая Г/Ж Газовые эмульсии, пены Твердая Г/Т Пористые и капиллярные тела (адсорбенты, катализаторы, 10 пемза, активированный уголь)
2. Классификация по агрегатному состоянию дисперсной фазы (ДФ) и дисперсионной среды (ДС) ДФ ДС Обозначение Примеры Твердая Газообразная Т/Г Аэрозоли (пыль, дым, смог ) Жидкая Т/Ж Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД Твердая Т/Т Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы) Жидкая Газообразная Ж/Г Аэрозоли (туман, облака) Жидкая Ж/Ж Эмульсии (молоко, сырая нефть, крема) Твердая Ж/Т Жидкость в пористых телах (адсорбенты, почвы) Газообразная Г/Г Системы с флуктуациями плотности (атмосфера) зная Жидкая Г/Ж Газовые эмульсии, пены Твердая Г/Т Пористые и капиллярные тела (адсорбенты, катализаторы, 10 пемза, активированный уголь)
 3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды (применима только для систем с жидкой дисперсионной средой) Лиофильные Лиофобные Сильное взаимодействием между ДФ Слабое межфазное взаимодействие и ДС Термодинамически устойчивые Термодинамически не устойчивы (равновесные) ΔG ≤ 0 (неравновесные) ΔG > 0 Можно получить самопроизвольным Для получения нужно затратить диспергированием работу Примеры: растворы желатина, Примеры: золи Ме в воде, частицы водорастворимых белков в воде, м. р. с и оксидов (Ag. J, V 2 O 5) в воде, каучука в бензоле, мыло в воде, капли воды в органической жидкости коллоидные ПАВы, критические (нефти) и др. эмульсии и т. д 11
3. Классификация по силе межфазного взаимодействия дисперсной фазы и дисперсионной среды (применима только для систем с жидкой дисперсионной средой) Лиофильные Лиофобные Сильное взаимодействием между ДФ Слабое межфазное взаимодействие и ДС Термодинамически устойчивые Термодинамически не устойчивы (равновесные) ΔG ≤ 0 (неравновесные) ΔG > 0 Можно получить самопроизвольным Для получения нужно затратить диспергированием работу Примеры: растворы желатина, Примеры: золи Ме в воде, частицы водорастворимых белков в воде, м. р. с и оксидов (Ag. J, V 2 O 5) в воде, каучука в бензоле, мыло в воде, капли воды в органической жидкости коллоидные ПАВы, критические (нефти) и др. эмульсии и т. д 11
