попередні дослідження Досліджувана система “Ферум (II) – 1,10-фенантролін”

![Можливі комплексні форми [Fe(H2O)6 ]2++ Phen = [Fe(H2O)4 (Phen)]2+ + 2H2O [Fe(H2O)4 Можливі комплексні форми [Fe(H2O)6 ]2++ Phen = [Fe(H2O)4 (Phen)]2+ + 2H2O [Fe(H2O)4](https://present5.com/presentacii-2/20171213\40388-gricik,_kapralova_fe-phen.ppt\40388-gricik,_kapralova_fe-phen_3.jpg)


40388-gricik,_kapralova_fe-phen.ppt
- Количество слайдов: 11
 попередні дослідження Досліджувана система “Ферум (II) – 1,10-фенантролін” Підготували: Грицик Н., Капралова О. 1
попередні дослідження Досліджувана система “Ферум (II) – 1,10-фенантролін” Підготували: Грицик Н., Капралова О. 1
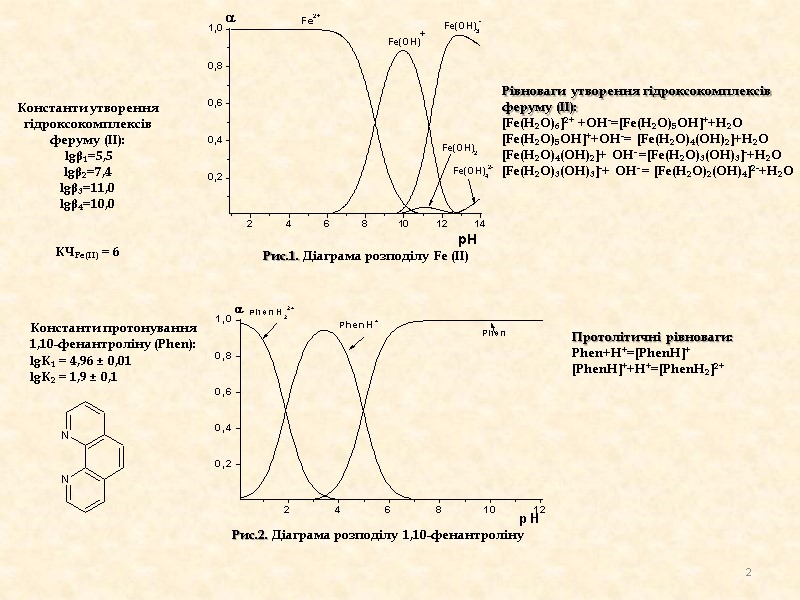
 Рис.1. Діаграма розподілу Fe (II) Константи утворення гідроксокомплексів феруму (ІІ): lgβ1=5,5 lgβ2=7,4 lgβ3=11,0 lgβ4=10,0 КЧFe(II) = 6 Рис.2. Діаграма розподілу 1,10-фенантролінy Константи протонування 1,10-фенантроліну (Phen): lgК1 = 4,96 ± 0,01 lgК2 = 1,9 ± 0,1 Рівноваги утворення гідроксокомплексів феруму (ІІ): [Fe(H2O)6]2+ +OH-=[Fe(H2O)5OH]++H2O [Fe(H2O)5OH]++OH-= [Fe(H2O)4(OH)2]+H2O [Fe(H2O)4(OH)2]+ OH- =[Fe(H2O)3(OH)3]-+H2O [Fe(H2O)3(OH)3]-+ OH- = [Fe(H2O)2(OH)4]2-+H2O Протолітичні рівноваги: Phen+H+=[PhenH]+ [PhenH]++H+=[PhenH2]2+ 2
Рис.1. Діаграма розподілу Fe (II) Константи утворення гідроксокомплексів феруму (ІІ): lgβ1=5,5 lgβ2=7,4 lgβ3=11,0 lgβ4=10,0 КЧFe(II) = 6 Рис.2. Діаграма розподілу 1,10-фенантролінy Константи протонування 1,10-фенантроліну (Phen): lgК1 = 4,96 ± 0,01 lgК2 = 1,9 ± 0,1 Рівноваги утворення гідроксокомплексів феруму (ІІ): [Fe(H2O)6]2+ +OH-=[Fe(H2O)5OH]++H2O [Fe(H2O)5OH]++OH-= [Fe(H2O)4(OH)2]+H2O [Fe(H2O)4(OH)2]+ OH- =[Fe(H2O)3(OH)3]-+H2O [Fe(H2O)3(OH)3]-+ OH- = [Fe(H2O)2(OH)4]2-+H2O Протолітичні рівноваги: Phen+H+=[PhenH]+ [PhenH]++H+=[PhenH2]2+ 2
![>Можливі комплексні форми [Fe(H2O)6 ]2++ Phen = [Fe(H2O)4 (Phen)]2+ + 2H2O [Fe(H2O)4 >Можливі комплексні форми [Fe(H2O)6 ]2++ Phen = [Fe(H2O)4 (Phen)]2+ + 2H2O [Fe(H2O)4](https://present5.com/presentacii-2/20171213\40388-gricik,_kapralova_fe-phen.ppt\40388-gricik,_kapralova_fe-phen_3.jpg) Можливі комплексні форми [Fe(H2O)6 ]2++ Phen = [Fe(H2O)4 (Phen)]2+ + 2H2O [Fe(H2O)4 (Phen)]2+ + Phen = [Fe(H2O)2(Phen)2 ]2+ + 2H2O [Fe(H2O)2(Phen)2 ]2+ + Phen = [Fe(Phen)3 ]2+ + 2H2O [Fe(H2O)5(OH)]++ Phen = [Fe(H2O)3(OH)(Phen)]+ + 2H2O [Fe(H2O)5(OH)]++ Phen = [Fe(H2O)4(Phen)]2+ + H2O+ OH- [Fe(H2O)4(Phen)]2+ + Phen = [Fe(H2O)2(Phen)2 ]2+ + 2H2O [Fe(H2O)3(OH)(Phen)]+ + Phen = [Fe(H2O)(OH)(Phen)2]++ 2H2O [Fe(H2O)3(OH)(Phen)]+ + Phen = [Fe(H2O)2(Phen)2]2+ + H2O + OH- [Fe(H2O)(OH)(Phen)2]++Phen = [Fe(Phen)3 ]2+ + H2O + OH- [Fe(H2O)2(Phen)2]2+ + Phen = [Fe(Phen)3 ]2+ + 2H2O [Fe(H2O)6 ]2++ PhenH+ = [Fe(H2O)4 (Phen)]2+ + 2H2O + H+ [Fe(H2O)4 (Phen)]2+ + PhenH+ = [Fe(H2O)2(Phen)2 ]2+ + 2H2O + H+ [Fe(H2O)2(Phen)2 ]2+ + PhenH+ = [Fe(Phen)3 ]2+ + 2H2O + H+ [Fe(H2O)5(OH)]++ PhenH+ = [Fe(H2O)3(OH)(Phen)]+ + 2H2O + H+ [Fe(H2O)5(OH)]++ PhenH+ = [Fe(H2O)4(Phen)]2+ + H2O + H++ OH- [Fe(H2O)4(Phen)]+ )]++ PhenH+ = [Fe(H2O)2(Phen)2]2+ + 2H2O + H+ [Fe(H2O)3(OH)(Phen)]+ + PhenH+ = [Fe(H2O)(OH)(Phen)2]++ 2H2O + H+ [Fe(H2O)3(OH)(Phen)]+ + PhenH+ = [Fe(H2O)2(Phen)2]2+ + H2O + OH- + H+ [Fe(H2O)(OH)(Phen)2]++ PhenH+ = [Fe(Phen)3 ]2+ + H2O + OH- + H+ [Fe(H2O)2(Phen)2]2+ + PhenH+ = [Fe(Phen)3 ]2+ + 2H2O + H+ 3
Можливі комплексні форми [Fe(H2O)6 ]2++ Phen = [Fe(H2O)4 (Phen)]2+ + 2H2O [Fe(H2O)4 (Phen)]2+ + Phen = [Fe(H2O)2(Phen)2 ]2+ + 2H2O [Fe(H2O)2(Phen)2 ]2+ + Phen = [Fe(Phen)3 ]2+ + 2H2O [Fe(H2O)5(OH)]++ Phen = [Fe(H2O)3(OH)(Phen)]+ + 2H2O [Fe(H2O)5(OH)]++ Phen = [Fe(H2O)4(Phen)]2+ + H2O+ OH- [Fe(H2O)4(Phen)]2+ + Phen = [Fe(H2O)2(Phen)2 ]2+ + 2H2O [Fe(H2O)3(OH)(Phen)]+ + Phen = [Fe(H2O)(OH)(Phen)2]++ 2H2O [Fe(H2O)3(OH)(Phen)]+ + Phen = [Fe(H2O)2(Phen)2]2+ + H2O + OH- [Fe(H2O)(OH)(Phen)2]++Phen = [Fe(Phen)3 ]2+ + H2O + OH- [Fe(H2O)2(Phen)2]2+ + Phen = [Fe(Phen)3 ]2+ + 2H2O [Fe(H2O)6 ]2++ PhenH+ = [Fe(H2O)4 (Phen)]2+ + 2H2O + H+ [Fe(H2O)4 (Phen)]2+ + PhenH+ = [Fe(H2O)2(Phen)2 ]2+ + 2H2O + H+ [Fe(H2O)2(Phen)2 ]2+ + PhenH+ = [Fe(Phen)3 ]2+ + 2H2O + H+ [Fe(H2O)5(OH)]++ PhenH+ = [Fe(H2O)3(OH)(Phen)]+ + 2H2O + H+ [Fe(H2O)5(OH)]++ PhenH+ = [Fe(H2O)4(Phen)]2+ + H2O + H++ OH- [Fe(H2O)4(Phen)]+ )]++ PhenH+ = [Fe(H2O)2(Phen)2]2+ + 2H2O + H+ [Fe(H2O)3(OH)(Phen)]+ + PhenH+ = [Fe(H2O)(OH)(Phen)2]++ 2H2O + H+ [Fe(H2O)3(OH)(Phen)]+ + PhenH+ = [Fe(H2O)2(Phen)2]2+ + H2O + OH- + H+ [Fe(H2O)(OH)(Phen)2]++ PhenH+ = [Fe(Phen)3 ]2+ + H2O + OH- + H+ [Fe(H2O)2(Phen)2]2+ + PhenH+ = [Fe(Phen)3 ]2+ + 2H2O + H+ 3
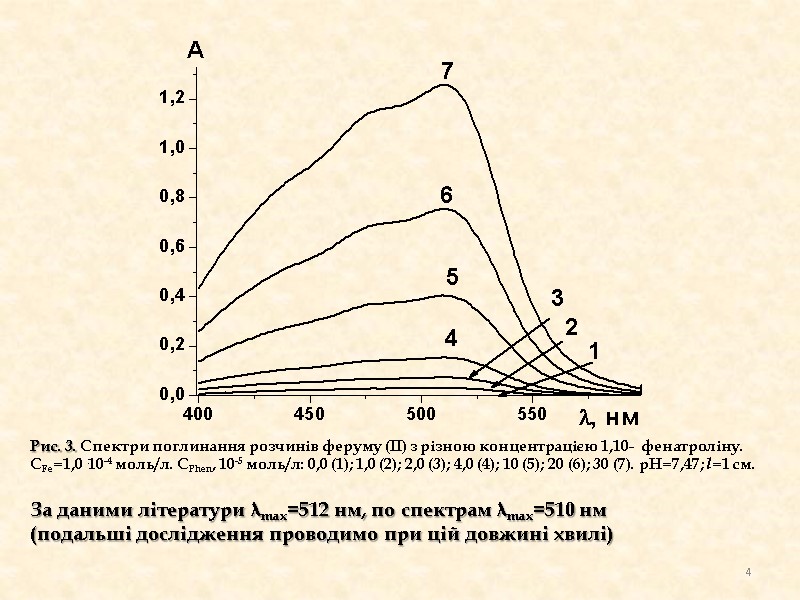
 Рис. 3. Спектри поглинання розчинів феруму (ІІ) з різною концентрацією 1,10- фенатроліну. СFe=1,0·10-4 моль/л. СPhen, 10-5 моль/л: 0,0 (1); 1,0 (2); 2,0 (3); 4,0 (4); 10 (5); 20 (6); 30 (7). рН=7,47; l=1 см. За даними літератури λmax=512 нм, по спектрам λmax=510 нм (подальші дослідження проводимо при цій довжині хвилі) 4
Рис. 3. Спектри поглинання розчинів феруму (ІІ) з різною концентрацією 1,10- фенатроліну. СFe=1,0·10-4 моль/л. СPhen, 10-5 моль/л: 0,0 (1); 1,0 (2); 2,0 (3); 4,0 (4); 10 (5); 20 (6); 30 (7). рН=7,47; l=1 см. За даними літератури λmax=512 нм, по спектрам λmax=510 нм (подальші дослідження проводимо при цій довжині хвилі) 4
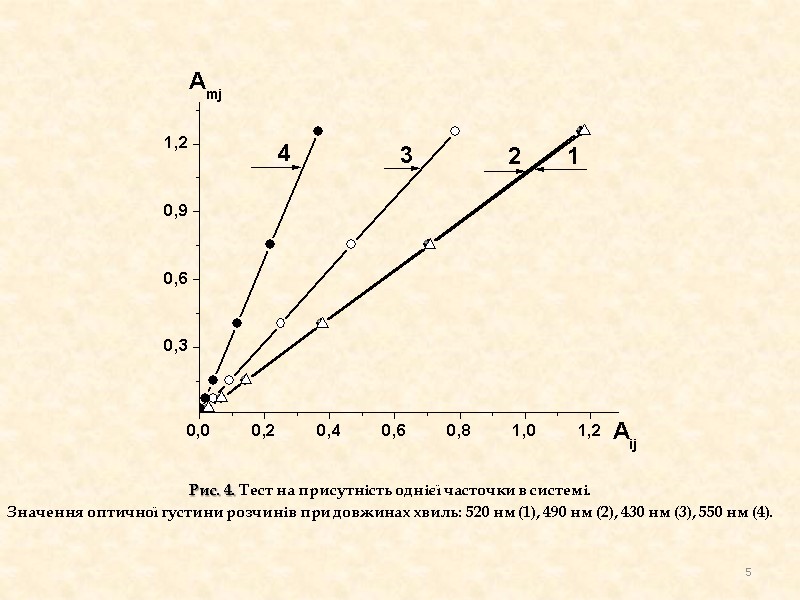
 Рис. 4. Тест на присутність однієї часточки в системі. Значення оптичної густини розчинів при довжинах хвиль: 520 нм (1), 490 нм (2), 430 нм (3), 550 нм (4). 5
Рис. 4. Тест на присутність однієї часточки в системі. Значення оптичної густини розчинів при довжинах хвиль: 520 нм (1), 490 нм (2), 430 нм (3), 550 нм (4). 5
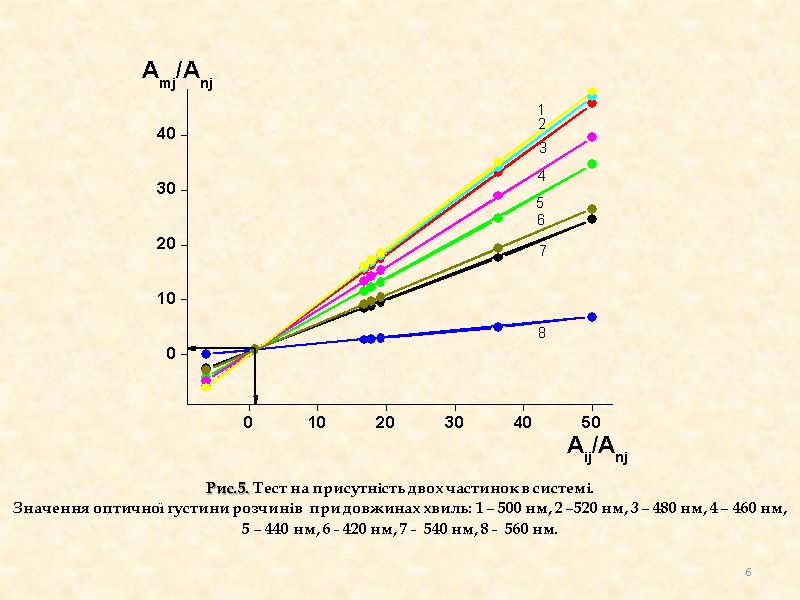
 Рис.5. Тест на присутність двох частинок в системі. Значення оптичної густини розчинів при довжинах хвиль: 1 – 500 нм, 2 –520 нм, 3 – 480 нм, 4 – 460 нм, 5 – 440 нм, 6 - 420 нм, 7 - 540 нм, 8 - 560 нм. 6
Рис.5. Тест на присутність двох частинок в системі. Значення оптичної густини розчинів при довжинах хвиль: 1 – 500 нм, 2 –520 нм, 3 – 480 нм, 4 – 460 нм, 5 – 440 нм, 6 - 420 нм, 7 - 540 нм, 8 - 560 нм. 6
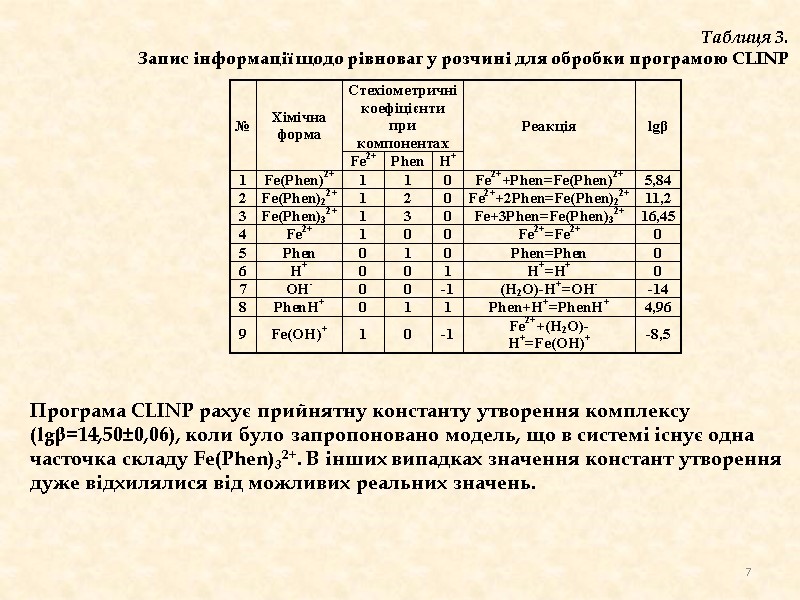
 Таблиця 3. Запис інформації щодо рівноваг у розчині для обробки програмою CLINP Програма CLINP рахує прийнятну константу утворення комплексу (lgβ=14,50±0,06), коли було запропоновано модель, що в системі існує одна часточка складу Fe(Phen)32+. В інших випадках значення констант утворення дуже відхилялися від можливих реальних значень. 7
Таблиця 3. Запис інформації щодо рівноваг у розчині для обробки програмою CLINP Програма CLINP рахує прийнятну константу утворення комплексу (lgβ=14,50±0,06), коли було запропоновано модель, що в системі існує одна часточка складу Fe(Phen)32+. В інших випадках значення констант утворення дуже відхилялися від можливих реальних значень. 7
 На спектрах поглинання розчинів Fe (ІІ) з різною концентрацією 1,10-фенантроліну, видно, що ізобестичної точки немає. Це свідчить про те, що в даній системі існує лише одна комплексна частка. Тест на присутність однієї часточки в системі дає позитивні результати, оскільки всі прямі проходять через початок координат. Тест на присутність двох часточок в системі дає негативні результати, оскільки прямі мають спільну точку перетину не в початку координат. Програма CLINP рахує адекватну константу утворення комплексу (lgβ=14,50±0,06), коли було запропоновано модель, що в системі існує одна часточка складу Fe(Phen)32+. Таким чином отримані у різний спосіб результати свідчать, що в системі присутня одна часточка складу Fe(Phen)32+. Отримані результати узгоджуються з даними літератури, в яких відмічається, що оранжево-червоний комплекс (λмакс=512 нм) Fe(Phen)32+ утворюється в широких межах рН (2-9). При утворенні комплексу замикаються стійкі п'ятичленні цикли. висновки 8
На спектрах поглинання розчинів Fe (ІІ) з різною концентрацією 1,10-фенантроліну, видно, що ізобестичної точки немає. Це свідчить про те, що в даній системі існує лише одна комплексна частка. Тест на присутність однієї часточки в системі дає позитивні результати, оскільки всі прямі проходять через початок координат. Тест на присутність двох часточок в системі дає негативні результати, оскільки прямі мають спільну точку перетину не в початку координат. Програма CLINP рахує адекватну константу утворення комплексу (lgβ=14,50±0,06), коли було запропоновано модель, що в системі існує одна часточка складу Fe(Phen)32+. Таким чином отримані у різний спосіб результати свідчать, що в системі присутня одна часточка складу Fe(Phen)32+. Отримані результати узгоджуються з даними літератури, в яких відмічається, що оранжево-червоний комплекс (λмакс=512 нм) Fe(Phen)32+ утворюється в широких межах рН (2-9). При утворенні комплексу замикаються стійкі п'ятичленні цикли. висновки 8
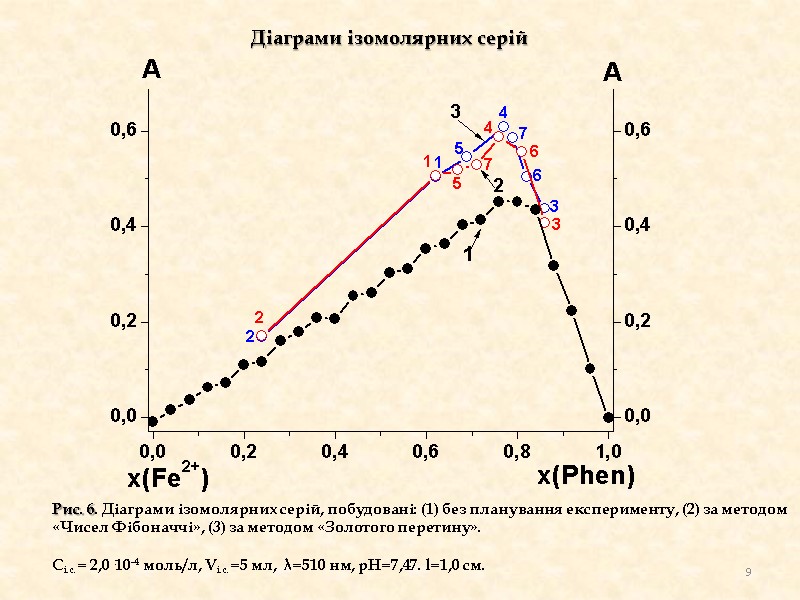
 Рис. 6. Діаграми ізомолярних серій, побудовані: (1) без планування експерименту, (2) за методом «Чисел Фібоначчі», (3) за методом «Золотого перетину». Сі.с.= 2,0·10-4 моль/л, Vі.с.=5 мл, λ=510 нм, рН=7,47. l=1,0 см. Діаграми ізомолярних серій 9
Рис. 6. Діаграми ізомолярних серій, побудовані: (1) без планування експерименту, (2) за методом «Чисел Фібоначчі», (3) за методом «Золотого перетину». Сі.с.= 2,0·10-4 моль/л, Vі.с.=5 мл, λ=510 нм, рН=7,47. l=1,0 см. Діаграми ізомолярних серій 9
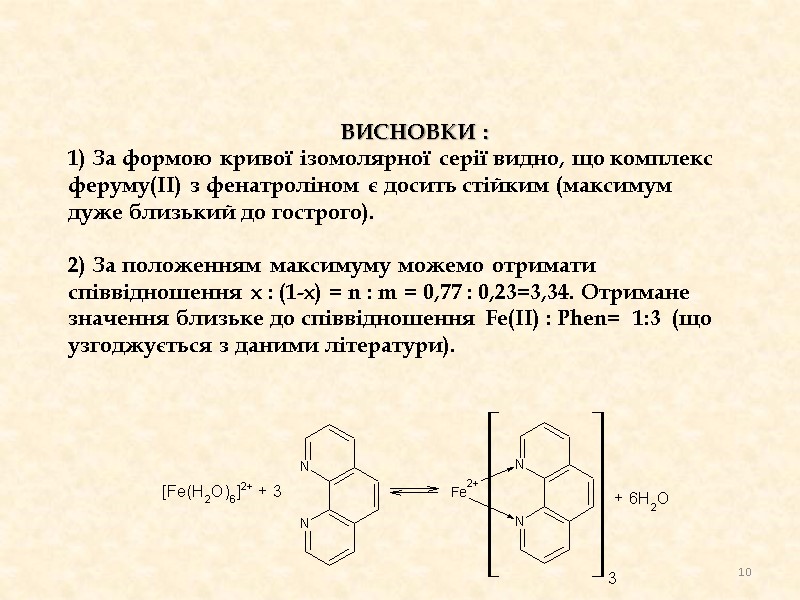
 Висновки : 1) За формою кривої ізомолярної серії видно, що комплекс феруму(ІІ) з фенатроліном є досить стійким (максимум дуже близький до гострого). 2) За положенням максимуму можемо отримати співвідношення х : (1-х) = n : m = 0,77 : 0,23=3,34. Отримане значення близьке до співвідношення Fe(II) : Phen= 1:3 (що узгоджується з даними літератури). 10
Висновки : 1) За формою кривої ізомолярної серії видно, що комплекс феруму(ІІ) з фенатроліном є досить стійким (максимум дуже близький до гострого). 2) За положенням максимуму можемо отримати співвідношення х : (1-х) = n : m = 0,77 : 0,23=3,34. Отримане значення близьке до співвідношення Fe(II) : Phen= 1:3 (що узгоджується з даними літератури). 10
 ЗАГАЛЬНИЙ ВИСНОВОК Для подальшого дослідження системи Fe(II)-Phen необхідно обрати метод для дослідження стійких комплексних сполук. Оптимальні умови дослідження системи Fe(II)-Phen: 1) довжина хвилі λ=510 нм; 2) середовище близьке до нейтрального (рН=7,47); 3) концентрація ізомолярної серії С = 2,0· 10-4 моль/л. 11
ЗАГАЛЬНИЙ ВИСНОВОК Для подальшого дослідження системи Fe(II)-Phen необхідно обрати метод для дослідження стійких комплексних сполук. Оптимальні умови дослідження системи Fe(II)-Phen: 1) довжина хвилі λ=510 нм; 2) середовище близьке до нейтрального (рН=7,47); 3) концентрація ізомолярної серії С = 2,0· 10-4 моль/л. 11
