 Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов.
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов.
 Расположение металлов в Периодической системе Д. И. Менделеева Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали: B(бор) – Si(кремний) – As(мышьяк) –Te(теллур) – At (астат)
Расположение металлов в Периодической системе Д. И. Менделеева Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали: B(бор) – Si(кремний) – As(мышьяк) –Te(теллур) – At (астат)
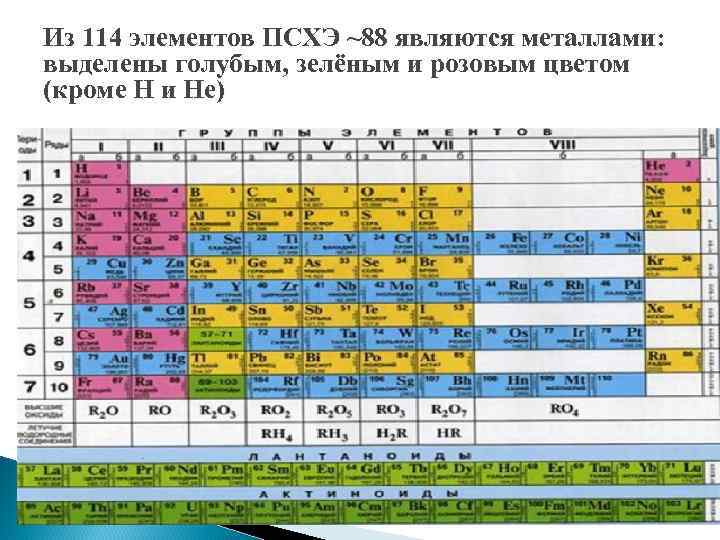 Из 114 элементов ПСХЭ ~88 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He)
Из 114 элементов ПСХЭ ~88 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He)
 Строение атомов Ме Ø Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий, натрий, калий, рубидий, цезий, франций. Ø На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Строение атомов Ме Ø Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий, натрий, калий, рубидий, цезий, франций. Ø На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
 Калий 39 0 +19 2 8 8 1 P = 19 n = 20 e = 19
Калий 39 0 +19 2 8 8 1 P = 19 n = 20 e = 19
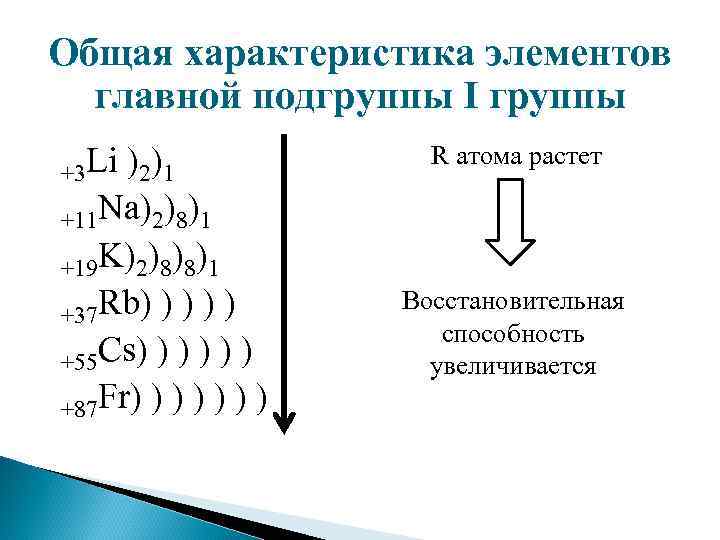 Общая характеристика элементов главной подгруппы I группы +3 Li )2)1 +11 Na)2)8)1 +19 K)2)8)8)1 +37 Rb) ) ) +55 Cs) ) ) +87 Fr) ) ) ) R атома растет Восстановительная способность увеличивается
Общая характеристика элементов главной подгруппы I группы +3 Li )2)1 +11 Na)2)8)1 +19 K)2)8)8)1 +37 Rb) ) ) +55 Cs) ) ) +87 Fr) ) ) ) R атома растет Восстановительная способность увеличивается
 Общая характеристика элементов главной подгруппы II группы +4 Be )2)2 +12 Mg)2)8)2 +20 Ca)2)8)8)2 +38 Sr) )))) +56 Ba) ) ) +88 Ra) ) ) ) У в е л и ч и в а е т с я R атома Увеличивается восстановительная способность Увеличиваются металлические свойства
Общая характеристика элементов главной подгруппы II группы +4 Be )2)2 +12 Mg)2)8)2 +20 Ca)2)8)8)2 +38 Sr) )))) +56 Ba) ) ) +88 Ra) ) ) ) У в е л и ч и в а е т с я R атома Увеличивается восстановительная способность Увеличиваются металлические свойства
 Основные особенности строения атомов металлов: 1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē). 2. Относительно большой атомный радиус. © Осиевская И. А.
Основные особенности строения атомов металлов: 1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē). 2. Относительно большой атомный радиус. © Осиевская И. А.
 Металлическая связь + e e e е е + +
Металлическая связь + e e e е е + +
 Металлическая связь – это связь в металлах и сплавах между атомионом посредством обобществления внешних электронов( «электронного газа» )
Металлическая связь – это связь в металлах и сплавах между атомионом посредством обобществления внешних электронов( «электронного газа» )
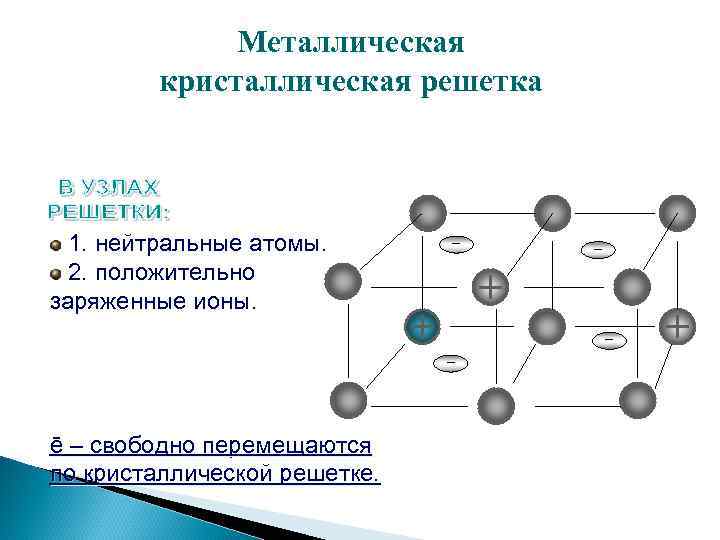 Металлическая кристаллическая решетка 1. нейтральные атомы. 2. положительно заряженные ионы. - - ē – свободно перемещаются по кристаллической решетке. - -
Металлическая кристаллическая решетка 1. нейтральные атомы. 2. положительно заряженные ионы. - - ē – свободно перемещаются по кристаллической решетке. - -
 Физические свойства металлов Ø Твердость (кроме ртути) Ø Пластичность Ø Электропроводность Ø Теплопроводность Ø Плотность Ø Металлический блеск
Физические свойства металлов Ø Твердость (кроме ртути) Ø Пластичность Ø Электропроводность Ø Теплопроводность Ø Плотность Ø Металлический блеск
 Твердость металлов Для всех металлов (кроме ртути) при обычных условиях характерно твердое агрегатное состояние. Однако твердость их различна. Наиболее твердые – металлы побочной подгруппы VI группы ПС. Самые мягкие – металлы главной подгруппы I группы (Na, K)
Твердость металлов Для всех металлов (кроме ртути) при обычных условиях характерно твердое агрегатное состояние. Однако твердость их различна. Наиболее твердые – металлы побочной подгруппы VI группы ПС. Самые мягкие – металлы главной подгруппы I группы (Na, K)
 Плотность металлов Легкие металлы (плотность меньше 5 г/см 3). К ним относятся щелочные, щелочноземельные металлы и алюминий. Самый легкий металл – литий. Тяжелые металлы (плотность больше 5 г/см 3). Самый тяжелый металл – осмий.
Плотность металлов Легкие металлы (плотность меньше 5 г/см 3). К ним относятся щелочные, щелочноземельные металлы и алюминий. Самый легкий металл – литий. Тяжелые металлы (плотность больше 5 г/см 3). Самый тяжелый металл – осмий.
 Нахождение металлов в природе: v В самородном виде (Au, Ag, Pt) v В виде соединений: Ø оксидов Ø сульфидов Ø карбонатов Ø сульфатов
Нахождение металлов в природе: v В самородном виде (Au, Ag, Pt) v В виде соединений: Ø оксидов Ø сульфидов Ø карбонатов Ø сульфатов
 Индивидуальные вещества, образующие земную кору, называются минералами. Al 2 O 3 - корунд Si. O 2 - кварц Hg. S-киноварь и т. д.
Индивидуальные вещества, образующие земную кору, называются минералами. Al 2 O 3 - корунд Si. O 2 - кварц Hg. S-киноварь и т. д.
 Аметист (Si. O 2)-синефиолетовая разновидность кварца Корунд - Al 2 O 3
Аметист (Si. O 2)-синефиолетовая разновидность кварца Корунд - Al 2 O 3
 Из минералов сложены горные породы: Мрамор - Ca. SO 4 Гранит – смесь кварца, полевого шпата и слюды Руда – природные образования, содержащие минерал в количестве, пригодном для его производства
Из минералов сложены горные породы: Мрамор - Ca. SO 4 Гранит – смесь кварца, полевого шпата и слюды Руда – природные образования, содержащие минерал в количестве, пригодном для его производства
 Применение металлов
Применение металлов
 Применение меди
Применение меди
 Применение железа
Применение железа
 Применение алюминия
Применение алюминия





















