лекция подготовка к экзамену.pptx
- Количество слайдов: 22
 Подготовка к экзамену
Подготовка к экзамену
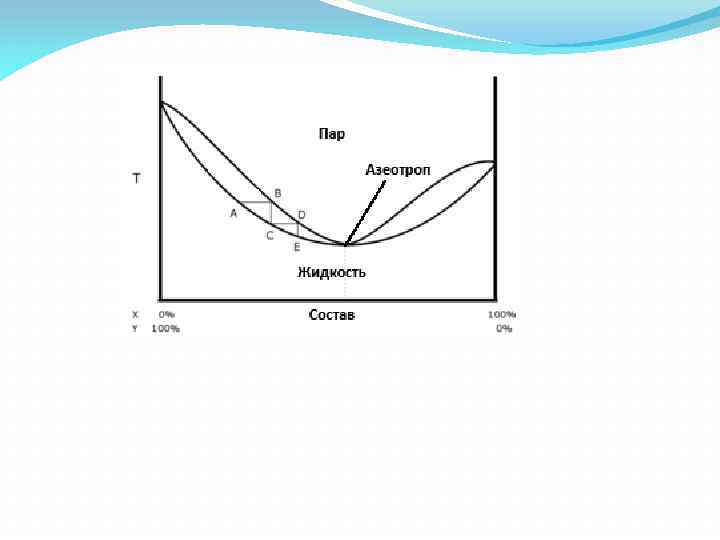
 1. II закон Коновалова. Азеотропные смеси. Азеотропы (графическое изображение). Получение ароматных вод. Диаграмма состояния нерастворяющейся жидкости (в бензоле). Нерастворяющиеся жидкости. Пример: вода – бензол. Для этих систем характерно, что они кипят при температуре ниже температуры кипения каждого отдельного компонента. Значит любое мало летучее вещество можно перевести в пар или кипятить его с более летучей жидкостью, в качестве такой более летучей жидкости используют воду, а процесс перегонки называется перегонкой с водяным паром. Пример: скипидар кипит при t 0 C = 1600 С. вода кипит при t = 1000 С в смеси 95, 50 С Процесс кипения начинается при той температуре, когда Рпара над раствором = атмосферному. Для данных систем: Р = Рн 2 о + РА. Если бы была одна вода, то ее надо было бы нагреть до 100 0 С потому, что при этой t 0 С: Ратм = Рн 2 о = 760 мм. рт. ст. Если же к воде добавить второй компонент, который вносит свой вклад в полное Рпара, то равенство Ратм = Рниже 100 0 С. при t 0 С= 95, 50 С Рн 2 о = 646 мм. рт. ст. Рскип = 114 мм. рт. ст. Ратм = 760 мм. рт. ст.
1. II закон Коновалова. Азеотропные смеси. Азеотропы (графическое изображение). Получение ароматных вод. Диаграмма состояния нерастворяющейся жидкости (в бензоле). Нерастворяющиеся жидкости. Пример: вода – бензол. Для этих систем характерно, что они кипят при температуре ниже температуры кипения каждого отдельного компонента. Значит любое мало летучее вещество можно перевести в пар или кипятить его с более летучей жидкостью, в качестве такой более летучей жидкости используют воду, а процесс перегонки называется перегонкой с водяным паром. Пример: скипидар кипит при t 0 C = 1600 С. вода кипит при t = 1000 С в смеси 95, 50 С Процесс кипения начинается при той температуре, когда Рпара над раствором = атмосферному. Для данных систем: Р = Рн 2 о + РА. Если бы была одна вода, то ее надо было бы нагреть до 100 0 С потому, что при этой t 0 С: Ратм = Рн 2 о = 760 мм. рт. ст. Если же к воде добавить второй компонент, который вносит свой вклад в полное Рпара, то равенство Ратм = Рниже 100 0 С. при t 0 С= 95, 50 С Рн 2 о = 646 мм. рт. ст. Рскип = 114 мм. рт. ст. Ратм = 760 мм. рт. ст.
 Перегонка с водяным паром используется для извлечения эфирных масел из лекарственного сырья, таким образом получают ароматные воды (лекарственные формы со слабым терапевтическим эффектом. Пример: укропная вода. Ароматные воды – это водный или водно-спиртовой раствор с эфиром. Растительное сырье измельчают и заливают водой или водноспиртовой смесью, а затем через нее пропускают пар. Пар, проходя через эту смесь увлекает за собой эфирное масло, затем пар собирается и конденсируется.
Перегонка с водяным паром используется для извлечения эфирных масел из лекарственного сырья, таким образом получают ароматные воды (лекарственные формы со слабым терапевтическим эффектом. Пример: укропная вода. Ароматные воды – это водный или водно-спиртовой раствор с эфиром. Растительное сырье измельчают и заливают водой или водноспиртовой смесью, а затем через нее пропускают пар. Пар, проходя через эту смесь увлекает за собой эфирное масло, затем пар собирается и конденсируется.
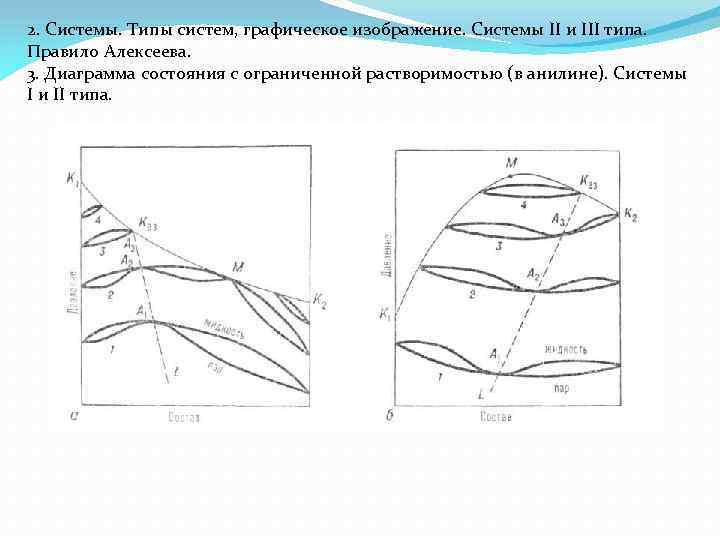 2. Системы. Типы систем, графическое изображение. Системы II и III типа. Правило Алексеева. 3. Диаграмма состояния с ограниченной растворимостью (в анилине). Системы I и II типа.
2. Системы. Типы систем, графическое изображение. Системы II и III типа. Правило Алексеева. 3. Диаграмма состояния с ограниченной растворимостью (в анилине). Системы I и II типа.

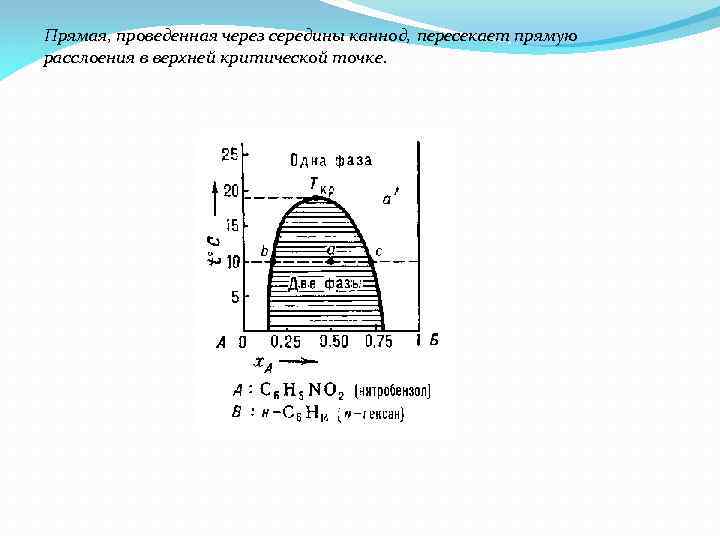 Прямая, проведенная через середины каннод, пересекает прямую расслоения в верхней критической точке.
Прямая, проведенная через середины каннод, пересекает прямую расслоения в верхней критической точке.
 5. III компонента в 2 -х слойной жидкой системе. Закон распределения. Процесс кипения. Процесс замерзания. Если к двухслойной системе добавить 3 -й компонент, который растворяется и в той и в другой фазе, то при каждой данной t 0 С отклонение концентраций 3 -го компонента в двухравновесных фазах есть величина const, которая называется – коэффициент распределения К = С 1 С 2 С 1 – концентрация 3 -го компонента в I фазе С 2 – концентрация 3 -го компонента во II фазе Закон распределения. Вещество, добавленное к системе, состоящей из двух нерастворимых друг в друге жидкостей, при постоянной температуре распределяется между ними в определенном и постоянном соотношении. Закон распределения справедлив, если размеры частиц 3 -го компонента в той и другой фазе одинаковы. Закон распределения лежит в основе процесса экстракции, которая используется как метод выделения какого-то растворенного вещества в системе, как метод разделения компонентов, как метод очистки. Экстракция: - процесс извлечения вещества, растворенного в одном растворителе, другим растворителем (экстрагентом), который не смешивается с первым и лучше растворяет извлекаемое вещество.
5. III компонента в 2 -х слойной жидкой системе. Закон распределения. Процесс кипения. Процесс замерзания. Если к двухслойной системе добавить 3 -й компонент, который растворяется и в той и в другой фазе, то при каждой данной t 0 С отклонение концентраций 3 -го компонента в двухравновесных фазах есть величина const, которая называется – коэффициент распределения К = С 1 С 2 С 1 – концентрация 3 -го компонента в I фазе С 2 – концентрация 3 -го компонента во II фазе Закон распределения. Вещество, добавленное к системе, состоящей из двух нерастворимых друг в друге жидкостей, при постоянной температуре распределяется между ними в определенном и постоянном соотношении. Закон распределения справедлив, если размеры частиц 3 -го компонента в той и другой фазе одинаковы. Закон распределения лежит в основе процесса экстракции, которая используется как метод выделения какого-то растворенного вещества в системе, как метод разделения компонентов, как метод очистки. Экстракция: - процесс извлечения вещества, растворенного в одном растворителе, другим растворителем (экстрагентом), который не смешивается с первым и лучше растворяет извлекаемое вещество.
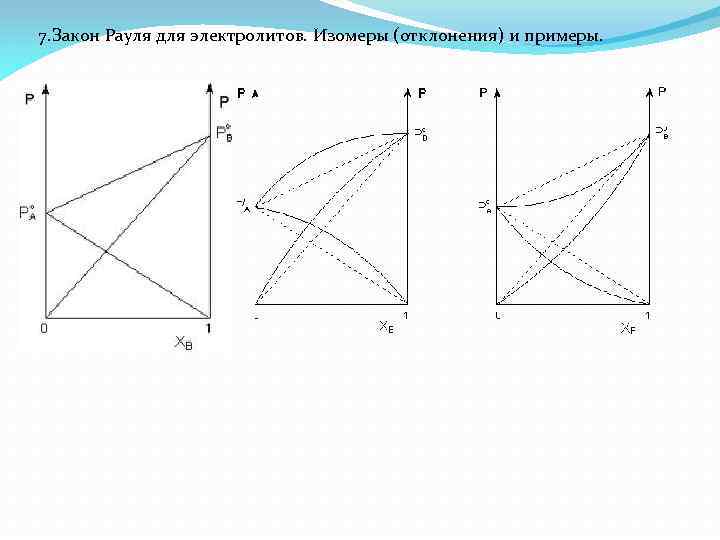 7. Закон Рауля для электролитов. Изомеры (отклонения) и примеры.
7. Закон Рауля для электролитов. Изомеры (отклонения) и примеры.
 Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходным объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0) ); объём раствора в этом случае будет меньше, чем сумма исходным объёмов компонентов (ΔV < 0).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходным объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0) ); объём раствора в этом случае будет меньше, чем сумма исходным объёмов компонентов (ΔV < 0).
 9. Виды теории растворов и выражения концентраций. Химическое равновесие и константа равновесия. Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого –либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ∆S; какие – либо тепловые или объемные эффекты при рассмотрении отсутствуют (∆Н = 0, ∆V= 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди Cu. SO 4 в воде приводит к образованию окрашенного раствора, из которого выделяется не Cu. SO 4, а голубой кристаллогидрат Cu. SO 4 * 5 Н 2 О). Современная термодинамика растворов основана на синтезе этих двух подходов.
9. Виды теории растворов и выражения концентраций. Химическое равновесие и константа равновесия. Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо поглощение теплоты. Теория растворов должна объяснять все эти явления. Физическая теория растворов рассматривает процесс растворения как распределение частиц растворенного вещества между частицами растворителя, предполагая отсутствие какого –либо взаимодействия между ними. Единственной движущей силой такого процесса является увеличение энтропии системы ∆S; какие – либо тепловые или объемные эффекты при рассмотрении отсутствуют (∆Н = 0, ∆V= 0; такие растворы принято называть идеальными). Химическая теория рассматривает процесс растворения как образование смеси неустойчивых химических соединений переменного состава, сопровождающееся тепловым эффектом и изменением объема системы (контракцией), что часто приводит к резкому изменению свойств растворенного вещества (так, растворение бесцветного сульфата меди Cu. SO 4 в воде приводит к образованию окрашенного раствора, из которого выделяется не Cu. SO 4, а голубой кристаллогидрат Cu. SO 4 * 5 Н 2 О). Современная термодинамика растворов основана на синтезе этих двух подходов.
 11. Уравнение изотермы Вант-Гоффа. Анализ уравнения Вант-Гоффа. Химическое сродство.
11. Уравнение изотермы Вант-Гоффа. Анализ уравнения Вант-Гоффа. Химическое сродство.
 Анализ уравнения. 1. Если ∆G <0, то реакция протекает в прямом направлении. 2. Если ∆G >0, то реакция в прямом направлении не идет. Pc. VC* PДVD 3. Если исходные парциальные давления равны 1, то тогда ln РАVA * РВVB = ln 1=0 и уравнение преобразуется: ∆G = RT ln. Kр 4. G<<0, реакция идет вправо, она является практически необратимой. 5. G>>0, данная реакция не идет не при каких условиях. 6. 10 ккал/моль > ∆G >0, при данных условиях реакция не идет, но можно поварьировать условиями и подобрать такие, где ∆G <0.
Анализ уравнения. 1. Если ∆G <0, то реакция протекает в прямом направлении. 2. Если ∆G >0, то реакция в прямом направлении не идет. Pc. VC* PДVD 3. Если исходные парциальные давления равны 1, то тогда ln РАVA * РВVB = ln 1=0 и уравнение преобразуется: ∆G = RT ln. Kр 4. G<<0, реакция идет вправо, она является практически необратимой. 5. G>>0, данная реакция не идет не при каких условиях. 6. 10 ккал/моль > ∆G >0, при данных условиях реакция не идет, но можно поварьировать условиями и подобрать такие, где ∆G <0.
 14. Связь теплоты и энтропии (три факта). Цикл Карно. изменение энтропии измеряется приведенной теплотой обратимого процесса, связывающего соответствующие состояния системы: δQобр d. S = Т или Тd. S = δQобр дифференциал δ- дельта образующего (кусочек от общей части) δQ – это элементарная теплота, при разбивке теплоты на малые циклы). Энтропия измеряется величиной δQобр/ T Существует три факта: 1. приведенная теплота обратимого микропроцесса δQобр/т является функцией состояния системы и не зависит от способа перехода из одного состояния в другое. 2. функция, измеряемая данной величиной, в необратимых процессах в изолированных системах всегда возрастает, а значит является критерием самопроизвольности процессов. 3. одновременно эта функция непосредственно связана с числом микросостояний, т. е. характеризует меру энергетического беспорядка системы.
14. Связь теплоты и энтропии (три факта). Цикл Карно. изменение энтропии измеряется приведенной теплотой обратимого процесса, связывающего соответствующие состояния системы: δQобр d. S = Т или Тd. S = δQобр дифференциал δ- дельта образующего (кусочек от общей части) δQ – это элементарная теплота, при разбивке теплоты на малые циклы). Энтропия измеряется величиной δQобр/ T Существует три факта: 1. приведенная теплота обратимого микропроцесса δQобр/т является функцией состояния системы и не зависит от способа перехода из одного состояния в другое. 2. функция, измеряемая данной величиной, в необратимых процессах в изолированных системах всегда возрастает, а значит является критерием самопроизвольности процессов. 3. одновременно эта функция непосредственно связана с числом микросостояний, т. е. характеризует меру энергетического беспорядка системы.
 Докажем 1 факт, с помощью обращения к простейшей газовой системе. Его доказательство строится на том, что в циклическом процессе (газовая система закрытая) результатирующее изменение любой функции состояния, должно равняться нулю.
Докажем 1 факт, с помощью обращения к простейшей газовой системе. Его доказательство строится на том, что в циклическом процессе (газовая система закрытая) результатирующее изменение любой функции состояния, должно равняться нулю.
 17. Понятие энтропии. Формулировка II начала Термодинамики. Условия необходимости II начала Термодинамики. Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса. Далее, второе начало термодинамики дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных задач прикладного характера. II начало ТД можно сформулировать следующим образом: «Самопроизвольными являются такие процессы, которые приводят к увеличению общей энтропии окружающей среды и системы: ∆Sсист + ∆Sокруж ≥ 0 Это условие необходимости, но не достаточности: процесс может протекать, но не означает, что он действительно будет идти. Последнее зависит от кинетических характеристик.
17. Понятие энтропии. Формулировка II начала Термодинамики. Условия необходимости II начала Термодинамики. Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса. Далее, второе начало термодинамики дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных задач прикладного характера. II начало ТД можно сформулировать следующим образом: «Самопроизвольными являются такие процессы, которые приводят к увеличению общей энтропии окружающей среды и системы: ∆Sсист + ∆Sокруж ≥ 0 Это условие необходимости, но не достаточности: процесс может протекать, но не означает, что он действительно будет идти. Последнее зависит от кинетических характеристик.
 19. Формулы II закона термодинамики: а) для обратимых процессов, б) для необратимых процессов, в) общая запись. ∂Q d. S ≥ T где знак неравенства относится к необратимым процессам, а знак равенства – к обратимым. Энтропия – является функцией состояния, т. к. рассеивание энергии зависит от состояния системы. Отношение количества теплоты ∂Q к температуре процесса (Т), т. е. ∂Q / Т, называют элементарной приведенной теплотой процесса, которая равна полному дифференциалу энтропии (d. S). Изменение энтропии ∆S не зависит от пути процесса, а определяется лишь начальным и конечным состояниями системы: кон ∆S = Sкон - Sнач = ∫ ∂Q / T нач ∆S ≥ ∂Q / T - 2 –й закон термодинамики Q ≥d. U + pd. V - 1 –й закон термодинамики d. U + pd. V ∆S ≥ T Т∆S ≥ d. U + pd. V > для необратимых процессов = для обратимых процессов
19. Формулы II закона термодинамики: а) для обратимых процессов, б) для необратимых процессов, в) общая запись. ∂Q d. S ≥ T где знак неравенства относится к необратимым процессам, а знак равенства – к обратимым. Энтропия – является функцией состояния, т. к. рассеивание энергии зависит от состояния системы. Отношение количества теплоты ∂Q к температуре процесса (Т), т. е. ∂Q / Т, называют элементарной приведенной теплотой процесса, которая равна полному дифференциалу энтропии (d. S). Изменение энтропии ∆S не зависит от пути процесса, а определяется лишь начальным и конечным состояниями системы: кон ∆S = Sкон - Sнач = ∫ ∂Q / T нач ∆S ≥ ∂Q / T - 2 –й закон термодинамики Q ≥d. U + pd. V - 1 –й закон термодинамики d. U + pd. V ∆S ≥ T Т∆S ≥ d. U + pd. V > для необратимых процессов = для обратимых процессов
 22. Вывод формулы (доказательство первого факта постулата), учитывая изотермическую стадию и адиабатическую. Изотермическое сжатие газа. 1 факт. приведенная теплота обратимого микропроцесса δQобр/т является функцией состояния системы и не зависит от способа перехода из одного состояния в другое. Докажем 1 факт, с помощью обращения к простейшей газовой системе. Его доказательство строится на том, что в циклическом процессе (газовая система закрытая) результатирующее изменение любой функции состояния, должно равняться нулю. Рассмотрим простейшую газовую систему – или цикл Карно:
22. Вывод формулы (доказательство первого факта постулата), учитывая изотермическую стадию и адиабатическую. Изотермическое сжатие газа. 1 факт. приведенная теплота обратимого микропроцесса δQобр/т является функцией состояния системы и не зависит от способа перехода из одного состояния в другое. Докажем 1 факт, с помощью обращения к простейшей газовой системе. Его доказательство строится на том, что в циклическом процессе (газовая система закрытая) результатирующее изменение любой функции состояния, должно равняться нулю. Рассмотрим простейшую газовую систему – или цикл Карно:
 1. Изотермическое расширение газа. от V 1 до V 2 при температуре Т 1, поглощается теплота Q 1; 2. Адиабатическое расширение. от V 2 до V 3 (при этом Q = 0, а температура снижается от Т 1 до Т 2); 3. Изотермическое сжатие от V 3 до V 4 при температуре Т 2, отдается теплота Q 2. 4. Адиабатическое сжатие от V 4 до V 1 ( Q = 0, температура увеличивается до Т 1). Просуммируем все работ: W = W 1 + W 2 + W 3 + W 4 V 2 W 1 = RT 1 ln V 1 W 2 = Cv (T 1 -T 2) теплоемкость V 4 W 3 = RT 2 ln V 3 W 4 = Cv(T 2 -T 1) V 2 V 4 W = RT 1 ln V 1 + Cv(T 1 -T 2) + RT 2 ln V 3 + Cv (T 2 –T 1) V 2 V 4 W = RT 1 ln V 1 + RT 2 ln V 3
1. Изотермическое расширение газа. от V 1 до V 2 при температуре Т 1, поглощается теплота Q 1; 2. Адиабатическое расширение. от V 2 до V 3 (при этом Q = 0, а температура снижается от Т 1 до Т 2); 3. Изотермическое сжатие от V 3 до V 4 при температуре Т 2, отдается теплота Q 2. 4. Адиабатическое сжатие от V 4 до V 1 ( Q = 0, температура увеличивается до Т 1). Просуммируем все работ: W = W 1 + W 2 + W 3 + W 4 V 2 W 1 = RT 1 ln V 1 W 2 = Cv (T 1 -T 2) теплоемкость V 4 W 3 = RT 2 ln V 3 W 4 = Cv(T 2 -T 1) V 2 V 4 W = RT 1 ln V 1 + Cv(T 1 -T 2) + RT 2 ln V 3 + Cv (T 2 –T 1) V 2 V 4 W = RT 1 ln V 1 + RT 2 ln V 3
 V 2 W = R ln V 1 ( T 1 –T 2) Если обозначить Q 1 теплоту, полученную от источника, а Q 2 – теплоту, отданную холодильнику, то разность Q 1 – Q 2 представляет собой теплоту, рпевращенную в работу W. Коэффициент полезного действия ŋ можно выразить равенством Q 1 – Q 2 W ŋ = Q 1 Коэффициент полезного действия тепловой машины не зависит от природы рабочего тела, а определяется только интервалом температур. Это вырахается следующим равенством Т 1 – Т 2 W R (T 1 – T 2) ln (V 2 / V 1) ŋ= Т 1 = Q 1 = R T 1 ln (V 2 / V 1) T 1 - температура источника теплоты Т 2 – температура холодильника. Q 1 – Q 2 T 1 – T 2 Q 1 = T 1 Учитывая, что Q 2 отдается газом теплоприемнику и ей следует приписать отрицательный знак, получим Q 1 + Q 2 T 1 T 2 = 0
V 2 W = R ln V 1 ( T 1 –T 2) Если обозначить Q 1 теплоту, полученную от источника, а Q 2 – теплоту, отданную холодильнику, то разность Q 1 – Q 2 представляет собой теплоту, рпевращенную в работу W. Коэффициент полезного действия ŋ можно выразить равенством Q 1 – Q 2 W ŋ = Q 1 Коэффициент полезного действия тепловой машины не зависит от природы рабочего тела, а определяется только интервалом температур. Это вырахается следующим равенством Т 1 – Т 2 W R (T 1 – T 2) ln (V 2 / V 1) ŋ= Т 1 = Q 1 = R T 1 ln (V 2 / V 1) T 1 - температура источника теплоты Т 2 – температура холодильника. Q 1 – Q 2 T 1 – T 2 Q 1 = T 1 Учитывая, что Q 2 отдается газом теплоприемнику и ей следует приписать отрицательный знак, получим Q 1 + Q 2 T 1 T 2 = 0
 25. Абсолютная энтропия. Изотермическое изменение концентрации раствора. Закон Кольрауша. Расчет абсолютной энтропии. Рассчитаем изменение энтропии некоторой системы при нагревании ее от абсолютного нуля до температуры Т при постоянном давлении. Из первого и второго начал термодинамики имеем: δQP = CPd. T δQP d. S = T Отсюда: d. T d. S = cp T = cpd(ln. T) Учитывая, что ST=0 = 0, получим: T ST = ∫ cpd(ln. T) 0
25. Абсолютная энтропия. Изотермическое изменение концентрации раствора. Закон Кольрауша. Расчет абсолютной энтропии. Рассчитаем изменение энтропии некоторой системы при нагревании ее от абсолютного нуля до температуры Т при постоянном давлении. Из первого и второго начал термодинамики имеем: δQP = CPd. T δQP d. S = T Отсюда: d. T d. S = cp T = cpd(ln. T) Учитывая, что ST=0 = 0, получим: T ST = ∫ cpd(ln. T) 0
 При Т=0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарноизотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода: ∆НФП ∆SФП = ТФП Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом: Tпр ∆Hпл Ткип ∆Hисп Т ST = ∫ с. Р, тв d(ln. T) + Тпл + ∫ с. Р, ж d(ln. T) + Ткип + ∫ с. Р, газ d(ln. T) 0 Тпл Т кип Ее рассчитывают при некой температуре Тх, где учтены 3 этапа нагревания вещества и два фазовых перехода между ними.
При Т=0 любое вещество может находиться только в твердом состоянии. При нагревании вещества возможен его переход в жидкое и затем в газообразное состояние; для фазовых переходов, происходящих в изобарноизотермических условиях, изменение энтропии равно приведенной теплоте фазового перехода: ∆НФП ∆SФП = ТФП Таким образом, нагревание вещества без фазовых переходов сопровождается непрерывным ростом энтропии; при фазовом переходе происходит скачкообразное изменение энтропии. Учитывая это, рассчитать абсолютную энтропию любого вещества при любой температуре можно следующим образом: Tпр ∆Hпл Ткип ∆Hисп Т ST = ∫ с. Р, тв d(ln. T) + Тпл + ∫ с. Р, ж d(ln. T) + Ткип + ∫ с. Р, газ d(ln. T) 0 Тпл Т кип Ее рассчитывают при некой температуре Тх, где учтены 3 этапа нагревания вещества и два фазовых перехода между ними.
