Периодические свойства элементов. Степень окисления. Валентность







3_urok.pptx
- Размер: 620.3 Кб
- Автор: Степан Киселёв
- Количество слайдов: 18
Описание презентации Периодические свойства элементов. Степень окисления. Валентность по слайдам
 Периодические свойства элементов. Степень окисления. Валентность
Периодические свойства элементов. Степень окисления. Валентность
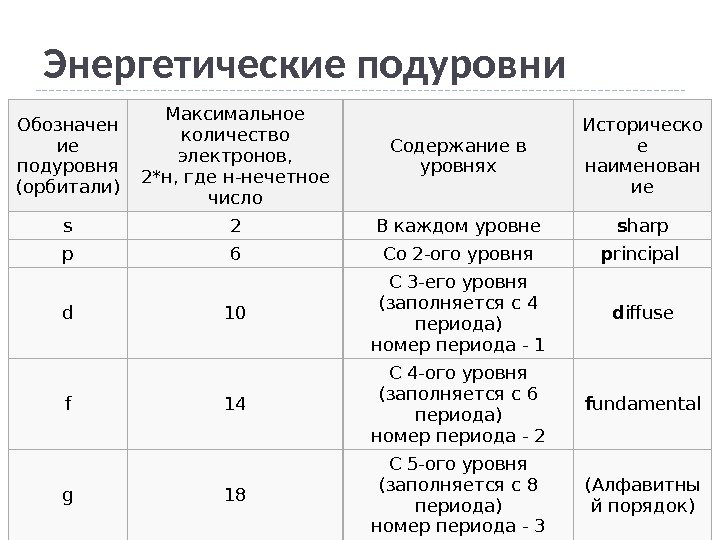
 Энергетические подуровни Обозначен ие подуровня (орбитали) Максимальное количество электронов, 2*н, где н-нечетное число Содержание в уровнях Историческо е наименован ие s 2 В каждом уровне s harp p 6 Со 2 -ого уровня p rincipal d 10 С 3 -его уровня (заполняется с 4 периода) номер периода — 1 d iffuse f 14 С 4 -ого уровня (заполняется с 6 периода) номер периода — 2 f undamental g 18 С 5 -ого уровня (заполняется с 8 периода) номер периода — 3 (Алфавитны й порядок)
Энергетические подуровни Обозначен ие подуровня (орбитали) Максимальное количество электронов, 2*н, где н-нечетное число Содержание в уровнях Историческо е наименован ие s 2 В каждом уровне s harp p 6 Со 2 -ого уровня p rincipal d 10 С 3 -его уровня (заполняется с 4 периода) номер периода — 1 d iffuse f 14 С 4 -ого уровня (заполняется с 6 периода) номер периода — 2 f undamental g 18 С 5 -ого уровня (заполняется с 8 периода) номер периода — 3 (Алфавитны й порядок)
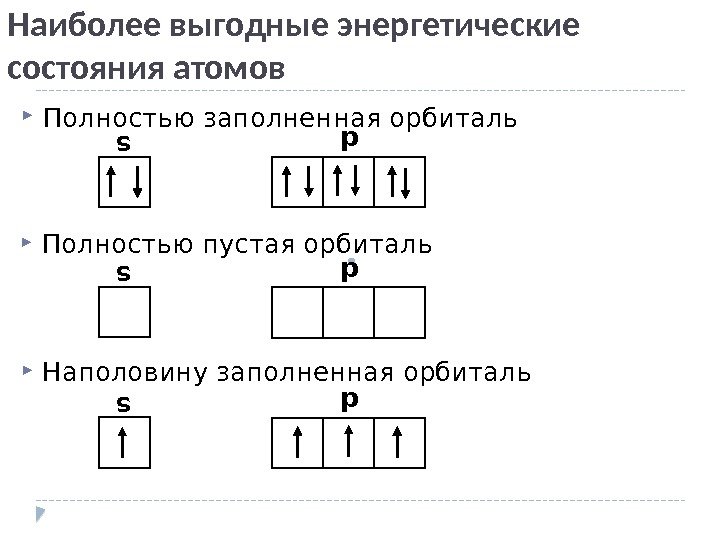
 Наиболее выгодные энергетические состояния атомов Полностью заполненная орбиталь s p Полностью пустая орбиталь Наполовину заполненная орбиталь s p
Наиболее выгодные энергетические состояния атомов Полностью заполненная орбиталь s p Полностью пустая орбиталь Наполовину заполненная орбиталь s p
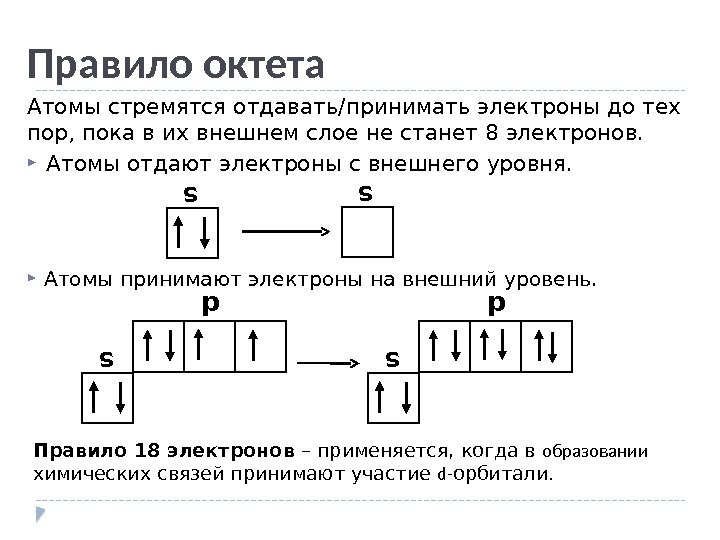
 Правило октета Атомы стремятся отдавать/принимать электроны до тех пор, пока в их внешнем слое не станет 8 электронов. Атомы отдают электроны с внешнего уровня. Правило 18 электронов – применяется, когда в образовании химических связей принимают участие d- орбитали. Атомы принимают электроны на внешний уровень. s s s p
Правило октета Атомы стремятся отдавать/принимать электроны до тех пор, пока в их внешнем слое не станет 8 электронов. Атомы отдают электроны с внешнего уровня. Правило 18 электронов – применяется, когда в образовании химических связей принимают участие d- орбитали. Атомы принимают электроны на внешний уровень. s s s p
 Свойства элементов Радиус атома r – половина среднего расстояния между ядрами двух соседних атомов.
Свойства элементов Радиус атома r – половина среднего расстояния между ядрами двух соседних атомов.
 Металлические и восстановительные свойства характеризуются способностью атома к отдаче электронов с внешнего уровня. Неметаллические и окислительные свойства характеризуются способностью атома к принятию недостающих электронов до завершения внешнего уровня. Свойства элементов
Металлические и восстановительные свойства характеризуются способностью атома к отдаче электронов с внешнего уровня. Неметаллические и окислительные свойства характеризуются способностью атома к принятию недостающих электронов до завершения внешнего уровня. Свойства элементов
 Металлы. Неметаллы
Металлы. Неметаллы
 Электроотрицательность – способность атома притягивать к себе электроны, образующие химическую связь. Чем больше электроотрицательность, тем сильнее атом притягивает к себе электроны химической связи.
Электроотрицательность – способность атома притягивать к себе электроны, образующие химическую связь. Чем больше электроотрицательность, тем сильнее атом притягивает к себе электроны химической связи.
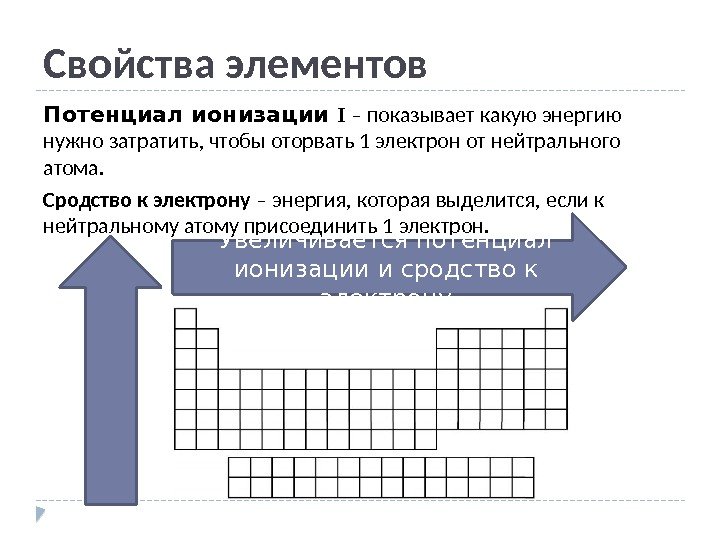
 Свойства элементов Потенциал ионизации I – показывает какую энергию нужно затратить, чтобы оторвать 1 электрон от нейтрального атома. Сродство к электрону – энергия, которая выделится, если к нейтральному атому присоединить 1 электрон. Увеличивается потенциал ионизации и сродство к электрону
Свойства элементов Потенциал ионизации I – показывает какую энергию нужно затратить, чтобы оторвать 1 электрон от нейтрального атома. Сродство к электрону – энергия, которая выделится, если к нейтральному атому присоединить 1 электрон. Увеличивается потенциал ионизации и сродство к электрону
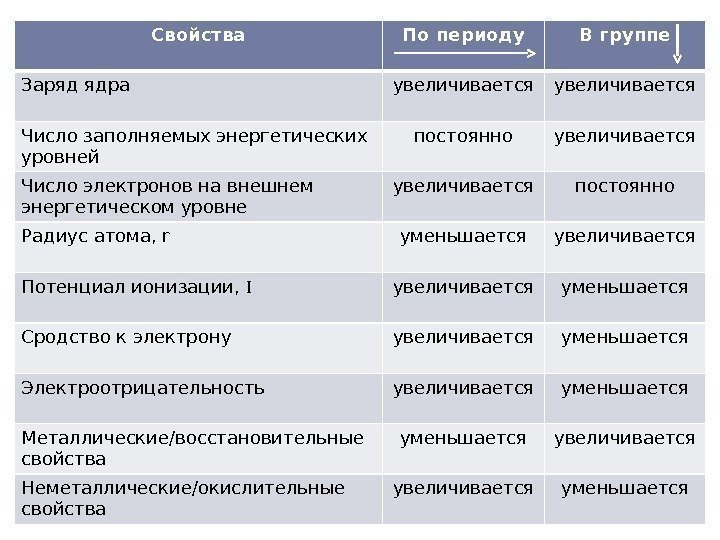
 Свойства По периоду В группе Заряд ядра увеличивается Число заполняемых энергетических уровней постоянно увеличивается Число электронов на внешнем энергетическом уровне увеличивается постоянно Радиус атома, r уменьшается увеличивается Потенциал ионизации, I увеличивается уменьшается Сродство к электрону увеличивается уменьшается Электроотрицательность увеличивается уменьшается Металлические/восстановительные свойства уменьшается увеличивается Неметаллические/окислительные свойства увеличивается уменьшается
Свойства По периоду В группе Заряд ядра увеличивается Число заполняемых энергетических уровней постоянно увеличивается Число электронов на внешнем энергетическом уровне увеличивается постоянно Радиус атома, r уменьшается увеличивается Потенциал ионизации, I увеличивается уменьшается Сродство к электрону увеличивается уменьшается Электроотрицательность увеличивается уменьшается Металлические/восстановительные свойства уменьшается увеличивается Неметаллические/окислительные свойства увеличивается уменьшается
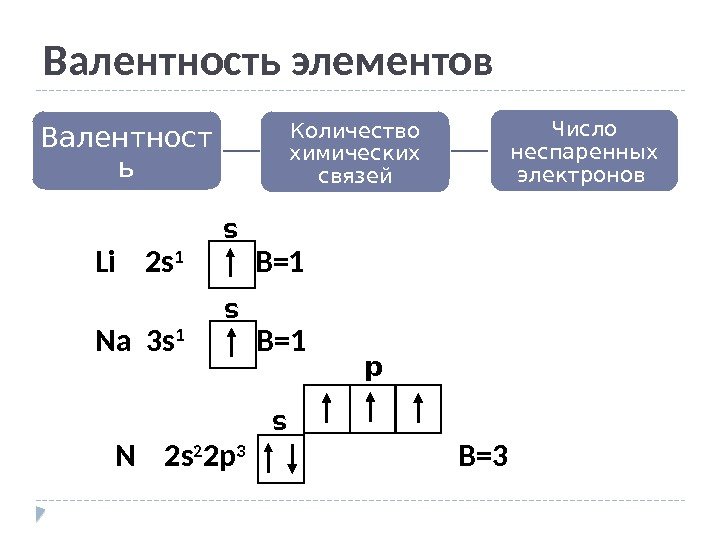
 Валентность элементов Количество химических связей. Валентност ь Число неспаренных электронов s ps Li 2 s 1 B=1 s Na 3 s 1 B=1 N 2 s 2 2 p 3 B=
Валентность элементов Количество химических связей. Валентност ь Число неспаренных электронов s ps Li 2 s 1 B=1 s Na 3 s 1 B=1 N 2 s 2 2 p 3 B=
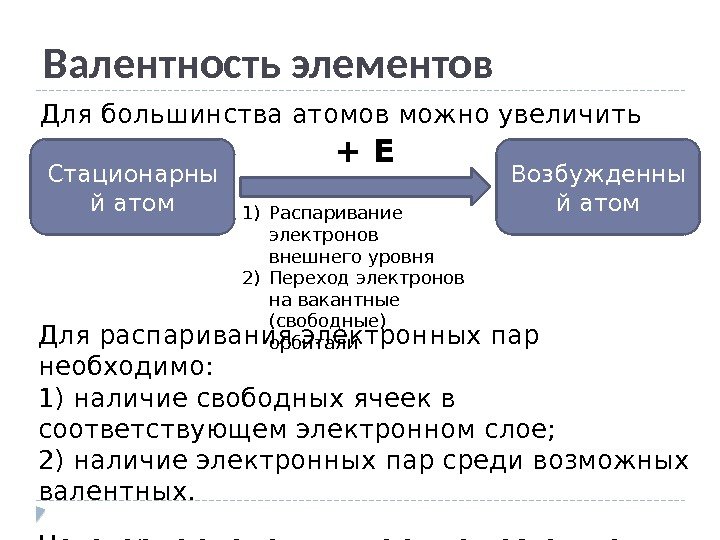
 Валентность элементов Для большинства атомов можно увеличить валентность: Стационарны й атом Возбужденны й атом+ Е 1) Распаривание электронов внешнего уровня 2) Переход электронов на вакантные (свободные) орбитали. Для распаривания электронных пар необходимо: 1) наличие свободных ячеек в соответствующем электронном слое; 2) наличие электронных пар среди возможных валентных. Некоторые элементы имеют по несколько валентностей.
Валентность элементов Для большинства атомов можно увеличить валентность: Стационарны й атом Возбужденны й атом+ Е 1) Распаривание электронов внешнего уровня 2) Переход электронов на вакантные (свободные) орбитали. Для распаривания электронных пар необходимо: 1) наличие свободных ячеек в соответствующем электронном слое; 2) наличие электронных пар среди возможных валентных. Некоторые элементы имеют по несколько валентностей.
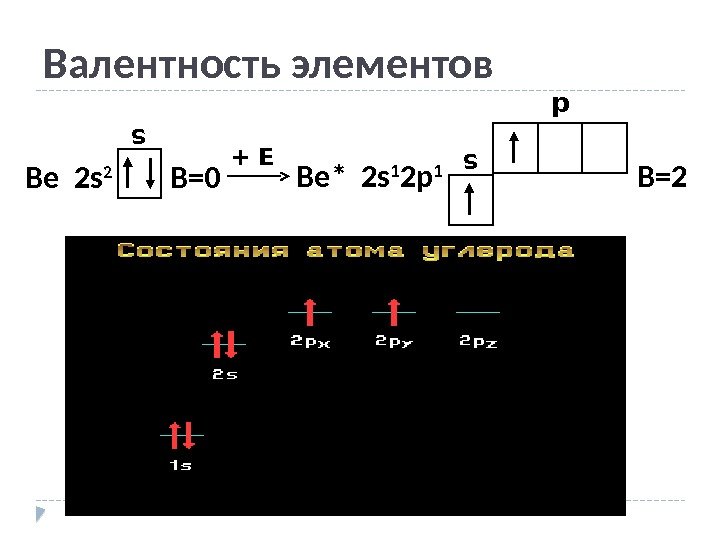
 Валентность элементов s Be 2 s 2 B=0 + E s p Be* 2 s 1 2 p 1 B=
Валентность элементов s Be 2 s 2 B=0 + E s p Be* 2 s 1 2 p 1 B=

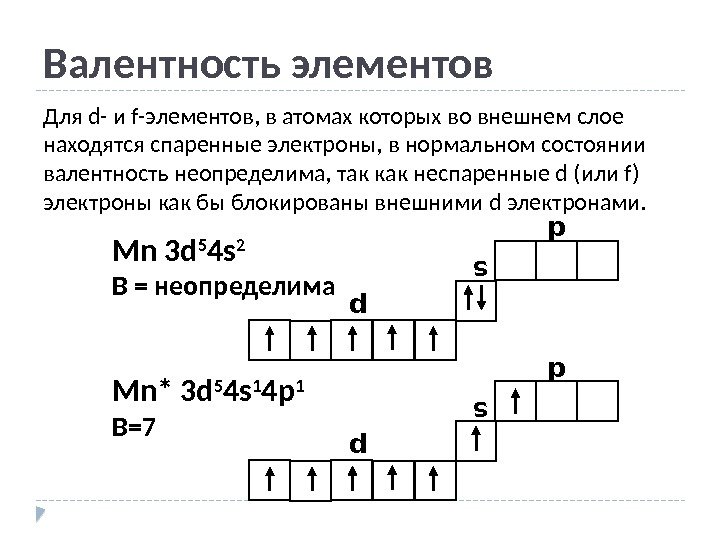
 Валентность элементов Для d- и f-элементов, в атомах которых во внешнем слое находятся спаренные электроны, в нормальном состоянии валентность неопределима, так как неспаренные d (или f) электроны как бы блокированы внешними d электронами. Mn 3 d 5 4 s 2 B = неопределима s p d Mn* 3 d 5 4 s 1 4 p 1 B=7 s p d
Валентность элементов Для d- и f-элементов, в атомах которых во внешнем слое находятся спаренные электроны, в нормальном состоянии валентность неопределима, так как неспаренные d (или f) электроны как бы блокированы внешними d электронами. Mn 3 d 5 4 s 2 B = неопределима s p d Mn* 3 d 5 4 s 1 4 p 1 B=7 s p d
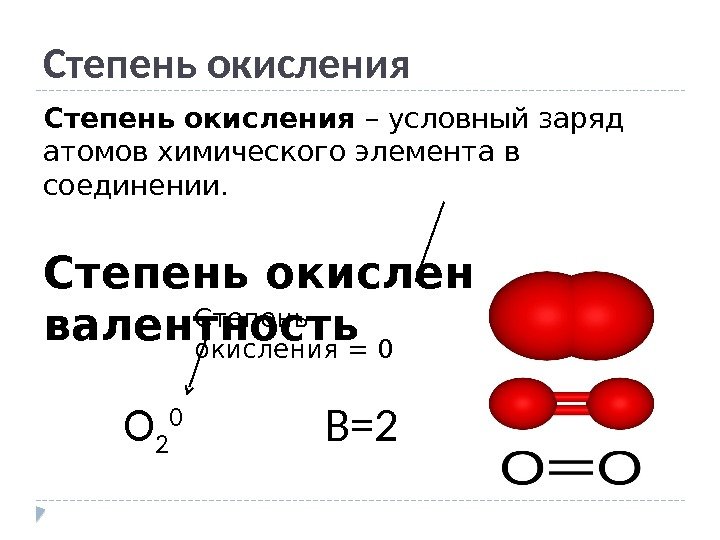
 Степень окисления – условный заряд атомов химического элемента в соединении. Степень окисления = валентность O 2 0 B=2 Степень окисления =
Степень окисления – условный заряд атомов химического элемента в соединении. Степень окисления = валентность O 2 0 B=2 Степень окисления =
 Правило определения степени окисления 1) В простых веществах = 0 (H 2 0 , C 0 , O 2 0 , Fe 0 ) 2) У фтора F = -1 (H + F — , Ca +2 F — 2 ) 3) У водорода H = +1 (H + 2 O -2 , K + O -2 H + ), исключение – в соединениях с металлами (гидриды) = -1 (Na + H — , Ca +2 H — 2 ) 4) У кислорода O = -2 (C +2 O -2 , Na + 2 C +4 O -2 3 ), исключения – во фториде водорода OF 2 = +2 и перекисных соединениях = -1 (H + 2 O — 2 , Na + 2 O — 2 ) 5) Максимальная степень окисления = номер группы, кроме элементов побочных подгрупп І и VІІІ групп (Au +3 , Cu +2 , Fe +6 ) 6) Минимальная степень окисления неметаллов = номер группы – 8 (H + 2 S -2 , H + Cl — ) 7) Алгебраическая сумма степеней окисления всех атомов в молекуле = 0 (H + 3 P +5 O -2 4 , Ca +2 Cl — 2 ) 8) Алгебраическая сумма степеней окисления всех атомов в ионе = заряд иона
Правило определения степени окисления 1) В простых веществах = 0 (H 2 0 , C 0 , O 2 0 , Fe 0 ) 2) У фтора F = -1 (H + F — , Ca +2 F — 2 ) 3) У водорода H = +1 (H + 2 O -2 , K + O -2 H + ), исключение – в соединениях с металлами (гидриды) = -1 (Na + H — , Ca +2 H — 2 ) 4) У кислорода O = -2 (C +2 O -2 , Na + 2 C +4 O -2 3 ), исключения – во фториде водорода OF 2 = +2 и перекисных соединениях = -1 (H + 2 O — 2 , Na + 2 O — 2 ) 5) Максимальная степень окисления = номер группы, кроме элементов побочных подгрупп І и VІІІ групп (Au +3 , Cu +2 , Fe +6 ) 6) Минимальная степень окисления неметаллов = номер группы – 8 (H + 2 S -2 , H + Cl — ) 7) Алгебраическая сумма степеней окисления всех атомов в молекуле = 0 (H + 3 P +5 O -2 4 , Ca +2 Cl — 2 ) 8) Алгебраическая сумма степеней окисления всех атомов в ионе = заряд иона
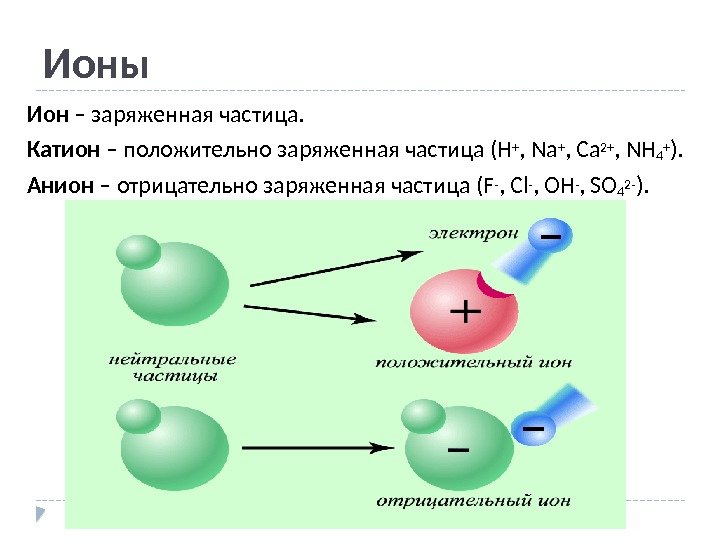
 Ионы Ион – заряженная частица. Катион – положительно заряженная частица (H + , Na + , Ca 2+ , NH 4 + ). Анион – отрицательно заряженная частица (F — , Cl — , OH — , SO 4 2 — ).
Ионы Ион – заряженная частица. Катион – положительно заряженная частица (H + , Na + , Ca 2+ , NH 4 + ). Анион – отрицательно заряженная частица (F — , Cl — , OH — , SO 4 2 — ).
