Параграф_11_schelochnye-metally.ppt
- Количество слайдов: 28
 Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно» . Au Os М Hg Li W Fe Al Ag Л О Cr О Н О С О В МЕТАЛЛЫ - ЧЕМПИОНЫ 1. 2. 3. 4. 5. 6. 7. 8. 9. Самый тугоплавкий. Самый распространенный на земле. Самый легкий. Самый электропроводный. Самый твердый. Самый пластичный. Самый легкоплавкий. Самый тяжелый. Самый космический.
Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно» . Au Os М Hg Li W Fe Al Ag Л О Cr О Н О С О В МЕТАЛЛЫ - ЧЕМПИОНЫ 1. 2. 3. 4. 5. 6. 7. 8. 9. Самый тугоплавкий. Самый распространенный на земле. Самый легкий. Самый электропроводный. Самый твердый. Самый пластичный. Самый легкоплавкий. Самый тяжелый. Самый космический.

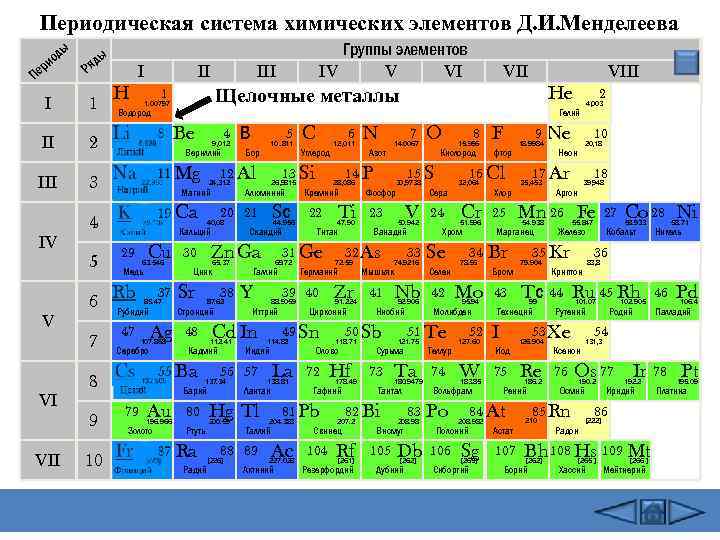 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р H I II II 2 Be III 3 Mg 4 Ca V VI VII 6 7 1. 00797 10 4 9, 012 Медь Rb 37 85. 47 Рубидий 47 Ag 107. 868 Серебро 65. 37 Цинк Sr 38 87. 62 Стронций 112. 41 Кадмий Au 196. 966 Золото Sс 44. 956 Скандий 80 Y Ртуть Ra Радий La 138. 81 Лантан Таллий Ac 227. 028 Актиний N Азот 7 14. 0067 14 P Кремний 22 Ti 47. 90 Титан Zr 91. 224 Цирконий Олово 72 Hf 178. 49 Гафний Rf [261] Резерфордий V 23 50. 942 Ванадий 41 Ta 180. 9479 Тантал 83 208. 98 Висмут Db [262] Дубний 32, 064 Cr 51. 996 Хром Селен 34 78. 96 Mo 95. 94 Молибден 51 Te 121. 75 Сурьма 105 24 42 Ниобий 73 Сера Nb 92. 906 F 9 фтор 16 Cl Se 33 8 15. 996 Кислород 74. 9216 Мышьяк 82 Bi 207. 2 Свинец 104 Фосфор 50 Sb 118. 71 O 15 S 30, 9738 32 As 72. 59 Германий 81 Pb 204. 383 12, 011 28, 086 49 Sn 114. 82 Индий 88 89 [226] Углерод 39 40 88. 9059 Иттрий Hg Tl 200. 59 6 31 Ge 69. 72 Галлий 56 57 137. 34 C 13 Si 26, 9815 Алюминий Cd In 48 Барий 79 Бор Zn Ga 30 Ba 5 10. 811 20 21 40, 08 Кальций Cu В 12 Al 24, 312 Магний 63. 546 2 4, 003 Гелий Вериллий 29 VIII He Водород 8 9 VII Щелочные металлы 1 5 III 1 I IV Группы элементов IV V VI Теллур 74 Br Бром 43 75 183. 85 Sg [263] Сиборгий Неон 18 39, 948 Аргон 54. 938 55. 847 Железо 35 Kr 79. 904 Tс 99 Иод 126. 904 Re 186. 2 Рений Ru 45 Rh 101. 07 Астат 107 102. 905 Родий [262] 46 Pd 106. 4 Палладий 54 Ксенон Os 77 Ir 78 Pt 190. 2 Осмий 192. 2 Иридий 86 Радон [222] Bh 108 Hs 109 Mt Борий 58. 71 Никель 131, 3 85 Rn 210 Кобальт Рутений 76 Co 28 Ni 58. 933 83, 8 Криптон 44 27 36 53 Xe 84 At 208. 982 10 20, 18 Mn 26 Fe Технеций W Ne 17 Ar 35, 453 Марганец I 52 Полоний 106 25 127. 60 Вольфрам Po Хлор 18. 9984 [265 ] Хассий [266 ] Мейтнерий 195. 09 Платина
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р H I II II 2 Be III 3 Mg 4 Ca V VI VII 6 7 1. 00797 10 4 9, 012 Медь Rb 37 85. 47 Рубидий 47 Ag 107. 868 Серебро 65. 37 Цинк Sr 38 87. 62 Стронций 112. 41 Кадмий Au 196. 966 Золото Sс 44. 956 Скандий 80 Y Ртуть Ra Радий La 138. 81 Лантан Таллий Ac 227. 028 Актиний N Азот 7 14. 0067 14 P Кремний 22 Ti 47. 90 Титан Zr 91. 224 Цирконий Олово 72 Hf 178. 49 Гафний Rf [261] Резерфордий V 23 50. 942 Ванадий 41 Ta 180. 9479 Тантал 83 208. 98 Висмут Db [262] Дубний 32, 064 Cr 51. 996 Хром Селен 34 78. 96 Mo 95. 94 Молибден 51 Te 121. 75 Сурьма 105 24 42 Ниобий 73 Сера Nb 92. 906 F 9 фтор 16 Cl Se 33 8 15. 996 Кислород 74. 9216 Мышьяк 82 Bi 207. 2 Свинец 104 Фосфор 50 Sb 118. 71 O 15 S 30, 9738 32 As 72. 59 Германий 81 Pb 204. 383 12, 011 28, 086 49 Sn 114. 82 Индий 88 89 [226] Углерод 39 40 88. 9059 Иттрий Hg Tl 200. 59 6 31 Ge 69. 72 Галлий 56 57 137. 34 C 13 Si 26, 9815 Алюминий Cd In 48 Барий 79 Бор Zn Ga 30 Ba 5 10. 811 20 21 40, 08 Кальций Cu В 12 Al 24, 312 Магний 63. 546 2 4, 003 Гелий Вериллий 29 VIII He Водород 8 9 VII Щелочные металлы 1 5 III 1 I IV Группы элементов IV V VI Теллур 74 Br Бром 43 75 183. 85 Sg [263] Сиборгий Неон 18 39, 948 Аргон 54. 938 55. 847 Железо 35 Kr 79. 904 Tс 99 Иод 126. 904 Re 186. 2 Рений Ru 45 Rh 101. 07 Астат 107 102. 905 Родий [262] 46 Pd 106. 4 Палладий 54 Ксенон Os 77 Ir 78 Pt 190. 2 Осмий 192. 2 Иридий 86 Радон [222] Bh 108 Hs 109 Mt Борий 58. 71 Никель 131, 3 85 Rn 210 Кобальт Рутений 76 Co 28 Ni 58. 933 83, 8 Криптон 44 27 36 53 Xe 84 At 208. 982 10 20, 18 Mn 26 Fe Технеций W Ne 17 Ar 35, 453 Марганец I 52 Полоний 106 25 127. 60 Вольфрам Po Хлор 18. 9984 [265 ] Хассий [266 ] Мейтнерий 195. 09 Платина
 Происхождение названий щелочных металлов • • Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" -сода К (1807) араб. "алкали" - щелочь Rb (1861) лат. "рубидус" - темнокрасный • Cs (1860) лат. "цезиус" - небесно-голубой • Fr (1939) от названия страны Франция.
Происхождение названий щелочных металлов • • Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" -сода К (1807) араб. "алкали" - щелочь Rb (1861) лат. "рубидус" - темнокрасный • Cs (1860) лат. "цезиус" - небесно-голубой • Fr (1939) от названия страны Франция.
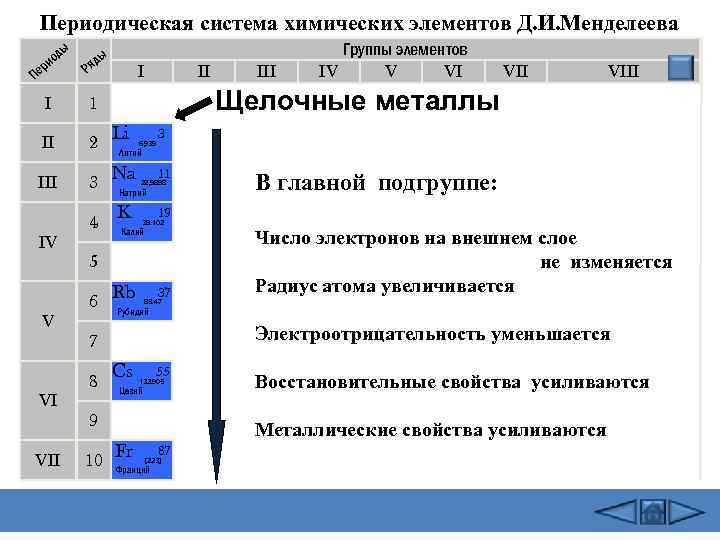 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I II 1 II 2 Li III 3 Na 4 K V VI VII 6, 939 Литий 11 22, 9898 Натрий Калий Rb 37 Число электронов на внешнем слое не изменяется Радиус атома увеличивается 85. 47 Рубидий Электроотрицательность уменьшается Cs 55 132. 905 Цезий 9 10 В главной подгруппе: 19 39. 102 7 8 VIII 3 5 6 VII Щелочные металлы I IV III Группы элементов IV V VI Fr Восстановительные свойства усиливаются Металлические свойства усиливаются 87 [223] Франций
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I II 1 II 2 Li III 3 Na 4 K V VI VII 6, 939 Литий 11 22, 9898 Натрий Калий Rb 37 Число электронов на внешнем слое не изменяется Радиус атома увеличивается 85. 47 Рубидий Электроотрицательность уменьшается Cs 55 132. 905 Цезий 9 10 В главной подгруппе: 19 39. 102 7 8 VIII 3 5 6 VII Щелочные металлы I IV III Группы элементов IV V VI Fr Восстановительные свойства усиливаются Металлические свойства усиливаются 87 [223] Франций
 ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ Элемент Li Аr 7 Число Валентные энергетических электроны уровней )) 2 s 1 39 )))) 3 s 1 4 s 1 Rb 85 ))))) 5 s 1 Cs 133 )))))) 6 s 1 [223] ))))))) 7 s 1 Na 23 ))) K Fr R атома у в е л и ч и в а е т с я Металлические свойства у с и л и в а ю т с я Восстановительные свойства у с и л и в а ю т с я
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ Элемент Li Аr 7 Число Валентные энергетических электроны уровней )) 2 s 1 39 )))) 3 s 1 4 s 1 Rb 85 ))))) 5 s 1 Cs 133 )))))) 6 s 1 [223] ))))))) 7 s 1 Na 23 ))) K Fr R атома у в е л и ч и в а е т с я Металлические свойства у с и л и в а ю т с я Восстановительные свойства у с и л и в а ю т с я
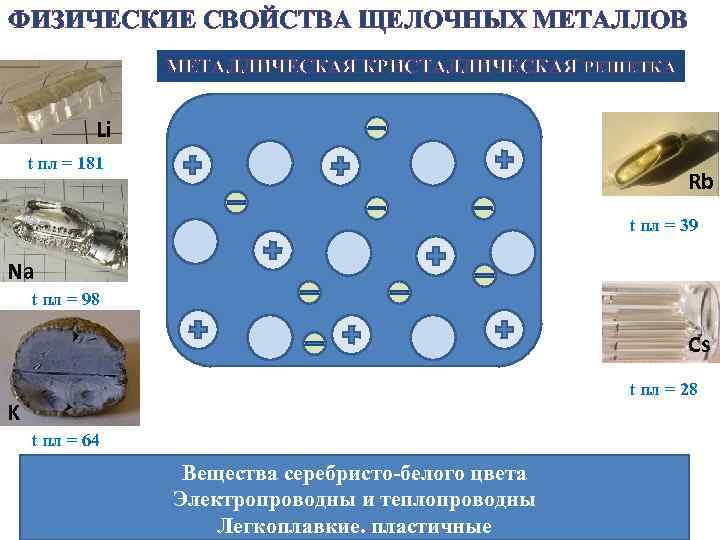 ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Li t пл = 181 Rb t пл = 39 Na t пл = 98 Cs t пл = 28 K t пл = 64 Вещества серебристо-белого цвета Электропроводны и теплопроводны Легкоплавкие. пластичные
ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Li t пл = 181 Rb t пл = 39 Na t пл = 98 Cs t пл = 28 K t пл = 64 Вещества серебристо-белого цвета Электропроводны и теплопроводны Легкоплавкие. пластичные
 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I III 2 III II 1 II I Группы элементов IV V VI 3 IV V VI VII Внешний вид Мягкий металл простого вещества серебристо-белого цвета. Электронная [He] 2 s 1 коефигуранция ЭО 0, 98 (по Полингу) Степень окисления 1 Плотность 0, 534 г/см³ 5 6 7 8 10 VIII Ли тий / Lithium (Li) 4 9 VII Li Температура плавления Температура кипения 453, 69 K 1613 K
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I III 2 III II 1 II I Группы элементов IV V VI 3 IV V VI VII Внешний вид Мягкий металл простого вещества серебристо-белого цвета. Электронная [He] 2 s 1 коефигуранция ЭО 0, 98 (по Полингу) Степень окисления 1 Плотность 0, 534 г/см³ 5 6 7 8 10 VIII Ли тий / Lithium (Li) 4 9 VII Li Температура плавления Температура кипения 453, 69 K 1613 K
 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I 1 II 2 III 3 IV V VI VII 4 5 6 7 8 9 10 I II III Группы элементов IV V VI VIII Натрий/Natrium (Na) серебристо-белый Внешний вид простого вещества мягкий металл Электронная коефигуранция ЭО (по Полингу) Степень окисления Плотность [Ne] 3 s 1 Температура плавления Температура кипения 370, 96 К 0, 93 1 0, 971 г/см ³ 1156, 1 К
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I 1 II 2 III 3 IV V VI VII 4 5 6 7 8 9 10 I II III Группы элементов IV V VI VIII Натрий/Natrium (Na) серебристо-белый Внешний вид простого вещества мягкий металл Электронная коефигуранция ЭО (по Полингу) Степень окисления Плотность [Ne] 3 s 1 Температура плавления Температура кипения 370, 96 К 0, 93 1 0, 971 г/см ³ 1156, 1 К
 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I 2 II III VIII 1 II I Группы элементов IV V VI III IV V VI VII 3 4 5 6 7 8 9 10 Калий / Kalium (K) Серебристо-белый Внешний вид простого вещества мягкий металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность Температура плавления Температура кипения [Ar] 3 d 10 4 s 1 0, 82 1 0, 856 г/см³ 336, 8 К 1047 К
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I 2 II III VIII 1 II I Группы элементов IV V VI III IV V VI VII 3 4 5 6 7 8 9 10 Калий / Kalium (K) Серебристо-белый Внешний вид простого вещества мягкий металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность Температура плавления Температура кипения [Ar] 3 d 10 4 s 1 0, 82 1 0, 856 г/см³ 336, 8 К 1047 К
 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I 2 III 3 II III VIII 1 II I Группы элементов IV V VI VII 4 5 6 7 8 9 10 Руби дий / Rubidium (Rb) Внешний вид Серебристо-белый простого вещества мягкий металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность [Kr] 5 s 1 Температура плавления Температура кипения 312, 2 К 0, 82 1 1, 532 г/см³ 961 К
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I 2 III 3 II III VIII 1 II I Группы элементов IV V VI VII 4 5 6 7 8 9 10 Руби дий / Rubidium (Rb) Внешний вид Серебристо-белый простого вещества мягкий металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность [Kr] 5 s 1 Температура плавления Температура кипения 312, 2 К 0, 82 1 1, 532 г/см³ 961 К
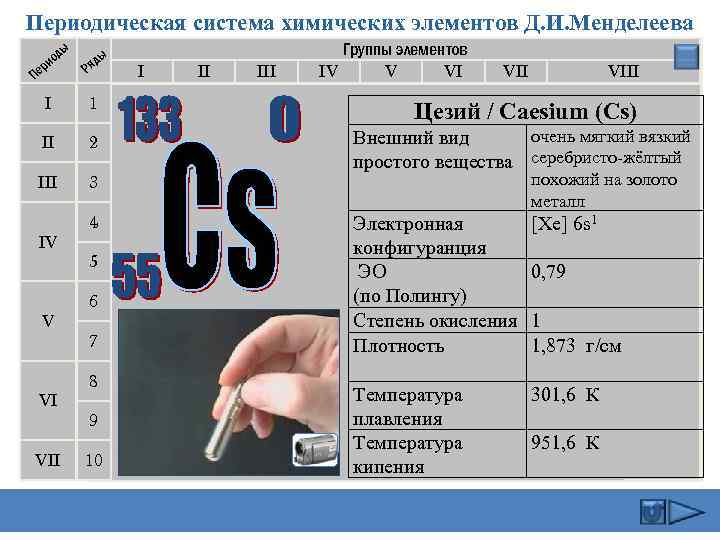 Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I II III Группы элементов IV V VI VIII I 1 Цезий / Caesium (Cs) II 2 очень мягкий вязкий Внешний вид простого вещества серебристо-жёлтый III 3 IV V VI VII 4 5 6 7 8 9 10 похожий на золото металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность [Xe] 6 s 1 Температура плавления Температура кипения 301, 6 К 0, 79 1 1, 873 г/см 951, 6 К
Периодическая система химических элементов Д. И. Менделеева ды ио ер П ы яд Р I II III Группы элементов IV V VI VIII I 1 Цезий / Caesium (Cs) II 2 очень мягкий вязкий Внешний вид простого вещества серебристо-жёлтый III 3 IV V VI VII 4 5 6 7 8 9 10 похожий на золото металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность [Xe] 6 s 1 Температура плавления Температура кипения 301, 6 К 0, 79 1 1, 873 г/см 951, 6 К
 Периодическая система химических элементов Д. И. Менделеева ды ио ер П I ы яд Р 2 III 3 V VI VII II III VIII 1 II IV I Группы элементов IV V VI 4 5 6 7 8 9 10 Франций / Francium (Fr) радиоактивный Внешний вид простого вещества щелочной металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность [Rn] 7 s 1 Температура плавления Температура кипения 300 К 2, 2 1 1, 87 г/см 950 К
Периодическая система химических элементов Д. И. Менделеева ды ио ер П I ы яд Р 2 III 3 V VI VII II III VIII 1 II IV I Группы элементов IV V VI 4 5 6 7 8 9 10 Франций / Francium (Fr) радиоактивный Внешний вид простого вещества щелочной металл Электронная конфигуранция ЭО (по Полингу) Степень окисления Плотность [Rn] 7 s 1 Температура плавления Температура кипения 300 К 2, 2 1 1, 87 г/см 950 К
![Фотография Описание минерала Химический состав Li. Al[Si 2 O 6] Цвет Плотность Сподуменн Бесцветный, Фотография Описание минерала Химический состав Li. Al[Si 2 O 6] Цвет Плотность Сподуменн Бесцветный,](https://present5.com/presentation/160469374_428061944/image-14.jpg) Фотография Описание минерала Химический состав Li. Al[Si 2 O 6] Цвет Плотность Сподуменн Бесцветный, красный, желтый, зеленый 3, 1— 3, 2 г/см 3 Твердость 6, 5
Фотография Описание минерала Химический состав Li. Al[Si 2 O 6] Цвет Плотность Сподуменн Бесцветный, красный, желтый, зеленый 3, 1— 3, 2 г/см 3 Твердость 6, 5
 Фотография Описание минерала Химический состав Цвет Бесцветный, красный, желтый, синий Плотность 2, 2— 2, 3 г/см 3 Твердость Галит Na. Сl 2, 5 Вкус Солёный
Фотография Описание минерала Химический состав Цвет Бесцветный, красный, желтый, синий Плотность 2, 2— 2, 3 г/см 3 Твердость Галит Na. Сl 2, 5 Вкус Солёный
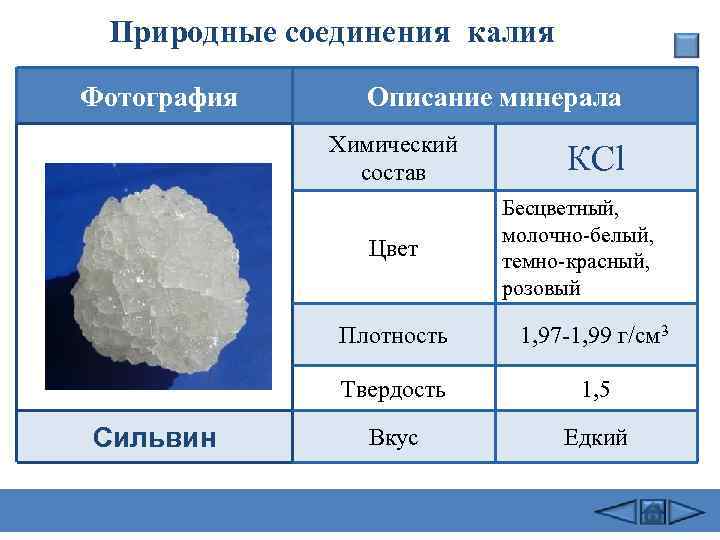 Природные соединения калия Фотография Описание минерала Химический состав КСl Цвет Бесцветный, молочно-белый, темно-красный, розовый Плотность 1, 97 -1, 99 г/см 3 Твердость Сильвин 1, 5 Вкус Едкий
Природные соединения калия Фотография Описание минерала Химический состав КСl Цвет Бесцветный, молочно-белый, темно-красный, розовый Плотность 1, 97 -1, 99 г/см 3 Твердость Сильвин 1, 5 Вкус Едкий
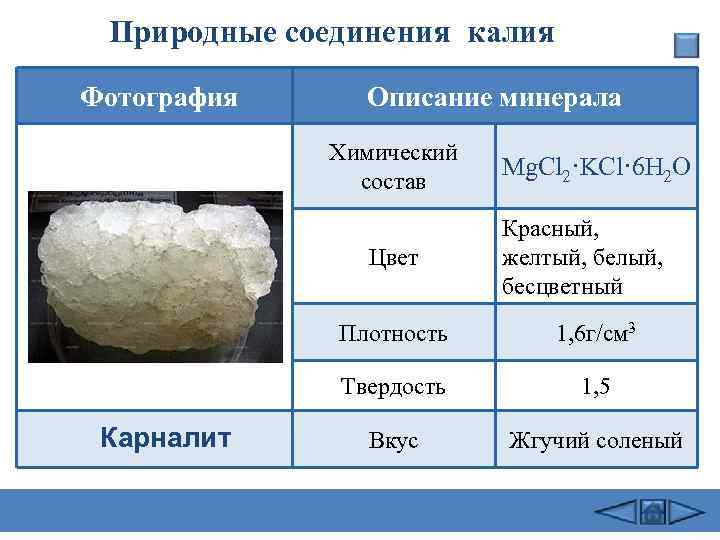 Природные соединения калия Фотография Описание минерала Химический состав Цвет Mg. Cl 2·KCl· 6 H 2 O Красный, желтый, белый, бесцветный Плотность Твердость Карналит 1, 6 г/см 3 1, 5 Вкус Жгучий соленый
Природные соединения калия Фотография Описание минерала Химический состав Цвет Mg. Cl 2·KCl· 6 H 2 O Красный, желтый, белый, бесцветный Плотность Твердость Карналит 1, 6 г/см 3 1, 5 Вкус Жгучий соленый
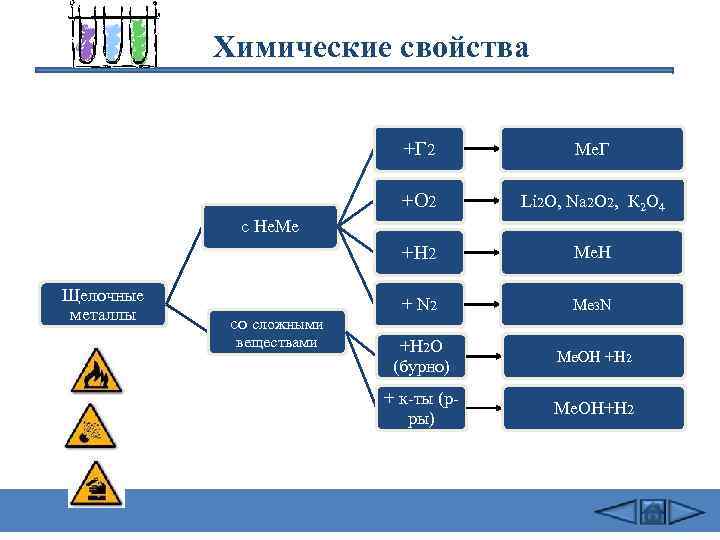 Химические свойства +Г 2 Me. Г +O 2 Li 2 O, Na 2 O 2, К 2 О 4 +H 2 Ме. H + N 2 Me 3 N +H 2 O (бурно) Ме. OH +H 2 + к-ты (рры) Ме. ОН+H 2 с Не. Ме Щелочные металлы со сложными веществами
Химические свойства +Г 2 Me. Г +O 2 Li 2 O, Na 2 O 2, К 2 О 4 +H 2 Ме. H + N 2 Me 3 N +H 2 O (бурно) Ме. OH +H 2 + к-ты (рры) Ме. ОН+H 2 с Не. Ме Щелочные металлы со сложными веществами
 Химические свойства 1) 2 Na + Cl 2 = 2 Na. Cl (в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются) 2) 4 Li + O 2 = 2 Li 2 O оксид Li 2 Na + O 2 = Na 2 O 2 пероксид Na 2 Na + Na 2 O 2 = 2 Na 2 O 2 K + 2 O 2 = K 2 O 4 надпероксид K 6 K + K 2 O 4 = 4 K 2 O 3) 2 Na + Н 2 = 2 Na. Н (при нагревании 200 -400 o. C) 4) 6 Li + N 2 = 2 Li 3 N (Li - при комнатной T, остальные щелочные Me -при нагревании) 5) 2 Na + 2 Н 2 О = 2 Na. ОН + Н 2 (Li - спокойно, Na - энергично, остальные – со взрывом – воспламеняется выделяющийся Н 2 Rb и Cs реагируют не только с жидкой Н 2 О, но и со льдом.
Химические свойства 1) 2 Na + Cl 2 = 2 Na. Cl (в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются) 2) 4 Li + O 2 = 2 Li 2 O оксид Li 2 Na + O 2 = Na 2 O 2 пероксид Na 2 Na + Na 2 O 2 = 2 Na 2 O 2 K + 2 O 2 = K 2 O 4 надпероксид K 6 K + K 2 O 4 = 4 K 2 O 3) 2 Na + Н 2 = 2 Na. Н (при нагревании 200 -400 o. C) 4) 6 Li + N 2 = 2 Li 3 N (Li - при комнатной T, остальные щелочные Me -при нагревании) 5) 2 Na + 2 Н 2 О = 2 Na. ОН + Н 2 (Li - спокойно, Na - энергично, остальные – со взрывом – воспламеняется выделяющийся Н 2 Rb и Cs реагируют не только с жидкой Н 2 О, но и со льдом.
 Качественное определение щелочных металлов Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки. Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий Na+ - желтый Rb + - красный Li+ Na+ K+
Качественное определение щелочных металлов Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки. Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий Na+ - желтый Rb + - красный Li+ Na+ K+
 БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ Сколько воды и хлорида натрия нужно Раствор хлорида натрия (0, 9%) взять для приготовления применяется в медицине. Такой раствор физиологического раствора называется физиологическим массой 0, 5 кг? 4, 5 г соли ответ 495, 5 г воды Смесь хлорида и гидрокарбоната Питьевая сода применяется в кулинарии, натрия массой 15 г обработали для выпечки кондитерских изделий. уксусной кислотой, при этом Хлорид натрия - как добавка к пище выделилось 2, 8 л (н. у. ) газа. Определите массовые доли в процентах компонентов смеси. 70% ответ 3 Na. HCO 30% Na. Cl Калийные удобрения играю важную Хлорид калия - очень ценное Тривиальные названия солей: роль в жизни растений. минеральное удобрение. Рассчитайте Na. Cl K 2 CO 3 поташ массовую долю калия (%) в этом веществе. Поваренная соль 52% ответ Кристалли. Na 2 CO 3*10 H 2 O ческая сода Na. HCO 3 Питьевая сода Калийная KNO селитра 3 Глауберова соль Na 2 SO 4*10 H 2 O
БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ Сколько воды и хлорида натрия нужно Раствор хлорида натрия (0, 9%) взять для приготовления применяется в медицине. Такой раствор физиологического раствора называется физиологическим массой 0, 5 кг? 4, 5 г соли ответ 495, 5 г воды Смесь хлорида и гидрокарбоната Питьевая сода применяется в кулинарии, натрия массой 15 г обработали для выпечки кондитерских изделий. уксусной кислотой, при этом Хлорид натрия - как добавка к пище выделилось 2, 8 л (н. у. ) газа. Определите массовые доли в процентах компонентов смеси. 70% ответ 3 Na. HCO 30% Na. Cl Калийные удобрения играю важную Хлорид калия - очень ценное Тривиальные названия солей: роль в жизни растений. минеральное удобрение. Рассчитайте Na. Cl K 2 CO 3 поташ массовую долю калия (%) в этом веществе. Поваренная соль 52% ответ Кристалли. Na 2 CO 3*10 H 2 O ческая сода Na. HCO 3 Питьевая сода Калийная KNO селитра 3 Глауберова соль Na 2 SO 4*10 H 2 O
 Получение щелочных металлов 1) Электролиз расплавов соединений щелочных металлов: 2 Ме. Cl = 2 Ме + Cl 2 4 Ме. OH = 4 Ме + 2 Н 2 О + О 2 2) Восстановление оксидов и гидроксидов щелочных металлов: 2 Li 2 O + Si = 4 Li + Si. O 2 KOH + Na = Nа. OH + K Схема электролизера для получения натрия Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% Na. F и 12% КСl (что позволяет проводить процесс при 610– 650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют Na. Cl.
Получение щелочных металлов 1) Электролиз расплавов соединений щелочных металлов: 2 Ме. Cl = 2 Ме + Cl 2 4 Ме. OH = 4 Ме + 2 Н 2 О + О 2 2) Восстановление оксидов и гидроксидов щелочных металлов: 2 Li 2 O + Si = 4 Li + Si. O 2 KOH + Na = Nа. OH + K Схема электролизера для получения натрия Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% Na. F и 12% КСl (что позволяет проводить процесс при 610– 650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют Na. Cl.
 Соединения щелочных металлов 1. Гидроксиды: Na. OH – едкий натр, каустическая сода, каустик КОН – едкое кали 2. Соли: Na 2 CO 3 • 10 Н 2 О – кристаллическая сода Na. HCO 3 – пищевая сода К 2 СО 3 – поташ Na 2 SO 4 • 10 H 2 O – глауберова соль
Соединения щелочных металлов 1. Гидроксиды: Na. OH – едкий натр, каустическая сода, каустик КОН – едкое кали 2. Соли: Na 2 CO 3 • 10 Н 2 О – кристаллическая сода Na. HCO 3 – пищевая сода К 2 СО 3 – поташ Na 2 SO 4 • 10 H 2 O – глауберова соль
 Физические свойства щелочных металлов Заполни пропуски Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с металлическим блеском. Все щелочные металлы характеризуются малой плотностью, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью. Благодаря малой плотности Li, Na и К всплывают на воде (Li–даже на керосине). Щелочные металлы легко режутся ножом. Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета: Li – в карминово–красный, Na – в желтый, К – фиолетовый , Rb - красный и Cs – в фиолетово-синий.
Физические свойства щелочных металлов Заполни пропуски Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с металлическим блеском. Все щелочные металлы характеризуются малой плотностью, малой твердостью, низкими температурами плавления и кипения и хорошей электропроводностью. Благодаря малой плотности Li, Na и К всплывают на воде (Li–даже на керосине). Щелочные металлы легко режутся ножом. Несветящееся пламя газовой горелки щелочные металлы и их летучие соединения окрашивают в характерные цвета: Li – в карминово–красный, Na – в желтый, К – фиолетовый , Rb - красный и Cs – в фиолетово-синий.
 Тест «Щелочные металлы» 1. В ряду от лития к францию атомный радиус: уменьшается не изменяется увеличивается 2. Степень окисления щелочных металлов равна: +1 -1 +2 3. Цвет пламени, в который его окрашивают ионы натрия фиолетовый красный желтый 4. Соединение Na. OH называется. каустическая сода проверить поташ кристаллическая сода
Тест «Щелочные металлы» 1. В ряду от лития к францию атомный радиус: уменьшается не изменяется увеличивается 2. Степень окисления щелочных металлов равна: +1 -1 +2 3. Цвет пламени, в который его окрашивают ионы натрия фиолетовый красный желтый 4. Соединение Na. OH называется. каустическая сода проверить поташ кристаллическая сода
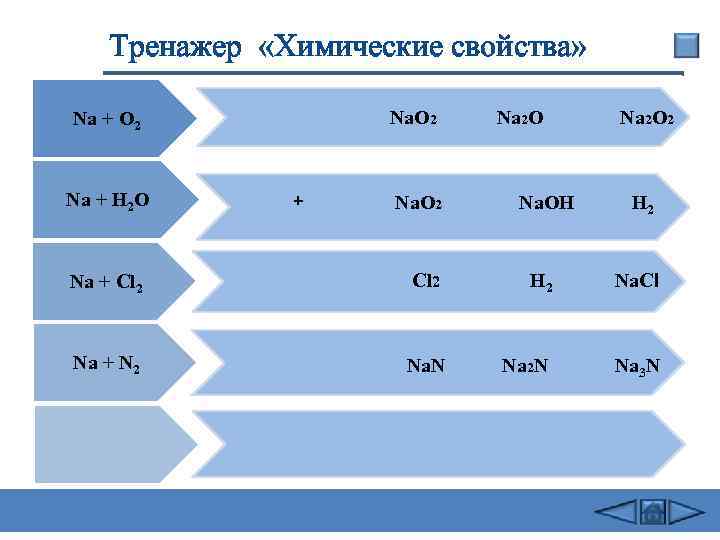 Тренажер «Химические свойства» Nа. О 2 Nа + O 2 Nа + Н 2 О + Nа. О 2 Na 2 O Nа 2 O 2 Nа. ОН H 2 Na + Cl 2 H 2 Na. Cl Na + N 2 Na. N Na 2 N Na 3 N
Тренажер «Химические свойства» Nа. О 2 Nа + O 2 Nа + Н 2 О + Nа. О 2 Na 2 O Nа 2 O 2 Nа. ОН H 2 Na + Cl 2 H 2 Na. Cl Na + N 2 Na. N Na 2 N Na 3 N
 ☺ Проверь себя: Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне щелочных металлов равно 1. 2. В реакциях щелочные металлы являются окислителями и восстановителями. 3. При взаимодействии натрия с кислородом образуется пероксид натрия 4. Щелочные металлы – это металлы IA группы Периодической системы химических элементов. 5. Щелочные металлы получают электролизом расплавов их солей. 6. Щелочные металлы не взаимодействуют с водой. 7. Качественной реакцией на ионы щелочных металлов является их взаимодействие с кислородом. 8. При переходе от лития к калию уменьшается радиус атома
☺ Проверь себя: Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне щелочных металлов равно 1. 2. В реакциях щелочные металлы являются окислителями и восстановителями. 3. При взаимодействии натрия с кислородом образуется пероксид натрия 4. Щелочные металлы – это металлы IA группы Периодической системы химических элементов. 5. Щелочные металлы получают электролизом расплавов их солей. 6. Щелочные металлы не взаимодействуют с водой. 7. Качественной реакцией на ионы щелочных металлов является их взаимодействие с кислородом. 8. При переходе от лития к калию уменьшается радиус атома
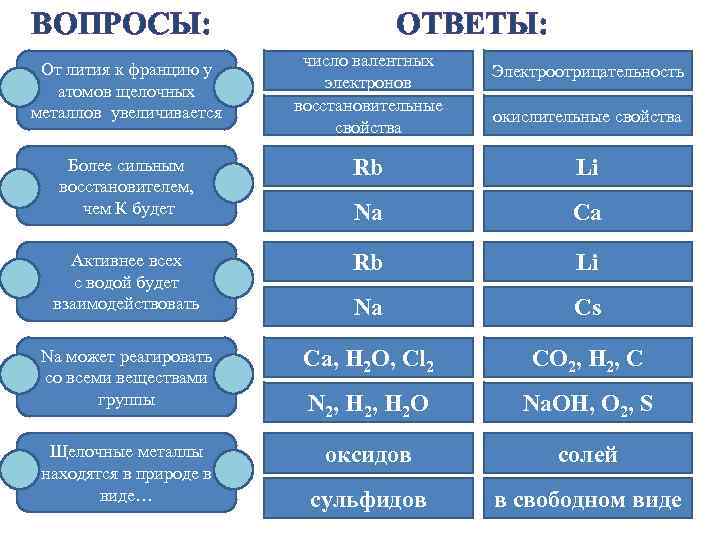 ВОПРОСЫ: От лития к францию у атомов щелочных металлов увеличивается ОТВЕТЫ: число валентных электронов восстановительные свойства Электроотрицательность окислительные свойства Rb Li Na Ca Активнее всех с водой будет взаимодействовать Rb Li Na Cs Na может реагировать со всеми веществами группы Сa, H 2 O, Cl 2 CO 2, H 2, C N 2, H 2 O Na. OH, O 2, S Щелочные металлы находятся в природе в виде… оксидов солей сульфидов в свободном виде Более сильным восстановителем, чем К будет
ВОПРОСЫ: От лития к францию у атомов щелочных металлов увеличивается ОТВЕТЫ: число валентных электронов восстановительные свойства Электроотрицательность окислительные свойства Rb Li Na Ca Активнее всех с водой будет взаимодействовать Rb Li Na Cs Na может реагировать со всеми веществами группы Сa, H 2 O, Cl 2 CO 2, H 2, C N 2, H 2 O Na. OH, O 2, S Щелочные металлы находятся в природе в виде… оксидов солей сульфидов в свободном виде Более сильным восстановителем, чем К будет
