останай мемлекеттік университетіҚ Саба ты та ырыбы:










22909_zhanargul-slajd-khimiya-54996469b4113.ppt
- Размер: 673.5 Кб
- Автор:
- Количество слайдов: 15
Описание презентации останай мемлекеттік университетіҚ Саба ты та ырыбы: по слайдам
 останай мемлекеттік университетіҚ Саба ты та ырыбы: қ ң қ Донорлы-акцепторлы байланыс. Комплексті осылыстар. қ 2016 -2017 о у жылы қ
останай мемлекеттік университетіҚ Саба ты та ырыбы: қ ң қ Донорлы-акцепторлы байланыс. Комплексті осылыстар. қ 2016 -2017 о у жылы қ
 Комплекс осылыстары т зілетін процестер м нін ашу шін қ ү ә ү швейцария химигі А. Вернер сын ан ж не к рнекті алымдар ұ ғ ә ө ғ Л. А. Чугаев, И. Л. Черняев, А. А. Гринберг толы тыр ан қ ғ координациялы теориямен ыс аша танысамыз. қ қ қ Б л теорияны негізгі а идалары мынадай: ұ ң қ ғ 1. Комплекс осылысында иондар мен атомдарды біреуі қ ң орталы деп саналады, оны қ комплекс т зуші ү деп атайды. 2. Орталы ион (атом) қ – комплекс т зуші ма ында лигандалар ү ң деп аталатын арама- арсы зарядтал ан иондар немесе полюсті қ қ ғ молекулалар орналасады (координацияланады). 3. Орталы ион (атом) мен лигандалар осылысты қ қ ң ішкі координациялы сферасын қ т зеді, оны квадрат жа ша а алып ү қ ғ жазады. 4. К п жа дайда орталы ионмен (атоммен) тікелей байланыс ан ө ғ қ қ лигандалар саны координациялы сан қ деп аталады, ол к бінесе ө 2 , 4, 6, 8 м ндеріне ие болады. ә 5. Орталы ионнан (атомнан) бір шама алысыра орналас ан қ қ қ иондар сырт ы координациялы сфера қ қ т зеді. ү
Комплекс осылыстары т зілетін процестер м нін ашу шін қ ү ә ү швейцария химигі А. Вернер сын ан ж не к рнекті алымдар ұ ғ ә ө ғ Л. А. Чугаев, И. Л. Черняев, А. А. Гринберг толы тыр ан қ ғ координациялы теориямен ыс аша танысамыз. қ қ қ Б л теорияны негізгі а идалары мынадай: ұ ң қ ғ 1. Комплекс осылысында иондар мен атомдарды біреуі қ ң орталы деп саналады, оны қ комплекс т зуші ү деп атайды. 2. Орталы ион (атом) қ – комплекс т зуші ма ында лигандалар ү ң деп аталатын арама- арсы зарядтал ан иондар немесе полюсті қ қ ғ молекулалар орналасады (координацияланады). 3. Орталы ион (атом) мен лигандалар осылысты қ қ ң ішкі координациялы сферасын қ т зеді, оны квадрат жа ша а алып ү қ ғ жазады. 4. К п жа дайда орталы ионмен (атоммен) тікелей байланыс ан ө ғ қ қ лигандалар саны координациялы сан қ деп аталады, ол к бінесе ө 2 , 4, 6, 8 м ндеріне ие болады. ә 5. Орталы ионнан (атомнан) бір шама алысыра орналас ан қ қ қ иондар сырт ы координациялы сфера қ қ т зеді. ү
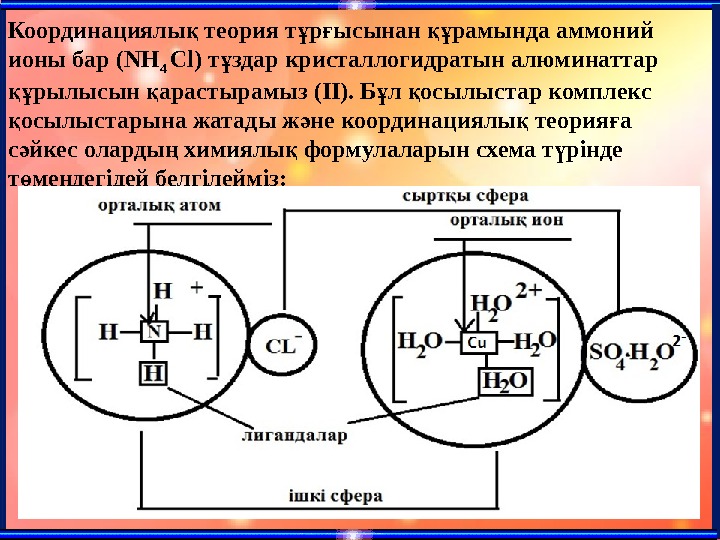
 Координациялы теория т р ысынан рамында аммоний қ ұ ғ құ ионы бар ( NH 4 Cl) т здар кристаллогидратын алюминаттар ұ рылысын арастырамыз (ІІ). Б л осылыстар комплекс құ қ осылыстарына жатады ж не координациялы теория а қ ә қ ғ с йкес оларды химиялы формулаларын схема т рінде ә ң қ ү т мендегідей белгілейміз: ө
Координациялы теория т р ысынан рамында аммоний қ ұ ғ құ ионы бар ( NH 4 Cl) т здар кристаллогидратын алюминаттар ұ рылысын арастырамыз (ІІ). Б л осылыстар комплекс құ қ осылыстарына жатады ж не координациялы теория а қ ә қ ғ с йкес оларды химиялы формулаларын схема т рінде ә ң қ ү т мендегідей белгілейміз: ө
 Коваленттік байланыс т зілу барысында атомдарда орта ж п т зу ү қ ұ ү шін жал ы электрондар рбір атомда болуы шарт емес. Байланыс а ү қ ә қ атынасушы бір атомда электрондар ж бы болса, екіншісінде сол қ ұ электрондар орналаса алатындай бос орын, я ни де гейше болса, олар ғ ң зара бір-бірімен донорлы-акцепторлы байланыс т зеді. Электрон ө ү ж бы бар атом не б лшек ұ ө донор , ал бос де гейшесі бар атом не б лшек ң ө акцептор деп аталынады. Мысалы, аммиак пен хлорлы сутек арасында ы осылу реакциясы: ғ қ Аммиак рамында ы азотты бос электрон ж бы хлорсутек құ ғ ң ұ молекуласында ы сутек атомыны бос s де гейшесінен орын алып, ғ ң ң зара байланыс т зді. М нда ы аммиак рамында ы азот – донор, ал ө ү ұ ғ құ ғ хлорсутек молекуласында ы сутек – акцептор ызметін ат арып т р. ғ қ қ ұ Донорлы-акцепторлы байланысу н тижесінде к птеген иондарды ә ө ң гидратациялануы, бейорганикалы осылыстарды зара осылуы, қ қ ң ө қ комплексті осылыстарды т зілуі ж зеге асады. қ ң ү ү
Коваленттік байланыс т зілу барысында атомдарда орта ж п т зу ү қ ұ ү шін жал ы электрондар рбір атомда болуы шарт емес. Байланыс а ү қ ә қ атынасушы бір атомда электрондар ж бы болса, екіншісінде сол қ ұ электрондар орналаса алатындай бос орын, я ни де гейше болса, олар ғ ң зара бір-бірімен донорлы-акцепторлы байланыс т зеді. Электрон ө ү ж бы бар атом не б лшек ұ ө донор , ал бос де гейшесі бар атом не б лшек ң ө акцептор деп аталынады. Мысалы, аммиак пен хлорлы сутек арасында ы осылу реакциясы: ғ қ Аммиак рамында ы азотты бос электрон ж бы хлорсутек құ ғ ң ұ молекуласында ы сутек атомыны бос s де гейшесінен орын алып, ғ ң ң зара байланыс т зді. М нда ы аммиак рамында ы азот – донор, ал ө ү ұ ғ құ ғ хлорсутек молекуласында ы сутек – акцептор ызметін ат арып т р. ғ қ қ ұ Донорлы-акцепторлы байланысу н тижесінде к птеген иондарды ә ө ң гидратациялануы, бейорганикалы осылыстарды зара осылуы, қ қ ң ө қ комплексті осылыстарды т зілуі ж зеге асады. қ ң ү ү
 Комплекс осылыстарды химиялы қ ң қ формулаларын арапайым т рде жазса қ ү қ : [NH 4 ] Cl, [Cu( Н 2 0) 4 ] SO 4 H 2 O, Na [Al (OH) 4 ] Орталы ион мен (атоммен) лигандалар арасында ы қ ғ байланыс таби аты екі жа ты болуы м мкін. Бір ғ қ ү жа ынан, орталы ионны лигандалармен ғ қ ң байланысы электростатикалы тартылыс к шіне қ ү негізделген, себебі лигандалар комплекст зушімен ү салыстыр анда арама- арсы зарядты ион болып ғ қ қ келеді. Мысал ретінде натрий алюминатын арастырамыз (д лірек, натрий қ ә тетрагидроксоалюминатын Na[Al(OH) 4 ]. Б л ұ осылыстар орталы алюминий атомыны ішінара қ қ ң о заряды, ал лигандалар – гидроксид-иондарыны ң ң – теріс заряды бар.
Комплекс осылыстарды химиялы қ ң қ формулаларын арапайым т рде жазса қ ү қ : [NH 4 ] Cl, [Cu( Н 2 0) 4 ] SO 4 H 2 O, Na [Al (OH) 4 ] Орталы ион мен (атоммен) лигандалар арасында ы қ ғ байланыс таби аты екі жа ты болуы м мкін. Бір ғ қ ү жа ынан, орталы ионны лигандалармен ғ қ ң байланысы электростатикалы тартылыс к шіне қ ү негізделген, себебі лигандалар комплекст зушімен ү салыстыр анда арама- арсы зарядты ион болып ғ қ қ келеді. Мысал ретінде натрий алюминатын арастырамыз (д лірек, натрий қ ә тетрагидроксоалюминатын Na[Al(OH) 4 ]. Б л ұ осылыстар орталы алюминий атомыны ішінара қ қ ң о заряды, ал лигандалар – гидроксид-иондарыны ң ң – теріс заряды бар.
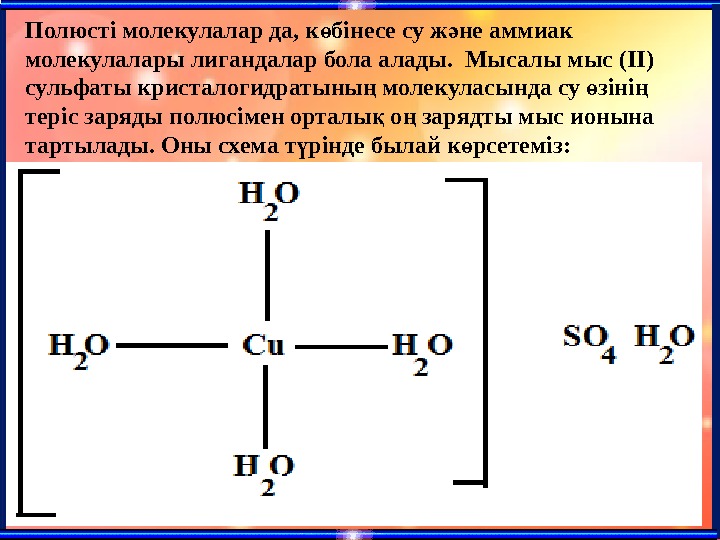
 Полюсті молекулалар да, к бінесе су ж не аммиак ө ә молекулалары лигандалар бола алады. Мысалы мыс (ІІ) сульфаты кр и сталогидратыны молекуласында су зіні ң ө ң теріс заряды полюсімен орталы о зарядты мыс ионына қ ң тартылады. Оны схема т рінде былай к рсетеміз: ү ө
Полюсті молекулалар да, к бінесе су ж не аммиак ө ә молекулалары лигандалар бола алады. Мысалы мыс (ІІ) сульфаты кр и сталогидратыны молекуласында су зіні ң ө ң теріс заряды полюсімен орталы о зарядты мыс ионына қ ң тартылады. Оны схема т рінде былай к рсетеміз: ү ө
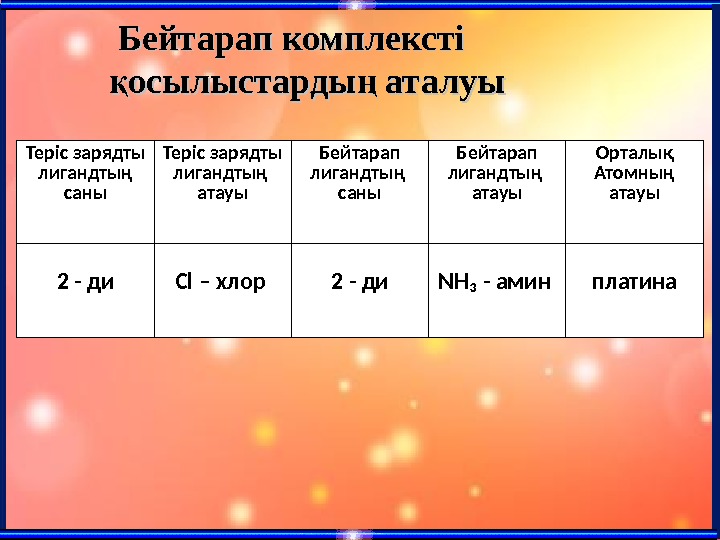
 Бейтарап комплексті осылыстарды аталуық ң Теріс зарядты лигандтың саны Теріс зарядты лигандтың атауы Бейтарап лигандтың саны Бейтарап лигандтың атауы Орталық Атомның атауы 2 — ди С l – хлор 2 — ди NH₃ — амин платина
Бейтарап комплексті осылыстарды аталуық ң Теріс зарядты лигандтың саны Теріс зарядты лигандтың атауы Бейтарап лигандтың саны Бейтарап лигандтың атауы Орталық Атомның атауы 2 — ди С l – хлор 2 — ди NH₃ — амин платина
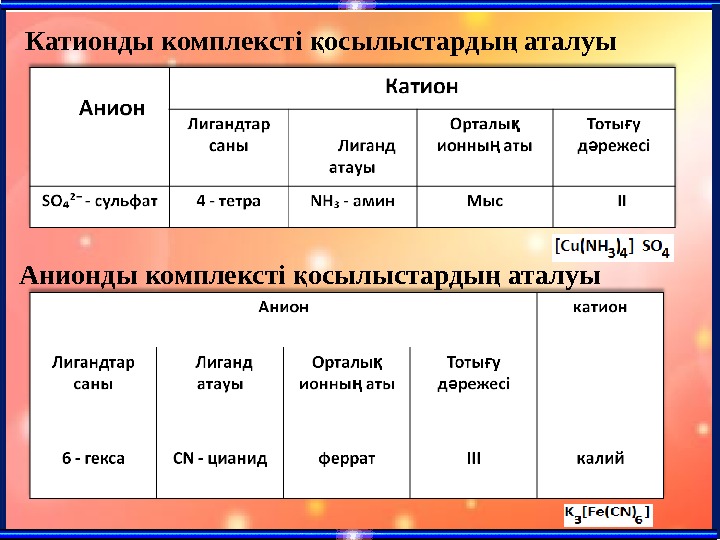
 Катионды комплексті осылыстарды аталуық ң Анионды комплексті осылыстарды аталуы қ ң
Катионды комплексті осылыстарды аталуық ң Анионды комплексті осылыстарды аталуы қ ң
 Екінші жа ынан, орталы атом мен лигандалар арасында ғ қ байланыс, аммоний ионы т зілгені сия ты, ү қ донорлы-акцепторлы механизммен т зілуі м мкін. ү ү К птеген комплекс осылыстарда орталы ион мен ө қ қ лигандалар арасында ы байланыс электростатикалы ғ қ тартылыс к штерімен оса комплекст зшіні б лінбеген ү қ ү ң ө электрон ж птасымен лигандаларды бос орбитальдары ұ ң ар ылы да байланыстар т зіледі. қ ү Комплекс осылыстарыны к пшілігі – электролиттер. қ ң ө Мысалы калий (ІІ) гексацианоферрат су ертінділерінде т мендегідей диссоциацияланды: ө
Екінші жа ынан, орталы атом мен лигандалар арасында ғ қ байланыс, аммоний ионы т зілгені сия ты, ү қ донорлы-акцепторлы механизммен т зілуі м мкін. ү ү К птеген комплекс осылыстарда орталы ион мен ө қ қ лигандалар арасында ы байланыс электростатикалы ғ қ тартылыс к штерімен оса комплекст зшіні б лінбеген ү қ ү ң ө электрон ж птасымен лигандаларды бос орбитальдары ұ ң ар ылы да байланыстар т зіледі. қ ү Комплекс осылыстарыны к пшілігі – электролиттер. қ ң ө Мысалы калий (ІІ) гексацианоферрат су ертінділерінде т мендегідей диссоциацияланды: ө
 Комплекс осылыстары диссоциациялан анда қ ғ комплекс иондарыны т зілетінін, оларды ң ү ң біршама берік екенін, оларды диссоцияциялану ң д режесі те аз екенін ерекше ата ан ж н. ә ө ғ ө Комплексті осылыстармен іс ж зінде танысу қ ү шін т мендегі т жірибені жасау а болады. ү ө ә ғ Сu (OH) 2 + 2 Na. OH — Na 2 [Cu (OH) 4 ] Натрий тетрагидроксокуптриты
Комплекс осылыстары диссоциациялан анда қ ғ комплекс иондарыны т зілетінін, оларды ң ү ң біршама берік екенін, оларды диссоцияциялану ң д режесі те аз екенін ерекше ата ан ж н. ә ө ғ ө Комплексті осылыстармен іс ж зінде танысу қ ү шін т мендегі т жірибені жасау а болады. ү ө ә ғ Сu (OH) 2 + 2 Na. OH — Na 2 [Cu (OH) 4 ] Натрий тетрагидроксокуптриты
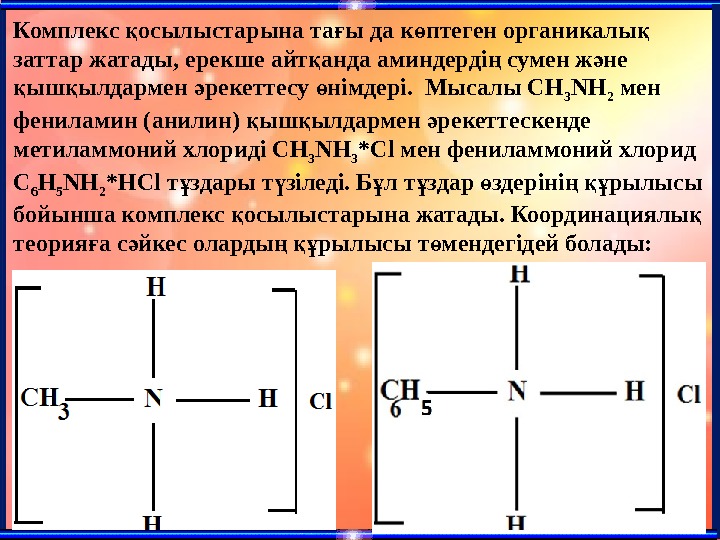
 Комплекс осылыстарына та ы да к птеген органикалы қ ғ ө қ заттар жатады, ерекше айт анда аминдерді сумен ж не қ ң ә ыш ылдармен рекеттесу німдері. Мысалы СН қ қ ә ө 3 NH 2 мен фениламин (анилин) ыш ылдармен рекеттескенде қ қ ә метиламмоний хлориді CH 3 NH 3 *Cl мен фениламмоний хлорид С 6 Н 5 NH 2 *HCl т здары т зіледі. Б л т здар здеріні рылысы ұ ү ұ ұ ө ң құ бойынша комплекс осылыстарына жатады. Координациялы қ қ теория а с йкес оларды рылысы т мендегідей болады: ғ ә ң құ ө
Комплекс осылыстарына та ы да к птеген органикалы қ ғ ө қ заттар жатады, ерекше айт анда аминдерді сумен ж не қ ң ә ыш ылдармен рекеттесу німдері. Мысалы СН қ қ ә ө 3 NH 2 мен фениламин (анилин) ыш ылдармен рекеттескенде қ қ ә метиламмоний хлориді CH 3 NH 3 *Cl мен фениламмоний хлорид С 6 Н 5 NH 2 *HCl т здары т зіледі. Б л т здар здеріні рылысы ұ ү ұ ұ ө ң құ бойынша комплекс осылыстарына жатады. Координациялы қ қ теория а с йкес оларды рылысы т мендегідей болады: ғ ә ң құ ө
 Б л осылыстарда ы азот – ұ қ ғ комплекст зуші, ал лигандалары – ү сутегі атомы ж не метил мен фенил ә радикалдары, комплекс осылысыны қ ң ішкі сферасын т зушілер. Сырт ы ү қ сферада хлорид-иондары бар. Тіршілікте лкен ма ызы бар к птеген ү ң ө органикалы заттар комплекс қ осылыста. Олар а гемоглабин, қ ғ хлорофилл, ферменттер ж не бас а да ә қ к птеген осылыстар жатады. ө қ
Б л осылыстарда ы азот – ұ қ ғ комплекст зуші, ал лигандалары – ү сутегі атомы ж не метил мен фенил ә радикалдары, комплекс осылысыны қ ң ішкі сферасын т зушілер. Сырт ы ү қ сферада хлорид-иондары бар. Тіршілікте лкен ма ызы бар к птеген ү ң ө органикалы заттар комплекс қ осылыста. Олар а гемоглабин, қ ғ хлорофилл, ферменттер ж не бас а да ә қ к птеген осылыстар жатады. ө қ
 Комплекс осылыстарын практикада олдану. Комплекс қ қ осылыстары: қ 1) аналитикалы химияда к птеген иондарды алу шін. қ ө ү Мысалы, т менгі реакция жолымен ж не аны тау шін: ө ә қ ү 2) кейбір металдарды (лантаноидтарды) б лу шін ж не ө ү ә жо ары д режелі таза металдарды (алтын, к міс, т. б. ) ғ ә ү алуда 3) боя ыш заттар ретінде ғ 4) суды кермектігін жою шін ң ү 5) ма ызды биохимиялы процестерді стимуляторы ң қ ң ретінде ке олданылады. ң қ
Комплекс осылыстарын практикада олдану. Комплекс қ қ осылыстары: қ 1) аналитикалы химияда к птеген иондарды алу шін. қ ө ү Мысалы, т менгі реакция жолымен ж не аны тау шін: ө ә қ ү 2) кейбір металдарды (лантаноидтарды) б лу шін ж не ө ү ә жо ары д режелі таза металдарды (алтын, к міс, т. б. ) ғ ә ү алуда 3) боя ыш заттар ретінде ғ 4) суды кермектігін жою шін ң ү 5) ма ызды биохимиялы процестерді стимуляторы ң қ ң ретінде ке олданылады. ң қ
 Комплексті осылыстарды қ ң жіктелуі: А) комплекстің заряды бойынша: 1) ыш ылды Қ қ қ [Cu(H O) ]Cl ₂ ₆ ₃ 2) Анионды K [[Cr. Cl ]³₃ ₆ 3) Бейтарап [Pt. Cl (H O) ]₂ ₂ ₂ ⁰ Б) лигандты таби атына арай ң ғ қ : 1) Аквакомплексті [Cr(H O) ]Cl ₂ ₆ ₃ 2) Ацидокомплексті K [Fe(CN) ]₄ ₆ 2) Гидроксокомплексті Na [Al(OH) ] ₃ ₆ 4) Аммиакаттар [Zn(NH ) ]SO₃ ₄ ₄
Комплексті осылыстарды қ ң жіктелуі: А) комплекстің заряды бойынша: 1) ыш ылды Қ қ қ [Cu(H O) ]Cl ₂ ₆ ₃ 2) Анионды K [[Cr. Cl ]³₃ ₆ 3) Бейтарап [Pt. Cl (H O) ]₂ ₂ ₂ ⁰ Б) лигандты таби атына арай ң ғ қ : 1) Аквакомплексті [Cr(H O) ]Cl ₂ ₆ ₃ 2) Ацидокомплексті K [Fe(CN) ]₄ ₆ 2) Гидроксокомплексті Na [Al(OH) ] ₃ ₆ 4) Аммиакаттар [Zn(NH ) ]SO₃ ₄ ₄

