Основные понятия термодинамики.pptx
- Количество слайдов: 19
 Основные понятия термодинамики
Основные понятия термодинамики
 М. В. Ломоносов: «Физическая химия — наука, объясняющая на основании положений и опытов физическую причину того, что происходит через химические операции в сложных телах. Химия и физика так соединены между собой, что одна без другой в совершенстве быть не могут» Физическая химия — это наука, изучающая связь химических и физических свойств веществ, химических, и физических явлений и процессов
М. В. Ломоносов: «Физическая химия — наука, объясняющая на основании положений и опытов физическую причину того, что происходит через химические операции в сложных телах. Химия и физика так соединены между собой, что одна без другой в совершенстве быть не могут» Физическая химия — это наука, изучающая связь химических и физических свойств веществ, химических, и физических явлений и процессов
 • Термодинамика изучает взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы. • Химическая термодинамика изучает превращение различных видов энергии при химических реакциях, процессах растворения, испарения, кристаллизации и др.
• Термодинамика изучает взаимные превращения различных видов энергии, связанные с переходом энергии в форме теплоты и работы. • Химическая термодинамика изучает превращение различных видов энергии при химических реакциях, процессах растворения, испарения, кристаллизации и др.
 Зная законы химической термодинамики, можно предсказать: q возможна ли данная реакция при данных условиях или нет, и при каких условиях она станет возможной, q каков будет выход продуктов реакции, т. е. какова степень превращения исходных веществ в конечные, q каким тепловым эффектом она будет сопровождаться. Энергетическая сторона химических процессов имеет важное значение, так как выделяющееся при этом тепло позволяет использовать реакции горения газообразного, жидкого и твердого топлива в качестве источника тепловой энергии. Кроме того, данные об энергетических эффектах реакций используются для определения прочности межатомных и межмолекулярных связей, для выяснения строения и реакционной способности химических соединений и т. д.
Зная законы химической термодинамики, можно предсказать: q возможна ли данная реакция при данных условиях или нет, и при каких условиях она станет возможной, q каков будет выход продуктов реакции, т. е. какова степень превращения исходных веществ в конечные, q каким тепловым эффектом она будет сопровождаться. Энергетическая сторона химических процессов имеет важное значение, так как выделяющееся при этом тепло позволяет использовать реакции горения газообразного, жидкого и твердого топлива в качестве источника тепловой энергии. Кроме того, данные об энергетических эффектах реакций используются для определения прочности межатомных и межмолекулярных связей, для выяснения строения и реакционной способности химических соединений и т. д.
 • Система тело или группа тел, выделенных фактически или мысленно из окружающей среды (газ в баллоне, стакан чая, кристалл сахара и т. п. • Особенность систем в термодинамике, они состоят из большого числа частиц — молекул или атомов.
• Система тело или группа тел, выделенных фактически или мысленно из окружающей среды (газ в баллоне, стакан чая, кристалл сахара и т. п. • Особенность систем в термодинамике, они состоят из большого числа частиц — молекул или атомов.
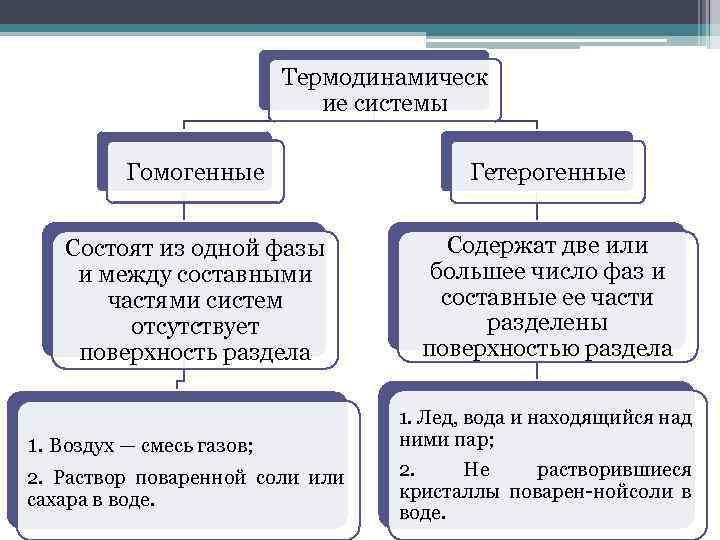 Термодинамическ ие системы Гомогенные Гетерогенные Состоят из одной фазы и между составными частями систем отсутствует поверхность раздела Содержат две или большее число фаз и составные ее части разделены поверхностью раздела 1. Воздух — смесь газов; 2. Раствор поваренной соли или сахара в воде. 1. Лед, вода и находящийся над ними пар; 2. Не растворившиеся кристаллы поварен ной соли в воде.
Термодинамическ ие системы Гомогенные Гетерогенные Состоят из одной фазы и между составными частями систем отсутствует поверхность раздела Содержат две или большее число фаз и составные ее части разделены поверхностью раздела 1. Воздух — смесь газов; 2. Раствор поваренной соли или сахара в воде. 1. Лед, вода и находящийся над ними пар; 2. Не растворившиеся кристаллы поварен ной соли в воде.
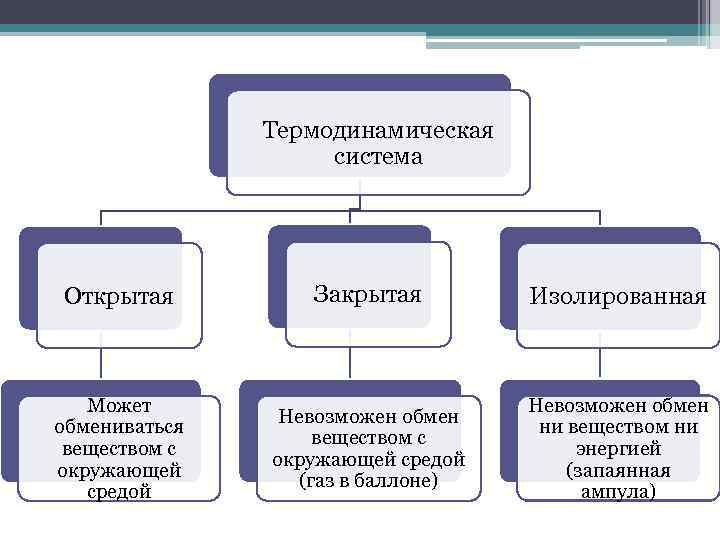 Термодинамическая система Открытая Закрытая Изолированная Может обмениваться веществом с окружающей средой Невозможен обмен веществом с окружающей средой (газ в баллоне) Невозможен обмен ни веществом ни энергией (запаянная ампула)
Термодинамическая система Открытая Закрытая Изолированная Может обмениваться веществом с окружающей средой Невозможен обмен веществом с окружающей средой (газ в баллоне) Невозможен обмен ни веществом ни энергией (запаянная ампула)
 Физические величины, позволяющие определить состояние системы, называются параметрами состояния. • • Параметры состояния, поддающиеся непосредственному изменению, принято считать основными. К ним относят: температуру Т, давление р, молярный объем V, концентрацию С.
Физические величины, позволяющие определить состояние системы, называются параметрами состояния. • • Параметры состояния, поддающиеся непосредственному изменению, принято считать основными. К ним относят: температуру Т, давление р, молярный объем V, концентрацию С.
 Математическое выражение, показывающее взаимозависимость основных параметров данной системы, называется уравнением состояния. Примером может служить уравнение состояния идеального газа: • p. V=RT, где р — давление газа; V — молярный объем; Т — абсолютная температура; R— универсальная газовая постоянная.
Математическое выражение, показывающее взаимозависимость основных параметров данной системы, называется уравнением состояния. Примером может служить уравнение состояния идеального газа: • p. V=RT, где р — давление газа; V — молярный объем; Т — абсолютная температура; R— универсальная газовая постоянная.
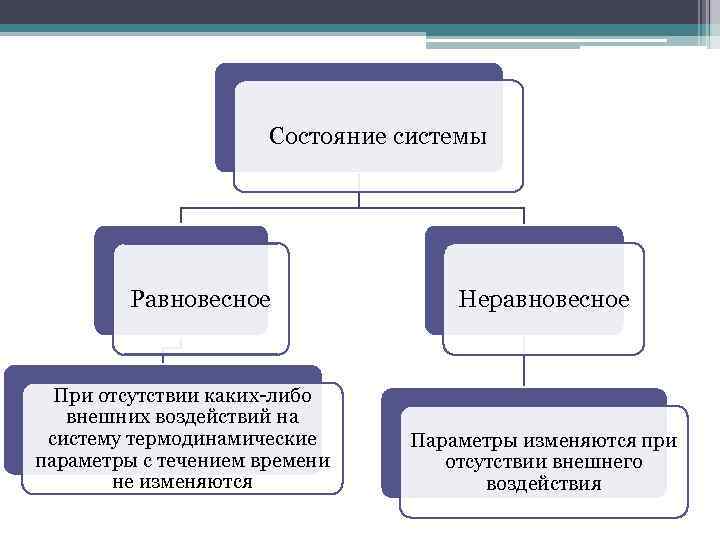 Состояние системы Равновесное При отсутствии каких либо внешних воздействий на систему термодинамические параметры с течением времени не изменяются Неравновесное Параметры изменяются при отсутствии внешнего воздействия
Состояние системы Равновесное При отсутствии каких либо внешних воздействий на систему термодинамические параметры с течением времени не изменяются Неравновесное Параметры изменяются при отсутствии внешнего воздействия
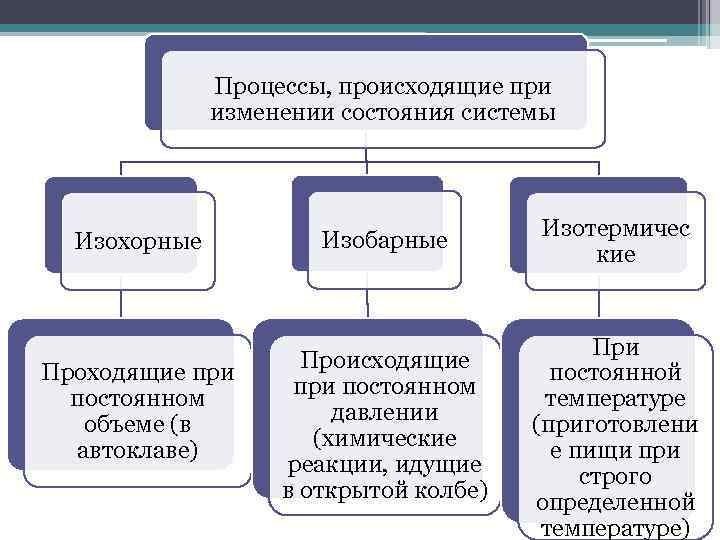 Процессы, происходящие при изменении состояния системы Изохорные Проходящие при постоянном объеме (в автоклаве) Изобарные Происходящие при постоянном давлении (химические реакции, идущие в открытой колбе) Изотермичес кие При постоянной температуре (приготовлени е пищи при строго определенной температуре)
Процессы, происходящие при изменении состояния системы Изохорные Проходящие при постоянном объеме (в автоклаве) Изобарные Происходящие при постоянном давлении (химические реакции, идущие в открытой колбе) Изотермичес кие При постоянной температуре (приготовлени е пищи при строго определенной температуре)
 Процессы Обратимые Необратимые Можно провести в прямом и обратном направлениях через те же стадии Такие переходы невозможны
Процессы Обратимые Необратимые Можно провести в прямом и обратном направлениях через те же стадии Такие переходы невозможны
 • Важнейшие понятия в термодинамике – энергия, теплота и работа. • Энергия — это мера способности тела совершать работу. • Для характеристики процессов особенно важное значение имеет внутренняя энергия системы. • Внутренняя энергия системы представляет собой ее полную энергию, которая складывается из энергии движения молекул, атомов, ядер и электронов в молекулах и атомах, внут риядерной энергии, энергии межмолекулярного взаимо действия и т. п. • Внутренняя энергия системы зависит от природы составляющих ее веществ, их массы и внешних условий. Абсолютное значение внутренней энергии в какой либо системе измерить невозможно, однако опытным путем удается определить изменение внутренней энергии системы при переходе ее из одного состояния в другое. Если обозначить U 1 внутреннюю энергию системы в состоянии 1, U 2 — внутреннюю энергию в состоянии 2, го изменение внутренней энергии в процессе перехода этой системы из состояния 1 в состояние 2 равно U =U 1 – U 2
• Важнейшие понятия в термодинамике – энергия, теплота и работа. • Энергия — это мера способности тела совершать работу. • Для характеристики процессов особенно важное значение имеет внутренняя энергия системы. • Внутренняя энергия системы представляет собой ее полную энергию, которая складывается из энергии движения молекул, атомов, ядер и электронов в молекулах и атомах, внут риядерной энергии, энергии межмолекулярного взаимо действия и т. п. • Внутренняя энергия системы зависит от природы составляющих ее веществ, их массы и внешних условий. Абсолютное значение внутренней энергии в какой либо системе измерить невозможно, однако опытным путем удается определить изменение внутренней энергии системы при переходе ее из одного состояния в другое. Если обозначить U 1 внутреннюю энергию системы в состоянии 1, U 2 — внутреннюю энергию в состоянии 2, го изменение внутренней энергии в процессе перехода этой системы из состояния 1 в состояние 2 равно U =U 1 – U 2
 Работа А, совершаемая системой, обусловлена взаимодействием между системой и внешней средой, в результате чего преодолеваются внешние силы, нарушившие равновесие в системе. Например, газ, расширяясь и цилиндре с поршнем, может сжимать пружину и таким образом передавать ей часть энергии. Следовательно, работа является макрофизической формой передачи энергии от системы к системе.
Работа А, совершаемая системой, обусловлена взаимодействием между системой и внешней средой, в результате чего преодолеваются внешние силы, нарушившие равновесие в системе. Например, газ, расширяясь и цилиндре с поршнем, может сжимать пружину и таким образом передавать ей часть энергии. Следовательно, работа является макрофизической формой передачи энергии от системы к системе.
 • Другой формой передачи энергии является теплота Q, в этом случае энергия непосредственно передается молекулами одного тела молекулам другого при их контакте. Такой обмен происходит между телами, имеющими различную температуру. • Поскольку теплота и работа в количественном отношении являются мерой передаваемой энергии, то количество их измеряется в тех же единицах, что и энергия, — в джоулях (Дж). • Часто говорят, что теплота (или работа) подводится к системе или отводится от нее. Однако это не совсем строгое выражение, и, употребляя его, не следует забывать, что подводится и отводится не теплота или работа, а энергия в форме теплоты или работы. Если система обменивается энергией с окружающей средой, то в какой бы форме это ни происходило, количество энергии, полученное системой, обозначается знаком. «+» , а ко личество энергии, отданное системой, знаком «—» . На пример, сли система е получила энергию в форме теплоты, то это можно обозначить +Q, а если система отдала теплоту, то — Q. •
• Другой формой передачи энергии является теплота Q, в этом случае энергия непосредственно передается молекулами одного тела молекулам другого при их контакте. Такой обмен происходит между телами, имеющими различную температуру. • Поскольку теплота и работа в количественном отношении являются мерой передаваемой энергии, то количество их измеряется в тех же единицах, что и энергия, — в джоулях (Дж). • Часто говорят, что теплота (или работа) подводится к системе или отводится от нее. Однако это не совсем строгое выражение, и, употребляя его, не следует забывать, что подводится и отводится не теплота или работа, а энергия в форме теплоты или работы. Если система обменивается энергией с окружающей средой, то в какой бы форме это ни происходило, количество энергии, полученное системой, обозначается знаком. «+» , а ко личество энергии, отданное системой, знаком «—» . На пример, сли система е получила энергию в форме теплоты, то это можно обозначить +Q, а если система отдала теплоту, то — Q. •
 Первый закон (первое начало) термодинамики вытекает из закона сохранения энергии. Согласно этому закону энергия не исчезает бесследно и не возникает из ничего, а лишь переходит из одной формы в другую в строго эквивалентных количествах.
Первый закон (первое начало) термодинамики вытекает из закона сохранения энергии. Согласно этому закону энергия не исчезает бесследно и не возникает из ничего, а лишь переходит из одной формы в другую в строго эквивалентных количествах.
 • Изохорные процессы. Если объем системы остается постоянным в ходе процесса (изохорный процесс), то работа А не совершается. При А=0 уравнение (I. 3) принимает вид • где — теплота, подведенная к системе при постоянном объеме. Из уравнения видно, что при изохорном процессе вся теплота расходуется на изменении внутренней энергии системы. Например, газ, сжатый в баллоне, не совершает никакой работы, как бы мы его ни нагревали, до тех пор, пока не начнем выпускать его из баллона. Нагревание газа в замкнутом объеме приводит к повышению его давления — к увеличению внутренней энергии системы.
• Изохорные процессы. Если объем системы остается постоянным в ходе процесса (изохорный процесс), то работа А не совершается. При А=0 уравнение (I. 3) принимает вид • где — теплота, подведенная к системе при постоянном объеме. Из уравнения видно, что при изохорном процессе вся теплота расходуется на изменении внутренней энергии системы. Например, газ, сжатый в баллоне, не совершает никакой работы, как бы мы его ни нагревали, до тех пор, пока не начнем выпускать его из баллона. Нагревание газа в замкнутом объеме приводит к повышению его давления — к увеличению внутренней энергии системы.
 • Изобарные процессы. Энтальпия. Подавляющее большинство химических процессов осуществляется при постоянном, как правило, атмосферном давлении (изобарные процессы). Часто при этих условиях происходит изменение объема. Величина изменения объема может быть определена как разность между объемом сис темы в конечном состоянии и объемом в начальном состоянии, т. е. . • Если при реакции происходит увеличение объема, равное , а внешнее давление равно р, то совершаемая при этом работа расширения равна • . • Подставив в уравнение (I. 3) значение работы расширения А, получим • (I. 5) • где — тепловая энергия процесса при постоянном давлении. Из уравнения (I. 5) видно, что в изобарном про цессе теплота расходуется на изменение внутренней энергии системы и работу расширения. Но так как a то уравнение (I. 5) может быть представлено в виде • .
• Изобарные процессы. Энтальпия. Подавляющее большинство химических процессов осуществляется при постоянном, как правило, атмосферном давлении (изобарные процессы). Часто при этих условиях происходит изменение объема. Величина изменения объема может быть определена как разность между объемом сис темы в конечном состоянии и объемом в начальном состоянии, т. е. . • Если при реакции происходит увеличение объема, равное , а внешнее давление равно р, то совершаемая при этом работа расширения равна • . • Подставив в уравнение (I. 3) значение работы расширения А, получим • (I. 5) • где — тепловая энергия процесса при постоянном давлении. Из уравнения (I. 5) видно, что в изобарном про цессе теплота расходуется на изменение внутренней энергии системы и работу расширения. Но так как a то уравнение (I. 5) может быть представлено в виде • .
 • Это уравнение для перехода системы из начального состояния 1 в конечное 2 можно записать так: • Обозначим сумму буквой Н. Эта величина получила название энтальпии (от греч. enthalpo — согреваю). Энтальпия (теплосодержание)—это новая функция состояния, которая равна сумме внутренней энергии и работы расширения: • (I. 6) • В тех случаях, когда процессы протекают только при участии твердых и жидких веществ, разница между Н и U (т. е. величина p. V) настолько незначительна, что ею можно пренебречь. • Энтальпию относят к 1 молю вещества. Она имеет размерность энергии (джоуль). Таким образом, подводимая к системе теплота при условии постоянства давления идет на увеличение энтальпии: • (I. 7) • Следовательно, изменение энтальпии зависит только от начального и конечного состояния системы, и его мож но определить как разность между энтальпией в конеч ном остоянии с Н 2 и энтальпией в начальном состоянии Н 1. Для химического процесса это энтальпии исходных веществ и продуктов реакции:
• Это уравнение для перехода системы из начального состояния 1 в конечное 2 можно записать так: • Обозначим сумму буквой Н. Эта величина получила название энтальпии (от греч. enthalpo — согреваю). Энтальпия (теплосодержание)—это новая функция состояния, которая равна сумме внутренней энергии и работы расширения: • (I. 6) • В тех случаях, когда процессы протекают только при участии твердых и жидких веществ, разница между Н и U (т. е. величина p. V) настолько незначительна, что ею можно пренебречь. • Энтальпию относят к 1 молю вещества. Она имеет размерность энергии (джоуль). Таким образом, подводимая к системе теплота при условии постоянства давления идет на увеличение энтальпии: • (I. 7) • Следовательно, изменение энтальпии зависит только от начального и конечного состояния системы, и его мож но определить как разность между энтальпией в конеч ном остоянии с Н 2 и энтальпией в начальном состоянии Н 1. Для химического процесса это энтальпии исходных веществ и продуктов реакции:
