5 Основные классы неорганических соединений.pptx
- Количество слайдов: 31
 Основные классы неорганических соединений
Основные классы неорганических соединений
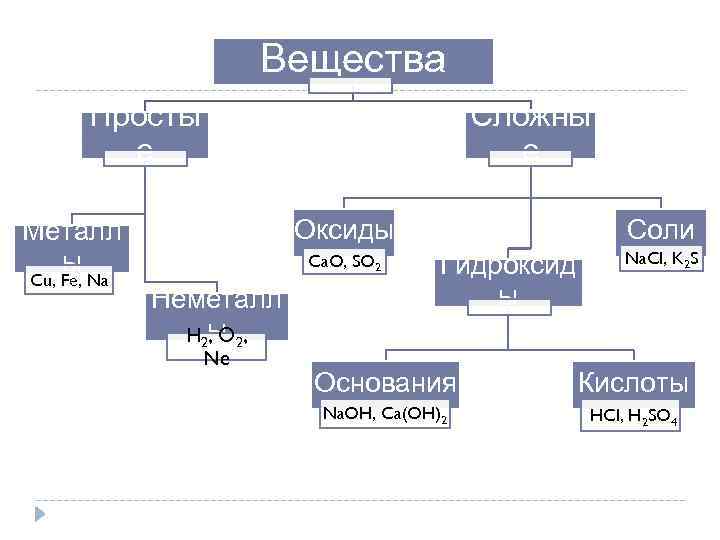 Вещества Просты е Сложны е Оксиды Металл ы Cu, Fe, Na Ca. O, SO 2 Неметалл H 2 ы 2, , O Ne Соли Гидроксид ы Na. Cl, K 2 S Основания Кислоты Na. OH, Ca(OH)2 HCl, H 2 SO 4
Вещества Просты е Сложны е Оксиды Металл ы Cu, Fe, Na Ca. O, SO 2 Неметалл H 2 ы 2, , O Ne Соли Гидроксид ы Na. Cl, K 2 S Основания Кислоты Na. OH, Ca(OH)2 HCl, H 2 SO 4
 Простые вещества v Металлы І группа главная подгруппа – щелочные металлы ü ІІ группа главная подгруппа – щелочноземельные металлы ü Ag, Au, Rh, Pd, Os, Ir, Pt (иногда Re) – благородные металлы ü v Неметаллы V группа главная подгруппа – пниктогены ü VІ группа главная подгруппа – халькогены ü VІІ группа главная подгруппа – галогены ü VІІІ группа главная подгруппа – благородные (инертные) газы ü
Простые вещества v Металлы І группа главная подгруппа – щелочные металлы ü ІІ группа главная подгруппа – щелочноземельные металлы ü Ag, Au, Rh, Pd, Os, Ir, Pt (иногда Re) – благородные металлы ü v Неметаллы V группа главная подгруппа – пниктогены ü VІ группа главная подгруппа – халькогены ü VІІ группа главная подгруппа – галогены ü VІІІ группа главная подгруппа – благородные (инертные) газы ü
 Металлы. Неметаллы
Металлы. Неметаллы
 Физические свойства простых веществ Металлы Неметаллы Твердые вещества (кроме ртути Hg) Твердые (B, C, Si, P 4, As, S, Se, Te, I 2, At); жидкие (Br 2); газообразные вещества (H 2, N 2, O 3, F 2, Cl 2, благородные газы) Металлический блеск Не имеют металлического блеска (кроме: графит C, Te, I 2) Электро- и теплопроводны Большинство не проводят электрический ток (кроме: графит C, Si) Ковкие, пластичные, тягучие В твердом состоянии - хрупкие
Физические свойства простых веществ Металлы Неметаллы Твердые вещества (кроме ртути Hg) Твердые (B, C, Si, P 4, As, S, Se, Te, I 2, At); жидкие (Br 2); газообразные вещества (H 2, N 2, O 3, F 2, Cl 2, благородные газы) Металлический блеск Не имеют металлического блеска (кроме: графит C, Te, I 2) Электро- и теплопроводны Большинство не проводят электрический ток (кроме: графит C, Si) Ковкие, пластичные, тягучие В твердом состоянии - хрупкие
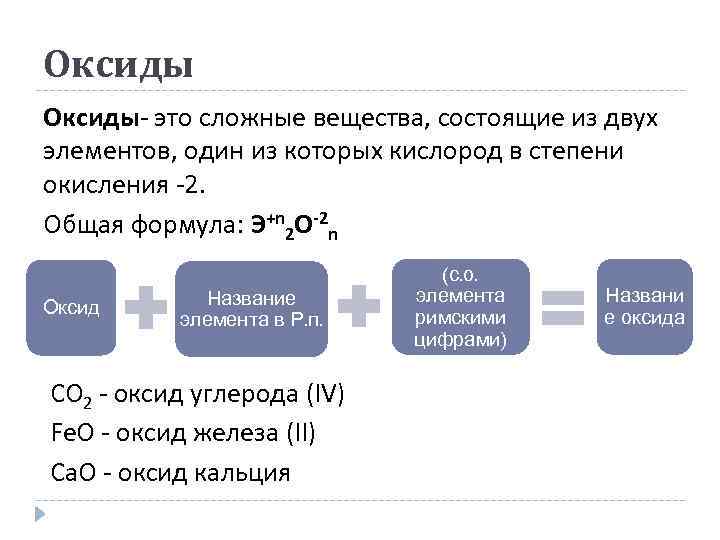 Оксиды- это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2. Общая формула: Э+n 2 O-2 n Оксид Название элемента в Р. п. CO 2 - оксид углерода (ІV) Fe. O - оксид железа (ІІ) Ca. O - оксид кальция (с. о. элемента римскими цифрами) Названи е оксида
Оксиды- это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2. Общая формула: Э+n 2 O-2 n Оксид Название элемента в Р. п. CO 2 - оксид углерода (ІV) Fe. O - оксид железа (ІІ) Ca. O - оксид кальция (с. о. элемента римскими цифрами) Названи е оксида
 Оксиды 1) Несолеобразующие - CO, Si. O, N 2 O, NO 2 2) Солеобразующие ü Основные – металлы со с. о. +1, +2 При взаимодействии с водой образуют основания Na 2 O, K 2 O, Ca. O ü Амфотерные – металлы со с. о. +3, +4; исключения: Be. O, Zn. O, Cu. O, Ge. O, Sn. O, Pb. O При взаимодействии с водой образуют основания и кислоты Al 2 O 3, Fe 2 O 3, Ge. O 2 ü Кислотные – неметаллы; металлы со с. о. +5, +6, +7 При взаимодействии с водой образуют кислоты Cl 2 O, CO 2, Mn 2 O 7 3) Двойные – Fe 3 O 4 (Fe. O·Fe 2 O 3), Pb 3 O 4 (Pb. O·Pb 2 O 3)
Оксиды 1) Несолеобразующие - CO, Si. O, N 2 O, NO 2 2) Солеобразующие ü Основные – металлы со с. о. +1, +2 При взаимодействии с водой образуют основания Na 2 O, K 2 O, Ca. O ü Амфотерные – металлы со с. о. +3, +4; исключения: Be. O, Zn. O, Cu. O, Ge. O, Sn. O, Pb. O При взаимодействии с водой образуют основания и кислоты Al 2 O 3, Fe 2 O 3, Ge. O 2 ü Кислотные – неметаллы; металлы со с. о. +5, +6, +7 При взаимодействии с водой образуют кислоты Cl 2 O, CO 2, Mn 2 O 7 3) Двойные – Fe 3 O 4 (Fe. O·Fe 2 O 3), Pb 3 O 4 (Pb. O·Pb 2 O 3)
 Гидриды - соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Li. H, Ca. H 2, Al. H 3 Иногда к гидридам относят соединения всех химических элементов с водородом. CH 4, NH 3, H 2 O, HCl
Гидриды - соединения водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Li. H, Ca. H 2, Al. H 3 Иногда к гидридам относят соединения всех химических элементов с водородом. CH 4, NH 3, H 2 O, HCl
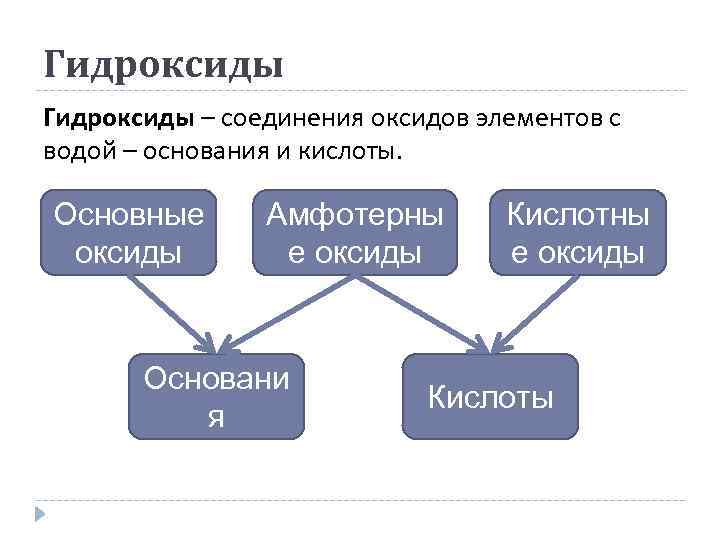 Гидроксиды – соединения оксидов элементов с водой – основания и кислоты. Основные оксиды Амфотерны е оксиды Основани я Кислотны е оксиды Кислоты
Гидроксиды – соединения оксидов элементов с водой – основания и кислоты. Основные оксиды Амфотерны е оксиды Основани я Кислотны е оксиды Кислоты
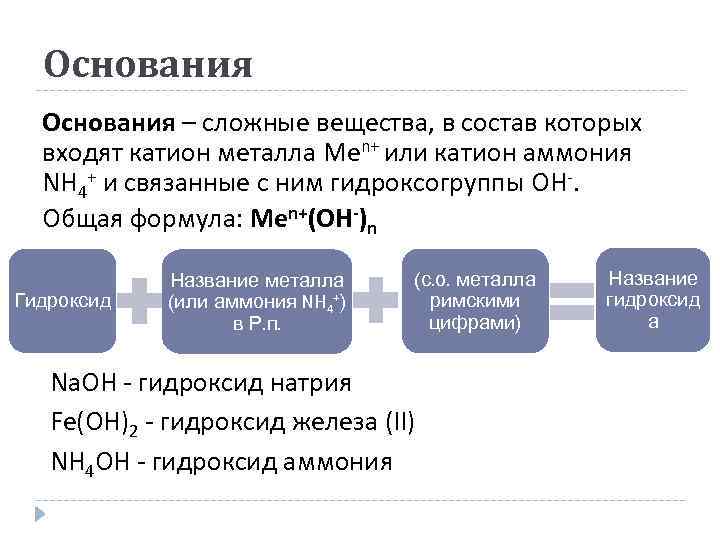 Основания – сложные вещества, в состав которых входят катион металла Men+ или катион аммония NH 4+ и связанные с ним гидроксогруппы OH-. Общая формула: Men+(OH-)n Гидроксид Название металла (или аммония NH 4+) в Р. п. (с. о. металла римскими цифрами) Na. OH - гидроксид натрия Fe(OH)2 - гидроксид железа (ІІ) NH 4 OH - гидроксид аммония Название гидроксид а
Основания – сложные вещества, в состав которых входят катион металла Men+ или катион аммония NH 4+ и связанные с ним гидроксогруппы OH-. Общая формула: Men+(OH-)n Гидроксид Название металла (или аммония NH 4+) в Р. п. (с. о. металла римскими цифрами) Na. OH - гидроксид натрия Fe(OH)2 - гидроксид железа (ІІ) NH 4 OH - гидроксид аммония Название гидроксид а
 Основания По числу гидроксогрупп OH: Однокислотные – Na. OH, KOH Двухкислотные – Ca(OH)2, Ba(OH)2 Многокислотные – Al(OH)3, Sn(OH)4 По растворимости в воде: Растворимые (щелочи) – гидроксиды щелочных (едкие щелочи) и щелочноземельных металлов – Li. OH, Ba(OH)2 Нерастворимые – Cu(OH)2, Cr(OH)3
Основания По числу гидроксогрупп OH: Однокислотные – Na. OH, KOH Двухкислотные – Ca(OH)2, Ba(OH)2 Многокислотные – Al(OH)3, Sn(OH)4 По растворимости в воде: Растворимые (щелочи) – гидроксиды щелочных (едкие щелочи) и щелочноземельных металлов – Li. OH, Ba(OH)2 Нерастворимые – Cu(OH)2, Cr(OH)3
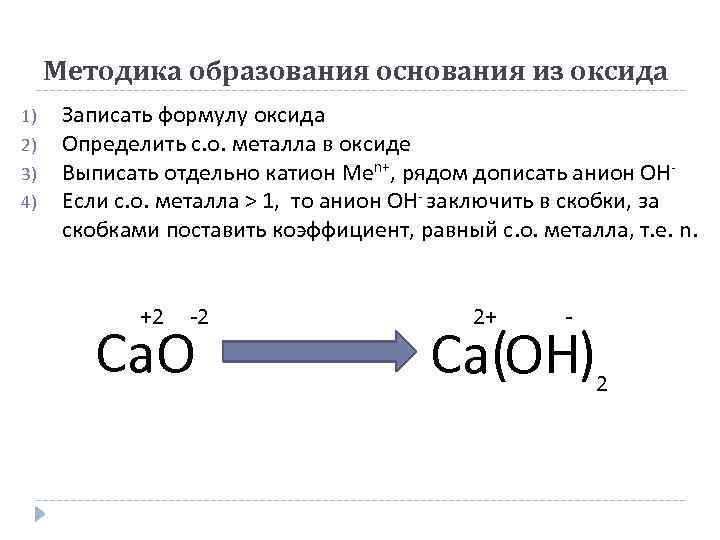 Методика образования основания из оксида 1) 2) 3) 4) Записать формулу оксида Определить с. о. металла в оксиде Выписать отдельно катион Men+, рядом дописать анион ОНЕсли с. о. металла > 1, то анион ОН- заключить в скобки, за скобками поставить коэффициент, равный с. о. металла, т. е. n. +2 -2 Ca. O 2+ - Ca(OH) 2
Методика образования основания из оксида 1) 2) 3) 4) Записать формулу оксида Определить с. о. металла в оксиде Выписать отдельно катион Men+, рядом дописать анион ОНЕсли с. о. металла > 1, то анион ОН- заключить в скобки, за скобками поставить коэффициент, равный с. о. металла, т. е. n. +2 -2 Ca. O 2+ - Ca(OH) 2
 Кислоты – сложные вещества, молекулы которых состоят из атомов водорода Н+ и кислотных остатков Аm-. Общая формула: Н+m. Аm-
Кислоты – сложные вещества, молекулы которых состоят из атомов водорода Н+ и кислотных остатков Аm-. Общая формула: Н+m. Аm-
 Кислоты По основности: Одноосновные – HF, HCl Двухосновные – H 2 S, H 2 SO 4 Многоосновные – H 3 PO 4, H 3 As. O 4 По составу: Бескислородные – HCl, HCN Кислородсодержащие – HNO 3, HCl. O
Кислоты По основности: Одноосновные – HF, HCl Двухосновные – H 2 S, H 2 SO 4 Многоосновные – H 3 PO 4, H 3 As. O 4 По составу: Бескислородные – HCl, HCN Кислородсодержащие – HNO 3, HCl. O
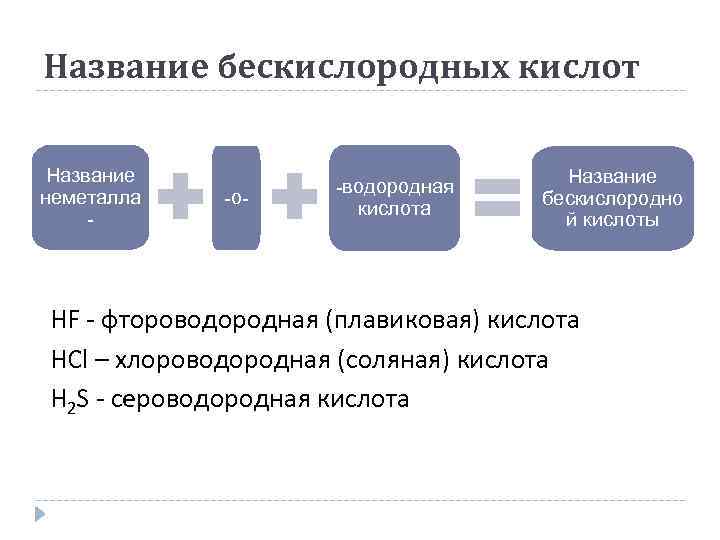 Название бескислородных кислот Название неметалла - -о- -водородная кислота Название бескислородно й кислоты HF - фтороводородная (плавиковая) кислота HCl – хлороводородная (соляная) кислота H 2 S - сероводородная кислота
Название бескислородных кислот Название неметалла - -о- -водородная кислота Название бескислородно й кислоты HF - фтороводородная (плавиковая) кислота HCl – хлороводородная (соляная) кислота H 2 S - сероводородная кислота
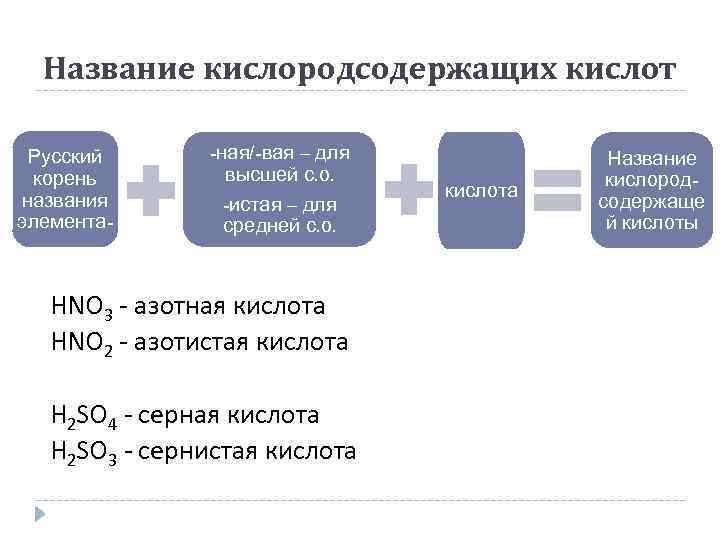 Название кислородсодержащих кислот Русский корень названия элемента- -ная/-вая – для высшей с. о. -истая – для средней с. о. HNO 3 - азотная кислота HNO 2 - азотистая кислота H 2 SO 4 - серная кислота H 2 SO 3 - сернистая кислота Название кислородсодержаще й кислоты
Название кислородсодержащих кислот Русский корень названия элемента- -ная/-вая – для высшей с. о. -истая – для средней с. о. HNO 3 - азотная кислота HNO 2 - азотистая кислота H 2 SO 4 - серная кислота H 2 SO 3 - сернистая кислота Название кислородсодержаще й кислоты
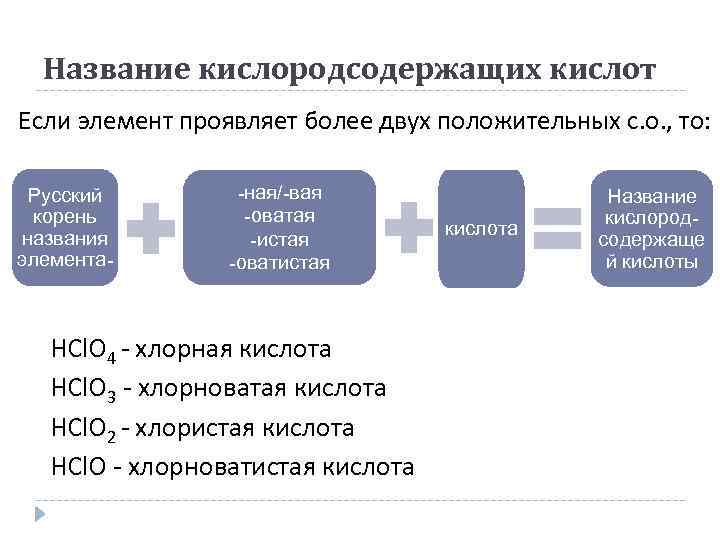 Название кислородсодержащих кислот Если элемент проявляет более двух положительных с. о. , то: Русский корень названия элемента- -ная/-вая -оватая -истая -оватистая HCl. O 4 - хлорная кислота HCl. O 3 - хлорноватая кислота HCl. O 2 - хлористая кислота HCl. O - хлорноватистая кислота Название кислородсодержаще й кислоты
Название кислородсодержащих кислот Если элемент проявляет более двух положительных с. о. , то: Русский корень названия элемента- -ная/-вая -оватая -истая -оватистая HCl. O 4 - хлорная кислота HCl. O 3 - хлорноватая кислота HCl. O 2 - хлористая кислота HCl. O - хлорноватистая кислота Название кислородсодержаще й кислоты
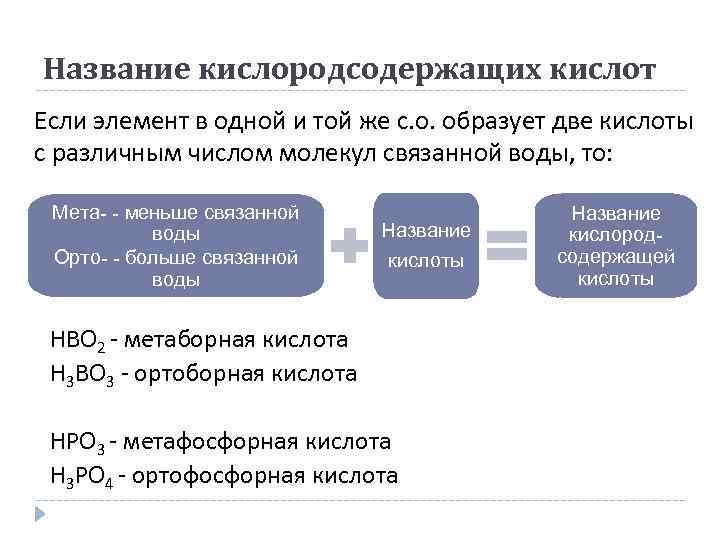 Название кислородсодержащих кислот Если элемент в одной и той же с. о. образует две кислоты с различным числом молекул связанной воды, то: Мета- - меньше связанной воды Орто- - больше связанной воды Название кислоты HBO 2 - метаборная кислота H 3 BO 3 - ортоборная кислота HPO 3 - метафосфорная кислота H 3 PO 4 - ортофосфорная кислота Название кислородсодержащей кислоты
Название кислородсодержащих кислот Если элемент в одной и той же с. о. образует две кислоты с различным числом молекул связанной воды, то: Мета- - меньше связанной воды Орто- - больше связанной воды Название кислоты HBO 2 - метаборная кислота H 3 BO 3 - ортоборная кислота HPO 3 - метафосфорная кислота H 3 PO 4 - ортофосфорная кислота Название кислородсодержащей кислоты
 Методика образования кислоты из оксида Записать формулу оксида К оксиду алгебраически прибавить одну молекулу воды Сократить коэффициенты, если это возможно Если нужно образовать ортокислоту, то к метакислоте надо добавить еще одну молекулу воды 1) 2) 3) 4) +5 + -2 P 2 O 5 H 2 O H 2 P 2 O 6 = HPO 3 + H 2 O H 3 PO 4
Методика образования кислоты из оксида Записать формулу оксида К оксиду алгебраически прибавить одну молекулу воды Сократить коэффициенты, если это возможно Если нужно образовать ортокислоту, то к метакислоте надо добавить еще одну молекулу воды 1) 2) 3) 4) +5 + -2 P 2 O 5 H 2 O H 2 P 2 O 6 = HPO 3 + H 2 O H 3 PO 4
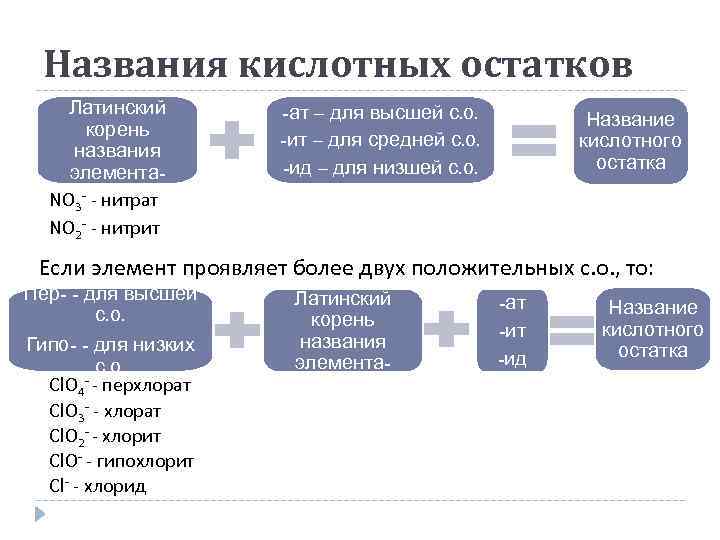 Названия кислотных остатков Латинский корень названия элемента. NO 3 - - нитрат NO 2 - - нитрит -ат – для высшей с. о. -ит – для средней с. о. -ид – для низшей с. о. Название кислотного остатка Если элемент проявляет более двух положительных с. о. , то: Пер- - для высшей с. о. Гипо- - для низких с. о. - - перхлорат Cl. O 4 Cl. O 3 - - хлорат Cl. O 2 - - хлорит Cl. O- - гипохлорит Cl- - хлорид Латинский корень названия элемента- -ат -ид Название кислотного остатка
Названия кислотных остатков Латинский корень названия элемента. NO 3 - - нитрат NO 2 - - нитрит -ат – для высшей с. о. -ит – для средней с. о. -ид – для низшей с. о. Название кислотного остатка Если элемент проявляет более двух положительных с. о. , то: Пер- - для высшей с. о. Гипо- - для низких с. о. - - перхлорат Cl. O 4 Cl. O 3 - - хлорат Cl. O 2 - - хлорит Cl. O- - гипохлорит Cl- - хлорид Латинский корень названия элемента- -ат -ид Название кислотного остатка
 Соли 1) Как продукты замены протонов в кислотах или гидроксогрупп в основаниях: Средние – KBr, Ca. SO 4 Основные – (Cu. OH)2 CO 3, Zn. OHCl Кислые – K 2 HPO 4, KH 2 PO 4 2) По числу присутствующих в структуре катионов и анионов: Простые – Na. Cl, Ag. I Двойные – KAl(SO 4)2, Ca. Mg(CO 3)2 Смешанные - Ca(Cl. O)Cl, Mg. Cl. Br
Соли 1) Как продукты замены протонов в кислотах или гидроксогрупп в основаниях: Средние – KBr, Ca. SO 4 Основные – (Cu. OH)2 CO 3, Zn. OHCl Кислые – K 2 HPO 4, KH 2 PO 4 2) По числу присутствующих в структуре катионов и анионов: Простые – Na. Cl, Ag. I Двойные – KAl(SO 4)2, Ca. Mg(CO 3)2 Смешанные - Ca(Cl. O)Cl, Mg. Cl. Br
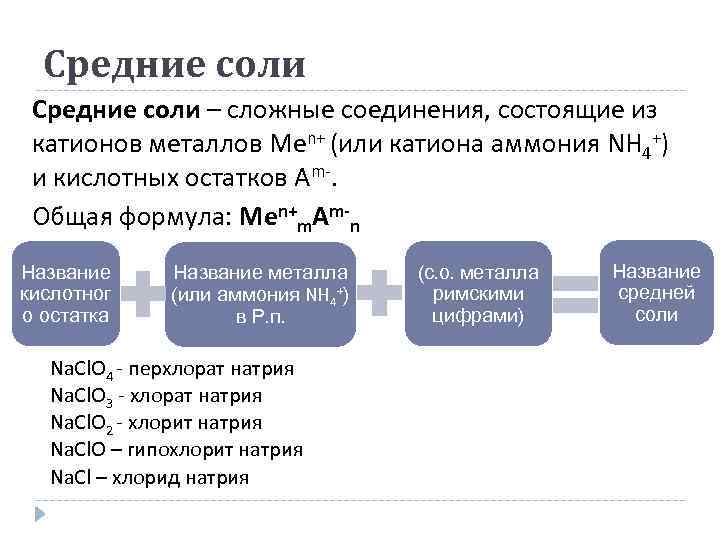 Средние соли – сложные соединения, состоящие из катионов металлов Men+ (или катиона аммония NH 4+) и кислотных остатков Аm-. Общая формула: Men+m. Аm-n Название кислотног о остатка Название металла (или аммония NH 4+) в Р. п. Na. Cl. O 4 - перхлорат натрия Na. Cl. O 3 - хлорат натрия Na. Cl. O 2 - хлорит натрия Na. Cl. O – гипохлорит натрия Na. Cl – хлорид натрия (с. о. металла римскими цифрами) Название средней соли
Средние соли – сложные соединения, состоящие из катионов металлов Men+ (или катиона аммония NH 4+) и кислотных остатков Аm-. Общая формула: Men+m. Аm-n Название кислотног о остатка Название металла (или аммония NH 4+) в Р. п. Na. Cl. O 4 - перхлорат натрия Na. Cl. O 3 - хлорат натрия Na. Cl. O 2 - хлорит натрия Na. Cl. O – гипохлорит натрия Na. Cl – хлорид натрия (с. о. металла римскими цифрами) Название средней соли
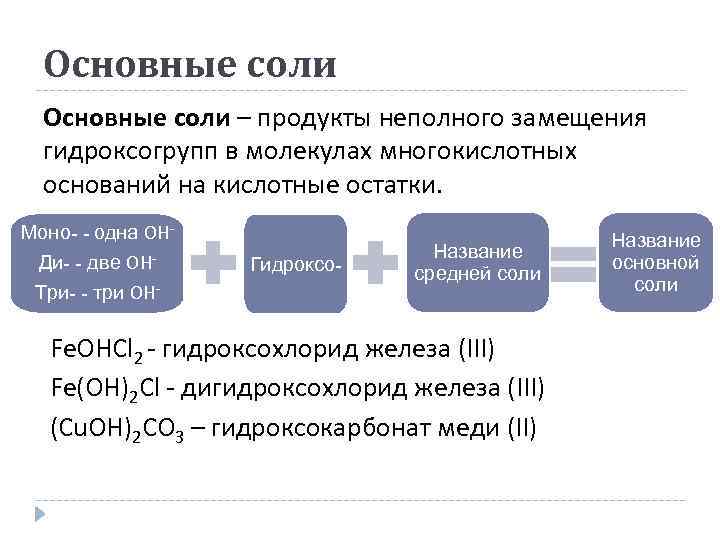 Основные соли – продукты неполного замещения гидроксогрупп в молекулах многокислотных оснований на кислотные остатки. Моно- - одна OHДи- - две OHТри- - три OH- Гидроксо- Название средней соли Fe. OHCl 2 - гидроксохлорид железа (ІІІ) Fe(OH)2 Cl - дигидроксохлорид железа (ІІІ) (Cu. OH)2 CO 3 – гидроксокарбонат меди (ІІ) Название основной соли
Основные соли – продукты неполного замещения гидроксогрупп в молекулах многокислотных оснований на кислотные остатки. Моно- - одна OHДи- - две OHТри- - три OH- Гидроксо- Название средней соли Fe. OHCl 2 - гидроксохлорид железа (ІІІ) Fe(OH)2 Cl - дигидроксохлорид железа (ІІІ) (Cu. OH)2 CO 3 – гидроксокарбонат меди (ІІ) Название основной соли
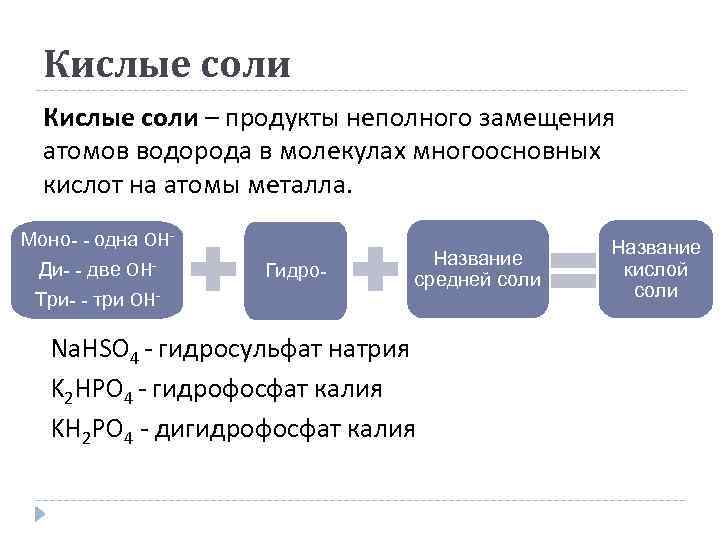 Кислые соли – продукты неполного замещения атомов водорода в молекулах многоосновных кислот на атомы металла. Моно- - одна OHДи- - две OHТри- - три OH- Гидро- Название средней соли Na. HSO 4 - гидросульфат натрия K 2 HPO 4 - гидрофосфат калия KH 2 PO 4 - дигидрофосфат калия Название кислой соли
Кислые соли – продукты неполного замещения атомов водорода в молекулах многоосновных кислот на атомы металла. Моно- - одна OHДи- - две OHТри- - три OH- Гидро- Название средней соли Na. HSO 4 - гидросульфат натрия K 2 HPO 4 - гидрофосфат калия KH 2 PO 4 - дигидрофосфат калия Название кислой соли
 По числу присутствующих в структуре катионов и анионов Простые соли – соли, состоящие из одного вида катионов и одного вида анионов. K 2 SO 4 – сульфат калия Двойные соли – соли, содержащие два типа катионов. KAl(SO 4)2 – сульфат алюминия-калия Смешанные соли – соли, содержащие два типа кислотных остатков. Ca(OCl)Cl – гипохлорит-хлорид кальция
По числу присутствующих в структуре катионов и анионов Простые соли – соли, состоящие из одного вида катионов и одного вида анионов. K 2 SO 4 – сульфат калия Двойные соли – соли, содержащие два типа катионов. KAl(SO 4)2 – сульфат алюминия-калия Смешанные соли – соли, содержащие два типа кислотных остатков. Ca(OCl)Cl – гипохлорит-хлорид кальция
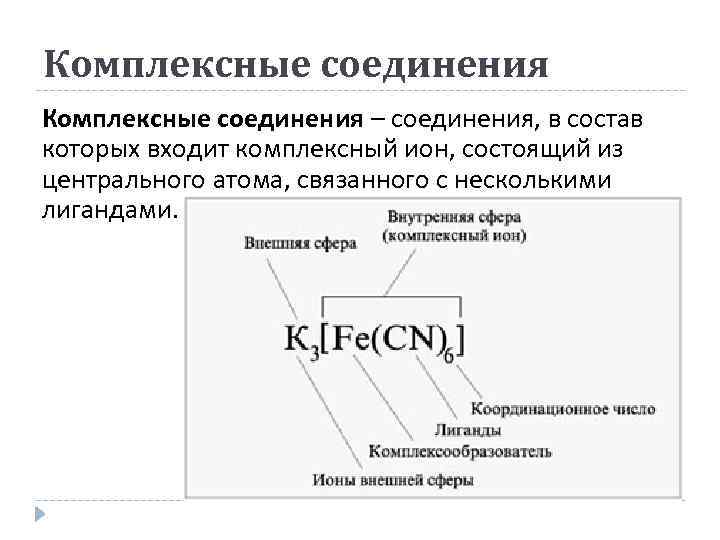 Комплексные соединения – соединения, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами.
Комплексные соединения – соединения, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами.
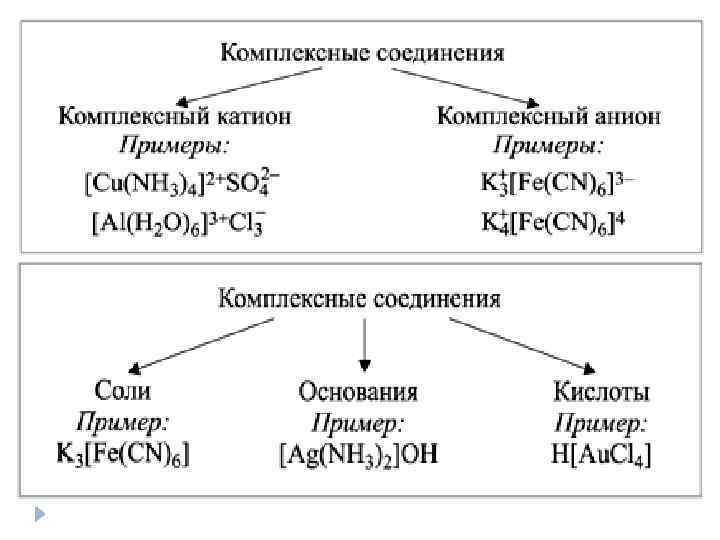
 Номенклатура комплексных соединений Если комплексный – анион: 1) Число лигандов (греческие числительные) 2) Латинское название лиганда 3) Соединительная «о» , если название лиганда оканчивается на согласную букву 4) Латинское название комплексообразователя на –ат с указание с. о. 5) Название катиона внешней сферы в Р. п. 1 моно 6 гекса 2 ди 7 гепта 3 три 8 окта 4 тетр а 9 нано 5 пент 10 дека H 2 а O аква NH 3 аммин CO карбонил OH- гидроксо K 3[Fe(CN)6] – гексацианоферрат (ІІІ) калия Na[Al(OH)4(H 2 O)2] - диакватетрагидроксоалюминат натрия
Номенклатура комплексных соединений Если комплексный – анион: 1) Число лигандов (греческие числительные) 2) Латинское название лиганда 3) Соединительная «о» , если название лиганда оканчивается на согласную букву 4) Латинское название комплексообразователя на –ат с указание с. о. 5) Название катиона внешней сферы в Р. п. 1 моно 6 гекса 2 ди 7 гепта 3 три 8 окта 4 тетр а 9 нано 5 пент 10 дека H 2 а O аква NH 3 аммин CO карбонил OH- гидроксо K 3[Fe(CN)6] – гексацианоферрат (ІІІ) калия Na[Al(OH)4(H 2 O)2] - диакватетрагидроксоалюминат натрия
 Номенклатура комплексных соединений Если комплексный – катион: 1) Число анионов внешней сферы 2) Латинское название анионов 3) Число лигандов (греческие числительные) 4) Название лигандов 5) Русское название комплексообразователя в Р. п. с указанием с. о. 6) Если внутренняя сфера комплекса нейтральна, то название комплексообразователя в И. п. [Zn(NH 3)4]Cl 2 – (ди)хлорид тетрааммин цинка [Cr(NH 3)3(H 2 O)3]Cl 3 - (три)хлорид триакватриаммин хрома (ІІІ) [Cr(H 2 O)3 Cl 3]· 6 H 2 O – гексагидрат трихлоротриаквахром (ІІІ)
Номенклатура комплексных соединений Если комплексный – катион: 1) Число анионов внешней сферы 2) Латинское название анионов 3) Число лигандов (греческие числительные) 4) Название лигандов 5) Русское название комплексообразователя в Р. п. с указанием с. о. 6) Если внутренняя сфера комплекса нейтральна, то название комплексообразователя в И. п. [Zn(NH 3)4]Cl 2 – (ди)хлорид тетрааммин цинка [Cr(NH 3)3(H 2 O)3]Cl 3 - (три)хлорид триакватриаммин хрома (ІІІ) [Cr(H 2 O)3 Cl 3]· 6 H 2 O – гексагидрат трихлоротриаквахром (ІІІ)
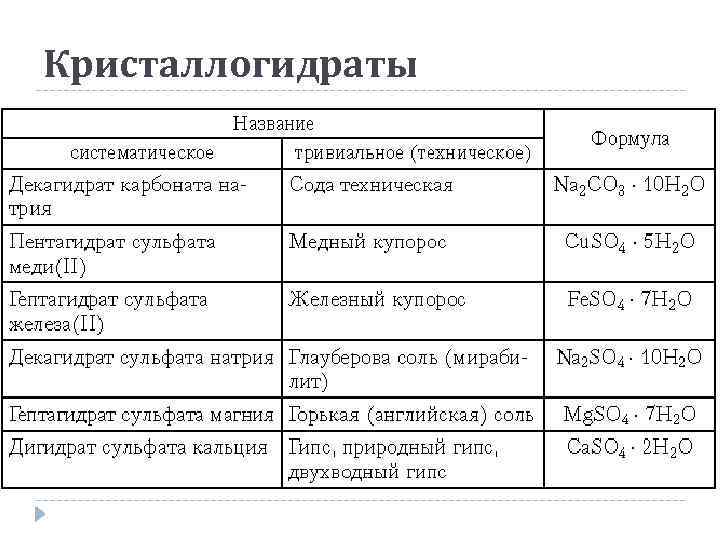
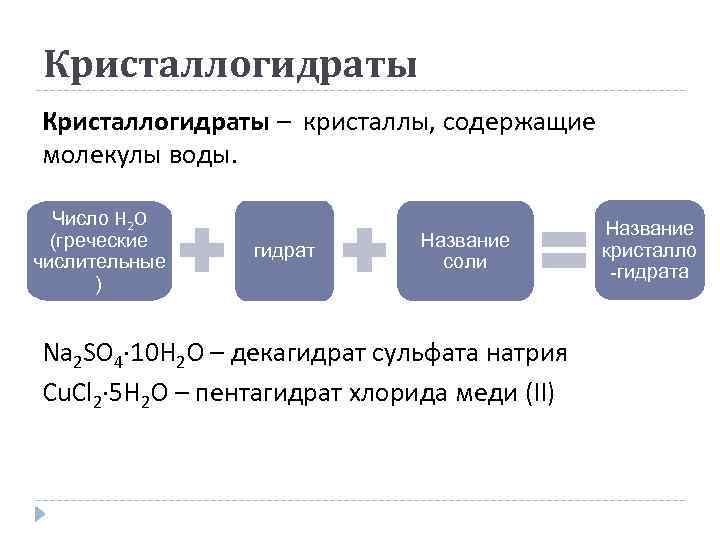 Кристаллогидраты – кристаллы, содержащие молекулы воды. Число H 2 O (греческие числительные ) гидрат Название соли Na 2 SO 4· 10 H 2 O – декагидрат сульфата натрия Cu. Cl 2· 5 H 2 O – пентагидрат хлорида меди (ІІ) Название кристалло -гидрата
Кристаллогидраты – кристаллы, содержащие молекулы воды. Число H 2 O (греческие числительные ) гидрат Название соли Na 2 SO 4· 10 H 2 O – декагидрат сульфата натрия Cu. Cl 2· 5 H 2 O – пентагидрат хлорида меди (ІІ) Название кристалло -гидрата
 Кристаллогидраты
Кристаллогидраты
