Осн класи неорг сполук.ppt
- Количество слайдов: 36
 Основні класи неорганічних сполук. Комплексні сполуки 1
Основні класи неорганічних сполук. Комплексні сполуки 1
 Неорганічні речовини поділяють на класи, або за складом (двохелементні, чи бінарні, сполуки і багатоелементні сполуки), або ж за хімічними властивостями, тобто за функціями ( кислотно-основними, окисно-відновними і т. д. ), які ці речовини проявляють в хімічних реакціях, - за їх функціональними ознаками. До найважливіших бінарних сполук відносяться сполуки елементів з оксигеном (оксиди), з галогенами (галогеніди), нітрогеном (нітриди), карбоном (карбіди), а також сполуки металічних елементів із гідрогеном (гідриди). Найважливішими класами неорганічних сполук за функціональними ознаками є оксиди, кислоти, основи, амфотерні гідроксиди й солі. 2
Неорганічні речовини поділяють на класи, або за складом (двохелементні, чи бінарні, сполуки і багатоелементні сполуки), або ж за хімічними властивостями, тобто за функціями ( кислотно-основними, окисно-відновними і т. д. ), які ці речовини проявляють в хімічних реакціях, - за їх функціональними ознаками. До найважливіших бінарних сполук відносяться сполуки елементів з оксигеном (оксиди), з галогенами (галогеніди), нітрогеном (нітриди), карбоном (карбіди), а також сполуки металічних елементів із гідрогеном (гідриди). Найважливішими класами неорганічних сполук за функціональними ознаками є оксиди, кислоти, основи, амфотерні гідроксиди й солі. 2
 Оксиди • Оксиди - бінарні оксигеновмісні сполуки, в яких Оксиген виявляє ступінь окиснення -2. • До оксидів належать майже всі бінарні сполуки елементів з Оксигеном, крім сполуки Оксигену з Флуором OF 2 • Оксиди мають різноманітні фізичні властивості – від газів, стійких за низьких температур, до твердих кристалічних сполук з дуже високими температурами плавлення. • Назви оксидів утворюють, ставлячи перед словом оксид назву елемента в називному відмінку. Якщо елемент утворює декілька оксидів, то в дужках зазначають валентність елемента римською цифрою, також іноді використовують числівникові префікси. Наприклад, SO 2 – сульфур (IV) оксид (або сульфур діоксид), SO 3 – сульфур (VI) оксид (або сульфур триоксид). 3
Оксиди • Оксиди - бінарні оксигеновмісні сполуки, в яких Оксиген виявляє ступінь окиснення -2. • До оксидів належать майже всі бінарні сполуки елементів з Оксигеном, крім сполуки Оксигену з Флуором OF 2 • Оксиди мають різноманітні фізичні властивості – від газів, стійких за низьких температур, до твердих кристалічних сполук з дуже високими температурами плавлення. • Назви оксидів утворюють, ставлячи перед словом оксид назву елемента в називному відмінку. Якщо елемент утворює декілька оксидів, то в дужках зазначають валентність елемента римською цифрою, також іноді використовують числівникові префікси. Наприклад, SO 2 – сульфур (IV) оксид (або сульфур діоксид), SO 3 – сульфур (VI) оксид (або сульфур триоксид). 3
 Класифікація оксидів За хімічними властивостями оксиди поділяють: солетворні і несолетворні. • солетворні - це оксиди, які в разі перебігу певних хімічних реакцій здатні утворювати солі. CO 2 + Ca(OH)2 → Ca. CO 3 + H 2 O Ca. O + 2 HCl → Ca. Cl 2 + H 2 O • несолетворні - це оксиди, які не здатні утворювати солей: NO, N 2 O, CO( їх є мало). Проте вони здатні вступати в інші хімічні реакції: 2 NO + O 2 → 2 NO 2 Солетворні оксиди поділяють на основні, гідрати яких є основами; кислотні, які з водою утворюють кислоти, і амфотерні, що залежно від умов реакції можуть виявляти основність або кислотність. 4
Класифікація оксидів За хімічними властивостями оксиди поділяють: солетворні і несолетворні. • солетворні - це оксиди, які в разі перебігу певних хімічних реакцій здатні утворювати солі. CO 2 + Ca(OH)2 → Ca. CO 3 + H 2 O Ca. O + 2 HCl → Ca. Cl 2 + H 2 O • несолетворні - це оксиди, які не здатні утворювати солей: NO, N 2 O, CO( їх є мало). Проте вони здатні вступати в інші хімічні реакції: 2 NO + O 2 → 2 NO 2 Солетворні оксиди поділяють на основні, гідрати яких є основами; кислотні, які з водою утворюють кислоти, і амфотерні, що залежно від умов реакції можуть виявляти основність або кислотність. 4
 Солетворні оксиди Основними називають оксиди, гідрати яких є основами. Такими можуть бути лише оксиди металів, наприклад: Na 2 O, Ca. O, La 2 O 3, Mg. O, Ba. O, Mn 2 O 3, Cr. O. Основні оксиди реагують: • з ангідридами кислот: Ba. O + N 2 O 5→ Ba(NO 3)2 • з кислотами: Ca. O + 2 HNO 3 → Ca(NO 3)2 + H 2 O • з водою (тільки оксиди ЛЗМ і ЛМ): K 2 O + H 2 O → 2 KOH • • Кислотні оксиди з водою утворюють кислоти, тому їх часто називають ангідридами кислот (N 2 O 5, SO 3, Cr. O 3, V 2 O 5). Оксиди типових неметалів мають кислотний характер, а також деяких металів з ступенем окиснення +5 і більше. Кислотні оксиди реагують: з основними оксидами: SO 3 + Ca. O → Ca. SO 4 з основами: N 2 O 3 + Ca(OH)2 → Ca(NO 2)2 + H 2 O з деякими кислотами: Si. O 2 + 4 HF → Si. F 4 + 2 H 2 O з водою: SO 3 + H 2 O → H 2 SO 4 5
Солетворні оксиди Основними називають оксиди, гідрати яких є основами. Такими можуть бути лише оксиди металів, наприклад: Na 2 O, Ca. O, La 2 O 3, Mg. O, Ba. O, Mn 2 O 3, Cr. O. Основні оксиди реагують: • з ангідридами кислот: Ba. O + N 2 O 5→ Ba(NO 3)2 • з кислотами: Ca. O + 2 HNO 3 → Ca(NO 3)2 + H 2 O • з водою (тільки оксиди ЛЗМ і ЛМ): K 2 O + H 2 O → 2 KOH • • Кислотні оксиди з водою утворюють кислоти, тому їх часто називають ангідридами кислот (N 2 O 5, SO 3, Cr. O 3, V 2 O 5). Оксиди типових неметалів мають кислотний характер, а також деяких металів з ступенем окиснення +5 і більше. Кислотні оксиди реагують: з основними оксидами: SO 3 + Ca. O → Ca. SO 4 з основами: N 2 O 3 + Ca(OH)2 → Ca(NO 2)2 + H 2 O з деякими кислотами: Si. O 2 + 4 HF → Si. F 4 + 2 H 2 O з водою: SO 3 + H 2 O → H 2 SO 4 5
 Солетворні оксиди Амфотерними називають оксиди металів, які одночасно виявляють властивості кислотних і основних оксидів: утворюють солі в разі взаємодії як з кислотами (кислотними оксидами), так і з основами (основними оксидами). До амфотерних оксидів належать Al 2 O 3, Zn. O, Cr 2 O 3, Be. O, Sn. O 2, Pb. O 2, Mn. O 2, UO 3 та ін. Наприклад, амфотерний цинк оксид реагує з натрій гідроксидом і з хлоридною кислотою: Zn. O + 2 Na. OH = Na 2 Zn. O 2 + H 2 O Zn. O + 2 HCl = Zn. Cl 2 + H 2 O Деякі амфотерні оксиди дуже стійкі проти різних впливів - не розчиняються в розчинах кислот чи основ. Їх можна перевести в розчини лише сплавлянням: Al 2 O 3 + 3 Na 2 CO 3 → 2 Na 3 Al. O 3 + 3 CO 2↑ Якщо метал утворює декілька оксидів, то з нижчим ступенем окиснення - основні, з найвищим - кислотні, а проміжні - амфотерні. Mn. O, Mn 2 O 3 - основні; Mn. O 2 - амфотерний; Mn 2 O 7(Mn. O 3) - кислотний. 6
Солетворні оксиди Амфотерними називають оксиди металів, які одночасно виявляють властивості кислотних і основних оксидів: утворюють солі в разі взаємодії як з кислотами (кислотними оксидами), так і з основами (основними оксидами). До амфотерних оксидів належать Al 2 O 3, Zn. O, Cr 2 O 3, Be. O, Sn. O 2, Pb. O 2, Mn. O 2, UO 3 та ін. Наприклад, амфотерний цинк оксид реагує з натрій гідроксидом і з хлоридною кислотою: Zn. O + 2 Na. OH = Na 2 Zn. O 2 + H 2 O Zn. O + 2 HCl = Zn. Cl 2 + H 2 O Деякі амфотерні оксиди дуже стійкі проти різних впливів - не розчиняються в розчинах кислот чи основ. Їх можна перевести в розчини лише сплавлянням: Al 2 O 3 + 3 Na 2 CO 3 → 2 Na 3 Al. O 3 + 3 CO 2↑ Якщо метал утворює декілька оксидів, то з нижчим ступенем окиснення - основні, з найвищим - кислотні, а проміжні - амфотерні. Mn. O, Mn 2 O 3 - основні; Mn. O 2 - амфотерний; Mn 2 O 7(Mn. O 3) - кислотний. 6
 Способи одержання оксидів 1. Взаємодія простих речовин з киснем: 4 Р + 5 О 2 = 2 Р 2 О 5 2. Взаємодія складних речовин з киснем, зокрема горіння органічних речовин: СН 4 + О 2 = СО 2 + 2 Н 2 О 3. Термічний розклад основ: Fe(ОН)2 = Fe. О + Н 2 О 4. Термічний розклад кислот: 4 HNO 3 = 4 NO 2 + 2 Н 2 О + О 2 5. Термічний розклад cолей: Ca. CO 3 = Ca. O + CO 2 6. Розкладання оксидів: 4 Cr. O 3 = 2 Cr 2 O 3 + 3 O 2 7
Способи одержання оксидів 1. Взаємодія простих речовин з киснем: 4 Р + 5 О 2 = 2 Р 2 О 5 2. Взаємодія складних речовин з киснем, зокрема горіння органічних речовин: СН 4 + О 2 = СО 2 + 2 Н 2 О 3. Термічний розклад основ: Fe(ОН)2 = Fe. О + Н 2 О 4. Термічний розклад кислот: 4 HNO 3 = 4 NO 2 + 2 Н 2 О + О 2 5. Термічний розклад cолей: Ca. CO 3 = Ca. O + CO 2 6. Розкладання оксидів: 4 Cr. O 3 = 2 Cr 2 O 3 + 3 O 2 7
 Хімічні властивості оксидів 1. Деякі основні та більшість кислотних оксидів безпосередньо взаємодіють з водою: Са. О + Н 2 О = Са(ОН)2, SO 3 + H 2 O = H 2 SO 4 2. Кислотні й основні оксиди реагують між собою з утворенням солей: SO 3 + Ca. O = Ca. SO 4 3. Основні оксиди, взаємодіючи з кислотами, утворюють солі: Mg. O + 2 HCl = Mg. Cl 2 + H 2 O 4. Кислотні оксиди утворюють солі, взаємодіючи з основами: SO 3 + 2 KOH = K 2 SO 4 + H 2 O 5. Основні та кислотні оксиди взаємодіють з амфотерними оксидами: Ca. O + Zn. O = Ca. Zn. O 2, P 2 O 5 + Al 2 O 3 = 2 Al. PO 4 6. Амфотерні оксиди взаємодіють з кислотами та лугами: Zn. O + H 2 SO 4 = Zn. SO 4 + H 2 O Zn. O + 2 Na. OH = Na 2 Zn. O 2 + H 2 O (під час сплавляння) Zn. O + 2 Na. OH + H 2 О = Na 2[Zn(OH)4] (у розчині) 8
Хімічні властивості оксидів 1. Деякі основні та більшість кислотних оксидів безпосередньо взаємодіють з водою: Са. О + Н 2 О = Са(ОН)2, SO 3 + H 2 O = H 2 SO 4 2. Кислотні й основні оксиди реагують між собою з утворенням солей: SO 3 + Ca. O = Ca. SO 4 3. Основні оксиди, взаємодіючи з кислотами, утворюють солі: Mg. O + 2 HCl = Mg. Cl 2 + H 2 O 4. Кислотні оксиди утворюють солі, взаємодіючи з основами: SO 3 + 2 KOH = K 2 SO 4 + H 2 O 5. Основні та кислотні оксиди взаємодіють з амфотерними оксидами: Ca. O + Zn. O = Ca. Zn. O 2, P 2 O 5 + Al 2 O 3 = 2 Al. PO 4 6. Амфотерні оксиди взаємодіють з кислотами та лугами: Zn. O + H 2 SO 4 = Zn. SO 4 + H 2 O Zn. O + 2 Na. OH = Na 2 Zn. O 2 + H 2 O (під час сплавляння) Zn. O + 2 Na. OH + H 2 О = Na 2[Zn(OH)4] (у розчині) 8
 Кислоти Кислотами називаються сполуки, що містять іони гідрогену, які здатні заміщуватись на метал (або металоподібну групу атомів) і утворювати при цьому солі. Кількість іонів Гідрогену в кислоті визначає її основність. Відповідно, розрізняють одно- та багатоосновні кислоти. Групу атомів, яка залишається після відщеплення від молекули кислоти атомів Гідрогену, називають кислотним залишком. За хімічним складом розрізняють безоксигенові та оксигеновмісні кислоти. Оксигеновмісні кислоти є гідратами кислотних оксидів, проте для деяких кислот (H 3 PO 2, HBr. O 3) відповідні оксиди не існують. В окисно-відновних реакціях кислоти можуть бути як окисниками (НNO 3, H 2 SO 4), так і відновниками (H 2 S, HСl). 9
Кислоти Кислотами називаються сполуки, що містять іони гідрогену, які здатні заміщуватись на метал (або металоподібну групу атомів) і утворювати при цьому солі. Кількість іонів Гідрогену в кислоті визначає її основність. Відповідно, розрізняють одно- та багатоосновні кислоти. Групу атомів, яка залишається після відщеплення від молекули кислоти атомів Гідрогену, називають кислотним залишком. За хімічним складом розрізняють безоксигенові та оксигеновмісні кислоти. Оксигеновмісні кислоти є гідратами кислотних оксидів, проте для деяких кислот (H 3 PO 2, HBr. O 3) відповідні оксиди не існують. В окисно-відновних реакціях кислоти можуть бути як окисниками (НNO 3, H 2 SO 4), так і відновниками (H 2 S, HСl). 9
 Номенклатура кислот Назви безоксигенових кислот утворюють з назви кислотоутворювального елемента (або радикала) та слова кислота: HCl – хлоридна, або хлороводнева, кислота, HBr – бромідна, або бромоводнева. Назви оксигеновмісних кислот утворюють з кореня латинської назви кислотоутворювального елемента, суфіксів -ат (вищий ступінь окиснення) або -ит (іт) (нижчий ступінь окиснення), закінчення -на і слова кислота. Наприклад, H 2 SO 4 – сульфатна кислота, H 2 SO 3 – сульфітна кислота. Якщо елемент зі змінною валентністю утворює декілька кислот, то для їхніх назв використовують суфікси: -ова, -увата, -иста, уватиста. Також використовують префікси гіпо- (найнижчий ступінь окиснення) та пер- (найвищий ступінь окиснення). Наприклад, оксигеновмісні кислоти хлору мають такі назви: 10
Номенклатура кислот Назви безоксигенових кислот утворюють з назви кислотоутворювального елемента (або радикала) та слова кислота: HCl – хлоридна, або хлороводнева, кислота, HBr – бромідна, або бромоводнева. Назви оксигеновмісних кислот утворюють з кореня латинської назви кислотоутворювального елемента, суфіксів -ат (вищий ступінь окиснення) або -ит (іт) (нижчий ступінь окиснення), закінчення -на і слова кислота. Наприклад, H 2 SO 4 – сульфатна кислота, H 2 SO 3 – сульфітна кислота. Якщо елемент зі змінною валентністю утворює декілька кислот, то для їхніх назв використовують суфікси: -ова, -увата, -иста, уватиста. Також використовують префікси гіпо- (найнижчий ступінь окиснення) та пер- (найвищий ступінь окиснення). Наприклад, оксигеновмісні кислоти хлору мають такі назви: 10
 Номенклатура кислот Молекули деяких ангідридів за різних умов можуть приєднувати різне число молекул води, тоді кислота з більшим вмістом води має назву з префіксом орто-, а з меншим – мета-. Наприклад: Р 2 О 5 + Н 2 О = 2 НРО 3 – метафосфатна кислота; Р 2 О 5 + 3 Н 2 О = 2 Н 3 РО 4 – ортофосфатна кислота. Для позначення кислот, які отримують частковим зневодненням ортокислот, використовують префікс піроабо зазначають кількість атомів кислотоутворювача: H 2 S 2 O 7 – піросульфатна (дисульфатна); H 4 P 2 O 7 – пірофосфатна (дифосфатна) кислота. 11
Номенклатура кислот Молекули деяких ангідридів за різних умов можуть приєднувати різне число молекул води, тоді кислота з більшим вмістом води має назву з префіксом орто-, а з меншим – мета-. Наприклад: Р 2 О 5 + Н 2 О = 2 НРО 3 – метафосфатна кислота; Р 2 О 5 + 3 Н 2 О = 2 Н 3 РО 4 – ортофосфатна кислота. Для позначення кислот, які отримують частковим зневодненням ортокислот, використовують префікс піроабо зазначають кількість атомів кислотоутворювача: H 2 S 2 O 7 – піросульфатна (дисульфатна); H 4 P 2 O 7 – пірофосфатна (дифосфатна) кислота. 11
 Методи одержання кислот 1. Взаємодія ангідридів кислот з водою: SO 3 + H 2 O = H 2 SO 4 N 2 O 5 + H 2 O = 2 HNO 3 2. Взаємодія солей з кислотами: KCl + H 2 SO 4 (конц) = HCl↑ + KHSO 4 Na 2 Si. O 3 + 2 НСl = H 2 Si. O 3↓ + 2 Na. Cl 3. Окиснення деяких простих речовин: I 2 + 5 Cl 2 + 6 H 2 O = 2 HIO 3 + 10 HCl 3 P + 5 HNO 3 + 2 H 2 O = 3 H 3 PO 4 + 5 NO 4. Безпосередня взаємодія активних неметалів з водою: Сl 2 + H 2 O = HCl + HCl. O 5. Взаємодія неметалів з воднем: Н 2 + Сl 2 = 2 HCl H 2 + I 2 = 2 HI 6. Гідроліз галогеноангідридів кислот: PІ3 + 3 H 2 O = 3 HI + H 3 PO 3 PCl 5 + 4 H 2 O = 5 HCl + H 3 PO 4 12
Методи одержання кислот 1. Взаємодія ангідридів кислот з водою: SO 3 + H 2 O = H 2 SO 4 N 2 O 5 + H 2 O = 2 HNO 3 2. Взаємодія солей з кислотами: KCl + H 2 SO 4 (конц) = HCl↑ + KHSO 4 Na 2 Si. O 3 + 2 НСl = H 2 Si. O 3↓ + 2 Na. Cl 3. Окиснення деяких простих речовин: I 2 + 5 Cl 2 + 6 H 2 O = 2 HIO 3 + 10 HCl 3 P + 5 HNO 3 + 2 H 2 O = 3 H 3 PO 4 + 5 NO 4. Безпосередня взаємодія активних неметалів з водою: Сl 2 + H 2 O = HCl + HCl. O 5. Взаємодія неметалів з воднем: Н 2 + Сl 2 = 2 HCl H 2 + I 2 = 2 HI 6. Гідроліз галогеноангідридів кислот: PІ3 + 3 H 2 O = 3 HI + H 3 PO 3 PCl 5 + 4 H 2 O = 5 HCl + H 3 PO 4 12
 Хімічні властивості кислот У водних розчинах кислоти дисоціюють: HCl = Н+ + Cl– Багатоосновні кислоти дисоціюють ступінчаcто, наприклад: H 2 CO 3 = Н+ + HCO 3− = Н+ + CO 32− За силою кислоти поділяють на три групи: сильні (HNO 3, HCl, H 2 SO 4, HCl. O 4, HBr тощо), середні (H 3 PO 4, H 2 SO 3, HSCN тощо) і слабкі (Н 3 ВО 3, Н 2 СО 3, HCN, HNO 2, H 2 S тощо). Під час нагрівання оксигеновмісні кислоти можуть відщеплювати воду, утворюючи оксиди або пірокислоти, наприклад: 4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2 2 H 3 PO 4 = H 2 O + H 4 P 2 O 7 Кислоти взаємодіють з основами (реакція нейтралізації): H 2 SO 4 + 2 KOH = K 2 SO 4 + 2 H 2 O 2 HNO 3 + Ca(OH)2 = Ca(NO 3)2 + 2 H 2 O 13
Хімічні властивості кислот У водних розчинах кислоти дисоціюють: HCl = Н+ + Cl– Багатоосновні кислоти дисоціюють ступінчаcто, наприклад: H 2 CO 3 = Н+ + HCO 3− = Н+ + CO 32− За силою кислоти поділяють на три групи: сильні (HNO 3, HCl, H 2 SO 4, HCl. O 4, HBr тощо), середні (H 3 PO 4, H 2 SO 3, HSCN тощо) і слабкі (Н 3 ВО 3, Н 2 СО 3, HCN, HNO 2, H 2 S тощо). Під час нагрівання оксигеновмісні кислоти можуть відщеплювати воду, утворюючи оксиди або пірокислоти, наприклад: 4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2 2 H 3 PO 4 = H 2 O + H 4 P 2 O 7 Кислоти взаємодіють з основами (реакція нейтралізації): H 2 SO 4 + 2 KOH = K 2 SO 4 + 2 H 2 O 2 HNO 3 + Ca(OH)2 = Ca(NO 3)2 + 2 H 2 O 13
 Хімічні властивості кислот Також кислоти взаємодіють з основними та амфотерними оксидами, утворюючи відповідні солі та воду: Ва. О + Н 2 SO 4 = Ba. SO 4 + H 2 O Sn. O + 2 HCl = Sn. Cl 2 + H 2 O Кислоти-неокисники взаємодіють з активними металами з виділенням водню: Fe + 2 HCl = Fe. Cl 2 + H 2↑ Zn + H 2 SO 4 (розв) = Zn. SO 4 + H 2↑ Унаслідок розчинення металів у кислотах-окисниках (HNO 3, концентрована H 2 SO 4) водень не виділяється, а утворюються продукти відновлення кислот: Hg + 4 HNO 3 (конц) = Hg(NO 3) 2 + 2 NO 2↑ + 2 H 2 O 3 Cu + 8 HNO 3 (розв) = 3 Сu(NO 3) 2 + 2 NO↑ + 4 H 2 O Zn + H 2 SO 4 (конц) = Zn. SO 4 + SO 2↑ + 2 H 2 О 14
Хімічні властивості кислот Також кислоти взаємодіють з основними та амфотерними оксидами, утворюючи відповідні солі та воду: Ва. О + Н 2 SO 4 = Ba. SO 4 + H 2 O Sn. O + 2 HCl = Sn. Cl 2 + H 2 O Кислоти-неокисники взаємодіють з активними металами з виділенням водню: Fe + 2 HCl = Fe. Cl 2 + H 2↑ Zn + H 2 SO 4 (розв) = Zn. SO 4 + H 2↑ Унаслідок розчинення металів у кислотах-окисниках (HNO 3, концентрована H 2 SO 4) водень не виділяється, а утворюються продукти відновлення кислот: Hg + 4 HNO 3 (конц) = Hg(NO 3) 2 + 2 NO 2↑ + 2 H 2 O 3 Cu + 8 HNO 3 (розв) = 3 Сu(NO 3) 2 + 2 NO↑ + 4 H 2 O Zn + H 2 SO 4 (конц) = Zn. SO 4 + SO 2↑ + 2 H 2 О 14
 Основи Основами називають гідрати основних оксидів, які складаються з катіона металу та гідроксильної групи. Загальна формула - Me(OH)x. Може замість металу бути група атомів: NH 4+, Ti. O 2+, [Cu(NH 3)4]2+. Кількість гідроксильних груп, які здатні до заміщення на кислотні залишки, визначає кислотність основи: Na. OH – однокислотна, Fe(OH)2 – двокислотна основа. Більшість основ малорозчинна у воді. Основи, розчинні у воді, називають лугами. Номенклатура основ. Назва основи складається з назви металу у називному відмінку і слова гідроксид (якщо метал має змінну валентність, то її зазначають у дужках). Наприклад, KOH – калій гідроксид, Fe(OH)2 – ферум (ІІ) гідроксид, Fe(OH)3 – ферум (ІІІ) гідроксид. 15
Основи Основами називають гідрати основних оксидів, які складаються з катіона металу та гідроксильної групи. Загальна формула - Me(OH)x. Може замість металу бути група атомів: NH 4+, Ti. O 2+, [Cu(NH 3)4]2+. Кількість гідроксильних груп, які здатні до заміщення на кислотні залишки, визначає кислотність основи: Na. OH – однокислотна, Fe(OH)2 – двокислотна основа. Більшість основ малорозчинна у воді. Основи, розчинні у воді, називають лугами. Номенклатура основ. Назва основи складається з назви металу у називному відмінку і слова гідроксид (якщо метал має змінну валентність, то її зазначають у дужках). Наприклад, KOH – калій гідроксид, Fe(OH)2 – ферум (ІІ) гідроксид, Fe(OH)3 – ферум (ІІІ) гідроксид. 15
 Cпособи одержання основ 1. Взаємодія активних металів з водою: 2 K + 2 Н 2 О = 2 KОН + Н 2 Ca + 2 H 2 O = Ca(OH)2 + H 2 2. Безпосередня взаємодія основних оксидів з водою (тільки оксиди лужних і лужноземельних металів): Na 2 O + H 2 O = 2 Na. OH Ba. O + H 2 O = Ba(OH)2 3. Взаємодія солей з лугами: Zn. Cl 2 + 2 KOH = Zn(OH)2↓ + 2 KCl Cu(NO 3)2 + 2 Na. OH = Cu(OH)2↓ + 2 Na. NO 3 Отримати цим способом розчинні основи можна лише тоді, коли утворюється нерозчинна сіль: Na 2 SO 4 + Ba(OH)2 = Ba. SO 4↓ + 2 Na. OH 4. Електроліз розчинів солей: 2 Na. Cl + 2 H 2 O = 2 Na. OH + H 2↑ + Cl 2↑ 16
Cпособи одержання основ 1. Взаємодія активних металів з водою: 2 K + 2 Н 2 О = 2 KОН + Н 2 Ca + 2 H 2 O = Ca(OH)2 + H 2 2. Безпосередня взаємодія основних оксидів з водою (тільки оксиди лужних і лужноземельних металів): Na 2 O + H 2 O = 2 Na. OH Ba. O + H 2 O = Ba(OH)2 3. Взаємодія солей з лугами: Zn. Cl 2 + 2 KOH = Zn(OH)2↓ + 2 KCl Cu(NO 3)2 + 2 Na. OH = Cu(OH)2↓ + 2 Na. NO 3 Отримати цим способом розчинні основи можна лише тоді, коли утворюється нерозчинна сіль: Na 2 SO 4 + Ba(OH)2 = Ba. SO 4↓ + 2 Na. OH 4. Електроліз розчинів солей: 2 Na. Cl + 2 H 2 O = 2 Na. OH + H 2↑ + Cl 2↑ 16
 Хімічні властивості основ 1. Розчинні основи у водних розчинах дисоціюють: Na. OH ↔ Na+ + ОН– 2. Під час нагрівання більшість основ розкладається: 2 Fe(OH)3 = Fe 2 O 3 + 3 H 2 O Cu(OH)2 = Cu. O + H 2 O 3. Основи взаємодіють з кислотами та кислотними оксидами: Na. OH + HNO 3 = Na. NO 3 + H 2 O 3 Са(ОН)2 +2 Н 3 РО 4 = Са 3(РО 4)2↓ + 6 Н 2 О 2 KOH + SO 3 = K 2 SO 4 + H 2 O 4. Луги в разі сплавляння або розчинення взаємодіють з амфотерними оксидами: Cr 2 O 3 + 2 Na. OH = Na. Cr. O 2 + H 2 O (сплавляння) Cr 2 O 3 + 6 Na. OH + 3 H 2 O = 2 Na 3[Cr(OH)6] (у розчині) 5. Луги взаємодіють з середніми і кислими солями: Cu. Cl 2 + 2 KOH =Cu(OH)2↓ + 2 KCl 17
Хімічні властивості основ 1. Розчинні основи у водних розчинах дисоціюють: Na. OH ↔ Na+ + ОН– 2. Під час нагрівання більшість основ розкладається: 2 Fe(OH)3 = Fe 2 O 3 + 3 H 2 O Cu(OH)2 = Cu. O + H 2 O 3. Основи взаємодіють з кислотами та кислотними оксидами: Na. OH + HNO 3 = Na. NO 3 + H 2 O 3 Са(ОН)2 +2 Н 3 РО 4 = Са 3(РО 4)2↓ + 6 Н 2 О 2 KOH + SO 3 = K 2 SO 4 + H 2 O 4. Луги в разі сплавляння або розчинення взаємодіють з амфотерними оксидами: Cr 2 O 3 + 2 Na. OH = Na. Cr. O 2 + H 2 O (сплавляння) Cr 2 O 3 + 6 Na. OH + 3 H 2 O = 2 Na 3[Cr(OH)6] (у розчині) 5. Луги взаємодіють з середніми і кислими солями: Cu. Cl 2 + 2 KOH =Cu(OH)2↓ + 2 KCl 17
 Амфотерні гідроксиди Амфотерним оксидам відповідають амфотерні гідроксиди: Be(OH)2, Zn(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)4, Cr(OH)3 та ін. Амфотерними називають такі гідроксиди, які під час дисоціації одночасно утворюють іони Гідрогену Н+ та гідроксид-іони ОН– Під час взаємодії з кислотами і кислотними оксидами амфотерні гідроксиди виявляють властивості основ: Zn(OH)2 + H 2 SO 4 = Zn. SO 4 + 2 H 2 O 2 Al(OH)3 + 3 SO 3 = Al 2(SO 4)3 + 3 H 2 O а під час взаємодії з основами й основними оксидами – властивості кислот: Zn(OH)2 + 2 Na. OH = Na 2 Zn. O 2 + 2 H 2 O Al(OH)3 + 3 Na. OH = Na 3[Al(OH)6] (у розчині) Амфотерні гідроксиди отримують взаємодією відповідних солей з лугами або кислотами, узятими в еквівалентних кількостях: Al 2(SO 4)3 + 6 Na. OH = 2 Al(OH)3↓ + 3 Na 2 SO 4 18
Амфотерні гідроксиди Амфотерним оксидам відповідають амфотерні гідроксиди: Be(OH)2, Zn(OH)2, Al(OH)3, Pb(OH)2, Sn(OH)4, Cr(OH)3 та ін. Амфотерними називають такі гідроксиди, які під час дисоціації одночасно утворюють іони Гідрогену Н+ та гідроксид-іони ОН– Під час взаємодії з кислотами і кислотними оксидами амфотерні гідроксиди виявляють властивості основ: Zn(OH)2 + H 2 SO 4 = Zn. SO 4 + 2 H 2 O 2 Al(OH)3 + 3 SO 3 = Al 2(SO 4)3 + 3 H 2 O а під час взаємодії з основами й основними оксидами – властивості кислот: Zn(OH)2 + 2 Na. OH = Na 2 Zn. O 2 + 2 H 2 O Al(OH)3 + 3 Na. OH = Na 3[Al(OH)6] (у розчині) Амфотерні гідроксиди отримують взаємодією відповідних солей з лугами або кислотами, узятими в еквівалентних кількостях: Al 2(SO 4)3 + 6 Na. OH = 2 Al(OH)3↓ + 3 Na 2 SO 4 18
 Солі – це продукти повного або часткового заміщення атомів Гідрогену кислоти на метал чи гідроксогруп основи на кислотний залишок. За хімічними властивостями і складом розрізняють середні (або нормальні), кислі, основні, змішані, подвійні солі. В окрему групу можна виділити комплексні солі. Середні (нормальні) солі – це продукти повного заміщення атомів Гідрогену на метал у кислоті або гідроксогруп в основі на кислотний залишок Кислі солі – продукти неповного заміщення атомів Гідрогену в кислоті (KH 2 PO 4, Na. HCO 3) Основні солі – продукти неповного заміщення гідроксогруп (Bi(OH)2 Cl, Mg(OH)Cl) Подвійні солі – це продукти заміщення атомів Гідрогену в молекулах кислот іонами двох металів (KAl(SO 4)2, Na. KSO 4). Змішані солі – це середні солі, у молекулах яких атом металу сполучений з кількома різними кислотними залишками (наприклад – хлорне вапно – кальцієва сіль хлоридної і гіпохлоритної кислот Cl–Ca –OCl або Ca. OCl 2). 19
Солі – це продукти повного або часткового заміщення атомів Гідрогену кислоти на метал чи гідроксогруп основи на кислотний залишок. За хімічними властивостями і складом розрізняють середні (або нормальні), кислі, основні, змішані, подвійні солі. В окрему групу можна виділити комплексні солі. Середні (нормальні) солі – це продукти повного заміщення атомів Гідрогену на метал у кислоті або гідроксогруп в основі на кислотний залишок Кислі солі – продукти неповного заміщення атомів Гідрогену в кислоті (KH 2 PO 4, Na. HCO 3) Основні солі – продукти неповного заміщення гідроксогруп (Bi(OH)2 Cl, Mg(OH)Cl) Подвійні солі – це продукти заміщення атомів Гідрогену в молекулах кислот іонами двох металів (KAl(SO 4)2, Na. KSO 4). Змішані солі – це середні солі, у молекулах яких атом металу сполучений з кількома різними кислотними залишками (наприклад – хлорне вапно – кальцієва сіль хлоридної і гіпохлоритної кислот Cl–Ca –OCl або Ca. OCl 2). 19
 Номенклатура солей Назви солей утворюють з назв катіона й аніона у називному відмінку (якщо потрібно, у дужках зазначають валентність металу). Назви кислих солей будують шляхом додавання до назви аніона префікса гідроген-, а основних – префікса гідроксо- або оксо- (в усіх випадках з відповідним числівником). Наприклад: Na. Cl – натрій хлорид, Ca. SO 4 – кальцій сульфат, Cr. Cl 3 – хром (III) хлорид; Na. HCO 3 – натрій гідрогенкарбонат, Na 2 HPO 4 – натрій гідрогенфосфат, Na. H 2 PO 4 – натрій дигідрогенфосфат, Zn. OHCl – цинк гідроксохлорид, Bi(OH)(NO 3)2 – бісмут (ІІІ) гідроксонітрат. У назвах подвійних солей катіони записують у називному відмінку в порядку, зворотному запису у формулі, наприклад: KAl(SO 4)2 – алюміній калій сульфат. У назвах змішаних солей аналогічно записують назви аніонів: Al(NO 3)(SO 4) – алюміній сульфат нітрат. 20
Номенклатура солей Назви солей утворюють з назв катіона й аніона у називному відмінку (якщо потрібно, у дужках зазначають валентність металу). Назви кислих солей будують шляхом додавання до назви аніона префікса гідроген-, а основних – префікса гідроксо- або оксо- (в усіх випадках з відповідним числівником). Наприклад: Na. Cl – натрій хлорид, Ca. SO 4 – кальцій сульфат, Cr. Cl 3 – хром (III) хлорид; Na. HCO 3 – натрій гідрогенкарбонат, Na 2 HPO 4 – натрій гідрогенфосфат, Na. H 2 PO 4 – натрій дигідрогенфосфат, Zn. OHCl – цинк гідроксохлорид, Bi(OH)(NO 3)2 – бісмут (ІІІ) гідроксонітрат. У назвах подвійних солей катіони записують у називному відмінку в порядку, зворотному запису у формулі, наприклад: KAl(SO 4)2 – алюміній калій сульфат. У назвах змішаних солей аналогічно записують назви аніонів: Al(NO 3)(SO 4) – алюміній сульфат нітрат. 20
 Способи одержання солей 1. Взаємодією кислот з основами або амфотерними гідроксидами: Al(OH)3 + H 3 PO 4 = Al. PO 4 + 3 H 2 O 2. Взаємодією кислот з основними або амфотерними оксидами: Са. О + 2 НСl = Ca. Cl 2 + H 2 O, Zn. O + 2 HNO 3 = Zn(NO 3)2 + H 2 O 3. Взаємодією кислот з металами: Zn + H 2 SO 4 (розв) = Zn. SO 4 + Н 2↑ 4. Взаємодією кислот з солями: 2 Na. Cl + H 2 SO 4 = Na 2 SO 4 + 2 HCl↑ 5. Взаємодією кислотних оксидів з основними або амфотерними оксидами: 3 Са. О + Р 2 О 5 = Са 3(РО 4)2, Zn. O + SO 3 = Zn. SO 4 6. Взаємодією кислотних оксидів з основами або амфотерними гідроксидами: N 2 O 5 + Zn(OH)2 = Zn(NO 3)2 + H 2 О, Cl 2 O 7 + 2 КОН = 2 KCl. O 4 + H 2 O 7. Взаємодією кислотних оксидів із солями Са. СО 3 + Si. O 2 = Ca. Si. O 3 + CO 2↑ (сплавляння) 8. Взаємодією основ із солями: Сu. Cl 2 + 2 KOH = Cu(OH)2↓ + 2 KCl 21
Способи одержання солей 1. Взаємодією кислот з основами або амфотерними гідроксидами: Al(OH)3 + H 3 PO 4 = Al. PO 4 + 3 H 2 O 2. Взаємодією кислот з основними або амфотерними оксидами: Са. О + 2 НСl = Ca. Cl 2 + H 2 O, Zn. O + 2 HNO 3 = Zn(NO 3)2 + H 2 O 3. Взаємодією кислот з металами: Zn + H 2 SO 4 (розв) = Zn. SO 4 + Н 2↑ 4. Взаємодією кислот з солями: 2 Na. Cl + H 2 SO 4 = Na 2 SO 4 + 2 HCl↑ 5. Взаємодією кислотних оксидів з основними або амфотерними оксидами: 3 Са. О + Р 2 О 5 = Са 3(РО 4)2, Zn. O + SO 3 = Zn. SO 4 6. Взаємодією кислотних оксидів з основами або амфотерними гідроксидами: N 2 O 5 + Zn(OH)2 = Zn(NO 3)2 + H 2 О, Cl 2 O 7 + 2 КОН = 2 KCl. O 4 + H 2 O 7. Взаємодією кислотних оксидів із солями Са. СО 3 + Si. O 2 = Ca. Si. O 3 + CO 2↑ (сплавляння) 8. Взаємодією основ із солями: Сu. Cl 2 + 2 KOH = Cu(OH)2↓ + 2 KCl 21
 Способи одержання солей 9. Взаємодією солей з іншими солями: Ba. Cl 2 + Na 2 SO 4 = Ba. SO 4↓ + 2 Na. Cl 10. Взаємодією металів з неметалами: Zn + S = Zn. S 11. Взаємодією солей з металами: Fe + Cu. SO 4 = Fe. SO 4 + Cu 12. Взаємодією активних неметалів (галогени, сірка) з лугами: Cl 2 + 2 KOH = KCl + KCl. O + H 2 O 13. Взаємодією деяких металів з лугами у розплавах і розчинах: Zn + 2 Na. OH = Na 2 Zn. O 2 + H 2↑ (сплавляння) 14. Взаємодія неметалів з солями: S + Na 2 SO 3 = Na 2 S 2 O 3 15. Термічним розкладанням солей: 2 KCl. O 3 = 2 KCl + 3 O 2↑ 16. Взаємодією сильних основ з амфотерними гідроксидами: Ba(OH)2 + Pb(OH)4 = Ba[Pb(OH)6] 22
Способи одержання солей 9. Взаємодією солей з іншими солями: Ba. Cl 2 + Na 2 SO 4 = Ba. SO 4↓ + 2 Na. Cl 10. Взаємодією металів з неметалами: Zn + S = Zn. S 11. Взаємодією солей з металами: Fe + Cu. SO 4 = Fe. SO 4 + Cu 12. Взаємодією активних неметалів (галогени, сірка) з лугами: Cl 2 + 2 KOH = KCl + KCl. O + H 2 O 13. Взаємодією деяких металів з лугами у розплавах і розчинах: Zn + 2 Na. OH = Na 2 Zn. O 2 + H 2↑ (сплавляння) 14. Взаємодія неметалів з солями: S + Na 2 SO 3 = Na 2 S 2 O 3 15. Термічним розкладанням солей: 2 KCl. O 3 = 2 KCl + 3 O 2↑ 16. Взаємодією сильних основ з амфотерними гідроксидами: Ba(OH)2 + Pb(OH)4 = Ba[Pb(OH)6] 22
 Хімічні властивості солей Розчинні у воді солі дисоціюють: Na. NO 3 ↔ Na+ + NO 3− Під час нагрівання більшість солей розкладається: Са. СО 3 = Ca. O + CO 2↑ Солі можуть вступати в реакцію з: − металами (згідно з електрохімічним рядом напруг): Zn + Cu. Cl 2 = Zn. Cl 2 + Cu − кислотними оксидами: Cr 2(SO 3)3 + 3 B 2 O 3 = 2 Cr(BO 2)3 + 3 SO 2 (сплавляння) − амфотерними оксидами: 4 KNO 3 + 2 Al 2 O 3 = 4 KAl. O 2 + 4 NO 2 ↑ + O 2↑ (сплавляння) − кислотами (склад продуктів залежить від молярних співвідношень речовин): Na 2 CO 3 + 2 HCl = 2 Na. Cl + CO 2↑ + H 2 O Na 2 CO 3 + HCl = Na. Cl + Na. HCO 3 − лугами або NH 4 OH (склад продуктів залежить від молярних співвідношень речовин): Mg. Cl 2 + KOH = Mg. OHCl + KCl, − іншими солями: 23 Ag. NO 3 + KI = Ag. I↓ + KNO 3
Хімічні властивості солей Розчинні у воді солі дисоціюють: Na. NO 3 ↔ Na+ + NO 3− Під час нагрівання більшість солей розкладається: Са. СО 3 = Ca. O + CO 2↑ Солі можуть вступати в реакцію з: − металами (згідно з електрохімічним рядом напруг): Zn + Cu. Cl 2 = Zn. Cl 2 + Cu − кислотними оксидами: Cr 2(SO 3)3 + 3 B 2 O 3 = 2 Cr(BO 2)3 + 3 SO 2 (сплавляння) − амфотерними оксидами: 4 KNO 3 + 2 Al 2 O 3 = 4 KAl. O 2 + 4 NO 2 ↑ + O 2↑ (сплавляння) − кислотами (склад продуктів залежить від молярних співвідношень речовин): Na 2 CO 3 + 2 HCl = 2 Na. Cl + CO 2↑ + H 2 O Na 2 CO 3 + HCl = Na. Cl + Na. HCO 3 − лугами або NH 4 OH (склад продуктів залежить від молярних співвідношень речовин): Mg. Cl 2 + KOH = Mg. OHCl + KCl, − іншими солями: 23 Ag. NO 3 + KI = Ag. I↓ + KNO 3
 Комплексні сполуки Комплексними (координаційними) сполуками називають хімічні сполуки, кристали яких складаються з комплексних груп, утворених унаслідок взаємодії йонів або молекул, здатних самостійно існувати в розчині. Реакції, унаслідок яких утворюються комплексні сполуки, називають реакціями комплексоутворення, або комплексоутворенням. Cu. SO 4 + 4 NH 3 = [Cu(NH 3)4]SO 4 HgІ2 + 2 KІ = K 2[HgІ4] Серед зовнішніх ознак, що супроводжують комплексоутворення в реакційній суміші, треба назвати такі: зменшення кількості вільних іонів, зменшення ступеня гідролізу, зміна забарвлення, зміна природи електроліту, зміна розчинності компонентів системи. 24
Комплексні сполуки Комплексними (координаційними) сполуками називають хімічні сполуки, кристали яких складаються з комплексних груп, утворених унаслідок взаємодії йонів або молекул, здатних самостійно існувати в розчині. Реакції, унаслідок яких утворюються комплексні сполуки, називають реакціями комплексоутворення, або комплексоутворенням. Cu. SO 4 + 4 NH 3 = [Cu(NH 3)4]SO 4 HgІ2 + 2 KІ = K 2[HgІ4] Серед зовнішніх ознак, що супроводжують комплексоутворення в реакційній суміші, треба назвати такі: зменшення кількості вільних іонів, зменшення ступеня гідролізу, зміна забарвлення, зміна природи електроліту, зміна розчинності компонентів системи. 24
 Теорія Вернера Наукова теорія, яка пояснює будову та властивості КС була сформована у 1893 р. швейцарським вченим - А. Вернером. Згідно цієї теорії: • Центральне місце в молекулі КС займає іон(як правило позитивно заряджений), що називаєтся комплексоутворювачем бо центральним іоном. • Безпосредньо біля цього атома скоординовано деяке число протилежо заряджених іонів або нейтральних молекул, які називаются лігандами(аддентами) і утворюють внутрішню координаційну сферу. Внутрішня сфера позначаєтся квадратними дужками. Число лігандів, що оточують центральний іон називають координаційним числом(КЧ). Інакше кажучи, координаційне число – це кількість хімічних зв’язків, якими йон-комплексоутворювач сполучений з лігандами. • Решта іонів, що не містяться у внутрішній сфері і містяться далі від атома комплексоутворювача уторюють зовнішню сферу. 25
Теорія Вернера Наукова теорія, яка пояснює будову та властивості КС була сформована у 1893 р. швейцарським вченим - А. Вернером. Згідно цієї теорії: • Центральне місце в молекулі КС займає іон(як правило позитивно заряджений), що називаєтся комплексоутворювачем бо центральним іоном. • Безпосредньо біля цього атома скоординовано деяке число протилежо заряджених іонів або нейтральних молекул, які називаются лігандами(аддентами) і утворюють внутрішню координаційну сферу. Внутрішня сфера позначаєтся квадратними дужками. Число лігандів, що оточують центральний іон називають координаційним числом(КЧ). Інакше кажучи, координаційне число – це кількість хімічних зв’язків, якими йон-комплексоутворювач сполучений з лігандами. • Решта іонів, що не містяться у внутрішній сфері і містяться далі від атома комплексоутворювача уторюють зовнішню сферу. 25
 • Комплексоутворювачем може бути будь-який іон, однак найчастіше це перехідні d-елементи (насамперед, метали восьмої групи, підгруп Купруму і Цинку), а найрідше – лужні й лужноземельні метали. Комплексоутворювальна здатність елементів однієї й тієї ж підгрупи зростає зі зменшенням активності металу та збільшенням його ступеня окиснення. • Лігандами можуть бути прості йони (Cl−, Br−, I−, OH−), складні (CO 32−, S 2 O 32− , NO 2− , C 2 O 24− ), а також нейтральні молекули (Н 2 О, NH 3, CO, NO, CH 3 NH 2). • Важливою характеристикою лігандів є їхня координаційна ємність або дентатність, яку визначають кількістю зв’язків, що утворює ліганд із центральним атомом, або інакше – кількістю місць, які ліганди займають у внутрішній координаційній сфері комплексної сполуки. 26
• Комплексоутворювачем може бути будь-який іон, однак найчастіше це перехідні d-елементи (насамперед, метали восьмої групи, підгруп Купруму і Цинку), а найрідше – лужні й лужноземельні метали. Комплексоутворювальна здатність елементів однієї й тієї ж підгрупи зростає зі зменшенням активності металу та збільшенням його ступеня окиснення. • Лігандами можуть бути прості йони (Cl−, Br−, I−, OH−), складні (CO 32−, S 2 O 32− , NO 2− , C 2 O 24− ), а також нейтральні молекули (Н 2 О, NH 3, CO, NO, CH 3 NH 2). • Важливою характеристикою лігандів є їхня координаційна ємність або дентатність, яку визначають кількістю зв’язків, що утворює ліганд із центральним атомом, або інакше – кількістю місць, які ліганди займають у внутрішній координаційній сфері комплексної сполуки. 26
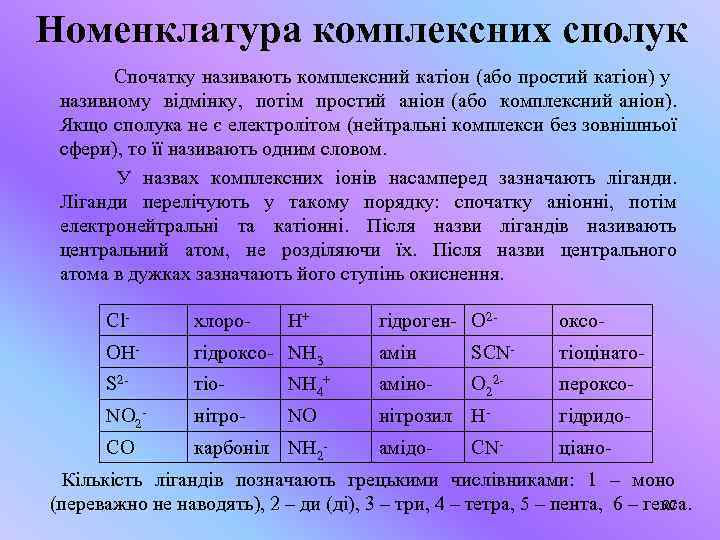 Номенклатура комплексних сполук Спочатку називають комплексний катіон (або простий катіон) у називному відмінку, потім простий аніон (або комплексний аніон). Якщо сполука не є електролітом (нейтральні комплекси без зовнішньої сфери), то її називають одним словом. У назвах комплексних іонів насамперед зазначають ліганди. Ліганди перелічують у такому порядку: спочатку аніонні, потім електронейтральні та катіонні. Після назви лігандів називають центральний атом, не розділяючи їх. Після назви центрального атома в дужках зазначають його ступінь окиснення. Cl- хлоро- OH- H+ гідроген- O 2 - оксо- гідроксо- NH 3 амін SCN- тіоцінато- S 2 - тіо- NH 4+ аміно- O 22 - пероксо- NO 2 - нітро- NO нітрозил H- гідридо- CO карбоніл NH 2 - амідо- ціано- CN- Кількість лігандів позначають грецькими числівниками: 1 – моно 27 (переважно не наводять), 2 – ди (ді), 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Номенклатура комплексних сполук Спочатку називають комплексний катіон (або простий катіон) у називному відмінку, потім простий аніон (або комплексний аніон). Якщо сполука не є електролітом (нейтральні комплекси без зовнішньої сфери), то її називають одним словом. У назвах комплексних іонів насамперед зазначають ліганди. Ліганди перелічують у такому порядку: спочатку аніонні, потім електронейтральні та катіонні. Після назви лігандів називають центральний атом, не розділяючи їх. Після назви центрального атома в дужках зазначають його ступінь окиснення. Cl- хлоро- OH- H+ гідроген- O 2 - оксо- гідроксо- NH 3 амін SCN- тіоцінато- S 2 - тіо- NH 4+ аміно- O 22 - пероксо- NO 2 - нітро- NO нітрозил H- гідридо- CO карбоніл NH 2 - амідо- ціано- CN- Кількість лігандів позначають грецькими числівниками: 1 – моно 27 (переважно не наводять), 2 – ди (ді), 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
![K 3[Fe(CN)6] К – калій + 6 – гекса+ СN – ціано+ Fe – K 3[Fe(CN)6] К – калій + 6 – гекса+ СN – ціано+ Fe –](https://present5.com/presentation/50579031_84749315/image-28.jpg) K 3[Fe(CN)6] К – калій + 6 – гекса+ СN – ціано+ Fe – ферат = калій гексаціаноферат (ІІІ) • K 2[Pt. Cl 6] - калій гексахлороплатинат • K 2[Co(NH 3)2(NO 2)4] - калій тетранітродиамінокобальтат (ІІІ) 28
K 3[Fe(CN)6] К – калій + 6 – гекса+ СN – ціано+ Fe – ферат = калій гексаціаноферат (ІІІ) • K 2[Pt. Cl 6] - калій гексахлороплатинат • K 2[Co(NH 3)2(NO 2)4] - калій тетранітродиамінокобальтат (ІІІ) 28
![[Ag(NH 3)2]Cl. O 4 2 – ді+ NH 3 – амін+ Ag – аргентум [Ag(NH 3)2]Cl. O 4 2 – ді+ NH 3 – амін+ Ag – аргентум](https://present5.com/presentation/50579031_84749315/image-29.jpg) [Ag(NH 3)2]Cl. O 4 2 – ді+ NH 3 – амін+ Ag – аргентум + Cl. O 4 – перхлорат = діамінаргентум (І) перхлорат • [Al(H 2 O)5 OH]SO 4 – гідроксопентаакваалюміній (ІІІ) сульфат; • [Cr(H 2 O)3 F 3] - трифторотриаквахром 29
[Ag(NH 3)2]Cl. O 4 2 – ді+ NH 3 – амін+ Ag – аргентум + Cl. O 4 – перхлорат = діамінаргентум (І) перхлорат • [Al(H 2 O)5 OH]SO 4 – гідроксопентаакваалюміній (ІІІ) сульфат; • [Cr(H 2 O)3 F 3] - трифторотриаквахром 29
![Класифікація комплексних сполук За характером заряду внутрішньої сфери: 1. Катіонні [Cu(NH 3)2]+Cl− 2. Аніонні Класифікація комплексних сполук За характером заряду внутрішньої сфери: 1. Катіонні [Cu(NH 3)2]+Cl− 2. Аніонні](https://present5.com/presentation/50579031_84749315/image-30.jpg) Класифікація комплексних сполук За характером заряду внутрішньої сфери: 1. Катіонні [Cu(NH 3)2]+Cl− 2. Аніонні K 2+[Pt. Cl 6]2− 3. Нейтральні [Ni 0(CO)4] За природою лігандів: 1. Аквакомплекси [Al(H 2 O)6 Cl 3] – ліганд молекула води 2. Амінокомплекси [Ag(NH 3)2]Cl – ліганд молекула NH 3 3. Ацидокомплекси K 4[Fe(CN)6] 4. Гідрокомплекси K 3[Al(OH)6] За приналежністю до певного класу: 1. Комплексні кислоти (H[Au. Cl 4]) 2. Комплексні основи ([Ag(NH 3)2]OH) 3. Комплексні солі (K 3[Fe(CN)6]) 30
Класифікація комплексних сполук За характером заряду внутрішньої сфери: 1. Катіонні [Cu(NH 3)2]+Cl− 2. Аніонні K 2+[Pt. Cl 6]2− 3. Нейтральні [Ni 0(CO)4] За природою лігандів: 1. Аквакомплекси [Al(H 2 O)6 Cl 3] – ліганд молекула води 2. Амінокомплекси [Ag(NH 3)2]Cl – ліганд молекула NH 3 3. Ацидокомплекси K 4[Fe(CN)6] 4. Гідрокомплекси K 3[Al(OH)6] За приналежністю до певного класу: 1. Комплексні кислоти (H[Au. Cl 4]) 2. Комплексні основи ([Ag(NH 3)2]OH) 3. Комплексні солі (K 3[Fe(CN)6]) 30
 Класифікація комплексних сполук За природою центрального атома і характером його зв’язку з лігандами 1. Моноядерні – з позитивним ступенем окиснення ЦА аква-, аміно-, ацидо 2. Поліядерні – два або кілька ЦА з позитивним ступенем окиснення [(H 3 N)5 Co-O-O-Co(NH 3)5]Br 4 H 2[O 3 Cr-O-Cr. O 3] 3. Сполуки з негативним ступенем окиснення центрального атома 4. Хелати – містять бі- або полідентатний ліганд, який «захоплює» центральний атом з утворенням цикла 5. Кластери – містять угрупування з двох чи кількох атомів металів, які безпосередньо зв’язані між собою і оточеі лігандами Ru 3(CO)12, [Mo 6 Cl 8]4+ 6. Клатрати (сполуки включення) – включення молекул або атомів однієї речовини у пустоти кристала 4 Xe*23 H 2 O, Na 2 CO 3*10 H 2 O 31
Класифікація комплексних сполук За природою центрального атома і характером його зв’язку з лігандами 1. Моноядерні – з позитивним ступенем окиснення ЦА аква-, аміно-, ацидо 2. Поліядерні – два або кілька ЦА з позитивним ступенем окиснення [(H 3 N)5 Co-O-O-Co(NH 3)5]Br 4 H 2[O 3 Cr-O-Cr. O 3] 3. Сполуки з негативним ступенем окиснення центрального атома 4. Хелати – містять бі- або полідентатний ліганд, який «захоплює» центральний атом з утворенням цикла 5. Кластери – містять угрупування з двох чи кількох атомів металів, які безпосередньо зв’язані між собою і оточеі лігандами Ru 3(CO)12, [Mo 6 Cl 8]4+ 6. Клатрати (сполуки включення) – включення молекул або атомів однієї речовини у пустоти кристала 4 Xe*23 H 2 O, Na 2 CO 3*10 H 2 O 31
 Стійкість комплексних сполук Між комплексним іоном і зовнішньою сферою є йонний тип зв’язку. Дисоціацію за цим зв ’язком називають первинною, і вона відбувається практично повністю: [Ag(NH 3)2]Cl → [Ag(NH 3)2]+ + Сl− Видалити молекули аміаку з внутрішньої сфери комплексної сполуки значно важче, оскільки дисоціація комплексного йона незначна і відбувається за типом слабких електролітів. Оборотний розпад внутрішньої сфери комплексу є ступінчастим, і його називають вторинною дисоціацією: [Ag(NH 3)2]+ ↔Ag+ + 2 NH 3 Кількісно здатність комплексних іонів дисоціювати у водних розчинах можна оцінити за константою рівноваги, яку називають константою нестійкості 32
Стійкість комплексних сполук Між комплексним іоном і зовнішньою сферою є йонний тип зв’язку. Дисоціацію за цим зв ’язком називають первинною, і вона відбувається практично повністю: [Ag(NH 3)2]Cl → [Ag(NH 3)2]+ + Сl− Видалити молекули аміаку з внутрішньої сфери комплексної сполуки значно важче, оскільки дисоціація комплексного йона незначна і відбувається за типом слабких електролітів. Оборотний розпад внутрішньої сфери комплексу є ступінчастим, і його називають вторинною дисоціацією: [Ag(NH 3)2]+ ↔Ag+ + 2 NH 3 Кількісно здатність комплексних іонів дисоціювати у водних розчинах можна оцінити за константою рівноваги, яку називають константою нестійкості 32
 Ізомерія комплексних сполук Ізомерія – це явище, коли хімічні сполуки, які мають однаковий якісний і кількісний склад, відрізняються за властивостями, що зумовлене різною будовою цих сполук. Сольватна, зокрема, гідратна ізомерія притаманна речовинам, що мають однаковий склад, але відрізняються за розміщенням молекул розчинника (води), які можуть міститися або у внутрішній, або у зовнішній сфері комплексу. Найліпше цей вид ізомерії простежують на прикладі комплексних гідратів хрому (ІІІ): [Сr(H 2 O)6]Cl 3 [Сr(H 2 O)5 Cl]Cl 2 ⋅ H 2 O [Сr(H 2 O)4 Cl 2]Cl ⋅ 2 H 2 O синьо-фіолетовий темно-зелений світло-зелений Іонізаційна ізомерія (метамерія) пов’язана з різним розподілом іонів у зовнішній і внутрішній сфері комплексної сполуки. Наприклад, метамери [Co(NH 3)5 Br]SO 4 i [Co(NH 3)5 SO 4]Br 33
Ізомерія комплексних сполук Ізомерія – це явище, коли хімічні сполуки, які мають однаковий якісний і кількісний склад, відрізняються за властивостями, що зумовлене різною будовою цих сполук. Сольватна, зокрема, гідратна ізомерія притаманна речовинам, що мають однаковий склад, але відрізняються за розміщенням молекул розчинника (води), які можуть міститися або у внутрішній, або у зовнішній сфері комплексу. Найліпше цей вид ізомерії простежують на прикладі комплексних гідратів хрому (ІІІ): [Сr(H 2 O)6]Cl 3 [Сr(H 2 O)5 Cl]Cl 2 ⋅ H 2 O [Сr(H 2 O)4 Cl 2]Cl ⋅ 2 H 2 O синьо-фіолетовий темно-зелений світло-зелений Іонізаційна ізомерія (метамерія) пов’язана з різним розподілом іонів у зовнішній і внутрішній сфері комплексної сполуки. Наприклад, метамери [Co(NH 3)5 Br]SO 4 i [Co(NH 3)5 SO 4]Br 33
 Ізомерія комплексних сполук Координаційна ізомерія притаманна тим комплексним сполукам, у яких катіон та аніон є комплексними, тобто є два атоми комплексоутворювача. В таких сполуках можливий перехід лігандів від одного комплексоутворювача до іншого, наприклад [Cr(NH 3)6][Co(CN)6] i [Co(NH 3)6][Cr(CN)6]. Геометрична, або просторова, ізомерія пов’язана з різним розташуванням лігандів навколо центрального атома. Просторова будова комплексних сполук залежить від координаційного числа центрального атома. Найчастіше трапляються парні КЧ – 2, 4, 6. 34
Ізомерія комплексних сполук Координаційна ізомерія притаманна тим комплексним сполукам, у яких катіон та аніон є комплексними, тобто є два атоми комплексоутворювача. В таких сполуках можливий перехід лігандів від одного комплексоутворювача до іншого, наприклад [Cr(NH 3)6][Co(CN)6] i [Co(NH 3)6][Cr(CN)6]. Геометрична, або просторова, ізомерія пов’язана з різним розташуванням лігандів навколо центрального атома. Просторова будова комплексних сполук залежить від координаційного числа центрального атома. Найчастіше трапляються парні КЧ – 2, 4, 6. 34
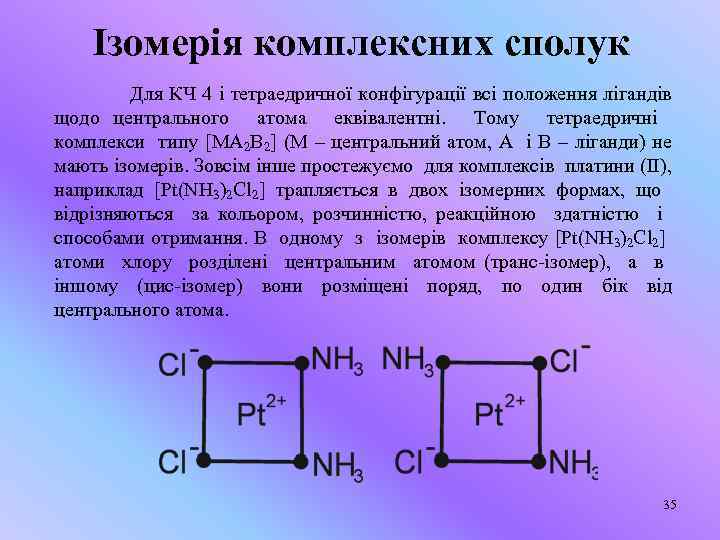 Ізомерія комплексних сполук Для КЧ 4 і тетраедричної конфігурації всі положення лігандів щодо центрального атома еквівалентні. Тому тетраедричні комплекси типу [MA 2 B 2] (М – центральний атом, А і В – ліганди) не мають ізомерів. Зовсім інше простежуємо для комплексів платини (ІІ), наприклад [Pt(NH 3)2 Cl 2] трапляється в двох ізомерних формах, що відрізняються за кольором, розчинністю, реакційною здатністю і способами отримання. В одному з ізомерів комплексу [Pt(NH 3)2 Cl 2] атоми хлору розділені центральним атомом (транс-ізомер), а в іншому (цис-ізомер) вони розміщені поряд, по один бік від центрального атома. 35
Ізомерія комплексних сполук Для КЧ 4 і тетраедричної конфігурації всі положення лігандів щодо центрального атома еквівалентні. Тому тетраедричні комплекси типу [MA 2 B 2] (М – центральний атом, А і В – ліганди) не мають ізомерів. Зовсім інше простежуємо для комплексів платини (ІІ), наприклад [Pt(NH 3)2 Cl 2] трапляється в двох ізомерних формах, що відрізняються за кольором, розчинністю, реакційною здатністю і способами отримання. В одному з ізомерів комплексу [Pt(NH 3)2 Cl 2] атоми хлору розділені центральним атомом (транс-ізомер), а в іншому (цис-ізомер) вони розміщені поряд, по один бік від центрального атома. 35
 Ізомерія комплексних сполук Оптична, або дзеркальна, ізомерія притаманна сполукам, молекули яких не мають центра і площини симетрії. Існування такого виду ізомерії довів А. Вернер 1911 р. Дзеркальними ізомерами один щодо іншого є предмет і його дзеркальне відображення. Наприклад, два оптичні ізомери має комплексна сполука [Pt(En)2 Cl. NH 3]3+ (En – етилендіамін) 36
Ізомерія комплексних сполук Оптична, або дзеркальна, ізомерія притаманна сполукам, молекули яких не мають центра і площини симетрії. Існування такого виду ізомерії довів А. Вернер 1911 р. Дзеркальними ізомерами один щодо іншого є предмет і його дзеркальне відображення. Наприклад, два оптичні ізомери має комплексна сполука [Pt(En)2 Cl. NH 3]3+ (En – етилендіамін) 36
