основания.ppt
- Количество слайдов: 24
 Основания
Основания
 Основания - Гидроксид натрия сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-ОН). Хорошо растворимые в воде основания называются щелочами. ХОН ⇄ Х+ + ОНГидроксид алюминия Гидроксид кальция Метагидроксид железа(III)
Основания - Гидроксид натрия сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-ОН). Хорошо растворимые в воде основания называются щелочами. ХОН ⇄ Х+ + ОНГидроксид алюминия Гидроксид кальция Метагидроксид железа(III)
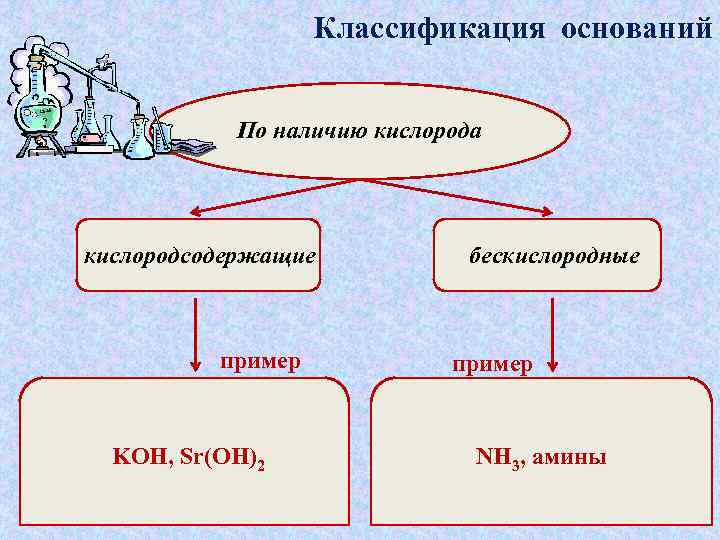 Классификация оснований По наличию кислорода кислородсодержащие пример KOH, Sr(OH)2 бескислородные пример NH 3, амины
Классификация оснований По наличию кислорода кислородсодержащие пример KOH, Sr(OH)2 бескислородные пример NH 3, амины
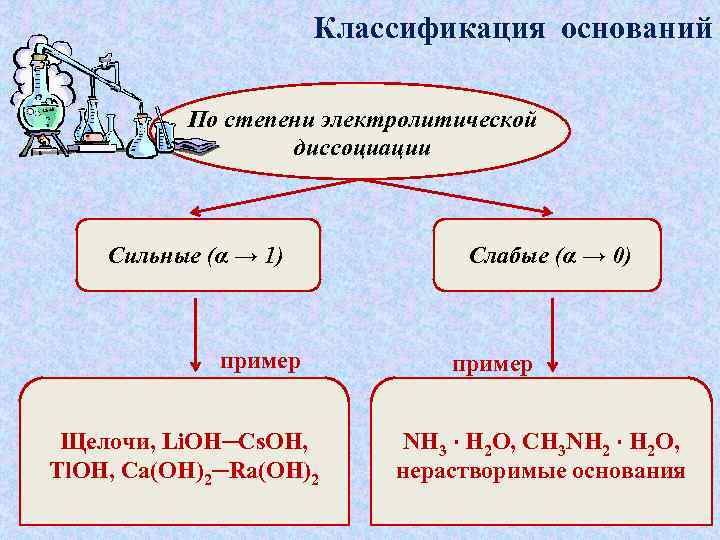 Классификация оснований По степени электролитической диссоциации Сильные (α → 1) пример Щелочи, Li. OH─Cs. OH, Tl. OH, Ca(OH)2─Ra(OH)2 Слабые (α → 0) пример NH 3 · H 2 O, CH 3 NH 2 · H 2 O, нерастворимые основания
Классификация оснований По степени электролитической диссоциации Сильные (α → 1) пример Щелочи, Li. OH─Cs. OH, Tl. OH, Ca(OH)2─Ra(OH)2 Слабые (α → 0) пример NH 3 · H 2 O, CH 3 NH 2 · H 2 O, нерастворимые основания
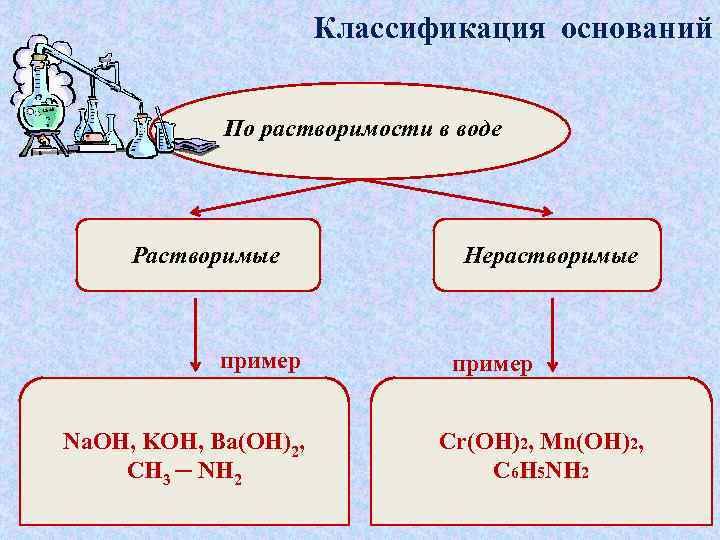 Классификация оснований По растворимости в воде Растворимые пример Na. OH, KOH, Ba(OH)2, CH 3 ─ NH 2 Нерастворимые пример Cr(OH)2, Mn(OH)2, C 6 H 5 NH 2
Классификация оснований По растворимости в воде Растворимые пример Na. OH, KOH, Ba(OH)2, CH 3 ─ NH 2 Нерастворимые пример Cr(OH)2, Mn(OH)2, C 6 H 5 NH 2
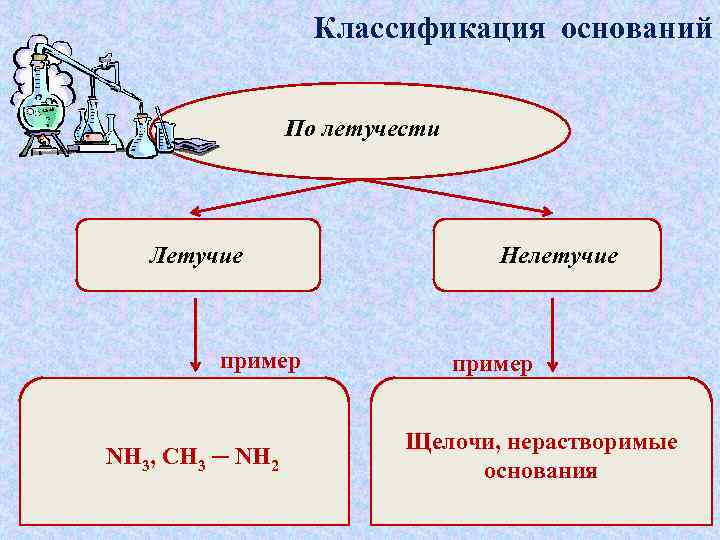 Классификация оснований По летучести Летучие пример NH 3, CH 3 ─ NH 2 Нелетучие пример Щелочи, нерастворимые основания
Классификация оснований По летучести Летучие пример NH 3, CH 3 ─ NH 2 Нелетучие пример Щелочи, нерастворимые основания
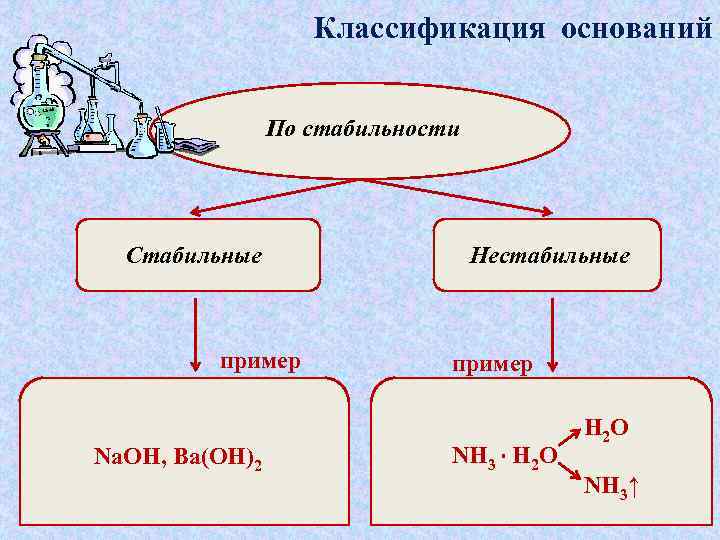 Классификация оснований По стабильности Стабильные пример Na. OH, Ba(OH)2 Нестабильные пример NH 3 · H 2 O NH 3↑
Классификация оснований По стабильности Стабильные пример Na. OH, Ba(OH)2 Нестабильные пример NH 3 · H 2 O NH 3↑
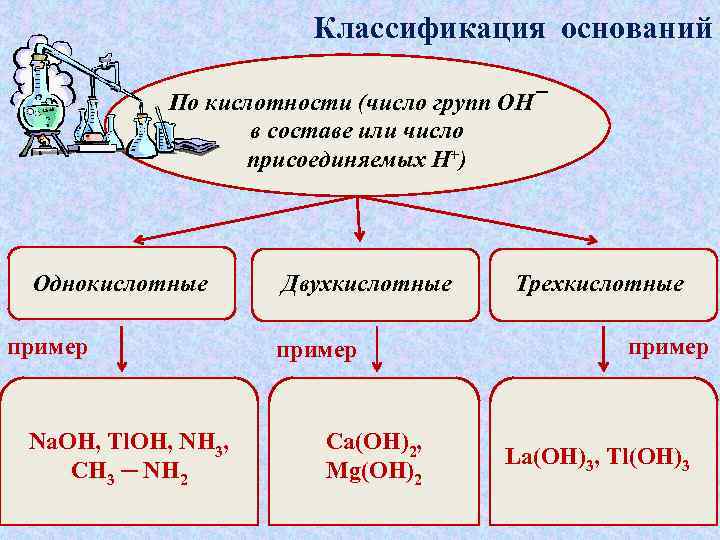 Классификация оснований По кислотности (число групп ОН¯ в составе или число присоединяемых H+) Однокислотные пример Na. OH, Tl. OH, NH 3, CH 3 ─ NH 2 Двухкислотные пример Ca(OH)2, Mg(OH)2 Трехкислотные пример La(OH)3, Tl(OH)3
Классификация оснований По кислотности (число групп ОН¯ в составе или число присоединяемых H+) Однокислотные пример Na. OH, Tl. OH, NH 3, CH 3 ─ NH 2 Двухкислотные пример Ca(OH)2, Mg(OH)2 Трехкислотные пример La(OH)3, Tl(OH)3
 Итак, основания классифицируются: по наличию кислорода по степени электролитической диссоциации по растворимости в воде по летучести по стабильности по кислотности кислородосодержащие бескислородные сильные слабые растворимые нерастворимые летучие нелетучие стабильные нестабильные однокислотные двухкислотные трехкислотные
Итак, основания классифицируются: по наличию кислорода по степени электролитической диссоциации по растворимости в воде по летучести по стабильности по кислотности кислородосодержащие бескислородные сильные слабые растворимые нерастворимые летучие нелетучие стабильные нестабильные однокислотные двухкислотные трехкислотные
 Химические свойства оснований Взаимодействие с кислотами Все группы оснований объединяет их общее свойство - взаимодействие с кислотами с образованием солей. Ba(OH)2 + 2 CH 3 COOH → (CH 3 COO)2 Ba + 2 H 2 O OH¯ + CH 3 COOH → CH 3 COO¯ + H 2 O Fe(OH)3 + 3 HCl = Fe. Cl 3 + 3 H 2 O Fe(OH)3 + 3 H+ = Fe 3+ + 3 H 2 O NH 3 + HCl = NH 4 Cl CH 3 NH 2 + HCl → [CH 3 NH 3]+Clхлорид метиламмония
Химические свойства оснований Взаимодействие с кислотами Все группы оснований объединяет их общее свойство - взаимодействие с кислотами с образованием солей. Ba(OH)2 + 2 CH 3 COOH → (CH 3 COO)2 Ba + 2 H 2 O OH¯ + CH 3 COOH → CH 3 COO¯ + H 2 O Fe(OH)3 + 3 HCl = Fe. Cl 3 + 3 H 2 O Fe(OH)3 + 3 H+ = Fe 3+ + 3 H 2 O NH 3 + HCl = NH 4 Cl CH 3 NH 2 + HCl → [CH 3 NH 3]+Clхлорид метиламмония
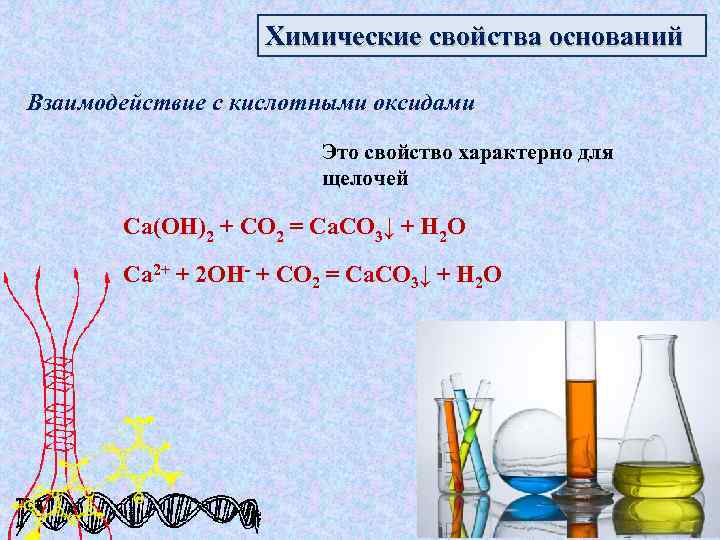 Химические свойства оснований Взаимодействие с кислотными оксидами Это свойство характерно для щелочей Ca(OH)2 + CO 2 = Ca. CO 3↓ + H 2 O Ca 2+ + 2 OH- + CO 2 = Ca. CO 3↓ + H 2 O
Химические свойства оснований Взаимодействие с кислотными оксидами Это свойство характерно для щелочей Ca(OH)2 + CO 2 = Ca. CO 3↓ + H 2 O Ca 2+ + 2 OH- + CO 2 = Ca. CO 3↓ + H 2 O
 Химические свойства оснований Взаимодействие с солями Эти химические реакции подчиняются общему правилу условий протекания реакций между электролитами – должны образоваться осадок, газ или малодиссоциирующее вещество 3 Na. OH + Fe. Cl 3 = Fe(OH)3 + 3 Na. Cl Fe 3+ + 3 OH- = Fe(OH)3↓ Cu. Cl 2 + 2 Na. OH = Cu(OH)2 + 2 Na. Cl Cu 2+ + 2 OH- = Cu(OH)2↓ Гидроксид меди
Химические свойства оснований Взаимодействие с солями Эти химические реакции подчиняются общему правилу условий протекания реакций между электролитами – должны образоваться осадок, газ или малодиссоциирующее вещество 3 Na. OH + Fe. Cl 3 = Fe(OH)3 + 3 Na. Cl Fe 3+ + 3 OH- = Fe(OH)3↓ Cu. Cl 2 + 2 Na. OH = Cu(OH)2 + 2 Na. Cl Cu 2+ + 2 OH- = Cu(OH)2↓ Гидроксид меди
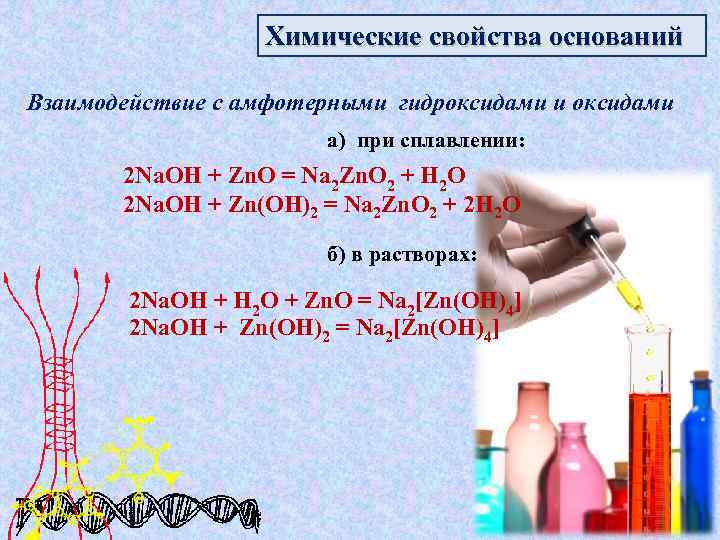 Химические свойства оснований Взаимодействие с амфотерными гидроксидами и оксидами а) при сплавлении: 2 Na. OH + Zn. O = Na 2 Zn. O 2 + H 2 O 2 Na. OH + Zn(OH)2 = Na 2 Zn. O 2 + 2 H 2 O б) в растворах: 2 Na. OH + H 2 O + Zn. O = Na 2[Zn(OH)4] 2 Na. OH + Zn(OH)2 = Na 2[Zn(OH)4]
Химические свойства оснований Взаимодействие с амфотерными гидроксидами и оксидами а) при сплавлении: 2 Na. OH + Zn. O = Na 2 Zn. O 2 + H 2 O 2 Na. OH + Zn(OH)2 = Na 2 Zn. O 2 + 2 H 2 O б) в растворах: 2 Na. OH + H 2 O + Zn. O = Na 2[Zn(OH)4] 2 Na. OH + Zn(OH)2 = Na 2[Zn(OH)4]
 Химические свойства оснований Разложение нерастворимых оснований Cu(OH)2 = Cu. O + H 2 O 2 Al(OH)3 = Al 2 O 3 + 3 H 2 O Разложение гидроксида меди (II) при нагревании
Химические свойства оснований Разложение нерастворимых оснований Cu(OH)2 = Cu. O + H 2 O 2 Al(OH)3 = Al 2 O 3 + 3 H 2 O Разложение гидроксида меди (II) при нагревании
 Закрепляем тему Вопрос № 1 К реакции нейтрализации можно отнести взаимодействие
Закрепляем тему Вопрос № 1 К реакции нейтрализации можно отнести взаимодействие
 Закрепляем тему Вопрос № 2 При нагревании будет разлагаться на оксид и воду
Закрепляем тему Вопрос № 2 При нагревании будет разлагаться на оксид и воду
 Закрепляем тему Вопрос № 3 При обычных условиях основания
Закрепляем тему Вопрос № 3 При обычных условиях основания
 Закрепляем тему Вопрос № 4 Соль и вода образуются при взаимодействии
Закрепляем тему Вопрос № 4 Соль и вода образуются при взаимодействии
 Закрепляем тему Вопрос № 5 Будет вступать в реакцию с соляной кислотой
Закрепляем тему Вопрос № 5 Будет вступать в реакцию с соляной кислотой
 Закрепляем тему Вопрос № 6 При приливании раствора гидроксида натрия к раствору сульфата меди (II)
Закрепляем тему Вопрос № 6 При приливании раствора гидроксида натрия к раствору сульфата меди (II)
 Закрепляем тему Вопрос № 7 В растворах щелочей лакмус и метилоранж соответственно изменяют свои цвета на
Закрепляем тему Вопрос № 7 В растворах щелочей лакмус и метилоранж соответственно изменяют свои цвета на
 Закрепляем тему Вопрос № 8 В уравнении реакции натрия с водой коэффициент перед водородом равен
Закрепляем тему Вопрос № 8 В уравнении реакции натрия с водой коэффициент перед водородом равен
 Закрепляем тему Вопрос № 9 В реакцию с гидроксидом бария вступает
Закрепляем тему Вопрос № 9 В реакцию с гидроксидом бария вступает
 Правильные ответы Вопрос № 1 а) гидроксид калия с серной кислотой Вопрос № 2 г) гидроксид железа (III) Вопрос № 3 а) твердые вещества Вопрос № 4 б) нерастворимое основание и кислота Вопрос № 5 г) все перечисленные вещества Вопрос № 6 б) образуется синий осадок Вопрос № 7 в) синий и желтый Вопрос № 8 а) 1 Вопрос № 9 а) оксид серы (VI)
Правильные ответы Вопрос № 1 а) гидроксид калия с серной кислотой Вопрос № 2 г) гидроксид железа (III) Вопрос № 3 а) твердые вещества Вопрос № 4 б) нерастворимое основание и кислота Вопрос № 5 г) все перечисленные вещества Вопрос № 6 б) образуется синий осадок Вопрос № 7 в) синий и желтый Вопрос № 8 а) 1 Вопрос № 9 а) оксид серы (VI)
