 ОСНОВАНИЯ Автор: Иванова Н. А. МАОУ "Лицей № 36 Саратов
ОСНОВАНИЯ Автор: Иванова Н. А. МАОУ "Лицей № 36 Саратов
 Какие вещества называются основаниями? n n n Гидроксиды металлов с общей формулой M(OH)n (M – металл, n – его валентность, обычно n < 3) называются основаниями. Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами. Например, основаниями являются гидроксиды натрия Na. OH, магния Mg(OH)2, железа (III) Fe(OH)3.
Какие вещества называются основаниями? n n n Гидроксиды металлов с общей формулой M(OH)n (M – металл, n – его валентность, обычно n < 3) называются основаниями. Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами. Например, основаниями являются гидроксиды натрия Na. OH, магния Mg(OH)2, железа (III) Fe(OH)3.
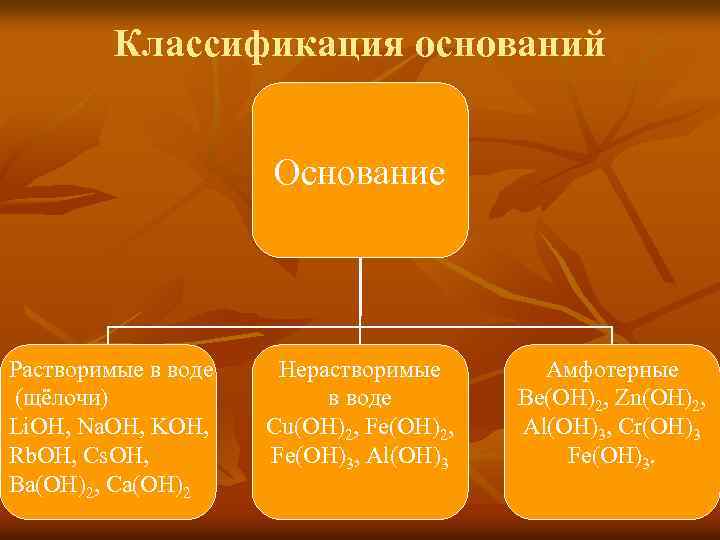 Классификация оснований Основание Растворимые в воде (щёлочи) Li. OH, Na. OH, KOH, Rb. OH, Cs. OH, Ba(OH)2, Ca(OH)2 Нерастворимые в воде Cu(OH)2, Fe(OH)3, Al(OH)3 Амфотерные Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 Fe(OH)3.
Классификация оснований Основание Растворимые в воде (щёлочи) Li. OH, Na. OH, KOH, Rb. OH, Cs. OH, Ba(OH)2, Ca(OH)2 Нерастворимые в воде Cu(OH)2, Fe(OH)3, Al(OH)3 Амфотерные Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 Fe(OH)3.
 Физические свойства n n n Все основания металлов – твердые вещества. Как и соли, они могут быть бесцветными и окрашенными. Основания делятся на растворимые и нерастворимые в воде. Растворимые в воде основания образованы самыми активными металлами, которые реагируют с водой при обычных температурах. Эти металлы находятся в IA группе (щелочные металлы) и во IIA группе (щелочноземельные металлы). Их гидроксиды называются щелочами.
Физические свойства n n n Все основания металлов – твердые вещества. Как и соли, они могут быть бесцветными и окрашенными. Основания делятся на растворимые и нерастворимые в воде. Растворимые в воде основания образованы самыми активными металлами, которые реагируют с водой при обычных температурах. Эти металлы находятся в IA группе (щелочные металлы) и во IIA группе (щелочноземельные металлы). Их гидроксиды называются щелочами.
 n Гидроксид калия (едкое кали)
n Гидроксид калия (едкое кали)
 Гидроксид кальция (гашеная известь)
Гидроксид кальция (гашеная известь)
 Получение n n n n В лаборатории: Щелочей: 1. Взаимодействием активного металла с водой n 2 К + 2 Н 2 О → 2 КОН + Н 2↑ 2. Взаимодействием основных оксидов с водой n К 2 О + Н 2 О → 2 КОН В промышленности: Электролиз солей. Нерастворимые основания получают действием щелочей на соли: n Cu. Cl 2 + Na. OH → Cu(OH)2↓ + 2 Na. Cl
Получение n n n n В лаборатории: Щелочей: 1. Взаимодействием активного металла с водой n 2 К + 2 Н 2 О → 2 КОН + Н 2↑ 2. Взаимодействием основных оксидов с водой n К 2 О + Н 2 О → 2 КОН В промышленности: Электролиз солей. Нерастворимые основания получают действием щелочей на соли: n Cu. Cl 2 + Na. OH → Cu(OH)2↓ + 2 Na. Cl
 Химические свойства n n 1. Изменяют окраску индикатора: n Na. OH + фенолфталеин → малиновая окраска n Na. OH + лакмус → синяя окраска n Na. OH + метиловый оранжевый → желтый 2. Взаимодействие с кислотными оксидами: n 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O 3. Взаимодействие с кислотами: n Na. OH + HCl → Na. Cl + H 2 O Взаимодействуют с растворами солей: n Fe. Cl 3 + 3 Na. OH → Fe(OH)3↓ + 3 Na. Cl
Химические свойства n n 1. Изменяют окраску индикатора: n Na. OH + фенолфталеин → малиновая окраска n Na. OH + лакмус → синяя окраска n Na. OH + метиловый оранжевый → желтый 2. Взаимодействие с кислотными оксидами: n 2 Na. OH + CO 2 = Na 2 CO 3 + H 2 O 3. Взаимодействие с кислотами: n Na. OH + HCl → Na. Cl + H 2 O Взаимодействуют с растворами солей: n Fe. Cl 3 + 3 Na. OH → Fe(OH)3↓ + 3 Na. Cl
 Нерастворимые основания: n n n Взаимодействие с кислотами: n Cu(OH)2 + 2 HCl → Cu. Cl 2 + 2 H 2 O При нагревании разлагаются: n Cu(OH)2 → Cu. O + H 2 O Присутствие щелочей может быть обнаружено и на ощупь, их растворы "мылкие". (Осторожно! Не рекомендуем пробовать – это опасно! Так как они разъедают многие органические вещества).
Нерастворимые основания: n n n Взаимодействие с кислотами: n Cu(OH)2 + 2 HCl → Cu. Cl 2 + 2 H 2 O При нагревании разлагаются: n Cu(OH)2 → Cu. O + H 2 O Присутствие щелочей может быть обнаружено и на ощупь, их растворы "мылкие". (Осторожно! Не рекомендуем пробовать – это опасно! Так как они разъедают многие органические вещества).
 Применение n n Li. OH – в аккумуляторах. Na. OH – для очистки нефти, производства мыла, в текстильной промышленности, для органического синтеза. KOH - в аккумуляторах. Ca(OH)2 – в производстве сахара, соды, в строительстве, применяют для приготовления бордовской смеси – средства для борьбы с болезнями и вредителями растений.
Применение n n Li. OH – в аккумуляторах. Na. OH – для очистки нефти, производства мыла, в текстильной промышленности, для органического синтеза. KOH - в аккумуляторах. Ca(OH)2 – в производстве сахара, соды, в строительстве, применяют для приготовления бордовской смеси – средства для борьбы с болезнями и вредителями растений.
 Тест «Пятерочка» 1. Выберите формулы оснований: n а) SO 3 б) Mg(OH)2 n в) H 2 SO 4 г) Са. О n 2. К каждому из ниже указанных веществ прибавили воду и фенолфталеин. В каких случаях появится малиновое окрашивание? n а) Ba. O б) HNO 3 n в) Cu. O г) КОН n 3. Какие из указанных гидроксидов не могут быть получены взаимодействием соответствующих оксидов с водой? n а) Аl(OH)3 б) Fe(OH)3 n
Тест «Пятерочка» 1. Выберите формулы оснований: n а) SO 3 б) Mg(OH)2 n в) H 2 SO 4 г) Са. О n 2. К каждому из ниже указанных веществ прибавили воду и фенолфталеин. В каких случаях появится малиновое окрашивание? n а) Ba. O б) HNO 3 n в) Cu. O г) КОН n 3. Какие из указанных гидроксидов не могут быть получены взаимодействием соответствующих оксидов с водой? n а) Аl(OH)3 б) Fe(OH)3 n
 n n n n n 4. Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом: а) лакмус краснеет б) лакмус синеет в) Метилоранж краснеет г) Метилоранж желтеет д) фенолфталеин становится малиновым е) Фенолфталеин остается бесцветным 5. Раствор гидроксида калия вступает в химические реакции с веществами, формулы которых а) СО 2 б) H 2 S в) Са(ОН)2 г) Cu д) Na. NO 3 e) Mg
n n n n n 4. Окраска индикаторов под действием раствора гидроксида калия меняется следующим образом: а) лакмус краснеет б) лакмус синеет в) Метилоранж краснеет г) Метилоранж желтеет д) фенолфталеин становится малиновым е) Фенолфталеин остается бесцветным 5. Раствор гидроксида калия вступает в химические реакции с веществами, формулы которых а) СО 2 б) H 2 S в) Са(ОН)2 г) Cu д) Na. NO 3 e) Mg
 Ответы n n n 1. б 2. а г 3. а б 4. б г д 5. а б
Ответы n n n 1. б 2. а г 3. а б 4. б г д 5. а б
 Задача n К 16, 2 г смеси оксидов натрия и никеля, содержащей 38, 3% оксида натрия, прибавили 200 мл воды. Какова массовая доля (%) щелочи в полученном растворе?
Задача n К 16, 2 г смеси оксидов натрия и никеля, содержащей 38, 3% оксида натрия, прибавили 200 мл воды. Какова массовая доля (%) щелочи в полученном растворе?


