 ОРГАНИЧЕСКАЯ ХИМИЯ
ОРГАНИЧЕСКАЯ ХИМИЯ
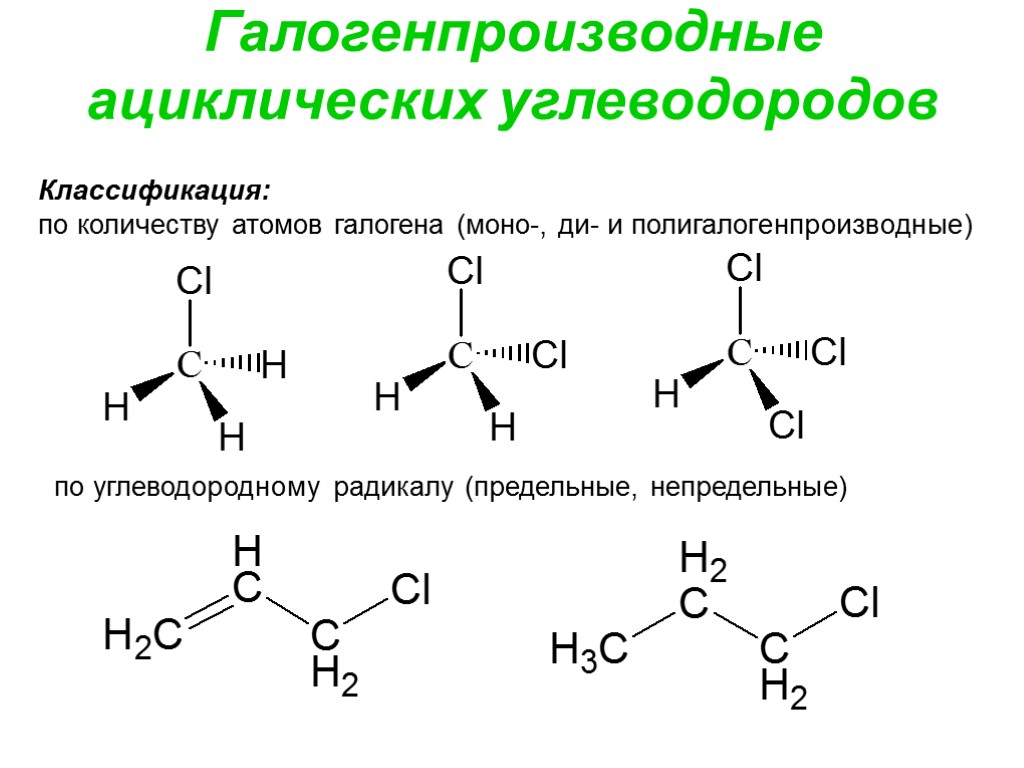 Галогенпроизводные ациклических углеводородов Классификация: по количеству атомов галогена (моно-, ди- и полигалогенпроизводные) по углеводородному радикалу (предельные, непредельные)
Галогенпроизводные ациклических углеводородов Классификация: по количеству атомов галогена (моно-, ди- и полигалогенпроизводные) по углеводородному радикалу (предельные, непредельные)
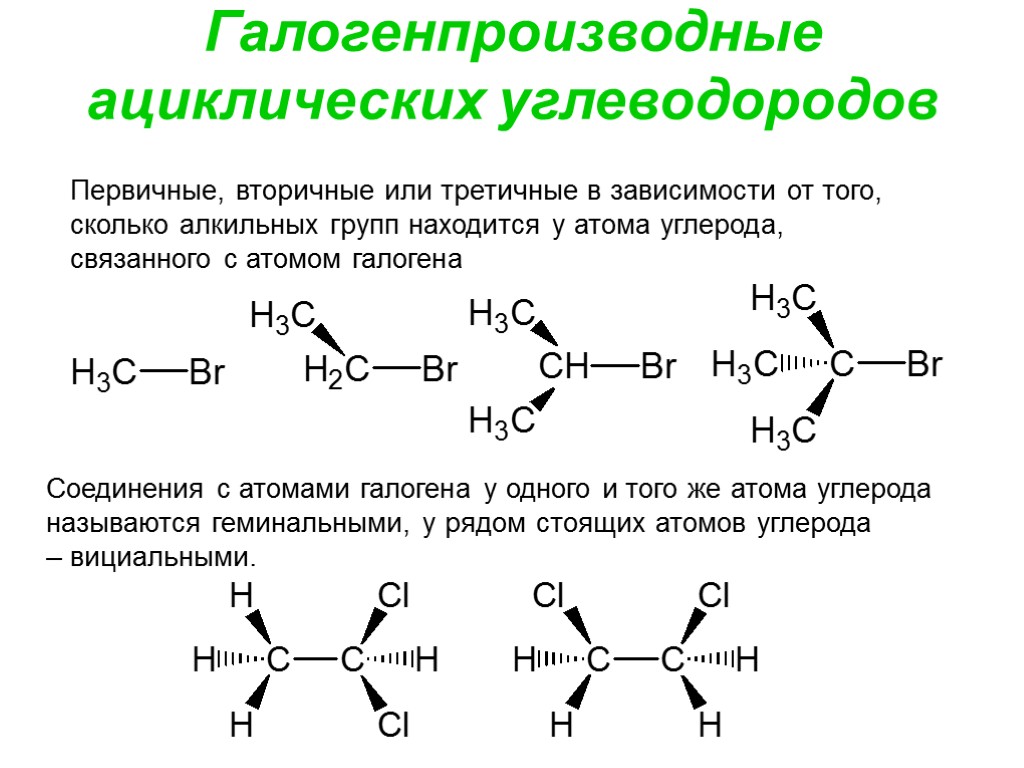 Галогенпроизводные ациклических углеводородов Первичные, вторичные или третичные в зависимости от того, сколько алкильных групп находится у атома углерода, связанного с атомом галогена Соединения с атомами галогена у одного и того же атома углерода называются геминальными, у рядом стоящих атомов углерода – вициальными.
Галогенпроизводные ациклических углеводородов Первичные, вторичные или третичные в зависимости от того, сколько алкильных групп находится у атома углерода, связанного с атомом галогена Соединения с атомами галогена у одного и того же атома углерода называются геминальными, у рядом стоящих атомов углерода – вициальными.
 Галогенпроизводные ациклических углеводородов Способы получения 1. Галогенирование алканов CH3-CH3 + Cl2 CH3CH2Cl + HCl 2. Присоединение галогенов, галогенводородов к непредельным углеводородам СН2=СН2 + Вr2 CBrН2-СBrН2 СН3-СН=СН2 + НСl СН3-СНCl-СН3 3. Замещение гидроксильной группы в спиртах R-OH + HCl R-Cl + H2O 4. Замещение кислорода в карбонильной группе: R-CHO + PCl5 RCHCl2 + POCl3 5. Очень реакционноспособные йодпроизводные получают следующим образом: R-CH2-Cl + NaI R-CH2-I + NaCl
Галогенпроизводные ациклических углеводородов Способы получения 1. Галогенирование алканов CH3-CH3 + Cl2 CH3CH2Cl + HCl 2. Присоединение галогенов, галогенводородов к непредельным углеводородам СН2=СН2 + Вr2 CBrН2-СBrН2 СН3-СН=СН2 + НСl СН3-СНCl-СН3 3. Замещение гидроксильной группы в спиртах R-OH + HCl R-Cl + H2O 4. Замещение кислорода в карбонильной группе: R-CHO + PCl5 RCHCl2 + POCl3 5. Очень реакционноспособные йодпроизводные получают следующим образом: R-CH2-Cl + NaI R-CH2-I + NaCl
 Галогенпроизводные ациклических углеводородов Химические свойства. Химические свойства галогеналкилов обусловлены наличием ковалентной полярной связи углерод-галоген. Важнейший класс органических реакций – нуклеофильное замещение у насыщенного атома углерода Nu: + ZC NuC + Z: 1. Реакции нуклеофильного замещения: R-Hal + Nu- R-Nu + Hal- Они реагируют с металлами, основаниями и солями слабых кислот: R-Hal + AgOH R-OH + AgHal R-Hal + NaOH R-OH + NaHal R-Hal + NaCN R-CN + NaHal R-Hal + NaHS R-SH + NaHal R-Hal + NaOR R-O-R + NaHal R-Hal + 2 NH3 R-NH2 + NH4Hal 2 R-Hal + 2 Na R-R + 2 NaHal (реакция Вюрца)
Галогенпроизводные ациклических углеводородов Химические свойства. Химические свойства галогеналкилов обусловлены наличием ковалентной полярной связи углерод-галоген. Важнейший класс органических реакций – нуклеофильное замещение у насыщенного атома углерода Nu: + ZC NuC + Z: 1. Реакции нуклеофильного замещения: R-Hal + Nu- R-Nu + Hal- Они реагируют с металлами, основаниями и солями слабых кислот: R-Hal + AgOH R-OH + AgHal R-Hal + NaOH R-OH + NaHal R-Hal + NaCN R-CN + NaHal R-Hal + NaHS R-SH + NaHal R-Hal + NaOR R-O-R + NaHal R-Hal + 2 NH3 R-NH2 + NH4Hal 2 R-Hal + 2 Na R-R + 2 NaHal (реакция Вюрца)
 Механизм нуклеофильное замещение у насыщенного атома углерода Классификация в соответствии с изменением заряда в субстрате или нуклеофиле по типу механизма замещения. По заряду. 1) Взаимодействие нейтрального субстрата с нейтральным нуклеофилом Nu: + RZ Nu+R + Z- Примеры: H3N: + RHal RN+H3Hal- Реакция Гофмана R3N: + RHal R4N+Hal- Реакция Гофмана RHal + ROH R-O-R + HHal
Механизм нуклеофильное замещение у насыщенного атома углерода Классификация в соответствии с изменением заряда в субстрате или нуклеофиле по типу механизма замещения. По заряду. 1) Взаимодействие нейтрального субстрата с нейтральным нуклеофилом Nu: + RZ Nu+R + Z- Примеры: H3N: + RHal RN+H3Hal- Реакция Гофмана R3N: + RHal R4N+Hal- Реакция Гофмана RHal + ROH R-O-R + HHal
 Механизм нуклеофильное замещение у насыщенного атома углерода 2. Взаимодействие нейтрального субстрата с анионным нуклеофилом Nu:- + RZ NuR + Z:- Примеры: R-Hal + R’O- R-O-R’ + Hal- R-Hal + CN- R-CN + Hal- 3. Катионный субстрат – нейтральный нуклеофил Nu: + RZ+ Nu+R + Z: Примеры: :S=C(NH2)2 + RS+(CH3)2X- X-N+H2=C(NH2)-S-R + (CH3)2S
Механизм нуклеофильное замещение у насыщенного атома углерода 2. Взаимодействие нейтрального субстрата с анионным нуклеофилом Nu:- + RZ NuR + Z:- Примеры: R-Hal + R’O- R-O-R’ + Hal- R-Hal + CN- R-CN + Hal- 3. Катионный субстрат – нейтральный нуклеофил Nu: + RZ+ Nu+R + Z: Примеры: :S=C(NH2)2 + RS+(CH3)2X- X-N+H2=C(NH2)-S-R + (CH3)2S
 Механизм нуклеофильное замещение у насыщенного атома углерода 4. Катионный субстрат – анионный нуклеофил Nu:- + RZ+ NuR + Z: Примеры: RCOO- + R’N+(CH3)3 RCOOR’ + (CH3)3N:
Механизм нуклеофильное замещение у насыщенного атома углерода 4. Катионный субстрат – анионный нуклеофил Nu:- + RZ+ NuR + Z: Примеры: RCOO- + R’N+(CH3)3 RCOOR’ + (CH3)3N:
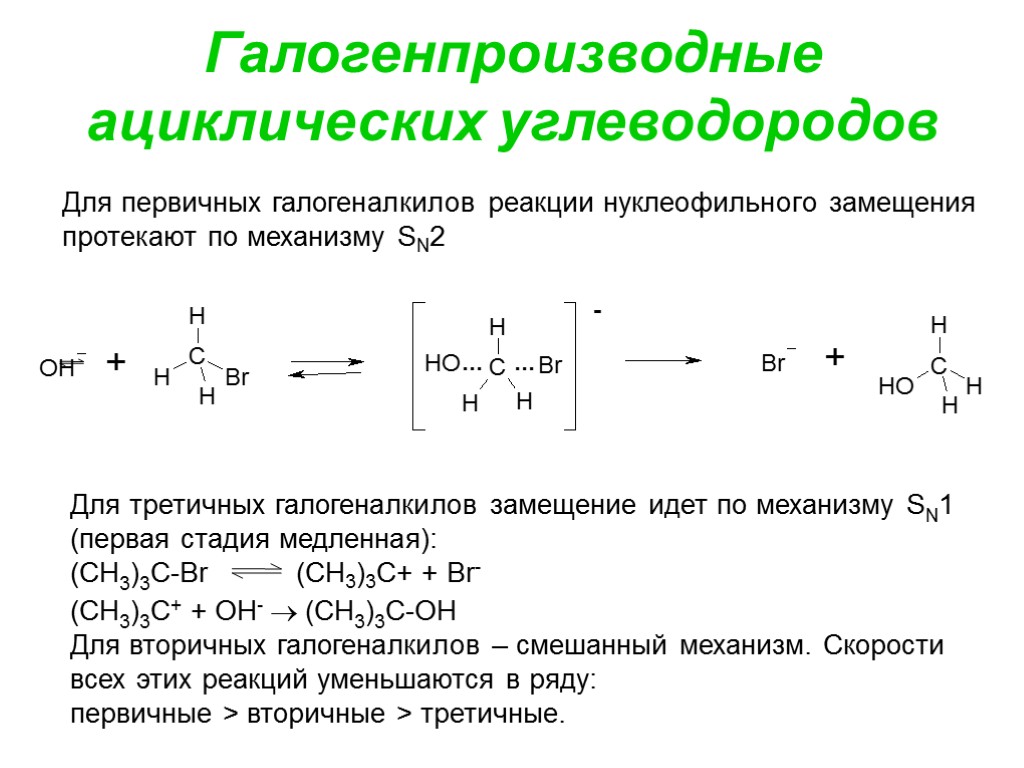 Галогенпроизводные ациклических углеводородов Для первичных галогеналкилов реакции нуклеофильного замещения протекают по механизму SN2 Для третичных галогеналкилов замещение идет по механизму SN1 (первая стадия медленная): (CH3)3C-Br (CH3)3C+ + Br- (CH3)3C+ + OH- (CH3)3C-OH Для вторичных галогеналкилов – смешанный механизм. Скорости всех этих реакций уменьшаются в ряду: первичные > вторичные > третичные.
Галогенпроизводные ациклических углеводородов Для первичных галогеналкилов реакции нуклеофильного замещения протекают по механизму SN2 Для третичных галогеналкилов замещение идет по механизму SN1 (первая стадия медленная): (CH3)3C-Br (CH3)3C+ + Br- (CH3)3C+ + OH- (CH3)3C-OH Для вторичных галогеналкилов – смешанный механизм. Скорости всех этих реакций уменьшаются в ряду: первичные > вторичные > третичные.
 Галогенпроизводные ациклических углеводородов 2. Галогеналкилы способны отщеплять галогенводороды с образованием олефинов. Для третичных галогеналкилов реакции протекают по механизму Е1 (первая стадия медленная) Реакции, протекающие по бимолекулярному механизму Е2 (скорость зависит от концентрации обоих реагентов), требуют присутствия основания.
Галогенпроизводные ациклических углеводородов 2. Галогеналкилы способны отщеплять галогенводороды с образованием олефинов. Для третичных галогеналкилов реакции протекают по механизму Е1 (первая стадия медленная) Реакции, протекающие по бимолекулярному механизму Е2 (скорость зависит от концентрации обоих реагентов), требуют присутствия основания.
 Галогенпроизводные ациклических углеводородов 3. При действии многих металлов в эфире галоген замещается на металл: R-Cl + 2 Li R-Li + LiCl R-Cl + Mg RMgCl (соединения Гриньяра) 4. Восстановление галогенпроизводных водородом (каталитически, в момент выделения) или химическими восстановителями (йодистым водородом): С2Н5I + НI С2Н6 + I2
Галогенпроизводные ациклических углеводородов 3. При действии многих металлов в эфире галоген замещается на металл: R-Cl + 2 Li R-Li + LiCl R-Cl + Mg RMgCl (соединения Гриньяра) 4. Восстановление галогенпроизводных водородом (каталитически, в момент выделения) или химическими восстановителями (йодистым водородом): С2Н5I + НI С2Н6 + I2
 Кислородсодержащие соединения. Спирты.
Кислородсодержащие соединения. Спирты.























