ОРГХИМИЯ_ Лекция 1.1.ppt
- Количество слайдов: 83

 Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН 4, С 4 Н 10). Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов. Органическая вещества Природные (Нефть, белки, жиры, углеводы) Искусственные (Бензин, вискоза) Синтетические (Лекарства, витамины , пластмасса)
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН 4, С 4 Н 10). Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов. Органическая вещества Природные (Нефть, белки, жиры, углеводы) Искусственные (Бензин, вискоза) Синтетические (Лекарства, витамины , пластмасса)
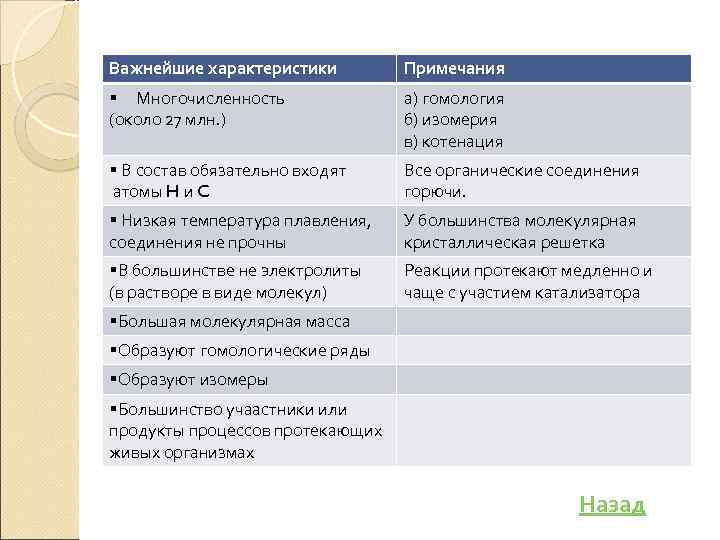 Важнейшие характеристики Примечания § Многочисленность (около 27 млн. ) а) гомология б) изомерия в) котенация § В состав обязательно входят атомы H и C Все органические соединения горючи. § Низкая температура плавления, соединения не прочны У большинства молекулярная кристаллическая решетка §В большинстве не электролиты (в растворе в виде молекул) Реакции протекают медленно и чаще с участием катализатора §Большая молекулярная масса §Образуют гомологические ряды §Образуют изомеры §Большинство учаастники или продукты процессов протекающих живых организмах Назад
Важнейшие характеристики Примечания § Многочисленность (около 27 млн. ) а) гомология б) изомерия в) котенация § В состав обязательно входят атомы H и C Все органические соединения горючи. § Низкая температура плавления, соединения не прочны У большинства молекулярная кристаллическая решетка §В большинстве не электролиты (в растворе в виде молекул) Реакции протекают медленно и чаще с участием катализатора §Большая молекулярная масса §Образуют гомологические ряды §Образуют изомеры §Большинство учаастники или продукты процессов протекающих живых организмах Назад
 Гомологический ряд – ряд веществ, расположеных в порядке возрастания молекулярной массы, имеющих сходно строение, свойства и отличающиеся друг от друга на одну или несколько групп СН 2 Гомологи – сходное строение и свойства, отличающиеся на одну или несколько СН 2
Гомологический ряд – ряд веществ, расположеных в порядке возрастания молекулярной массы, имеющих сходно строение, свойства и отличающиеся друг от друга на одну или несколько групп СН 2 Гомологи – сходное строение и свойства, отличающиеся на одну или несколько СН 2
 Изомерия – явление существования разных веществ с одинаковым качественным и количественным составом, но имеющих разное строение и свойства. Изомеры – вещества, имеющие одинаковую молекулярную форму, но разное строение и свойства.
Изомерия – явление существования разных веществ с одинаковым качественным и количественным составом, но имеющих разное строение и свойства. Изомеры – вещества, имеющие одинаковую молекулярную форму, но разное строение и свойства.
 ТИПЫ ГИБРИДИЗАЦИИ АТОМА УГЛЕРОДА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
ТИПЫ ГИБРИДИЗАЦИИ АТОМА УГЛЕРОДА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
 Гибридизация - это процесс выравнивания атомных орбителей по форме и энергии
Гибридизация - это процесс выравнивания атомных орбителей по форме и энергии
 Причины гибридизации: необходимость образования равноценных связей с другими атомами максимальное удаление атомов друг от друга в пространстве
Причины гибридизации: необходимость образования равноценных связей с другими атомами максимальное удаление атомов друг от друга в пространстве
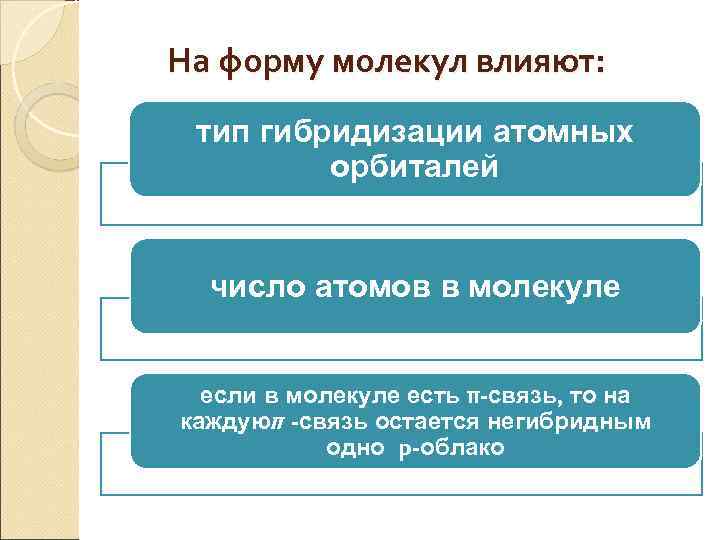 На форму молекул влияют: тип гибридизации атомных орбиталей число атомов в молекуле если в молекуле есть π-связь, то на каждуюπ -связь остается негибридным одно p-облако
На форму молекул влияют: тип гибридизации атомных орбиталей число атомов в молекуле если в молекуле есть π-связь, то на каждуюπ -связь остается негибридным одно p-облако
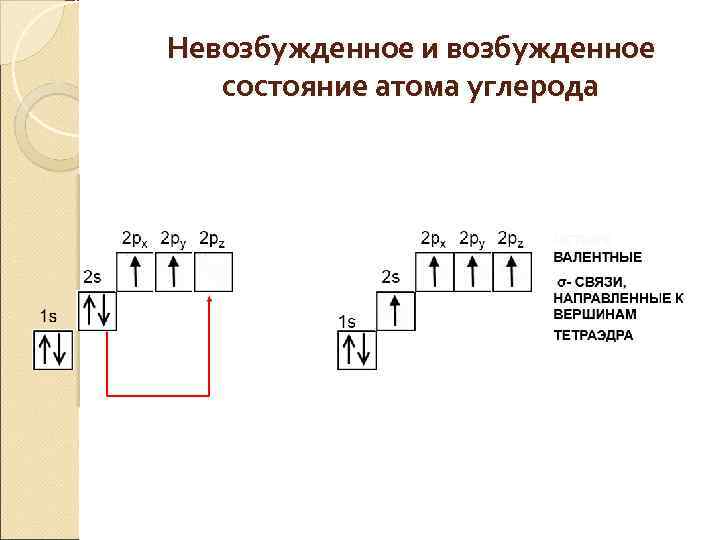 Невозбужденное и возбужденное состояние атома углерода
Невозбужденное и возбужденное состояние атома углерода
 Первое валентное состояние углерода sр3 -Гибридизация ‒ смешение одной 2 s- и трех 2 рорбиталей. Все четыре гибридные орбитали строго ориентированы в пространстве под углом 109° 28' друг к другу, создавая утолщенными "лепестками" геометрическую фигуру ‒ тетраэдр Поэтому sp 3 -гибридизованный атом углерода часто называют "тетраэдрическим". Состояние углеродного атома с sp 3 -гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов – алканов.
Первое валентное состояние углерода sр3 -Гибридизация ‒ смешение одной 2 s- и трех 2 рорбиталей. Все четыре гибридные орбитали строго ориентированы в пространстве под углом 109° 28' друг к другу, создавая утолщенными "лепестками" геометрическую фигуру ‒ тетраэдр Поэтому sp 3 -гибридизованный атом углерода часто называют "тетраэдрическим". Состояние углеродного атома с sp 3 -гибридными орбиталями (первое валентное состояние) характерно для предельных углеводородов – алканов.
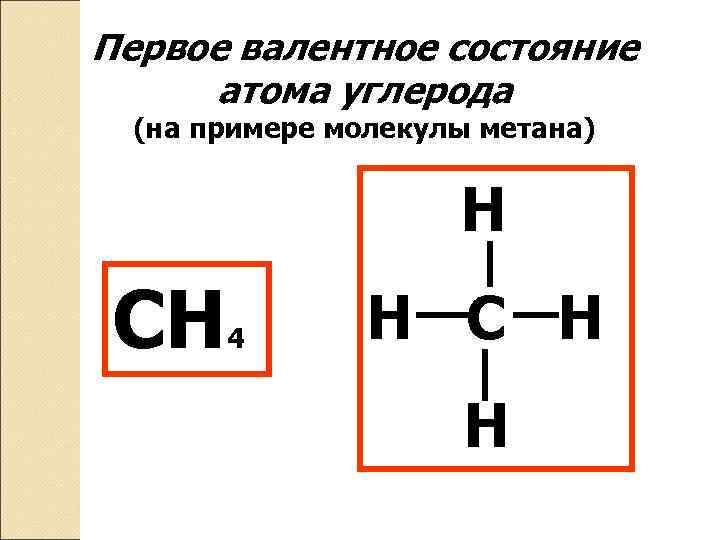 Первое валентное состояние атома углерода (на примере молекулы метана) Н СН 4 Н С Н Н
Первое валентное состояние атома углерода (на примере молекулы метана) Н СН 4 Н С Н Н
 Два «противоречия» в строении метана: 1 противоречие: Валентность углерода равна четырем в наличии только 2 валентных электрона Решение: Выход в возбужденное состояние атома углерода
Два «противоречия» в строении метана: 1 противоречие: Валентность углерода равна четырем в наличии только 2 валентных электрона Решение: Выход в возбужденное состояние атома углерода
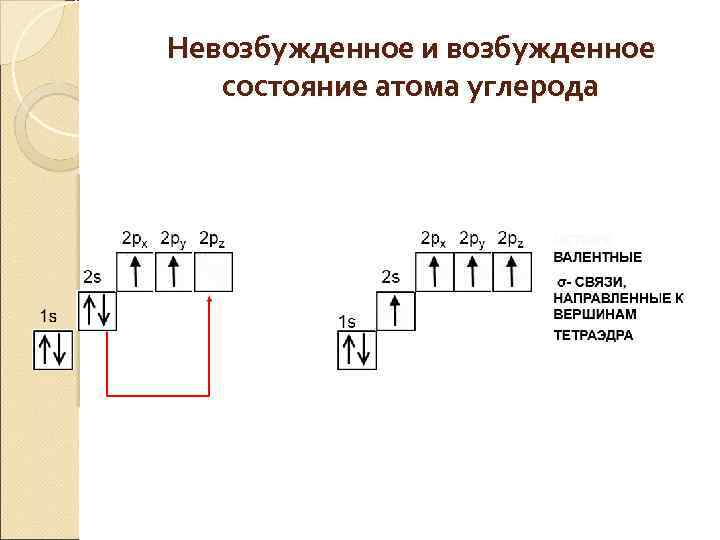 Невозбужденное и возбужденное состояние атома углерода
Невозбужденное и возбужденное состояние атома углерода
 2 противоречие: В молекуле все четыре связи одинаковые по теории – одна SS связь и три SP связи Решение: SP 3 -гибридизация
2 противоречие: В молекуле все четыре связи одинаковые по теории – одна SS связь и три SP связи Решение: SP 3 -гибридизация
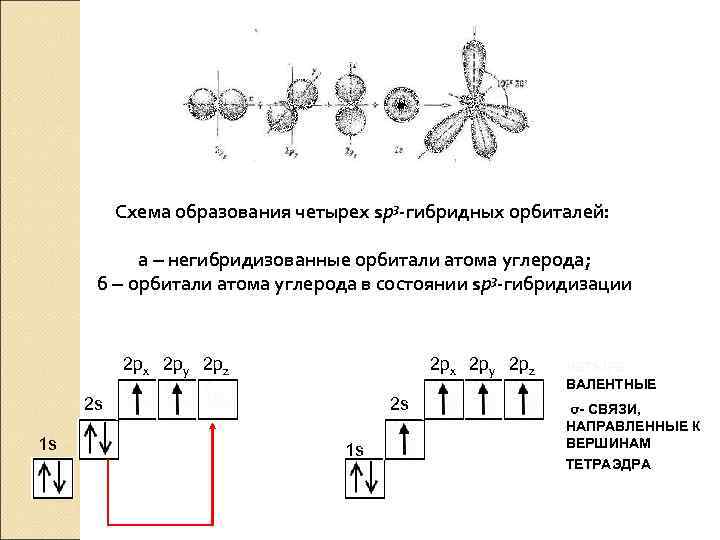 Схема образования четырех sp 3 -гибридных орбиталей: а ‒ негибридизованные орбитали атома углерода; б ‒ орбитали атома углерода в состоянии sp 3 -гибридизации 2 px 2 py 2 pz 2 s 1 s ЧЕТЫРЕ ВАЛЕНТНЫЕ σ- СВЯЗИ, НАПРАВЛЕННЫЕ К ВЕРШИНАМ ТЕТРАЭДРА sp 3 – ГИБРИДИЗАЦИЯ
Схема образования четырех sp 3 -гибридных орбиталей: а ‒ негибридизованные орбитали атома углерода; б ‒ орбитали атома углерода в состоянии sp 3 -гибридизации 2 px 2 py 2 pz 2 s 1 s ЧЕТЫРЕ ВАЛЕНТНЫЕ σ- СВЯЗИ, НАПРАВЛЕННЫЕ К ВЕРШИНАМ ТЕТРАЭДРА sp 3 – ГИБРИДИЗАЦИЯ
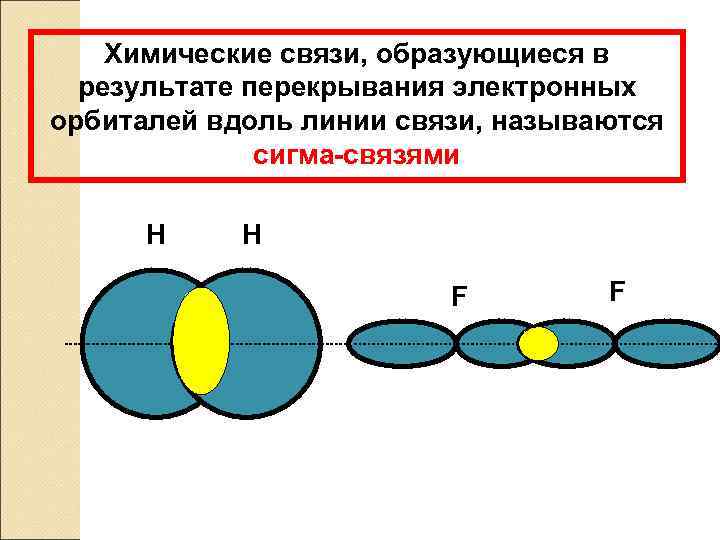 Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются сигма-связями Н Н F F
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются сигма-связями Н Н F F
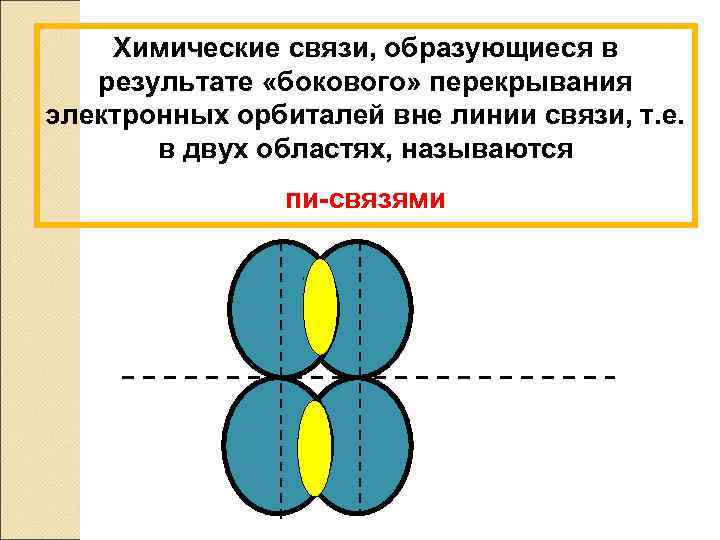 Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т. е. в двух областях, называются пи-связями
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т. е. в двух областях, называются пи-связями
 Второе валентное состояние углерода sр2 -Гибридизация ‒ смешение одной 2 s- и двух 2 р-орбиталей. Одна 2 p не гибридизована и перпендикулярна плоскости, в которой расположены три sp 2 -гибридные орбитали. Состояние атома углерода с sp 2 -гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена ‒ алкенов
Второе валентное состояние углерода sр2 -Гибридизация ‒ смешение одной 2 s- и двух 2 р-орбиталей. Одна 2 p не гибридизована и перпендикулярна плоскости, в которой расположены три sp 2 -гибридные орбитали. Состояние атома углерода с sp 2 -гибридными орбиталями (второе валентное состояние) характерно для непредельных углеводородов ряда этилена ‒ алкенов
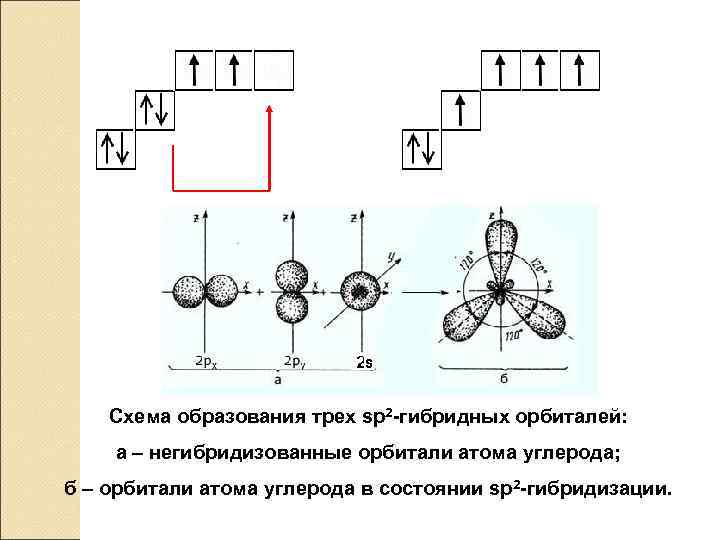 2 px 2 py 2 pz 2 s 1 s sp 2– ГИБРИДИЗАЦИЯ Схема образования трех sр2 -гибридных орбиталей: a ‒ негибридизованные орбитали атома углерода; б ‒ орбитали атома углерода в состоянии sp 2 -гибридизации.
2 px 2 py 2 pz 2 s 1 s sp 2– ГИБРИДИЗАЦИЯ Схема образования трех sр2 -гибридных орбиталей: a ‒ негибридизованные орбитали атома углерода; б ‒ орбитали атома углерода в состоянии sp 2 -гибридизации.
 Третье валентное состояние углерода sр-Гибридизация ‒ смешение одной 2 s- и одной 2 р-орбитали. Две гибридные орбитали расположены на одной прямой линии под углом 180° друг к другу. Остальные две негибридизованные 2 р-орбитали расположены во взаимно перпендикулярных плоскостях. Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда ‒ алкинов.
Третье валентное состояние углерода sр-Гибридизация ‒ смешение одной 2 s- и одной 2 р-орбитали. Две гибридные орбитали расположены на одной прямой линии под углом 180° друг к другу. Остальные две негибридизованные 2 р-орбитали расположены во взаимно перпендикулярных плоскостях. Состояние атома углерода с sp-гибридными орбиталями (третье валентное состояние) характерно для непредельных углеводородов ацетиленового ряда ‒ алкинов.
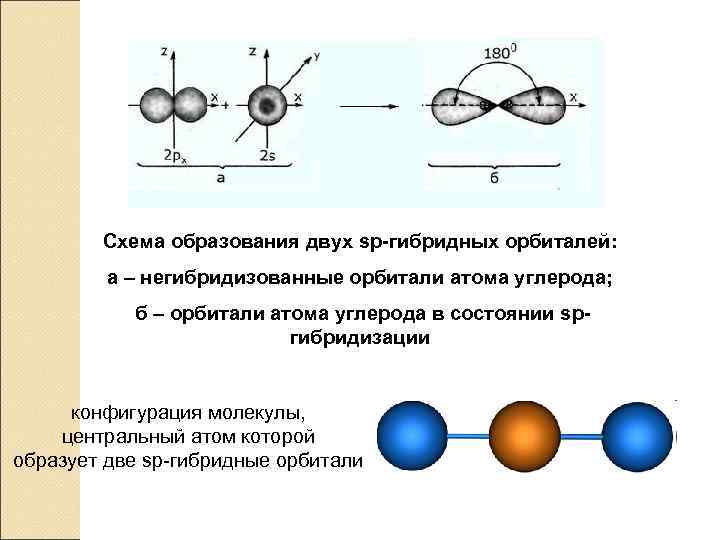 Схема образования двух sp-гибридных орбиталей: а ‒ негибридизованные орбитали атома углерода; б ‒ орбитали атома углерода в состоянии spгибридизации Пространственная конфигурация молекулы, центральный атом которой образует две sp-гибридные орбитали
Схема образования двух sp-гибридных орбиталей: а ‒ негибридизованные орбитали атома углерода; б ‒ орбитали атома углерода в состоянии spгибридизации Пространственная конфигурация молекулы, центральный атом которой образует две sp-гибридные орбитали
 Атомы в молекулах соединяются согласно валентности. Порядок соединения атомов называется химическим строением С 1. Способность атома С образовывать одинарные, двойные, тройные разветвлённые и неразветвлённые цепи, называется котенацией. 2. Свойства вещества зависят не только от того, какие атомы и в каком количеств входят в состав его молекулы, но и от того, в коком порядке они соединены. То есть от химического строения (следствием является изомерия). 3. Атомы или группы атомов, образующие молекулы взаимно влияют друг на друга, от чего зависят свойства вещества и его реакционная способность. 1. Вывод: свойства вещества определяются химическим, пространственным и электрическим строением.
Атомы в молекулах соединяются согласно валентности. Порядок соединения атомов называется химическим строением С 1. Способность атома С образовывать одинарные, двойные, тройные разветвлённые и неразветвлённые цепи, называется котенацией. 2. Свойства вещества зависят не только от того, какие атомы и в каком количеств входят в состав его молекулы, но и от того, в коком порядке они соединены. То есть от химического строения (следствием является изомерия). 3. Атомы или группы атомов, образующие молекулы взаимно влияют друг на друга, от чего зависят свойства вещества и его реакционная способность. 1. Вывод: свойства вещества определяются химическим, пространственным и электрическим строением.
 Бутлеров доказал, что для каждого вещества возможна только одна рациональная формула Бутлеров доказал, что структура органического вещества, познаваема с помощью химических методов анализа, в последствии и физических: a) Спектроскопия b) ЯМР c) Масс-спектроскопия d) Рентгенография Назад
Бутлеров доказал, что для каждого вещества возможна только одна рациональная формула Бутлеров доказал, что структура органического вещества, познаваема с помощью химических методов анализа, в последствии и физических: a) Спектроскопия b) ЯМР c) Масс-спектроскопия d) Рентгенография Назад
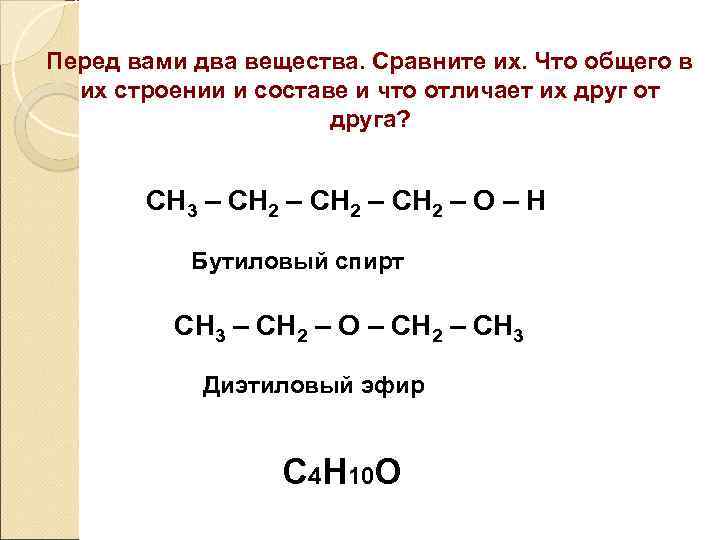 Перед вами два вещества. Сравните их. Что общего в их строении и составе и что отличает их друг от друга? СН 3 – СН 2 – О – Н Бутиловый спирт СН 3 – СН 2 – О – СН 2 – СН 3 Диэтиловый эфир С 4 Н 10 О
Перед вами два вещества. Сравните их. Что общего в их строении и составе и что отличает их друг от друга? СН 3 – СН 2 – О – Н Бутиловый спирт СН 3 – СН 2 – О – СН 2 – СН 3 Диэтиловый эфир С 4 Н 10 О
 Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов обуславливает явление изомерии ИЗОМЕРИЯ греч. isos – одинаковый, meros – часть одно из важнейших понятий в органической химии
Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов обуславливает явление изомерии ИЗОМЕРИЯ греч. isos – одинаковый, meros – часть одно из важнейших понятий в органической химии
 Вещества, имеющие одинаковый количественный и качественный состав молекул, но отличающиеся по своей структуре и свойствам, называются изомерами
Вещества, имеющие одинаковый количественный и качественный состав молекул, но отличающиеся по своей структуре и свойствам, называются изомерами
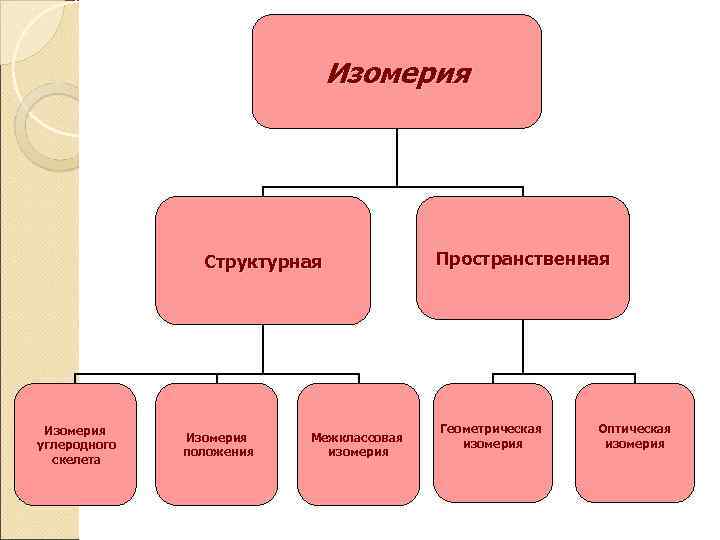 Изомерия Структурная Изомерия углеродного скелета Изомерия положения Межклассовая изомерия Пространственная Геометрическая изомерия Оптическая изомерия
Изомерия Структурная Изомерия углеродного скелета Изомерия положения Межклассовая изомерия Пространственная Геометрическая изомерия Оптическая изомерия
 СТРУКТУРНАЯ ИЗОМЕРИЯ ИЛИ ИЗОМЕРИЯ ЦЕПИ Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. А В Б
СТРУКТУРНАЯ ИЗОМЕРИЯ ИЛИ ИЗОМЕРИЯ ЦЕПИ Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. А В Б
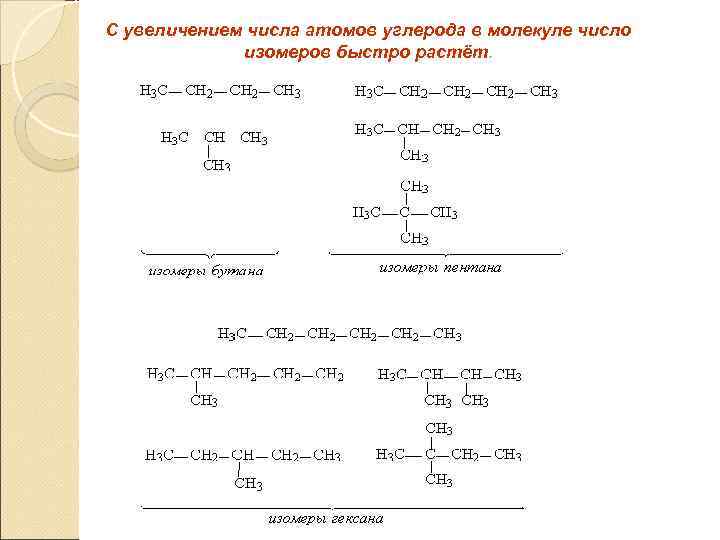 С увеличением числа атомов углерода в молекуле число изомеров быстро растёт.
С увеличением числа атомов углерода в молекуле число изомеров быстро растёт.
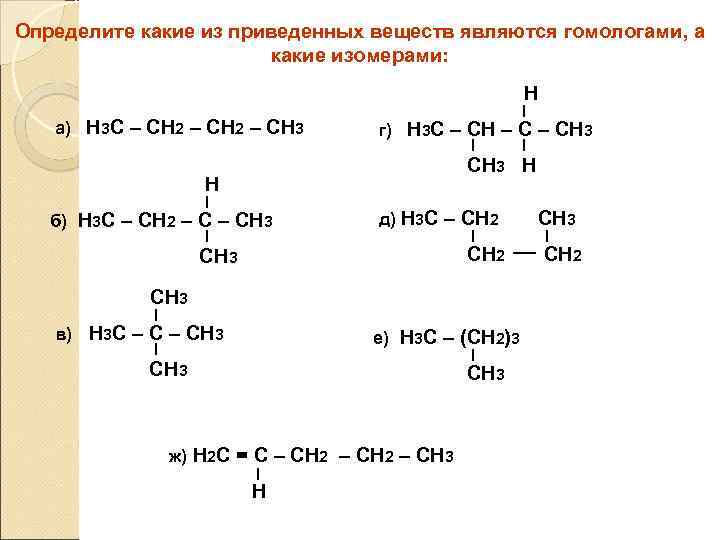 Определите какие из приведенных веществ являются гомологами, а какие изомерами: Н а) Н 3 С – СН 2 – СН 3 г) Н 3 С – СН 3 СН 3 Н Н б) Н 3 С – СН 2 – СН 3 д) Н 3 С – СН 2 СН 3 в) Н 3 С – СН 3 е) Н 3 С – (СН 2)3 СН 3 ж) Н 2 С = С – СН 2 – СН 3 Н СН 3 СН 2
Определите какие из приведенных веществ являются гомологами, а какие изомерами: Н а) Н 3 С – СН 2 – СН 3 г) Н 3 С – СН 3 СН 3 Н Н б) Н 3 С – СН 2 – СН 3 д) Н 3 С – СН 2 СН 3 в) Н 3 С – СН 3 е) Н 3 С – (СН 2)3 СН 3 ж) Н 2 С = С – СН 2 – СН 3 Н СН 3 СН 2
 Изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета. Н 3 С – СН 2 – СН 2 ОН Гексанол - 1 Н 3 С – СН 2 – СН 3 Гексанол - 2 ОН Н 3 С – СН 2 – СН 3 ОН Гексанол - 3 Н 2 С = СН – СН 2 – СН 3 Пентен - 1 Н 3 С – СН = СН – СН 2 – СН 3 Пентен - 2
Изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета. Н 3 С – СН 2 – СН 2 ОН Гексанол - 1 Н 3 С – СН 2 – СН 3 Гексанол - 2 ОН Н 3 С – СН 2 – СН 3 ОН Гексанол - 3 Н 2 С = СН – СН 2 – СН 3 Пентен - 1 Н 3 С – СН = СН – СН 2 – СН 3 Пентен - 2
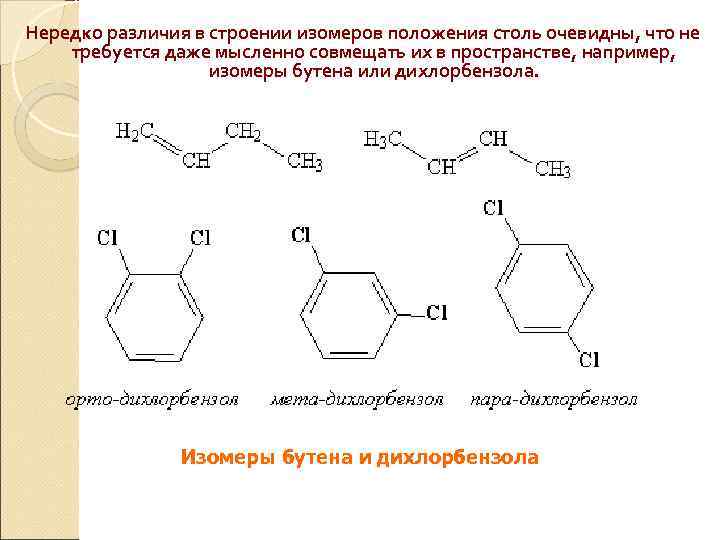 Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола. Изомеры бутена и дихлорбензола
Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола. Изомеры бутена и дихлорбензола
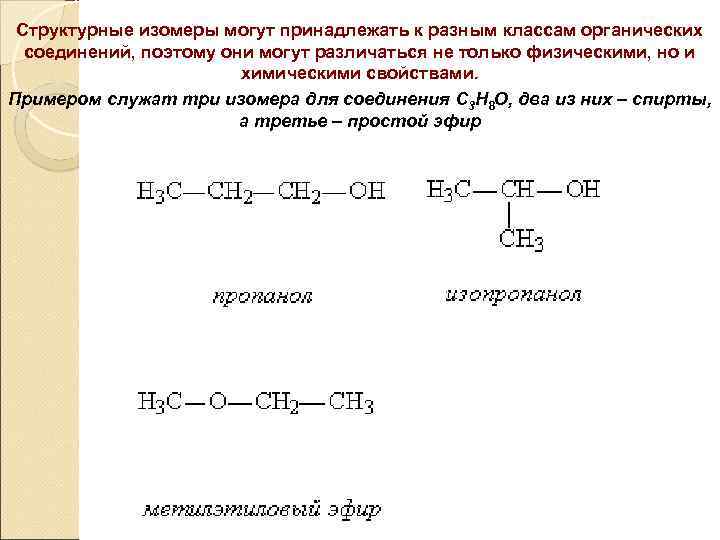 Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами. Примером служат три изомера для соединения С 3 Н 8 О, два из них – спирты, а третье – простой эфир
Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами. Примером служат три изомера для соединения С 3 Н 8 О, два из них – спирты, а третье – простой эфир
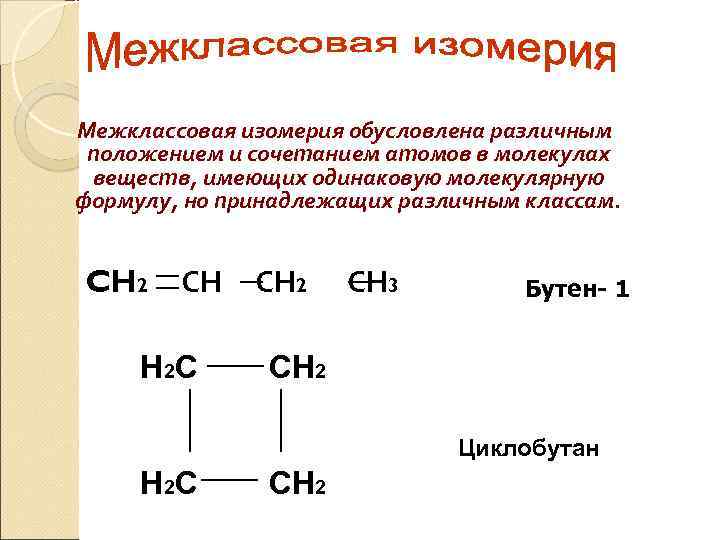 Межклассовая изомерия обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих различным классам. CH 2 СН H 2 C CH 2 CH 3 Бутен- 1 CH 2 Циклобутан H 2 C CH 2
Межклассовая изомерия обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих различным классам. CH 2 СН H 2 C CH 2 CH 3 Бутен- 1 CH 2 Циклобутан H 2 C CH 2
 Цис-транс-изомерия наблюдается в соединениях, содержащих кратные связи или плоские циклы. В отличие от простой связи, кратная связь не позволяет вращать вокруг нее отдельные фрагменты молекулы.
Цис-транс-изомерия наблюдается в соединениях, содержащих кратные связи или плоские циклы. В отличие от простой связи, кратная связь не позволяет вращать вокруг нее отдельные фрагменты молекулы.
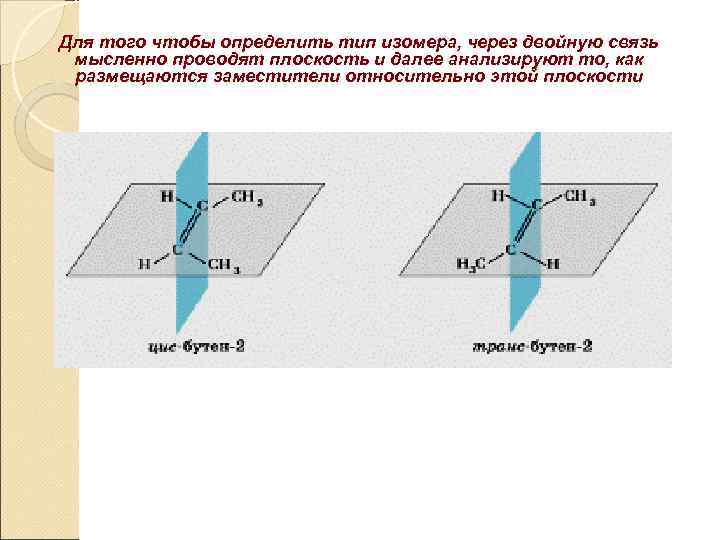 Для того чтобы определить тип изомера, через двойную связь мысленно проводят плоскость и далее анализируют то, как размещаются заместители относительно этой плоскости
Для того чтобы определить тип изомера, через двойную связь мысленно проводят плоскость и далее анализируют то, как размещаются заместители относительно этой плоскости
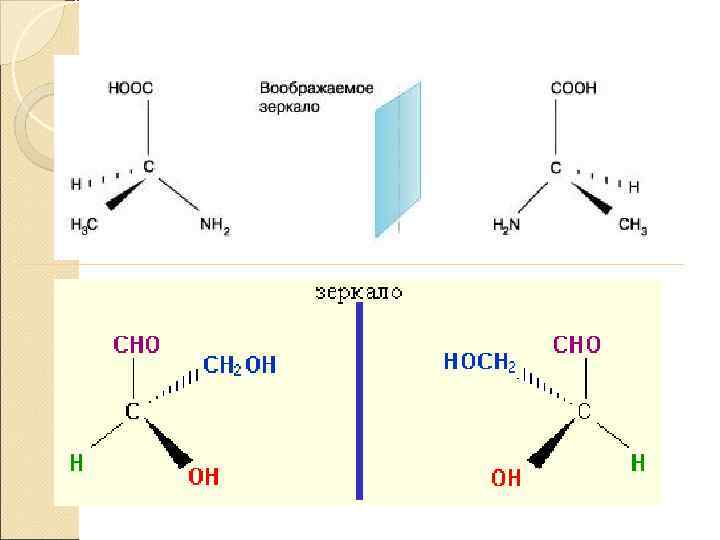
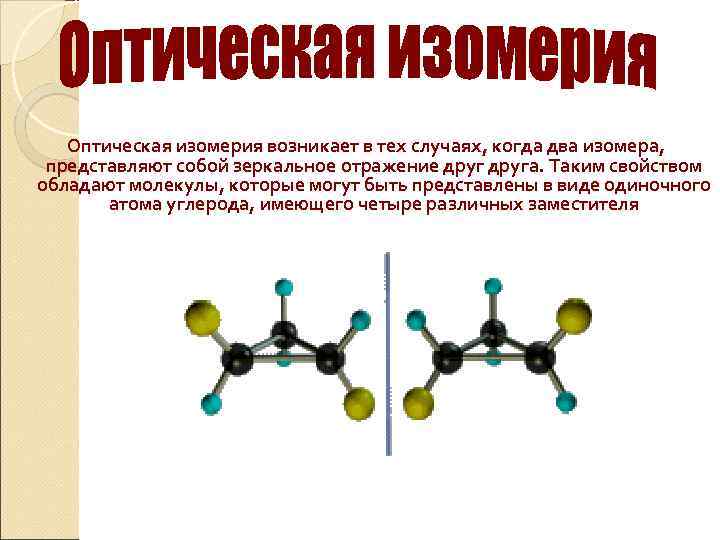 Оптическая изомерия возникает в тех случаях, когда два изомера, представляют собой зеркальное отражение друга. Таким свойством обладают молекулы, которые могут быть представлены в виде одиночного атома углерода, имеющего четыре различных заместителя
Оптическая изомерия возникает в тех случаях, когда два изомера, представляют собой зеркальное отражение друга. Таким свойством обладают молекулы, которые могут быть представлены в виде одиночного атома углерода, имеющего четыре различных заместителя
 Органические вещества классифицируют: По типу углеродной цепи По функциональной группе Функциональной называется группа атомов, определяющая наиболее характерные свойства вещества и его принадлежность к определенному классу соединений.
Органические вещества классифицируют: По типу углеродной цепи По функциональной группе Функциональной называется группа атомов, определяющая наиболее характерные свойства вещества и его принадлежность к определенному классу соединений.
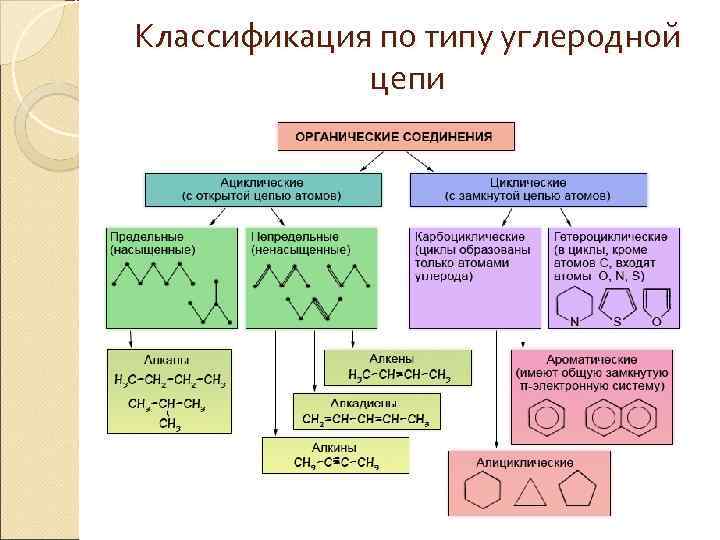 Классификация по типу углеродной цепи
Классификация по типу углеродной цепи
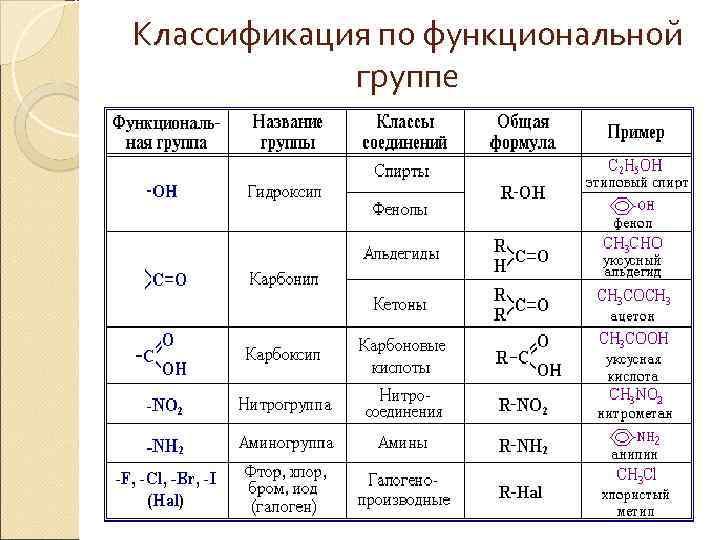 Классификация по функциональной группе
Классификация по функциональной группе
 Номенклатура органических соединений
Номенклатура органических соединений
 Номенклатура: ·это система названий, употребляющихся в какойлибо науке. ·Химическая номенклатура это система формул и названий химических веществ. Она включает правила составления формул и названий. – Названия органических соединений - это сложные слова, включающие: 1. обозначение углеродных цепей; 2. обозначение боковых цепей; 3. обозначение кратности связей между атомами; 4. обозначение характеристических групп; 5. числовые приставки (умножающие префиксы); 6. цифры или буквы (локанты); 7. разделительные знаки (дефисы, запятые, точки, скобки).
Номенклатура: ·это система названий, употребляющихся в какойлибо науке. ·Химическая номенклатура это система формул и названий химических веществ. Она включает правила составления формул и названий. – Названия органических соединений - это сложные слова, включающие: 1. обозначение углеродных цепей; 2. обозначение боковых цепей; 3. обозначение кратности связей между атомами; 4. обозначение характеристических групп; 5. числовые приставки (умножающие префиксы); 6. цифры или буквы (локанты); 7. разделительные знаки (дефисы, запятые, точки, скобки).
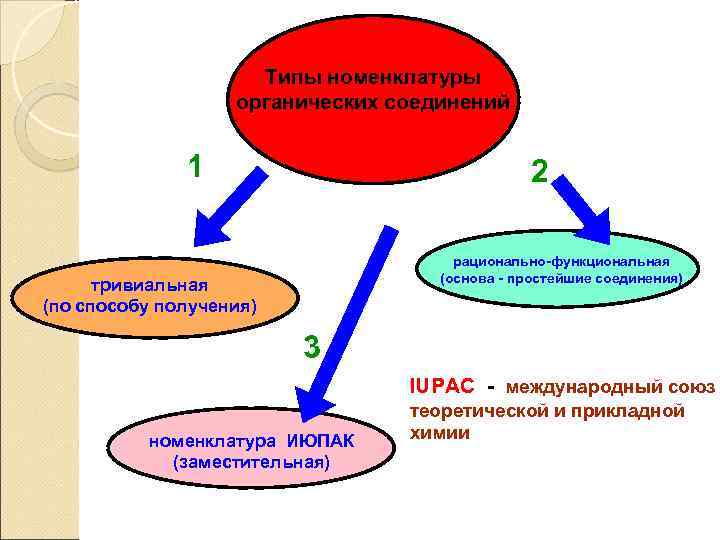 Типы номенклатуры органических соединений 1 2 рационально-функциональная (основа - простейшие соединения) тривиальная (по способу получения) 3 IUPAC - международный союз номенклатура ИЮПАК (заместительная) теоретической и прикладной химии
Типы номенклатуры органических соединений 1 2 рационально-функциональная (основа - простейшие соединения) тривиальная (по способу получения) 3 IUPAC - международный союз номенклатура ИЮПАК (заместительная) теоретической и прикладной химии

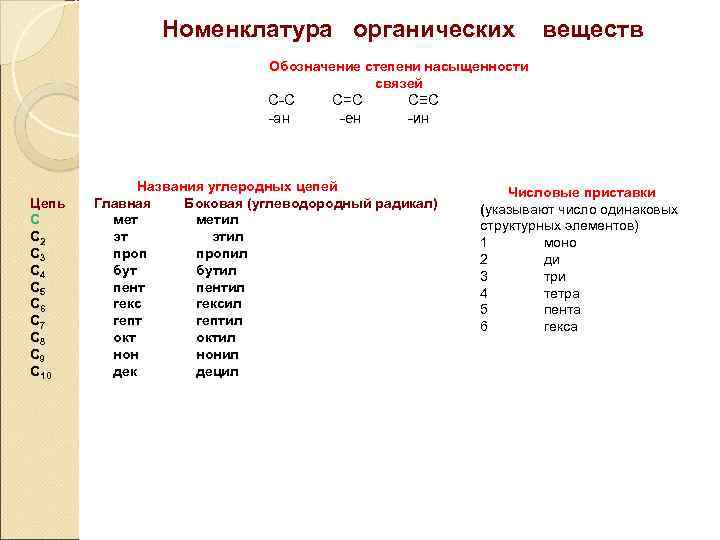 Номенклатура органических веществ Обозначение степени насыщенности связей С-С -ан Цепь С С 2 С 3 С 4 С 5 С 6 С 7 С 8 С 9 С 10 С=С -ен С≡С -ин Названия углеродных цепей Главная Боковая (углеводородный радикал) метил эт этил пропил бутил пентил гексил гептил октил нонил дек децил Числовые приставки (указывают число одинаковых структурных элементов) 1 моно 2 ди 3 три 4 тетра 5 пента 6 гекса
Номенклатура органических веществ Обозначение степени насыщенности связей С-С -ан Цепь С С 2 С 3 С 4 С 5 С 6 С 7 С 8 С 9 С 10 С=С -ен С≡С -ин Названия углеродных цепей Главная Боковая (углеводородный радикал) метил эт этил пропил бутил пентил гексил гептил октил нонил дек децил Числовые приставки (указывают число одинаковых структурных элементов) 1 моно 2 ди 3 три 4 тетра 5 пента 6 гекса

 CН ≡ С - СН 2 - СН 3 I С 2 Н 5 СН 3 - СН 2 - С = СН - СООН I Cl 4 -этилгексин-1 3 -хлорпентен-2 -овая кислота СН 2 - СН 3 I I ОН СН 3 2 -метилпентанол-1 СН 3 - С = СН - СН 3 I CН 3 2 -метилбутен-2 СН 2 = С - СН 2 - СН 3 I I C 2 H 5 CH 3 3 -метил-2 -этилгексен
CН ≡ С - СН 2 - СН 3 I С 2 Н 5 СН 3 - СН 2 - С = СН - СООН I Cl 4 -этилгексин-1 3 -хлорпентен-2 -овая кислота СН 2 - СН 3 I I ОН СН 3 2 -метилпентанол-1 СН 3 - С = СН - СН 3 I CН 3 2 -метилбутен-2 СН 2 = С - СН 2 - СН 3 I I C 2 H 5 CH 3 3 -метил-2 -этилгексен
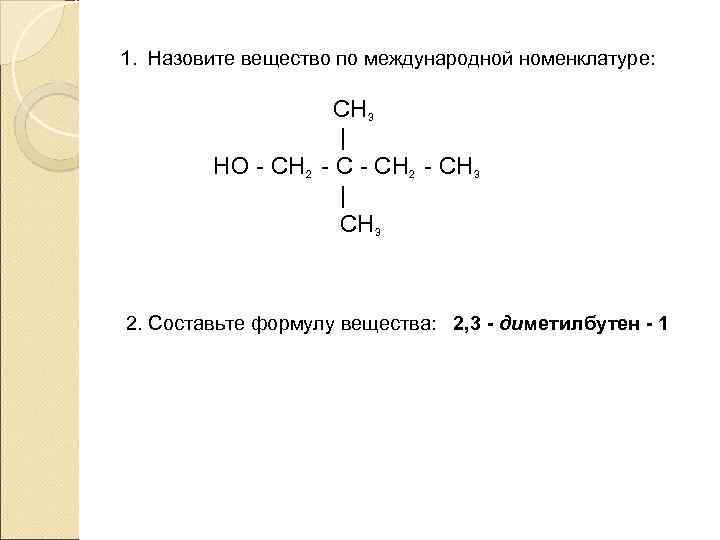 1. Назовите вещество по международной номенклатуре: СН 3 | НО - СН 2 - СН 3 | СН 3 2. Составьте формулу вещества: 2, 3 - диметилбутен - 1
1. Назовите вещество по международной номенклатуре: СН 3 | НО - СН 2 - СН 3 | СН 3 2. Составьте формулу вещества: 2, 3 - диметилбутен - 1
 УГЛЕВОДОРОДЫ предельные
УГЛЕВОДОРОДЫ предельные
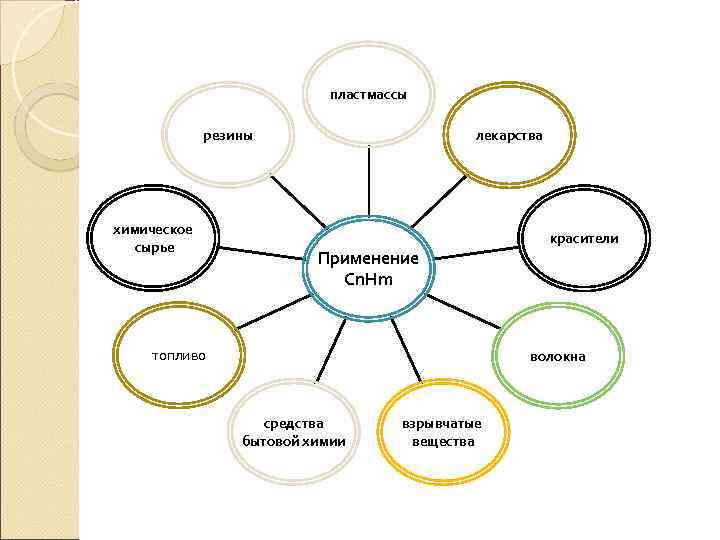 пластмассы резины химическое сырье лекарства Применение Сn. Hm топливо красители волокна средства бытовой химии взрывчатые вещества
пластмассы резины химическое сырье лекарства Применение Сn. Hm топливо красители волокна средства бытовой химии взрывчатые вещества
 Предельные углеводороды
Предельные углеводороды
 Предельные углеводороды - это органические вещества, состоящие только из углерода и водорода, соответствующие общей формуле Сn Н 2 n +2 У этих веществ только простые одинарные связи между атомами углерода, которые соединяются с максимально возможным количеством числом атомов водорода. Их поэтому называют предельными или насыщенными
Предельные углеводороды - это органические вещества, состоящие только из углерода и водорода, соответствующие общей формуле Сn Н 2 n +2 У этих веществ только простые одинарные связи между атомами углерода, которые соединяются с максимально возможным количеством числом атомов водорода. Их поэтому называют предельными или насыщенными
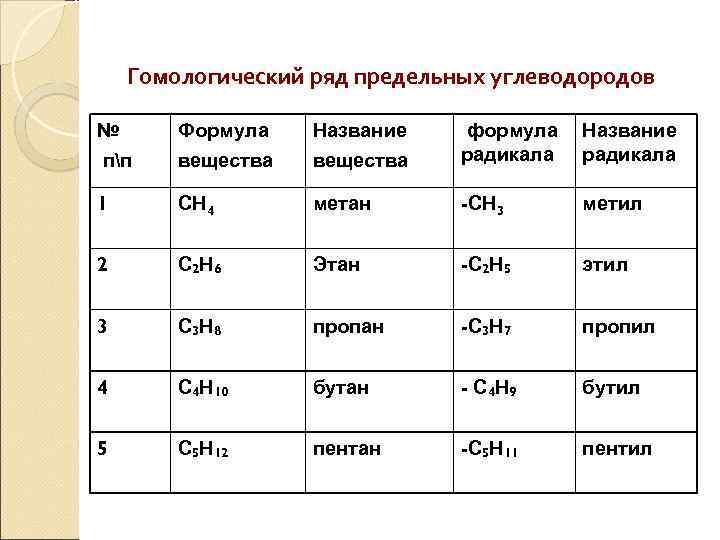 Гомологический ряд предельных углеводородов № пп Формула вещества Название вещества формула радикала Название радикала 1 СН 4 метан -СН 3 метил 2 С 2 Н 6 Этан -С 2 Н 5 этил 3 С 3 Н 8 пропан -С 3 Н 7 пропил 4 С 4 Н 10 бутан - С 4 Н 9 бутил 5 С 5 Н 12 пентан -С 5 Н 11 пентил
Гомологический ряд предельных углеводородов № пп Формула вещества Название вещества формула радикала Название радикала 1 СН 4 метан -СН 3 метил 2 С 2 Н 6 Этан -С 2 Н 5 этил 3 С 3 Н 8 пропан -С 3 Н 7 пропил 4 С 4 Н 10 бутан - С 4 Н 9 бутил 5 С 5 Н 12 пентан -С 5 Н 11 пентил
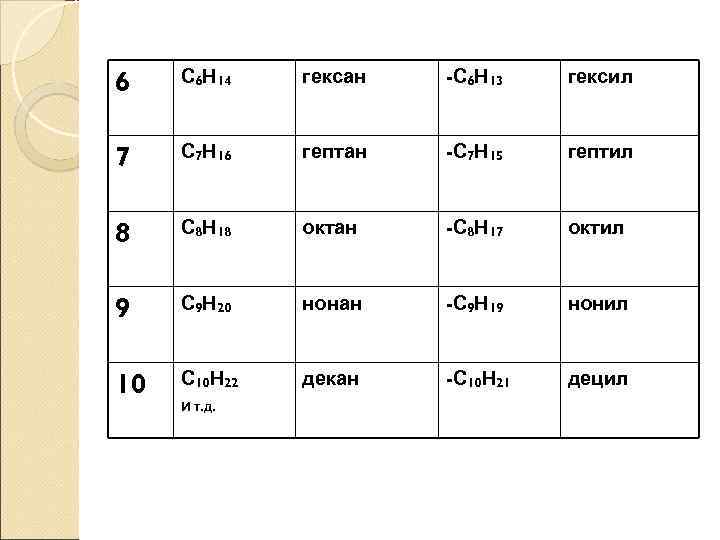 6 С 6 Н 14 гексан -С 6 Н 13 гексил 7 С 7 Н 16 гептан -С 7 Н 15 гептил 8 С 8 Н 18 октан -С 8 Н 17 октил 9 С 9 Н 20 нонан -С 9 Н 19 нонил 10 С 10 Н 22 декан -С 10 Н 21 децил И т. д.
6 С 6 Н 14 гексан -С 6 Н 13 гексил 7 С 7 Н 16 гептан -С 7 Н 15 гептил 8 С 8 Н 18 октан -С 8 Н 17 октил 9 С 9 Н 20 нонан -С 9 Н 19 нонил 10 С 10 Н 22 декан -С 10 Н 21 децил И т. д.
 Физические свойства предельных углеводородов Агрегатное состояние: первые четыре члена гомологического ряда(С 1 -С 4) – газы, С 5 -С 15 жидкости, С 16 и более тяжелые – твердые вещества Температура кипения и плавления постепенно увеличиваются с ростом молекулярной массы вещества Растворимость в воде - плохая
Физические свойства предельных углеводородов Агрегатное состояние: первые четыре члена гомологического ряда(С 1 -С 4) – газы, С 5 -С 15 жидкости, С 16 и более тяжелые – твердые вещества Температура кипения и плавления постепенно увеличиваются с ростом молекулярной массы вещества Растворимость в воде - плохая
 Химические свойства предельных углеводородов Для предельных углеводородов характерны следующие химические реакции: √ замещения (по свободно-радикальному механизму); √ окисления (полное и неполное); √ разложения (крекинг, дегидрирование); √ изомеризации. Для предельных углеводородов совсем не характерны реакции присоединения.
Химические свойства предельных углеводородов Для предельных углеводородов характерны следующие химические реакции: √ замещения (по свободно-радикальному механизму); √ окисления (полное и неполное); √ разложения (крекинг, дегидрирование); √ изомеризации. Для предельных углеводородов совсем не характерны реакции присоединения.
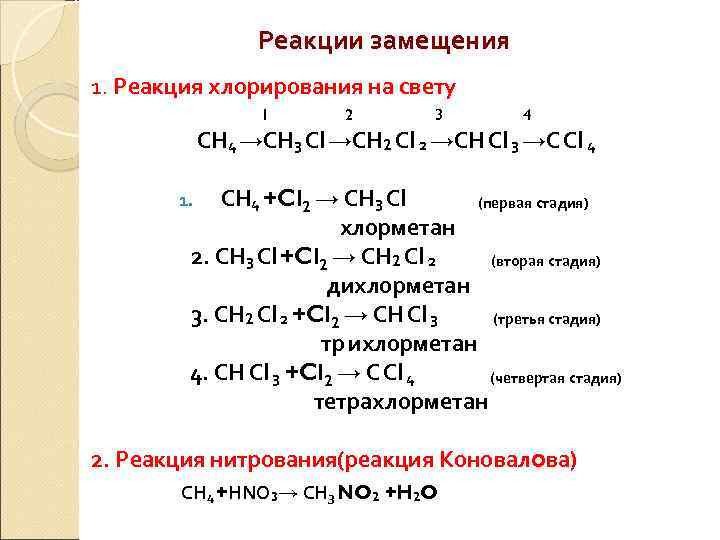 Реакции замещения 1. Реакция хлорирования на свету 1 2 3 4 СН 4 →СН 3 Сl →СН 2 Сl 2 →СН Сl 3 →С Сl 4 СН 4 +Cl 2 → СН 3 Сl (первая стадия) хлорметан 2. СН 3 Сl +Cl 2 → СН 2 Сl 2 (вторая стадия) дихлорметан 3. СН 2 Сl 2 +Cl 2 → СН Сl 3 (третья стадия) тр ихлорметан 4. СН Сl 3 +Cl 2 → С Сl 4 (четвертая стадия) тетрахлорметан 1. 2. Реакция нитрования(реакция Коновалова) СН 4 +НNO 3→ СН 3 NO 2 +H 2 O
Реакции замещения 1. Реакция хлорирования на свету 1 2 3 4 СН 4 →СН 3 Сl →СН 2 Сl 2 →СН Сl 3 →С Сl 4 СН 4 +Cl 2 → СН 3 Сl (первая стадия) хлорметан 2. СН 3 Сl +Cl 2 → СН 2 Сl 2 (вторая стадия) дихлорметан 3. СН 2 Сl 2 +Cl 2 → СН Сl 3 (третья стадия) тр ихлорметан 4. СН Сl 3 +Cl 2 → С Сl 4 (четвертая стадия) тетрахлорметан 1. 2. Реакция нитрования(реакция Коновалова) СН 4 +НNO 3→ СН 3 NO 2 +H 2 O
 Реакции окисления 1. Полное окисление – горение СН 4 + 2 О 2→СО 2 +2 Н 2 О +Q 2. Неполное окисление СН 4 + [О] →метиловый спирт, метаналь (формальдегид), метановая (муравьиная)кислота
Реакции окисления 1. Полное окисление – горение СН 4 + 2 О 2→СО 2 +2 Н 2 О +Q 2. Неполное окисление СН 4 + [О] →метиловый спирт, метаналь (формальдегид), метановая (муравьиная)кислота
 Реакции разложения 1. крекинг (реакции идут при нагревании с разрывом углеродной цепи) 0 1500 С СН 4→ 2 С+2 Н 2 С 4 Н 10→ С 2 Н 4+С 2 Н 6 2. отщепление молекулы водорода (дегидрирование) С 2 Н 6→ С 2 Н 4+Н 2
Реакции разложения 1. крекинг (реакции идут при нагревании с разрывом углеродной цепи) 0 1500 С СН 4→ 2 С+2 Н 2 С 4 Н 10→ С 2 Н 4+С 2 Н 6 2. отщепление молекулы водорода (дегидрирование) С 2 Н 6→ С 2 Н 4+Н 2
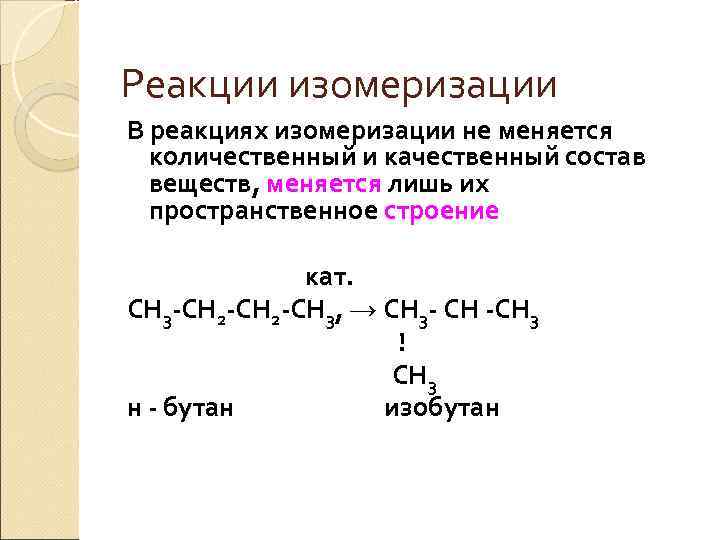 Реакции изомеризации В реакциях изомеризации не меняется количественный и качественный состав веществ, меняется лишь их пространственное строение кат. СН 3 -СН 2 -СН 3, → СН 3 - СН -СН 3 ! СН 3 н - бутан изобутан
Реакции изомеризации В реакциях изомеризации не меняется количественный и качественный состав веществ, меняется лишь их пространственное строение кат. СН 3 -СН 2 -СН 3, → СН 3 - СН -СН 3 ! СН 3 н - бутан изобутан
 Применение предельных углеводородов Предельные углеводороды находят свое применение как: √ топливо (бензин, керосин, мазут и др. ); √ растворители ; √ химическое сырье (для получения алкенов ацетилена, бутадиена и др. ); √ сырье для синтеза ( водорода, сажи, парафина, сероуглерода и др. )
Применение предельных углеводородов Предельные углеводороды находят свое применение как: √ топливо (бензин, керосин, мазут и др. ); √ растворители ; √ химическое сырье (для получения алкенов ацетилена, бутадиена и др. ); √ сырье для синтеза ( водорода, сажи, парафина, сероуглерода и др. )
 Prezentacii. com Непредельные углеводороды
Prezentacii. com Непредельные углеводороды
 Непредельные, или ненасыщенные, УВ содержат кратные углеродные связи (>C=C<, -CΞC-) Непредельными называются углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными или тройными связями. Их также называют ненасыщенными углеводородами, так как их молекулы имеют меньшее число атомов водорода, чем насыщенные.
Непредельные, или ненасыщенные, УВ содержат кратные углеродные связи (>C=C<, -CΞC-) Непредельными называются углеводороды, в молекулах которых имеются атомы углерода, связанные между собой двойными или тройными связями. Их также называют ненасыщенными углеводородами, так как их молекулы имеют меньшее число атомов водорода, чем насыщенные.
 Алкены ( олефины, этиленовые УВ) Cn. H 2 n, n>2 Алкены – это УВ, в молекулах которых два атома углерода находятся в состоянии Sp²-гибридизации и связаны друг с другом двойной связью
Алкены ( олефины, этиленовые УВ) Cn. H 2 n, n>2 Алкены – это УВ, в молекулах которых два атома углерода находятся в состоянии Sp²-гибридизации и связаны друг с другом двойной связью
 Изомерия алкенов Для алкенов возможны 4 типа изомерии: Изомерия углеродной цепи Изомерия положения двойной связи Цис, - транс- изомерия Классов соединений (циклоалканы)
Изомерия алкенов Для алкенов возможны 4 типа изомерии: Изомерия углеродной цепи Изомерия положения двойной связи Цис, - транс- изомерия Классов соединений (циклоалканы)
 Номенклатура Cn. H 2 n ‒ен или ‒илен В качестве главной выбирают цепь, включающую двойную связь, даже если она не самая длинная. Нумерация с того конца, к которому ближе двойная связь Положение = связи указывают в конце суффиксом ‒ен, и номер атома углерода, у которого она находится.
Номенклатура Cn. H 2 n ‒ен или ‒илен В качестве главной выбирают цепь, включающую двойную связь, даже если она не самая длинная. Нумерация с того конца, к которому ближе двойная связь Положение = связи указывают в конце суффиксом ‒ен, и номер атома углерода, у которого она находится.
 Химические свойства Характерны реакции присоединения Гидрирование (присоединение водорода) СН 3 -СН=СН 2 +Н 2→ CH 3 -CH 2 -CH 3 (кат. Ni) пропен пропан § Галогенирование( +Hal 2 ) СН 3 -СН=СН 2 +Br 2 → CH 3 -CHBr-CH 2 Br пропен 1, 2 - дибромпропан качественная реакция Гидрогалогенирование (+HHal) CH 2=CH 2 + HCl→ CH 3 – CH 2 Cl этен хлорэтан
Химические свойства Характерны реакции присоединения Гидрирование (присоединение водорода) СН 3 -СН=СН 2 +Н 2→ CH 3 -CH 2 -CH 3 (кат. Ni) пропен пропан § Галогенирование( +Hal 2 ) СН 3 -СН=СН 2 +Br 2 → CH 3 -CHBr-CH 2 Br пропен 1, 2 - дибромпропан качественная реакция Гидрогалогенирование (+HHal) CH 2=CH 2 + HCl→ CH 3 – CH 2 Cl этен хлорэтан
 Присоединение галогеноводородов к несимметричным алкенам происходит по правилу В. В. Марковникова При присоединении полярных молекул (НHal, H 2 O) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода. CH 3 -CH=CH 2 +HBr →CH 3 -CHBr-CH 3 пропен 2 -бромпропан Гидратация (+Н 2 О) происходит по правилу Марковникова СН 2=СН 2 +Н 2 О →СН 3 -СН 2 ОН (в кислой среде при нагревании) этанол (первичный спирт) СН 2=СН-СН 2 -СН 3+Н 2 О→СН 3 -СНОН-СН 2 -СН 3 бутен-1 бутанол-2 ( вторичный спирт ) II. Реакция окисления Горение: а) полное ( избыток О 2) С 2 Н 4 +3 О 2 → 2 СО 2 +2 Н 2 О
Присоединение галогеноводородов к несимметричным алкенам происходит по правилу В. В. Марковникова При присоединении полярных молекул (НHal, H 2 O) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода. CH 3 -CH=CH 2 +HBr →CH 3 -CHBr-CH 3 пропен 2 -бромпропан Гидратация (+Н 2 О) происходит по правилу Марковникова СН 2=СН 2 +Н 2 О →СН 3 -СН 2 ОН (в кислой среде при нагревании) этанол (первичный спирт) СН 2=СН-СН 2 -СН 3+Н 2 О→СН 3 -СНОН-СН 2 -СН 3 бутен-1 бутанол-2 ( вторичный спирт ) II. Реакция окисления Горение: а) полное ( избыток О 2) С 2 Н 4 +3 О 2 → 2 СО 2 +2 Н 2 О
 б) неполное( недостаток кислорода) C 2 H 4 +2 O 2→ 2 CO + 2 H 2 O C 2 H 4 + O 2→ 2 C +2 H 2 O в)под действием окислителей типа KMn. O 4, K 2 Cr 2 O 7 CH 2=CH 2 + ( O ) + H 2 O----- CH 2 – CH 2 l l OH OH качественная реакция алкилирование (присоединение алканов) кат. Al. Cl 3, Al. Br 3, HF, H 2 SO 4 CH 2=CH 2+ CH 3 -CH 2 -CH 3→-CH 3 -CH 2 -CH 3 и СH 3 -CH 2 -CH-CH 3 l пентан CH 3 2 -метилбутан
б) неполное( недостаток кислорода) C 2 H 4 +2 O 2→ 2 CO + 2 H 2 O C 2 H 4 + O 2→ 2 C +2 H 2 O в)под действием окислителей типа KMn. O 4, K 2 Cr 2 O 7 CH 2=CH 2 + ( O ) + H 2 O----- CH 2 – CH 2 l l OH OH качественная реакция алкилирование (присоединение алканов) кат. Al. Cl 3, Al. Br 3, HF, H 2 SO 4 CH 2=CH 2+ CH 3 -CH 2 -CH 3→-CH 3 -CH 2 -CH 3 и СH 3 -CH 2 -CH-CH 3 l пентан CH 3 2 -метилбутан
 III. Реакции полимеризации Процесс полимеризации алкенов открыт А. М. Бутлеровым. Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием высокомолекулярного соединения (полимера) Условия t, P, kat. n CH 2=CH 2 → (-CH 2 -) n мономер (этилен) полимер ( полиэтилен)
III. Реакции полимеризации Процесс полимеризации алкенов открыт А. М. Бутлеровым. Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием высокомолекулярного соединения (полимера) Условия t, P, kat. n CH 2=CH 2 → (-CH 2 -) n мономер (этилен) полимер ( полиэтилен)
 Получение алкенов 1) Крекинг нефтепродуктов С 16 Н 34 → С 8 Н 18 + С 8 Н 16( t ) 2) Дегидрирование алканов (де + гидр = удалять +водород) Cn. H 2 n+2 → Cn. H 2 n + H 2 (t, kat. ) Отщепление водорода. 3) Гидрирование алкинов Cn. H 2 n-2+ H 2 → Cn. H 2 n (kat. Ni, Pt) 4) Дегидратация спиртов (t, kat: H 2 SO 4, H 3 PO 4, Al 2 O 3, Zn. Cl 2) CH 3 -CH 2 OH → CH 2=CH 2 +H 2 O (170 , Н 2 SO 4 конц. ) При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А. М. Зайцева)
Получение алкенов 1) Крекинг нефтепродуктов С 16 Н 34 → С 8 Н 18 + С 8 Н 16( t ) 2) Дегидрирование алканов (де + гидр = удалять +водород) Cn. H 2 n+2 → Cn. H 2 n + H 2 (t, kat. ) Отщепление водорода. 3) Гидрирование алкинов Cn. H 2 n-2+ H 2 → Cn. H 2 n (kat. Ni, Pt) 4) Дегидратация спиртов (t, kat: H 2 SO 4, H 3 PO 4, Al 2 O 3, Zn. Cl 2) CH 3 -CH 2 OH → CH 2=CH 2 +H 2 O (170 , Н 2 SO 4 конц. ) При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А. М. Зайцева)
 5) Дегидрогалогенирование моногалогеналканов (-HHal) действием твердой щелочи или ее спиртового раствора. Происходит по правилу Зайцева: СН 3 -СН 2 -С(СН 3)Cl-CH 3 + KOH→CH 3 -CH=C(CH 3)-CH 3 +KCl+H 2 O 2 -метил-2 -хлорбутан 2 -метилбутен-2 6) Дегалогенирование (-2 Наl) дигалогеналканов с атомами галогена у соседних атомов «С» действием Zn или Mq. CH 3 -CH 2 -CHBr-CH 3 + Zn → CH 3 -CH 2 -CH=CH-CH 3 +Zn. Br 2 2, 3 -дибромпентан пентен-2 Вместо цинка может быть использован натрий или магний.
5) Дегидрогалогенирование моногалогеналканов (-HHal) действием твердой щелочи или ее спиртового раствора. Происходит по правилу Зайцева: СН 3 -СН 2 -С(СН 3)Cl-CH 3 + KOH→CH 3 -CH=C(CH 3)-CH 3 +KCl+H 2 O 2 -метил-2 -хлорбутан 2 -метилбутен-2 6) Дегалогенирование (-2 Наl) дигалогеналканов с атомами галогена у соседних атомов «С» действием Zn или Mq. CH 3 -CH 2 -CHBr-CH 3 + Zn → CH 3 -CH 2 -CH=CH-CH 3 +Zn. Br 2 2, 3 -дибромпентан пентен-2 Вместо цинка может быть использован натрий или магний.
 Алкины (ацетиленовые УВ) Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии SP-гибридизации и связаны друг с другом тройной связью. Общая формула: Cn. H 2 n-2, n>2
Алкины (ацетиленовые УВ) Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии SP-гибридизации и связаны друг с другом тройной связью. Общая формула: Cn. H 2 n-2, n>2
 Изомерия Углеродного скелета с «С» >5 CНΞС-СН 2 -СН 3 СНΞС-СН –СН 3 бутин-1 СН 3 3 -метилбутин-1 Положения тройной (кратной) связи СНΞС-СН 2 -СН 3 -СΞС-СН 3 бутин-1 бутин-2 Классов соединений (алкадиены) СНΞС-СН 2 -СН 3 СН 2=СН-СН=СН 2 бутин-1 бутадиен-1, 3 Пространственной изомерии нет
Изомерия Углеродного скелета с «С» >5 CНΞС-СН 2 -СН 3 СНΞС-СН –СН 3 бутин-1 СН 3 3 -метилбутин-1 Положения тройной (кратной) связи СНΞС-СН 2 -СН 3 -СΞС-СН 3 бутин-1 бутин-2 Классов соединений (алкадиены) СНΞС-СН 2 -СН 3 СН 2=СН-СН=СН 2 бутин-1 бутадиен-1, 3 Пространственной изомерии нет
 Номенклатура АН → ИН Выбор главной цепи и начало нумерации определяется тройной связью Правила составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов.
Номенклатура АН → ИН Выбор главной цепи и начало нумерации определяется тройной связью Правила составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов.
 Химические свойства алкинов Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, алкины могут вступать в реакции двойного присоединения (присоединять 2 молекулы реагента по тройной связи). Присоединение несимметричных реагентов к несимметричным алкинам происходит по правилу Марковникова.
Химические свойства алкинов Алкины во многих реакциях обладают большей реакционной способностью, чем алкены. Для алкинов, как и для алкенов, характерны реакции присоединения. Так как тройная связь содержит две π-связи, алкины могут вступать в реакции двойного присоединения (присоединять 2 молекулы реагента по тройной связи). Присоединение несимметричных реагентов к несимметричным алкинам происходит по правилу Марковникова.
 Реакции присоединения: 1. Присоединение водорода (гидрирование) На I ступени образуются алкены, на II cтупени - алканы: С 2 H 2 + Н 2 → СН 2=СН 2 (кат. Pt, Pd, Ni, t=150) CН 2=СН 2 +Н 2→СН 3 -СН 3 Суммарное уравнение: С 2 Н 2+2 Н 2 →СН 3 -СН 3 2. Присоединение галогенов (галогенирование) На I ступени образуются дигалогеналкены, на II - тетрагалогеналканы: С 4 Н 6 + Br 2 → CНBr=СBr -СН 2 -СН 3 бутин-1 1, 2 -дибромбутен-1 СНBr=СBr-СН 2 -СН 3 + Br 2 → CHBr 2 -CH 3 1, 1, 2, 2 -тетрабромбутан Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается.
Реакции присоединения: 1. Присоединение водорода (гидрирование) На I ступени образуются алкены, на II cтупени - алканы: С 2 H 2 + Н 2 → СН 2=СН 2 (кат. Pt, Pd, Ni, t=150) CН 2=СН 2 +Н 2→СН 3 -СН 3 Суммарное уравнение: С 2 Н 2+2 Н 2 →СН 3 -СН 3 2. Присоединение галогенов (галогенирование) На I ступени образуются дигалогеналкены, на II - тетрагалогеналканы: С 4 Н 6 + Br 2 → CНBr=СBr -СН 2 -СН 3 бутин-1 1, 2 -дибромбутен-1 СНBr=СBr-СН 2 -СН 3 + Br 2 → CHBr 2 -CH 3 1, 1, 2, 2 -тетрабромбутан Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается.
 3. Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются моногалогеналкены, на II –дигалогеналканы (кат. Cu, Hg) : С 2 Н 2 + НCl → CH 2=CHCl + HCl → CH 3 -CHCl 2 хлорэтен 1, 1 -дихлорэтан 4. Присоединение воды (гидратация) Происходит по правилу Марковникова. Ацетилен образует альдегид, его гомологи – кетоны (реакция М. Г. Кучерова, кат. Hg): С 2 Н 2 + НОН→ СН 3 -СНО этаналь С 3 Н 4 + НОН→ СН 3 -С-СН 3 О пропанон (ацетон)
3. Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются моногалогеналкены, на II –дигалогеналканы (кат. Cu, Hg) : С 2 Н 2 + НCl → CH 2=CHCl + HCl → CH 3 -CHCl 2 хлорэтен 1, 1 -дихлорэтан 4. Присоединение воды (гидратация) Происходит по правилу Марковникова. Ацетилен образует альдегид, его гомологи – кетоны (реакция М. Г. Кучерова, кат. Hg): С 2 Н 2 + НОН→ СН 3 -СНО этаналь С 3 Н 4 + НОН→ СН 3 -С-СН 3 О пропанон (ацетон)
 Реакция с KMn. O 4 является качественной реакцией на алкины. Раствор KMn. O 4 обесцвечивается.
Реакция с KMn. O 4 является качественной реакцией на алкины. Раствор KMn. O 4 обесцвечивается.
 III. Реакции полимеризации. Очень длинные цепи молекулы ацетилена полимеризуются с трудом, а вот несколько молекул (от двух до пяти ) соединяются друг с другом относительно легко. Впервые подобную реакцию в 1866 г. Осуществил М. Бертло. При нагревании ацетилена до 600 о. С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Николай Дмитриевич Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). С тех пор эта реакция носит имя Н. Д. Зелинского. 3 С 2 Н 2 → С 6 Н 6 бензол
III. Реакции полимеризации. Очень длинные цепи молекулы ацетилена полимеризуются с трудом, а вот несколько молекул (от двух до пяти ) соединяются друг с другом относительно легко. Впервые подобную реакцию в 1866 г. Осуществил М. Бертло. При нагревании ацетилена до 600 о. С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Николай Дмитриевич Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). С тех пор эта реакция носит имя Н. Д. Зелинского. 3 С 2 Н 2 → С 6 Н 6 бензол
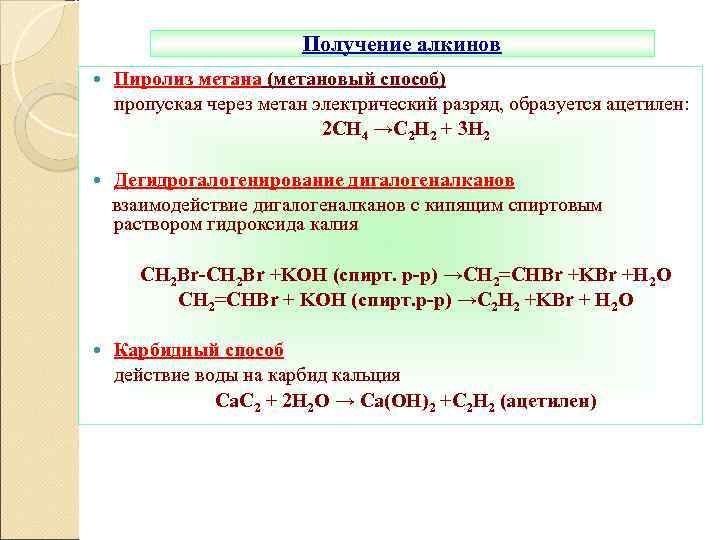 Получение алкинов Пиролиз метана (метановый способ) пропуская через метан электрический разряд, образуется ацетилен: 2 СН 4 →С 2 Н 2 + 3 Н 2 Дегидрогалогенирование дигалогеналканов взаимодействие дигалогеналканов с кипящим спиртовым раствором гидроксида калия СН 2 Br-CH 2 Br +KOH (спирт. р-р) →CH 2=CHBr +KBr +H 2 O CH 2=CHBr + KOH (спирт. р-р) →С 2 Н 2 +KBr + H 2 O Карбидный способ действие воды на карбид кальция Ca. C 2 + 2 H 2 O → Ca(OH)2 +C 2 H 2 (ацетилен)
Получение алкинов Пиролиз метана (метановый способ) пропуская через метан электрический разряд, образуется ацетилен: 2 СН 4 →С 2 Н 2 + 3 Н 2 Дегидрогалогенирование дигалогеналканов взаимодействие дигалогеналканов с кипящим спиртовым раствором гидроксида калия СН 2 Br-CH 2 Br +KOH (спирт. р-р) →CH 2=CHBr +KBr +H 2 O CH 2=CHBr + KOH (спирт. р-р) →С 2 Н 2 +KBr + H 2 O Карбидный способ действие воды на карбид кальция Ca. C 2 + 2 H 2 O → Ca(OH)2 +C 2 H 2 (ацетилен)
