Коллоидная химия.ppt
- Количество слайдов: 187
 ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция 9. Коллоидные растворы (часть 1) 1. Основные понятия. Классификация дисперсных систем. 2. Методы получения коллоидных растворов. 3. Методы очистки коллоидных растворов. 4. Строение мицеллы гидрофобных систем. 5. Электрокинетический потенциал. Изоэлектрическое состояние мицеллы. 6. Электрические свойства коллоидных растворов. Лектор: Ирина Петровна Степанова, доктор биологических наук, профессор, зав. кафедрой химии
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция 9. Коллоидные растворы (часть 1) 1. Основные понятия. Классификация дисперсных систем. 2. Методы получения коллоидных растворов. 3. Методы очистки коллоидных растворов. 4. Строение мицеллы гидрофобных систем. 5. Электрокинетический потенциал. Изоэлектрическое состояние мицеллы. 6. Электрические свойства коллоидных растворов. Лектор: Ирина Петровна Степанова, доктор биологических наук, профессор, зав. кафедрой химии
 Коллоидная химия ( «коллоид» – от греческого κόλλα – клей) – наука, изучающая физико-химические свойства гетерогенных высокодисперсных систем и ВМВ в твердом состоянии и в растворах. Коллоидный раствор золота (экспонат музея Фарадея в Королевском институте)
Коллоидная химия ( «коллоид» – от греческого κόλλα – клей) – наука, изучающая физико-химические свойства гетерогенных высокодисперсных систем и ВМВ в твердом состоянии и в растворах. Коллоидный раствор золота (экспонат музея Фарадея в Королевском институте)
 История развития коллоидной химии Томас Грэм (Грэхэм) английский/шотладский химик впервые использовал термин «коллоид» для описания растворов с необычными свойствами. В развитие этой науки внесли вклад Т. Юнг, П. Лаплас, Д. Гиббс, Г. Гельмгольц, Д. Рэлей И. Ленгмюр и др. Т. Грэм (1805 -1869)
История развития коллоидной химии Томас Грэм (Грэхэм) английский/шотладский химик впервые использовал термин «коллоид» для описания растворов с необычными свойствами. В развитие этой науки внесли вклад Т. Юнг, П. Лаплас, Д. Гиббс, Г. Гельмгольц, Д. Рэлей И. Ленгмюр и др. Т. Грэм (1805 -1869)
 История развития коллоидной химии Николай Петрович Песков основатель современной коллоидной химии как науки о поверхностных явлениях и дисперсных системах. Ввел понятие об агрегативной и седиментационной устойчивости дисперсных систем. Н. П. Песков (1880 -1940)
История развития коллоидной химии Николай Петрович Песков основатель современной коллоидной химии как науки о поверхностных явлениях и дисперсных системах. Ввел понятие об агрегативной и седиментационной устойчивости дисперсных систем. Н. П. Песков (1880 -1940)



 .
.
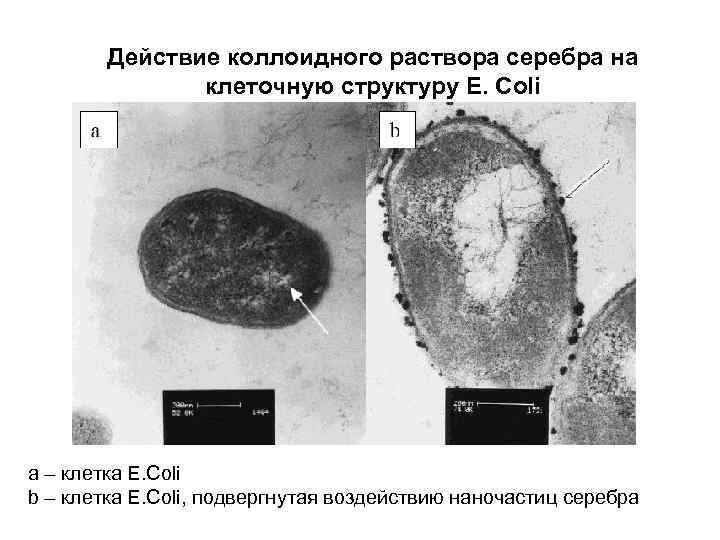 Действие коллоидного раствора серебра на клеточную структуру E. Coli a – клетка E. Coli b – клетка E. Coli, подвергнутая воздействию наночастиц серебра
Действие коллоидного раствора серебра на клеточную структуру E. Coli a – клетка E. Coli b – клетка E. Coli, подвергнутая воздействию наночастиц серебра
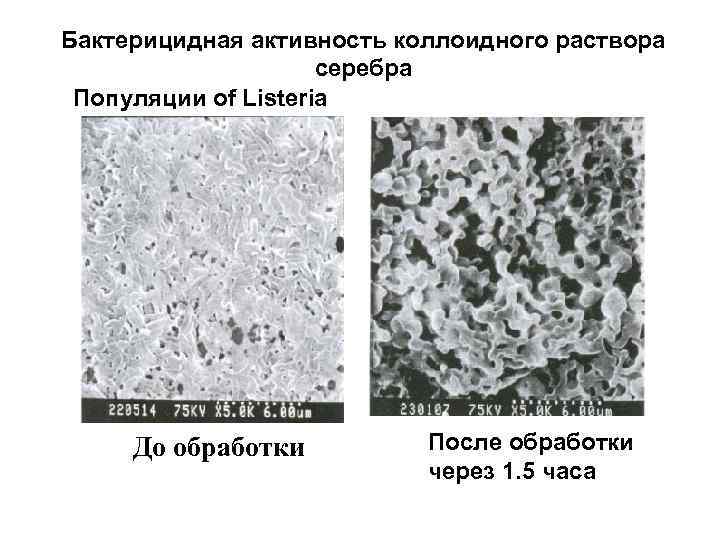 Бактерицидная активность коллоидного раствора серебра Популяции of Listeria До обработки После обработки через 1. 5 часа
Бактерицидная активность коллоидного раствора серебра Популяции of Listeria До обработки После обработки через 1. 5 часа
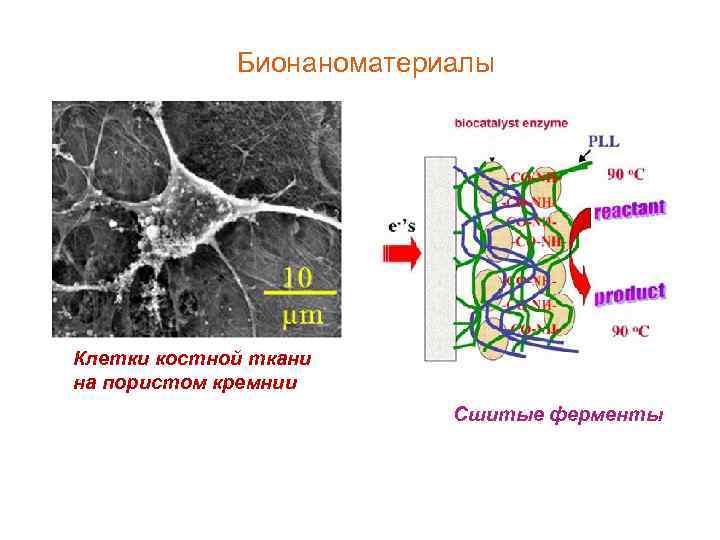 Бионаноматериалы Клетки костной ткани на пористом кремнии Сшитые ферменты
Бионаноматериалы Клетки костной ткани на пористом кремнии Сшитые ферменты
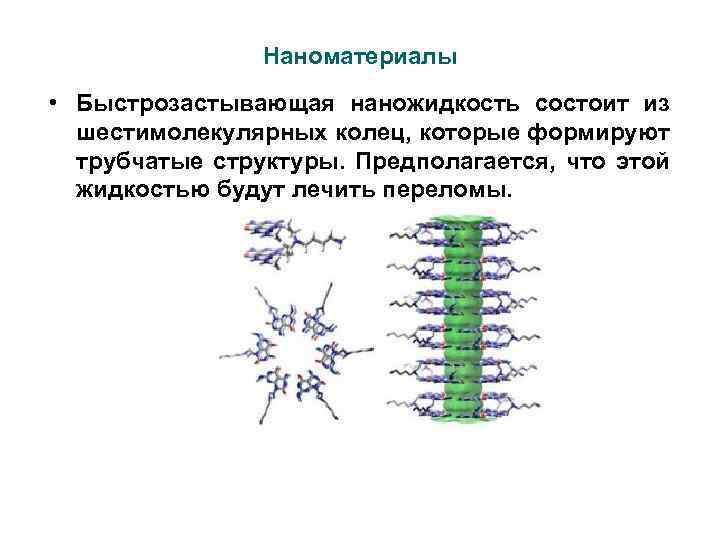 Наноматериалы • Быстрозастывающая наножидкость состоит из шестимолекулярных колец, которые формируют трубчатые структуры. Предполагается, что этой жидкостью будут лечить переломы.
Наноматериалы • Быстрозастывающая наножидкость состоит из шестимолекулярных колец, которые формируют трубчатые структуры. Предполагается, что этой жидкостью будут лечить переломы.
 Основные понятия • Два общих признака дисперсных систем: гетерогенность и дисперсность. • Дисперсной системой называется система, в которой одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества.
Основные понятия • Два общих признака дисперсных систем: гетерогенность и дисперсность. • Дисперсной системой называется система, в которой одно вещество в более или менее раздробленном (дисперсном) состоянии равномерно распределено в массе другого вещества.
 Классификация дисперсных систем • Дисперсная фаза (ДФ) представляет собой частицы, а дисперсионная среда (ДСр) - сплошная среда, в которой находится раздробленая дисперсная фаза. Степень дисперсности (δ) определяется величиной, обратной диаметру частиц (d): δ = 1/ d.
Классификация дисперсных систем • Дисперсная фаза (ДФ) представляет собой частицы, а дисперсионная среда (ДСр) - сплошная среда, в которой находится раздробленая дисперсная фаза. Степень дисперсности (δ) определяется величиной, обратной диаметру частиц (d): δ = 1/ d.
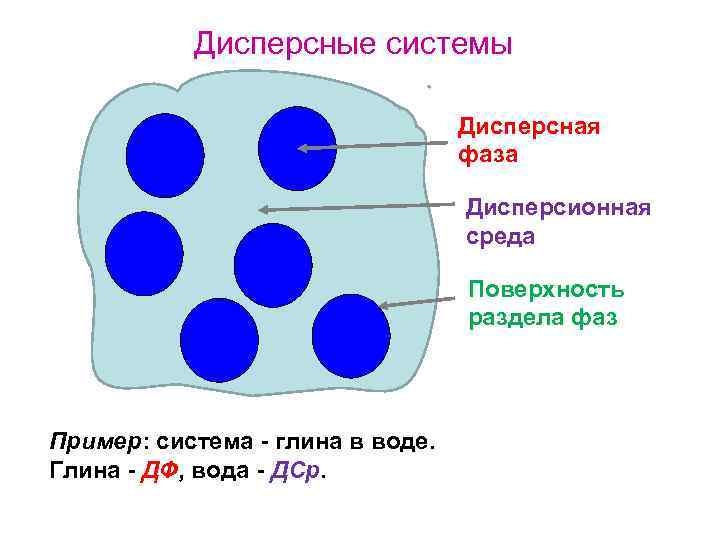 Дисперсные системы Дисперсная фаза Дисперсионная среда Поверхность раздела фаз Пример: система - глина в воде. Глина - ДФ, вода - ДСр.
Дисперсные системы Дисперсная фаза Дисперсионная среда Поверхность раздела фаз Пример: система - глина в воде. Глина - ДФ, вода - ДСр.
 Коллоидные системы Коллоидный раствор серебра
Коллоидные системы Коллоидный раствор серебра
 Pedagogy innovatio. Формы дисперсной фазы n of using ICT is a continuum from using ICT to reinforce existing teaching …
Pedagogy innovatio. Формы дисперсной фазы n of using ICT is a continuum from using ICT to reinforce existing teaching …
 Формы дисперсной фазы n
Формы дисперсной фазы n
 Классификация По степени дисперсности дисперсные системы классифицируют на: 1. Грубодисперсные (d ˃ 10 -5 см). 2. Коллоидно-дисперсные (10 -7 ˂ d ˂ 10 -5 см). 3. Молекулярно-дисперсные (истинные растворы) (d ˂ 10 -7 см).
Классификация По степени дисперсности дисперсные системы классифицируют на: 1. Грубодисперсные (d ˃ 10 -5 см). 2. Коллоидно-дисперсные (10 -7 ˂ d ˂ 10 -5 см). 3. Молекулярно-дисперсные (истинные растворы) (d ˂ 10 -7 см).
 Классификация дисперсных систем d ˂ 10 -7 см Истинный раствор d: 10 -5 – 10 -7 см d ˃ 10 -5 см Коллоидный раствор Суспензия
Классификация дисперсных систем d ˂ 10 -7 см Истинный раствор d: 10 -5 – 10 -7 см d ˃ 10 -5 см Коллоидный раствор Суспензия
 Классификация дисперсных систем • Грубодисперсные (d ˃ 10 -5 см) – не проходят через тонкие бумажные фильтры, быстро оседают, видимы в обычный микроскоп. • Коллоидно-дисперсные (10 -7 ˂ d ˂ 10 -5 см) – проходят через бумажные фильтры, но задерживаются на ультрафильтрах, видимы в ультрамикроскоп. Структурной единицей является мицелла. • Молекулярно-дисперсные (истинные растворы) (d ˂ 10 -7 см) – дискретными единицами в них являются молекулы или ионы. Образуются самопроизвольно.
Классификация дисперсных систем • Грубодисперсные (d ˃ 10 -5 см) – не проходят через тонкие бумажные фильтры, быстро оседают, видимы в обычный микроскоп. • Коллоидно-дисперсные (10 -7 ˂ d ˂ 10 -5 см) – проходят через бумажные фильтры, но задерживаются на ультрафильтрах, видимы в ультрамикроскоп. Структурной единицей является мицелла. • Молекулярно-дисперсные (истинные растворы) (d ˂ 10 -7 см) – дискретными единицами в них являются молекулы или ионы. Образуются самопроизвольно.
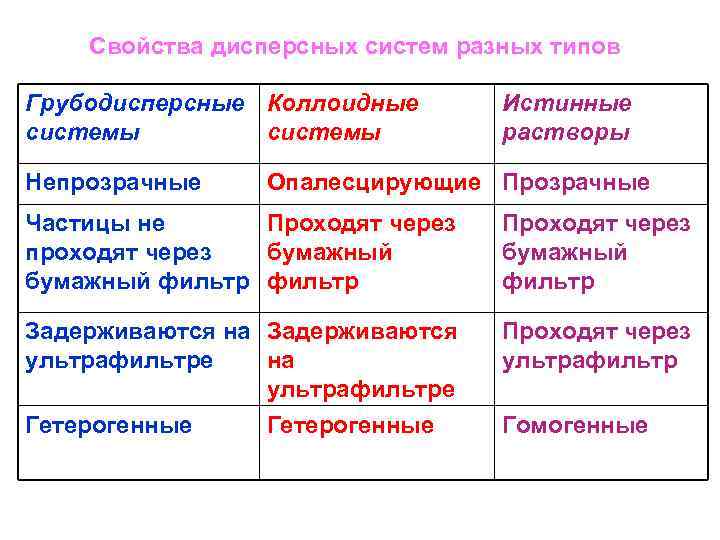 Свойства дисперсных систем разных типов Грубодисперсные Коллоидные системы Непрозрачные Истинные растворы Опалесцирующие Прозрачные Частицы не Проходят через проходят через бумажный фильтр Проходят через бумажный фильтр Задерживаются на Задерживаются ультрафильтре на ультрафильтре Гетерогенные Проходят через ультрафильтр Гомогенные
Свойства дисперсных систем разных типов Грубодисперсные Коллоидные системы Непрозрачные Истинные растворы Опалесцирующие Прозрачные Частицы не Проходят через проходят через бумажный фильтр Проходят через бумажный фильтр Задерживаются на Задерживаются ультрафильтре на ультрафильтре Гетерогенные Проходят через ультрафильтр Гомогенные
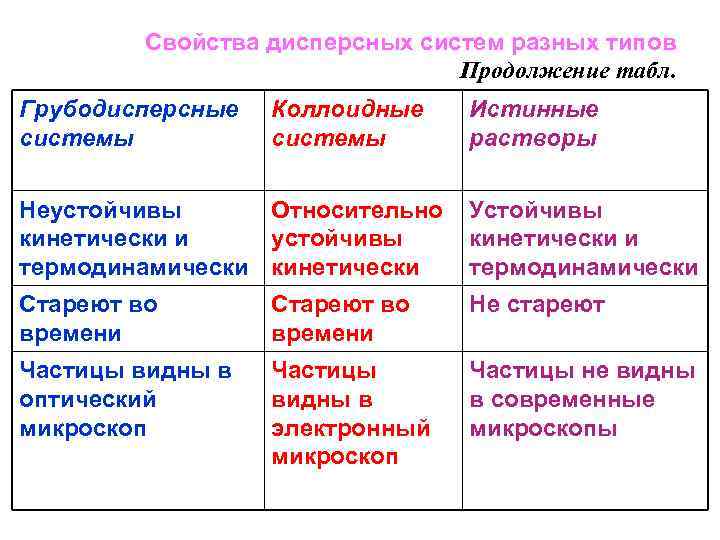 Свойства дисперсных систем разных типов Продолжение табл. Грубодисперсные системы Коллоидные системы Истинные растворы Неустойчивы Относительно кинетически и устойчивы термодинамически кинетически Устойчивы кинетически и термодинамически Стареют во времени Не стареют Частицы видны в оптический микроскоп Частицы видны в электронный микроскоп Частицы не видны в современные микроскопы
Свойства дисперсных систем разных типов Продолжение табл. Грубодисперсные системы Коллоидные системы Истинные растворы Неустойчивы Относительно кинетически и устойчивы термодинамически кинетически Устойчивы кинетически и термодинамически Стареют во времени Не стареют Частицы видны в оптический микроскоп Частицы видны в электронный микроскоп Частицы не видны в современные микроскопы
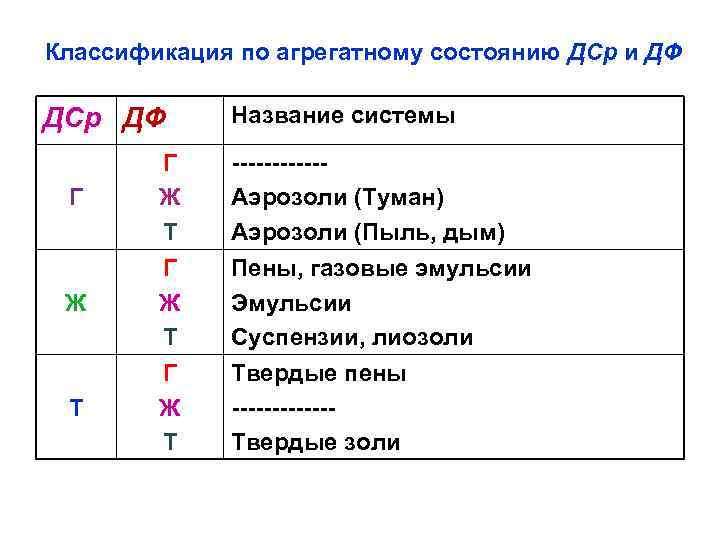 Классификация по агрегатному состоянию ДСр и ДФ ДСр ДФ Название системы Г Г Ж Т ------Аэрозоли (Туман) Аэрозоли (Пыль, дым) Ж Г Ж Т Пены, газовые эмульсии Эмульсии Суспензии, лиозоли Т Г Ж Т Твердые пены ------Твердые золи
Классификация по агрегатному состоянию ДСр и ДФ ДСр ДФ Название системы Г Г Ж Т ------Аэрозоли (Туман) Аэрозоли (Пыль, дым) Ж Г Ж Т Пены, газовые эмульсии Эмульсии Суспензии, лиозоли Т Г Ж Т Твердые пены ------Твердые золи
 Суспензия
Суспензия
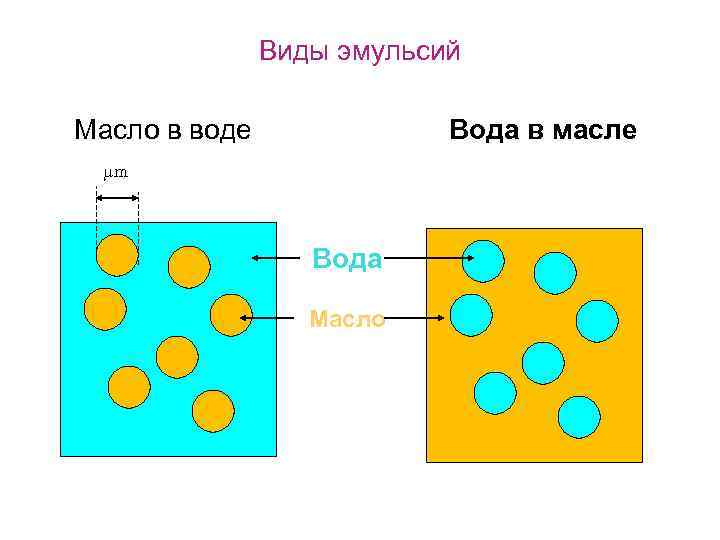 Виды эмульсий Масло в воде Вода в масле mm Вода Масло
Виды эмульсий Масло в воде Вода в масле mm Вода Масло
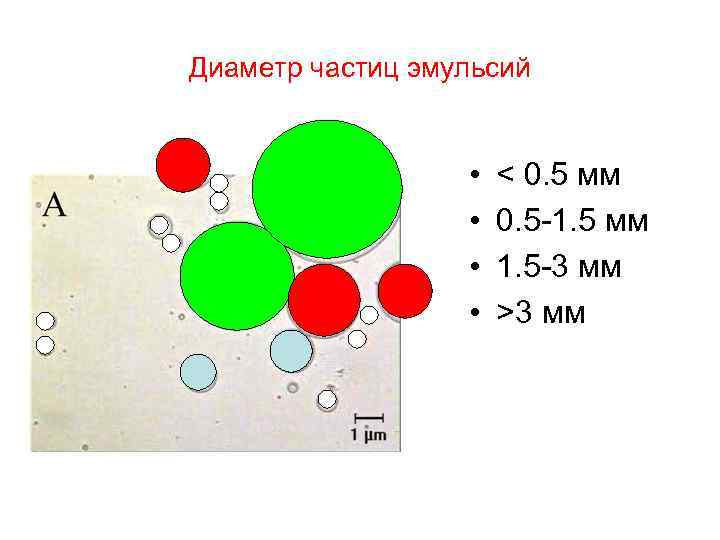 Диаметр частиц эмульсий • • < 0. 5 мм 0. 5 -1. 5 мм 1. 5 -3 мм >3 мм
Диаметр частиц эмульсий • • < 0. 5 мм 0. 5 -1. 5 мм 1. 5 -3 мм >3 мм
 Эмульсии
Эмульсии
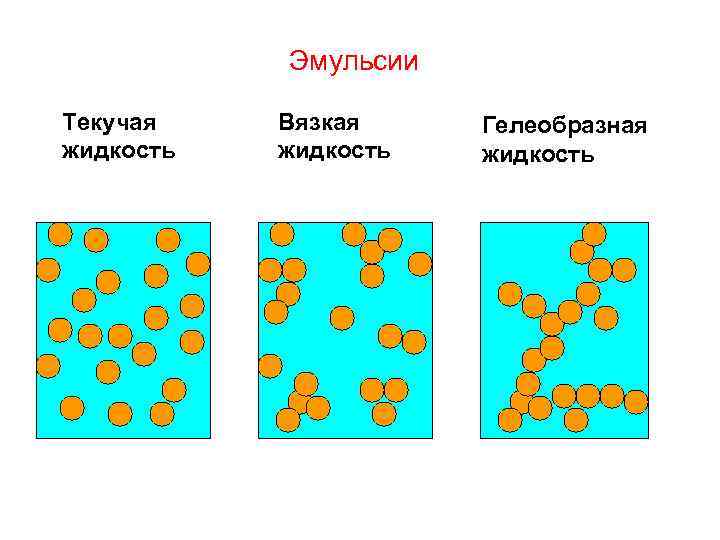 Эмульсии Текучая жидкость Вязкая жидкость Гелеобразная жидкость
Эмульсии Текучая жидкость Вязкая жидкость Гелеобразная жидкость
 Эмульсии
Эмульсии
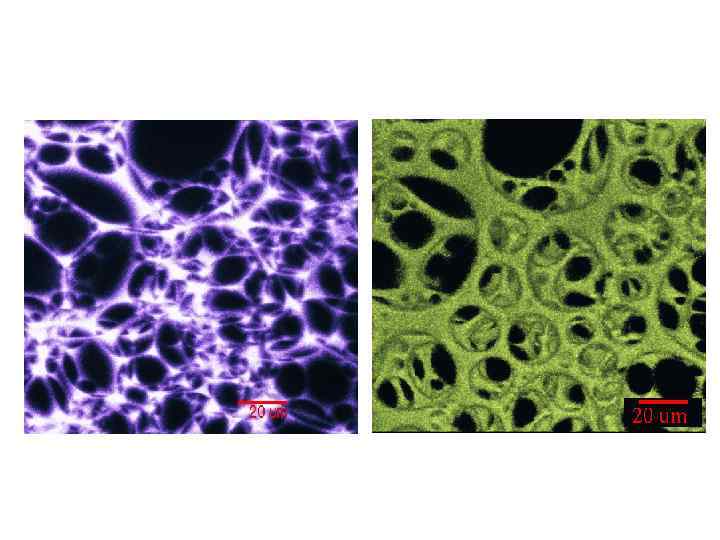
 Пена
Пена
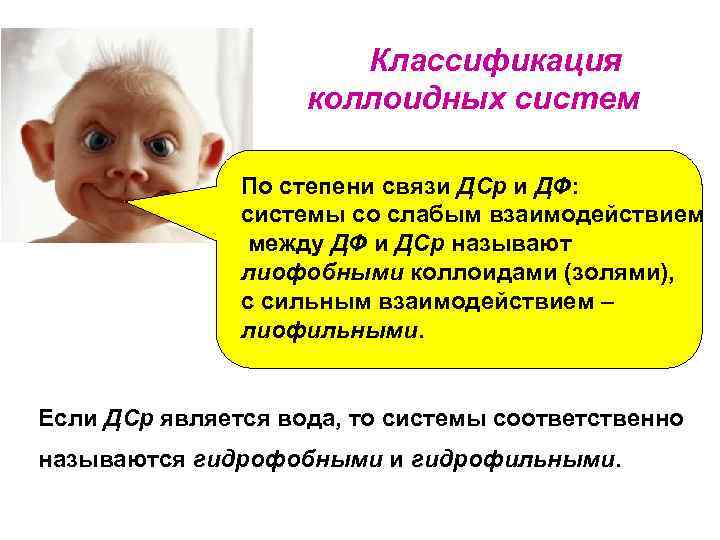 Классификация коллоидных систем По степени связи ДСр и ДФ: системы со слабым взаимодействием между ДФ и ДСр называют лиофобными коллоидами (золями), с сильным взаимодействием – лиофильными. Если ДСр является вода, то системы соответственно называются гидрофобными и гидрофильными.
Классификация коллоидных систем По степени связи ДСр и ДФ: системы со слабым взаимодействием между ДФ и ДСр называют лиофобными коллоидами (золями), с сильным взаимодействием – лиофильными. Если ДСр является вода, то системы соответственно называются гидрофобными и гидрофильными.
 Золи и гели Кровь Сухожилия
Золи и гели Кровь Сухожилия
 Классификация дисперсных систем • Золь – бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют между собой и свободно передвигаются друг относительно друга (например, золь серебра – колларгол). • По внешнему виду золи напоминают истинные растворы.
Классификация дисперсных систем • Золь – бесструктурный коллоидный раствор, в котором частицы ДФ слабо взаимодействуют между собой и свободно передвигаются друг относительно друга (например, золь серебра – колларгол). • По внешнему виду золи напоминают истинные растворы.
 Классификация дисперсных систем • Гель – структурированный коллоидный раствор, в котором частицы ДФ связаны между собой в пространственные структуры типа каркасов. • В них коллоидные частицы малоподвижны и способны совершать только колебательные движения. По внешнему виду гели желеобразны (например, зубная паста Blend-a-med).
Классификация дисперсных систем • Гель – структурированный коллоидный раствор, в котором частицы ДФ связаны между собой в пространственные структуры типа каркасов. • В них коллоидные частицы малоподвижны и способны совершать только колебательные движения. По внешнему виду гели желеобразны (например, зубная паста Blend-a-med).
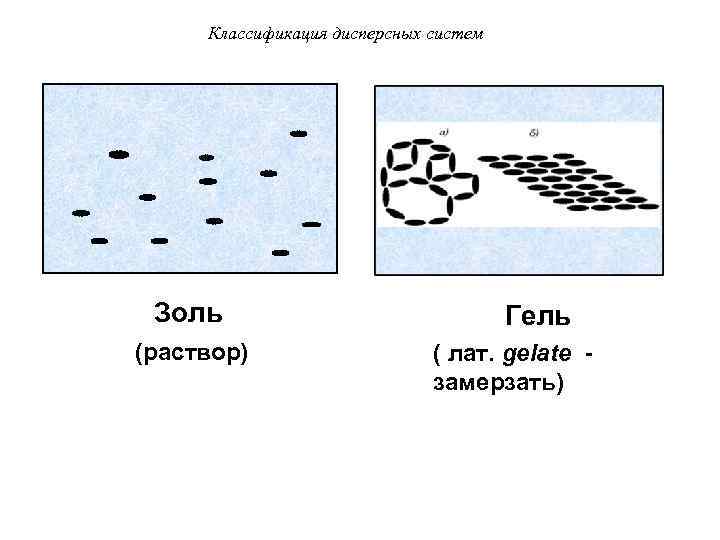 Классификация дисперсных систем Золь (раствор) Гель ( лат. gelate замерзать)
Классификация дисперсных систем Золь (раствор) Гель ( лат. gelate замерзать)
 Методы получения коллоидных растворов По способу достижения коллоидной степени дисперсности различают диспергационные и конденсационные методы получения.
Методы получения коллоидных растворов По способу достижения коллоидной степени дисперсности различают диспергационные и конденсационные методы получения.
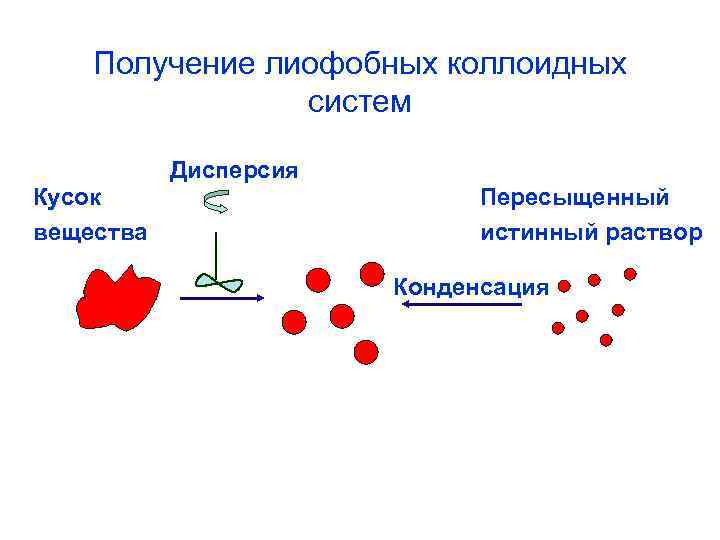 Получение лиофобных коллоидных систем Дисперсия Кусок вещества Пересыщенный истинный раствор Конденсация
Получение лиофобных коллоидных систем Дисперсия Кусок вещества Пересыщенный истинный раствор Конденсация
 Методы получения коллоидных растворов Методы диспергирования (от лат. – измельчать) – получение частиц ДФ путем дробления крупных частиц на более мелкие. Применяют: • механическое дробление (с помощью шаровых или коллоидных мельниц) • ультразвуковое (под действием ультразвука) • электрическое (при использовании электродов).
Методы получения коллоидных растворов Методы диспергирования (от лат. – измельчать) – получение частиц ДФ путем дробления крупных частиц на более мелкие. Применяют: • механическое дробление (с помощью шаровых или коллоидных мельниц) • ультразвуковое (под действием ультразвука) • электрическое (при использовании электродов).
 Методы диспергирования Коллоидная мельница
Методы диспергирования Коллоидная мельница
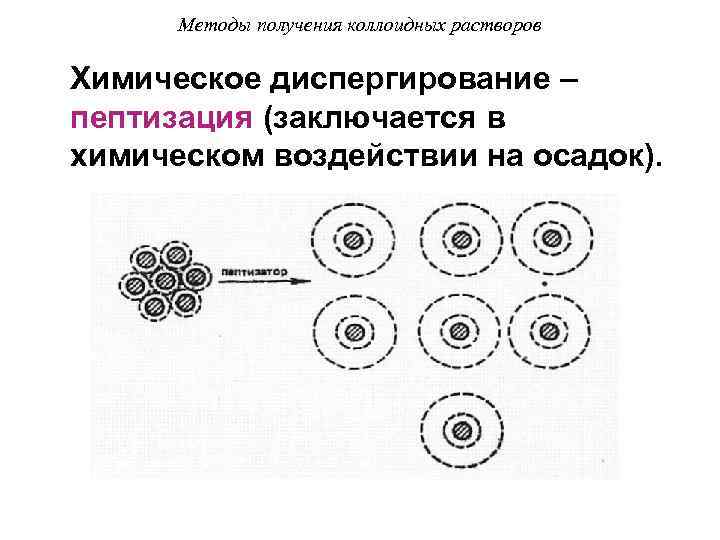 Методы получения коллоидных растворов Химическое диспергирование – пептизация (заключается в химическом воздействии на осадок).
Методы получения коллоидных растворов Химическое диспергирование – пептизация (заключается в химическом воздействии на осадок).
 Методы получения коллоидных растворов • Конденсационные методы (от лат. – укрупнять) – получение частиц ДФ путем объединения атомов, молекул, ионов. • Различают физическую и химическую конденсацию.
Методы получения коллоидных растворов • Конденсационные методы (от лат. – укрупнять) – получение частиц ДФ путем объединения атомов, молекул, ионов. • Различают физическую и химическую конденсацию.
 Методы получения коллоидных растворов • Физическая конденсация – это метод замены растворителя. • Сначала готовят истинный раствор вещества в летучем растворителе (например, канифоль в спирте) и добавляют к жидкости, в которой вещество нерастворимо (вода). • В результате происходит резкое понижение растворимости и молекулы вещества конденсируются в частицы коллоидных размеров.
Методы получения коллоидных растворов • Физическая конденсация – это метод замены растворителя. • Сначала готовят истинный раствор вещества в летучем растворителе (например, канифоль в спирте) и добавляют к жидкости, в которой вещество нерастворимо (вода). • В результате происходит резкое понижение растворимости и молекулы вещества конденсируются в частицы коллоидных размеров.
 Методы получения коллоидных растворов • Химическая конденсация – для получения коллоидных растворов используют любые реакции, в результате которых образуются малорастворимые соединения (реакции обмена, гидролиза, восстановления и др. ).
Методы получения коллоидных растворов • Химическая конденсация – для получения коллоидных растворов используют любые реакции, в результате которых образуются малорастворимые соединения (реакции обмена, гидролиза, восстановления и др. ).
 Методы очистки коллоидных растворов Коллоидные растворы, как и истинные, хорошо фильтруются через бумажный пористый фильтр, но, в отличие от истинных, не проходят через полупроницаемые мембраны. На этом основана очистка коллоидных растворов от низкомолекулярных веществ (диализ, фильтрация, ультрацентрифугирование).
Методы очистки коллоидных растворов Коллоидные растворы, как и истинные, хорошо фильтруются через бумажный пористый фильтр, но, в отличие от истинных, не проходят через полупроницаемые мембраны. На этом основана очистка коллоидных растворов от низкомолекулярных веществ (диализ, фильтрация, ультрацентрифугирование).
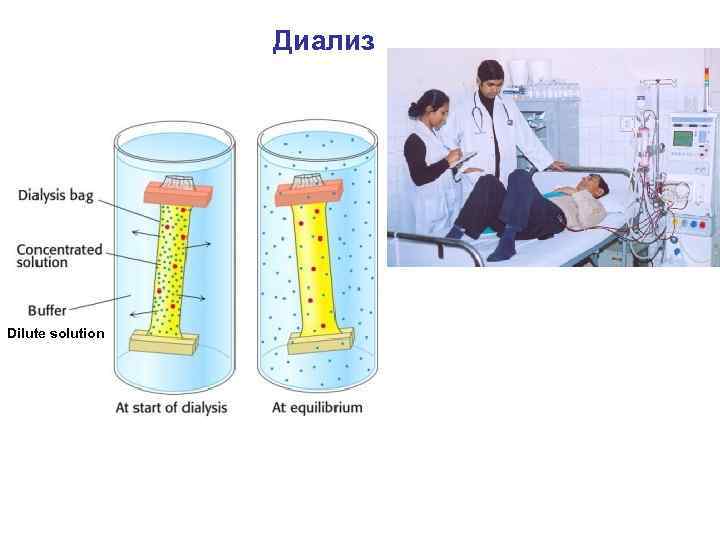
 Диализ • Диализ проводят с помощью прибора диализатора. Он состоит из 2 сосудов, отделенных полупроницаемой мембраной, способной пропускать молекулы и ионы низкомолекулярных веществ. • Во внутренний сосуд наливается раствор золя, во внешнем – циркулирует вода. Примеси удаляются через мембрану из раствора золя в растворитель. • Для ускорения процесса применяют электродиализ.
Диализ • Диализ проводят с помощью прибора диализатора. Он состоит из 2 сосудов, отделенных полупроницаемой мембраной, способной пропускать молекулы и ионы низкомолекулярных веществ. • Во внутренний сосуд наливается раствор золя, во внешнем – циркулирует вода. Примеси удаляются через мембрану из раствора золя в растворитель. • Для ускорения процесса применяют электродиализ.
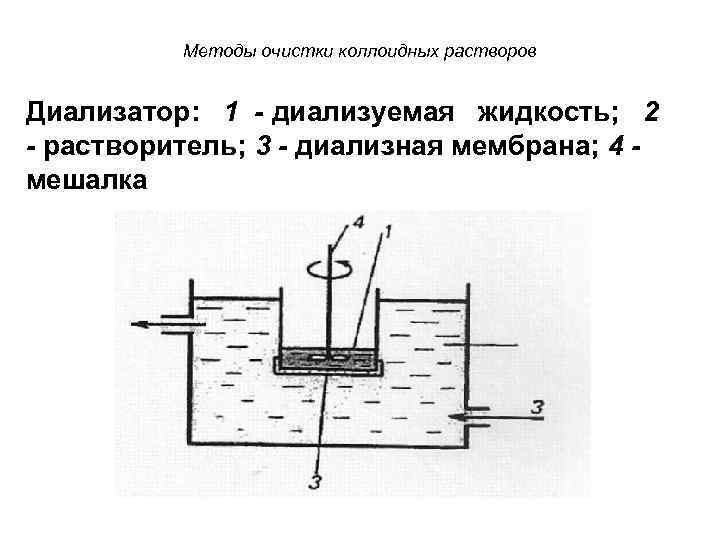 Методы очистки коллоидных растворов Диализатор: 1 - диализуемая жидкость; 2 - растворитель; 3 - диализная мембрана; 4 мешалка
Методы очистки коллоидных растворов Диализатор: 1 - диализуемая жидкость; 2 - растворитель; 3 - диализная мембрана; 4 мешалка
 Диализ
Диализ
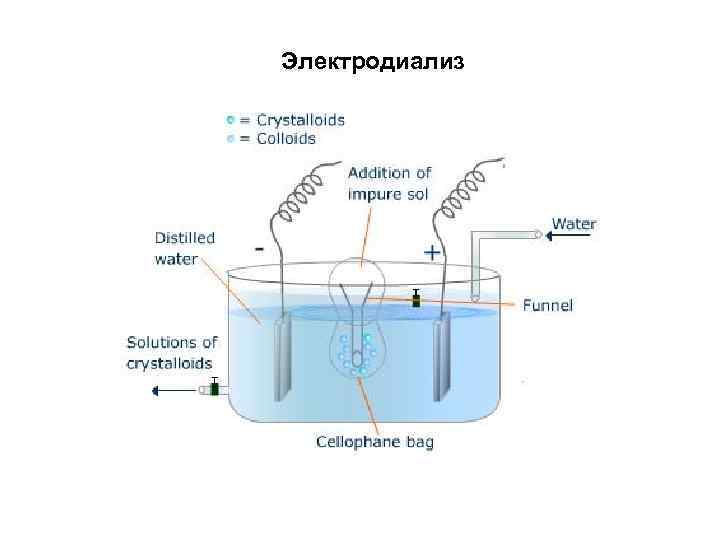 Электродиализ
Электродиализ
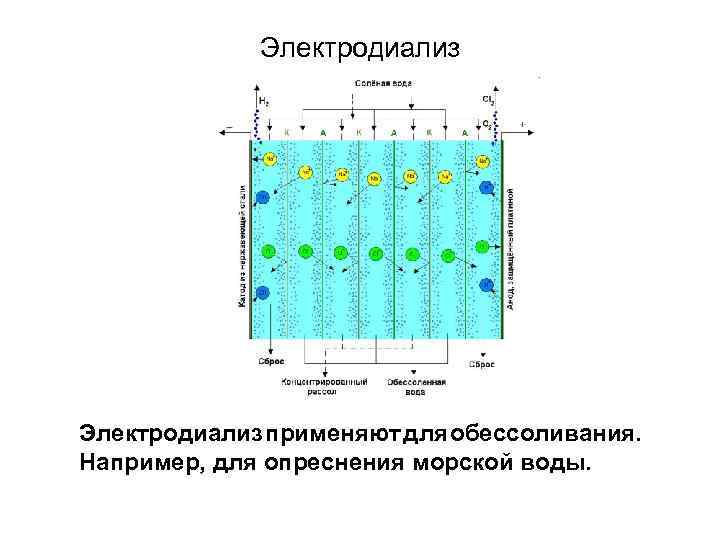 Электродиализ применяют для обессоливания. Например, для опреснения морской воды.
Электродиализ применяют для обессоливания. Например, для опреснения морской воды.
 Диализ • По принципу компенсационного диализа работает аппарат «искусственная почка» . • Аппарат подключают к системе кровообращения больного, кровь под давлением протекает между двумя мембранами, омываемыми снаружи физраствором. • При этом токсичные вещества крови вымываются в физраствор, что способствует очищению крови.
Диализ • По принципу компенсационного диализа работает аппарат «искусственная почка» . • Аппарат подключают к системе кровообращения больного, кровь под давлением протекает между двумя мембранами, омываемыми снаружи физраствором. • При этом токсичные вещества крови вымываются в физраствор, что способствует очищению крови.
 Диализ Dilute solution
Диализ Dilute solution
 Методы очистки коллоидных растворов • Для очистки коллоидных растворов от грубодисперсных частиц проводят фильтрование через обычные бумажные фильтры. Грубодисперсные частицы задерживаются на фильтре. • Для отделения ДФ от ДС, применяют ультрафильтрацию. При этом используют специальные фильтры, не пропускающие коллоидные частицы или макромолекулы. • Как правило, ультрафильтрацию проводят под давлением.
Методы очистки коллоидных растворов • Для очистки коллоидных растворов от грубодисперсных частиц проводят фильтрование через обычные бумажные фильтры. Грубодисперсные частицы задерживаются на фильтре. • Для отделения ДФ от ДС, применяют ультрафильтрацию. При этом используют специальные фильтры, не пропускающие коллоидные частицы или макромолекулы. • Как правило, ультрафильтрацию проводят под давлением.
 Методы очистки коллоидных растворов Прибор для ультрафильтрации: 1 - воронка Бюхнера; 2 - мембрана; 3 - колба Бунзена; 4 - насос
Методы очистки коллоидных растворов Прибор для ультрафильтрации: 1 - воронка Бюхнера; 2 - мембрана; 3 - колба Бунзена; 4 - насос
 Методы очистки коллоидных растворов • Для разделения частиц ДФ, имеющих различную массу, применяют ультрацентрифугирование. • При этом разделение частиц происходит в центробежном поле больших ускорений в центрифугах. Так, разделяют фракции белков.
Методы очистки коллоидных растворов • Для разделения частиц ДФ, имеющих различную массу, применяют ультрацентрифугирование. • При этом разделение частиц происходит в центробежном поле больших ускорений в центрифугах. Так, разделяют фракции белков.
 Строение мицеллы гидрофобных систем В коллоидных системах структурной единицей является мицелла. Строение коллоидных частиц и возникновение на них заряда объясняет мицеллярная теория коллоидных систем.
Строение мицеллы гидрофобных систем В коллоидных системах структурной единицей является мицелла. Строение коллоидных частиц и возникновение на них заряда объясняет мицеллярная теория коллоидных систем.
 Строение мицеллы • Заряд на коллоидных частицах возникает либо за счет ионизации молекул, находящихся на поверхности твердой фазы, либо в результате избирательной адсорбции на твердой фазе.
Строение мицеллы • Заряд на коллоидных частицах возникает либо за счет ионизации молекул, находящихся на поверхности твердой фазы, либо в результате избирательной адсорбции на твердой фазе.
 Строение мицеллы • Рассмотрим второй случай – образование мицеллы Ag. I в KI. Ag. NO 3 + KI (избыток) = Ag. I + KNO 3 • Осадок Ag. I находится в избытке раствора KI. • Избыток электролита выполняет роль стабилизатора.
Строение мицеллы • Рассмотрим второй случай – образование мицеллы Ag. I в KI. Ag. NO 3 + KI (избыток) = Ag. I + KNO 3 • Осадок Ag. I находится в избытке раствора KI. • Избыток электролита выполняет роль стабилизатора.
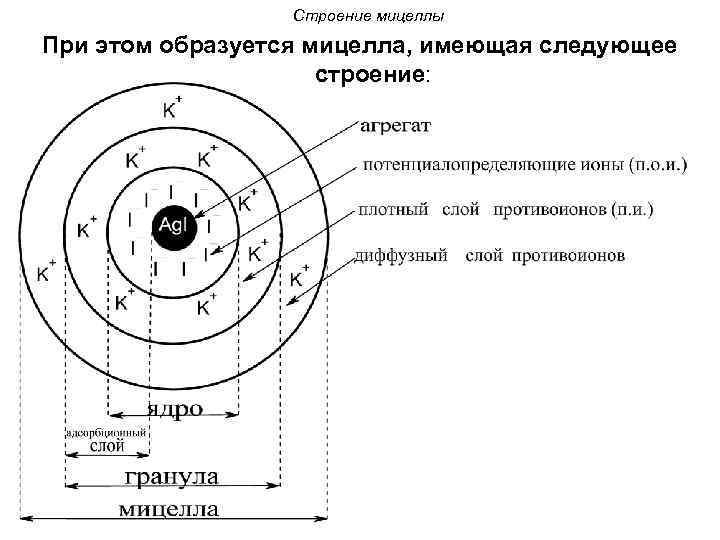 Строение мицеллы При этом образуется мицелла, имеющая следующее строение:
Строение мицеллы При этом образуется мицелла, имеющая следующее строение:
 Строение мицеллы • Осадок Ag. I является агрегатом мицеллы. • На твердой кристаллической поверхности осадка в соответствии с правилом Панета. Фаянса будут адсорбироваться ионы I-, достраивая кристаллическую решетку и сообщая частицам отрицательный заряд. • Ионы I- называются потенциалопределяющими.
Строение мицеллы • Осадок Ag. I является агрегатом мицеллы. • На твердой кристаллической поверхности осадка в соответствии с правилом Панета. Фаянса будут адсорбироваться ионы I-, достраивая кристаллическую решетку и сообщая частицам отрицательный заряд. • Ионы I- называются потенциалопределяющими.
 Строение мицеллы • Агрегат и потенциалопределяющие ионы составляют ядро мицеллы. • К отрицательному заряду будут притягиваться противоионы K+, образуя плотный слой противоионов. • Потенциалопределяющие ионы и противоионы плотного слоя вместе образуют адсорбционный слой.
Строение мицеллы • Агрегат и потенциалопределяющие ионы составляют ядро мицеллы. • К отрицательному заряду будут притягиваться противоионы K+, образуя плотный слой противоионов. • Потенциалопределяющие ионы и противоионы плотного слоя вместе образуют адсорбционный слой.
 Строение мицеллы • Адсорбционный слой вместе с агрегатом составляют гранулу (или частицу). Гранула заряжена, её заряд определятся знаком и величиной заряда потенциалопределяющих ионов. • Часть противоионов, не вошедших в адсорбционный слой, образуют диффузный слой. • Гранула и диффузный слой составляют мицеллу. Мицелла таким образом электронейтральна.
Строение мицеллы • Адсорбционный слой вместе с агрегатом составляют гранулу (или частицу). Гранула заряжена, её заряд определятся знаком и величиной заряда потенциалопределяющих ионов. • Часть противоионов, не вошедших в адсорбционный слой, образуют диффузный слой. • Гранула и диффузный слой составляют мицеллу. Мицелла таким образом электронейтральна.
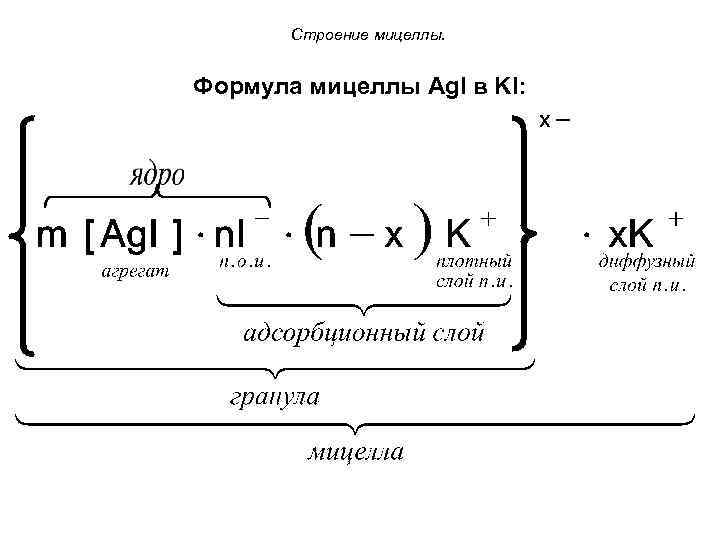 Строение мицеллы. Формула мицеллы Ag. I в KI:
Строение мицеллы. Формула мицеллы Ag. I в KI:
 Строение мицеллы. Ионы стабилизатора, адсорбируясь на поверхности агрегата, образуют ионогенную часть мицеллы, которая по своему строению и свойствам является двойным электрическим слоем (ДЭС). Строение ДЭС мицеллы Ag. I в KI: 1. Стабильная часть ДЭС - потенциалопределяющие ионы. 2. Плотный слой противоионов 3. Диффузный слой противоионов
Строение мицеллы. Ионы стабилизатора, адсорбируясь на поверхности агрегата, образуют ионогенную часть мицеллы, которая по своему строению и свойствам является двойным электрическим слоем (ДЭС). Строение ДЭС мицеллы Ag. I в KI: 1. Стабильная часть ДЭС - потенциалопределяющие ионы. 2. Плотный слой противоионов 3. Диффузный слой противоионов
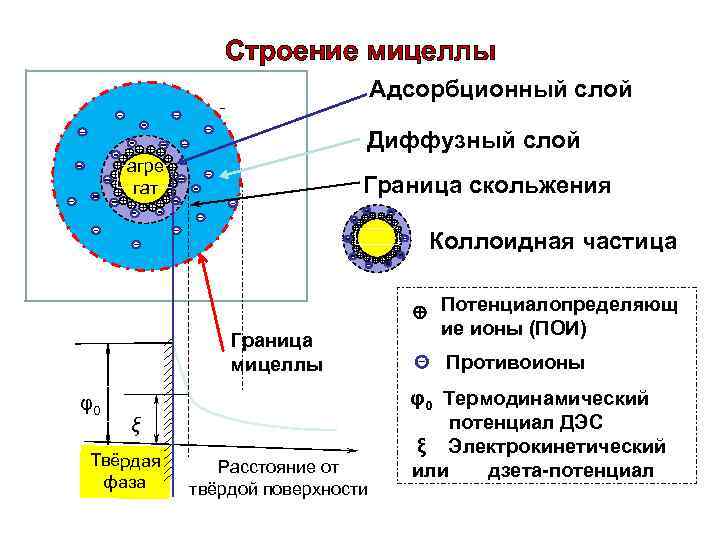
 Электрокинетический потенциал. Электрокинетический потенциал • В мицелле выделяют две границы: • Граница раздела фаз - проходит между потенциалопределяющими ионами и противоионами плотного слоя. • На границе раздела фаз возникает электротермодинамический потенциал мицеллы - Е-потенциал.
Электрокинетический потенциал. Электрокинетический потенциал • В мицелле выделяют две границы: • Граница раздела фаз - проходит между потенциалопределяющими ионами и противоионами плотного слоя. • На границе раздела фаз возникает электротермодинамический потенциал мицеллы - Е-потенциал.
 Электрокинетический потенциал • Граница скольжения - проходит между гранулой и диффузным слоем. • На границе скольжения возникает электрокинетический потенциал или дзета-потенциал. • Дзета-потенциал – ξ- один из основных факторов, определяющих поведение мицеллы в электрическом поле.
Электрокинетический потенциал • Граница скольжения - проходит между гранулой и диффузным слоем. • На границе скольжения возникает электрокинетический потенциал или дзета-потенциал. • Дзета-потенциал – ξ- один из основных факторов, определяющих поведение мицеллы в электрическом поле.
 Строение мицеллы Адсорбционный слой Диффузный слой агре гат Граница скольжения Коллоидная частица Граница мицеллы φ0 ξ Твёрдая фаза Расстояние от твёрдой поверхности Потенциалопределяющ ие ионы (ПОИ) Противоионы φ0 Термодинамический потенциал ДЭС ξ Электрокинетический или дзета-потенциал
Строение мицеллы Адсорбционный слой Диффузный слой агре гат Граница скольжения Коллоидная частица Граница мицеллы φ0 ξ Твёрдая фаза Расстояние от твёрдой поверхности Потенциалопределяющ ие ионы (ПОИ) Противоионы φ0 Термодинамический потенциал ДЭС ξ Электрокинетический или дзета-потенциал
 Электрокинетический потенциал • Название кинетический связано с тем, что его рассчитывают по скорости движения частиц дисперсной фазы при электрофорезе или дисперсионной среды при электроосмосе. • Величина дзета-потенциала определяется толщиной диффузного слоя и зависит от разности между общим числом зарядов потенциалопределяющих ионов и числом зарядов противоионов, находящихся в адсорбционном слое.
Электрокинетический потенциал • Название кинетический связано с тем, что его рассчитывают по скорости движения частиц дисперсной фазы при электрофорезе или дисперсионной среды при электроосмосе. • Величина дзета-потенциала определяется толщиной диффузного слоя и зависит от разности между общим числом зарядов потенциалопределяющих ионов и числом зарядов противоионов, находящихся в адсорбционном слое.
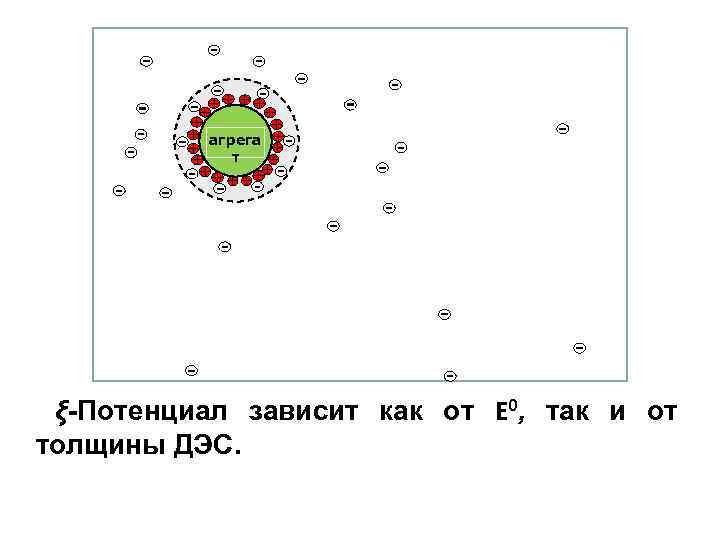 агрега т ξ-Потенциал зависит как от E 0, так и от толщины ДЭС.
агрега т ξ-Потенциал зависит как от E 0, так и от толщины ДЭС.
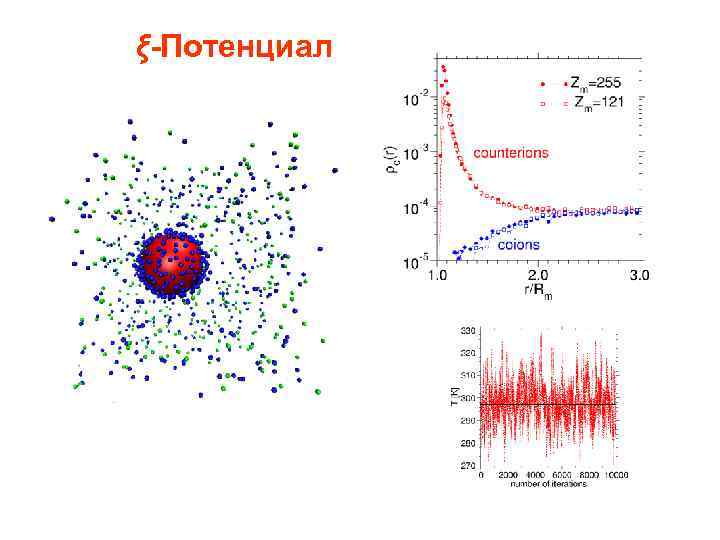 ξ-Потенциал
ξ-Потенциал
 Электрокинетический потенциал. • Чем больше заряд гранулы и, соответственно, величина дзетапотенциала, тем устойчивее коллоидный раствор. • Наличие одноименного заряда способствует отталкиванию частиц друг от друга, препятствуя таким образом их коагуляции (укрупнению) и седиментации (осаждению).
Электрокинетический потенциал. • Чем больше заряд гранулы и, соответственно, величина дзетапотенциала, тем устойчивее коллоидный раствор. • Наличие одноименного заряда способствует отталкиванию частиц друг от друга, препятствуя таким образом их коагуляции (укрупнению) и седиментации (осаждению).
 Изоэлектрическое состояние мицеллы • С увеличением концентрации электролита часть ионов из диффузного слоя может перейти в адсорбционный слой. • Толщина диффузного слоя при этом будет уменьшаться и, следовательно, дзетапотенциал будет уменьшаться. • Если все противоионы перейдут из диффузного слоя в адсорбционный, дзетапотенциал станет равен нулю.
Изоэлектрическое состояние мицеллы • С увеличением концентрации электролита часть ионов из диффузного слоя может перейти в адсорбционный слой. • Толщина диффузного слоя при этом будет уменьшаться и, следовательно, дзетапотенциал будет уменьшаться. • Если все противоионы перейдут из диффузного слоя в адсорбционный, дзетапотенциал станет равен нулю.
 Изоэлектрическое состояние мицеллы • В этом случае говорят об изоэлектрическом состоянии мицеллы, которое характеризуется электронейтральным состоянием гранулы. • В изоэлектрическом состоянии гранула не обладает электрофоретической подвижностью.
Изоэлектрическое состояние мицеллы • В этом случае говорят об изоэлектрическом состоянии мицеллы, которое характеризуется электронейтральным состоянием гранулы. • В изоэлектрическом состоянии гранула не обладает электрофоретической подвижностью.
 Изоэлектрическое состояние мицеллы В изоэлектрическом состоянии коллоидные частицы наименее устойчивы, наиболее склонны к коагуляции и седиментации.
Изоэлектрическое состояние мицеллы В изоэлектрическом состоянии коллоидные частицы наименее устойчивы, наиболее склонны к коагуляции и седиментации.
 Электрические свойства коллоидных растворов • Наличие электрического заряда на коллоидных частицах впервые было установлено Ф. Ф. Рейссом (1807 г. ). • Опыт Рейсса заключался в следующем: В слой влажной глины помещали две стеклянные трубки заполненные водой. В трубки опускали электроды, подключенные к источнику постоянного тока.
Электрические свойства коллоидных растворов • Наличие электрического заряда на коллоидных частицах впервые было установлено Ф. Ф. Рейссом (1807 г. ). • Опыт Рейсса заключался в следующем: В слой влажной глины помещали две стеклянные трубки заполненные водой. В трубки опускали электроды, подключенные к источнику постоянного тока.
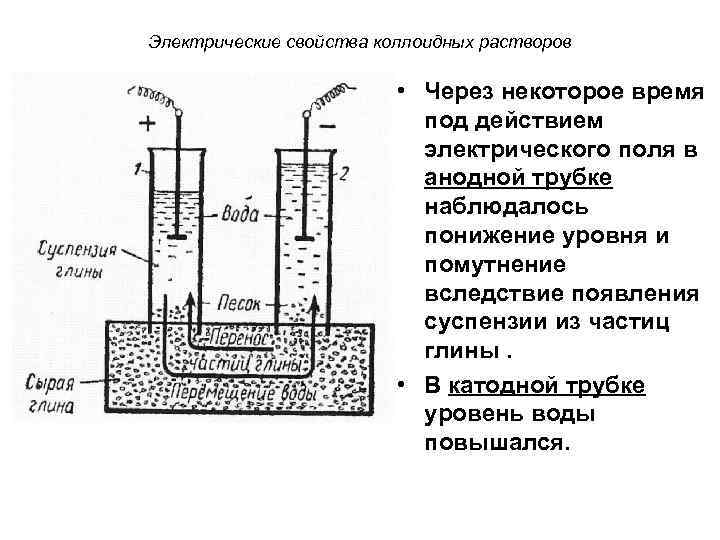 Электрические свойства коллоидных растворов • Через некоторое время под действием электрического поля в анодной трубке наблюдалось понижение уровня и помутнение вследствие появления суспензии из частиц глины. • В катодной трубке уровень воды повышался.
Электрические свойства коллоидных растворов • Через некоторое время под действием электрического поля в анодной трубке наблюдалось понижение уровня и помутнение вследствие появления суспензии из частиц глины. • В катодной трубке уровень воды повышался.
 Электрические свойства коллоидных растворов • Результаты опыта свидетельствовали о том, что коллоидные частицы глины несут отрицательный заряд, так как перемещаются к положительно заряженному электроду – аноду.
Электрические свойства коллоидных растворов • Результаты опыта свидетельствовали о том, что коллоидные частицы глины несут отрицательный заряд, так как перемещаются к положительно заряженному электроду – аноду.
 Электрические свойства коллоидных растворов • Перемещение дисперсной фазы или дисперсионной среды под действием внешнего электрического поля называют электрокинетическими явлениями. • Причина электрокинетических явлений – образование ДЭС на границе раздела дисперсной фазы и дисперсионной среды и, как следствие, наличие электрического заряда у частиц дисперсной фазы и дисперсионной среды.
Электрические свойства коллоидных растворов • Перемещение дисперсной фазы или дисперсионной среды под действием внешнего электрического поля называют электрокинетическими явлениями. • Причина электрокинетических явлений – образование ДЭС на границе раздела дисперсной фазы и дисперсионной среды и, как следствие, наличие электрического заряда у частиц дисперсной фазы и дисперсионной среды.
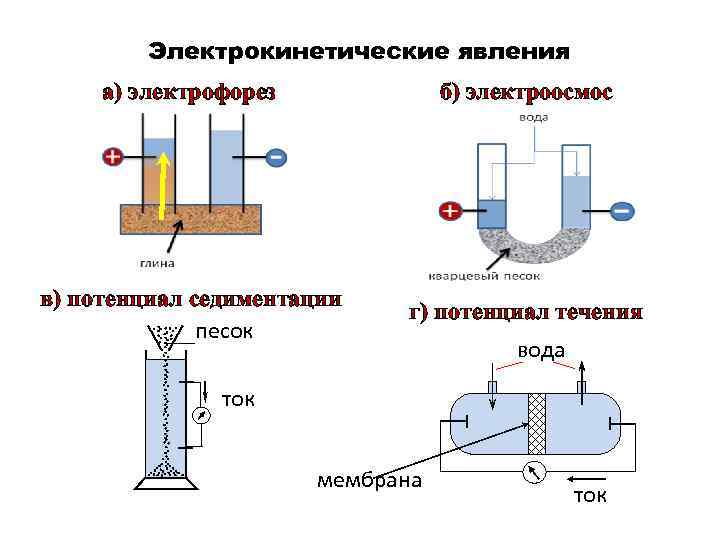 Электрокинетические явления а) электрофорез б) электроосмос в) потенциал седиментации песок г) потенциал течения вода ток мембрана ток
Электрокинетические явления а) электрофорез б) электроосмос в) потенциал седиментации песок г) потенциал течения вода ток мембрана ток
 Электрические свойства коллоидных растворов Направленное движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля называют электрофорезом, а перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмосом.
Электрические свойства коллоидных растворов Направленное движение частиц дисперсной фазы относительно неподвижной дисперсионной среды под действием внешнего электрического поля называют электрофорезом, а перемещение дисперсионной среды относительно неподвижной дисперсной фазы – электроосмосом.
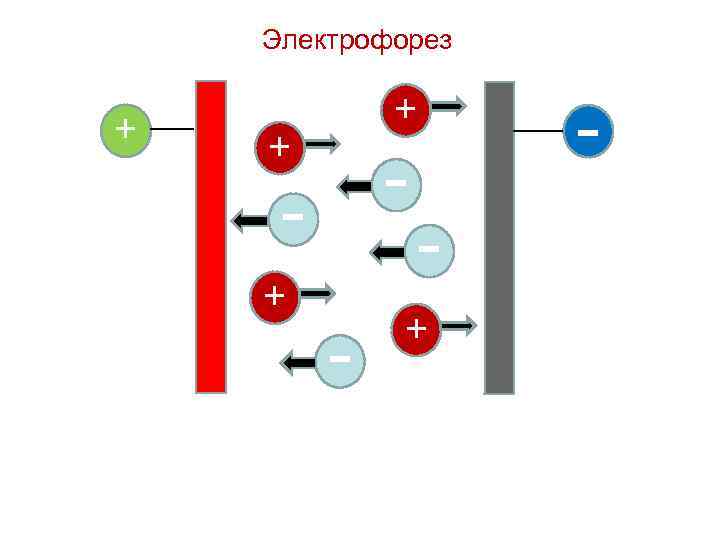 Электрофорез + - + + + -
Электрофорез + - + + + -
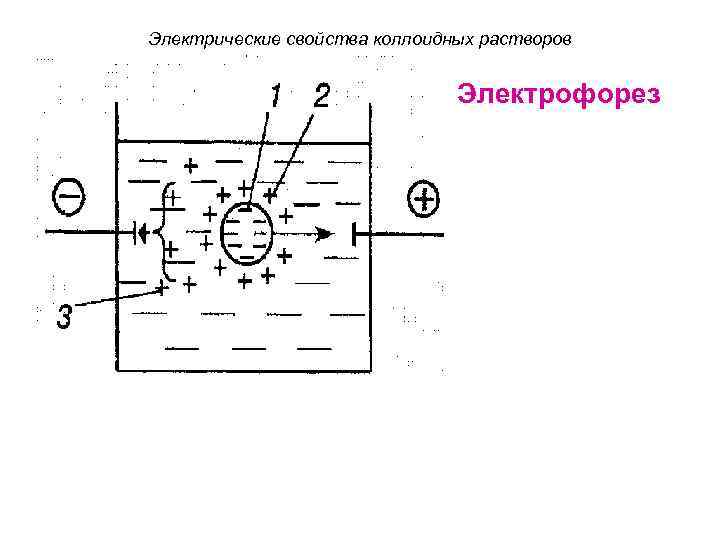 Электрические свойства коллоидных растворов Электрофорез
Электрические свойства коллоидных растворов Электрофорез
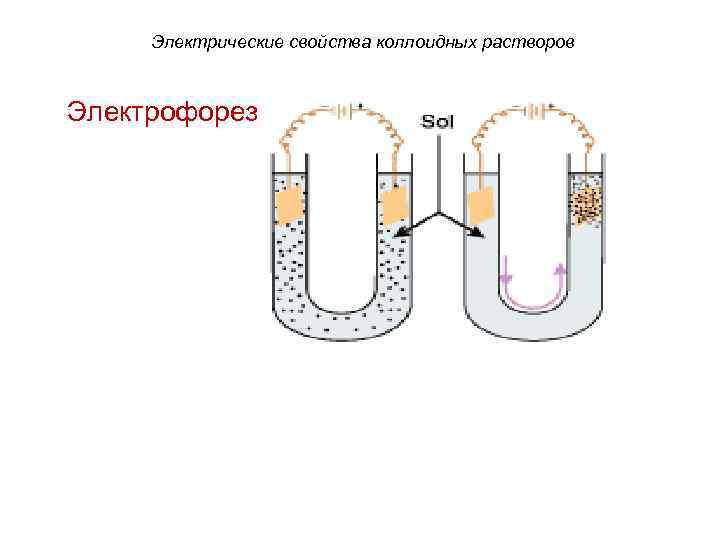 Электрические свойства коллоидных растворов Электрофорез
Электрические свойства коллоидных растворов Электрофорез
 Электрические свойства коллоидных растворов. • Явления электрофореза и электроосмоса позволяют определять знак и величину заряда дисперсных частиц. • Установлено что поверхность биомембран несет отрицательный заряд.
Электрические свойства коллоидных растворов. • Явления электрофореза и электроосмоса позволяют определять знак и величину заряда дисперсных частиц. • Установлено что поверхность биомембран несет отрицательный заряд.
 Электрические свойства коллоидных растворов • Электрофорез широко используется в биологии и медицине: • для диагностики многих заболеваний; • разделения аминокислот; • изучения ферментов, антибиотиков и других объектов. • Явления электроосмоса используют • для снятия отеков; • в технике – для осушения болотистых участков местности.
Электрические свойства коллоидных растворов • Электрофорез широко используется в биологии и медицине: • для диагностики многих заболеваний; • разделения аминокислот; • изучения ферментов, антибиотиков и других объектов. • Явления электроосмоса используют • для снятия отеков; • в технике – для осушения болотистых участков местности.
 СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
 ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция: Коллоидные растворы (часть 2) 1. Молекулярно-кинетические свойства коллоидных растворов. 2. Оптические свойства коллоидных растворов. 3. Устойчивость коллоидных систем. 4. Коагуляция. 5. Лиофильные системы. Лектор: Ирина Петровна Степанова, зав. кафедрой химии, доктор биологических наук, профессор
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ Лекция: Коллоидные растворы (часть 2) 1. Молекулярно-кинетические свойства коллоидных растворов. 2. Оптические свойства коллоидных растворов. 3. Устойчивость коллоидных систем. 4. Коагуляция. 5. Лиофильные системы. Лектор: Ирина Петровна Степанова, зав. кафедрой химии, доктор биологических наук, профессор
 Молекулярно-кинетические свойства коллоидных растворов Молекулярнокинетические свойства обусловлены хаотическим тепловым движением частиц. К ним относятся: • броуновское движение частиц • диффузия • осмос • седиментация
Молекулярно-кинетические свойства коллоидных растворов Молекулярнокинетические свойства обусловлены хаотическим тепловым движением частиц. К ним относятся: • броуновское движение частиц • диффузия • осмос • седиментация
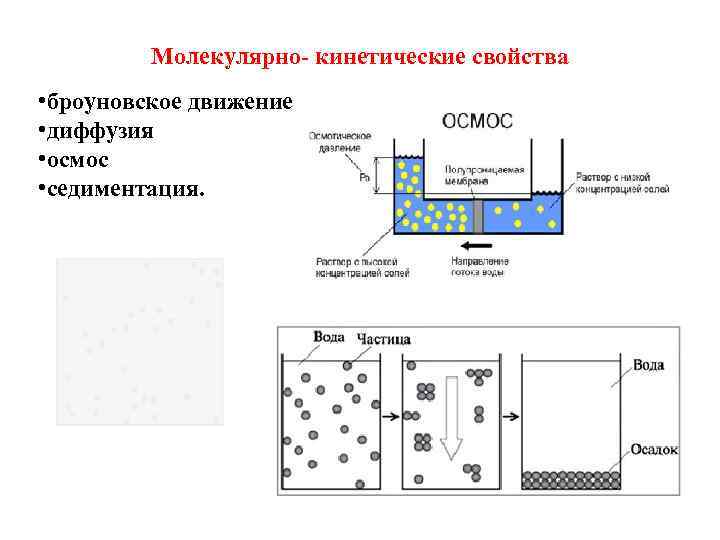 Молекулярно- кинетические свойства • броуновское движение • диффузия • осмос • седиментация.
Молекулярно- кинетические свойства • броуновское движение • диффузия • осмос • седиментация.
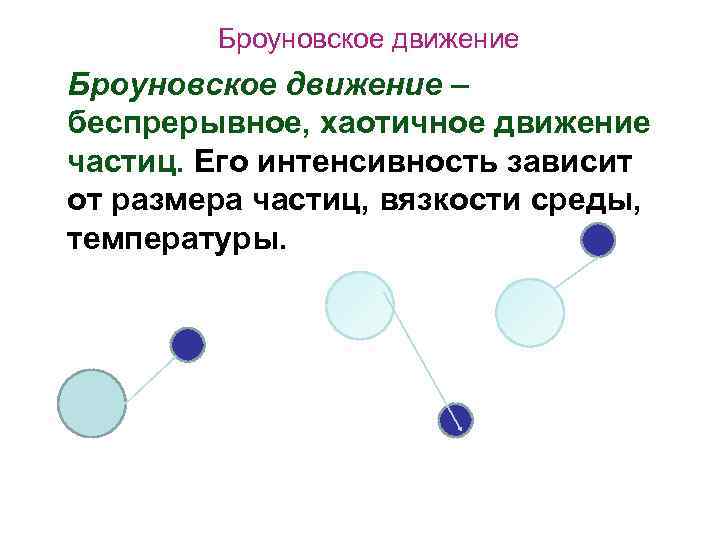 Броуновское движение – беспрерывное, хаотичное движение частиц. Его интенсивность зависит от размера частиц, вязкости среды, температуры.
Броуновское движение – беспрерывное, хаотичное движение частиц. Его интенсивность зависит от размера частиц, вязкости среды, температуры.
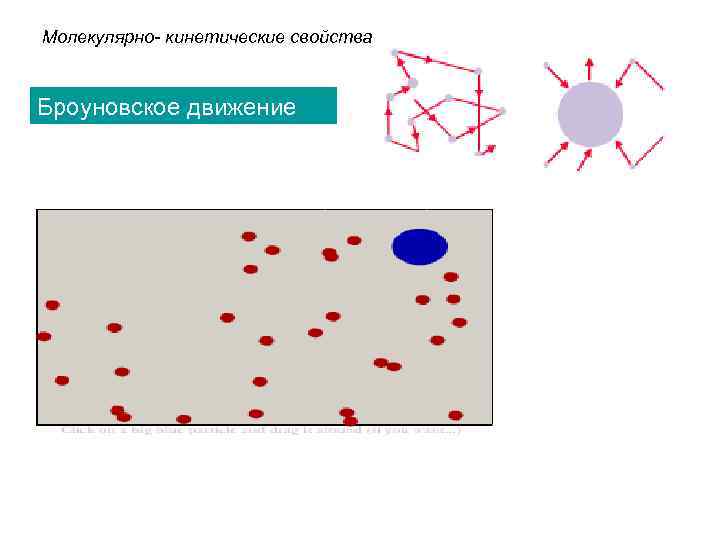 Молекулярно- кинетические свойства Броуновское движение
Молекулярно- кинетические свойства Броуновское движение
 Диффузия • Диффузия – процесс самопроизвольного выравнивания концентрации диспергированного вещества под влиянием теплового хаотичного движения частиц. • Скорость диффузии коллоидных частиц (из-за больших размеров) во много раз меньше скорости диффузии молекул и ионов низкомолекулярных веществ. • Поэтому по скорости диффузии можно определить радиус и степень дисперсности коллоидных частиц.
Диффузия • Диффузия – процесс самопроизвольного выравнивания концентрации диспергированного вещества под влиянием теплового хаотичного движения частиц. • Скорость диффузии коллоидных частиц (из-за больших размеров) во много раз меньше скорости диффузии молекул и ионов низкомолекулярных веществ. • Поэтому по скорости диффузии можно определить радиус и степень дисперсности коллоидных частиц.
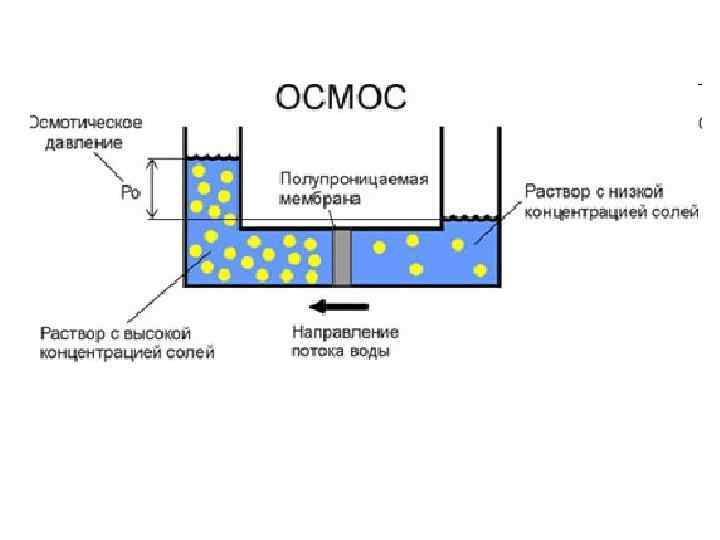
 Осмос – это односторонняя диффузия молекул чистого растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в более концентрированный раствор.
Осмос – это односторонняя диффузия молекул чистого растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в более концентрированный раствор.
 Осмос
Осмос
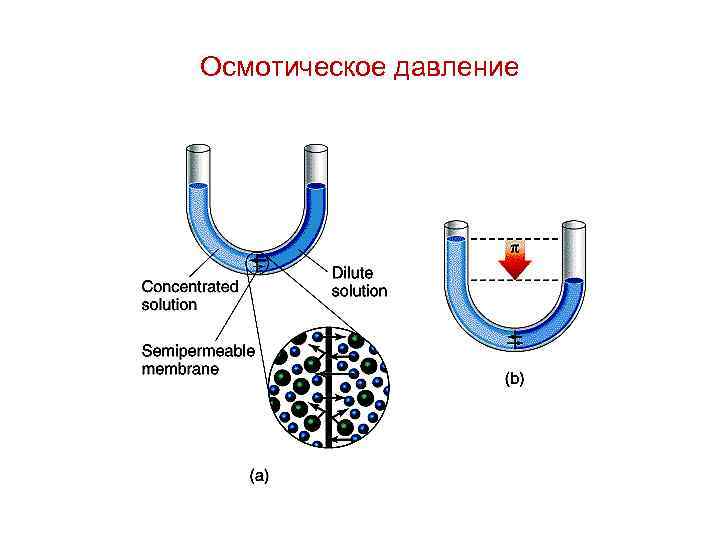 Oсмотическое давление
Oсмотическое давление
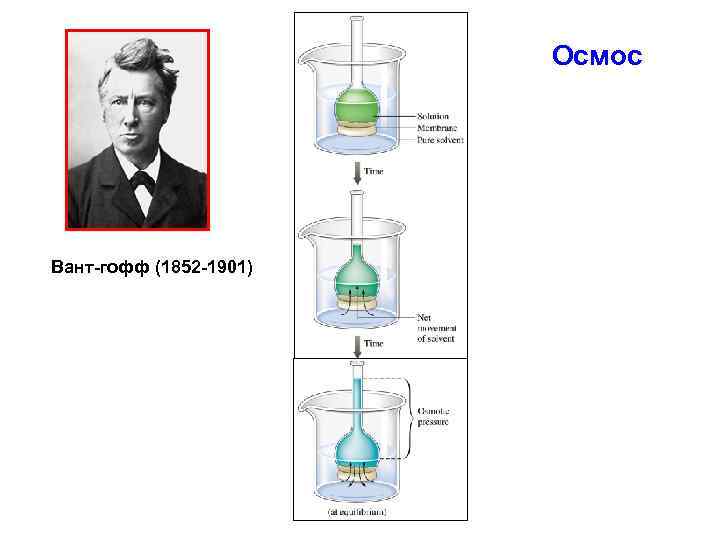 Осмос Вант-гофф (1852 -1901)
Осмос Вант-гофф (1852 -1901)
 Осмотическое давление определяется законом Вант-Гоффа: π = К Б · Сν · Т π – осмотическое давление [Па] КБ - константа Больцмана, КБ = 1, 38 · 10 -23 [Дж· К-1] Сν - частичная концентрация частиц золя [м-3]; Т - абсолютная температура [К].
Осмотическое давление определяется законом Вант-Гоффа: π = К Б · Сν · Т π – осмотическое давление [Па] КБ - константа Больцмана, КБ = 1, 38 · 10 -23 [Дж· К-1] Сν - частичная концентрация частиц золя [м-3]; Т - абсолютная температура [К].
 Осмотическое давление • Осмотическое давление коллоидных растворов имеет особенности: - является низким (из-за больших размеров частиц и низкой концентрации); - меняется во времени (из-за агрегации коллоидных частиц).
Осмотическое давление • Осмотическое давление коллоидных растворов имеет особенности: - является низким (из-за больших размеров частиц и низкой концентрации); - меняется во времени (из-за агрегации коллоидных частиц).
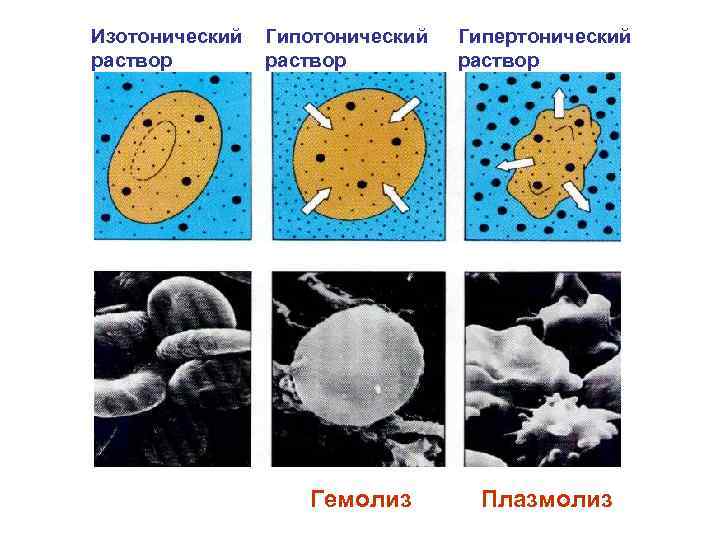 Изотонический раствор Гипотонический раствор Гемолиз Гипертонический раствор Плазмолиз
Изотонический раствор Гипотонический раствор Гемолиз Гипертонический раствор Плазмолиз
 Осмотическое давление
Осмотическое давление
 Седиментация Седиментацией называется оседание коллоидных частиц под действием сил разной природы (гравитационной, центростремительной и др. ). Состояние системы, при котором сила тяжести и сила диффузии уравновешивают друга называется седиментационным равновесием.
Седиментация Седиментацией называется оседание коллоидных частиц под действием сил разной природы (гравитационной, центростремительной и др. ). Состояние системы, при котором сила тяжести и сила диффузии уравновешивают друга называется седиментационным равновесием.
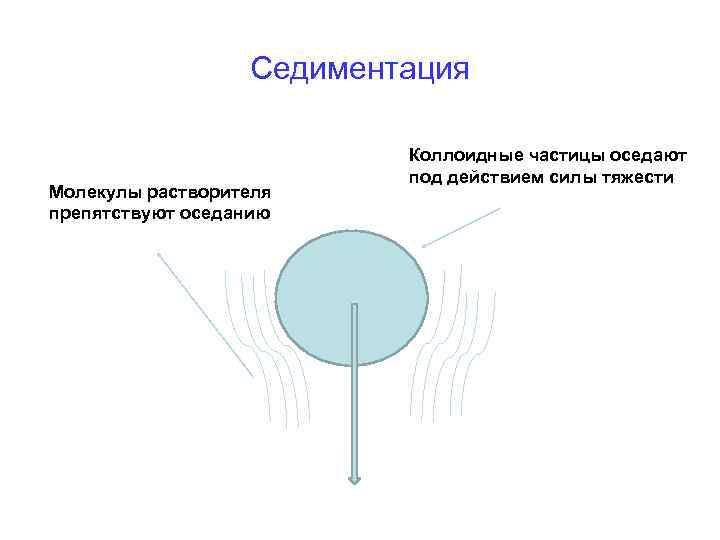 Седиментация Молекулы растворителя препятствуют оседанию Коллоидные частицы оседают под действием силы тяжести
Седиментация Молекулы растворителя препятствуют оседанию Коллоидные частицы оседают под действием силы тяжести
 Седиментационное равновесие n 0 – общее число коллоидных частиц; nh - число коллоидных частиц на высоте h; NA=6, 02 · 1023 моль-1; постоянная Авогадро m – масса частиц [кг]; g – ускорение свободного падения. g = 9, 8 м · c-2; h – высота [м]; R – универсальная газовая постоянная T - абсолютная температура [К].
Седиментационное равновесие n 0 – общее число коллоидных частиц; nh - число коллоидных частиц на высоте h; NA=6, 02 · 1023 моль-1; постоянная Авогадро m – масса частиц [кг]; g – ускорение свободного падения. g = 9, 8 м · c-2; h – высота [м]; R – универсальная газовая постоянная T - абсолютная температура [К].
 Седиментация Из уравнения следует, что с увеличением высоты концентрация коллоидных частиц уменьшается (более выражена эта зависимость для тяжелых частиц). Способность дисперсной системы сохранять равномерное распределение частиц по всему объему называется седиментационной или кинетической устойчивостью.
Седиментация Из уравнения следует, что с увеличением высоты концентрация коллоидных частиц уменьшается (более выражена эта зависимость для тяжелых частиц). Способность дисперсной системы сохранять равномерное распределение частиц по всему объему называется седиментационной или кинетической устойчивостью.
 Седиментация
Седиментация
 Седиментация • Биологические жидкости организма – кровь, спинномозговая жидкость, лимфа, слюна и др. – это сложные растворы, содержащие ионы электролитов, коллоидные частицы и макромолекулы ВМВ. • Цельную кровь можно рассматривать как дисперсную систему, в которой форменные элементы: эритроциты, лейкоциты, тромбоциты составляют ДФ, а плазма – ДСр.
Седиментация • Биологические жидкости организма – кровь, спинномозговая жидкость, лимфа, слюна и др. – это сложные растворы, содержащие ионы электролитов, коллоидные частицы и макромолекулы ВМВ. • Цельную кровь можно рассматривать как дисперсную систему, в которой форменные элементы: эритроциты, лейкоциты, тромбоциты составляют ДФ, а плазма – ДСр.
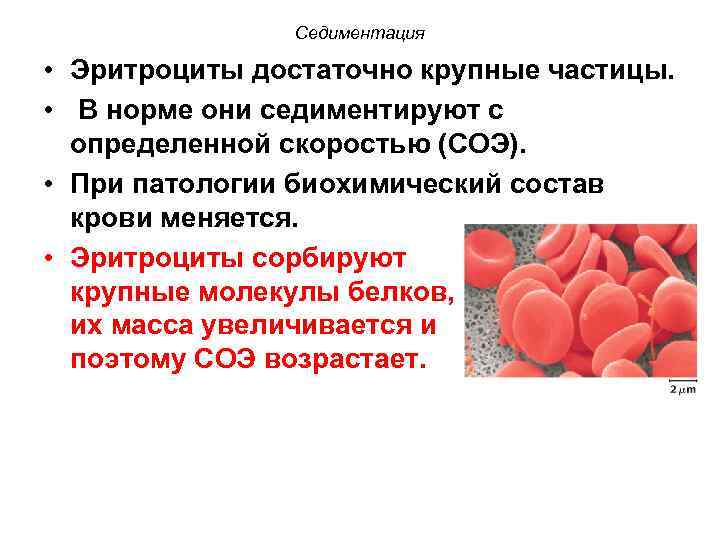 Седиментация • Эритроциты достаточно крупные частицы. • В норме они седиментируют с определенной скоростью (СОЭ). • При патологии биохимический состав крови меняется. • Эритроциты сорбируют крупные молекулы белков, их масса увеличивается и поэтому СОЭ возрастает.
Седиментация • Эритроциты достаточно крупные частицы. • В норме они седиментируют с определенной скоростью (СОЭ). • При патологии биохимический состав крови меняется. • Эритроциты сорбируют крупные молекулы белков, их масса увеличивается и поэтому СОЭ возрастает.
 Оптические свойства коллоидных растворов Для коллоидных растворов диаметр частиц примерно равен длине волны падающего света. В этом случае преобладает дифракционное рассеяние света, так каждая коллоидная частица становится вторичным источником света.
Оптические свойства коллоидных растворов Для коллоидных растворов диаметр частиц примерно равен длине волны падающего света. В этом случае преобладает дифракционное рассеяние света, так каждая коллоидная частица становится вторичным источником света.
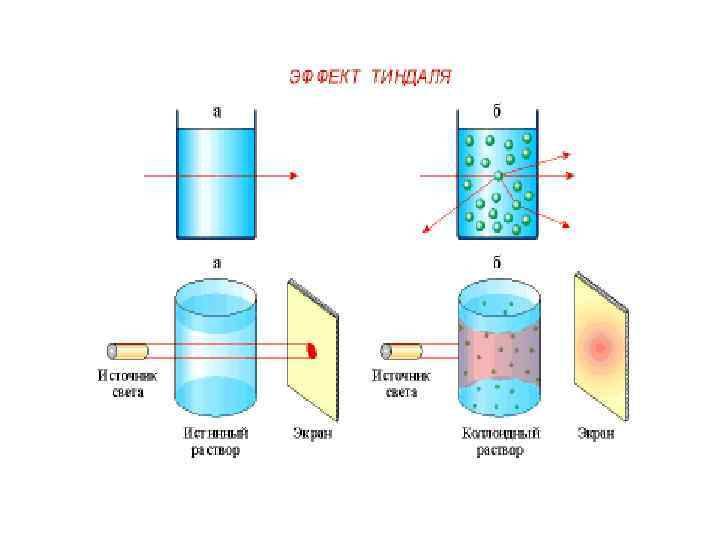
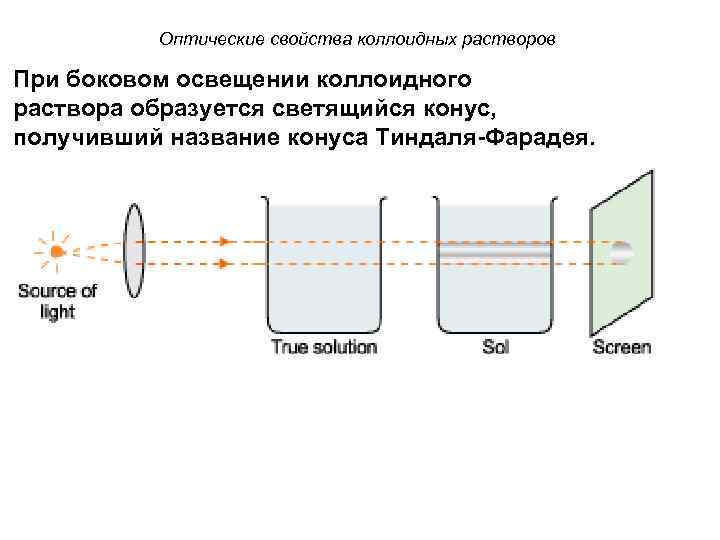 Оптические свойства коллоидных растворов При боковом освещении коллоидного раствора образуется светящийся конус, получивший название конуса Тиндаля-Фарадея.
Оптические свойства коллоидных растворов При боковом освещении коллоидного раствора образуется светящийся конус, получивший название конуса Тиндаля-Фарадея.
 Оптические свойства Эффект Тиндаля
Оптические свойства Эффект Тиндаля




 Оптические свойства Коллоидные растворы серебра, золота, серебра-золота
Оптические свойства Коллоидные растворы серебра, золота, серебра-золота
 Оптические свойства коллоидных растворов Математически рассеяние света выражают уравнением Рэлея: I = I 0 k Сν V 2 / λ 4 I - интенсивность рассеяного света; I 0 - интенсивность падающего света; Сν - частичная концентрация коллоидных частиц [м-3]; V – объем одной коллоидной частицы [м 3]; λ – длина волны падающего света [м]; k – константа, зависящая от показателей преломления ДСр и ДФ.
Оптические свойства коллоидных растворов Математически рассеяние света выражают уравнением Рэлея: I = I 0 k Сν V 2 / λ 4 I - интенсивность рассеяного света; I 0 - интенсивность падающего света; Сν - частичная концентрация коллоидных частиц [м-3]; V – объем одной коллоидной частицы [м 3]; λ – длина волны падающего света [м]; k – константа, зависящая от показателей преломления ДСр и ДФ.
 Оптические свойства коллоидных растворов • Из уравнения Рэлея следует, что интенсивность светорассеяния обратно пропорционально длине волны. • Какая часть спектра лучше рассеивается? • Лучше рассеивается коротковолновая часть спектра (синяя и фиолетовая), хуже – длинноволновая (оранжево-красная).
Оптические свойства коллоидных растворов • Из уравнения Рэлея следует, что интенсивность светорассеяния обратно пропорционально длине волны. • Какая часть спектра лучше рассеивается? • Лучше рассеивается коротковолновая часть спектра (синяя и фиолетовая), хуже – длинноволновая (оранжево-красная).
 Оптические свойства коллоидных растворов • Визуально наблюдают опалесценцию, т. е. окраска коллоидных растворов в рассеянном свете (при рассмотрении сбоку) и в проходящем свете неодинакова. • Конус Тиндаля при рассмотрении сбоку имеет голубой оттенок, на просвет – красный. • Оптические явления лежат в основе методов изучения дисперсных систем – нефелометрии и ультрамикроскопии.
Оптические свойства коллоидных растворов • Визуально наблюдают опалесценцию, т. е. окраска коллоидных растворов в рассеянном свете (при рассмотрении сбоку) и в проходящем свете неодинакова. • Конус Тиндаля при рассмотрении сбоку имеет голубой оттенок, на просвет – красный. • Оптические явления лежат в основе методов изучения дисперсных систем – нефелометрии и ультрамикроскопии.
 Оптические свойства коллоидных растворов Нефелометрия – метод, используемый для изучения дисперсных систем по интенсивности рассеянного света, которая прямо пропорциональна частичной концентрации коллоидных частиц.
Оптические свойства коллоидных растворов Нефелометрия – метод, используемый для изучения дисперсных систем по интенсивности рассеянного света, которая прямо пропорциональна частичной концентрации коллоидных частиц.
 Оптические свойства коллоидных растворов • Коллоидные частицы видны только в ультрамикроскоп (прибор, позволяющий наблюдать отсветы частиц на темном фоне при боковом освещении).
Оптические свойства коллоидных растворов • Коллоидные частицы видны только в ультрамикроскоп (прибор, позволяющий наблюдать отсветы частиц на темном фоне при боковом освещении).
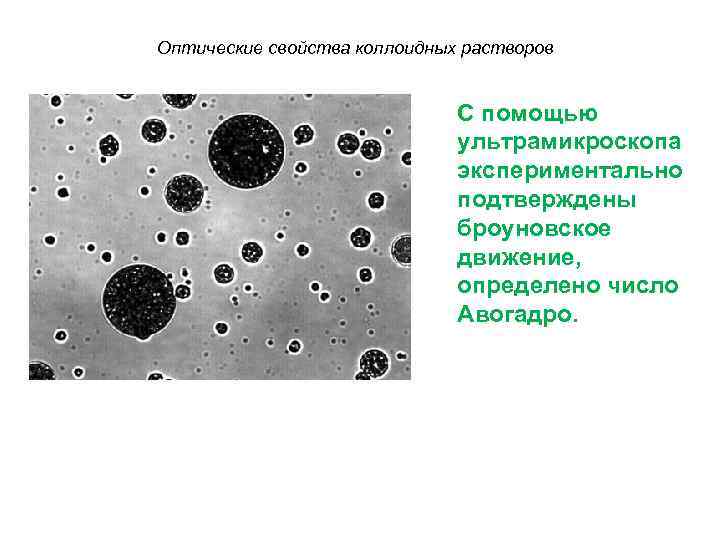 Оптические свойства коллоидных растворов С помощью ультрамикроскопа экспериментально подтверждены броуновское движение, определено число Авогадро.
Оптические свойства коллоидных растворов С помощью ультрамикроскопа экспериментально подтверждены броуновское движение, определено число Авогадро.
 Устойчивость коллоидных растворов Различают кинетическую и агрегативную устойчивость коллоидных растворов.
Устойчивость коллоидных растворов Различают кинетическую и агрегативную устойчивость коллоидных растворов.
 Устойчивость коллоидных систем Под кинетической устойчивостью понимают способность дисперсной фазы находится во взвешенном состоянии.
Устойчивость коллоидных систем Под кинетической устойчивостью понимают способность дисперсной фазы находится во взвешенном состоянии.
 Устойчивость коллоидных систем Коллоидные системы кинетически устойчивы. Для них характерно состояние седиментационного равновесия.
Устойчивость коллоидных систем Коллоидные системы кинетически устойчивы. Для них характерно состояние седиментационного равновесия.
 Устойчивость коллоидных систем Агрегативная устойчивость – это способность системы сохранять определенную степень дисперсности, не объединяясь в более крупные агрегаты.
Устойчивость коллоидных систем Агрегативная устойчивость – это способность системы сохранять определенную степень дисперсности, не объединяясь в более крупные агрегаты.
 Устойчивость коллоидных систем • К факторам агрегативной устойчивости относят: 1) Наличие электрического заряда на частицах дисперсной фазы - чем выше заряд и чем выше дзета-потенциал, тем выше устойчивость коллоидных систем; коллоидные системы в изоэлектрическом состоянии наименее устойчивы.
Устойчивость коллоидных систем • К факторам агрегативной устойчивости относят: 1) Наличие электрического заряда на частицах дисперсной фазы - чем выше заряд и чем выше дзета-потенциал, тем выше устойчивость коллоидных систем; коллоидные системы в изоэлектрическом состоянии наименее устойчивы.
 Устойчивость коллоидных систем 2) Наличие сольватной (гидратной) оболочки на коллоидных частицах. При этом упругие силы сольватных слоев оказывают расклинивающее действие на коллоидные частицы и не дают им сближаться, что повышает устойчивость коллоидных систем.
Устойчивость коллоидных систем 2) Наличие сольватной (гидратной) оболочки на коллоидных частицах. При этом упругие силы сольватных слоев оказывают расклинивающее действие на коллоидные частицы и не дают им сближаться, что повышает устойчивость коллоидных систем.
 Устойчивость коллоидных систем 3)Адсорбционно-структурирующие свойства коллоидных систем. На хорошо развитой поверхности частиц дисперсной фазы обычно легко адсорбируются молекулы ПАВ и ВМВ, которые, будучи сольватированными, создают адсорбционно-сольватные слои значительной протяженности и плотности. Это препятствует сближению коллоидных частиц и повышает устойчивость.
Устойчивость коллоидных систем 3)Адсорбционно-структурирующие свойства коллоидных систем. На хорошо развитой поверхности частиц дисперсной фазы обычно легко адсорбируются молекулы ПАВ и ВМВ, которые, будучи сольватированными, создают адсорбционно-сольватные слои значительной протяженности и плотности. Это препятствует сближению коллоидных частиц и повышает устойчивость.
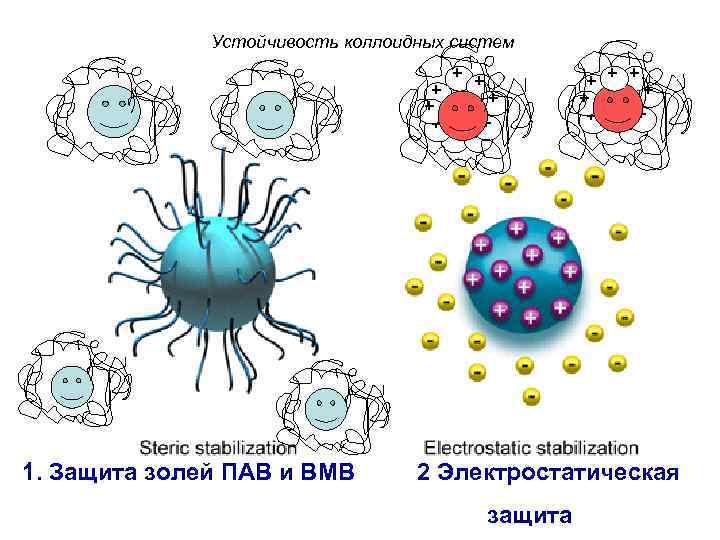 Устойчивость коллоидных систем + + + + + 1. Защита золей ПАВ и ВМВ + + + 2 Электростатическая защита
Устойчивость коллоидных систем + + + + + 1. Защита золей ПАВ и ВМВ + + + 2 Электростатическая защита
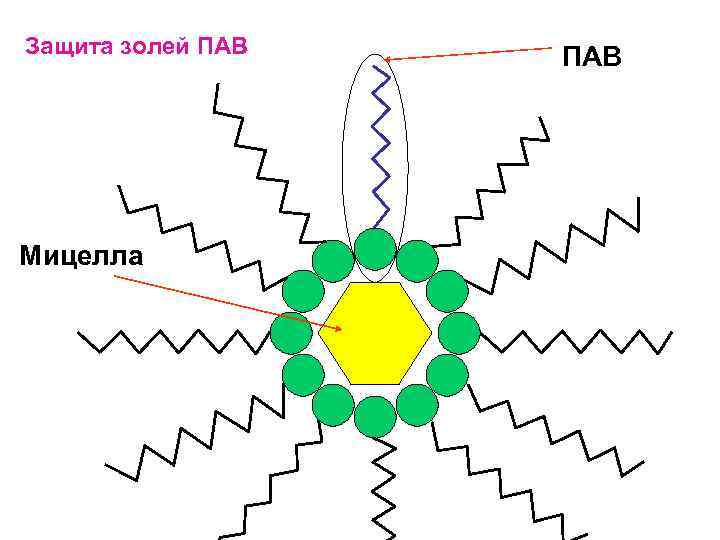 Защита золей ПАВ Мицелла ПАВ
Защита золей ПАВ Мицелла ПАВ
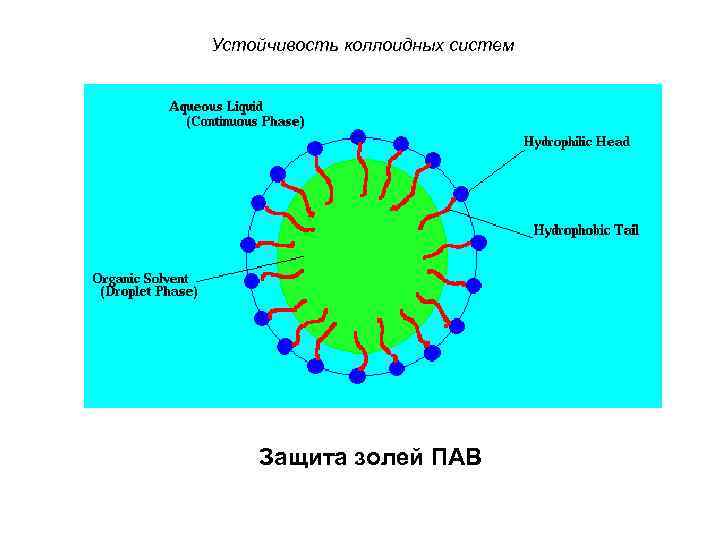 Устойчивость коллоидных систем Защита золей ПАВ
Устойчивость коллоидных систем Защита золей ПАВ
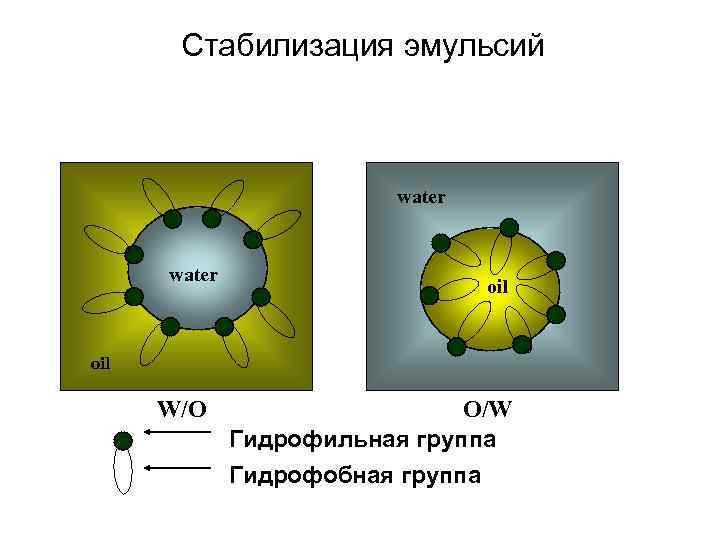 Стабилизация эмульсий water oil W/O O/W Гидрофильная группа Гидрофобная группа
Стабилизация эмульсий water oil W/O O/W Гидрофильная группа Гидрофобная группа
 Устойчивость коллоидных систем Способность ПАВ и ВМВ к образованию адсорбционносольватных слоев на поверхности коллоидных частиц называется защитным действием (коллоидной защитой).
Устойчивость коллоидных систем Способность ПАВ и ВМВ к образованию адсорбционносольватных слоев на поверхности коллоидных частиц называется защитным действием (коллоидной защитой).
 Коллоидная защита Защитная способность ВМС или ПАВ относительно выбранного золя характеризуется защитным числом. Защитное число – это масса сухого защищающего вещества в миллиграммах, которую необходимо добавить к 10 мл золя, чтобы защитить его от коагуляции 1 мл раствора электролита определенной концентрации.
Коллоидная защита Защитная способность ВМС или ПАВ относительно выбранного золя характеризуется защитным числом. Защитное число – это масса сухого защищающего вещества в миллиграммах, которую необходимо добавить к 10 мл золя, чтобы защитить его от коагуляции 1 мл раствора электролита определенной концентрации.
![Коллоидная защита Вычисляют защитное число по формуле: S = Cзв ∙ Vзв [мл], где Коллоидная защита Вычисляют защитное число по формуле: S = Cзв ∙ Vзв [мл], где](https://present5.com/presentation/3/49881402_77083126.pdf-img/49881402_77083126.pdf-139.jpg) Коллоидная защита Вычисляют защитное число по формуле: S = Cзв ∙ Vзв [мл], где Cзв – концентрация раствора защитного вещества, мг/мл; Vзв – объем раствора защитного вещества, необходимого для предотвращения коагуляции, мл.
Коллоидная защита Вычисляют защитное число по формуле: S = Cзв ∙ Vзв [мл], где Cзв – концентрация раствора защитного вещества, мг/мл; Vзв – объем раствора защитного вещества, необходимого для предотвращения коагуляции, мл.
 Коллоидная защита При диагностике гнойного менингита определяют защитное число белков спинномозговой жидкости. Определите это число, если известно, что для предотвращения коагуляции 20 мл золя Ag. Br при действии 2 мл 10%-го Na. NO 3 потребовалось добавить к этому золю 3 мл спинномозговой жидкости, содержащей 2 г белков в 1 л. Ответ: 6 мл
Коллоидная защита При диагностике гнойного менингита определяют защитное число белков спинномозговой жидкости. Определите это число, если известно, что для предотвращения коагуляции 20 мл золя Ag. Br при действии 2 мл 10%-го Na. NO 3 потребовалось добавить к этому золю 3 мл спинномозговой жидкости, содержащей 2 г белков в 1 л. Ответ: 6 мл
 Коллоидная защита Большое значение коллоидная защита имеет для животных организмов. Белки, нуклеиновые кислоты, полисахариды и др. соединения адсорбируются на коллоидных частицах и переводят их в устойчивое состояние.
Коллоидная защита Большое значение коллоидная защита имеет для животных организмов. Белки, нуклеиновые кислоты, полисахариды и др. соединения адсорбируются на коллоидных частицах и переводят их в устойчивое состояние.
 Коллоидная защита • При патологии и старении организма защитные свойства белков и других соединений снижаются. • Следствием этого может явиться патологическое минералообразование в организме. Почечные камни
Коллоидная защита • При патологии и старении организма защитные свойства белков и других соединений снижаются. • Следствием этого может явиться патологическое минералообразование в организме. Почечные камни
 Антитела продуцируются иммунной системой
Антитела продуцируются иммунной системой
 Коллоидная защита Желчные камни
Коллоидная защита Желчные камни
 Коллоидная защита • Явление коллоидной защиты используют в фармации при изготовлении лекарственных препаратов, например золей серебра и серы, защищенных белками.
Коллоидная защита • Явление коллоидной защиты используют в фармации при изготовлении лекарственных препаратов, например золей серебра и серы, защищенных белками.
 Коагуляция Понижение устойчивости коллоидных систем приводит к их коагуляции (от лат. coagulum – сгусток) – укрупнению коллоидных частиц. коагуляция золь гель пептизация
Коагуляция Понижение устойчивости коллоидных систем приводит к их коагуляции (от лат. coagulum – сгусток) – укрупнению коллоидных частиц. коагуляция золь гель пептизация
 Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии.
 Коагуляция Различают две стадии коагуляции. Первая стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости. Вторая стадия – явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Коагуляция Различают две стадии коагуляции. Первая стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости. Вторая стадия – явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
 Коагуляция происходит под различных факторов: • температуры, • встряхивании, • перемешивании, • облучении, • добавлении электролитов. влиянием
Коагуляция происходит под различных факторов: • температуры, • встряхивании, • перемешивании, • облучении, • добавлении электролитов. влиянием
 Коагуляция Правила электролитной коагуляции: 1. Коагулирующим действием обладает ион электролита, имеющий заряд, противоположный заряду гранулы. Какой ион (натрия, кальция, алюминия, хлорид ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в нитрате серебра? Ответ: хлорид-ион.
Коагуляция Правила электролитной коагуляции: 1. Коагулирующим действием обладает ион электролита, имеющий заряд, противоположный заряду гранулы. Какой ион (натрия, кальция, алюминия, хлорид ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в нитрате серебра? Ответ: хлорид-ион.
 Устойчивость коллоидных систем 2. Чем выше степень окисления иона, тем выше его коагулирующая способность (правило Шульце-Гарди): Ti 4+ > Al 3+ > Ca 2+ > K+
Устойчивость коллоидных систем 2. Чем выше степень окисления иона, тем выше его коагулирующая способность (правило Шульце-Гарди): Ti 4+ > Al 3+ > Ca 2+ > K+
 Коагуляция Какой ион (хлорид-ион, сульфатион, фосфат-ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в нитрате серебра? Ответ: фосфат-анион.
Коагуляция Какой ион (хлорид-ион, сульфатион, фосфат-ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в нитрате серебра? Ответ: фосфат-анион.
 Устойчивость коллоидных систем 3. При одинаковой степени окисления ионов коагулирующая способность возрастает с уменьшением степени гидратированности ионов: Ba 2+ > Sr 2+ > Ca 2+ > Mg 2+ SCN- > I- > Br- > Cl-
Устойчивость коллоидных систем 3. При одинаковой степени окисления ионов коагулирующая способность возрастает с уменьшением степени гидратированности ионов: Ba 2+ > Sr 2+ > Ca 2+ > Mg 2+ SCN- > I- > Br- > Cl-
 Коагуляция Какой ион (хлорид-, бромид-, иодид-, роданид -ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в нитрате серебра? Ответ: роданид-анион.
Коагуляция Какой ион (хлорид-, бромид-, иодид-, роданид -ион) оказывает большее коагулирующее действие на мицеллу иодида серебра в нитрате серебра? Ответ: роданид-анион.
 Коагуляция Каждый ион определенным коагуляции. обладает порогом Порог коагуляции - это минимальная концентрация электролита, которую необходимо добавить к 1 литру коллоидного раствора, чтобы вызвать его коагуляцию [ммоль · дм-3].
Коагуляция Каждый ион определенным коагуляции. обладает порогом Порог коагуляции - это минимальная концентрация электролита, которую необходимо добавить к 1 литру коллоидного раствора, чтобы вызвать его коагуляцию [ммоль · дм-3].
 Коагуляция Расчет порога коагуляции проводят по формуле: где V 0 - объем золя, V 1 -минимальный объем раствора электролита, вызвавший коагуляцию золя.
Коагуляция Расчет порога коагуляции проводят по формуле: где V 0 - объем золя, V 1 -минимальный объем раствора электролита, вызвавший коагуляцию золя.
 Флокуляция (от лат. flocculi – клочья, хлопья) - вид коагуляции, при которой ДФ в жидкой или газовой среде, образует рыхлые хлопьевидные скопления, т. н. флокулы. Флокуляция в золях, суспензиях, эмульсиях, латексах происходит под влиянием флокулянтов, а также при тепловых, механических, электрических и пр. воздействиях. Эффективные флокулянты – растворимые полимеры, особенно полиэлектролиты.
Флокуляция (от лат. flocculi – клочья, хлопья) - вид коагуляции, при которой ДФ в жидкой или газовой среде, образует рыхлые хлопьевидные скопления, т. н. флокулы. Флокуляция в золях, суспензиях, эмульсиях, латексах происходит под влиянием флокулянтов, а также при тепловых, механических, электрических и пр. воздействиях. Эффективные флокулянты – растворимые полимеры, особенно полиэлектролиты.
 Коалесценция • Коалесценция (от лат. coalesce — срастаюсь, соединяюсь) - слияние частиц (например, капель или пузырей) внутри подвижной среды (жидкости, газа) или на поверхности тела. • Это самопроизвольный процесс (сопровождается уменьшением свободной энергии системы). • В жидкой дисперсионной среде коалесценции часто предшествует коагуляция.
Коалесценция • Коалесценция (от лат. coalesce — срастаюсь, соединяюсь) - слияние частиц (например, капель или пузырей) внутри подвижной среды (жидкости, газа) или на поверхности тела. • Это самопроизвольный процесс (сопровождается уменьшением свободной энергии системы). • В жидкой дисперсионной среде коалесценции часто предшествует коагуляция.
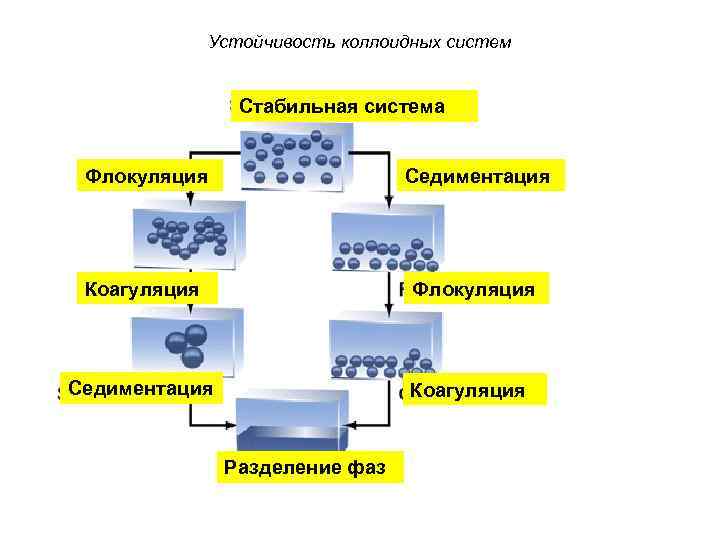 Устойчивость коллоидных систем Стабильная система Флокуляция Седиментация Коагуляция Разделение фаз
Устойчивость коллоидных систем Стабильная система Флокуляция Седиментация Коагуляция Разделение фаз
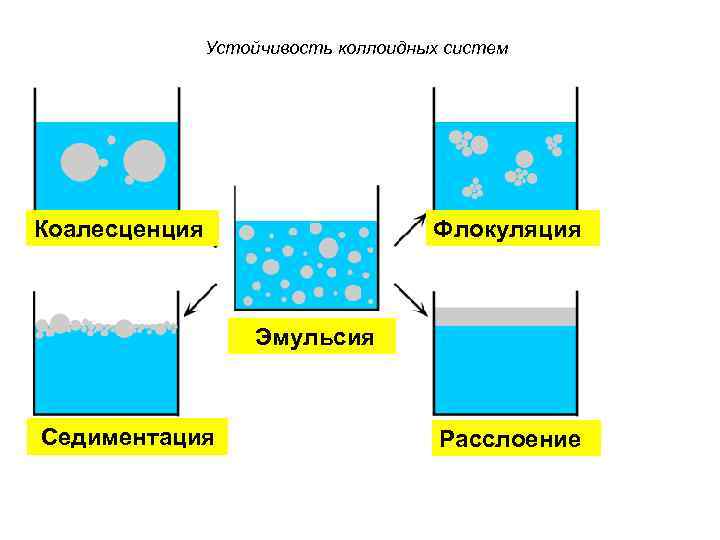 Устойчивость коллоидных систем Коалесценция Флокуляция Эмульсия Седиментация Расслоение
Устойчивость коллоидных систем Коалесценция Флокуляция Эмульсия Седиментация Расслоение
 «Человек – это ходячий коллоид» И. И. Жуков В любом животном или растительном организме представлены практически все коллоидные дисперсные системы: как лиофильные, так и лиофобные, связаннодисперсные и свободнодисперсные.
«Человек – это ходячий коллоид» И. И. Жуков В любом животном или растительном организме представлены практически все коллоидные дисперсные системы: как лиофильные, так и лиофобные, связаннодисперсные и свободнодисперсные.
 Молекулярные коллоиды (обратимые и лиофильные) Их образуют природные и синтетические ВМВ. • Очень разбавленные растворы гомогенны (истинные и подчиняются законам разбавленных растворов). •
Молекулярные коллоиды (обратимые и лиофильные) Их образуют природные и синтетические ВМВ. • Очень разбавленные растворы гомогенны (истинные и подчиняются законам разбавленных растворов). •
 Молекулярные коллоиды • При достижении критической концентрации мицеллообразования (С ккм белка = 10 -10 моль/л) в зависимости от природы растворителя и белка отдельные макромолекулы способны сворачиваться в глобулы с размерами коллоидных частиц.
Молекулярные коллоиды • При достижении критической концентрации мицеллообразования (С ккм белка = 10 -10 моль/л) в зависимости от природы растворителя и белка отдельные макромолекулы способны сворачиваться в глобулы с размерами коллоидных частиц.
 Молекулярные коллоиды • Другой особенностью растворов молекулярных коллоидов является обратимость, то есть способность мицелл самопроизвольно переходить в раствор при добавлении новой порции растворителя.
Молекулярные коллоиды • Другой особенностью растворов молекулярных коллоидов является обратимость, то есть способность мицелл самопроизвольно переходить в раствор при добавлении новой порции растворителя.
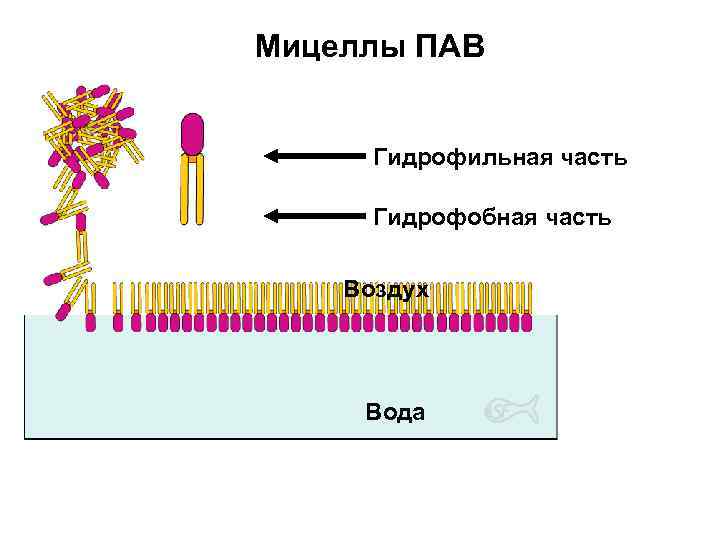
 Мицеллярные (ассоциативные) коллоиды Их образуют ПАВ – вещества с дифильной природой (содержат как неполярные, так и полярные фрагменты). неполярный углеводородный радикал ( «хвост» ) полярная ионогенная ( «голова» ) или группа
Мицеллярные (ассоциативные) коллоиды Их образуют ПАВ – вещества с дифильной природой (содержат как неполярные, так и полярные фрагменты). неполярный углеводородный радикал ( «хвост» ) полярная ионогенная ( «голова» ) или группа
 Мицеллы ПАВ При небольшой концентрации ПАВ образуют истинные молекулярные растворы. • С увеличением концентрации отдельные молекулы начинают ассоциировать друг с другом с образованием агрегатов или мицелл коллоидных размеров. •
Мицеллы ПАВ При небольшой концентрации ПАВ образуют истинные молекулярные растворы. • С увеличением концентрации отдельные молекулы начинают ассоциировать друг с другом с образованием агрегатов или мицелл коллоидных размеров. •
 Мицеллярные коллоиды • Мицеллы ПАВ образуются самопроизвольно при достижении критической концентрации мицеллообразования (ККМ). • Величина ККМ зависит от природы ПАВ. Для ионогенных ПАВ С ккм = 10 -2 -10 -3 моль/л, для неионогенных ПАВ Сккм = 10 -4 -10 -5 моль/л. • Мембраны мицелл обладают избирательной проницаемостью.
Мицеллярные коллоиды • Мицеллы ПАВ образуются самопроизвольно при достижении критической концентрации мицеллообразования (ККМ). • Величина ККМ зависит от природы ПАВ. Для ионогенных ПАВ С ккм = 10 -2 -10 -3 моль/л, для неионогенных ПАВ Сккм = 10 -4 -10 -5 моль/л. • Мембраны мицелл обладают избирательной проницаемостью.
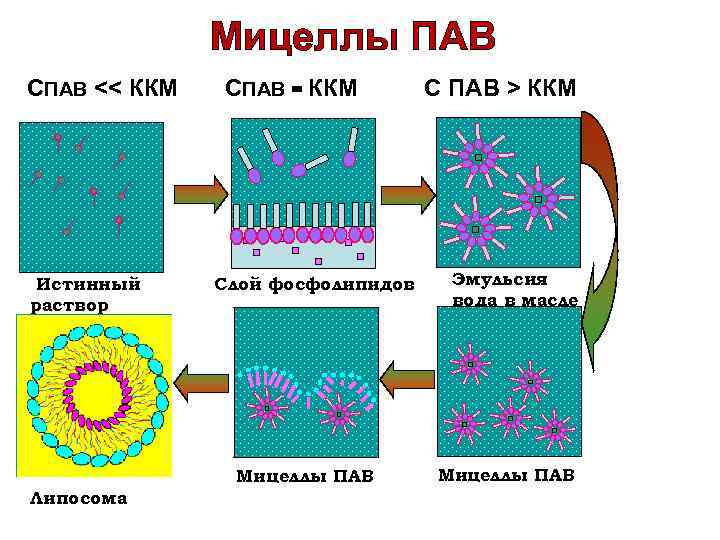 Мицеллы ПАВ СПАВ ˂˂ ККМ Истинный раствор СПАВ = ККМ Слой фосфолипидов Мицеллы ПАВ Липосома С ПАВ ˃ ККМ Эмульсия вода в масле Мицеллы ПАВ
Мицеллы ПАВ СПАВ ˂˂ ККМ Истинный раствор СПАВ = ККМ Слой фосфолипидов Мицеллы ПАВ Липосома С ПАВ ˃ ККМ Эмульсия вода в масле Мицеллы ПАВ
 Мицеллы ПАВ Гидрофильная часть Гидрофобная часть Воздух Вода
Мицеллы ПАВ Гидрофильная часть Гидрофобная часть Воздух Вода
 Мицеллы ПАВ
Мицеллы ПАВ
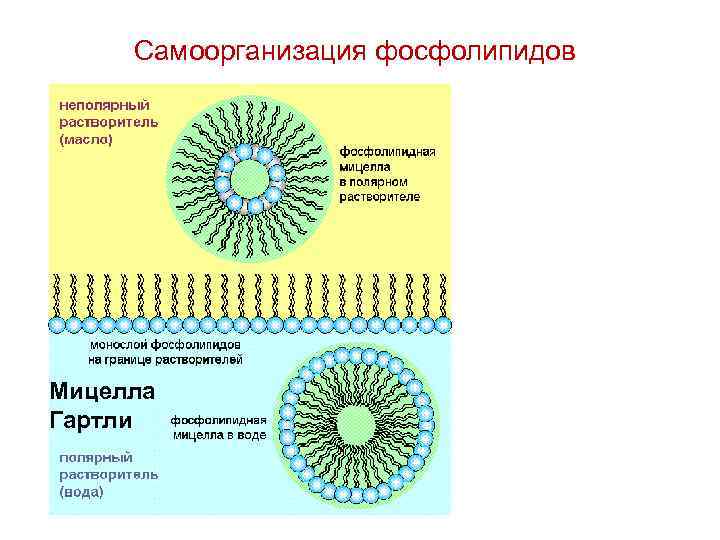 Самоорганизация фосфолипидов Мицелла Гартли
Самоорганизация фосфолипидов Мицелла Гартли
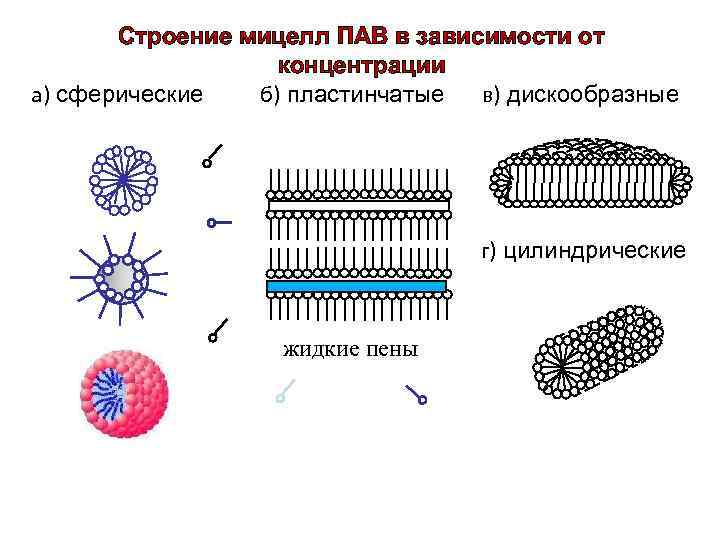 Строение мицелл ПАВ в зависимости от концентрации а) сферические б) пластинчатые в) дискообразные г) цилиндрические жидкие пены
Строение мицелл ПАВ в зависимости от концентрации а) сферические б) пластинчатые в) дискообразные г) цилиндрические жидкие пены
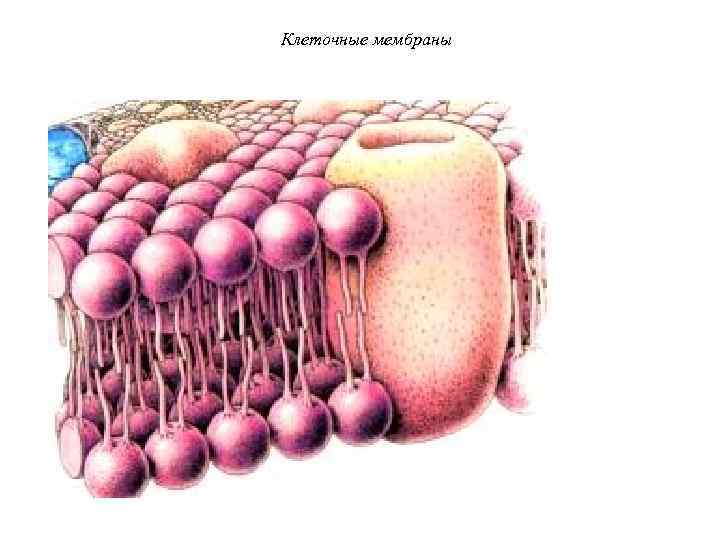 Клеточные мембраны
Клеточные мембраны
 Мицеллообразование в растворах ПАВ. ККМ Значение ККМ зависит от различных факторов: • природы коллоидного ПАВ: установлено, что с ростом длины углеводородного радикала молекулы коллоидного ПАВ значение ККМ уменьшается. • присутствия электролитов: электролиты для неионогенного коллоидного ПАВ не оказывает существенного влияния на ККМ, для ионогенного ПАВ приводят к уменьшению ККМ. • температуры: понижение температуры также способствует уменьшению ККМ.
Мицеллообразование в растворах ПАВ. ККМ Значение ККМ зависит от различных факторов: • природы коллоидного ПАВ: установлено, что с ростом длины углеводородного радикала молекулы коллоидного ПАВ значение ККМ уменьшается. • присутствия электролитов: электролиты для неионогенного коллоидного ПАВ не оказывает существенного влияния на ККМ, для ионогенного ПАВ приводят к уменьшению ККМ. • температуры: понижение температуры также способствует уменьшению ККМ.
 Солюбилизация Солюбилизацией (или коллоидным растворением) называется явление проникновения молекул низкомолекулярных веществ в мицеллы ПАВ. Вещество, растворяющееся в мицеллах, называется солюбилизатом.
Солюбилизация Солюбилизацией (или коллоидным растворением) называется явление проникновения молекул низкомолекулярных веществ в мицеллы ПАВ. Вещество, растворяющееся в мицеллах, называется солюбилизатом.
 Солюбилизация Способ включения молекул солюбилизата в мицеллы зависит от их природы. Неполярные углеводороды, внедряясь в мицеллы, располагаются внутри углеводородных ядер мицелл. Полярные органические вещества (спирты, амины, кислоты, жиры) встраиваются между молекулами ПАВ так, чтобы их полярные группы были обращены к воде, а углеводородные радикалы — ориентированы параллельно углеводородным радикалам ПАВ.
Солюбилизация Способ включения молекул солюбилизата в мицеллы зависит от их природы. Неполярные углеводороды, внедряясь в мицеллы, располагаются внутри углеводородных ядер мицелл. Полярные органические вещества (спирты, амины, кислоты, жиры) встраиваются между молекулами ПАВ так, чтобы их полярные группы были обращены к воде, а углеводородные радикалы — ориентированы параллельно углеводородным радикалам ПАВ.
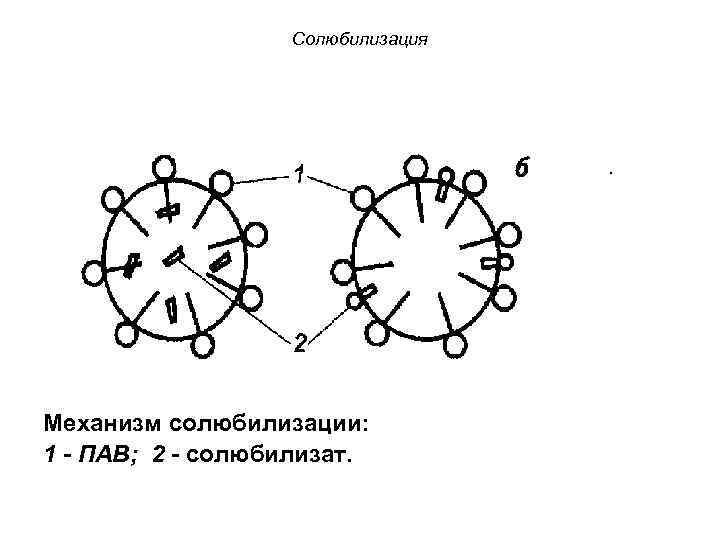 Солюбилизация . Механизм солюбилизации: 1 - ПАВ; 2 - солюбилизат.
Солюбилизация . Механизм солюбилизации: 1 - ПАВ; 2 - солюбилизат.
 Солюбилизация Процесс солюбилизации является самопроизвольным и обратимым. Солюбилизация приводит к набуханию мицелл и, соответственно, к увеличению их размеров. Процесс протекает медленно. Перемешивание и повышение температуры ускоряет наступление равновесия.
Солюбилизация Процесс солюбилизации является самопроизвольным и обратимым. Солюбилизация приводит к набуханию мицелл и, соответственно, к увеличению их размеров. Процесс протекает медленно. Перемешивание и повышение температуры ускоряет наступление равновесия.
 Солюбилизация Количественной характеристикой солюбилизации является относительная солюбилизация – отношение числа моль солюбилизированного вещества к числу моль ПАВ, находящегося в мицеллярном состоянии.
Солюбилизация Количественной характеристикой солюбилизации является относительная солюбилизация – отношение числа моль солюбилизированного вещества к числу моль ПАВ, находящегося в мицеллярном состоянии.
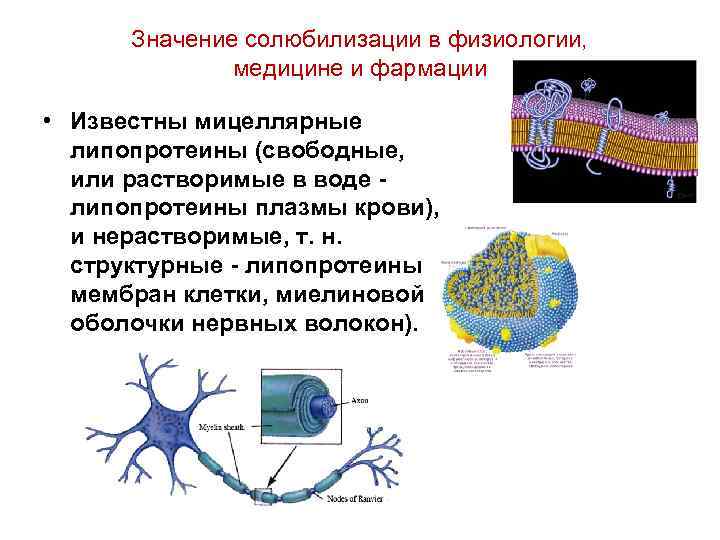 Значение солюбилизации в физиологии, медицине и фармации • Известны мицеллярные липопротеины (свободные, или растворимые в воде липопротеины плазмы крови), и нерастворимые, т. н. структурные - липопротеины мембран клетки, миелиновой оболочки нервных волокон).
Значение солюбилизации в физиологии, медицине и фармации • Известны мицеллярные липопротеины (свободные, или растворимые в воде липопротеины плазмы крови), и нерастворимые, т. н. структурные - липопротеины мембран клетки, миелиновой оболочки нервных волокон).
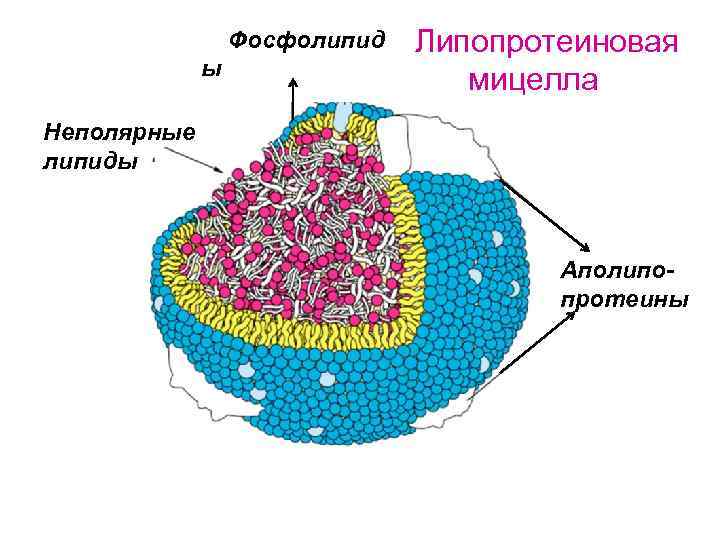 Фосфолипид ы Липопротеиновая мицелла Неполярные липиды Аполипопротеины
Фосфолипид ы Липопротеиновая мицелла Неполярные липиды Аполипопротеины
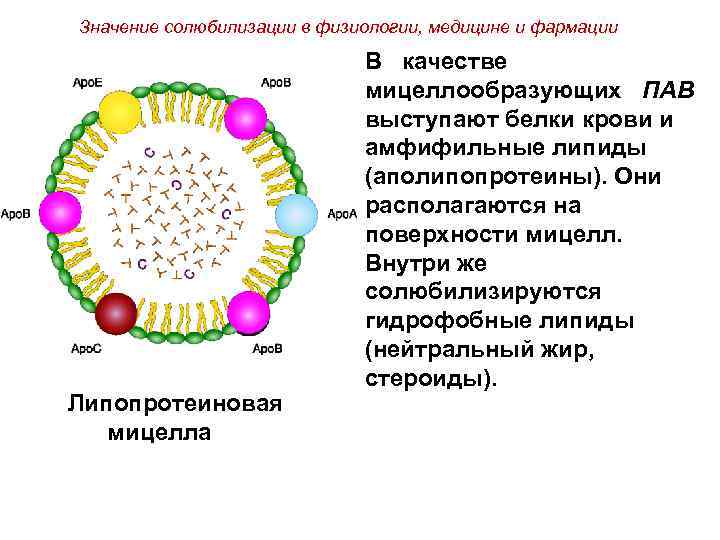 Значение солюбилизации в физиологии, медицине и фармации Липопротеиновая мицелла В качестве мицеллообразующих ПАВ выступают белки крови и амфифильные липиды (аполипопротеины). Они располагаются на поверхности мицелл. Внутри же солюбилизируются гидрофобные липиды (нейтральный жир, стероиды).
Значение солюбилизации в физиологии, медицине и фармации Липопротеиновая мицелла В качестве мицеллообразующих ПАВ выступают белки крови и амфифильные липиды (аполипопротеины). Они располагаются на поверхности мицелл. Внутри же солюбилизируются гидрофобные липиды (нейтральный жир, стероиды).
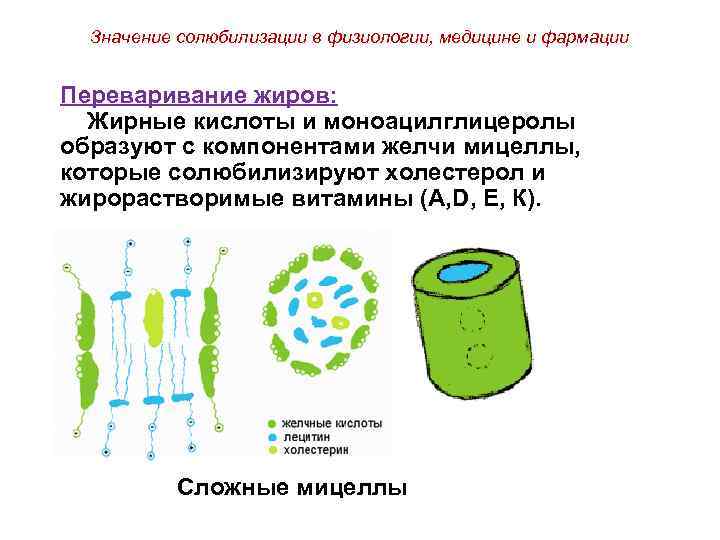 Значение солюбилизации в физиологии, медицине и фармации Переваривание жиров: Жирные кислоты и моноацилглицеролы образуют с компонентами желчи мицеллы, которые солюбилизируют холестерол и жирорастворимые витамины (А, D, Е, К). Сложные мицеллы
Значение солюбилизации в физиологии, медицине и фармации Переваривание жиров: Жирные кислоты и моноацилглицеролы образуют с компонентами желчи мицеллы, которые солюбилизируют холестерол и жирорастворимые витамины (А, D, Е, К). Сложные мицеллы
 Значение солюбилизации в медицине, фармации и физиологии • Липосомы рассматривают как модель биологических мембран. С их помощью можно изучать проницаемость мембран и влияние на нее разного рода факторов для различных соединений.
Значение солюбилизации в медицине, фармации и физиологии • Липосомы рассматривают как модель биологических мембран. С их помощью можно изучать проницаемость мембран и влияние на нее разного рода факторов для различных соединений.
 Значение солюбилизации в медицине, фармации и физиологии • Известны препараты иода, распределенного в ПАВ (иодофоры). • Введение ПАВ позволяет получать препараты стероидов для парентерального и наружного использования. С этой целью используют неионные ПАВ. • Широко известна солюбилизация витаминов и особенно масел. В частности, витамины А и Е были солюбилизированы эфирами сахарозы. • Примером «адресного» лекарства является препарат «Веторон» , содержащий каротин, солюбилизированный в липидных мицеллах.
Значение солюбилизации в медицине, фармации и физиологии • Известны препараты иода, распределенного в ПАВ (иодофоры). • Введение ПАВ позволяет получать препараты стероидов для парентерального и наружного использования. С этой целью используют неионные ПАВ. • Широко известна солюбилизация витаминов и особенно масел. В частности, витамины А и Е были солюбилизированы эфирами сахарозы. • Примером «адресного» лекарства является препарат «Веторон» , содержащий каротин, солюбилизированный в липидных мицеллах.
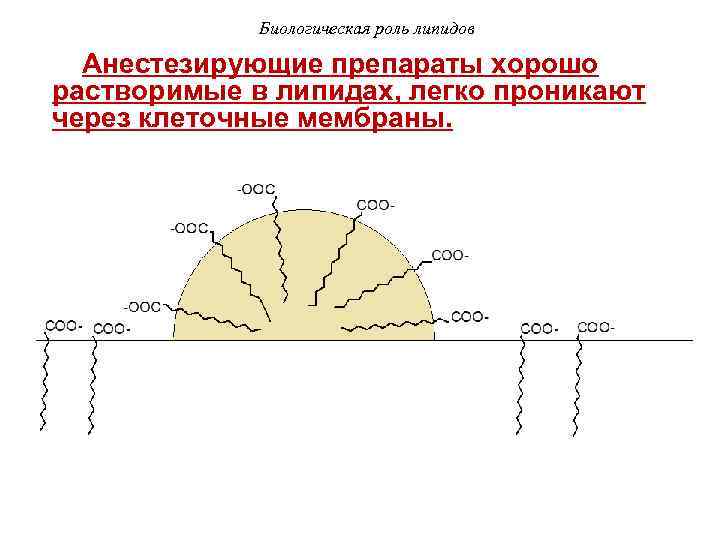 Биологическая роль липидов Анестезирующие препараты хорошо растворимые в липидах, легко проникают через клеточные мембраны.
Биологическая роль липидов Анестезирующие препараты хорошо растворимые в липидах, легко проникают через клеточные мембраны.
 Спасибо за Ваше внимание!
Спасибо за Ваше внимание!
