Окислительно востановительные реакции.pptx
- Количество слайдов: 19
 Окислительновосстановительные реакции Черноголовка 2016
Окислительновосстановительные реакции Черноголовка 2016
 Теория окислительно-восстановительных реакций: Реакции, протекающее с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными Степень окисления (с. о. ) – заряд атома элемента в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов, т. е. все ковалентные полярные связи в соединении – ионные
Теория окислительно-восстановительных реакций: Реакции, протекающее с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными Степень окисления (с. о. ) – заряд атома элемента в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов, т. е. все ковалентные полярные связи в соединении – ионные
 Основные положения теории: Окислением называется процесс отдачи электронов атомов, молекулой или ионом: Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом: Окисление всегда сопровождается восстановлением и наоборот:
Основные положения теории: Окислением называется процесс отдачи электронов атомов, молекулой или ионом: Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом: Окисление всегда сопровождается восстановлением и наоборот:
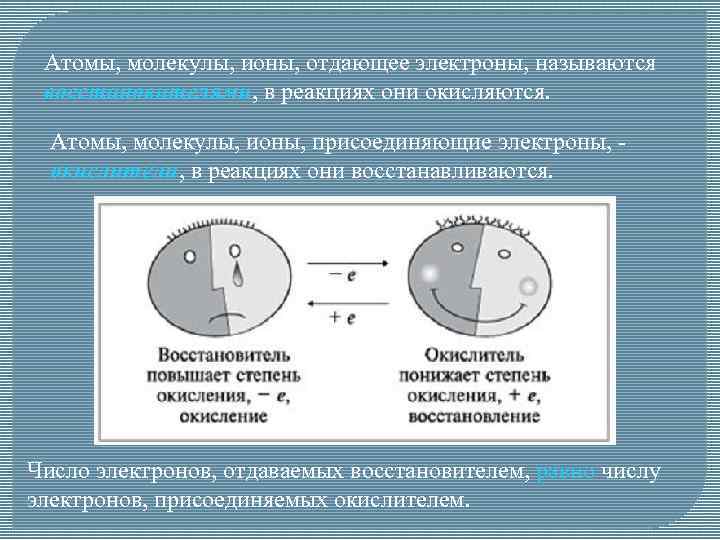 Атомы, молекулы, ионы, отдающее электроны, называются восстановителями, в реакциях они окисляются. Атомы, молекулы, ионы, присоединяющие электроны, окислители, в реакциях они восстанавливаются. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Атомы, молекулы, ионы, отдающее электроны, называются восстановителями, в реакциях они окисляются. Атомы, молекулы, ионы, присоединяющие электроны, окислители, в реакциях они восстанавливаются. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
 Важнейшие восстановители и окислители Восстановители Окислители Металлы Галогены Водород Перманганат калия(KMn. O 4) Уголь Манганат калия (K 2 Mn. O 4) Окись углерода (II) (CO) О 3 – озон, О 2 - кислород Сероводород (H 2 S) Дихромат калия (K 2 Cr 2 O 7) Оксид серы (IV) (SO 2) Хромат калия (K 2 Cr. O 4) Cернистая кислота H 2 SO 3 и ее соли Азотная кислота (HNO 3) Галогеноводородные кислоты и их соли Серная кислота (H 2 SO 4) концентрированная Sn. Cl 2, Fe. Cl 2, Mn. SO 4, Cr 2(SO 4)3 Оксиды (Cu. O) Азотистая кислота HNO 2 Оксид свинца(IV) (Pb. O 2) Аммиак NH 3 Оксид серебра (Ag 2 O) Гидразин NH 2 Хлорид железа(III) (Fe. Cl 3), Оксид азота(II) (NO) Пероксид водорода (H 2 O 2) Катод при электролизе Анод при электролизе
Важнейшие восстановители и окислители Восстановители Окислители Металлы Галогены Водород Перманганат калия(KMn. O 4) Уголь Манганат калия (K 2 Mn. O 4) Окись углерода (II) (CO) О 3 – озон, О 2 - кислород Сероводород (H 2 S) Дихромат калия (K 2 Cr 2 O 7) Оксид серы (IV) (SO 2) Хромат калия (K 2 Cr. O 4) Cернистая кислота H 2 SO 3 и ее соли Азотная кислота (HNO 3) Галогеноводородные кислоты и их соли Серная кислота (H 2 SO 4) концентрированная Sn. Cl 2, Fe. Cl 2, Mn. SO 4, Cr 2(SO 4)3 Оксиды (Cu. O) Азотистая кислота HNO 2 Оксид свинца(IV) (Pb. O 2) Аммиак NH 3 Оксид серебра (Ag 2 O) Гидразин NH 2 Хлорид железа(III) (Fe. Cl 3), Оксид азота(II) (NO) Пероксид водорода (H 2 O 2) Катод при электролизе Анод при электролизе
 Из истории происхождения окислительновосстановительных реакций: Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого горючего вещества), а восстановление — его приобретение. Но понятия окислителя и восстановителя, которые мы применяем и сейчас, разработал Л. В. Писаржевский в 1914 г.
Из истории происхождения окислительновосстановительных реакций: Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого горючего вещества), а восстановление — его приобретение. Но понятия окислителя и восстановителя, которые мы применяем и сейчас, разработал Л. В. Писаржевский в 1914 г.
 Составление уравнений окислительновосстановительных реакций Метод электронного баланса Ионно-электронный метод (тв. +тв. , тв. +газ) (в растворах)
Составление уравнений окислительновосстановительных реакций Метод электронного баланса Ионно-электронный метод (тв. +тв. , тв. +газ) (в растворах)
 Метод электронного баланса +1 +7 – 2 +1 – 1 +2 – 1 0 +1 – 2 KMn. O 4 + HCl KCl + Mn. Cl 2 + H 2 O +7 +2 Mn + 5 e– Mn – 1 0 10 2 Cl – 2 e– Cl 2 ок-ль , в-ние 5 в-ль, ок-е KMn. O 4 + HCl KCl + Mn. Cl 2 + Cl 2 5 2 + H 2 O KMn. O 4+ HCl KCl+ Mn. Cl 2+ H 2 16 2 8 2 O
Метод электронного баланса +1 +7 – 2 +1 – 1 +2 – 1 0 +1 – 2 KMn. O 4 + HCl KCl + Mn. Cl 2 + H 2 O +7 +2 Mn + 5 e– Mn – 1 0 10 2 Cl – 2 e– Cl 2 ок-ль , в-ние 5 в-ль, ок-е KMn. O 4 + HCl KCl + Mn. Cl 2 + Cl 2 5 2 + H 2 O KMn. O 4+ HCl KCl+ Mn. Cl 2+ H 2 16 2 8 2 O
 Классификация окислительно-восстановительных реакций Межмолекулярные 2 Al+Fe 2 O 3=2 Fe+Al 2 O 3 Атомы разных элементов, изменяющие степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах Внутримолекулярные 2 KCl. O 3=2 KCl+3 O 2 Атомы разных элементов, изменяющие степени окисления, находятся в одной и той же молекулярной частице
Классификация окислительно-восстановительных реакций Межмолекулярные 2 Al+Fe 2 O 3=2 Fe+Al 2 O 3 Атомы разных элементов, изменяющие степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах Внутримолекулярные 2 KCl. O 3=2 KCl+3 O 2 Атомы разных элементов, изменяющие степени окисления, находятся в одной и той же молекулярной частице
 МЕЖМОЛЕКУЛЯРНЫЕ +1 +5 – 2 0 +1 – 1 +5 – 2 5 KCl. O 3 + 6 P = 5 KCl + 3 P 2 O 5 о-ль в-ль ВНУТРИМОЛЕКУЛЯРНЫЕ +1 +5 -2 +1 – 1 0 2 KCl. O 3 = 2 KCl + 3 O 2 о-ль в-ль
МЕЖМОЛЕКУЛЯРНЫЕ +1 +5 – 2 0 +1 – 1 +5 – 2 5 KCl. O 3 + 6 P = 5 KCl + 3 P 2 O 5 о-ль в-ль ВНУТРИМОЛЕКУЛЯРНЫЕ +1 +5 -2 +1 – 1 0 2 KCl. O 3 = 2 KCl + 3 O 2 о-ль в-ль
 Классификация окислительновосстановительных реакций РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ 4 K 2 SO 3=3 K 2 SO 4+K 2 S Процессы, в результате которых происходит изменение степени окисления атомов одного и того же элемента, находящегося в исходном веществе РЕАКЦИИ КОНПРОПОРЦИОНИРОВАНИЯ 2 H 2 S + SO 2 = 3 S + 2 H 2 O Процессы, в результате которых происходит изменение степени окисления атомов одного и того же элемента, находящегося в исходных веществах в разных состояниях
Классификация окислительновосстановительных реакций РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ 4 K 2 SO 3=3 K 2 SO 4+K 2 S Процессы, в результате которых происходит изменение степени окисления атомов одного и того же элемента, находящегося в исходном веществе РЕАКЦИИ КОНПРОПОРЦИОНИРОВАНИЯ 2 H 2 S + SO 2 = 3 S + 2 H 2 O Процессы, в результате которых происходит изменение степени окисления атомов одного и того же элемента, находящегося в исходных веществах в разных состояниях
 Диспропорционирование(дисмутация, самоокисление-самовосстановление) +1 +5 – 2 Δ +1 – 1 +1 +7 – 2 4 KCl. O 3 = KCl + 3 KCl. O 4 +5 – 1 – Сl + 6 e Cl 1 (восстановление, Cl-окислитель) +5 +7 Сl – 2 e– Cl 3 (окисление, Cl - восстановитель Конпропорционирование( КОНМУТАЦИЯ) +1 – 2 +4 – 2 0 +1 – 2 2 H 2 S + SO 2 = 3 S + 2 H 2 O – 2 0 – S – 2 e S 2 (Окисление, ВОССТАНОВИТЕЛЬ) +4 0 S + 4 e– S 1 (Восстановление, ОКИСЛИТЕЛЬ)
Диспропорционирование(дисмутация, самоокисление-самовосстановление) +1 +5 – 2 Δ +1 – 1 +1 +7 – 2 4 KCl. O 3 = KCl + 3 KCl. O 4 +5 – 1 – Сl + 6 e Cl 1 (восстановление, Cl-окислитель) +5 +7 Сl – 2 e– Cl 3 (окисление, Cl - восстановитель Конпропорционирование( КОНМУТАЦИЯ) +1 – 2 +4 – 2 0 +1 – 2 2 H 2 S + SO 2 = 3 S + 2 H 2 O – 2 0 – S – 2 e S 2 (Окисление, ВОССТАНОВИТЕЛЬ) +4 0 S + 4 e– S 1 (Восстановление, ОКИСЛИТЕЛЬ)
 Влияние среды на характер протекания реакций Кислая среда H+ Mn. O 4 ¯ Нейтральная H 2 O Щелочная OH- 2 KMn. O 4 + 5 KNO 2 +3 H 2 SO 4 2 KMn. O 4 + 3 K 2 SO 3 + H 2 O Mn. O 2 + 4 KOH+O 2 Mn(+2) Бесцветный раствор Mn. O 2 Бурый осадок Mn. O 4 (-2) Раствор темнозеленого цвета 2 Mn. SO 4 + 5 KNO 3 + K 2 SO 4 + 3 H 2 O 2 Mn. O 2 +3 K 2 SO 4 + 2 KOH 2 K 2 Mn. O 4 + H 2 O
Влияние среды на характер протекания реакций Кислая среда H+ Mn. O 4 ¯ Нейтральная H 2 O Щелочная OH- 2 KMn. O 4 + 5 KNO 2 +3 H 2 SO 4 2 KMn. O 4 + 3 K 2 SO 3 + H 2 O Mn. O 2 + 4 KOH+O 2 Mn(+2) Бесцветный раствор Mn. O 2 Бурый осадок Mn. O 4 (-2) Раствор темнозеленого цвета 2 Mn. SO 4 + 5 KNO 3 + K 2 SO 4 + 3 H 2 O 2 Mn. O 2 +3 K 2 SO 4 + 2 KOH 2 K 2 Mn. O 4 + H 2 O
 Опыт. Окислительные свойства перманганата калия в различных средах
Опыт. Окислительные свойства перманганата калия в различных средах
 Окислительные свойства перманганата калия в различных средах Расставить коэффициенты в молекулярном уравнении реакции: а) в кислой среде реакция протекает в соответствии со схемой: KMn. O 4 + Na 2 SO 3 + H 2 SO 4 → Mn. SO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O б) в нейтральной среде реакция протекает в соответствии со схемой: KMn. O 4 + Na 2 SO 3 + H 2 O → Mn. O 2 + Na 2 SO 4 + KOH в) в сильнощелочной среде реакция протекает в соответствии со схемой: KMn. O 4 + Na 2 SO 3 + Na. OH → Na 2 Mn. O 4 + K 2 Mn. O 4 + Na 2 SO 4 + H 2 O Сравните окислительные свойства перманганата калия в разных средах:
Окислительные свойства перманганата калия в различных средах Расставить коэффициенты в молекулярном уравнении реакции: а) в кислой среде реакция протекает в соответствии со схемой: KMn. O 4 + Na 2 SO 3 + H 2 SO 4 → Mn. SO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O б) в нейтральной среде реакция протекает в соответствии со схемой: KMn. O 4 + Na 2 SO 3 + H 2 O → Mn. O 2 + Na 2 SO 4 + KOH в) в сильнощелочной среде реакция протекает в соответствии со схемой: KMn. O 4 + Na 2 SO 3 + Na. OH → Na 2 Mn. O 4 + K 2 Mn. O 4 + Na 2 SO 4 + H 2 O Сравните окислительные свойства перманганата калия в разных средах:
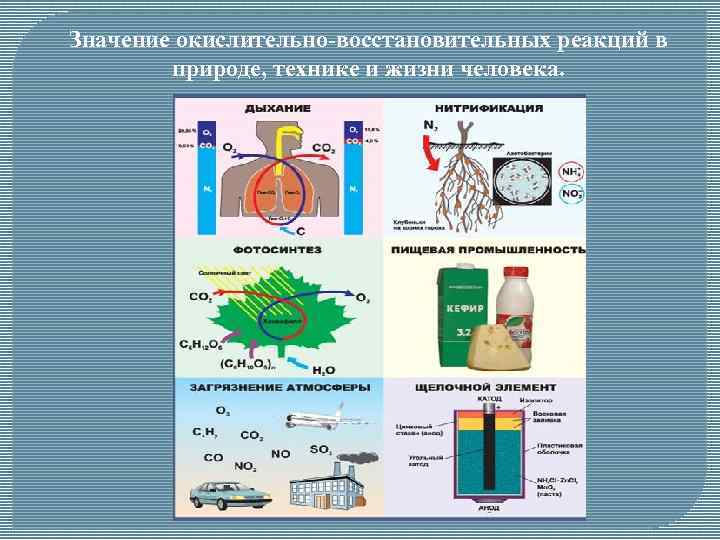 Значение окислительно-восстановительных реакций в природе, технике и жизни человека.
Значение окислительно-восстановительных реакций в природе, технике и жизни человека.
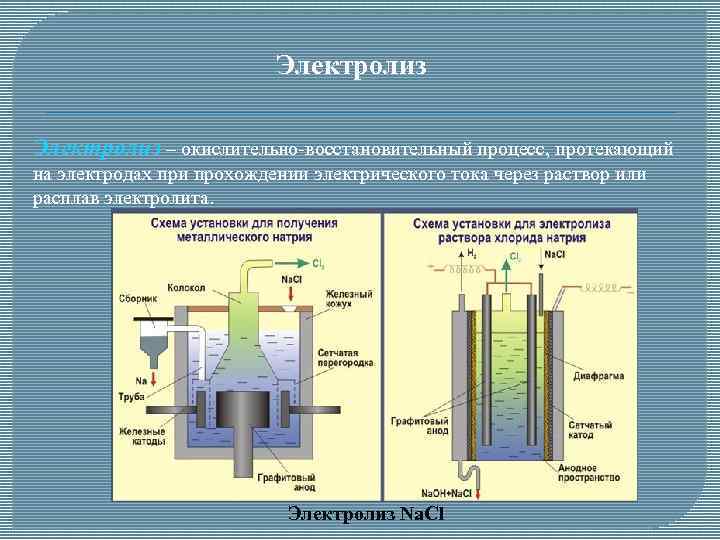 Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита. Электролиз Na. Cl
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита. Электролиз Na. Cl
 Электролиз расплава Na. Cl Электролиз раствора Na. Cl
Электролиз расплава Na. Cl Электролиз раствора Na. Cl
 Домашнее задание Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель 1) NO+KCl. O+…→ KNO 3+ KCl+ …. 2) PH 3+ HBr. O 3→ H 3 PO 4+ Br 2+ … 3) K 2 Cr 2 O 7+ HJ→ Cr. J 3+ J 2+ … + …. 4) KMn. O 4+ HBr→ Mn. Br 2+ Br 2 + …. 5) K 2 Cr 2 O 7 + K 2 SO 3+ H 2 SO 4→ Cr 2(SO 4)3+… + ….
Домашнее задание Используя метод электронного баланса, составьте уравнение реакции: Определите окислитель и восстановитель 1) NO+KCl. O+…→ KNO 3+ KCl+ …. 2) PH 3+ HBr. O 3→ H 3 PO 4+ Br 2+ … 3) K 2 Cr 2 O 7+ HJ→ Cr. J 3+ J 2+ … + …. 4) KMn. O 4+ HBr→ Mn. Br 2+ Br 2 + …. 5) K 2 Cr 2 O 7 + K 2 SO 3+ H 2 SO 4→ Cr 2(SO 4)3+… + ….
